Строение молекулы воды unikalnye-svoystva-vody (1)
жүктеу/скачать 1.27 Mb.
|
Байланысты:
unikalnye-svoystva-vody (1)
Су, powerpointbase.com-1026
- Бұл бет үшін навигация:
- УНИКАЛЬНЫЕ СВОЙСТВА
- СИЛА НАТЯЖЕНИЯ
- БЕРЕГИТЕ ВОДУ
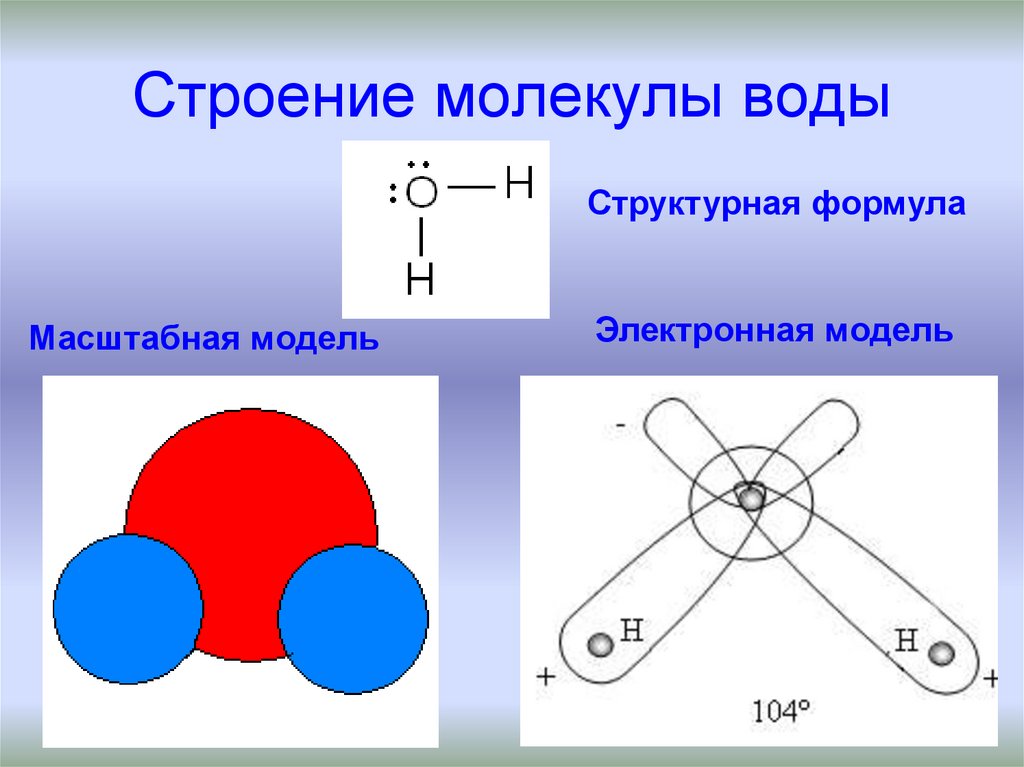
| Уникальные свойства воды БЕРЕГИ ЕЁ! СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ В молекуле воды атомы водорода и атом кислорода находятся друг к другу под углом в 104,7 градуса. Расстояния между атомом кислорода и водородными атомами одинаковы и равны 97 десятимиллиардным долям сантиметра. Расстояние между атомами водорода равно 154 десятимиллиардным долям сантиметра.  Если размер молекулы увеличить в десять миллиардов раз, этот треугольник поместился бы на столе среднего размера. Если размер молекулы увеличить в десять миллиардов раз, этот треугольник поместился бы на столе среднего размера.
Почти все физико-химические свойства воды — исключения в природе. Некоторые из этих аномалий имеют определяющее значение для развития и возникновения жизни, формирования климата и рельефа нашей планеты. Согласно аналогиям с веществами, схожими по молекулярным строениям, вода должна была бы кипеть при +70 °С, а замерзать при -90 °С. Но молекулы воды обладают необычайно сильной способностью притягиваться друг к другу, а разрываются с большим трудом, поэтому температуры плавления и кипения воды гораздо выше «нормальных». ТЕМПЕРАТУРА ЗАМЕРЗАНИЯ ВОДЫ О °С ТЕМПЕРАТУРА КИПЕНИЯ ВОДЫ УНИКАЛЬНЫЕ СВОЙСТВА Вода обладает высокой удельной теплотой парообразования Такая особенность, например, защищает озера и реки нашей планеты от полного пересыхания летом. 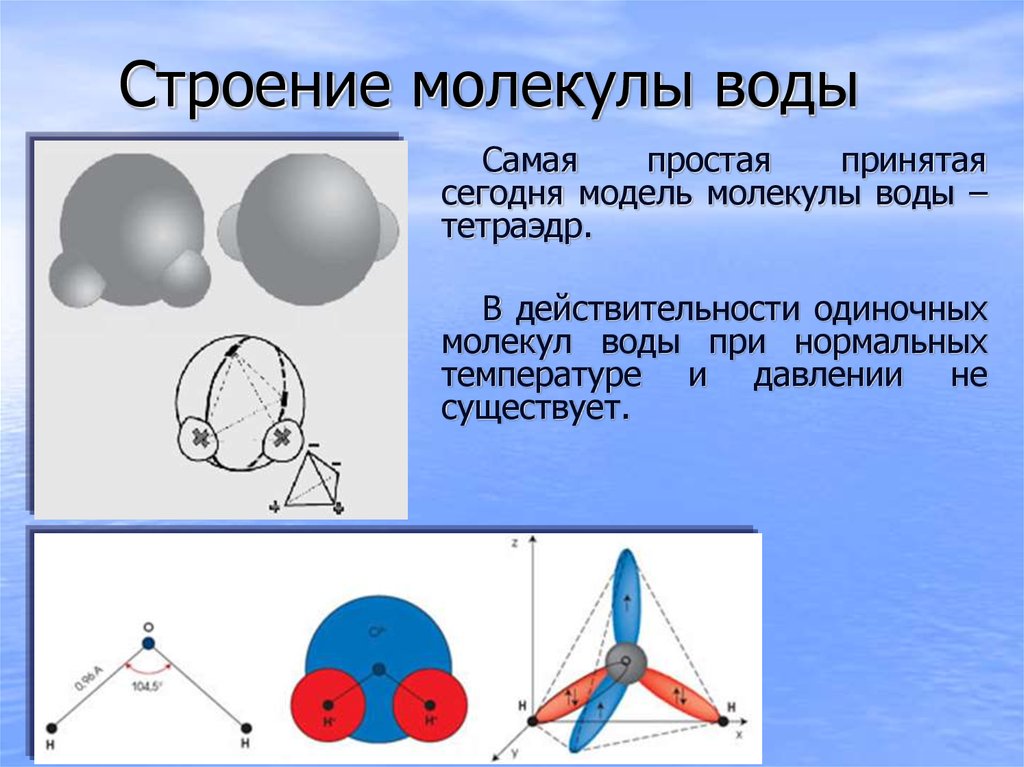
Вода, как и все жидкости при охлаждении сжимается. Но это происходит только до температуры +4 градуса После чего, вода, вопреки всем законам, начинает расширяться. Подсчитано, что при замерзании вода расширяется на 9 процентов. Поэтому лед всегда легче незамерзшей воды. Только вода в земных условиях встречается во всех трёх состояниях: жидком, твердом и газообразном Вода — универсальный растворитель Её растворяющему действию в той или иной мере подвластны и твёрдые тела, и жидкости, и газы. Поэтому исключительно чистую воду можно получить только в лаборатории и то в небольших количествах Дистиллированная вода УНИКАЛЬНЫЕ СВОЙСТВА Вода обладает высокой удельной теплотой парообразования Такая особенность, например, защищает озера и реки нашей планеты от полного пересыхания летом. Вода имеет высокую теплоёмкость Поглощая огромное количество теплоты, сама вода существенно не нагревается. 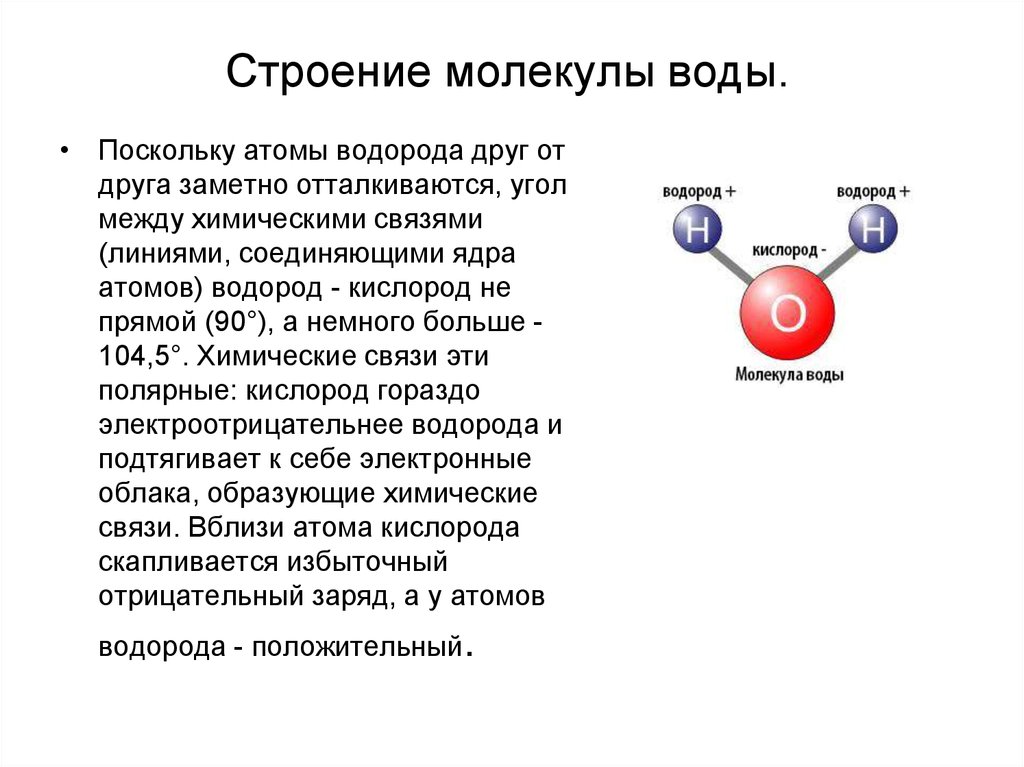 Вода практически не сжимаема. Это позволяет многим беспозвоночным животным использовать заполненные водой полости тела в качестве внутренней опоры организма при передвиженииВода практически не сжимаема. Это позволяет многим беспозвоночным животным использовать заполненные водой полости тела в качестве внутренней опоры организма при передвиженииБЕРЕГИТЕ ВОДУжүктеу/скачать 1.27 Mb. Достарыңызбен бөлісу: |
©melimde.com 2023
әкімшілігінің қараңыз
Строение молекул воды и их ассоциаты
разное
«Мир чарующий и фантастический», — такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
Итак, молекула воды (1h316O) состоит из двух атомов водорода (1H) и одного атома кислорода (16O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
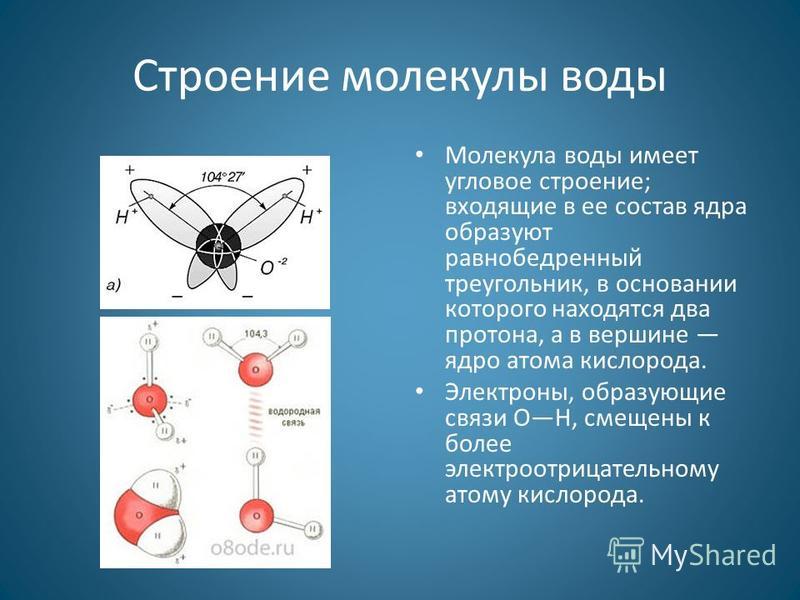
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его — сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, — по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно — в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром — ядром O2- (рис.
А — угол между связями O—H;
Б — расположение полюсов заряда;
104° 27′ |
Рис. 1.5. Строение молекулы воды |
В — внешний вид электронного облака молекулы воды.
Двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра — протоны — оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким ди — польным моментом — 1,87дебая1. Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений.
Во многом благодаря этому, вода проявляет себя как универсальный растворитель.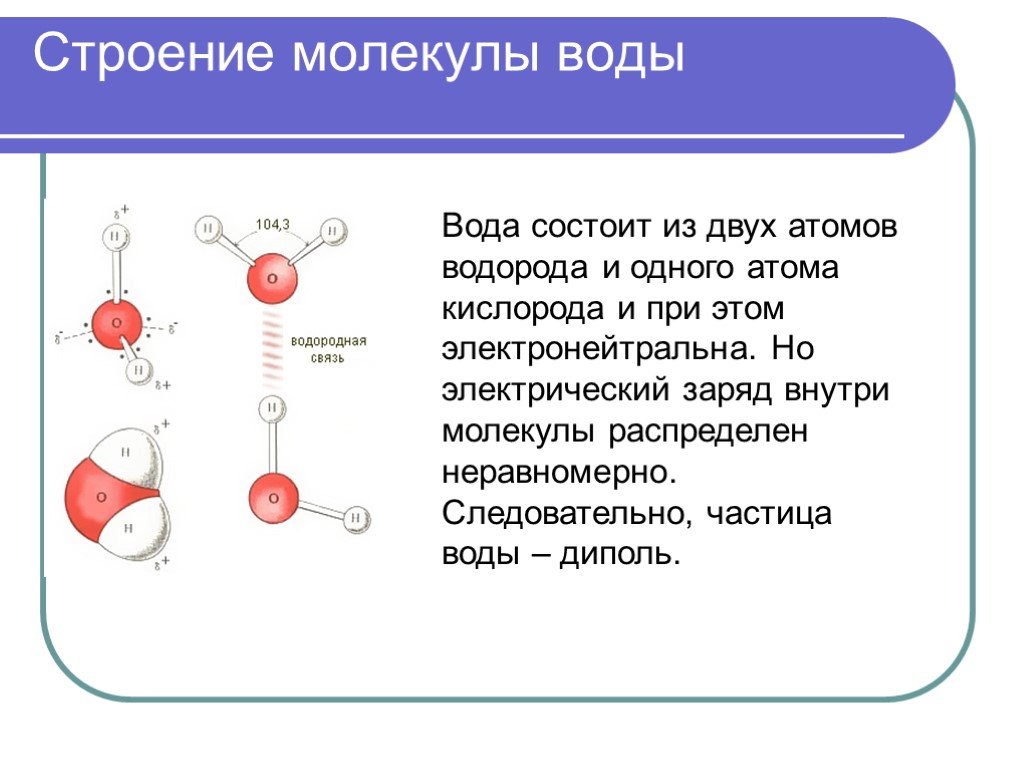 Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
В пресных природных водах — речных, озерных — содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном — 18, а в Красном море — около 40 г/л. В среднем в 1 л океанской воды растворено 34…35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно — натрия и кальция), на 10% — из сульфатов (натрия, калия и магния), на 1% — из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) — до 80%. Сульфатов (натрия, кальция и магния) — около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
На 89% морские соли состоят из хлоридов (преимущественно — натрия и кальция), на 10% — из сульфатов (натрия, калия и магния), на 1% — из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) — до 80%. Сульфатов (натрия, кальция и магния) — около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода — до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты — растворимые соединения типа белков, сахаров, спиртов, углеводородов и т. п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.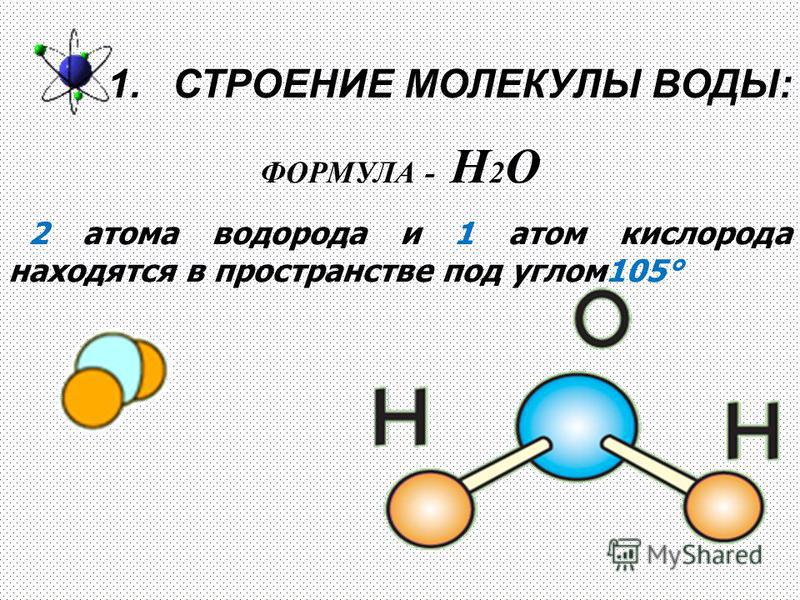
— Химическая связь Водородная связь
Рис. 1.6. Схема объединения молекул воды
— ассоциаты. Оказывается, полностью соответствует формуле Н20 лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (h30)x.
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их.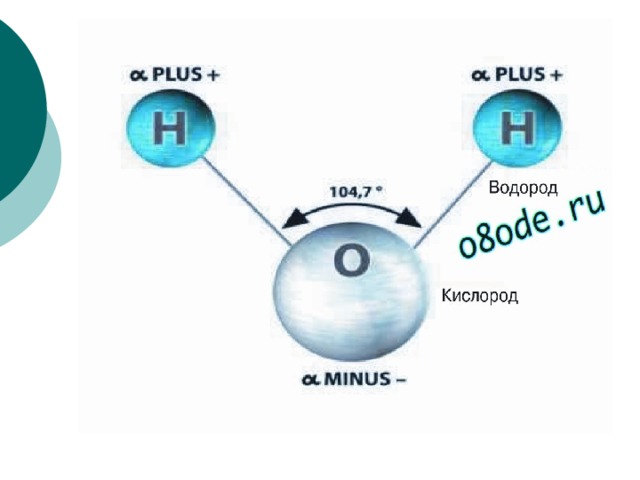 Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
X h3O ~ (h30)x
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес — кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоци — атов (рис. 1.6).
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные рои довольно стабильного состава. Пространства между роями заполняют мономерные молекулы воды.
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподоб — ной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры — нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
Вопросы покупателей услуг практически всегда сводятся к двум – когда и сколько? В этой статье рассмотрим информацию и том что сделать, чтобы слова «когда» звучала меньше. Расчет бюджета Да, сколько …
4 обращения в день по рекламе в метро – много это или мало? Расчет количества контактов с рекламой и конверсии при трафике 41,3 тысяч человек в сутки.
привет ты на канале о бизнесе сегодня 00:02 поговорим о пяти бизнес идеях которые 00:05 будут актуальны в 2021 году и на что 00:09 следует обратить внимание чтобы начать 00:11 …
Вода в полуоболочке: структура воды с акцентом на угловую структуру и сольватацию
1. Bragg WH. Кристаллическая структура льда. проц.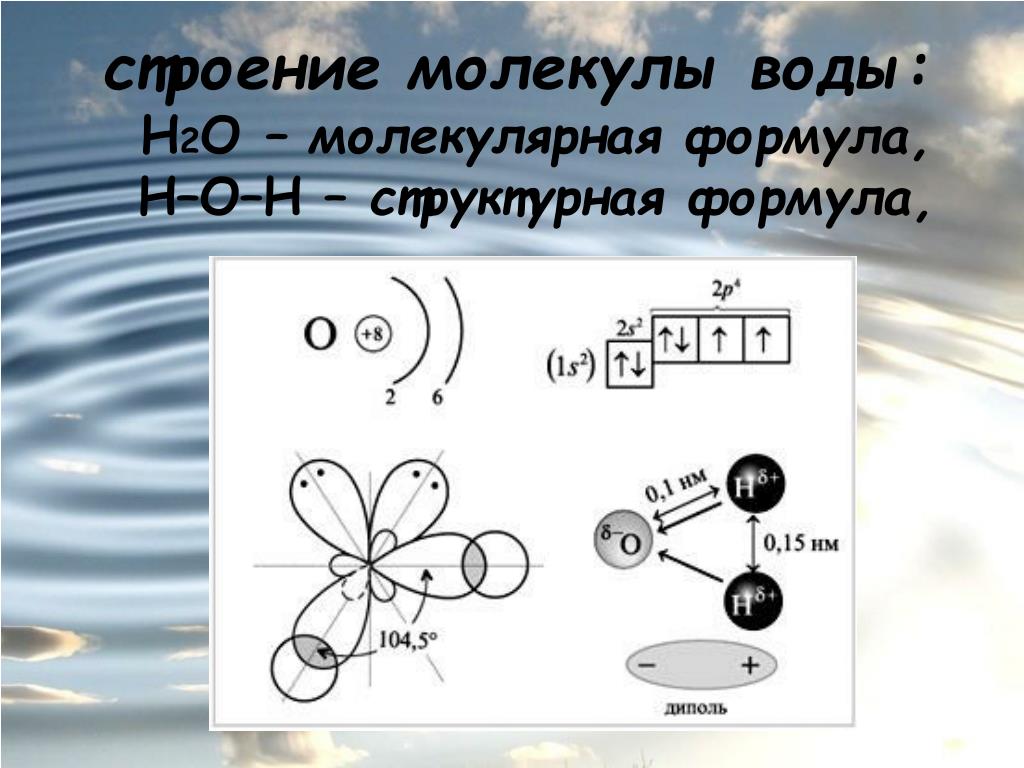 физ. соц. Лондон. 1921; 34: 98–103. [Google Scholar]
физ. соц. Лондон. 1921; 34: 98–103. [Google Scholar]
2. Нартен А., Леви Х. Жидкая вода: функции молекулярной корреляции на основе рентгеновской дифракции. Дж. Хим. физ. 1971; 55: 2263–2269. [Google Scholar]
3. Bosio L, Chen S, Teixeira J. Изохорный температурный перепад рентгеновского структурного фактора и структурные перестройки в низкотемпературной тяжелой воде. физ. Ред. А. 1983;27:1468–1475. [Google Scholar]
4. Сопер А.К. Функции радиального распределения воды и льда. хим. физ. 2002; 258:121–137. [Google Scholar]
5. Рахман А., Стиллинджер Ф. Изучение молекулярной динамики жидкой воды. Дж. Хим. физ. 1971; 55: 3336–3359. [Google Scholar]
6. Тернер Дж., Сопер А. Влияние неполярных растворенных веществ на структуру воды: спирты и ионы тетраалкиламмония. Дж. Хим. физ. 1994; 101:6116–6125. [Google Scholar]
7. Тернер Дж., Сопер А., Финни Дж. Ионное и аполярное поведение иона тераметиламмония в воде. Дж. Хим. физ. 1995;102:5438–5443. [Google Scholar]
8. Чау П., Хардвик А. Новый параметр порядка для тетраэдрических конфигураций. Мол. физ. 1998; 93: 511–518. [Google Scholar]
Чау П., Хардвик А. Новый параметр порядка для тетраэдрических конфигураций. Мол. физ. 1998; 93: 511–518. [Google Scholar]
9. Эррингтон Дж., Дебенедетти П. Связь между структурным порядком и аномалиями жидкой воды. Природа. 2001; 409: 318–21. [PubMed] [Google Scholar]
10. Медведев Н., Наберухин Ю. Форма симплексов Делоне в плотных случайных упаковках твердых и мягких сфер. J. Некристалл. Твердые вещества. 1987; 94: 402–406. [Академия Google]
11. Смолин Н., Даггетт В. Формирование льдоподобной структуры воды на поверхности антифриза. Дж. Физ. хим. Б. 2008; 112:6193–6202. [PubMed] [Google Scholar]
12. Свищев И., Кусалик П. Структура жидкой воды: исследование функций пространственного распределения. Дж. Хим. физ. 1993; 99: 3049–61. [Google Scholar]
13. Свищев И.М., Засецкий А., Кусалик П. Сольватационные структуры в трех измерениях. хим. физ. 2000; 258:181–186. [Google Scholar]
14. Сопер А., Риччи М. Структуры воды высокой и низкой плотности. физ. Преподобный Летт. 2000; 84: 2881–2884. [PubMed] [Академия Google]
физ. Преподобный Летт. 2000; 84: 2881–2884. [PubMed] [Академия Google]
15. Сопер А.К. Исследование структуры воды вокруг биологических молекул: концепции, построения и последствия. Физика Б. 2000; 276: 12–16. [Google Scholar]
16. Хенн А.Р., Каузманн В. Уравнение состояния случайной сети, континуальная модель жидкой воды. Дж. Физ. хим. 1989;93:3770–3783. [Google Scholar]
17. Pople J. Proc. Рой. соц. Лонд. 1961; А 205:163. [Google Scholar]
18. Sceats MG, Stavola M, Rice SA. Случайная сетевая модель нулевого порядка жидкой воды. Дж. Хим. физ. 1979;70:3927–38. [Google Scholar]
19. Sceats MG, Rice SA. Случайная сетевая модель расчета свободной энергии жидкой воды. Дж. Хим. физ. 1980; 72: 6183–91. [Google Scholar]
20. Rice SA, Sceats MG. Случайная сетевая модель для воды. Дж. Физ. хим. 1981; 85: 1108–1119. [Google Scholar]
21. Галлахер К., Шарп К.А. Новый взгляд на изменение теплоемкости при гидрофобной сольватации. Варенье. хим.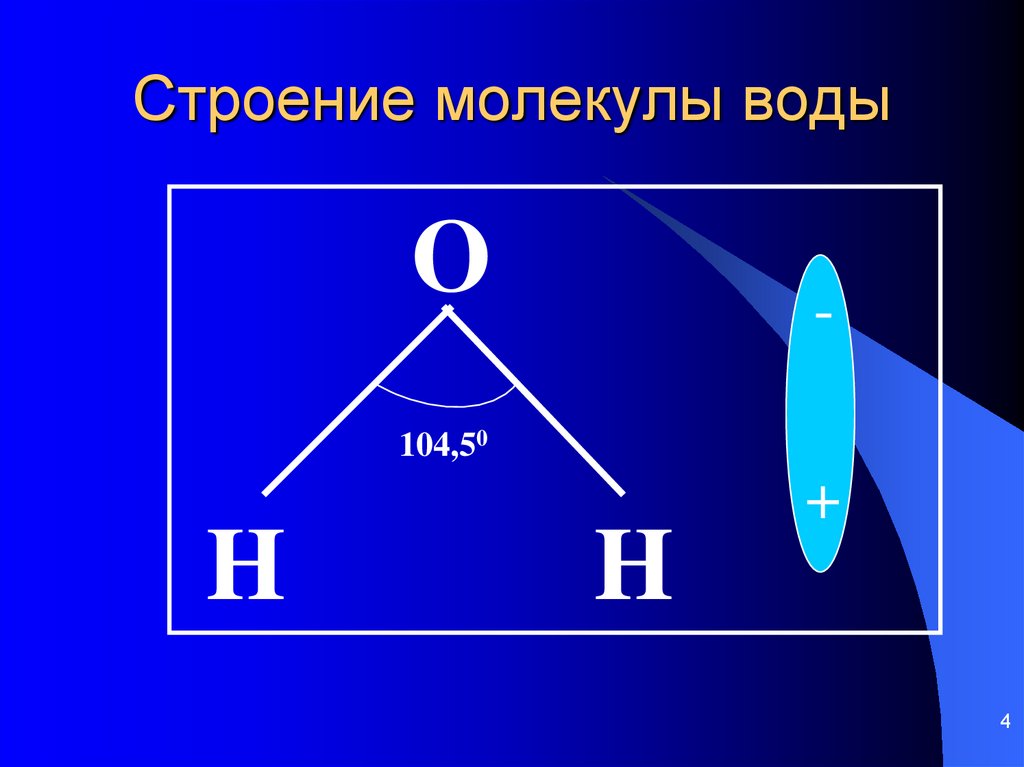 соц. 2003; 125:9863–9870. [PubMed] [Google Scholar]
соц. 2003; 125:9863–9870. [PubMed] [Google Scholar]
22. Рашке Т., Левитт М. Неполярные растворенные вещества улучшают структуру воды в гидратных оболочках, уменьшая взаимодействие между ними. проц. Натл. акад. науч. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 2005; 102: 6777–6782. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Кумар Р., Шмидт Дж., Скиннер Дж. Определение и динамика водородных связей в жидкой воде. Дж. Хим. физ. 2007; 126:204107–11. [PubMed] [Google Scholar]
24. Чо Х., Сингх С., Робинсон Г. Понимание всех аномалий воды с нелокальным потенциалом. Дж. Хим. физ. 1997; 107:7979–7988. [Google Scholar]
25. Мадан Б., Шарп К. Изменения в структуре воды, вызванные гидрофобным раствором, подтверждены моделированием углов водородных связей воды и функций радиального распределения. Биофиз. хим. 1999;78:33–41. [PubMed] [Google Scholar]
26. Мадан Б., Шарп К. Изменения теплоемкости, сопровождающие гидрофобную и ионную сольватацию: исследование методом Монте-Карло и случайной сети.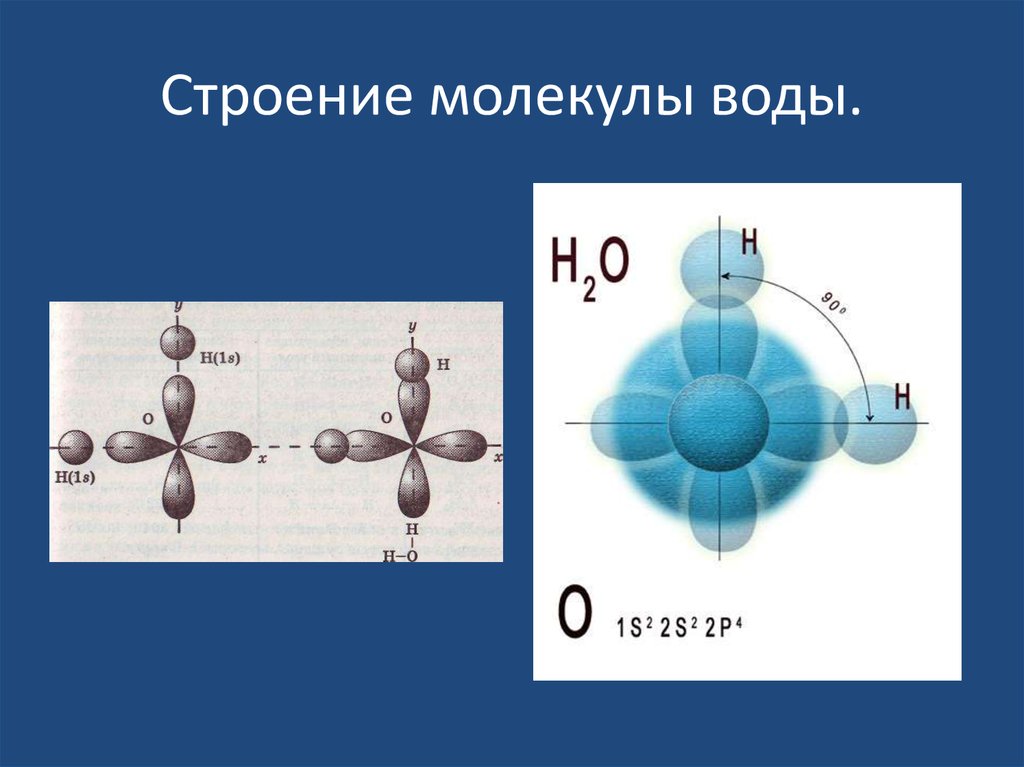 Дж. Физ. хим. 1996; 100:7713–7721. [Google Scholar]
Дж. Физ. хим. 1996; 100:7713–7721. [Google Scholar]
27. Мадан Б., Шарп К. Молекулярное происхождение изменений теплоемкости гидратации гидрофобных растворенных веществ: возмущение структуры воды вокруг алканов. Дж. Физ. хим. Б. 1997; 101:11237–11242. [Google Scholar]
28. Шарп К.А., Мадан Б. Гидрофобный эффект, структура воды и изменения теплоемкости. Дж. Физ. Хим.Б. 1997;101:4343–4348. [Google Scholar]
29. Ванци Ф., Мадан Б., Шарп К. Влияние белковых денатурантов мочевины и гуанидиния на структуру воды: структурное и термодинамическое исследование. JACS. 1998; 120:10748–53. [Google Scholar]
30. Мадан Б., Шарп К.А. Теплоемкость гидратации компонентов нуклеиновых кислот, определенная с помощью модели случайных сетей. Биофизический журнал. 2001; 81: 1881–1887. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Gallagher KR, Sharp KA. Анализ термогистерезисной гидратации белков с использованием модели случайных сетей. Биофиз. хим. 2003;105:195–209. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
32. Spolar RS, Livingstone JR, Record MT., Jr. Использование данных о переносе жидких углеводородов и амидов для оценки вклада в сворачивание белка. Биохимия. 1992; 31: 3947–55. [PubMed] [Google Scholar]
33. Гомес Дж., Хильзер В., Се Д., Фрейре Э. Теплоемкость белков. Белки. 1995; 22: 404–412. [PubMed] [Google Scholar]
34. Галлахер К.Р., Шарп К.А. Новый взгляд на изменение теплоемкости при гидрофобной сольватации. Варенье. хим. соц. 2003;125:9853–9860. [PubMed] [Google Scholar]
35. Frank HS, Wen WY. Структурные аспекты взаимодействия ионов и растворителей в водных растворах: предполагаемая картина структуры воды. Обсуждать. Фарадей Сок. 1957; 24:133. [Google Scholar]
36. Немети Г., Шерага Х. Структура воды и гидрофобная связь. I Модель термодинамических свойств жидкой воды. Дж. Хим. физ. 1962; 36: 3382–3400. [Google Scholar]
37. Walrafen GE. Раман-спектральные исследования влияния температуры на структуру воды.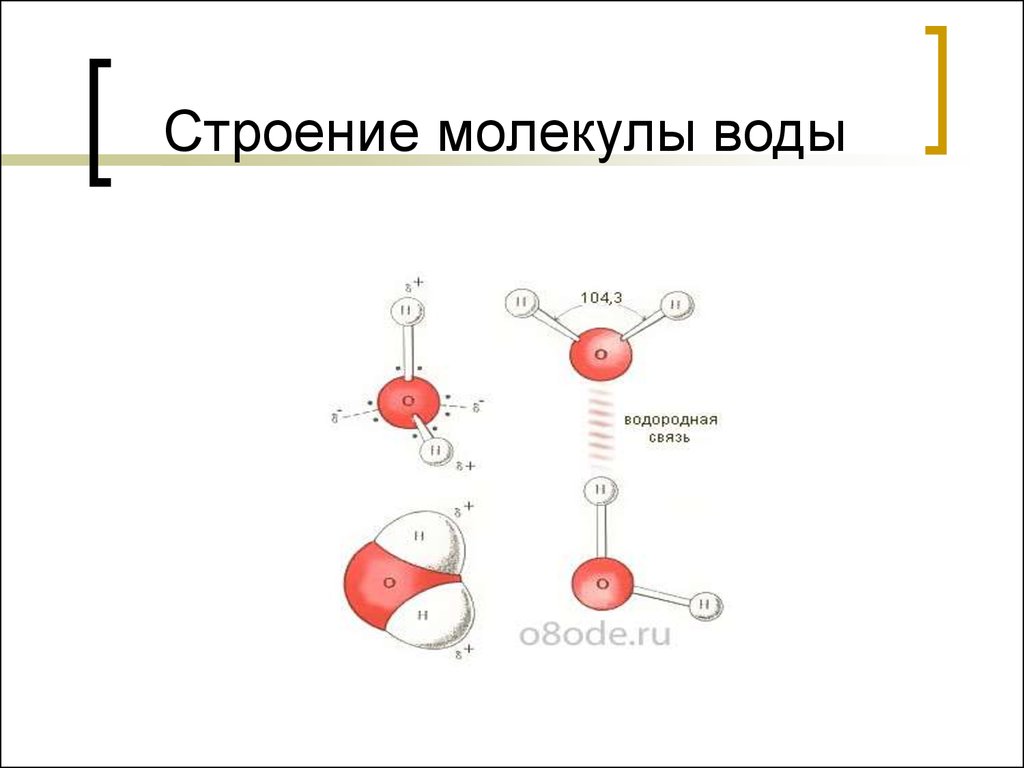 Дж. Хим. физ. 1967;47:114–26. [Google Scholar]
Дж. Хим. физ. 1967;47:114–26. [Google Scholar]
38. Smith JD, Cappa CD, Wilson KR, Cohen RC, Geissler PL, Saykally RJ. Единое описание температурно-зависимых перегруппировок водородных связей в жидкой воде. проц. Натл. акад. науч. США. 2005; 102:14171–14174. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Wernet P, Nordlund D, Bergmann U, Cavalleri M, Odelius M, Ogasawara H, Naslund L, Hirsch TK, Ojamae L, Glatsel P, Pettersson LG, Nilsson А. Строение первой координационной оболочки в жидкой воде. Наука. 2004;304:995–999. [PubMed] [Google Scholar]
40. Смит Дж., Каппа С., Уилсон К., Мессер Б., Коэн Р., Сайкалли Р. Энергетика перегруппировок сети водородных связей в жидкой воде. Наука. 2004; 306:851–3. [PubMed] [Google Scholar]
41. Джеффри Г.А. Введение в водородную связь. Издательство Оксфордского университета; New York: 1997. [Google Scholar]
42. Вандеркуи Дж.М., Дашнау Дж.Л., Зелент Б. Инфракрасная спектроскопия с отклонением температуры (TEIR) для изучения водородных связей между водой и биомолекулами. Биохим. Биофиз. Акта. 2005;1749: 214–233. [PubMed] [Google Scholar]
Биохим. Биофиз. Акта. 2005;1749: 214–233. [PubMed] [Google Scholar]
43. Sharp KA, Madan B, Manas ES, Vanderkooi JM. Изменения структуры воды, вызванные гидрофобными и полярными растворенными веществами, выявленные с помощью моделирования и инфракрасной спектроскопии. Дж. Хим. физ. 2001; 114:1791–1796. [Google Scholar]
44. Нуччи Н.В., Вандеркуи Дж.М. Влияние солей ряда Гофмейстера на сеть водородных связей воды. Дж. Мол. Жидкости. 2008; 143:160–170. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Коллинз К.Д. Сила гидратации и биологическая структура в зависимости от плотности заряда. Биофиз. Дж. 1997;72:65–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Дашнау Ю.Л., Нуччи Н.В., Шарп К., Вандеркоой Ю.М. Водородная связь и криозащитные свойства смесей глицерин/вода. Дж. Физ. хим. 2006; 110:13670–13677. [PubMed] [Google Scholar]
47. Pace CN. Определение и анализ кривых денатурации мочевины и гидрохлорида гуанидина. Методы Энзимол. 1986; 131: 266–280. [PubMed] [Google Scholar]
1986; 131: 266–280. [PubMed] [Google Scholar]
48. Rezus YLA, Bakker HJ. Влияние мочевины на структурную динамику воды. Proc Natl Acad Sci U S A. 2006;103:18417–18420. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Сопер А.К., Кастнер Э.В., Лузар А. Влияние мочевины на структуру воды: ключ к ее свойствам в качестве денатуранта? Биофиз хим. 2003; 105: 649–666. [PubMed] [Google Scholar]
50. Скотт Дж. Н., Нуччи Н. В., Вандеркуи Дж. М. Изменения в структуре воды, вызванные катионом гуанидиния, и влияние на денатурацию белков. Дж. Физ. хим. А. 2008; 112:10939–10948. [Статья бесплатно PMC] [PubMed] [Google Scholar]
51. Кримм С., Бандекар Дж. Колебательная спектроскопия и конформация пептидов, полипептидов и белков. Доп. Белок хим. 1986;38:181–364. [PubMed] [Google Scholar]
52. Манас Э.С., Гетахун З., Райт В.В., ДеГрадо В.Ф., Вандеркуи Дж.М. Инфракрасные спектры амидных групп в α-спиральных белках: свидетельство водородных связей между спиралями и водой. Варенье. хим. соц. 2000;122:9883–9890. [Google Scholar]
Варенье. хим. соц. 2000;122:9883–9890. [Google Scholar]
53. Уолш С.Т., Ченг Р.П., Даггетт В., Вандеркуи Дж.М., ДеГрадо В.Ф. Гидратация амидов в спиралях: полная картина молекулярной динамики, ИК и ЯМР. Белковая наука. 2003; 12: 520–531. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Мукерджи П., Касс И., Аркин И.Т., Занни М.Т. Структурное нарушение трансмембранного домена Ch4 изучено с помощью двумерной ИК-спектроскопии и моделирования молекулярной динамики. Дж. Физ. хим. Б. 2006; 110:24740–24749. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Ян С., Шарп К. Гидрофобная тенденция гидратации полярных групп как основная сила в распознавании антифризного белка I типа. Белки. 2005; 59: 266–74. [PubMed] [Google Scholar]
56. Ян С., Шарп К.А. Механизм действия белка-антифриза III типа: вычислительное исследование. Биофиз. хим. 2004;109: 137–148. [PubMed] [Google Scholar]
57. Pentelute BL, Gates Z, Dashnau JL, Vanderkooi JM, Kent SBH. Зеркальные формы антифризного белка снежной блохи (sfAFP), полученные методом тотального химического синтеза, обладают идентичной антифризной активностью.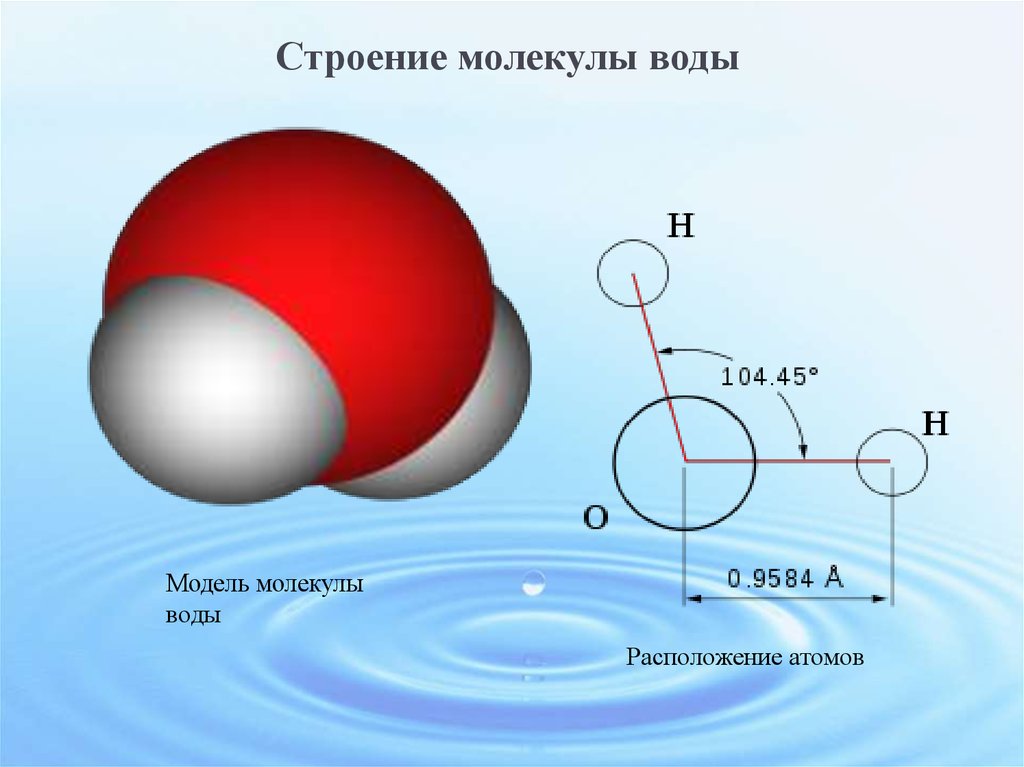 Варенье. хим. соц. 2008; 130:9702–9707. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Варенье. хим. соц. 2008; 130:9702–9707. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Zelent B, Bryan MA, Sharp KA, Vanderkooi JM. Влияние поверхностных групп белков на воду изучали методами гистерезиса замораживания/оттаивания и инфракрасной спектроскопии. Биофиз хим. 2009 г.;141:222–230. [PubMed] [Google Scholar]
59. Soper AK, Phillips MG. Новое определение структуры воды при 25°С. хим. физ. 1986; 107: 47–60. [Google Scholar]
60. Зелент Б., Нуччи Н.В., Вандеркуи Дж.М. Сравнение жидкой и ледяной воды и глицерин/водных стекол с помощью инфракрасной спектроскопии от 295 до 12 K. J. Phys. хим. А. 2004; 108:11141–11150. [Google Scholar]
Ученые зафиксировали «квантовый буксир» между молекулами воды
Вода — самая распространенная, но наименее изученная жидкость в природе. Он демонстрирует много странного поведения, которое ученые до сих пор пытаются объяснить. В то время как большинство жидкостей становятся более плотными по мере того, как они становятся холоднее, вода имеет наибольшую плотность при температуре 39°С.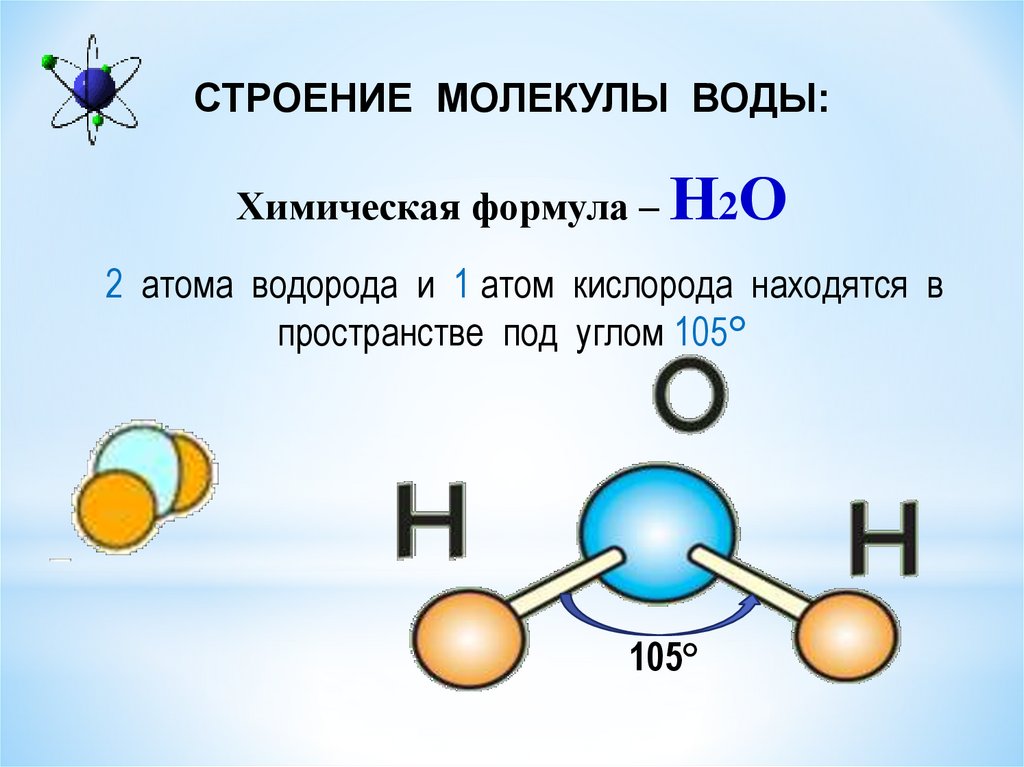 градусов по Фаренгейту, чуть выше точки замерзания. Вот почему лед всплывает на поверхность стакана для питья, а озера замерзают с поверхности вниз, что позволяет морским обитателям пережить холодные зимы. Вода также имеет необычно высокое поверхностное натяжение, позволяющее насекомым ходить по ее поверхности, и большую способность сохранять тепло, поддерживая стабильную температуру океана.
градусов по Фаренгейту, чуть выше точки замерзания. Вот почему лед всплывает на поверхность стакана для питья, а озера замерзают с поверхности вниз, что позволяет морским обитателям пережить холодные зимы. Вода также имеет необычно высокое поверхностное натяжение, позволяющее насекомым ходить по ее поверхности, и большую способность сохранять тепло, поддерживая стабильную температуру океана.
Теперь группа, в которую входят исследователи из Национальной ускорительной лаборатории SLAC Министерства энергетики, Стэнфордского университета, Калифорнийского университета в Дэвисе и Стокгольмского университета в Швеции, провела первое прямое наблюдение того, как атомы водорода в молекулах воды тянут и толкают соседние молекулы воды, когда они возбуждаются лазерным светом. Их результаты, опубликованные в Nature 25 августа, раскрывают эффекты, которые могут лежать в основе ключевых аспектов микроскопического происхождения странных свойств воды и могут привести к лучшему пониманию того, как вода помогает белкам функционировать в живых организмах.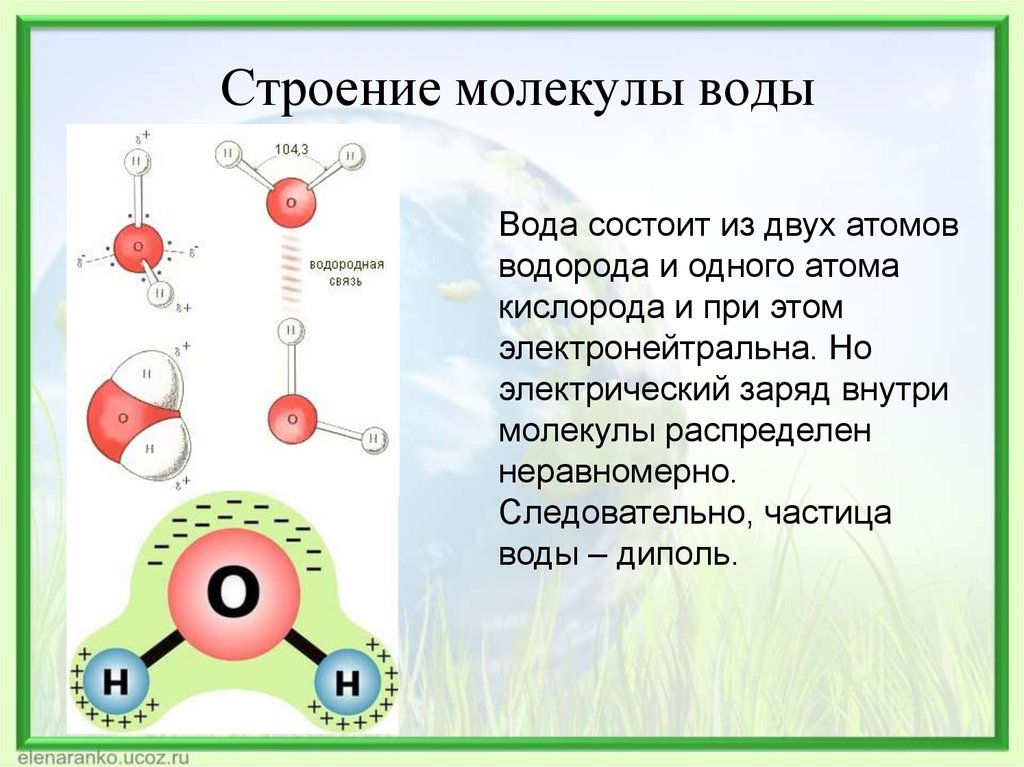
«Водородная связь, молекулярный строительный блок, который придает воде ее особые свойства, до сих пор полностью не изучена», — сказал Давид Донадио, профессор химии Калифорнийского университета в Дэвисе и соавтор статьи. «Эта работа сочетает в себе беспрецедентные эксперименты и выходящее за рамки современного неравновесного молекулярного моделирования, чтобы раскрыть динамику релаксации водородных связей, когда внутримолекулярная связь ОН возбуждается интенсивным инфракрасным лазером».
Каждая молекула воды содержит один атом кислорода и два атома водорода, а сеть водородных связей между положительно заряженными атомами водорода в одной молекуле и отрицательно заряженными атомами кислорода в соседних молекулах удерживает их вместе. Эта сложная сеть является движущей силой многих необъяснимых свойств воды, но до недавнего времени исследователи не могли напрямую наблюдать, как молекула воды взаимодействует со своими соседями.
«Небольшая масса атомов водорода подчеркивает их квантово-волновое поведение», — говорит соавтор Келли Гаффни, ученый из Стэнфордского института пульса в SLAC.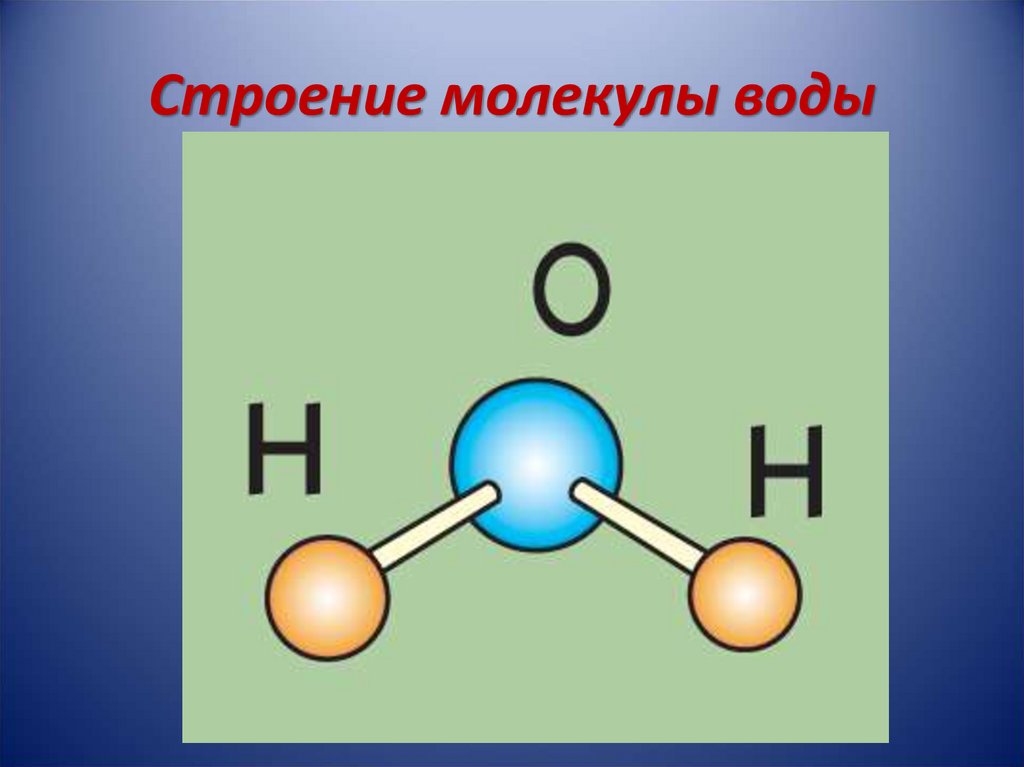 «Это исследование является первым, которое прямо демонстрирует, что реакция сети водородных связей на импульс энергии критически зависит от квантово-механической природы того, как атомы водорода разнесены, что, как уже давно предполагалось, отвечает за уникальные атрибуты. воды и ее сети водородных связей».
«Это исследование является первым, которое прямо демонстрирует, что реакция сети водородных связей на импульс энергии критически зависит от квантово-механической природы того, как атомы водорода разнесены, что, как уже давно предполагалось, отвечает за уникальные атрибуты. воды и ее сети водородных связей».
До сих пор сделать это наблюдение было сложно, потому что движения водородных связей очень малы и быстры. В этом эксперименте эта проблема была решена благодаря использованию MeV-UED от SLAC, высокоскоростной «электронной камеры», которая обнаруживает тонкие молекулярные движения, рассеивая мощный пучок электронов на образцах.
Исследовательская группа создала струи жидкой воды толщиной 100 нанометров — примерно в 1000 раз тоньше, чем толщина человеческого волоса — и заставила молекулы воды вибрировать с помощью инфракрасного лазерного излучения. Затем они взорвали молекулы короткими импульсами высокоэнергетических электронов из МэВ-УЭД.
В результате были созданы снимки в высоком разрешении меняющейся атомной структуры молекул, которые они объединили в покадровую анимацию того, как сеть молекул воды реагирует на свет.
Снимки, сделанные на группы из трех молекул воды, показали, что когда возбужденная молекула воды начинает вибрировать, ее атом водорода притягивает атомы кислорода от соседних молекул воды ближе, прежде чем оттолкнуть их с вновь обретенной силой, расширяя пространство между молекулами воды. молекулы.
Лаборатория Донадио в Калифорнийском университете в Дэвисе вместе с Тоддом Мартинесом в Стэнфорде построили симуляции, чтобы смоделировать реакцию молекул воды в эксперименте за чрезвычайно короткие промежутки времени — фемтосекунды или квадриллионные доли секунды. Команда может сравнить эти симуляции с экспериментальными результатами, чтобы исключить некоторые гипотезы.
«Долгое время исследователи пытались понять сеть водородных связей, используя методы спектроскопии», — сказал Цзе Ян, бывший научный сотрудник SLAC, а ныне профессор Университета Цинхуа в Китае, который руководил исследованием. «Прелесть этого эксперимента в том, что мы впервые смогли напрямую наблюдать, как движутся эти молекулы».
«Прелесть этого эксперимента в том, что мы впервые смогли напрямую наблюдать, как движутся эти молекулы».
Результаты моделирования также подтвердили квантово-механическую природу динамики в краткосрочной перспективе, сказал Донадио.
«Небольшой сюрприз. Обычно, когда вы что-то нагреваете, вы ожидаете, что молекулы разойдутся, но в этом случае нагревание одной молекулы на самом деле заставляет другие сблизиться в очень короткий срок», — сказал Донадио.
Окно в водуИсследователи надеются использовать этот метод, чтобы лучше понять квантовую природу водородных связей и роль, которую они играют в странных свойствах воды, а также ключевую роль, которую эти свойства играют во многих химических процессах. и биологические процессы.
«Это действительно открыло новое окно для изучения воды», — сказал Сицзе Ван, выдающийся научный сотрудник SLAC и соавтор исследования. «Теперь, когда мы, наконец, можем увидеть движение водородных связей, мы хотели бы связать эти движения с более широкой картиной, которая могла бы пролить свет на то, как вода привела к возникновению и выживанию жизни на Земле, и дать информацию о развитии методов возобновляемой энергии.