Физические свойства воды Интересно о Доставке питьевой бутилированной воды в Твери
- Главная
- Полезная информация
- Физические свойства воды
Под свойствами воды понимают совокупность биохимических, органолептических, физико-химических, физических, химических и других свойств воды. Многие свойства воды аномальны, это вызвано особенностями строения молекулы воды. Вода (Н2О) — это окись водорода, она является наиболее важным и распространенным веществом, в природе не существует чистой воды, в ней обязательно содержатся какие-либо примеси, чистая вода не имеет вкуса и запаха, прозрачна, ее получают в процессе перегонки, после этого она называется дистиллированной.
- При переходе воды из твердого состояния в жидкое ее плотность не уменьшается, а возрастает, также плотность воды увеличивается при ее нагреве от 0 до 4°С, максимальную плотность вода имеет при 4°С, и только при последующем ее нагревании плотность уменьшается.
- Еще одним свойством воды является то, что она обладает высокой теплоемкостью (4,1868 кДж/кг), это объясняет, почему в ночное время и при переходе от лета к зиме вода остывает медленно, а днем или во время перехода от зимы к лету так же медленно нагревается, благодаря этому свойству вода является регулятором температуре на Земле.
- Среди всех жидкостей вода имеет самое высокое поверхностное натяжение
- По массе в состав воды входит 88,81% кислорода и 11,19% водорода, а наибольшую плотность вода имеет при 0°С (1г/см3), она плохой проводник для электричества и теплоты, но хороший растворитель, вода кипит при температуре 100°С, а замерзает при 0°С.

Тяжелой водой (D2О) называется та вода, в состав которой входит изотоп водорода дейтерий, химические реакции с такой водой протекают медленнее, чем с обычной.
| Физические свойства | Н2О | D2О |
| Температура кипения (°С) | 100 | 101,4 |
| Температура кристаллизации (°С) | 0 | 3,8 |
| Плотность при 20°С (г/см3) | 0,9982 | |
| Молекулярная масса | 18 | 20 |
Физические свойства воды аномальны, вода является единственным веществом на Земле, существующим в жидком, твердом и газообразном состояниях.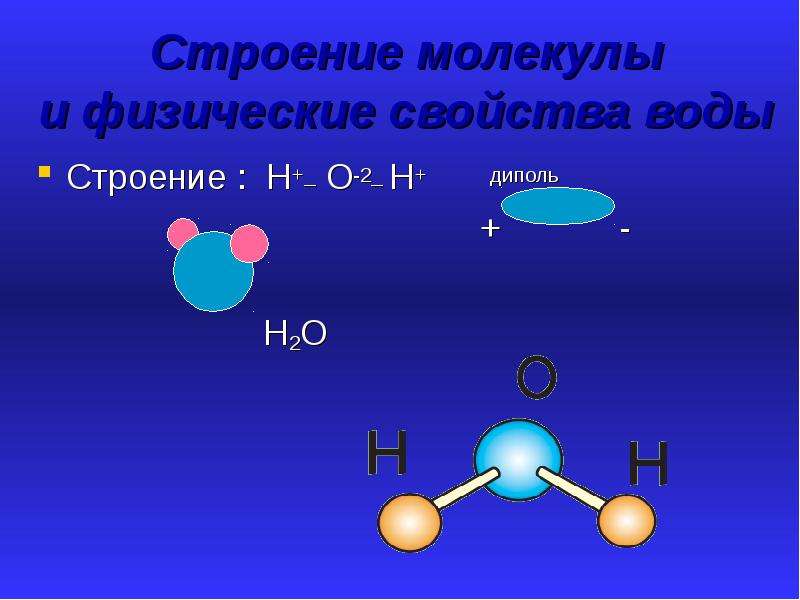
Подробнее о составе воды можно посмотреть в карточке товара
Источник: www.vodoobmen.ru
Список акций
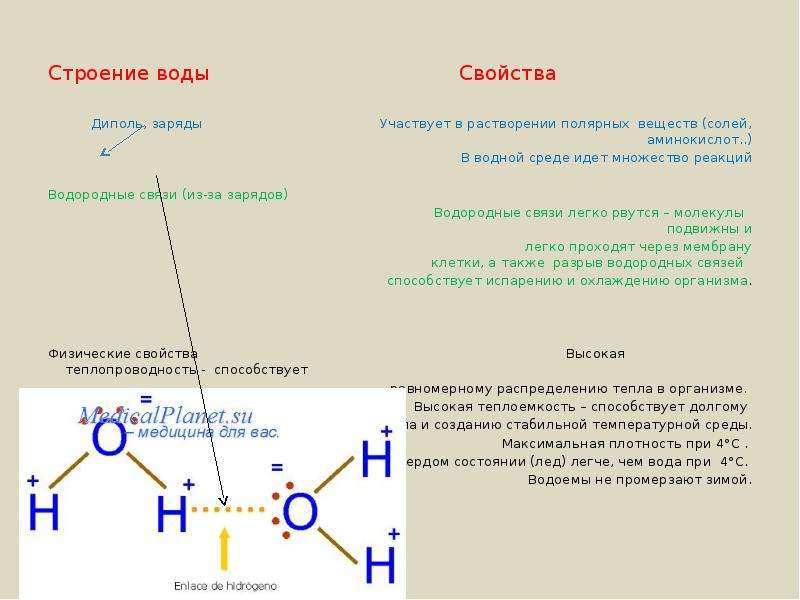
Строение молекулы и свойства воды
Аномальные свойства воды предполагают
существование прочных сил между
молекулами воды. Это можно объяснить
уже при рассмотрении природы единичной
молекулы воды, а затем и группы молекул.
Шесть валентных электронов кислорода
в молекуле воды гибридизированы в
четырех Sp
Две гибридные орбитали образуют О—Н ковалентные связи с углом 105°, тогда как другие две орбитали имеют неподеленные электронные пары. Ковалентные О—Н связи, благодаря высокой электроотрицательности кислорода, частично (на 40%) имеют ионный характер.
Таким образом, молекула воды имеет два отрицательных и два положительных заряда по углам тетраэдра. Вследствие этого, каждая
465
молекула воды тетраэдричес-ки
координирована с четырьмя другими
молекулами воды благодаря водородным
связям (см.
Рис. 10.2. Тетраэдрическая координация молекул воды
Одновременное присутствие в молекуле воды двух доноров и двух акцепторов делает возможной ассоциацию в трехмерную сеть, стабилизированную водородными связями, что обеспечивает большую силу взаимодействия между молекулами. Эта структура объясняет особые физические свойства воды, необычные для малых молекул. Так, например, спирт и соединения с изоэлектрическими диполями, такие как HF или NH3, образуют, в отличие от воды, только линейную или двухмерную ассоциацию.
Частичная поляризация Н—О связи в
дальнейшем усиливается за счет образования
водородных связей. Поэтому дипольный
момент комплекса, состоящего из
увеличенного числа водных молекул
(мультимолекулярный диполь), тем больше,
чем больше молекул ассоциировано и,
естественно, больше дипольного момента
единичной молекулы. Как следствие,
диэлектрическая постоянная воды
оказывается большой и превышает величину,
которая может быть вычислена на основе
дипольного момента единичной молекулы.
Транспорт (перенос) протона осуществляется
вдоль водородной связи. Это поистине
прыжок протона от одной молекулы воды
к соседней молекуле воды. Независимо
от того, получен ли протон путем
диссоциации воды или будет получен от
кислоты, он будет погружаться в орбита-ли
неподеленных электронов молекулы,
образуя гидратированный ион водорода
Н
Подобный механизм действует и в транспорте ионов ОН—, который осуществляется вдоль водородных связей:
466
Переход протона от одного атома кислорода
к другому осуществляется чрезвычайно
быстро (V>1012c-1), поэтому
подвижность протона весьма велика. Она
превышает подвижность других ионов в
4—5 раз и соизмерима только с подвижностью
ионов ОН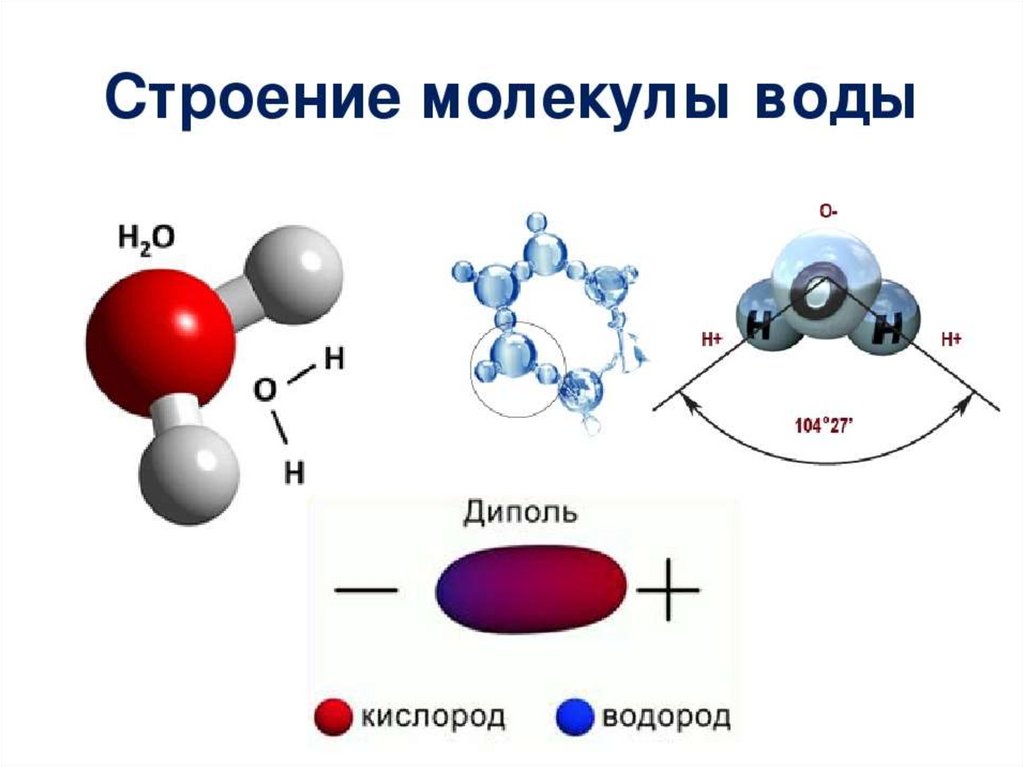
Способность воды образовывать трехмерные водородные связи, для разрушения которых необходима дополнительная энергия, объясняет рассмотренные выше необычные свойства воды, например высокие значения теплоемкости, точек плавления и кипения, поверхностного натяжения и теплот фазовых переходов.
Вода может влиять на конформацию
макромолекул, если там имеют место
какие-либо нековалентные связи, которые
стабилизируют конформацию большой
молекулы. Эти нековалентные связи могут
быть трех видов: водородные, ионные и
неполярные связи. В белках существует
конкуренция между CO…HN водородными
связями и вода-амид водородными связями.
Чем больше способность растворителя к
образованию водородных связей, тем
слабее CO…HN связь. В водной среде теплота
образования или разрыва этой связи
равна 0. Это означает, что CO…HN водородная
связь не может обеспечить стабилизацию
в водном растворе. Конкурирующая
водородная связь от Н
Рис. 10.3. Образование гидрофобной связи
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов,
467
взаимодействует с активными металлами и вступает в различные другие реакции самого разнообразного характера.
Превращения белков, Липидов, углеводов с участием воды имеют важное значение в пищевых технологиях.
Помимо химических реакций, в которые
вступает вода, при растворении веществ
в воде имеют место взаимодействия
физико-химического характера. Ниже мы
кратко рассмотрим взаимодействие воды
с ионами и ионными группами, группами,
обладающими способностью к образованию
водородных связей, и с неполярными
веществами (группами). Эти взаимодействия
необходимо принимать во внимание при
рассмотрении классификации видов влаги
в пищевых продуктах и ее причастности
к химическим, биохимическим и
микробиологическим изменениям в продукте
при хранении (см. раздел 10.3).
Эти взаимодействия
необходимо принимать во внимание при
рассмотрении классификации видов влаги
в пищевых продуктах и ее причастности
к химическим, биохимическим и
микробиологическим изменениям в продукте
при хранении (см. раздел 10.3).
468
465::466::467::468::Содержание
468::469::470::Содержание
Физические и химические свойства воды
Основные понятия
В этом уроке по свойствам воды вы узнаете о физических и химических свойствах воды. Вы также узнаете о структуре молекулы воды.
Темы, освещенные в других статьях
Полярность воды
Электроотрицательность
Растворитель против растворителя Растворенное вещество
Удельная теплоемкость
Плотность
Словарь
Плотность- Масса на единицу объема
Удельная теплоемкость — Количество энергии, необходимое для повышения температуры 1 кг материала на 1 °С
Теплота парообразования — Количество энергии, необходимое для превращения некоторого количества жидкости в газ
Полярная молекула- Молекула с частично отрицательно заряженным концом и частично положительно заряженным концом
Электроотрицательность- Склонность атома притягивать общие электроны в химической связи
Введение в свойства воды
Вода (h30) является «универсальным растворителем» и самой распространенной поверхностью на Земле. Это также единственное обычное вещество, существующее в твердом, жидком и газообразном состояниях. Молекулы воды образуют водородные связи и чрезвычайно полярны. Пять основных свойств воды — это ее высокая полярность, высокая удельная теплоемкость, высокая теплота парообразования, низкая плотность в твердом состоянии и притяжение к другим полярным молекулам.
Это также единственное обычное вещество, существующее в твердом, жидком и газообразном состояниях. Молекулы воды образуют водородные связи и чрезвычайно полярны. Пять основных свойств воды — это ее высокая полярность, высокая удельная теплоемкость, высокая теплота парообразования, низкая плотность в твердом состоянии и притяжение к другим полярным молекулам.
Полярность и структура
Один атом кислорода и два атома водорода составляют молекулу воды. Он имеет изогнутую молекулярную геометрию с кислородом, имеющим две неподеленные пары электронов. Разница в электроотрицательности между кислородом и водородом приводит к тому, что кислород имеет частичный отрицательный заряд, а водород — частичный положительный заряд. Эта разница в заряде вызывает полярность. Частичный положительный заряд водорода одной молекулы воды притягивает частичный отрицательный заряд кислорода другой молекулы воды. Это притяжение называется водородной связью.
Водородная связь слабее, чем ковалентная связь между кислородом и водородом одной и той же молекулы, но обуславливает многие уникальные свойства воды. Например, для разрыва водородных связей требуется больше энергии, поэтому вода имеет более высокую температуру плавления и кипения.
Например, для разрыва водородных связей требуется больше энергии, поэтому вода имеет более высокую температуру плавления и кипения.
Универсальный растворитель
Вода — растворитель жизни. Гидрофильные вещества – это те, которые растворяются в воде, тогда как гидрофобные вещества плохо смешиваются с водой. Вещества могут растворяться в воде, если они могут соответствовать или преодолевать водородные связи между молекулами воды. Если они не могут, вещество образует осадок. Кислоты, спирты и соли хорошо растворимы в воде, а жиры и масла гидрофобны.
Растворенное в воде ионное вещество отделяется. Например, NaCl распадается на катионы Na+ и анионы Cl-, окруженные молекулами воды. Вода амфотерна, то есть может действовать как кислота или основание в зависимости от раствора. Он может образовывать ионы H+ и OH-.
Удельная теплоемкость
Вода имеет высокую удельную теплоемкость 4184 Дж/(кг x К) при 20°С и высокую теплоту парообразования из-за водородных связей. Это позволяет водоемам иметь минимальные колебания температуры для регулирования климата.
Это позволяет водоемам иметь минимальные колебания температуры для регулирования климата.
Высокая температура испарения воды позволяет людям использовать пот для охлаждения. Пот в основном состоит из воды. Он поглощает избыточное тепло тела, когда оно испаряется. Этот процесс известен как испарительное охлаждение.
Плотность
Плотность воды 1 грамм на кубический сантиметр. Это используется для определения грамма. Вместо того, чтобы подвергаться тепловому расширению, плотность увеличивается с температурой до пика 3,98 ° C, а затем уменьшается. Отрицательное тепловое расширение — это увеличение плотности между 32 и 390,16 F. В результате лед менее плотный, чем вода, которая имеет уменьшение плотности примерно на 10%. Вот почему водоемы могут иметь слой льда на поверхности, но содержать жидкость под ним. Это позволяет рыбам и морским обитателям выживать подо льдом. Высокая удельная теплоемкость поддерживает относительно стабильную температуру воды в течение зимы, что позволяет морской флоре и фауне выжить.
Содержание соли снижает температуру замерзания океана почти на 2°C. Лед по-прежнему плавает в океане, но он почти не содержит солей и имеет такую же плотность, что и лед в пресноводных водоемах. Соль увеличивает соленость и плотность оставшейся воды, которая опускается за счет конвекции. Этот процесс называется отказом от рассола.
Сжимаемость
Сжимаемость является результатом давления и температуры. Сжимаемость воды настолько мала, что ее часто считают несжимаемой. Низкая сжимаемость позволяет воде в глубоких океанах с высоким давлением уменьшаться в объеме всего на 1,8%.
Электропроводность
Чистая вода является хорошим изолятором, но деионизированная вода никогда не бывает полностью свободной от ионов. Вода в жидком состоянии подвергается процессу, называемому автоионизацией. Это означает, что две молекулы воды могут образовать один анион гидроксида (OH-) и один катион гидроксония (H 3 0+).
Когезия и адгезия
Водородные связи между молекулами воды постоянно разрываются и восстанавливаются с другими молекулами воды. Когезия – это способность молекул воды слипаться. Полярность воды также придает воде высокую адгезию: способность прилипать к другим поверхностям. Силы сцепления сильнее, чем силы сцепления.
Когезия – это способность молекул воды слипаться. Полярность воды также придает воде высокую адгезию: способность прилипать к другим поверхностям. Силы сцепления сильнее, чем силы сцепления.
Благодаря сильному когезии и адгезии вода проявляет капиллярное действие. Капиллярное действие — это процесс течения жидкости через узкое пространство без и часто против силы тяжести. Вода прилипает к стенкам корней растений и поднимается в растение. Пористые материалы, такие как вода, также проявляют капиллярное действие. Деревья могут переносить воду за счет капиллярного действия на расстояние более 100 метров.
Поверхностное натяжение
Водородная связь также приводит к тому, что вода имеет высокое поверхностное натяжение 71,99 мН/м при 25. Поверхностное натяжение достаточно велико, чтобы насекомые могли ходить по воде. Поверхностное натяжение является результатом когезионных свойств воды. Капли воды и вода, поднимающаяся над краем стакана, показывают высокое поверхностное натяжение воды. Подробнее о свойствах воды читайте здесь.
Подробнее о свойствах воды читайте здесь.
Свойства воды – физические и химические свойства
Что такое вода?
Вода представляет собой химическое вещество с химической формулой H 2 O , в одной молекуле воды два атома водорода ковалентно связаны с одним атомом кислорода. Познакомимся с физическими и химическими свойствами воды.
Содержание
- Свойства воды
- Физические свойства воды
- Химические свойства воды
- Часто задаваемые вопросы – Часто задаваемые вопросы
Взгляд на землю из космоса покажет ее синей. Этот синий цвет на самом деле вода, большая часть земли покрыта водой. Нам нужна вода практически для всего, например, для питья, купания, приготовления пищи и т. д., и поэтому мы должны знать о свойствах воды. Тело человека на 65 % состоит из воды. Вода необходима для выживания жизни на Земле.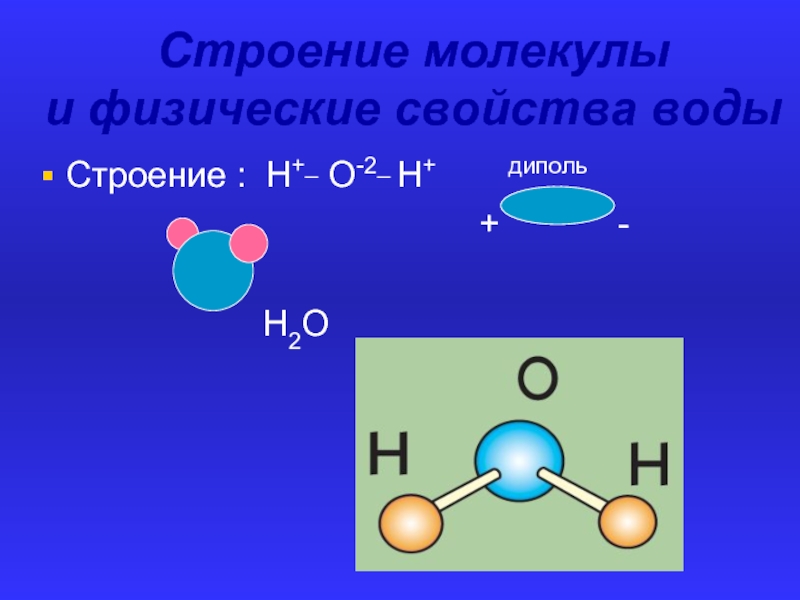 Вода распределена по земной поверхности неравномерно. Он образует основной растворитель и растворяет почти все полярные растворенные вещества. Итак, давайте посмотрим на его свойства и поймем причину его значения:
Вода распределена по земной поверхности неравномерно. Он образует основной растворитель и растворяет почти все полярные растворенные вещества. Итак, давайте посмотрим на его свойства и поймем причину его значения:
Физические свойства воды
Вода – бесцветная жидкость без вкуса. Молекулы воды имеют обширные водородные связи, что приводит к необычным свойствам в конденсированной форме. Это также приводит к высоким температурам плавления и кипения. По сравнению с другими жидкостями вода обладает более высокими удельной теплоемкостью, теплопроводностью, поверхностным натяжением, дипольным моментом и др. Эти свойства обуславливают ее значение в биосфере. Вода является отличным растворителем и поэтому помогает транспортировать ионы и молекулы, необходимые для метаболизма. Обладает высокой скрытой теплотой парообразования, что помогает регулировать температуру тела.
Химические свойства воды
Вода реагирует со многими веществами, образуя различные соединения. — (aq)\end{массив} \) 9- (aq)\end{массив} \)
— (aq)\end{массив} \) 9- (aq)\end{массив} \)
Электроположительные элементы восстанавливают воду до молекулы водорода. Таким образом, вода является отличным источником водорода. Давайте посмотрим на пример в этом случае:
\(\begin{array}{l}2H_2O(l) + 2Na(s) \rightarrow 2NaOH(aq) + H_2(g) \end{array} \)
В процессе фотосинтеза вода окисляется до O 2 . Поскольку вода может окисляться и восстанавливаться, она очень полезна в окислительно-восстановительных реакциях.
3. Реакция гидролизаВода имеет очень сильную склонность к гидратации из-за своей диэлектрической проницаемости. Он растворяет многие ионные соединения. Некоторые ковалентные и ионные соединения могут гидролизоваться в воде.
| Недвижимость | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Химическая формула | Н 2 О | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная масса | 18,01528(33) г/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Запах | Нет | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность | Твердый: 0,9167 г/мл при 0 °C Жидкость : 0,961893 г/мл при 95 °C 0,9970474 г/мл при 25 °C 0,9998396 г/мл при 0 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 99,98 ° С (211,96 ° F, 373,13 К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 0,00 °С (32,00 °F; 273,15 К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Растворимость | Плохо растворим в алифатических и ароматических углеводородах и эфирах. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кислотность (p K a)
| 13,995 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Давление пара | 3,1690 кПа или 0,031276 атм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основность (p K б) | 13,995 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Показатель преломления ( n D) | 1.3330 (20°С) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 0,6065 Вт/м·К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вязкость | 0,890 сП | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Структура | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | Шестигранник | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярная форма | Изогнутый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа точек | С 2v | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дипольный момент | 1.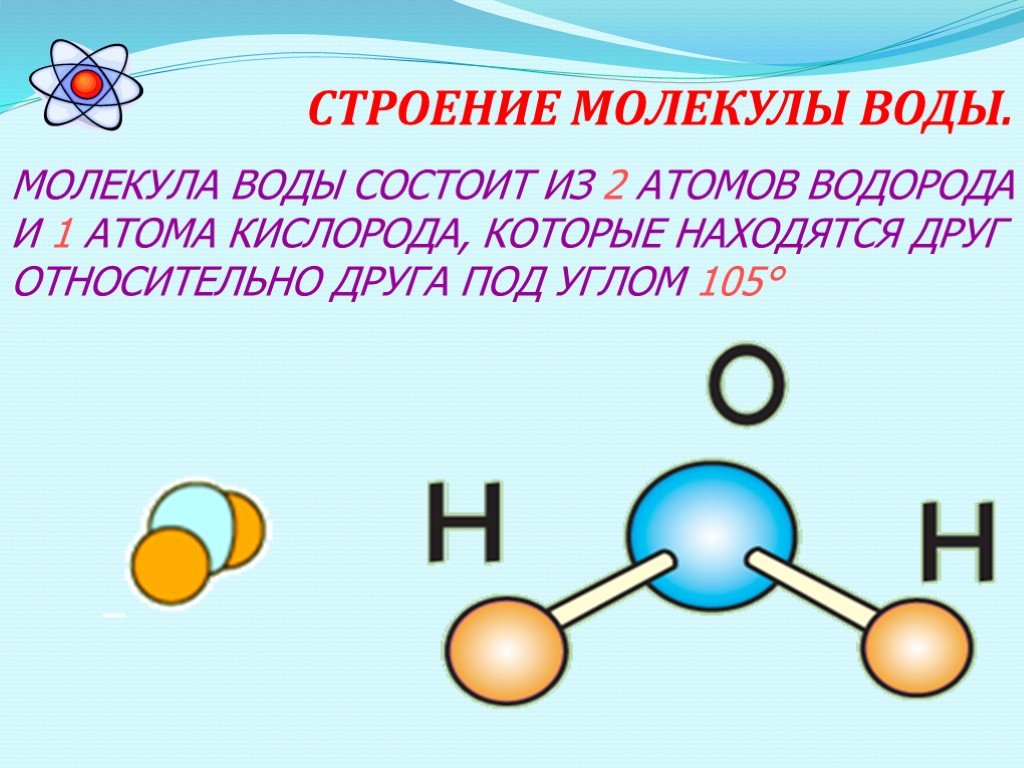 8546 Д 8546 Д | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Термохимия | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная Теплоемкость ( C ) | 75,375 ± 0,05 Дж/моль·К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартная энтальпия пласта (Δ f H o 298 ) | -285,83 ± 0,040 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартная молярная энтропия ( S o 298 ) | 69,95 ± 0,03 Дж/моль·К | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Свободная энергия Гиббса (Δ f G ˚) | -237,24 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Часто задаваемые вопросы – Часто задаваемые вопросы
Q1
Какова температура плавления?
Температура, при которой твердое тело становится жидким из-за достаточного количества тепла. Для данного вещества точка плавления его твердой формы такая же, как и точка замерзания его жидкой формы, и зависит от таких факторов, как чистота вещества и окружающее давление.
Q2
Как работает точка кипения?
Температура кипения жидкости – это температура, при которой давление ее пара равно атмосферному давлению. Нормальная температура кипения жидкости – это температура, при которой одна атмосфера (760 торр) равна давлению пара. Нормальная температура кипения воды составляет 100 градусов по Цельсию.
Q3
Что влияет на температуру кипения воды?
Окружающее давление является самым большим фактором, определяющим точку кипения жидкости. Давление воздуха в открытой системе, безусловно, равно земной атмосфере. Например, вода достигает стандартного атмосферного давления при 100 градусах по Цельсию. Вода может кипеть при более низкой температуре по мере увеличения высоты.
Q4
Что такое удельная теплоемкость в химии?
Количество энергии, необходимое для повышения температуры 1 грамма материала на 1 °C, называется удельной теплоемкостью.
Q5
Почему важна удельная теплоемкость?
Высокая удельная теплоемкость воды делает ее подходящей для систем центрального отопления, поскольку она может передавать много энергии путем нагревания при незначительных изменениях температуры.