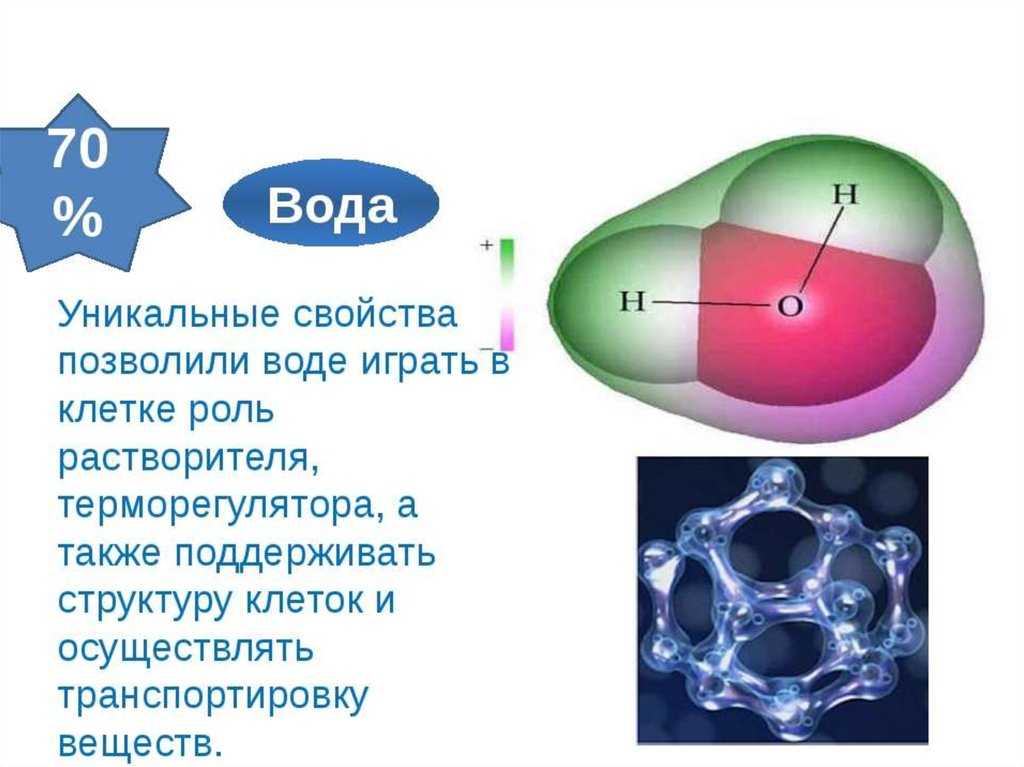
Свойства воды — презентация онлайн
СВОЙСТВА ВОДЫ
ВОДА — Н О (оксид водорода) — простейшее
2
устойчивое соединение водорода с кислородом.
Количество ВОДЫ на поверхности Земли оценивается в
1,39×1018 т.
ПРЕСНЫХ ВОД в реках, озерах, болотах и
водохранилищах составляет 2×1014 т.
Масса ледников Антарктики, Антарктиды и
высокогорных районов 2,4×1016т, примерно столько же
имеется ПОДЗЕМНЫХ ВОД, причем только небольшая
их часть — пресные.
В атмосфере находится примерно 1,3×1013 т ВОДЫ.
ВОДА входит в состав минералов и горных пород,
присутствует в почве.
ВОДА является обязательным компонентом всех живых
организмов.
ВОДА — самое распространенное вещество на
Земле. Молекулы воды обнаружены в
межзвездном пространстве.
ВОДА входит в состав комет,
большинства планет солнечной
системы и их спутников.
3/4 поверхности земного шара
покрыты водой в виде океанов,
морей, рек и озер.
ВОДА имеет очень большое значение в жизни
растений, животных и человека.
Происхождение жизни на Земле обязано ВОДЕ.
СВОЙСТВА
это совокупность
биохимических,
физических,
химических,
физико-химических,
органолептических,
и других свойств воды
ВОДЫ
Вода очень необычная по своим
физико-химическим свойствам.
Многие свойства воды аномальны.
ВОДА не имеет запаха, цвета и вкуса.
ВОДУ очень трудно окислить, сжечь или разложить
на составные части.
ВОДА — химически стойкое вещество.
ВОДА — универсальный растворитель.
Она растворяет больше солей и прочих веществ,
чем любое другое вещество.
Она окисляет почти все металлы и разрушает даже самые
твердые горные породы.
ВОДА — единственное известное нам
вещество, которое встречается в
естественных условиях на
поверхности Земли в твердом, жидком
и газообразном состояниях.
Расположение молекул
Стройными рядами
Тесновато
Простор
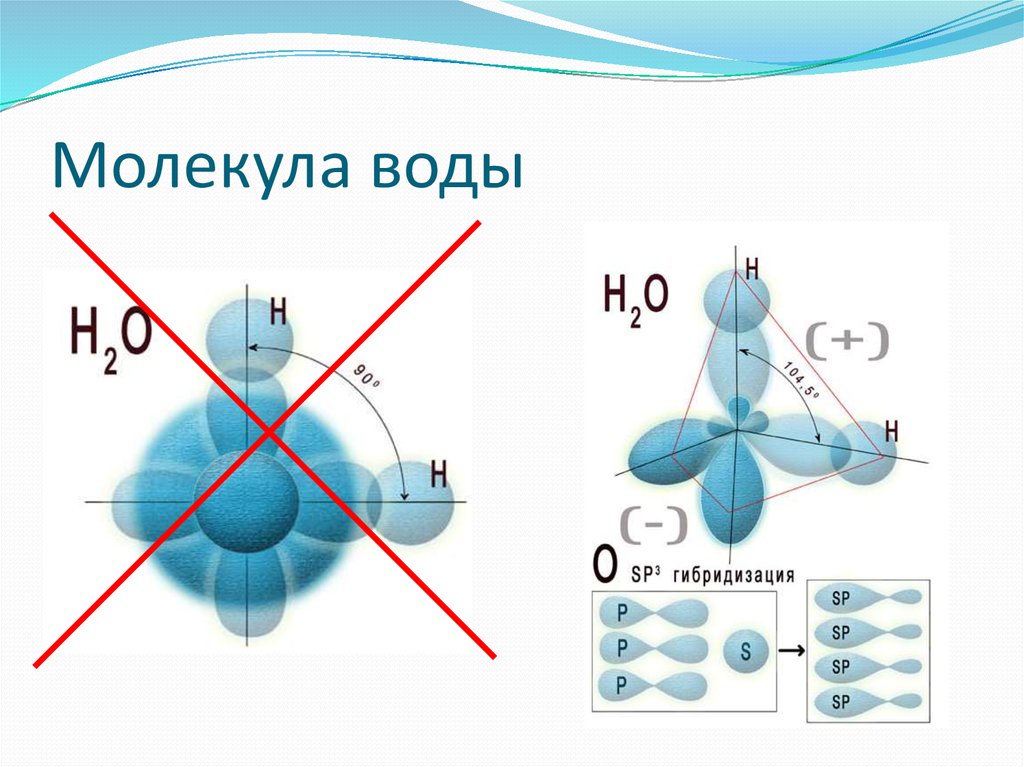
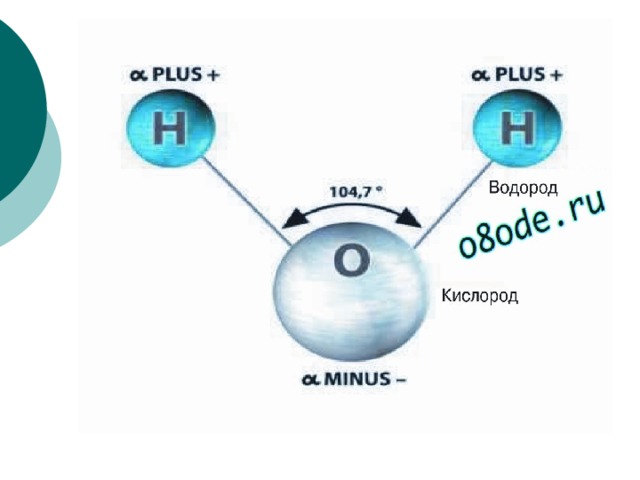
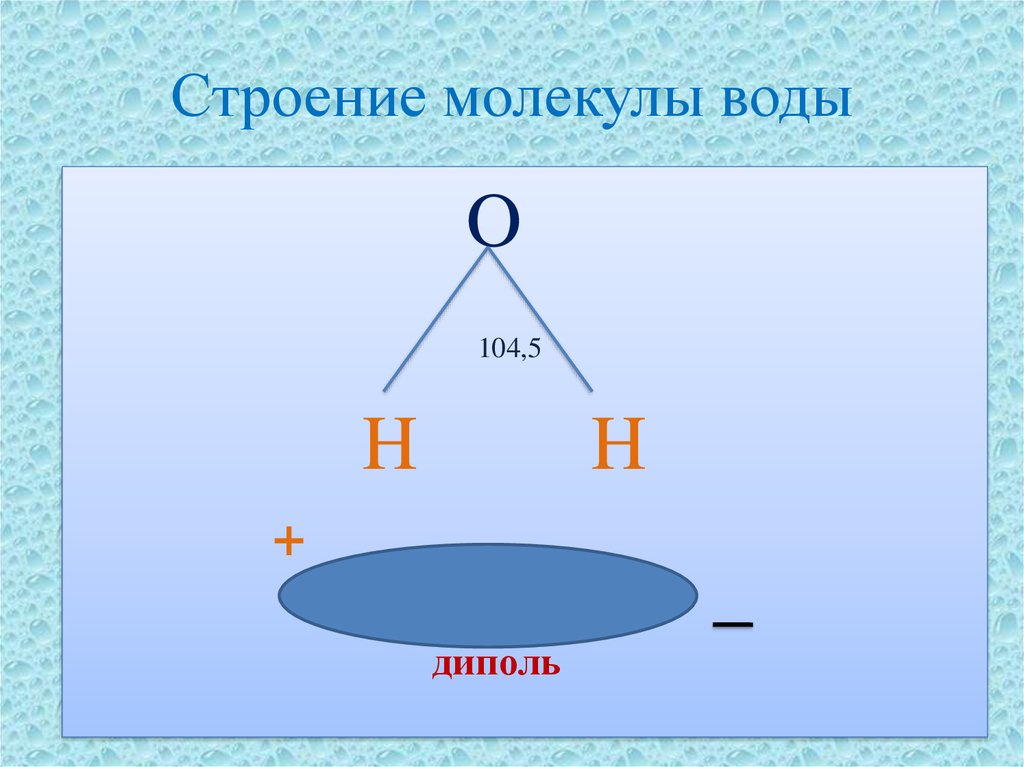
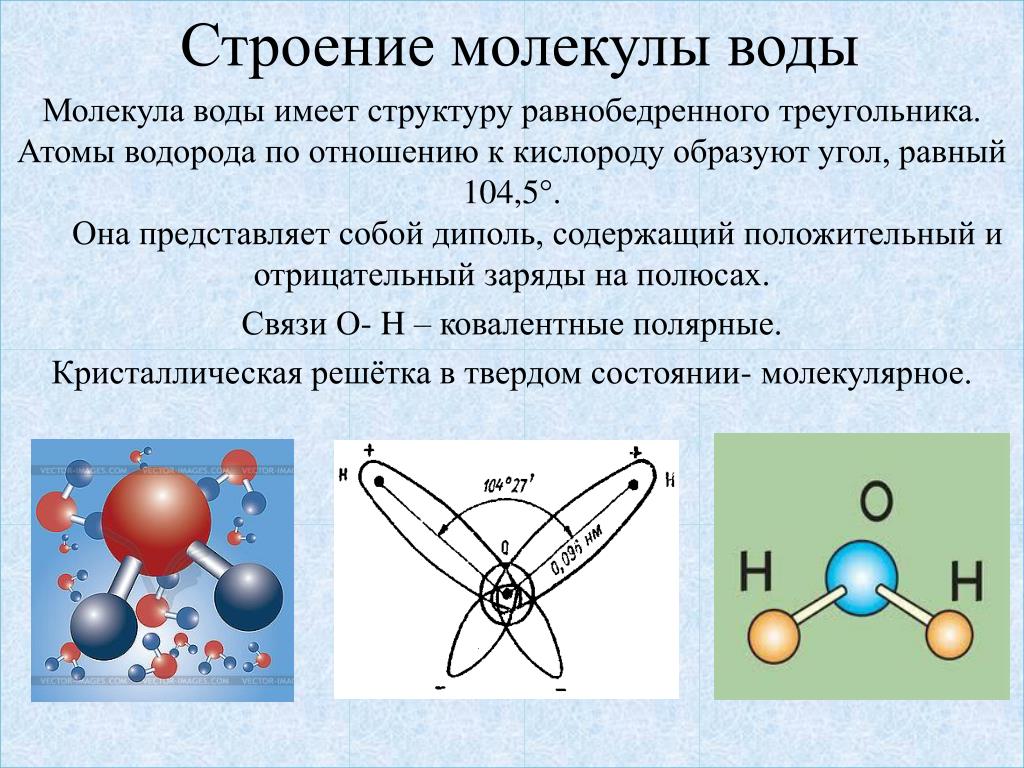
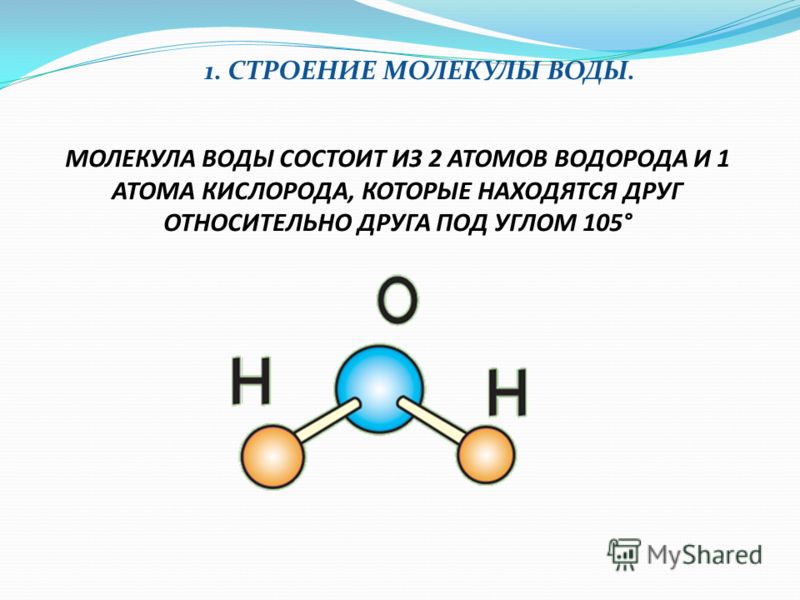
1. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ.
МОЛЕКУЛА ВОДЫ СОСТОИТ ИЗ 2 АТОМОВ ВОДОРОДА
И 1 АТОМА КИСЛОРОДА, КОТОРЫЕ НАХОДЯТСЯ ДРУГ
ОТНОСИТЕЛЬНО ДРУГА ПОД УГЛОМ 104,5°
8.
 Молекула водыСхема образования молекулы воды — из
Молекула водыСхема образования молекулы воды — изодного атома кислорода и двух атомов
водорода:
9. Строение молекулы воды
Самаяпростая
принятая
сегодня модель молекулы воды –
тетраэдр.
В действительности одиночных
молекул воды при нормальных
температуре и давлении не
существует.
Хотя молекула воды в целом
электронейтральна, она представляет собою все же
диполь, т.е. с одного края у нее преобладает
отрицательный заряд, а с другого — положительный.
Между собой диполи способны организовывать
соединения, когда одна молекула воды отрицательно заряженным краешком притягивает к себе
другую молекулу за ее положительный краешек.
Образуется водородная связь.
11. АНОМАЛИИ ВОДЫ Вода-самое аномальное соединение на земном шаре
Поверхностноенатяжение
обусловлено
силами притяжения между молекулами.
Внутри воды силы притяжения между молекулами
взаимно
компенсируются,
а
на
молекулы,
находящиеся
вблизи
поверхности,
действует
нескомпенсированная
результирующая
сила,
направленная внутрь от ее поверхности.
Поверхностное натяжение стремится уменьшить
поверхность жидкости до минимума.
Поверхностное натяжение влияет на условия
обмерзания сооружений, испарение, волнение,
влажность
снежного
покрова
и
другие
гидроледотермические явления.
Среди существующих в природе жидкостей
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ВОДЫ
уступает только ртути.
С поверхностным натяжением воды связано
ее сильное смачивающее действие (способность
«прилипать» к поверхности многих твердых тел).
Смачивание. При соприкосновении твердого тела
с водой смачивание наблюдается в том случае, когда
взаимодействие между их молекулами сильнее
взаимодействия между молекулами самой воды.
В этом случае вода будет стремиться увеличить
поверхность соприкосновения и растечется по
твердому телу.
Когда же взаимодействие между молекулами
твердого тела и молекулами воды более слабое, чем
между молекулами самой воды, вода будет
стремиться сократить поверхность соприкосновения с
твердым телом.
По отношению к твердым телам вода обладает
свойством полного и частичного смачивания и
полного несмачивания.
Явление смачивания позволяет воде подниматься
по капиллярным сосудам секвойи на высоту 115,8 м
15. Аномалия плотности
Плотность большинства веществ — жидкостей,кристаллов и газов — при нагревании уменьшается, а
при охлаждении увеличивается, вплоть до процесса
кристаллизации или конденсации.
Плотность воды при охлаждении от 100 до 4ºС
возрастает, однако, достигнув максимального
значения при температуре 4ºС, плотность при
дальнейшем
охлаждении
воды
начинает
уменьшаться.
Максимальная плотность воды (1.00 г·см-3)
наблюдается при температуре 4ºС, а не при
температуре замерзания 0ºС.
ПЛОТНОСТЬ ВОДЫ при переходе ее из твердого
состояния в жидкое не уменьшается, как у других
веществ, а возрастает.
Плотность льда — 916,7 кг/м³
воды — 999,8 кг/м³
В жидком состоянии при 4°С ее
плотность максимальна и больше
плотности льда.
Поэтому
лед
плавает
на
поверхности воды.
В лабораторных условиях х.ч. вода была
охлаждена в капиллярах до температуры -38ºС
При -120 °C вода она становится сверхвязкой или
тягучей, как патока, а при температуре ниже -135
°C она превращается в «стеклянную» или
«стекловидную» воду – твердое вещество, в
котором отсутствует кристаллическая структура.
Аномалия изменения объема при замерзании.
Замерзание воды происходит внезапно
скачкообразно, при этом её плотность резко
снижается более, чем на 8%, а объём также резко
возрастает примерно на 11 %.
Температура замерзания
воды с увеличением
давления понижается, а не
повышается, как это
следовало бы ожидать.
ВОДА имеет
аномально
высокие
температуры
замерзания
(0°С) и
кипения
(+100°С).
(Морская вода
замерзает при
более низкой
температуре: 1,9° при
солености 35%)
Вода плохо проводит электрический
ток, но становится хорошим
проводником,
если
в
ней
растворены
даже
небольшие
количества ионных веществ.

Теплота испарения ВОДЫ выше
теплоты испарения любых других
жидкостей, а теплота
кристаллизации уступает лишь
аммиаку.
20. Аномалия удельной теплоемкости [4,18 Дж/кг].
• Ни одно вещество в мире не поглощает и не отдаетсреде столько тепла, сколько вода. Теплоемкость
воды в 3100 раз больше воздуха, 10 раз больше
чем у стали и в 30 раз больше ртути.
• С поверхности морей, океанов, суши испаряется за
год 520000 км3 воды, которые, конденсируясь,
отдают много тепла холодным и полярным
регионам.
• Вода в организме человека составляет 70-90%. от
веса тела. Не обладай вода такой теплоемкостью,
обмен веществ в теплокровных и холоднокровных
организмах был бы невозможен.
В ночное время, а также при переходе
от лета к зиме вода остывает
медленно, а днем или при переходе от
зимы к лету так же медленно
нагревается, являясь, таким образом,
РЕГУЛЯТОРОМ ТЕМПЕРАТУРЫ НА
ЗЕМНОМ ШАРЕ.
22. Легче всего вода нагревается и быстрее всего охлаждается в своеобразной «температурной яме», соответствующей +37 °С —
Легче всего вода нагревается и быстреевсего охлаждается в своеобразной
«температурной яме», соответствующей
+37 °С — температуре человеческого тела.
При отрицательных температурах
также обнаружен минимум этой
характеристики. Он приходится на
– 20°С.
Аномалия теплоты плавления.
Вода обладает высокой удельной теплотой плавления.
Теплота плавления льда равна 79,7 кал·г-1, т. е. вода и
лед при 0°С отличаются по содержанию скрытой
энергии почти на 80 калорий. Она эквивалентна расходу
количества теплоты при нагреве того же количества
воды на 80°С (от 20 до 100°С).
Воду очень трудно заморозить, а лед — растопить.
Аномалия скрытой теплоты парообразования.
Скрытая теплота парообразования очень велика — 539
кал·г-1 при температуре 100°С.
Для испарения 1 л воды, нагретого до 100°С
требуется в 6 раз больше тепла, чем для нагрева его от
20° до 100°С.
Аномалия диэлектрической постоянной.
Диэлектрическая постоянная воды при 20°С равна
81 единице, а у большинства других веществ она
находится в пределах от 2 до 3 единиц.
Следствием такой большой диэлектрической
постоянной является сильное ионизирующее
свойство воды (расщепление растворенных веществ
на ионы) и параллельная ей большая способность к
растворению различных веществ.

Способность поляризации в магнитном поле.
Аномалия коэффициента преломления света.
Коэффициент преломления света в воде 1.34.
По волновой теории света он должен быть равным 9.
25. Еще несколько удивительных свойств…
• Ни одна жидкость не поглощает газы с такойжадностью, как вода. Но она их также легко отдает.
Дождь растворяет в себе все ядовитые газы
атмосферы. Вода — ее мощный природный фильтр,
очищающий атмосферу от всех вредных и ядовитых
газов.
Чтобы превратить 1 кг водопроводной воды в пар необходимо 2260 кДж тепла.
Для талой воды потребуется уже 2268,38 кДж. Разность в 8,38 кДж.
Водородные протоны в молекуле Н2О вращаются вокруг собственных осей и,
значит, обладают моментом количества движения или имеют спин.
Когда протоны вращаются в одну сторону, их моменты складываются, и
получается молекула пáраводы.
Если же они вращаются в разные стороны, возникает разность моментов, и
получается молекула όртоводы.
Молекулы параводы и ортоводы находятся на разных энергетических
уровнях.
Соотношение в обычной воде между ортоводой и параводой (¾ :¼)
Талая вода обладает
повышенной биологической
активностью т.к. содержит
большое количество параводы.
Долголетие горцев можно
объяснить и этим фактором
тоже.
Аномальные свойства воды вызваны
особенностями строения ее молекулы.
Все многообразие свойств воды и необычность их
проявления определяется физической природой этих
атомов, способом их объединения в молекулу и
группировкой образовавшихся молекул.
Аномальные свойства воды объясняются
существованием в ней водородных связей,
которые связывают между собой молекулы
как в жидком, так и в твердом состоянии.
Последующий материал излагается на правах
гипотезы,
ибо пока не получил полного научного
подтверждения
Особая группа свойств воды —
ПАМЯТЬ ВОДЫ
Особенности физических свойств воды и
многочисленные короткоживущие водородные связи
между соседними атомами водорода и кислорода в
молекуле воды создают благоприятные возможности
для образования особых структур-ассоциатов
(кластеров), воспринимающих, хранящих и
передающих самую различную информацию.

По мнению С.В.Зенина, вода состоит не из
отдельных молекул, а из крупных соединений,
включающих до 900 молекул — так называемых
кластеров.
Вода представляет собой иерархию
правильных объемных структур «ассоциатов»
(clathrates), в основе которых лежит
кристаллоподобный «квант воды», состоящий
из 57 ее молекул, которые взаимодействуют
друг с другом за счет свободных водородных
связей. При этом 57 молекул воды (квантов),
образуют структуру, напоминающую
тетраэдр. Тетраэдр в свою очередь состоит
из 4 додекаэдров (правильных 12гранников). 16 квантов образуют
структурный элемент, состоящий из 912
молекул воды.
Вода на 80% состоит из таких элементов, 15% — кванты-тетраэдры и 3% классические молекулы Н2О. Таким образом, структура воды связана с так
называемыми платоновыми телами (тетраэдр, додекаэдр), форма которых
связана с золотой пропорцией.
ВОДА, состоящая из множества кластеров различных
типов, образует иерархическую пространственную
жидкокристаллическую структуру, которая может
воспринимать и хранить огромные объемы информации.

Исследования показали, что чувствительность
информационной системы воды оказалась настолько
высокой, что она способна ощущать влияние не только
тех или иных внешних воздействий, но и форм
окружающих предметов, воздействия человеческих
эмоций и мыслей.
Емото Масару сфотографировал
кристаллы воды в различных
уголках земного шара.
Фотографии были опубликованы
в книге под названием
«Послание воды»
Емото Масару
Фотоаппарат Емото Масару
с вмонтированным
микроскопом
Для
получения
фотографий
микрокристаллов капельки воды помещали
в 100 чашек Петри и резко охлаждали в
морозильнике в течение 2 часов. Затем
они помещались в специальный прибор,
который состоит из холодильной камеры
и микроскопа с подключенным к нему
фотоаппаратом.
При температуре –5°С в темном поле
микроскопа под увеличением 200—500 раз
рассматривались образцы и делались
снимки наиболее характерных кристаллов.
Кристалл дистиллированной
воды, не подвергнутый
никакому воздействию
Кристалл
ключевой воды
Кристалл
антарктического льда
Кристалл воды,
прослушавший
«Пастораль» Бетховена
Вода, прослушавшая
тяжёлый рок
Вода после
приказа:
«Сделать это»
Вода получала
электромагнитные
излучения любви и
благодарности от
телевизора
Слова:
«Ты меня достал»
Слово
«Адольф Гитлер»
Вода, взятая из озера
Fujiwara, до молитвы
Кристалл той же воды
после молитвы
буддистского
первосвященника Като
Фонтан в Лувре,
Франция
Слова «Любовь и
благодарность»,
произнесенные на
английском языке
.
 . . на японском
. . на японскомязыке
. . . на немецком
языке
Слова, подобные слову «дурак»
уничтожают кластеры. Негативные
фразы и слова формируют крупные
кластеры или вообще их не создают, а
положительные, красивые слова и фразы
создают мелкие, напряженные кластеры.
Более мелкие кластеры дольше хранят
память воды.
ВОДА
– самое загадочное вещество в природе после ДНК.
Она обладает уникальными свойствами,
ещё полностью не объяснены и не все известны.
Чем дольше ее изучают, тем больше находят
новых аномалий и загадок в ней.
Большинство из этих аномалий
обеспечивают жизнь на Земле.
Нам и всему живому на Земле обязательно
необходима чистая и добрая ВОДА.
26. Охарактеризуйте физические и химические свойства воды, её роль в природе.
Под
свойствами воды понимают совокупность
биохимических, органолептических,
физико-химических, физических, химических
и других свойств воды. Многие свойства
воды аномальны, это вызвано особенностями
строения молекулы воды. Молекула воды
обладает угловым строением, ядра которого
образуют равнобедренный треугольник.
В основании этого треугольника находятся
два протона, а вершиной является ядро
атома кислорода.
Молекула воды
обладает угловым строением, ядра которого
образуют равнобедренный треугольник.
В основании этого треугольника находятся
два протона, а вершиной является ядро
атома кислорода.
Вода (Н2О) – это окись водорода, она является наиболее важным и распространенным веществом, в природе не существует чистой воды, в ней обязательно содержатся какие-либо примеси, чистая вода не имеет вкуса и запаха, прозрачна, ее получают в процессе перегонки, после этого она называется дистиллированной.
При переходе воды из твердого состояния в жидкое ее плотность не уменьшается, а возрастает, также плотность воды увеличивается при ее нагреве от 0 до +4°С, максимальную плотность вода имеет при +4°С, и только при последующем ее нагревании плотность уменьшается.
При
+4°С градусах плотность воды превышает
плотность льда, благодаря чему охлаждаясь
сверху вода опускается на дно лишь до
тех пор, пока ее температура не достигнет
+4°С, вследствие чего лед остается на
поверхности водоемов, что делает
возможным жизнь под слоем льда водной
флоры и фауны.
Данные свойства воды связаны с существующими в ней водородными связями, связывающими между собой молекулы, как в жидком, так и в твердом состоянии.
Еще одним свойством воды является то, что она обладает высокой теплоемкостью (4,1868 кДж/кг), это объясняет, почему в ночное время и при переходе от лета к зиме вода остывает медленно, а днем или во время перехода от зимы к лету также медленно нагревается. Благодаря этому свойству вода является регулятором температуры на Земле.
Вода обладает большой удельной теплоемкостью и является хорошим теплоносителем.
Среди всех жидкостей вода имеет самое высокое поверхностное натяжение, исключение составляет только ртуть. Дистиллированная вода не проводит электрический ток, так как она слабый электролит и диссоциирует в малой степени.
Однако вода способна стать хорошим проводником при условии растворения в ней даже малого количества ионных веществ.
По
массе в состав воды входит 88,81% кислорода
и 11,19% водорода, вода кипит при температуре
+100°С, а замерзает при 0°С, она плохой
проводник для электричества и теплоты,
но хороший растворитель.
Вода является растворителем необходимым для протекания биохимических реакций, она хорошо растворяет ионные и многие ковалентные соединения. Своими способностями к растворению многих веществ вода обязана полярности своих молекул (при растворении ионных веществ молекулы воды ориентируются вокруг ионов).
Тяжелой
водой (D
Физические свойства | Н2О | D2О |
Температура кипения (°С) | 100 | 101,4 |
Температура кристаллизации (°С) | 3,8 | |
Плотность при 20°С (г/см3) | 0,9982 | 1,1050 |
Молекулярная масса | 18 | 20 |
Физические
свойства воды аномальны, вода является
единственным веществом на Земле,
существующим в жидком, твердом и
газообразном состояниях.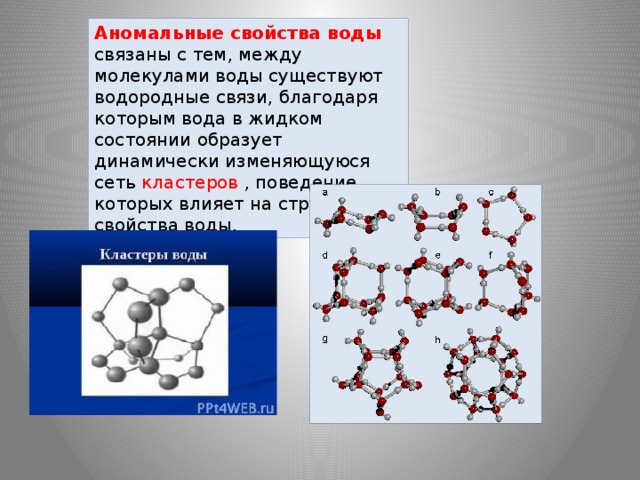
Многие
столетия люди не знали, что представляет
собой вода, и как появилась она на
планете. До XIX века люди не знали, что
вода — химическое соединение. Ее считали
обычным химическим элементом. После
этого свыше ста лет все и всюду считали,
что вода — соединение, описываемое
единственно возможной формулой H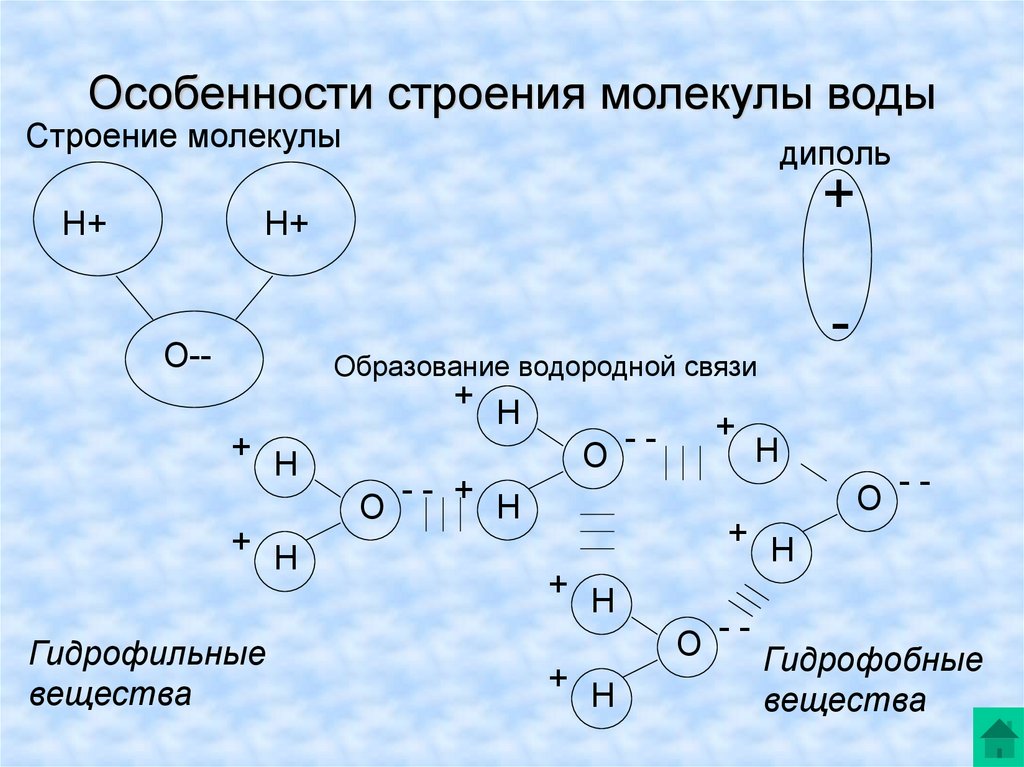

Температура
замерзания и таяния воды 0° С, а кипения
— 100° С.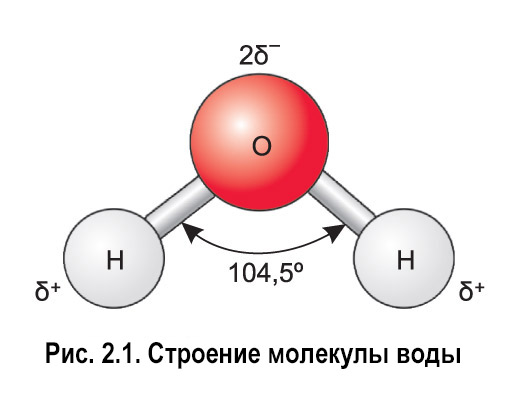 Толстый слой воды имеет голубой
цвет, что обусловливается не только ее
физическими свойствами, но и присутствием
взвешенных частиц примесей. Вода горных
рек зеленоватая из-за содержащихся в
ней взвешенных частиц карбоната кальция.
Чистая вода — плохой проводник
электричества.
Сжимаемость воды очень
мала. Плотность воды максимальна при
4° С. Это объясняется свойствами водородных
связей ее молекул. Если оставить воду
в открытой емкости, то она постепенно
испарится — все ее молекулы перейдут в
воздух. В то же время вода, находящаяся
в плотно закупоренном сосуде испаряется
лишь частично, т.е. при определенном
давлении водяных паров между водой и
воздухом, находящимся над ней,
устанавливается равновесие. Давление
паров в равновесии зависит от температуры
и называется давлением насыщенного
пара (или его упругостью). При обычном
давлении 760 мм рт.ст. вода кипит при 100°
С, а на высоте 2900 м над уровнем моря
атмосферное давление падает до 525 мм
рт.ст. и температура кипения оказывается
равной 90° С.
Толстый слой воды имеет голубой
цвет, что обусловливается не только ее
физическими свойствами, но и присутствием
взвешенных частиц примесей. Вода горных
рек зеленоватая из-за содержащихся в
ней взвешенных частиц карбоната кальция.
Чистая вода — плохой проводник
электричества.
Сжимаемость воды очень
мала. Плотность воды максимальна при
4° С. Это объясняется свойствами водородных
связей ее молекул. Если оставить воду
в открытой емкости, то она постепенно
испарится — все ее молекулы перейдут в
воздух. В то же время вода, находящаяся
в плотно закупоренном сосуде испаряется
лишь частично, т.е. при определенном
давлении водяных паров между водой и
воздухом, находящимся над ней,
устанавливается равновесие. Давление
паров в равновесии зависит от температуры
и называется давлением насыщенного
пара (или его упругостью). При обычном
давлении 760 мм рт.ст. вода кипит при 100°
С, а на высоте 2900 м над уровнем моря
атмосферное давление падает до 525 мм
рт.ст. и температура кипения оказывается
равной 90° С.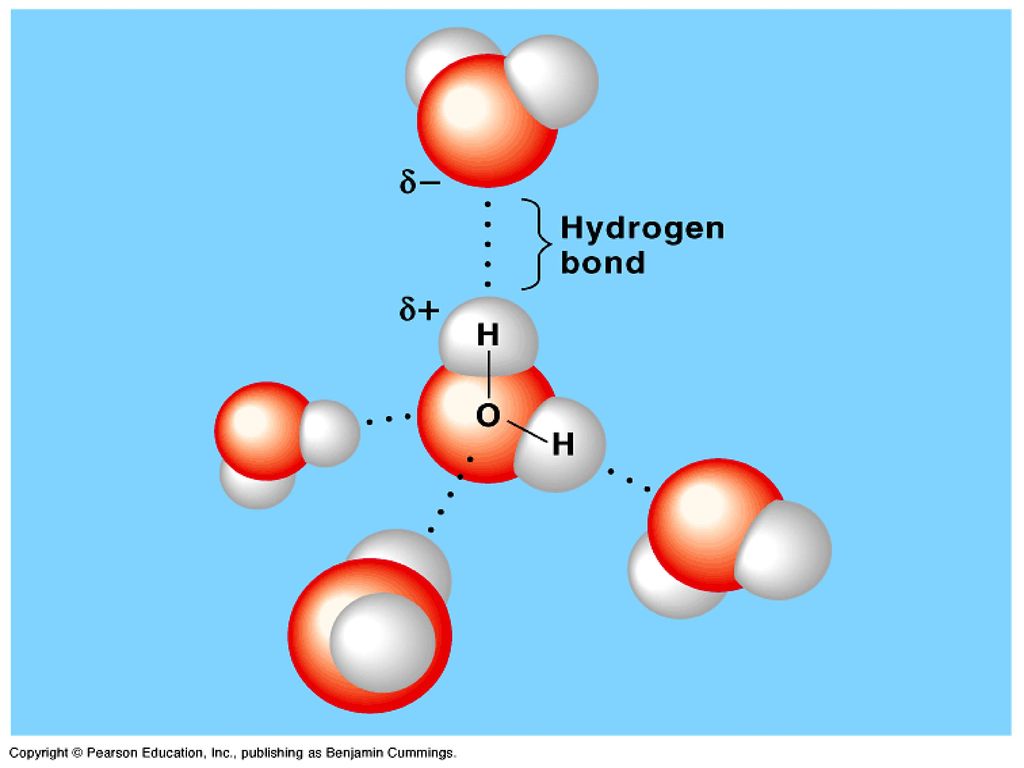
Ученые выяснили структуру воды и объяснили её аномальные свойства
https://ria.ru/20090812/180637381.html
Ученые выяснили структуру воды и объяснили её аномальные свойства
Ученые выяснили структуру воды и объяснили её аномальные свойства — РИА Новости, 12.08.2009
Ученые выяснили структуру воды и объяснили её аномальные свойства
Аномальные свойства воды, определяющие, в том числе, и наличие жизни на Земле — её переменная плотность, высокая теплоемкость и большое поверхностное натяжение, объясняются двумя типами структур, в которые самоорганизуются молекулы жидкости.
2009-08-12T15:22
2009-08-12T15:22
2009-08-12T15:22
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.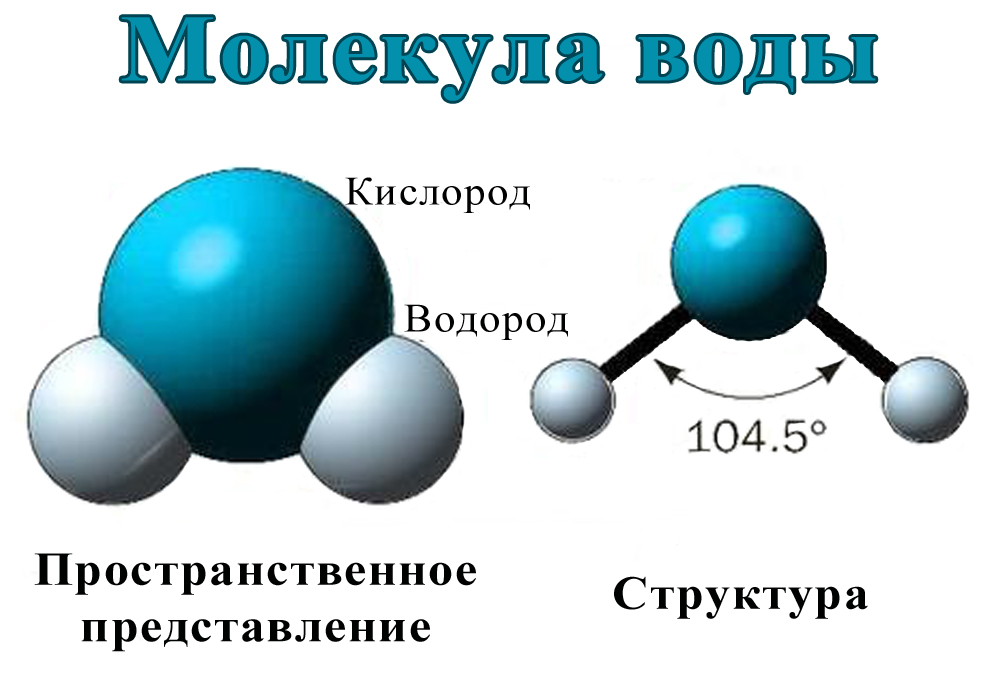 img.ria.ru/images/17907/05/179070534_0:56:500:337_1920x0_80_0_0_7789f3f70b98577bb198b00663f5581f.jpg
img.ria.ru/images/17907/05/179070534_0:56:500:337_1920x0_80_0_0_7789f3f70b98577bb198b00663f5581f.jpg
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2009
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/17907/05/179070534_0:0:500:375_1920x0_80_0_0_1c1ab57f349768665f6c771f10056762.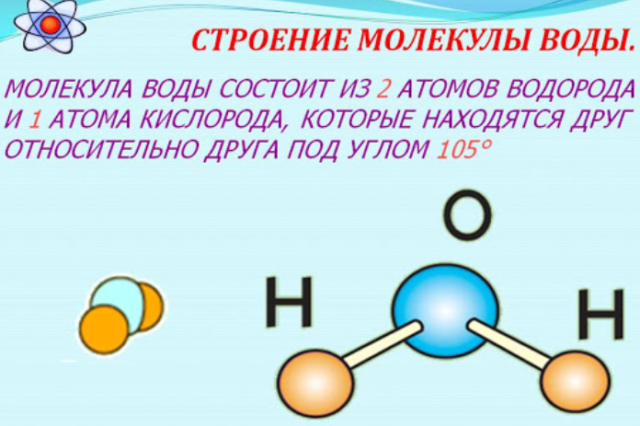 jpg
jpg
1920
1920
true
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
экология
Экология, Наука
МОСКВА, 12 авг — РИА Новости. Аномальные свойства воды, определяющие, в том числе, и наличие жизни на Земле — её переменная плотность, высокая теплоемкость и большое поверхностное натяжение, объясняются двумя типами структур, в которые самоорганизуются молекулы жидкости, уверены авторы нового исследования, опубликованного в журнале Proceedings of the National Academy of Sciences.
Ученым давно были известны 66 необъяснимых свойств воды, отличающих её от большинства других химических веществ, встречающихся в жидком состоянии. Так, в отличие от всех известных жидкостей, плотность которых монотонно увеличивается с понижением температуры, плотность воды максимальна при 4 градусах Цельсия, а при дальнейшем понижении температуры вновь начинает убывать. Это уникальное свойство воды делает возможной жизнь в реках и озерах — в противном случае эти относительно мелкие водоемы неизбежно промерзали бы до дна в зимний период и были бы лишены всех живых организмов, за исключением, может быть, простейших бактерий экстремофилов.
Так, в отличие от всех известных жидкостей, плотность которых монотонно увеличивается с понижением температуры, плотность воды максимальна при 4 градусах Цельсия, а при дальнейшем понижении температуры вновь начинает убывать. Это уникальное свойство воды делает возможной жизнь в реках и озерах — в противном случае эти относительно мелкие водоемы неизбежно промерзали бы до дна в зимний период и были бы лишены всех живых организмов, за исключением, может быть, простейших бактерий экстремофилов.
Вода обладает огромной теплоемкостью — благодаря этому теплые океанические течения согревают многие северные регионы планеты, принося тепло из южных широт.
Аномально высокое поверхностное натяжение жидкой воды не только позволяет некоторым насекомым спокойно ходить по её поверхности, но и благодаря капиллярным силам обеспечивает поступление питательных веществ к кронам гигантских деревьев, достигающих нескольких десятков метров в высоту.
Объяснить эти свойства на основании лишь строения и химических параметров молекул воды ученые до последнего времени не могли. Секрет крылся в структуре, в которую самоорганизуются молекулы жидкой воды. Он долгое время оставался неразгаданным, так как изучить эту структуру теми же методами, что применяются для изучения строения твердых тел, практически невозможно.
Секрет крылся в структуре, в которую самоорганизуются молекулы жидкой воды. Он долгое время оставался неразгаданным, так как изучить эту структуру теми же методами, что применяются для изучения строения твердых тел, практически невозможно.
Команда Андерса Нильсона (Anders Nilsson), ведущего специалиста Стенфордского центра синхротронного излучения (Stanford Synchrotron Radiation Lightsource), сумела преодолеть эти трудности благодаря новейшим методам изучения строения жидкостей с использованием мощного рентгеновского излучения, получаемого с помощью больших ускорителей элементарных частиц, называемых синхротронами. Один из использованных в работе синхротронов находится в Японии, а второй в США.
Ученые выяснили, что существовавшие до сих пор представления о молекулярной структуре воды были неверными — оказалось, что её молекулы формируют не одну структуру, а одновременно два типа структур, сосуществующих в жидкости вне зависимости от температуры. Один тип структуры формируется в виде сгустков примерно по 100 молекул, структура которых напоминает структуру льда. Второй тип структуры, окружающей сгустки, гораздо менее упорядочен.
Второй тип структуры, окружающей сгустки, гораздо менее упорядочен.
Увеличение температуры вплоть до точки кипения воды приводит к некоторому искажению структуры сгустков и уменьшению их количества и доминированию разупорядоченной структуры.
«Этот процесс можно представить как танцевальный клуб, где часть людей сидит за столиками, отражая упорядоченную компоненту воды, а часть находясь в толпе, непрерывно перемещается в танце, отражая разупорядоченную. Увеличение температуры воды в этом случае можно сравнить с всеобщим поднятием настроения и ускорением музыки, когда люди начинают вставать из-за столов и присоединяться к танцующим, а часть пустующих столов и вовсе убирается для высвобождения места. Охлаждение — обратный процесс, когда танцпол заполняется столами, и за них присаживаются утомленные танцами гости клуба. При этом при одной и той же «температуре» танцующие и сидящие люди постоянно меняются местами — некоторые присаживаются отдохнуть а некоторые наоборот идут танцевать, тогда как общее соотношение танцующих и сидящих остается прежним» — пояснил результаты работы Нильсон, слова которого приводит пресс-служба Стенфордского центра линейных ускорителей в США.
Это, в частности, объясняет нелинейную зависимость плотности воды от температуры — упорядоченные скопления молекул имеют меньшую плотность, чем неупорядоченные, и она мало меняется с изменением температуры, которую можно сравнить с постоянным размером столов, не зависящим от настроения собравшихся или громкости музыки в ресторане.
8(a) Физические свойства воды
Мы живем на планете, где преобладают
вода. Покрыто более 70% поверхности Земли.
с этой простой молекулой. Ученые подсчитали, что гидросфера содержит около
1,36 миллиарда кубических километров этого вещества в основном
в виде жидкости (воды), занимающей топографические
депрессии на Земле. Вторая по распространенности форма
молекулы воды на нашей планете составляет лед.
Если бы весь лед на нашей планете растаял, уровень моря
подняться примерно на 70 метров.
Вода также необходима для жизни. Вода является основным компонентом почти всех форм жизни. Самый животные и растения содержат более 60% воды по объему. Без воды жизнь, вероятно, никогда бы не развилась на нашей планете.
Вода имеет очень простую атомную структуру.
Эта структура состоит из двух атомов водорода, связанных
на один атом кислорода ( Рисунок 8a-1 ).
Природа атомного строения воды обуславливает ее
молекулы обладают уникальными электрохимическими свойствами.
Водородная сторона молекулы воды имеет небольшое
положительный заряд (см. рис. 8а-1 ). На
на другой стороне молекулы существует отрицательный заряд.
Эта молекулярная полярность делает воду мощным
платежеспособным и отвечает за его сильные поверхность
натяжение (для получения дополнительной информации об этих двух свойствах
см. обсуждение ниже).
обсуждение ниже).
| Рисунок 8а-1 : Атомная структура воды (или диводорода монооксид) молекула состоит из двух водородных ( Х ) атомов, соединенных с одним кислородом ( О ) атом. Уникальный способ, которым атомы водорода присоединяются к атому кислорода, вызывают одну сторону молекула имеет отрицательный заряд и область в противоположном направлении, чтобы иметь положительное обвинение. Результирующая полярность заряда вызывает молекулы воды притягиваются друг к другу образуя прочные молекулярные связи. |
Когда молекула воды образует физическую фазу изменить его молекулы располагаются в
совершенно разные модели ( Рисунок 8a-2 ).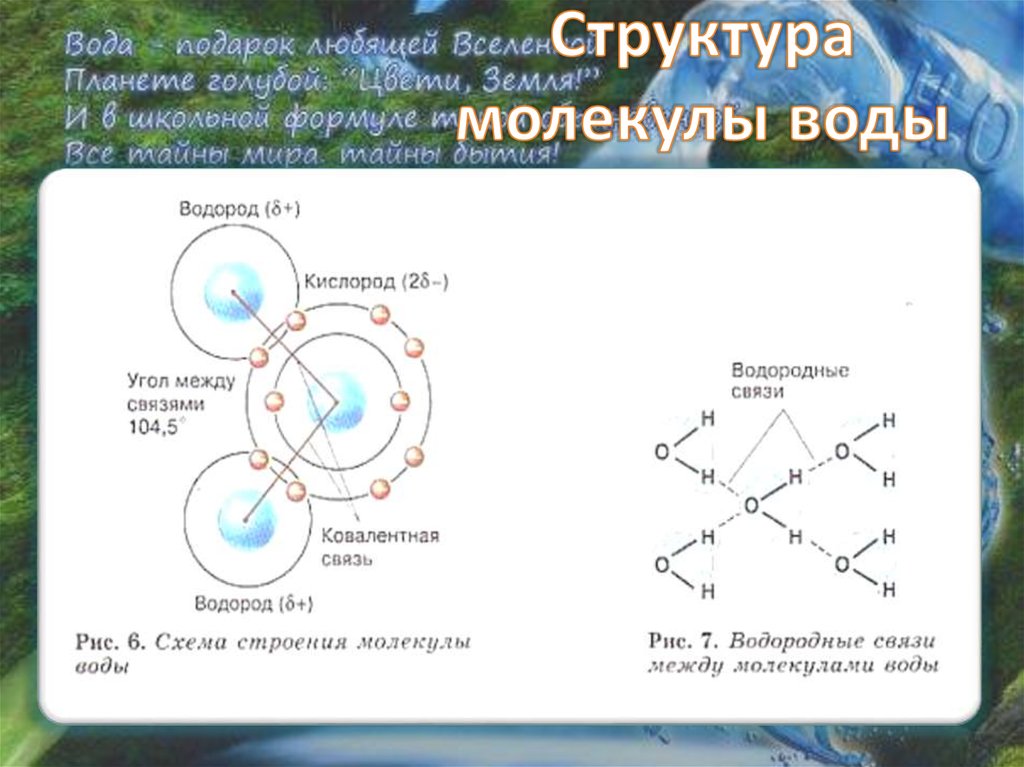 Молекулярное расположение, принятое льдом (твердая
форма молекулы воды) приводит к увеличению
в объеме и снижение плотности.
Расширение молекулы воды при замерзании позволяет
лед, чтобы плавать поверх жидкой воды.
Молекулярное расположение, принятое льдом (твердая
форма молекулы воды) приводит к увеличению
в объеме и снижение плотности.
Расширение молекулы воды при замерзании позволяет
лед, чтобы плавать поверх жидкой воды.
Рисунок
8а-2 :
Три приведенные выше диаграммы иллюстрируют различные
схемы расположения молекул воды как
они меняют свое физическое состояние со льда на воду
к газу. Молекулы замороженной воды располагаются
себя в особом высокоорганизованном жестком
геометрический узор, вызывающий массу воды
расширяться и уменьшаться в плотности. Диаграмма
выше показан срез массы льда, который
имеет ширину в одну молекулу. В жидкой фазе вода
молекулы объединяются в небольшие группы
соединенных частиц. Тот факт, что эти договоренности
маленькие позволяют жидкой воде двигаться и течь.
Молекулы воды в виде газа сильно
заряжены энергией. Это высокоэнергетическое состояние
заставляет молекулы всегда двигаться, уменьшая
вероятность связи между отдельными
молекулы от образования. Диаграмма
выше показан срез массы льда, который
имеет ширину в одну молекулу. В жидкой фазе вода
молекулы объединяются в небольшие группы
соединенных частиц. Тот факт, что эти договоренности
маленькие позволяют жидкой воде двигаться и течь.
Молекулы воды в виде газа сильно
заряжены энергией. Это высокоэнергетическое состояние
заставляет молекулы всегда двигаться, уменьшая
вероятность связи между отдельными
молекулы от образования. |
Вода обладает рядом других уникальных физических свойств. характеристики. Эти свойства:
- Вода имеет высокую удельную тепло .
 Удельная теплоемкость – это количество
энергия, необходимая для изменения температуры
вещество. Поскольку вода имеет высокую удельную
тепла, он может поглощать большое количество тепловой энергии
прежде чем он начнет нагреваться. Это также означает, что
вода медленно выделяет тепловую энергию в ситуациях
заставить его остыть. Высокая удельная теплоемкость воды
позволяет смягчать климат Земли
и помогает организмам регулировать температуру тела
более эффективно.
Удельная теплоемкость – это количество
энергия, необходимая для изменения температуры
вещество. Поскольку вода имеет высокую удельную
тепла, он может поглощать большое количество тепловой энергии
прежде чем он начнет нагреваться. Это также означает, что
вода медленно выделяет тепловую энергию в ситуациях
заставить его остыть. Высокая удельная теплоемкость воды
позволяет смягчать климат Земли
и помогает организмам регулировать температуру тела
более эффективно. - Вода в чистом виде имеет нейтральный pH .
В результате чистая вода не является ни кислой , ни основной .
Вода меняет свой pH при растворении веществ
в этом.
 Дождь имеет естественно кислый pH около 5,6.
потому что он содержит природный углекислый газ
и диоксид серы.
Дождь имеет естественно кислый pH около 5,6.
потому что он содержит природный углекислый газ
и диоксид серы. - Вода проводит тепла легче любой жидкости, кроме ртути. Этот факт вызывает большие массы жидкой воды, такие как озера и океаны иметь по существу единую вертикаль температурный профиль.
- Молекулы воды существуют в жидкой форме на протяжении важного диапазон температур от 0 до 100°С. Этот диапазон позволяет молекулам воды существовать в виде жидкости в большинстве мест на нашей планете.
- Вода универсальный растворитель .
Он способен растворять большое количество различных
химические соединения.
 Эта функция также позволяет сток , инфильтрация , подземные воды
поток и живые организмы.
Эта функция также позволяет сток , инфильтрация , подземные воды
поток и живые организмы. - Вода имеет высокую поверхность
напряжение ( Рисунки 8a-3 и 8a-4 ).
Другими словами, вода клейкая и эластичная,
и имеет тенденцию собираться в капли, а не растекаться
на поверхности в виде тонкой пленки. Этот феномен
также заставляет воду прилипать к сторонам вертикальных
структуры, несмотря на нисходящее притяжение гравитации. Вода
Высокое поверхностное натяжение позволяет образовывать
капель воды и волн, позволяет растениям
перемещать воду (и растворенные питательные вещества) из
корни к их листьям, и движение крови
через мельчайшие сосуды в телах некоторых животных.

| Рисунок 8a-3 : На следующем рисунке показано, как вода молекулы притягиваются друг к другу, создавая высокое поверхностное натяжение. Это свойство может привести к тому, что вода существовать в виде обширной тонкой пленки на твердых поверхностях. В приведенном выше примере пленка состоит из двух слоев. молекулы воды толщиной. |
Рисунок
8a-4 : Свойство адгезионного соединения
молекул воды позволяет образовать
капель воды (Фото © 2004 Edward
Цанг).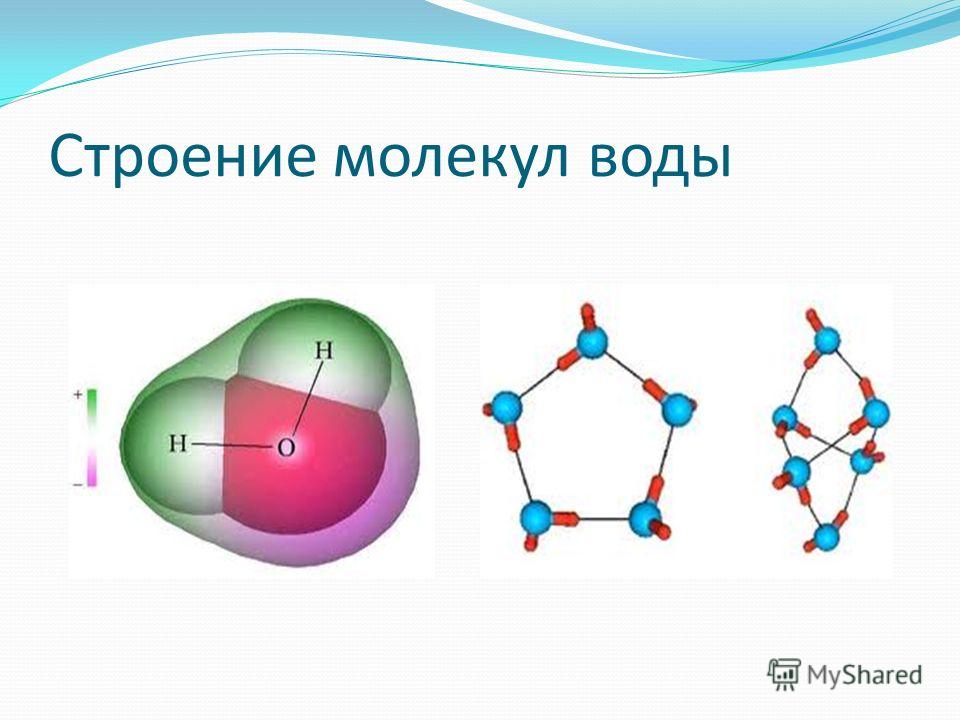 |
- Молекулы воды — единственное вещество на Земле которые существуют во всех трех физический состояния вещества : твердое , жидкое и газообразное . Включенные в изменения состояния являются массовыми количества теплообмена. Эта особенность играет важную роль в перераспределении тепловой энергии в Атмосфера Земли. По количеству передаваемого тепла в атмосферу, примерно 3/4 этого процесс происходит за счет испарения и конденсации воды.
- Замерзание молекул воды вызывает их массу
занимать больший объем. Когда вода замерзает
быстро расширяется, добавляя около 9% по объему.
 Свежий
вода имеет максимальную плотность при температуре около 4° по Цельсию
(см. Таблицу 8а-1 ).
Вода – единственное вещество на этой планете, где
максимальная плотность его массы не возникает, когда
он становится твердым.
Свежий
вода имеет максимальную плотность при температуре около 4° по Цельсию
(см. Таблицу 8а-1 ).
Вода – единственное вещество на этой планете, где
максимальная плотность его массы не возникает, когда
он становится твердым.
Таблица 8a-1: Плотность молекул воды при различных температурах.
Температура (градусы Цельсия) | Плотность (грамм на куб. сантиметр) |
0 (сплошной) | 0,9150 |
0 (жидкость) | 0,9999 |
4 | 1. |
20 | 0,9982 |
40 | 0,9922 |
60 | 0,9832 |
80 | 0,9718 |
100 (газ) | 0,0006 |
Физические и химические свойства воды
Важнейшим ресурсом, также необходимым для основного устойчивого развития человека, является вода.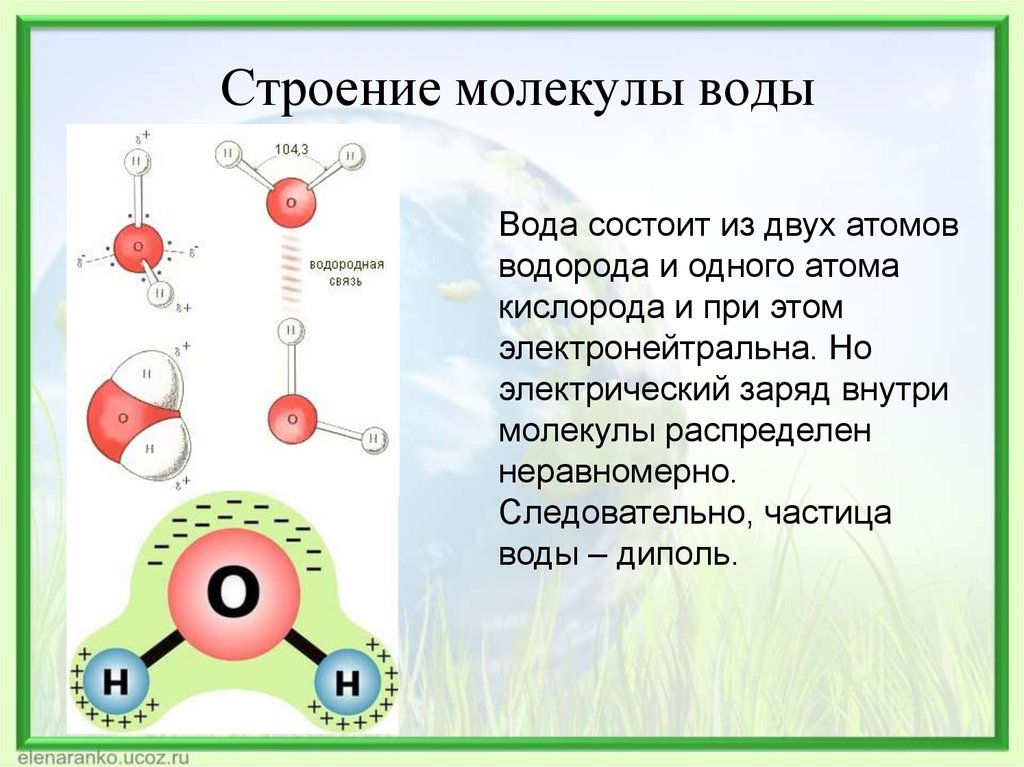 Прежде чем мы обсудим воду, давайте познакомимся с некоторыми ключевыми статистическими данными о воде. Вот некоторые из них:
Прежде чем мы обсудим воду, давайте познакомимся с некоторыми ключевыми статистическими данными о воде. Вот некоторые из них:
В среднем человек использует 101 галлон воды в день, т. е. 380 литров воды в день.
68% запасов пресной воды на Земле находится в ледниках
85% человеческого мозга состоит из воды
Что такое вода?
Вода, также известная как \[H_{2}O\], представляет собой вещество, состоящее из химических элементов водорода (\[H_{2}\]) и кислорода (\[O_{2} \]). Как полярное неорганическое соединение вода представляет собой бесцветную жидкость без вкуса и запаха. Вода, как наиболее изученное химическое соединение, известна как универсальный растворитель. Это единственное вещество, которое существует во всех трех агрегатных состояниях – твердом, жидком и газообразном.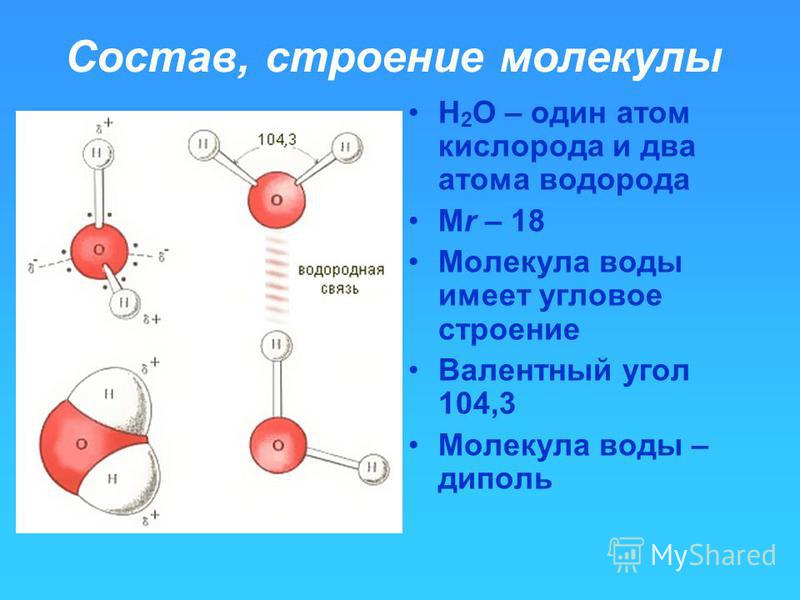 Считалось, что жизнь на Земле зародилась в водоемах мира, таких как океаны, реки, озера.
Считалось, что жизнь на Земле зародилась в водоемах мира, таких как океаны, реки, озера.
Как образуется молекула воды?
Молекула воды образуется при химической связи водорода и кислорода. Вода — лучший пример полярной ковалентной связи. Это означает химическую связь, при которой электроны неравномерно делят атомы. Каждая молекула воды ковалентно связана с двумя атомами водорода и одним атомом кислорода, реакция может быть записана следующим образом:
\[H_{2} + O_{2} \rightarrow H_{2}O \]
Какие состояния воды?
Как уже говорилось, вода — единственное вещество, которое существует во всех трех агрегатных состояниях — твердом, жидком и газообразном. Первое состояние воды в твердом состоянии — это лед. Как твердое вещество, вода доступна в виде твердого амальгамированного кристалла, называемого льдом, и рыхлого амальгамированного кристалла, называемого снегом. Наиболее часто видимым состоянием воды, которое является вторым состоянием, в атмосфере Земли является жидкость, известная как «вода».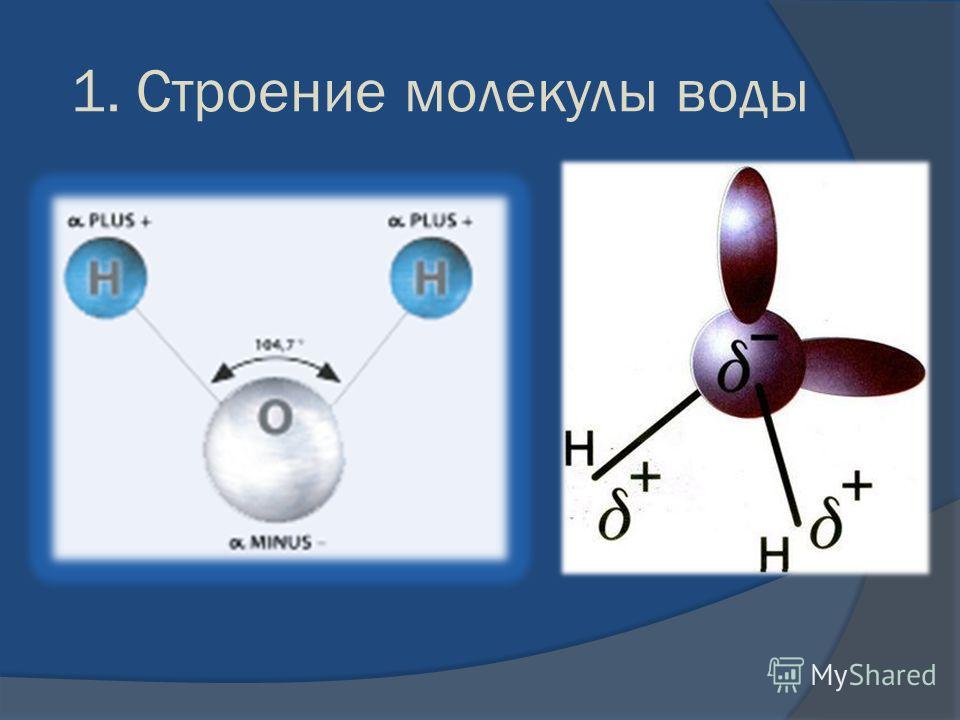 Третье состояние воды в газообразном состоянии называется водяным паром или паром. Это состояние воды, когда образуются облака — из мельчайших капелек воды, взвешенных в воздухе.
Третье состояние воды в газообразном состоянии называется водяным паром или паром. Это состояние воды, когда образуются облака — из мельчайших капелек воды, взвешенных в воздухе.
Какая связь между гидрологическим циклом и состоянием воды?
Гидрологический цикл – это общий круговорот в природе, при котором поток воды регулируется в различных состояниях воды, что делает его переносимым для всех форм жизни на Земле. Это усиливается за счет наличия воды во всех штатах. Кроме того, процесс испарения, осаждения и конденсации облегчает транспортировку воды по разным формам рельефа.
Жидкое состояние воды из водоемов – океанов, рек, озер и т.д. переходит в газообразное состояние, называемое водяным паром, в результате процесса испарения. Далее вода конденсируется вместе, образуя крошечные капельки водяного пара, называемые облаками. Кроме того, облака осаждаются в виде воды в жидком состоянии, известной как дождь. Эта вода в жидком состоянии используется формами жизни для различных целей, а оставшаяся вода собирается обратно в водоемы.
Каковы свойства воды?
Свойства соединения – вода можно разделить на:
Давайте продолжим и сосредоточимся на физических и химических свойствах воды:
Физические свойства воды
Внешний вид: Как вы уже знаете, вода бесцветная жидкость без запаха и вкуса в естественном состоянии. Кристаллическая структура воды шестиугольная.
Температура кипения воды: Температура кипения определяется как температура, при которой давление паров жидкости равно давлению, окружающему жидкость, и, таким образом, жидкость превращается в пар. Нам известно, что температура кипения воды равна 100°С.
Температура замерзания воды: Температура замерзания – это температура, при которой вещество переходит из жидкого состояния в твердое.
 Итак, для воды точка, в которой вода из жидкого состояния превращается в лед в твердом состоянии, является точкой замерзания воды, которая составляет 0°C или 32°F.
Итак, для воды точка, в которой вода из жидкого состояния превращается в лед в твердом состоянии, является точкой замерзания воды, которая составляет 0°C или 32°F.Удельная теплоемкость: Вода имеет высокую удельную теплоемкость 4,2 Дж на грамм при 25°C. Это связано с обширными водородными связями между молекулами воды.
Плотность воды: Плотность воды составляет около 1 г/куб. см и изменяется в зависимости от температуры необычным образом. Плотность воды в разных состояниях – твердом и жидком. В твердом состоянии плотность составляет 0,9 г/см3.
Вязкость воды: Вязкость определяется сопротивлением деформации при заданной скорости. Другими словами, густота жидкости — например, сиропа и воды. Вязкость воды составляет 0,89 сП (сантипуаз).
Поверхностное натяжение воды: Поверхностное натяжение – это тенденция жидкости сжиматься на минимальной площади поверхности.
 Вода имеет высокое поверхностное натяжение 72 мН/м при 25°C. Из-за высокого поверхностного натяжения воды насекомые могут ходить по поверхности воды без какого-либо дискомфорта.
Вода имеет высокое поверхностное натяжение 72 мН/м при 25°C. Из-за высокого поверхностного натяжения воды насекомые могут ходить по поверхности воды без какого-либо дискомфорта.Показатель преломления воды: Проще говоря, показатель преломления — это число, которое описывает, как быстро свет достигает материала. Показатель преломления воды составляет 1,333 при 20°С.
Сжимаемость воды: Сжимаемость определяется как функция температуры и давления и их влияние на вещество. Для воды сжимаемость при 0°C составляет \[5,1 \times 10 — 10 Pa — 1\], а до 45°C она снижается до \[ 4,4 \times 10 — 10 Pa — 1\]. По мере увеличения давления сжимаемость еще больше снижается.
Диэлектрическая проницаемость воды: Диэлектрическая проницаемость является мерой того, насколько легко материал поляризуется электрическим полем.
 Диэлектрическая проницаемость воды очень высока и составляет 78,6. Эта константа играет очень важную роль в воде, являющейся универсальным растворителем.
Диэлектрическая проницаемость воды очень высока и составляет 78,6. Эта константа играет очень важную роль в воде, являющейся универсальным растворителем.
Химические свойства воды
Химическая формула: Химическая формула воды \[H_{2}O\]. Как было описано ранее, молекула воды образована ковалентной связью атомов водорода и кислорода.
Амфотерность воды: Амфотерность — одно из важнейших свойств воды. Амфотерность означает способность вещества действовать как кислота или основание. Вода в естественном состоянии не является ни кислой, ни щелочной. Основная причина заключается в его способности отдавать и принимать протоны. Однако дождевая вода слабокислая, с pH от 5,2 до 5,8.
Растворимость воды: Вода считается универсальным растворителем. Это связано с химическим составом и физическими свойствами, а также с его высокой диэлектрической проницаемостью, что делает его наиболее растворимым веществом. Наличие положительных и отрицательных зарядов у водорода и кислорода соответственно позволяет ему притягиваться к другим молекулам соединений, нарушая их молекулярные силы и позволяя им распадаться и растворяться.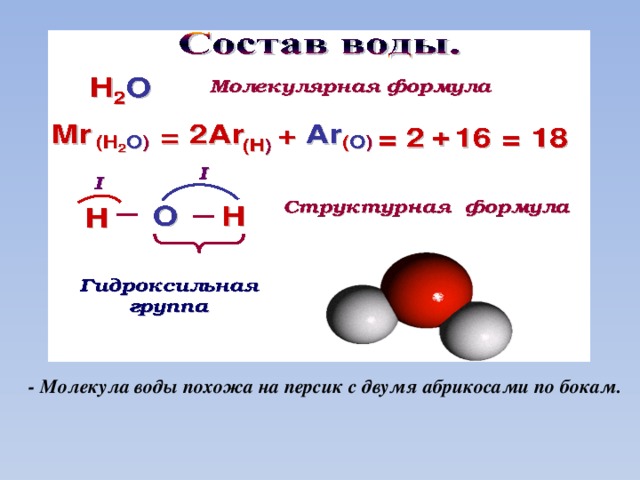
Химическое соединение, состоящее из двух атомов водорода и одного атома кислорода, известно как вода. Воду обычно называют жидким состоянием этого соединения, твердую фазу называют льдом, а газ называют паром. Сверхкритический флюид также образуется водой при особых условиях. В химии формула воды — \[H_{2}O\].
Формула воды
\[H_{2}O\] — это химическая формула воды, состоящей из двух элементов: водорода и кислорода. Чтобы образовалась вода, две молекулы водорода соединяются с одной молекулой кислорода. Вода также известна как универсальный растворитель, что указывает на то, что она обладает свойством растворять многие вещества.
Физические свойства воды
Некоторые из физических свойств воды:
Молекулы воды имеют водородные связи между собой.
Температура кипения и плавления воды составляет 100° и 0°C соответственно.

Вода может иметь три состояния: твердое, жидкое и газообразное.
Вода имеет полярную природу, из-за которой она может растворять почти все вещества, поэтому ее называют универсальным растворителем.
В твердом состоянии вода имеет кристаллическую структуру, которая представляет собой клетку в виде трехмерной структуры. Кристаллическая структура воды имеет много пустот, из-за которых плотность льда меньше, чем у воды, и, следовательно, он может плавать на воде.
Известно, что плотность воды составляет 0,99 г/мл при 4°C.
Физические свойства воды{-}\]
Гидролиз. Диэлектрическая проницаемость воды очень высока, что означает сильную склонность воды к гидратации.
 При наличии вокруг себя гидратных оболочек вода вступает в сильные реакции с ионами солей.
При наличии вокруг себя гидратных оболочек вода вступает в сильные реакции с ионами солей.
\[SiCl_{4} + 2H{2}O \rightarrow SiO_{2} 4HCl \]
Окислительно-восстановительные реакции — Диводород можно получить с помощью воды, поскольку он является отличным источником и может быть восстановлен при реагирует с высоко электроположительным металлом, таким как натрий.
\[H_{2}O + Na \rightarrow 2NaOH + H_{2}\]
Свойства воды: объяснение, когезия и адгезия
Знаете ли вы, что вода – это единственное вещество на Земле, которое естественным все три состояния вещества? Несмотря на то, что вода не имеет запаха, вкуса и не имеет калорийности, она необходима для жизни, и мы не можем жить без нее. Он играет роль в фотосинтезе и дыхании, растворяет многие растворенные вещества в организме, обеспечивает сотни химических реакций и необходим для метаболизма и функции ферментов.
Однако это тоже необычная молекула. Несмотря на свой небольшой размер, он имеет странно высокие температуры плавления и кипения и образует прочные связи со многими другими молекулами, включая саму себя. В этой статье мы рассмотрим, почему это так, наряду с некоторыми другими свойствами воды .
- Эта статья представляет собой сфокусированный на химии обзор свойств воды .
- Начнем со структуры воды.
- Затем мы увидим, как это соотносится с его физическими свойствами, включая когезия , адгезия и поверхностное натяжение .
- Мы также исследуем воду с высокой удельной теплоемкостью и температурами плавления и кипения .
- После этого мы рассмотрим почему лед менее плотный, чем вода и почему воду часто называют универсальным растворителем .
- Наконец, мы исследуем некоторые химические свойства воды: то, как она самоионизируется , и ее амфотерная природа .

Структура воды
Официальное название воды: монооксид дигидрогена . Более внимательное изучение этого имени дает нам представление о его структуре. -водород говорит нам, что он содержит атомы водорода, а ди- указывает на то, что их два. -оксид относится к атомам кислорода, а моно- говорит нам, что он имеет только один. Соедините все это вместе, и у нас останется вода: H 2 O. Вот она, показанная ниже:
Молекула воды. Анна Брюэр, StudySmarter Originals
Вода состоит из двух атомов водорода, соединенных с центральным атомом кислорода одинарными ковалентными связями . Атом кислорода имеет две неподеленных пары электронов . Они плотно сжимают две ковалентные связи, уменьшая валентный угол до 104,5° и превращая воду в молекулу v-образной формы .
Валентный угол в воде. Анна Брюэр, StudySmarter Originals
Для получения дополнительной информации о различных формах молекул и влиянии неподеленных пар электронов на валентные углы см.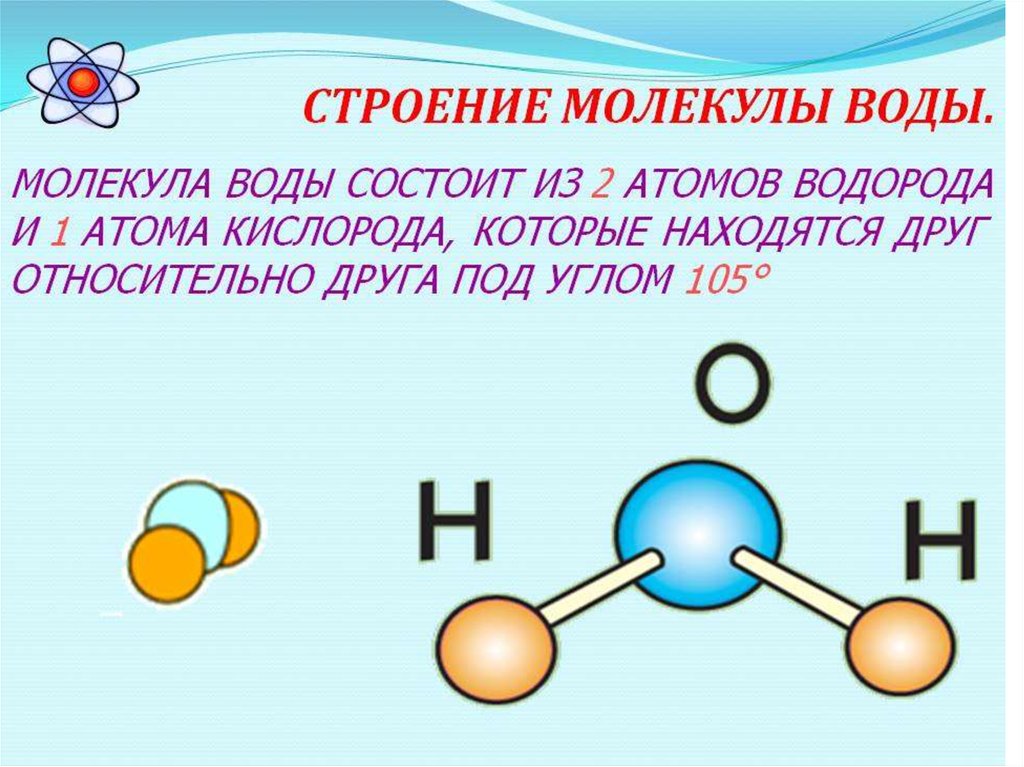 Формы молекул .
Формы молекул .
Связь в воде
Давайте теперь посмотрим, как структура воды влияет на ее связь.
Водородные связи являются типом межмолекулярной силы . Они возникают из-за разницы в электроотрицательности между водородом и чрезвычайно электроотрицательным атомом, таким как кислород.
Электроотрицательность — это способность атома притягивать связанную пару электронов. Это приводит к тому, что связывающие электроны находятся ближе к одному атому в ковалентной связи, чем к другому.
Если вы еще этого не сделали, рекомендуем прочитать Межмолекулярные силы . Он объяснит некоторые концепции, которые мы упоминаем здесь, более подробно.
Как известно, вода содержит два атома водорода, связанных с центральным атомом кислорода ковалентной связью . Благодаря этому вы обнаружите водородных связей между соседними молекулами воды.
В случае воды кислород намного более электроотрицательный, чем водород. Это означает, что кислород притягивает связанную пару электронов, обнаруженную в каждой из связей кислород-водород, к себе и от водорода. Водород становится электрон-дефицитный , и мы говорим, что в целом молекула полярная .
Поскольку электроны имеют отрицательный заряд, кислород теперь слегка заряжен отрицательно, а водород слегка заряжен положительно. Мы представляем эти частичные заряды дельта-символом , δ .
Полярность воды. Анна Брюэр, StudySmarter Original
Но как это приводит к образованию водородных связей? Ну, водород — это маленький атом. Фактически, это самый маленький атом во всей таблице Менделеева! Это означает, что его частичный положительный заряд плотно упакован в одно крошечное пространство. Мы говорим, что он имеет высокая плотность заряда . Поскольку он настолько положительно заряжен, его особенно притягивают отрицательно заряженные частицы, такие как другие электроны.
Что мы знаем об атоме кислорода в воде? Он содержит две неподеленные пары электронов! Это означает, что атомы водорода в молекулах воды притягиваются к неподеленным парам электронов в атомах кислорода в других молекулах воды.
Притяжение между плотно заряженным атомом водорода и неподеленной парой электронов кислорода известно как водородная связь .
Водородная связь между молекулами воды. Анна Брюэр, StudySmarter Original
Подводя итог, мы обнаруживаем водородные связи, когда у нас есть атом водорода , ковалентно связанный с чрезвычайно электроотрицательным атомом с неподеленной парой электронов . Атом водорода становится электронодефицитным и притягивается к неподеленной паре электронов другого атома. Это водородная связь .
Только некоторые элементы обладают достаточной электроотрицательностью для образования водородных связей. Этими элементами являются кислород, азот и фтор. Хлор также теоретически достаточно электроотрицателен, но не образует водородных связей. Это потому, что это более крупный атом, и отрицательный заряд его неподеленных пар электронов распределен по большей площади. Плотность заряда недостаточно велика, чтобы должным образом притянуть частично заряженный атом водорода, поэтому он не образует водородных связей. Однако хлор испытывает постоянные диполь-дипольные силы.
Это потому, что это более крупный атом, и отрицательный заряд его неподеленных пар электронов распределен по большей площади. Плотность заряда недостаточно велика, чтобы должным образом притянуть частично заряженный атом водорода, поэтому он не образует водородных связей. Однако хлор испытывает постоянные диполь-дипольные силы.
Еще одно напоминание — мы более подробно рассмотрим эту тему в Межмолекулярные силы .
Физические свойства воды
Теперь, когда мы рассмотрели структуру и связь воды, мы можем исследовать, как это влияет на ее физические свойства. В следующем разделе мы рассмотрим следующие свойства:
- Когезия
- Адгезия
- Поверхностное натяжение
- Удельная теплоемкость
- Температура плавления и кипения
- Плотность
- Способность растворять
Когезионные свойства воды
Когезия — это способность частиц вещества прилипать друг к другу.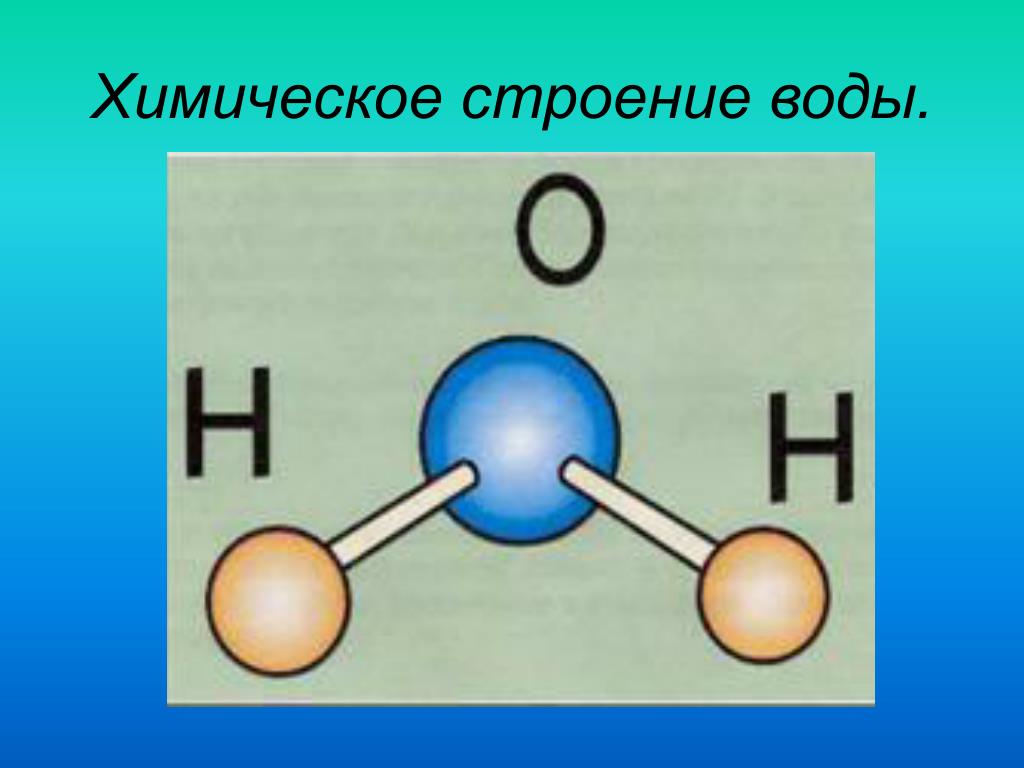
Если вы плеснете небольшое количество воды на поверхность, вы заметите, что она образует капли. Это пример сплоченности . Вместо того, чтобы распространяться равномерно, молекулы воды прилипают друг к другу в виде кластеров. Это связано с водородными связями между соседними молекулами воды.
Адгезионные свойства воды
Адгезия — это способность частиц одного вещества прилипать к другому веществу.
Когда вы наливаете воду в пробирку, вы заметите, что вода поднимается по краям сосуда. Он образует так называемый мениск . Когда вы измеряете объем воды, вы должны измерять от нижней части мениска, чтобы ваши измерения были полностью точными. это пример адгезия . Это происходит, когда вода образует водородные связи с другим веществом, например со стенками пробирки в данном случае.
Мениск. Изображение предоставлено: commons.wikimedia.org
Не путайте сплоченность и адгезию.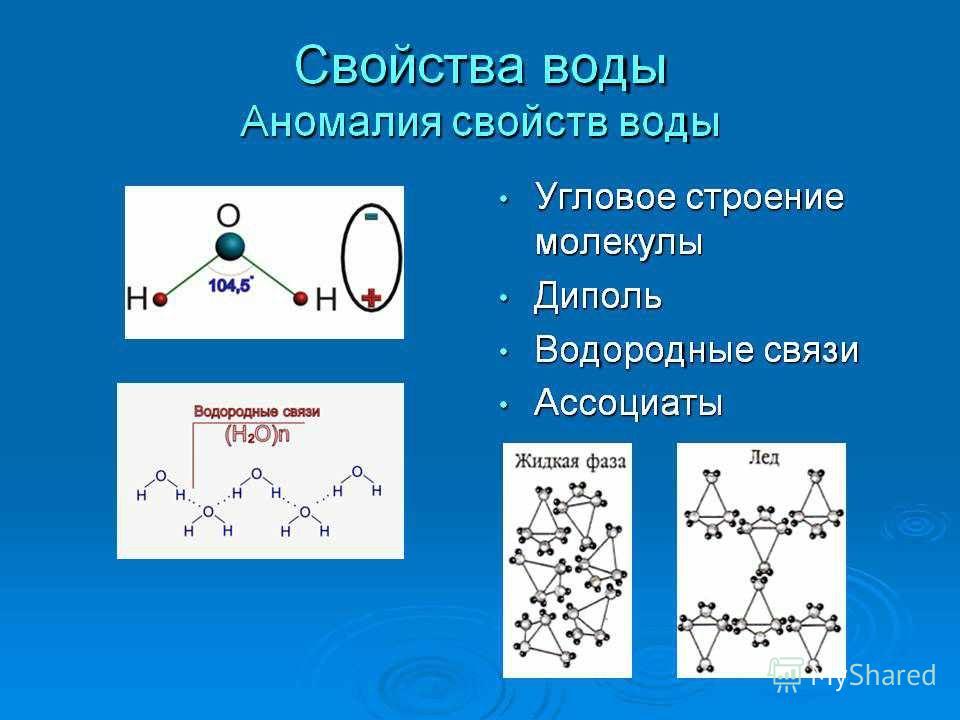 Когезия — это способность вещества прилипать к самому себе, тогда как адгезия — это способность вещества прилипать к другому веществу.
Когезия — это способность вещества прилипать к самому себе, тогда как адгезия — это способность вещества прилипать к другому веществу.
Поверхностное натяжение воды
Вы когда-нибудь задумывались, как насекомые могут ходить по поверхности луж и озер? Это из-за поверхностное натяжение .
Поверхностное натяжение описывает то, как молекулы на поверхности жидкости действуют как эластичный лист и пытаются занять наименьшую возможную площадь поверхности.
Это место, где частицы на поверхности жидкости сильно притягиваются к другим частицам в жидкости. Эти внешние частицы втягиваются в объем жидкости, заставляя жидкость принимать форму с наименьшей возможной площадью поверхности. Благодаря этому притяжению поверхность жидкости способна противостоять внешним силам, например весу насекомого. Вода имеет особенно высокое поверхностное натяжение из-за водородных связей между его молекулами. Это еще один пример связной природы воды.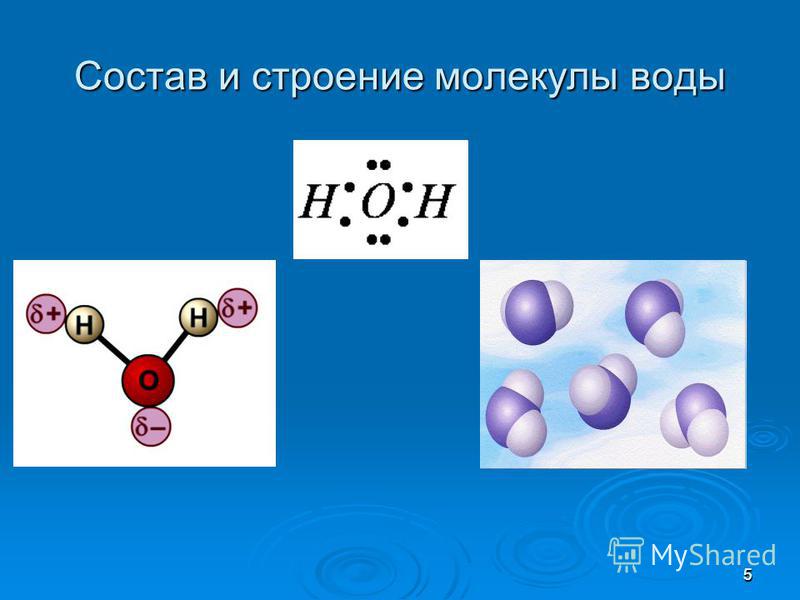
Удельная теплоемкость воды
Удельная теплоемкость — это энергия, необходимая для повышения температуры одного грамма вещества на один градус Кельвина или один градус Цельсия.
Помните, что изменение на один градус Кельвина равносильно изменению на один градус Цельсия.
Изменение температуры вещества связано с разрывом некоторых связей внутри него. Водородные связи между молекулами воды очень прочны, поэтому для их разрыва требуется много энергии. Это означает, что вода имеет высокая удельная теплоемкость .
Высокая удельная теплоемкость воды означает, что она дает много преимуществ живым организмам, поскольку вода устойчива к экстремальным колебаниям температуры. Это помогает им поддерживать постоянную внутреннюю температуру, оптимизируя активность ферментов.
Точки плавления и кипения воды
Вода имеет высокие температуры плавления и кипения из-за сильных водородных связей между ее молекулами, для преодоления которых требуется много энергии.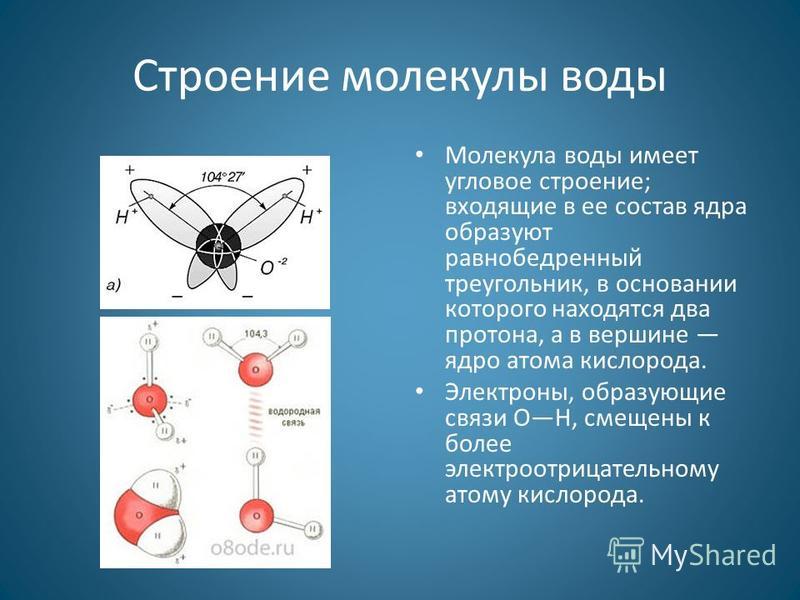 Это становится очевидным, когда вы сравниваете воду с молекулами аналогичного размера, которые не имеют водородных связей. Например, метан (СН 4 ) имеет молекулярную массу 16 и температуру кипения -161,5 ℃, в то время как вода имеет аналогичную молекулярную массу 18, но гораздо более высокую температуру кипения — ровно 100,0 ℃!
Это становится очевидным, когда вы сравниваете воду с молекулами аналогичного размера, которые не имеют водородных связей. Например, метан (СН 4 ) имеет молекулярную массу 16 и температуру кипения -161,5 ℃, в то время как вода имеет аналогичную молекулярную массу 18, но гораздо более высокую температуру кипения — ровно 100,0 ℃!
Плотность воды
Возможно, вы знаете, что большинство твердых тел плотнее соответствующих им жидкостей. А вот с водой немного необычно — все наоборот. Твердый лед намного менее плотный, чем жидкая вода , поэтому айсберги плавают на поверхности моря, а не тонут на дне океана. Чтобы понять почему, нам нужно более внимательно изучить структуру воды в двух состояниях.
Жидкая вода
В жидкости молекулы воды постоянно движутся . Это означает, что водородные связи между молекулами постоянно разрываются и снова восстанавливаются. Некоторые молекулы воды расположены очень близко друг к другу, а другие далеко друг от друга.
Твердый лед
В твердом состоянии молекулы воды зафиксированы в положении . Каждая молекула воды связана с четырьмя соседними молекулами воды водородными связями, удерживая ее в решетчатой структуре. Четыре водородные связи означают, что молекулы воды удерживаются на фиксированном расстоянии друг от друга. На самом деле, в этом твердом состоянии они находятся дальше друг от друга, чем в жидкой форме. Это делает твердый лед менее плотным, чем жидкая вода.
Ледяная решетка. Изображение предоставлено: commons.wikimedia.org
Вода как растворитель
Последнее физическое свойство, которое мы сегодня рассмотрим, — это способность воды выступать в качестве растворителя .
Растворитель — это вещество, которое растворяет второе вещество, называемое растворенным веществом , с образованием раствора .
Воду часто называют универсальным растворителем .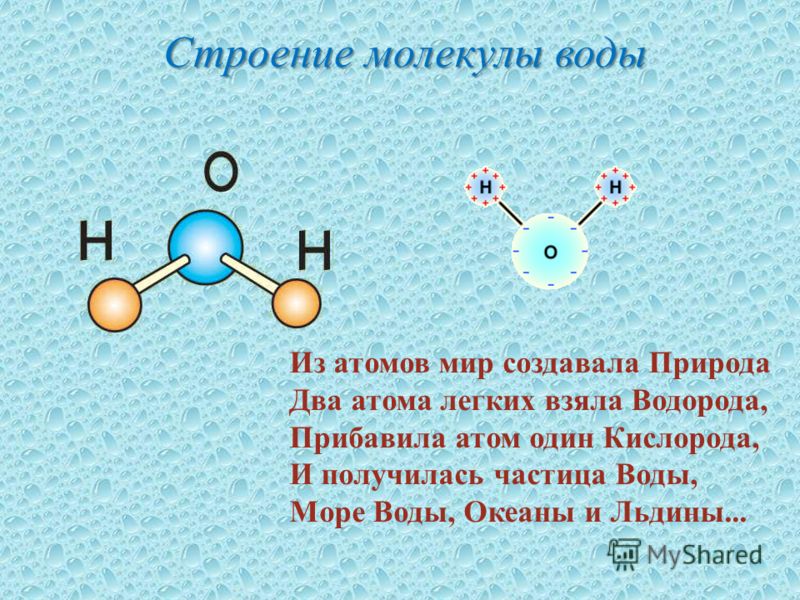 Это потому, что он может растворять широкий спектр различных веществ. На самом деле почти все полярные вещества растворяются в воде . Это потому, что молекулы воды также полярны. Вещества растворяются, когда притяжение между ними и растворителем сильнее, чем притяжение между молекулой растворителя и молекулой растворителя, молекулой растворенного вещества и молекулой растворенного вещества.
Это потому, что он может растворять широкий спектр различных веществ. На самом деле почти все полярные вещества растворяются в воде . Это потому, что молекулы воды также полярны. Вещества растворяются, когда притяжение между ними и растворителем сильнее, чем притяжение между молекулой растворителя и молекулой растворителя, молекулой растворенного вещества и молекулой растворенного вещества.
В случае воды отрицательный атом кислорода притягивается к любым положительно заряженным молекулам растворенного вещества, а положительные атомы водорода притягиваются к любым отрицательно заряженным молекулам растворенного вещества. Это притяжение сильнее, чем силы, удерживающие растворенное вещество вместе, поэтому растворенное вещество растворяется.
Химические свойства воды
Все идеи, которые мы исследовали выше, были примерами физических свойств . Это свойства, которые можно наблюдать и измерять без изменения химического состава вещества. Например, молекулы воды в паре имеют точно такую же химическую идентичность, что и молекулы воды во льду, с той лишь разницей, что они состоят из вещества. Однако химические свойства — это свойства, которые мы наблюдаем, когда вещество подвергается химической реакции. В частности, мы собираемся сосредоточиться на двух химических свойствах воды.
Например, молекулы воды в паре имеют точно такую же химическую идентичность, что и молекулы воды во льду, с той лишь разницей, что они состоят из вещества. Однако химические свойства — это свойства, которые мы наблюдаем, когда вещество подвергается химической реакции. В частности, мы собираемся сосредоточиться на двух химических свойствах воды.
- Способность к самоионизации
- Амфотерность
Самоионизация воды
Как жидкость вода существует в равновесии . Большинство его молекул находятся в виде нейтральных молекул H 2 O, но некоторые ионизируются в ионы гидроксония, H 3 O + , и ионы гидроксида, OH — . Молекулы постоянно переключаются между этими двумя состояниями вперед и назад, как показано в приведенном ниже уравнении:
2H 2 O ⇋ H 3 O + + OH —
Это известно как самоионизация . Вода делает это сама по себе — ей не нужно другое вещество для реакции.
Вода делает это сама по себе — ей не нужно другое вещество для реакции.
Амфотерная природа воды
Поскольку вода самоионизируется, как мы видели выше, она может действовать амфотерно .
Амфотерное вещество может действовать как кислота и как основание.
Помните, что кислота является донором протонов, тогда как основание является акцептором протонов. Протон — это просто ион водорода, H + .
Как это делает вода? Что ж, посмотрите на ионы, которые он образует при самоионизации: H 3 O + и OH — . Ион гидроксония, H 3 O + , может действовать как кислота, теряя протон с образованием H 2 O и H + . Ион гидроксида, OH — , может действовать как основание, принимая протон, снова образуя H 2 O.
H 3 o + → H 2 O + H +
OH — + H + → H 2 O + → H 2 O
9 9001S ANSARS ANSARS.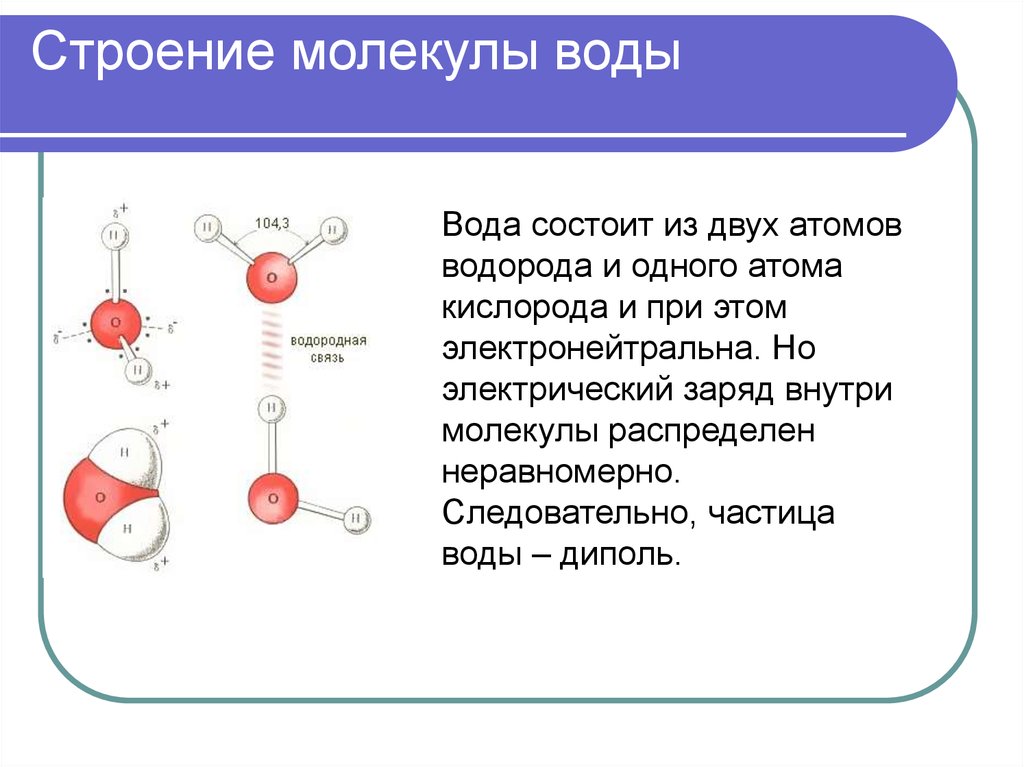


 Удельная теплоемкость – это количество
энергия, необходимая для изменения температуры
вещество. Поскольку вода имеет высокую удельную
тепла, он может поглощать большое количество тепловой энергии
прежде чем он начнет нагреваться. Это также означает, что
вода медленно выделяет тепловую энергию в ситуациях
заставить его остыть. Высокая удельная теплоемкость воды
позволяет смягчать климат Земли
и помогает организмам регулировать температуру тела
более эффективно.
Удельная теплоемкость – это количество
энергия, необходимая для изменения температуры
вещество. Поскольку вода имеет высокую удельную
тепла, он может поглощать большое количество тепловой энергии
прежде чем он начнет нагреваться. Это также означает, что
вода медленно выделяет тепловую энергию в ситуациях
заставить его остыть. Высокая удельная теплоемкость воды
позволяет смягчать климат Земли
и помогает организмам регулировать температуру тела
более эффективно.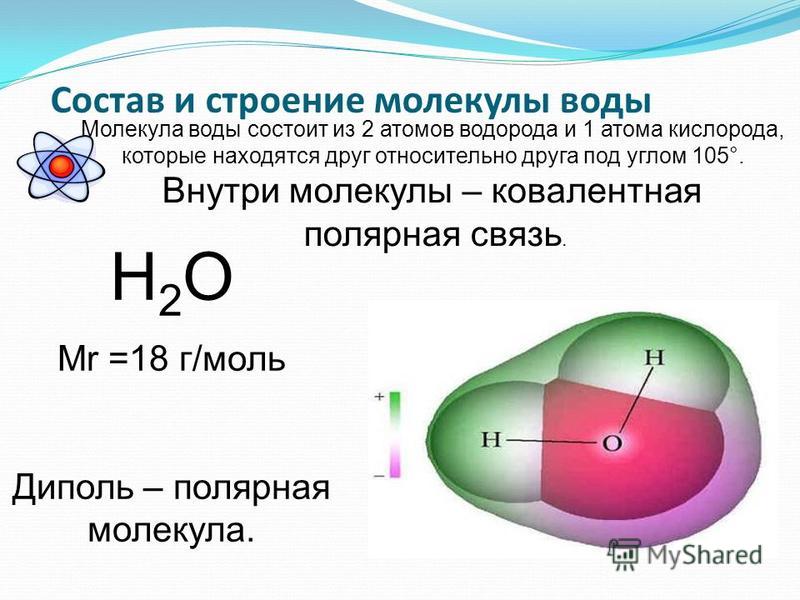 Дождь имеет естественно кислый pH около 5,6.
потому что он содержит природный углекислый газ
и диоксид серы.
Дождь имеет естественно кислый pH около 5,6.
потому что он содержит природный углекислый газ
и диоксид серы.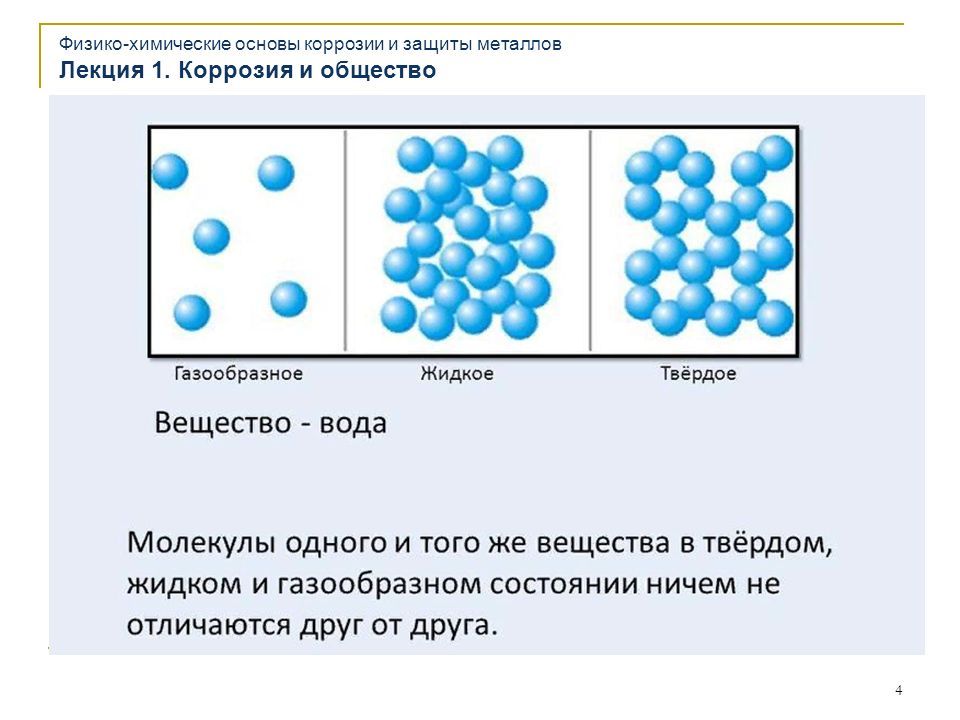 Эта функция также позволяет сток , инфильтрация , подземные воды
поток и живые организмы.
Эта функция также позволяет сток , инфильтрация , подземные воды
поток и живые организмы.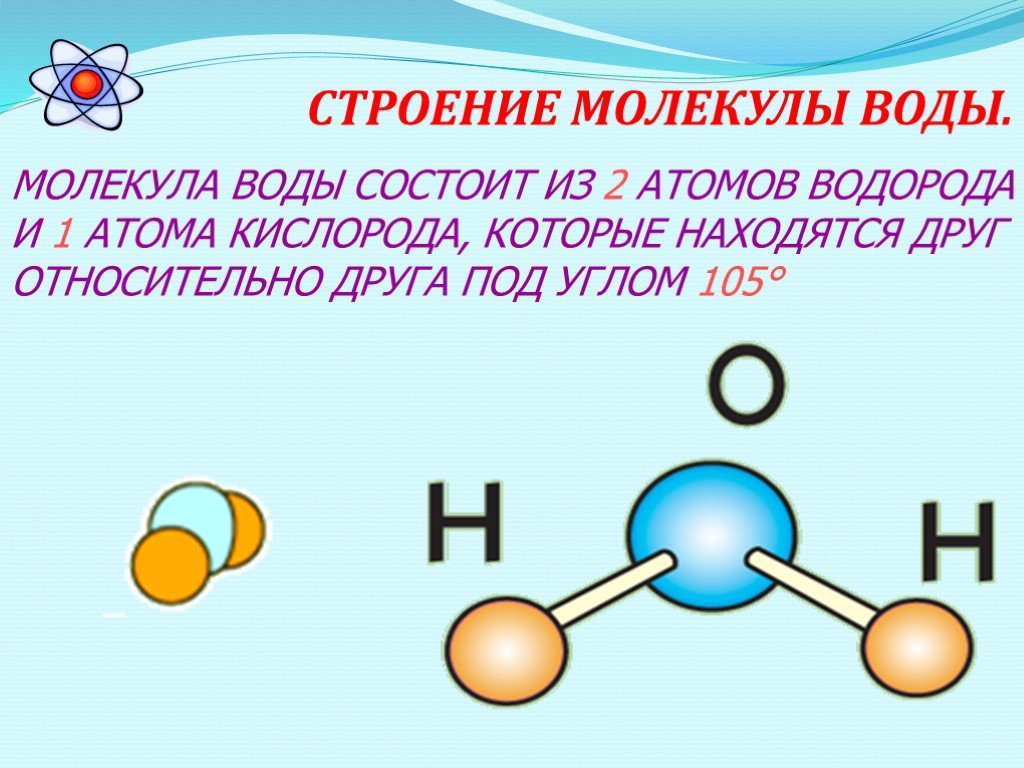
 Свежий
вода имеет максимальную плотность при температуре около 4° по Цельсию
(см. Таблицу 8а-1 ).
Вода – единственное вещество на этой планете, где
максимальная плотность его массы не возникает, когда
он становится твердым.
Свежий
вода имеет максимальную плотность при температуре около 4° по Цельсию
(см. Таблицу 8а-1 ).
Вода – единственное вещество на этой планете, где
максимальная плотность его массы не возникает, когда
он становится твердым. 0000
0000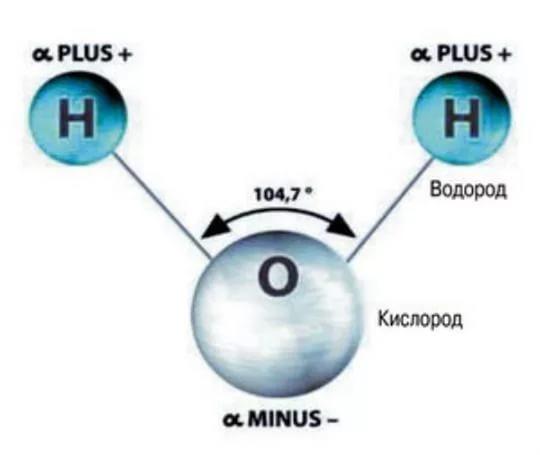 Итак, для воды точка, в которой вода из жидкого состояния превращается в лед в твердом состоянии, является точкой замерзания воды, которая составляет 0°C или 32°F.
Итак, для воды точка, в которой вода из жидкого состояния превращается в лед в твердом состоянии, является точкой замерзания воды, которая составляет 0°C или 32°F. Вода имеет высокое поверхностное натяжение 72 мН/м при 25°C. Из-за высокого поверхностного натяжения воды насекомые могут ходить по поверхности воды без какого-либо дискомфорта.
Вода имеет высокое поверхностное натяжение 72 мН/м при 25°C. Из-за высокого поверхностного натяжения воды насекомые могут ходить по поверхности воды без какого-либо дискомфорта. Диэлектрическая проницаемость воды очень высока и составляет 78,6. Эта константа играет очень важную роль в воде, являющейся универсальным растворителем.
Диэлектрическая проницаемость воды очень высока и составляет 78,6. Эта константа играет очень важную роль в воде, являющейся универсальным растворителем.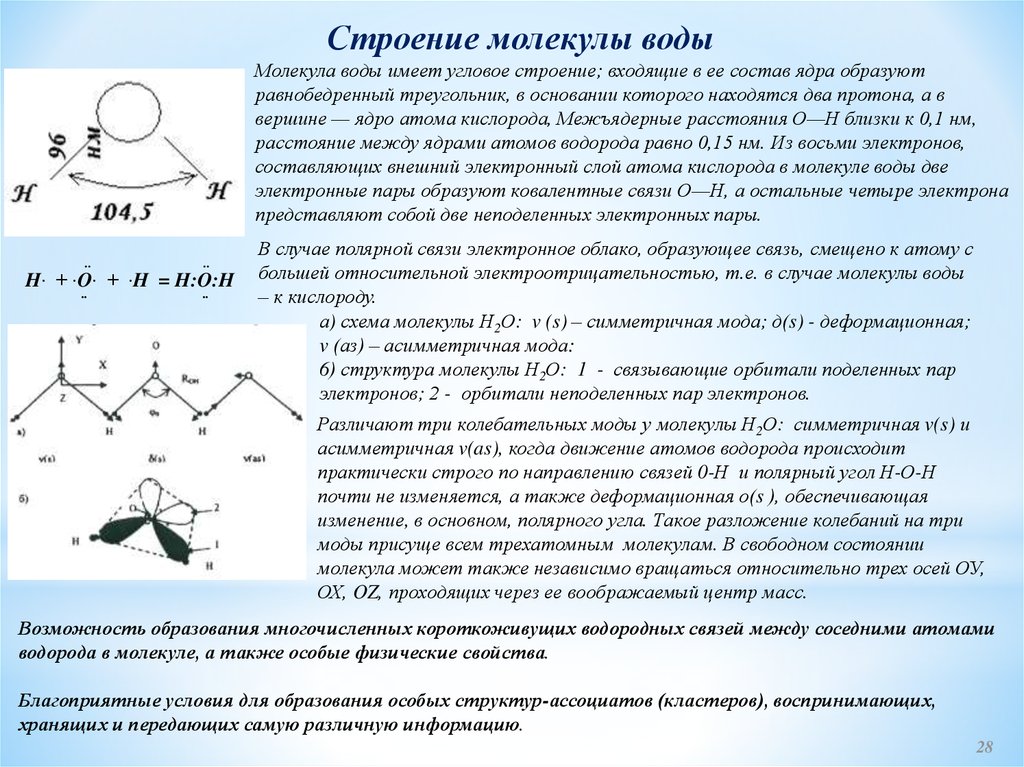
 При наличии вокруг себя гидратных оболочек вода вступает в сильные реакции с ионами солей.
При наличии вокруг себя гидратных оболочек вода вступает в сильные реакции с ионами солей.