Вода, её состав, строение молекулы, физические и химические свойства… на Сёзнайке.ру
Вода, её состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция, серы(IV)). Основные загрязнители природной воды, очистка природных и сточных вод.
В состав молекулы воды входят два атома водорода и один атом кислорода, атомы связаны ковалентной полярной связью, валентный угол составляет 104,5о. Говорят, молекула воды является диполем. Н · + · О · + · Н ® Н ·· О ·· Н.
Вода – бесцветная летучая жидкость, в толстом слое – голубая, без запаха, плотность – 1г/см3(при 40С), tпл. = 00С, tкип. = 1000С. вода является хорошим растворителем.
Химические свойства:
При пропускании через подкисленный раствор электрического тока вода разлагается на простые вещества: кислород и водород: 2Н2О ? 2Н2 + О2.
Вода вступает во взаимодействие со щелочными и щелочноземельными металлами при обычных условиях, при этом в молекуле воды один атом водорода замещается на атом металла и образуются щёлочь и водород. Реакция протекает с выделением большого количества теплоты. 2Na + 2H2O = 2NaOH + H2
При взаимодействии основных оксидов с водой образуется щёлочь. Например, при взаимодействии оксида кальция (негашёной извести) с водой образуется гидроксид кальция (гашёная известь): CaO + H2O = Ca(OH)2.
Кислотные оксиды растворяются в воде с образованием кислот, например, оксид серы(IV) при растворении в воде образует сернистую кислоту: SO2
Загрязнителями природных вод являются ядовитые отходы, которые в течение многих лет захоранивались в шахтах и скважинах и продолжают захораниваться сейчас, подземные хранилища нефти и продуктов её переработки, пестициды, применяемые в сельском хозяйстве. Главным и постоянным загрязнителем природных вод являются сточные воды, которые текут из городов, с заводов, шахт, сельских ферм. Они образуются разными путями, но в общем-то у все у них один и тот же путь – в ближайшую реку или озеро или море.
Органические загрязнители из сточных вод способны вызвать цепную реакцию, которая лишает воду нормального содержания кислорода, быть ядовитыми для организмов, живущих в воде и способствовать развитию менее желательных видов и захвату ими господствующего положения.
Очистка природных вод (для бытовых нужд).
В 1872 году было обнаружено, что фильтрование воды через слой песка является хорошим способом её очистки и делает её относительно безопасной для питья. Песчаные фильтры также эффективны для удаления из воды болезнетворных микроорганизмов (холеры, брюшного тифа, дизентерии). Уже в начале 20-го века в практику было введено химическое «обеззараживание» воды посредством хлора или его соединений. При очистке природных вод используют аэрацию (для удаления запаха), активированный уголь(для обесцвечивания воды и улучшения её вкуса), алюминиевые и железные квасцы (для удаления взвешенных в воде частиц), фильтрование через песчаный фильтр (для удаления из воды бактерий, вирусов и других микроорганизмов),
Физические и химические свойства воды
Формула – H2O. Молярная масса – 18 г/моль. Может существовать в трех агрегатных состояниях – жидком (вода), твердом (лед) и газообразном (водяной пар).
Химические свойства воды
Вода – наиболее распространенный растворитель. В растворе воды существует равновесие, поэтому воду называют амфолитом:
H2O ↔ H+ + OH— ↔ H3O+ + OH—.
Под действием электрического тока вода разлагается на водород и кислород:
H2O = H2 + O2.
При комнатной температуре вода растворяет активные металлы с образованием щелочей, при этом также происходит выделение водорода:
2H2O + 2Na = 2NaOH + H2↑.
Вода способна взаимодействовать с фтором и межгалоидными соединениями, причем во втором случае реакция протекает при пониженных температурах:
2H2O + 2F2 = 4HF + O2↑.
3H2O +IF5
Соли, образованные слабым основанием и слабой кислотой, подвергаются гидролизу при растворении в воде:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑.
Вода способна растворять некоторые вещества металлы и неметаллы при нагревании:
4H2O + 3Fe = Fe3O4 + 4H2↑;
H2O + C ↔ CO + H2.
Вода, в присутствии серной кислоты, вступает в реакции взаимодействия (гидратации) с непредельными углеводородами – алкенами с образованием предельных одноатомных спиртов:
CH2 = CH2 + H2O → CH3-CH2-OH.
Физические свойства воды
Вода – прозрачная жидкость (н.у.). Дипольный момент – 1,84 Д (за счет сильного различия электроотрицательностей кислорода и водорода). Вода обладает самым высоким значением удельной теплоемкости среди всех веществ в жидком и твердом агрегатном состояних. Удельная теплота плавления воды – 333,25 кДж/кг (0 С), парообразования – 2250 кДж/кг. Вода способна растворять полярные вещества. Вода обладает высоким поверхностным натяжением и отрицательным электрическим потенциалом поверхности.
Получение воды
H2SO4 + 2KOH = K2SO4 + H2O;
HNO3 + NH4OH = NH4NO3 + H2O;
2CH3COOH + Ba(OH)2 = (CH3COO)2Ba + H2O.
Один из способов получения воды – восстановление металлов водородом из их оксидов:
CuO + H2 = Cu + H2O.
Примеры решения задач
Not Found (#404)
ПОЛИТИКА КОНФИДЕНЦИАЛЬНОСТИ ПЕРСОНАЛЬНЫХ ДАННЫХ
Настоящая Политика конфиденциальности персональных данных (далее fff Политика конфиденциальности) действует в отношении всей информации, которую сайт
1. Определение терминов
1.1 В настоящей Политике конфиденциальности используются следующие термины:
1.1.1. «Администрация сайта» (далее Администрация) уполномоченные сотрудники на управление сайтом Агванд, действующие от имени ООО «Агванд», которые организуют и (или) осуществляют обработку персональных данных, а также определяет цели обработки персональных данных, состав персональных данных, подлежащих обработке, действия (операции), совершаемые с персональными данными.
1.1.2. «Персональные данные» — любая информация, относящаяся к прямо или косвенно определенному, или определяемому физическому лицу (субъекту персональных данных).
1.1.3. «Обработка персональных данных» — любое действие (операция) или совокупность действий (операций), совершаемых с использованием средств автоматизации или без использования таких средств с персональными данными, включая сбор, запись, систематизацию, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передачу (распространение, предоставление, доступ), обезличивание, блокирование, удаление, уничтожение персональных данных.
1.1.4. «Конфиденциальность персональных данных» — обязательное для соблюдения Оператором или иным получившим доступ к персональным данным лицом требование не допускать их распространения без согласия субъекта персональных данных или наличия иного законного основания.
1.1.5. «Сайт Агванд» — это совокупность связанных между собой веб-страниц, размещенных в сети Интернет по уникальному адресу (URL): agvand.ru, а также его субдоменах.
1.1.6. «Субдомены» — это страницы или совокупность страниц, расположенные на доменах третьего уровня, принадлежащие сайту Агванд, а также другие временные страницы, внизу который указана контактная информация Администрации
1.1.5. «Пользователь сайта Агванд » (далее Пользователь) лицо, имеющее доступ к сайту Агванд, посредством сети Интернет и использующее информацию, материалы и продукты сайта Агванд.
1.1.7. «Cookies» небольшой фрагмент данных, отправленный веб-сервером и хранимый на компьютере пользователя, который веб-клиент или веб-браузер каждый раз пересылает веб-серверу в HTTP-запросе при попытке открыть страницу соответствующего сайта.
1.1.8. «IP-адрес» уникальный сетевой адрес узла в компьютерной сети, через который Пользователь получает доступ на Сайт.
1.1.9. «Товар » — продукт, который Пользователь заказывает на сайте и оплачивает через платёжные системы.
2. Общие положения
2.1. Использование сайта Агванд Пользователем означает согласие с настоящей Политикой конфиденциальности и условиями обработки персональных данных Пользователя.
2.2. В случае несогласия с условиями Политики конфиденциальности Пользователь должен прекратить использование сайта Агванд .
2.3. Настоящая Политика конфиденциальности применяется к сайту Агванд. Сайт не контролирует и не несет ответственность за сайты третьих лиц, на которые Пользователь может перейти по ссылкам, доступным на сайте Агванд.
2.4. Администрация не проверяет достоверность персональных данных, предоставляемых Пользователем.
3. Предмет политики конфиденциальности
3.1. Настоящая Политика конфиденциальности устанавливает обязательства Администрации по неразглашению и обеспечению режима защиты конфиденциальности персональных данных, которые Пользователь предоставляет по запросу Администрации при регистрации на сайте Агванд, при подписке на информационную e-mail рассылку или при оформлении заказа.
3.2. Персональные данные, разрешённые к обработке в рамках настоящей Политики конфиденциальности, предоставляются Пользователем путём заполнения форм на сайте Агванд и включают в себя следующую информацию:
3.2.1. фамилию, имя, отчество Пользователя;
3.2.2. контактный телефон Пользователя;
3.2.3. адрес электронной почты (e-mail)
3.2.4. место жительство Пользователя (при необходимости)
3.2.5. адрес доставки Товара (при необходимости) 3.2.6. фотографию (при необходимости).
3.3. Сайт защищает Данные, которые автоматически передаются при посещении страниц:
— IP адрес;
— информация из cookies;
— информация о браузере
— время доступа;
— реферер (адрес предыдущей страницы).
3.3.1. Отключение cookies может повлечь невозможность доступа к частям сайта , требующим авторизации.
3.3.2. Сайт осуществляет сбор статистики об IP-адресах своих посетителей. Данная информация используется с целью предотвращения, выявления и решения технических проблем.
3.4. Любая иная персональная информация неоговоренная выше (история посещения, используемые браузеры, операционные системы и т.д.) подлежит надежному хранению и нераспространению, за исключением случаев, предусмотренных в п.п. 5.2. и 5.3. настоящей Политики конфиденциальности.
4. Цели сбора персональной информации пользователя
4.1. Персональные данные Пользователя Администрация может использовать в целях:
4.1.1. Идентификации Пользователя, зарегистрированного на сайте Агванд для его дальнейшей авторизации, оформления заказа и других действий.
4.1.2. Предоставления Пользователю доступа к персонализированным данным сайта Агванд.
4.1.3. Установления с Пользователем обратной связи, включая направление уведомлений, запросов, касающихся использования сайта Агванд, оказания услуг и обработки запросов и заявок от Пользователя.
4.1.4. Определения места нахождения Пользователя для обеспечения безопасности, предотвращения мошенничества.
4.1.5. Подтверждения достоверности и полноты персональных данных, предоставленных Пользователем.
4.1.6. Создания учетной записи для использования частей сайта Агванд, если Пользователь дал согласие на создание учетной записи.
4.1.7. Уведомления Пользователя по электронной почте.
4.1.8. Предоставления Пользователю эффективной технической поддержки при возникновении проблем, связанных с использованием сайта Агванд.
4.1.9. Предоставления Пользователю с его согласия специальных предложений, информации о ценах, новостной рассылки и иных сведений от имени сайта Агванд.
4.1.10. Осуществления рекламной деятельности с согласия Пользователя.
5. Способы и сроки обработки персональной информации
5.1. Обработка персональных данных Пользователя осуществляется без ограничения срока, любым законным способом, в том числе в информационных системах персональных данных с использованием средств автоматизации или без использования таких средств.
5.2. Пользователь соглашается с тем, что Администрация вправе передавать персональные данные третьим лицам, в частности, курьерским службам, организациями почтовой связи (в том числе электронной), операторам электросвязи, исключительно в целях выполнения заказа Пользователя, оформленного на сайте Агванд, включая доставку Товара, документации или e-mail сообщений.
5.3. Персональные данные Пользователя могут быть переданы уполномоченным органам государственной власти Российской Федерации только по основаниям и в порядке, установленным законодательством Российской Федерации.
5.4. При утрате или разглашении персональных данных Администрация вправе не информировать Пользователя об утрате или разглашении персональных данных.
5.5. Администрация принимает необходимые организационные и технические меры для защиты персональной информации Пользователя от неправомерного или случайного доступа, уничтожения, изменения, блокирования, копирования, распространения, а также от иных неправомерных действий третьих лиц.
5.6. Администрация совместно с Пользователем принимает все необходимые меры по предотвращению убытков или иных отрицательных последствий, вызванных утратой или разглашением персональных данных Пользователя.
6. Права и обязанности сторон
6.1. Пользователь вправе:
6.1.1. Принимать свободное решение о предоставлении своих персональных данных, необходимых для использования сайта Агванд, и давать согласие на их обработку.
6.1.2. Обновить, дополнить предоставленную информацию о персональных данных в случае изменения данной информации.
6.1.3. Пользователь имеет право на получение у Администрации информации, касающейся обработки его персональных данных, если такое право не ограничено в соответствии с федеральными законами. Пользователь вправе требовать от Администрации уточнения его персональных данных, их блокирования или уничтожения в случае, если персональные данные являются неполными, устаревшими, неточными, незаконно полученными или не являются необходимыми для заявленной цели обработки, а также принимать предусмотренные законом меры по защите своих прав.
6.2. Администрация обязана:
6.2.1. Использовать полученную информацию исключительно для целей, указанных в п. 4 настоящей Политики конфиденциальности.
6.2.2. Обеспечить хранение конфиденциальной информации в тайне, не разглашать без предварительного письменного разрешения Пользователя, а также не осуществлять продажу, обмен, опубликование, либо разглашение иными возможными способами переданных персональных данных Пользователя, за исключением п.п. 5.2 и 5.3. настоящей Политики Конфиденциальности.
6.2.3. Принимать меры предосторожности для защиты конфиденциальности персональных данных Пользователя согласно порядку, обычно используемого для защиты такого рода информации в существующем деловом обороте.
6.2.4. Осуществить блокирование персональных данных, относящихся к соответствующему Пользователю, с момента обращения или запроса Пользователя, или его законного представителя либо уполномоченного органа по защите прав субъектов персональных данных на период проверки, в случае выявления недостоверных персональных данных или неправомерных действий.
7. Ответственность сторон
7.1. Администрация, не исполнившая свои обязательства, несёт ответственность за убытки, понесённые Пользователем в связи с неправомерным использованием персональных данных, в соответствии с законодательством Российской Федерации, за исключением случаев, предусмотренных п.п. 5.2., 5.3. и 7.2. настоящей Политики Конфиденциальности.
7.2. В случае утраты или разглашения Конфиденциальной информации Администрация не несёт ответственность, если данная конфиденциальная информация:
7.2.1. Стала публичным достоянием до её утраты или разглашения.
7.2.2. Была получена от третьей стороны до момента её получения Администрацией Ресурса.
7.2.3. Была разглашена с согласия Пользователя.
7.3. Пользователь несет полную ответственность за соблюдение требований законодательства РФ, в том числе законов о рекламе, о защите авторских и смежных прав, об охране товарных знаков и знаков обслуживания, но не ограничиваясь перечисленным, включая полную ответственность за содержание и форму материалов.
7.4. Пользователь признает, что ответственность за любую информацию (в том числе, но не ограничиваясь: файлы с данными, тексты и т. д.), к которой он может иметь доступ как к части сайта Агванд, несет лицо, предоставившее такую информацию.
7.5. Пользователь соглашается, что информация, предоставленная ему как часть сайта Агванд, может являться объектом интеллектуальной собственности, права на который защищены и принадлежат другим Пользователям, партнерам или рекламодателям, которые размещают такую информацию на сайте Агванд.
Пользователь не вправе вносить изменения, передавать в аренду, передавать на условиях займа, продавать, распространять или создавать производные работы на основе такого Содержания (полностью или в части), за исключением случаев, когда такие действия были письменно прямо разрешены собственниками такого Содержания в соответствии с условиями отдельного соглашения.
7.6. В отношение текстовых материалов (статей, публикаций, находящихся в свободном публичном доступе на сайте Агванд) допускается их распространение при условии, что будет дана ссылка на Сайт.
7.7. Администрация не несет ответственности перед Пользователем за любой убыток или ущерб, понесенный Пользователем в результате удаления, сбоя или невозможности сохранения какого-либо Содержания и иных коммуникационных данных, содержащихся на сайте Агванд или передаваемых через него.
7.8. Администрация не несет ответственности за любые прямые или косвенные убытки, произошедшие из-за: использования либо невозможности использования сайта, либо отдельных сервисов; несанкционированного доступа к коммуникациям Пользователя; заявления или поведение любого третьего лица на сайте.
7.9. Администрация не несет ответственность за какую-либо информацию, размещенную пользователем на сайте Агванд, включая, но не ограничиваясь: информацию, защищенную авторским правом, без прямого согласия владельца авторского права.
8. Разрешение споров
8.1. До обращения в суд с иском по спорам, возникающим из отношений между Пользователем и Администрацией, обязательным является предъявление претензии (письменного предложения или предложения в электронном виде о добровольном урегулировании спора).
8.2. Получатель претензии в течение 30 календарных дней со дня получения претензии, письменно или в электронном виде уведомляет заявителя претензии о результатах рассмотрения претензии.
8.3. При не достижении соглашения спор будет передан на рассмотрение Арбитражного суда г. Нижний Новгород.
8.4. К настоящей Политике конфиденциальности и отношениям между Пользователем и Администрацией применяется действующее законодательство Российской Федерации.
9. Дополнительные условия
9.1. Администрация вправе вносить изменения в настоящую Политику конфиденциальности без согласия Пользователя.
9.2. Новая Политика конфиденциальности вступает в силу с момента ее размещения на сайте Агванд, если иное не предусмотрено новой редакцией Политики конфиденциальности.
9.3. Все предложения или вопросы касательно настоящей Политики конфиденциальности следует сообщать по адресу: [email protected]
9.4. Действующая Политика конфиденциальности размещена на странице по адресу http://agvand.ru/politika
Обновлено: 25.12.2017 года
г. Нижний Новгород, ООО «Агванд»
Строение молекулы и свойства воды
Аномальные свойства воды предполагают существование прочных сил между молекулами воды. Это можно объяснить уже при рассмотрении природы единичной молекулы воды, а затем и группы молекул. Шесть валентных электронов кислорода в молекуле воды гибридизированы в четырех Sp3-орбиталях, которые вытянуты к углам, образуя тетраэдр.
Две гибридные орбитали образуют О—Н ковалентные связи с углом 105°, тогда как другие две орбитали имеют неподеленные электронные пары. Ковалентные О—Н связи, благодаря высокой электроотрицательности кислорода, частично (на 40%) имеют ионный характер.
Таким образом, молекула воды имеет два отрицательных и два положительных заряда по углам тетраэдра. Вследствие этого, каждая
465
молекула воды тетраэдричес-ки координирована с четырьмя другими молекулами воды благодаря водородным связям (см. рис. 10.2). Энергия диссоциации водородной связи ~25 кДж/моль.
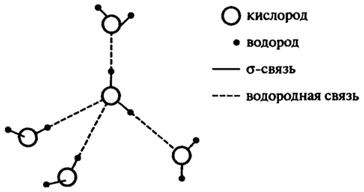 Рис.
10.2. Тетраэдрическая координация молекул
воды
Рис.
10.2. Тетраэдрическая координация молекул
воды
Одновременное присутствие в молекуле воды двух доноров и двух акцепторов делает возможной ассоциацию в трехмерную сеть, стабилизированную водородными связями, что обеспечивает большую силу взаимодействия между молекулами. Эта структура объясняет особые физические свойства воды, необычные для малых молекул. Так, например, спирт и соединения с изоэлектрическими диполями, такие как HF или NH3, образуют, в отличие от воды, только линейную или двухмерную ассоциацию.
Частичная поляризация Н—О связи в дальнейшем усиливается за счет образования водородных связей. Поэтому дипольный момент комплекса, состоящего из увеличенного числа водных молекул (мультимолекулярный диполь), тем больше, чем больше молекул ассоциировано и, естественно, больше дипольного момента единичной молекулы. Как следствие, диэлектрическая постоянная воды оказывается большой и превышает величину, которая может быть вычислена на основе дипольного момента единичной молекулы.
Транспорт (перенос) протона осуществляется вдоль водородной связи. Это поистине прыжок протона от одной молекулы воды к соседней молекуле воды. Независимо от того, получен ли протон путем диссоциации воды или будет получен от кислоты, он будет погружаться в орбита-ли неподеленных электронов молекулы, образуя гидратированный ион водорода Н3О+(ион гидроксония) с исключительно сильной водородной связью (энергия диссоциации — 100 кДж/моль):
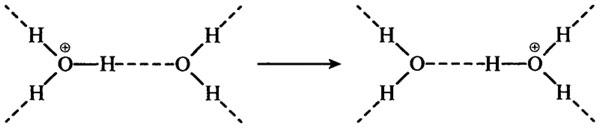
Подобный механизм действует и в транспорте ионов ОН—, который осуществляется вдоль водородных связей:
466
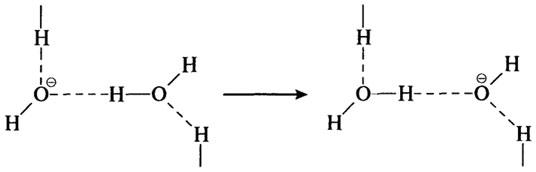
Переход протона от одного атома кислорода к другому осуществляется чрезвычайно быстро (V>1012c-1), поэтому подвижность протона весьма велика. Она превышает подвижность других ионов в 4—5 раз и соизмерима только с подвижностью ионов ОН—, которая, однако, примерно на 40% меньше. При этом скорость протонов во льду примерно в 100 раз больше, чем в воде.
Способность воды образовывать трехмерные водородные связи, для разрушения которых необходима дополнительная энергия, объясняет рассмотренные выше необычные свойства воды, например высокие значения теплоемкости, точек плавления и кипения, поверхностного натяжения и теплот фазовых переходов.
Вода может влиять на конформацию макромолекул, если там имеют место какие-либо нековалентные связи, которые стабилизируют конформацию большой молекулы. Эти нековалентные связи могут быть трех видов: водородные, ионные и неполярные связи. В белках существует конкуренция между CO…HN водородными связями и вода-амид водородными связями. Чем больше способность растворителя к образованию водородных связей, тем слабее CO…HN связь. В водной среде теплота образования или разрыва этой связи равна 0. Это означает, что CO…HN водородная связь не может обеспечить стабилизацию в водном растворе. Конкурирующая водородная связь от Н2О ослабляет термодинамическую тенденцию к образованию CO…HN водородных связей. Водные молекулы вокруг неполярных групп (молекул) становятся более упорядоченными, приводя к потере энтропии, и в результате возникает тенденция к ассоциации отдельных неполярных групп в водной среде с другими, большими чем водные, молекулами (гидрофобное взаимодействие). Концепция гидрофобной связи схематично показана на рис. 10.3.
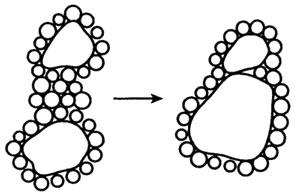 Рис.
10.3. Образование гидрофобной связи
Рис.
10.3. Образование гидрофобной связи
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов,
467
взаимодействует с активными металлами и вступает в различные другие реакции самого разнообразного характера.
Превращения белков, Липидов, углеводов с участием воды имеют важное значение в пищевых технологиях.
Помимо химических реакций, в которые вступает вода, при растворении веществ в воде имеют место взаимодействия физико-химического характера. Ниже мы кратко рассмотрим взаимодействие воды с ионами и ионными группами, группами, обладающими способностью к образованию водородных связей, и с неполярными веществами (группами). Эти взаимодействия необходимо принимать во внимание при рассмотрении классификации видов влаги в пищевых продуктах и ее причастности к химическим, биохимическим и микробиологическим изменениям в продукте при хранении (см. раздел 10.3).
468
465::466::467::468::Содержание
468::469::470::Содержание
состав, таблица, основные свойства природных вод, строение молекулы, изменение подземных вод
Вода – второе по значимости, после воздуха, вещество для человеческого организма. Прожить без нее человек может не более, чем 8 суток. Все химико-биологические реакции проходят с участием данного вещества. В природе вода пребывает с трех агрегатных состояниях – в твердом, жидком и газообразном. Таким разнообразием обладает только она. Многие физические и химические свойства воды удивляют и поражают. Еще великий ученый Вернадский писал о том, что нет на Земле такого компонента, который мог бы сравниться с ней по влиянию на основные процессы, происходящие в природе.
…
Вконтакте
Мой мир
Изучение
Благодаря своим уникальным физическим и химическим свойствам, вода сделала возможным зарождение и развитие жизни на планете. Многие ученые посвятили свою жизнь изучению данной жидкости. На протяжении нескольких столетий проводились эксперименты с целью узнать все химические и физические свойства воды. Даже сейчас интерес к этому веществу не угасает.
Формула воды известна каждому школьнику. Это три простых знака, но содержатся они в 75% от общей массы всего на планете.
Н2О – это два атома водорода и один — кислорода. Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Простота строения позволяет жидкости существовать в нескольких агрегатных состояниях. Ни одно вещество на планете не может этим похвастаться. Н2О очень подвижна, она уступает в этом свойстве лишь воздуху. Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег. Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Физические свойства
Н2О и физические ее свойства зависят от многих ключевых факторов. Основные из них:
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится. Это интересное ее физическое свойство. Если притяжение есть, она будет подстраивать форму под сосуд, а в космосе будет геометрически правильной формы.
- Следующее физическое свойство — реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.
- Обладает высокой теплоемкостью и теплопроводностью, быстро нагревается и долго не остывает.
- Еще со школы известно и такое физическое свойство воды — температура ее кипения — 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Чтобы определить физические свойства воды при нагревании был проведен эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным физическим свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным. Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Особое биологическое значение имеет такое физическое свойство воды как поверхностное напряжение. Объяснить это просто. Если налить немного жидкости на гладкую поверхность, то она не растечется по ней, а образует сферические капли. Это физическое свойство объясняет высокую биологическую активность воды. Поверхностное напряжение дает возможность всем растениям на планете поглощать жидкость, находящуюся в почве, своей корневой системой. Это же физическое свойство помогает крови человека проникать через все ткани организма.
Интересное физическое свойство — Н2О, очищенная от примесей (дистиллированная), не может проводить ток. Это свойство оксида водорода появляется лишь при наличии растворенных в нем солей.
Другие особенности и физические свойства
Лед – это состояние, которое свойственно оксиду водорода. Он образует рыхлые связи, которые легко деформируются. Кроме того, расстояние между частицами увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
У воды есть уникальное физическое свойство, которое называется явлением тройной точки. Это когда она находится сразу в трех своих состояниях. Возможно это условие, лишь при температуре 0,01 градус и давлении 610 Па.
Химические свойства
Химические свойства воды:
- Разделяют воду по жесткости, от мягкой и средней — до жесткой. Этот показатель зависит от содержания солей магния и калия в растворе. Есть также такие металлы, которые находятся в жидкости постоянно, а от некоторых можно избавиться кипячением.
- Следующие важные химические свойства воды — окисление и восстановление. Вода влияет на процессы, изучаемые в химии, происходящие с другими веществами: одни она растворяет, с другими вступает в реакцию. Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.
- Влияние на биохимические процессы. Вода основная часть любой клетки, в ней как в среде, происходят все реакции в организме.
- Интересное химическое свойство воды — жидком состоянии впитывает в себя газы, которые неактивны. Их молекулы располагаются между молекулами Н2О внутри полостей. Так образуются клатраты.
- При помощи оксида водорода образуются новые вещества, которые не связаны с окислительно-восстановительным процессом. Речь идет о щелочах, кислотах и основаниях.
- Еще одно химическое свойство воды — это способность образовывать кристаллогидраты. Оксид водорода при этом остается в неизменном виде. Среди обычных гидратов можно выделить медный купорос.
- Если через соединение пропустить электрический ток, то можно разложить молекулу на газы.
Важность физических и химических свойств воды для человека
Давно люди поняли значение жидкости для всего живого и планеты. Без нее человек не может прожить и недели. Вода — вещество, обладающее уникальными физическими и химическими свойствами. Она участвует во всех процессах внутри человеческого организма. Положительное воздействие жидкости:
- Главное применение — это наличие в организме, в клетках, где проходят все реакции.
- Образование водородных связей благоприятно сказывается на живых существах, ведь при изменении температуры жидкость в теле не замерзает.
- Человек давно применяет воду в бытовых нуждах, кроме приготовления пищи, это: стирка, уборка, купание.
- Ни один промышленный завод не может работать без жидкости.
- Н2О – источник жизни и здоровья, она является лекарством.
- Растения используют ее на всех этапах развития и жизни. С ее помощью они производят кислород, такой необходимый для жизни живых существ, газ.
Важность воды для человека
Критическая температура
У Н2О, как и у всех веществ, есть температура, которая называется критической. Критическая температура воды определяется методом нагрева. До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении. Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно (химическое свойство жидкости).
Применение в химии
Интерес у химиков вода вызывает благодаря своему умению растворять (одно из химических свойств). Часто ученые ею очищают вещества, чем создают благоприятные условия для проведения экспериментов. Она является средой, в которой можно провести опытные испытания. Кроме того, Н2О сама участвует в химических процессах, влияя на тот или иной химический эксперимент. Она соединяется с неметаллическими и металлическими веществами.
Три состояния
Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по физическим и химическим особенностям. Умение перевоплощаться – важная характеристика воды для планеты, таким образом, происходит ее круговорот.
Сравнивая три состояния, человек чаще видит химическое соединение все же в жидком виде. Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных веществ.
Физические и химические свойства воды в жидком состоянии — это: сила, позволяющая точить камни и рушить скалы, а также возможность принимать любую форму.
Мелкие частицы при замерзании сокращают скорость сдвижения и увеличивают дистанцию, поэтому структура льда пористая и по плотности ниже жидкости. Лед применяется в холодильных установках, для бытовых и промышленных целей. В природе лед несет разрушения, выпадая в виде града или лавины.
Газ – еще одно состояние, который образуется, когда не достигается критическая температура воды. Обычно при температуре больше 100 градусов, или испаряясь с поверхности (физическая особенность). В природе это облака, туманы и испарения. Большую роль искусственное газообразование сыграло в техническом прогрессе в 19 веке, когда были изобретены паровые двигатели.
Количество вещества в природе
75% — такая цифра покажется огромной, но это вся вода на планете, даже та, которая находится в разных агрегатных состояниях, в живых существах и органических соединениях. Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Распределение процентного содержания такое:
- моря и океаны – 74,8%
- Н2О пресных источников, распределенная неравномерно по планете, в ледниках составляет — 3,4%, а в озерах, болотах и реках 1,1%.
- На подземные источники приходится 20,7% от всего количества.
Характеристика тяжелой воды
Природное вещество – водород встречается в виде трех изотопов, в таком же количестве форм есть и кислород. Это позволяет выделять кроме обычной питьевой воды еще дейтериевую и тритиевую.
Дейтериевая имеет самую устойчивую форму, она встречается во всех природных источниках, но в малом количестве. Жидкость с такой формулой обладает рядом отличий от легкой, и иными физическими и химическими свойствами. Так, образование кристаллов начинается уже при температуре 3,82 градуса. А вот температура кипения (физическое свойство) выше — 101,42 градуса Цельсия. У нее больше плотность и способность к растворению веществ снижена (химическое свойство). Кроме того, ее обозначают другой формулой (D2O).
Живые системы реагируют на такое химическое соединение плохо. Лишь некоторые виды бактерий смогли в нем приспособиться к жизни. Рыбы и вовсе не выдержали такого эксперимента. В организме человека, дейтерий может находиться несколько недель, а после выводится, не причиняя вреда.
Пить дейтериевую воду – нельзя!
Свойства воды:
Химические свойства воды:
За счет иных физических и химических свойств применение тяжелая вода нашла в ядерной и атомной промышленности, а обычная — в повсеместном.
Физико-химические свойства воды и их значение для природных процессов
Вода — простейшее химическое соединение водорода с кислородом. Химически чистая вода состоит из 11,19% водорода и 88,81% кислорода (по весу). Вода — самое распространенное и самое необыкновенное вещество на Земле благодаря своим аномальным свойствам. В земных условиях только вода находится в трех физических агрегатных состояниях: твердом (лед, снег), жидком (вода) и газообразном (пар). В парообразном состоянии (при температуре 100°С) вода состоит главным образом из простых молекул, называемых гидролями (Н2О). В жидкой фазе вода представляет собой смесь гидролей (Н2О) двойных молекул — дигидролей (Н2О)2 и тройных молекул — тригидролей (Н2О)3.
В твердой фазе (лед) в воде преобладают тригидроли (Н2О)3. Переход воды из одного состояния в другое происходит быстро и сопровождается или поглощением тепла (при испарении, таянии льда и снега) или выделением тепла (при конденсации и сублимации водяного пара, при замерзании воды), но на температуру самой воды (льда) это не влияет. При этом скачкообразно изменяются физические и химические свойства воды. Химически чистая вода при нормальном атмосферном давлении 760 мм (1013 гПа) кипит при 100 °С, замерзает при О°С (это и температура плавления льда), имеет наибольшую плотность при температуре +4 °С.
Теплоемкость. Вода — одно из самых теплоемких в природе тел. Удельной теплоемкостью вещества называется количество теплоты, необходимое для нагревания 1 кг вещества на 1 °С. Вследствие высокой теплоемкости воды океанов, морей и озер поглощают огромное количество тепла летом, являясь его мощными аккумуляторами. Зимой воды, охлаждаясь, отдают тепло в атмосферу. Этим объясняется большое умеряющее (летом охлаждающее, зимой отепляющее) влияние океанов и морей на климат прилегающих материков в умеренных и высоких широтах. В экваториально-тропических теплоэнергетических зонах вода нагревается весь год и тепло морскими течениями и воздушными потоками передается в умеренные и полярные широты. Это перераспределение тепла имеет огромное климатическое значение.
Для воды характерны высокие значения теплоты испарения (597 кал/г) и теплоты плавления (79,4 кал/г). Эти свойства очень важны для живых организмов. Высокая теплота испарения обеспечивает защиту их от перегрева, а большая теплота плавления — от переохлаждения.
Теплопроводность воды весьма незначительна. Поэтому нагревание воды в естественных водоемах происходит не столько путем молекулярной теплопроводности, сколько путем плотностной конвекции, перемешивания воды вследствие течений и волнения. При отсутствии перемешивания воды в озерах наблюдается вертикальная термическая слоистость (стратификация). Лед и особенно снег обладают еще меньшей теплопроводностью, чем вода. Поэтому лед, возникнув на поверхности водоема, предохраняет воду от дальнейшего охлаждения, а снег — почву от промерзания, бесснежие же губит озимые культуры.
Плотность воды зависит от температуры и солености. Наибольшая плотность химически чистой воды достигается при температуре +4 °С, а выше и ниже +4 °С плотность воды уменьшается — вода становится легче. Это удивительное аномальное свойство воды по сравнению с другими жидкостями, плотность которых при понижении температуры и затвердевании увеличивается, объясняется тем, что одиночные молекулы воды Н2О (моногидроли) могут объединяться и образовывать сложные молекулы: дигидроли и тригидроли. Они более крупные по объему, но относительно рыхлые, ажурные по структуре и поэтому более легкие.
При понижении температуры воды происходит, с одной стороны, нормальное уменьшение объема и уплотнение воды, вызванное охлаждением, как у всех жидкостей, а с другой — увеличение объема и соответственно уменьшение плотности воды из-за объединения молекул воды в более сложные, но более легкие. При охлаждении воды до +4 °С преобладает первый процесс, при температуре +4 °С оба процесса уравновешиваются, поэтому плотность наибольшая, при дальнейшем охлаждении воды ниже +4 °С преобладает второй процесс. Плотностная аномалия воды имеет громадное значение для природных вод. Во-первых, при осеннем охлаждении пресных водоемов до +4 °С более холодная и плотная вода с поверхности опускается и обогащает глубинные слои кислородом, как бы подготавливая водоем к зиме. Во-вторых, вследствие этой аномалии водоемы даже в условиях сурового климата не промерзают до дна, за исключением совсем мелких, поскольку при охлаждении воды ниже +4 °С вплоть до О °С верхние слои воды становятся менее плотными, более легкими и удерживаются на поверхности.
Так как молекулярная теплопроводность воды и льда невелика, верхние слои предохраняют от охлаждения ниже расположенные толщи воды; живые организмы тем самым уберегаются от гибели. Весной после таяния льда и нагревания воды в верхнем ее слое до +4 °С она становится тяжелее, плотнее и опускается вниз, обогащая глубинные слои кислородом, что очень важно для жизни, так как после зимы запасы кислорода в водоемах истощаются. Но это опускание прекращается после достижения температуры +4 °С, ибо при последующем прогревании поверхностная вода становится легче. Таким образом, благодаря плотностной аномалии воды сохраняется жизнь в водоемах в условиях холодных и умеренных климатических поясов.
Своеобразным свойством воды является резкое увеличение ее объема при замерзании. Объем льда примерно на 10% больше по сравнению с первоначальным объемом воды. И наоборот, плавление льда сопровождается не расширением, а сжатием и уменьшением объема воды. Это аномальное свойство воды объясняется тем, что при понижении температуры воды и переходе ее через О °С происходит быстрое превращение почти всех ее молекул в тригидроли, что сопровождается скачкообразным увеличением объема льда. Увеличиваясь в объеме, лед становится менее плотным (плотность льда при замерзании воды составляет 0,91 г/см3), а значит, более легким, чем вода, и всплывает.
Будучи плохим проводником тепла, лед предохраняет глубокие слои воды от замерзания. Свойство воды увеличиваться в объеме при замерзании играет огромную роль при разрушении горных пород путем физического («морозного») выветривания, поскольку, замерзая в трещинах пород, лед давит на их стенки и разрывает породу на мелкие части. Изменение объема воды при замерзании и таянии льда создает в области многолетней мерзлоты особый рельеф: бугры пучения при замерзании воды и впадины при таянии льдистых грунтов и линз льда.
Подвижность — характерное свойство жидкой воды. Движение воды происходит под действием силы тяжести, различия плотностей, под влиянием ветра, вследствие притяжения Луной и Солнцем и др. Перемешивание воды способствует выравниванию ее температуры, солености, химического состава и т. д. Велика роль движущейся воды в перераспределении тепла в океанах путем морских течений. Благодаря поверхностным текучим водам размываются, перемещаются и отлагаются огромные массы горных пород.
Термическая устойчивость воды весьма высока. Водяной пар разлагается на водород и кислород только при температуре выше 1000°С в высоких слоях атмосферы.
Поверхностное натяжение. Вода среди жидкостей, кроме ртути, обладает самым большим поверхностным натяжением. Благодаря этому свойству вода поднимается по капиллярам в грунтах, движется вверх в растениях, обеспечивая соответственно почвообразование и питание растений. Без воды земледелие было бы невозможно.
Вода — прекрасный растворитель, поэтому все воды представляют собой газосолевые растворы различного химического состава и различной концентрации. Концентрация растворенных в воде веществ характеризуется соленостью, обозначается символом 5 и выражается в промилле (%о), т. е. в тысячных долях (граммах вещества на килограмм воды). Соленость пресной воды менее 1%о, остальные воды в той или иной степени соленые. Большая часть химических элементов находится в воде в виде гидратированных ионов, газы — в виде растворенных молекул. Растворимость газов в воде больше при низких температурах и повышенном давлении. Обнаружилось, что вода изменяет свою растворяющую способность под воздействием искусственно создаваемого магнитного поля. Растворяющая способность воды обусловливает химическое выщелачивание (выветривание) горных пород, обмен веществами между компонентами природы внутри географической оболочки, между сушей и океаном, между организмами и средой. Вообще минерализация воды до определенного предела — основа жизни. Химически чистая вода для жизни непригодна.
Многообразен не только химический и молекулярный, но и изотопный состав природных вод, так как кислород и водород имеют несколько изотопов. В природных условиях известны атомы водорода с атомным весом 1 (Н1 — протий), 2 (Н2=Д — дейтерий) и 3 (Н3=Т — тритий) и атомы кислорода с атомным весом 16(О16), 17(О17) и 18(О18). Из сочетания изотопов водорода Н, Д и Т и кислорода О16, О17 и О18 образуется девять видов воды. Природная вода — смесь всех этих видов. Причем на долю обыкновенной воды Н2‘О16 приходится 99,7% на Земле. Все остальные виды воды, кроме обыкновенной, называются тяжелой водой. Наиболее существенно отличается от обыкновенной тяжелая вода Н2 О16 (Д2О). Она имеет молекулярный вес 20, кипит при температуре 101,42°С, замерзает при температуре 0,8 °С, имеет максимальную плотность при 11,6 °С. Тяжелая вода нашла применение в атомной энергетике.
Способность к самоочищению — важное свойство воды. Оно осуществляется в процессе течения в реках, волнения в озерах и морях, фильтрации воды через грунт, в процессе испарения. Но при загрязнении выше определенных пределов эта способность нарушается.
Цвет воды. Вода имеет голубоватый оттенок, но в тонких слоях бесцветна. Оттенки цвета зависят от угла падения солнечных лучей, глубины проникновения света и от примесей.
Прозрачность воды определяется глубиной погружения белого диска диаметром 30 см. Прозрачность зависит от примесей. При большой прозрачности свет проникает на большую глубину, поддерживая необходимые условия для существования организмов.
Физические и химические свойства воды тесно взаимосвязаны. Особенно сильно изменяются свойства воды под влиянием температуры и давления. Удивительные свойства воды способствовали появлению и развитию жизни на Земле. Благодаря воде совершаются все процессы в географической оболочке.
Строение молекулы и свойства воды
Аномальные свойства воды предполагают существование прочных сил между молекулами воды. Это можно объяснить уже при рассмотрении природы единичной молекулы воды, а затем и группы молекул. Шесть валентных электронов кислорода в молекуле воды гибридизированы в четырех Sp3-орбиталях, которые вытянуты к углам, образуя тетраэдр.
Две гибридные орбитали образуют О—Н ковалентные связи с углом 105°, тогда как другие две орбитали имеют неподеленные электронные пары. Ковалентные О—Н связи, благодаря высокой электроотрицательности кислорода, частично (на 40%) имеют ионный характер.
Таким образом, молекула воды имеет два отрицательных и два положительных заряда по углам тетраэдра. Вследствие этого, каждая
465
молекула воды тетраэдричес-ки координирована с четырьмя другими молекулами воды благодаря водородным связям (см. рис. 10.2). Энергия диссоциации водородной связи ~25 кДж/моль.
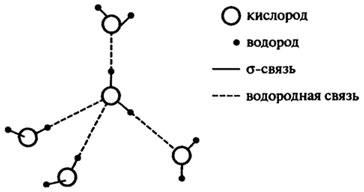 Рис.
10.2. Тетраэдрическая координация молекул
воды
Рис.
10.2. Тетраэдрическая координация молекул
воды
Одновременное присутствие в молекуле воды двух доноров и двух акцепторов делает возможной ассоциацию в трехмерную сеть, стабилизированную водородными связями, что обеспечивает большую силу взаимодействия между молекулами. Эта структура объясняет особые физические свойства воды, необычные для малых молекул. Так, например, спирт и соединения с изоэлектрическими диполями, такие как HF или NH3, образуют, в отличие от воды, только линейную или двухмерную ассоциацию.
Частичная поляризация Н—О связи в дальнейшем усиливается за счет образования водородных связей. Поэтому дипольный момент комплекса, состоящего из увеличенного числа водных молекул (мультимолекулярный диполь), тем больше, чем больше молекул ассоциировано и, естественно, больше дипольного момента единичной молекулы. Как следствие, диэлектрическая постоянная воды оказывается большой и превышает величину, которая может быть вычислена на основе дипольного момента единичной молекулы.
Транспорт (перенос) протона осуществляется вдоль водородной связи. Это поистине прыжок протона от одной молекулы воды к соседней молекуле воды. Независимо от того, получен ли протон путем диссоциации воды или будет получен от кислоты, он будет погружаться в орбита-ли неподеленных электронов молекулы, образуя гидратированный ион водорода Н3О+(ион гидроксония) с исключительно сильной водородной связью (энергия диссоциации — 100 кДж/моль):
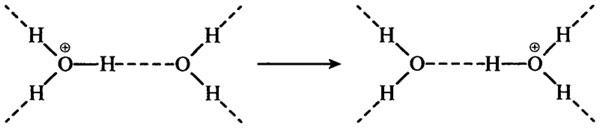
Подобный механизм действует и в транспорте ионов ОН—, который осуществляется вдоль водородных связей:
466
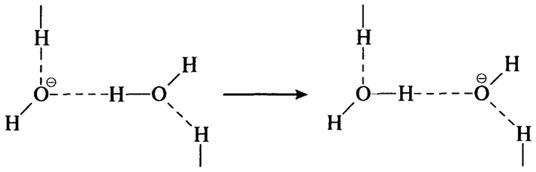
Переход протона от одного атома кислорода к другому осуществляется чрезвычайно быстро (V>1012c-1), поэтому подвижность протона весьма велика. Она превышает подвижность других ионов в 4—5 раз и соизмерима только с подвижностью ионов ОН—, которая, однако, примерно на 40% меньше. При этом скорость протонов во льду примерно в 100 раз больше, чем в воде.
Способность воды образовывать трехмерные водородные связи, для разрушения которых необходима дополнительная энергия, объясняет рассмотренные выше необычные свойства воды, например высокие значения теплоемкости, точек плавления и кипения, поверхностного натяжения и теплот фазовых переходов.
Вода может влиять на конформацию макромолекул, если там имеют место какие-либо нековалентные связи, которые стабилизируют конформацию большой молекулы. Эти нековалентные связи могут быть трех видов: водородные, ионные и неполярные связи. В белках существует конкуренция между CO…HN водородными связями и вода-амид водородными связями. Чем больше способность растворителя к образованию водородных связей, тем слабее CO…HN связь. В водной среде теплота образования или разрыва этой связи равна 0. Это означает, что CO…HN водородная связь не может обеспечить стабилизацию в водном растворе. Конкурирующая водородная связь от Н2О ослабляет термодинамическую тенденцию к образованию CO…HN водородных связей. Водные молекулы вокруг неполярных групп (молекул) становятся более упорядоченными, приводя к потере энтропии, и в результате возникает тенденция к ассоциации отдельных неполярных групп в водной среде с другими, большими чем водные, молекулами (гидрофобное взаимодействие). Концепция гидрофобной связи схематично показана на рис. 10.3.
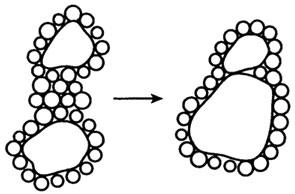 Рис.
10.3. Образование гидрофобной связи
Рис.
10.3. Образование гидрофобной связи
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов,
467
взаимодействует с активными металлами и вступает в различные другие реакции самого разнообразного характера.
Превращения белков, Липидов, углеводов с участием воды имеют важное значение в пищевых технологиях.
Помимо химических реакций, в которые вступает вода, при растворении веществ в воде имеют место взаимодействия физико-химического характера. Ниже мы кратко рассмотрим взаимодействие воды с ионами и ионными группами, группами, обладающими способностью к образованию водородных связей, и с неполярными веществами (группами). Эти взаимодействия необходимо принимать во внимание при рассмотрении классификации видов влаги в пищевых продуктах и ее причастности к химическим, биохимическим и микробиологическим изменениям в продукте при хранении (см. раздел 10.3).
468
465::466::467::468::Содержание
468::469::470::Содержание
Вода: свойства и биомолекулярная структура
Вода: свойства и биомолекулярная структура
Вода необходима для жизни. Многие приспособления растений и животных сохраняют воду — толстая кожа пустынных кактусов и сложная структура почек млекопитающих — лишь два примера. Ученые-планетологи ищут доказательства наличия жидкой воды, размышляя о возможности существования жизни на других планетах, таких как Марс или спутник Юпитера Титан.
Вода обладает многими замечательными свойствами, в том числе:
- Высокое поверхностное натяжение: Небольшие объекты, например водные насекомые, несмотря на то, что они плотнее воды, могут оставаться на поверхности воды.
- Высокая температура кипения: По отношению к молекулярной массе вода кипит при высокой температуре. Например, аммиак с молекулярной массой почти 17 кипит при -33 ° C, а вода с молекулярной массой 18 кипит при 100 ° C.
- Плотность зависит от температуры: Твердая вода (лед) менее плотная, чем жидкая вода. Это свойство означает, что озера и пруды замерзают сверху вниз, что является преимуществом для обитающих там рыб, которые могут перезимовать, не будучи замороженными до твердого состояния.
Рисунок 1
В воде несвязывающие электроны являются акцепторами Н-связи , , а атомы водорода являются донорами Н-связи . Биомолекулы содержат акцепторы и доноры водородных связей. Рассмотрим боковую цепь простой аминокислоты серина.Кислород, как и вода, содержит две пары несвязывающих электронов, а водород, соответственно, является фокусом частичного положительного заряда. Таким образом, серин может быть как , так иакцептор и донор Н-связи, иногда одновременно. Как и следовало ожидать, серин растворим в воде благодаря своей способности образовывать водородные связи с окружающим его растворителем. Серин внутри белка, вдали от воды, может образовывать Н-связи с другими аминокислотами; например, он может служить донором Н-связи для несвязывающих электронов на кольцевом азоте гистидина, как показано на Рисунке 2
.Рисунок 2
Эти водородные связи обычно существуют только при отсутствии воды. Если боковая цепь серина находится на поверхности белка, она с большой вероятностью образует Н-связи, учитывая относительно высокую концентрацию доступной воды.
.Необычные свойства молекул воды
- Образование
- Наука
- Химия
- Необычные свойства молекул воды
Молекулы воды обладают необычными химическими и физическими свойствами. Вода может существовать во всех трех состояниях вещества одновременно: жидком, газообразном и твердом.
Представьте, что вы сидите в своей гидромассажной ванне (наполненной жидкостью, водой) и наблюдаете, как пар ( газ, ) поднимается с поверхности, когда вы наслаждаетесь холодным напитком из стакана, наполненного кубиками льда ( твердый ).Очень немногие другие химические вещества могут существовать во всех этих физических состояниях в этом близком температурном диапазоне.
Уникальные свойства воды
Ниже приведены некоторые уникальные свойства воды:
В твердом состоянии частицы вещества обычно гораздо ближе друг к другу, чем в жидком состоянии. Итак, если вы поместите твердое вещество в соответствующую жидкость, оно тонет. Но это не относится к воде. Его твердое состояние менее плотное, чем жидкое, поэтому оно плавает.
Температура кипения воды необычно высокая. Другие соединения, сходные по весу с водой, имеют температуру кипения на значительно ниже.
Еще одно уникальное свойство воды — ее способность растворять большое количество различных химических веществ. Он растворяет соли и другие ионные соединения, а также полярные ковалентные соединения, такие как спирты и органические кислоты.
Воду иногда называют универсальным растворителем, потому что она может растворять очень многие вещества.Он также может поглощать большое количество тепла, что позволяет большим водоемам смягчать температуру на Земле.
Вода обладает множеством необычных свойств из-за полярных ковалентных связей. Кислород имеет большую электроотрицательность, чем водород, поэтому электронные пары притягиваются ближе к атому кислорода, придавая ему частичный отрицательный заряд. Впоследствии оба атома водорода принимают частичный положительный заряд. Частичные заряды на атомах, созданные полярными ковалентными связями в воде, показаны на следующем рисунке.
Полярное ковалентное связывание в воде.
Межмолекулярные силы
Вода является диполем и действует как магнит, причем конец кислорода имеет отрицательный заряд, а конец водорода — положительный. Эти заряженные концы могут притягивать другие молекулы воды. Это притяжение между молекулами — это межмолекулярная сила , (сила между разными молекулами).
Межмолекулярные силы могут быть трех разных типов:
Лондонская сила (или сила рассеивания) .Этот слабый тип притяжения обычно возникает между неполярными ковалентными молекулами, такими как азот, водород или метан. Это происходит в результате приливов и отливов электронных орбиталей, что дает слабое и кратковременное разделение зарядов вокруг связи.
Слабое диполь-дипольное взаимодействие. Эта межмолекулярная сила возникает, когда положительный конец одной дипольной молекулы притягивается к отрицательному концу другой дипольной молекулы. Они намного сильнее лондонских войск, но все же довольно слабы.
Чрезвычайно сильное диполь-дипольное взаимодействие. Эта сила возникает, когда атом водорода связан с одним из трех чрезвычайно электроотрицательных элементов — O, N или F. Эти три элемента имеют очень сильное притяжение для связывающей пары электронов, поэтому атомы, участвующие в связи, принимают на большую сумму частичного заряда.
Эта связь оказывается очень полярной — и чем выше полярность, тем эффективнее связь. Когда O, N или F на одной молекуле притягивает водород другой молекулы, диполь-дипольное взаимодействие очень сильно.Это сильное взаимодействие называется водородной связью . Водородная связь — это тип взаимодействия, который присутствует в воде, как показано на следующем рисунке.
Водородная связь в воде.
Молекулы воды стабилизируются этими водородными связями, поэтому разорвать (разделить) молекулы очень сложно. Водородные связи определяют высокую температуру кипения воды и ее способность поглощать тепло. Когда вода замерзает, водородные связи удерживают воду в открытом каркасе, который включает в себя много пустого пространства.
В жидкой воде молекулы могут немного сблизиться друг с другом, но когда образуется твердое тело, водородные связи приводят к образованию структуры, содержащей большие отверстия. Отверстия увеличивают объем и уменьшают плотность.
Этот процесс объясняет, почему плотность льда меньше плотности жидкой воды (причина, по которой лед плавает). Структура льда показана ниже, водородные связи обозначены пунктирными линиями.
Структура льда.
.5 Физико-химические свойства и судьба окружающей среды | Основы для руководства по выбору химических альтернатив
главное отличие от разложения более мелких молекул.
Использование физико-химических свойств для прогнозирования биодоступности неорганических химических веществ
Охарактеризовать срок службы металлов в окружающей среде сложно, потому что взаимодействия сильно зависят от характеристик системы окружающей среды, в которой они выделяются.Выщелачивание 25 и старение 26 связаны с условиями в почвах и отложениях, поэтому прогнозирование экологической опасности, основанное исключительно на стандартных тестах на токсичность в водной среде с использованием растворимых солей, не является адекватным. Таким образом, в области экотоксикологии все чаще используются протоколы испытаний на токсичность отложений и почвы, которые включают этапы выщелачивания и старения или применение моделей биодоступности для корректировки данных, полученных в лабораторных условиях, в соответствии с реалистичными условиями в почве, отложениях и воде (Santore et al. .2002; Smolders et al. 2009 г.).
Металлы, недавно попавшие в почву или отложения, более биодоступны, чем металлы, которые постарели от месяцев до лет. Изначально металлы выщелачиваются из почвы или отложений — процесс, который происходит относительно быстро (то есть от недель до месяцев), за которым следует медленный процесс старения (то есть годы), что со временем приводит к снижению токсичности для отложений или почвенных организмов. Следовательно, исследования токсичности, проводимые с почвой или донными отложениями, недавно измененными солями металлов, приведут к эффектам при гораздо более низких концентрациях, чем те, которые наблюдаются в реальных ситуациях (Besser et al.2011).
Старение происходит из-за нескольких различных процессов, включая сорбцию оксидами алюминия, марганца или железа и в конечном итоге включение иона металла в кристаллическую структуру минеральных частиц почвы или отложений (Adriano 2001). Скорость химической сорбции оксидами, глинами, другими минералами или органическими веществами определяется силой и количеством отрицательно заряженных участков связывания в почве или частицах отложений, на которые, в свою очередь, влияет количество алюминия, железа или кремний присутствует.Реакции сорбции обратимы и сильно зависят от pH, при этом более высокие скорости сорбции происходят при более высоких pH, увеличивая биодоступность при снижении pH (т.е. становится более кислым). Редокс-потенциал влияет на биодоступность катионных металлов; очень нерастворимые сульфиды металлов образуются в восстановительных условиях, например, в насыщенных почвах или бескислородных отложениях. Следовательно, тип окружающей среды, в которую вводится металл, также влияет на ожидаемую степень токсичности, хотя в зависимости от металла она отличается.Сила притяжения между ионами металла и заряженными участками является функцией сродства металла к заряженному участку относительно его сродства к молекулам воды. Медь обычно имеет самую высокую скорость сорбции, за ней в порядке убывания следуют никель, кобальт, свинец, кадмий и цинк. Этот порядок немного отличается для электростатического связывания с глинами и другими отрицательно заряженными частицами, при этом никель имеет самое высокое сродство связывания, а лидер — самое низкое.
Аффинность связывания также влияет на токсичность катионных металлов.Например, жабры водных организмов имеют отрицательный заряд и действуют как еще один сайт связывания некоторых ионов металлов (Playle 2004). Токсичность зависит от относительной силы связывания биотического лиганда и других отрицательно заряженных частиц в воде (например, органического вещества, сульфидов железа) и конкуренции за сайты связывания со стороны других металлов. Модель биотического лиганда можно использовать для прогнозирования токсичности для данного металла, если известны концентрации других основных катионов (DiToro et al. 2001). Эта модель корректирует значения стандартных испытаний на токсичность для различных типов водной среды и может повлиять на относительную опасность различных металлов.
Анионные металлы и металлоиды, такие как молибден, мышьяк, ртуть и селен, также связываются с оксидами железа, но связывание уменьшается с увеличением pH, что противоположно тому, что происходит с катионными металлами. Поэтому токсичность этих металлов существенно отличается от токсичности катионных металлов в той же среде. Кроме того, метилирование металлоидов играет очень важную роль в увеличении их мобильности и поглощения, а также их способности к биоусилению в пищевой цепи.Хорошо известными примерами этого явления является наблюдение, что метилированный мышьяк менее токсичен, чем его неорганическая форма, в то время как метилированная ртуть и селенорганические соединения более токсичны. Метилирование — это биологический процесс, который происходит в бактериях, причем начальная стадия протекает в отложениях в восстановительных условиях (низкое содержание кислорода) и в присутствии большого количества органических веществ (Jonnalagadda and Rao 1993).
Поскольку растения, беспозвоночные и почвенные микроорганизмы взаимодействуют с водой из пор почвы или донных отложений, количество свободных ионов металлов в растворе является наиболее важным фактором, определяющим токсичность.Корни растений могут выделять фитохелатины, которые
_____________
25 Выщелачивание — это процесс, при котором растворимые вещества в почве, такие как соли, вымываются в нижний слой почвы или растворяются и уносятся водой (USGS 2014).
26 Старение означает снижение биодоступности с течением времени (Kelsey and Alexander 1997).
.молекул воды характеризуют структуру генетического материала ДНК — ScienceDaily
Молекулы воды очень специфическим образом окружают ДНК генетического материала. Ученые из Helmholtz-Zentrum Dresden-Rossendorf (HZDR) обнаружили, что, с одной стороны, текстура этой гидратной оболочки зависит от содержания воды, а с другой стороны, фактически влияет на структуру самого генетического вещества. Эти открытия важны не только для понимания биологической функции ДНК; они также могут быть использованы для создания новых материалов на основе ДНК.
Двойная спираль ДНК никогда не встречается изолированно; вместо этого вся его поверхность всегда покрыта молекулами воды, которые соединяются с помощью водородных связей. Но ДНК не связывает все молекулы одинаково. «Мы смогли убедиться, что часть воды связана сильнее, а другие молекулы — в меньшей степени», — отмечает доктор Карим Фахми, глава отдела биофизики Института радиохимии. Однако это верно только при низком содержании воды. Когда водная оболочка набухает, эти различия корректируются, и все водородные связи становятся одинаково прочными.Это, в свою очередь, изменяет геометрию цепи ДНК: основа двойной спирали, состоящей из сахарных и фосфатных групп, слегка изгибается. «Точная структура ДНК зависит от конкретного количества воды, окружающей молекулу», — резюмирует д-р Фахми.
Анализы генетического материала были проведены в HZDR докторантом Хасаном Хесбаком. ДНК, полученная из семенников лосося, сначала была приготовлена в виде тонких пленок, а затем смочена ультратонкими дозами воды в течение нескольких секунд.С помощью инфракрасной спектроскопии Хасан Хесбак смог проверить, что сила водородных связей варьируется и что молекулы воды демонстрируют разные периоды покоя в таких конфигурациях. Колебания водных связей в гидратной оболочке двойной спирали можно возбуждать инфракрасным светом. Чем выше частота колебаний, тем слабее водородная связь. Стало очевидно, что сахарные компоненты и пары оснований создают особенно сильные связи с водной оболочкой, в то время как связи между водой и фосфатными группами более слабые.Результаты были опубликованы совсем недавно в журнале Американского химического общества .
«Таким образом, ДНК является чувствительным материалом», — объясняет Карим Фахми. «Под этим мы имеем в виду материалы, которые динамически реагируют на изменяющиеся условия. Структура двойной спирали, прочность водородных связей и даже объем ДНК имеют тенденцию изменяться с увеличением содержания воды». Уже сегодня генетический материал представляет собой необычайно универсальную и интересную молекулу для так называемой ДНК-нанотехнологии.Потому что с ДНК можно реализовать высокоупорядоченные структуры с новыми оптическими, электронными и механическими свойствами при крошечных размерах, которые также представляют интерес для HZDR. Связанная водная оболочка — не просто неотъемлемая часть таких конструкций. Он также может предполагать точную функцию переключения, потому что результаты показывают, что увеличение гидратной оболочки только на две молекулы воды на фосфатную группу может вызвать мгновенное «складывание» структуры ДНК. Такие зависящие от воды процессы переключения могут управлять, например, высвобождением активных агентов из материалов на основе ДНК.
Неудивительно, что водная оболочка генетического материала также имеет большое значение для естественной биологической функции ДНК. Потому что каждая биомолекула, которая связана с ДНК, должна сначала вытеснить водную оболочку. Ученые из Дрездена проанализировали этот процесс на пептиде индолицидин. Этот антимикробный белок менее структурирован и очень гибок. То, что он все еще так точно «идентифицирует» двойную спираль, связано с тем, что высокоструктурированные молекулы воды высвобождаются, когда она сливается с генетическим материалом.Реструктуризация водной оболочки, что на самом деле является энергетическим преимуществом, увеличивает связывание активного агента. Такие детали действительно важны для разработки ДНК-связывающих лекарств, например, для лечения рака, потому что они могут быть установлены с помощью метода, разработанного в HZDR.
История Источник:
Материалы предоставлены Ассоциацией немецких исследовательских центров им. Гельмгольца . Примечание. Содержимое можно редактировать по стилю и длине.
.
