9) Направленность ковалентной связи. Строение молекул h3, Cl2, hCl, h3o, h3s, nh4, ch5, bCl3, BeCl2. Гибридизация электронных облаков, s и p связь. Строение молекул этилена, ацетилена.
В случае ковалентной связи взаимное перекрытие электронных облаков в пространстве определяет форму молекулы.
1)AA, BB.Этот тип молекул характерен для Н2 (s-связь), галогенов, и соединений Н с галогенами. (см.рис).Молекулы водорода имеют линейную структуру. Химическая связь действует по кратчайшему расстоянию, связывая атомыs-связью(см.рис).
2)А2В.Этот тип характерен для соединений, образованных элементами главной подгруппы 6-ой группы: Н2О, Н2S.(см.рис) ( Н2О – угол –1050, Н2S – 92035’) Максимальная плотность возникает при темп.=4 градуса цельсия.
3)А3В.Элементы главной подгруппы 3
группы(N,P,As,Sb). NH3 (см.рис).
NH3 (см.рис).
4)А4В Главная подгруппа 4 группа(Si,C,Ge,Sn). СН
5)АВ3 – характерно для соединений гл. подгруппы 3-ей группы.(B,Al,Ga,In,Tl) BCl3. s2p®sp2®q3(см.рис).
6)АВ2–для некоторых соединений, образованными
элементами главной подгруппы 2 группы.
ВеCl2(линейная структура, угол –
180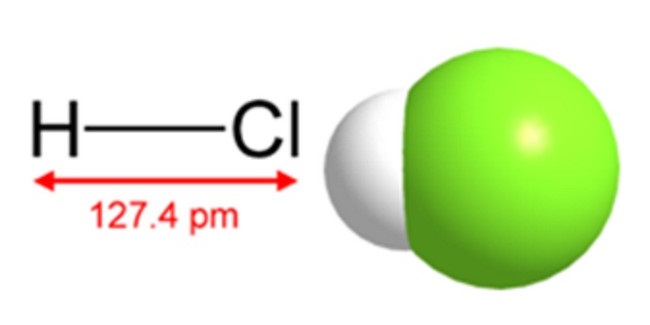 1)C2H4– этилен 2)C2Н2– ацетилен При образовании молекул
этилена происходит неполная гибридизация
электронов оболочки атомов углерода.
s2p2®sp3®sp2p®q3p Негибридизорованные электроны
в плоскости, перпендикулярной плоскости,
где расположены атомы этилена, образуютp- связь(см.рис).Повышение электронной
плотности образуется между ядрами –
стягивание ядер. При образованииp- связи электронные облака перекрываются
в меньшей степени, чем сигма-связь (в
случае сигма-связи облака гибридизированы,
что обеспечивает их большее перекрывание),
поэтомуp- связь менее прочная
1)C2H4– этилен 2)C2Н2– ацетилен При образовании молекул
этилена происходит неполная гибридизация
электронов оболочки атомов углерода.
s2p2®sp3®sp2p®q3p Негибридизорованные электроны
в плоскости, перпендикулярной плоскости,
где расположены атомы этилена, образуютp- связь(см.рис).Повышение электронной
плотности образуется между ядрами –
стягивание ядер. При образованииp- связи электронные облака перекрываются
в меньшей степени, чем сигма-связь (в
случае сигма-связи облака гибридизированы,
что обеспечивает их большее перекрывание),
поэтомуp- связь менее прочная
Предположим, что
мы имеем соединение АB, при этом
взаимодействуют атомы A B с большим
значением энергии сродства к электрону.
ЭОa>Эоb -> общая электронная пара в
молекуле AB смещена от атома B к атому А.
Электронейтральность нарушается, в
молекуле появляются положительный и
отрицательный полюса.(см.рис5) Такая
структура молекулы носит название
полярная структура.
Понятие о методе электронных орбиталей.
Метод валентных
связей в целом ряде случаев не может
объяснить механизм возникновения ряда
соединений и свойств образованных
молекул.
12.1) Донорно-акцепторная связь. Комплексные соединения.
 1)Nh4+ HClà[Nh5]Cl, 2)AgCl+2Nh4=[Ag(Nh4)2]Cl, 3)CuSO4+4Nh4= [Cu(Nh4)4]SO4,
4)2KJ+HgJ2= K2[HgJ4], 5)FeCl3+6h3Oà[Fe(h3O)6]Cl3. Комплексные соединения-
соединения, которые образуются без
возникновения новых электронных пар,
а за счет проявления дон.-акц. связи.(см.рис)
BF3+Nh4àBF3Nh4,
B-акцептор, N-донор.Общие св-ва ков.
и дон.-акцепторных связей. Возникают
за счет общих электрон- ных пар. В случае
ковалентной связи все участники
равноправны (каждый участник дает по
1 электрону) , д-а (каждый участник дает
электронную пару).[Cu(Nh4)4]SO4.
Cu-комплексообразователь,
4-координационное число. ( )- внутренняя
сфера, [ ]-внешняя сфера, Nh4-лиганды. Заряд
внутри сферы представляет собой сумму
зарядов центрального иона и заряда
лиганд. В целом заряд нейтрален.
1)Nh4+ HClà[Nh5]Cl, 2)AgCl+2Nh4=[Ag(Nh4)2]Cl, 3)CuSO4+4Nh4= [Cu(Nh4)4]SO4,
4)2KJ+HgJ2= K2[HgJ4], 5)FeCl3+6h3Oà[Fe(h3O)6]Cl3. Комплексные соединения-
соединения, которые образуются без
возникновения новых электронных пар,
а за счет проявления дон.-акц. связи.(см.рис)
BF3+Nh4àBF3Nh4,
B-акцептор, N-донор.Общие св-ва ков.
и дон.-акцепторных связей. Возникают
за счет общих электрон- ных пар. В случае
ковалентной связи все участники
равноправны (каждый участник дает по
1 электрону) , д-а (каждый участник дает
электронную пару).[Cu(Nh4)4]SO4.
Cu-комплексообразователь,
4-координационное число. ( )- внутренняя
сфера, [ ]-внешняя сфера, Nh4-лиганды. Заряд
внутри сферы представляет собой сумму
зарядов центрального иона и заряда
лиганд. В целом заряд нейтрален.Константа нестойкости. Двойные соли.
К4[Fe(CN)6]4=желтая гравитая соль = 4K++ [Fe(CN)6]4-
Комплексный ион
может распадаться на простые соли,
например, [Fe(CN)6]4-=Fe
Kn-
константа нестойкости молекулярного
иона. (-4) (для )
(-4) (для )
Наряду с комплексными соединениями существуют так называемые двойные соли.
K2Al2(SO4)4*24H2O , etc… В отличие от комплексных соединений, у которых очень прочная внутренняя сфера, двойные соли при диссоциации сразу распадаются на простые ионы:K[MgCl3] =K++Mg2++ 3Cl—.
Соляная кислота, HCl, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Кислота HCl (соляная кислота) — структура, свойства и применение
Соляная кислота представляет собой неорганическое соединение, содержащее водород и хлор. Это агрессивная кислота. Соляную кислоту также называют хлористым водородом или соляной кислотой. И соляная кислота, и хлороводород имеют одну и ту же молекулярную формулу HCl , поскольку они представляют собой одно и то же соединение. Однако они различаются по штатам. Хлористый водород встречается в виде газа при комнатной температуре и давлении.
Когда газообразный хлористый водород растворяется в воде, образуется кислота HCl. Итак, чтобы различать их, нижний индекс, изображающий состояние вещества, записывается химической формулой — HCl(g) и HCl(aq) . В следующей статье подробно рассматривается химия HCl.
Структура соляной кислоты – HCL
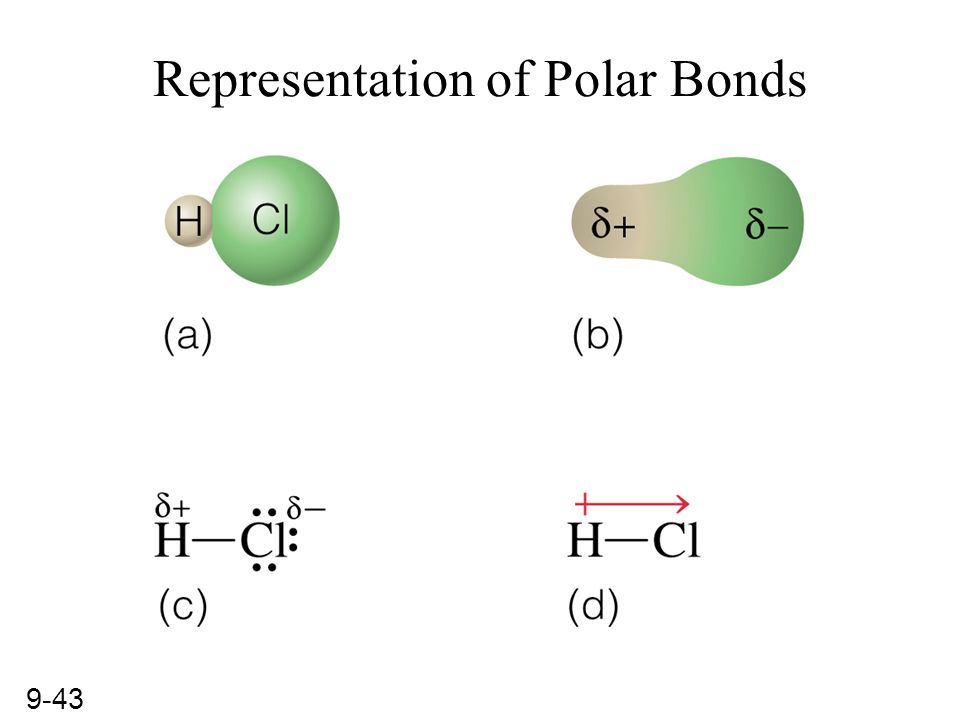
Хлористый водород или соляная кислота представляет собой простую двухатомную молекулу, в которой два атома – водород и хлор – связаны одинарной ковалентной связью.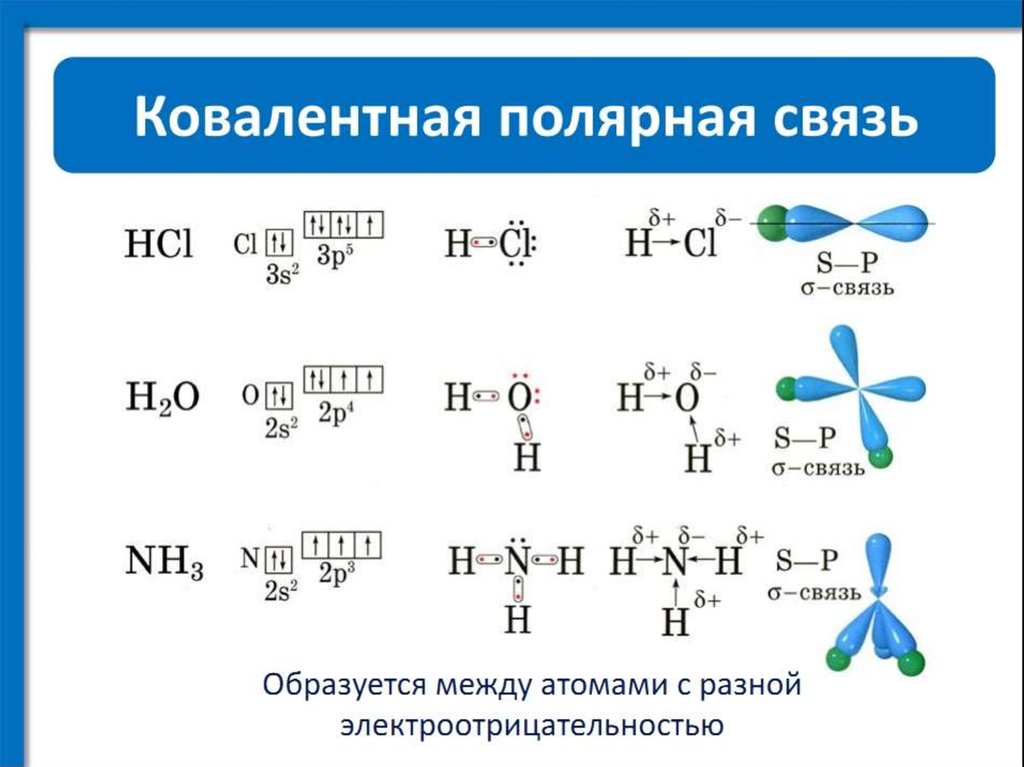 Связь полярная, потому что атом хлора более электроотрицательный, чем атом водорода. В то время как электроотрицательность хлора составляет 3,16, водород имеет электроотрицательность 2,2.
Связь полярная, потому что атом хлора более электроотрицательный, чем атом водорода. В то время как электроотрицательность хлора составляет 3,16, водород имеет электроотрицательность 2,2.
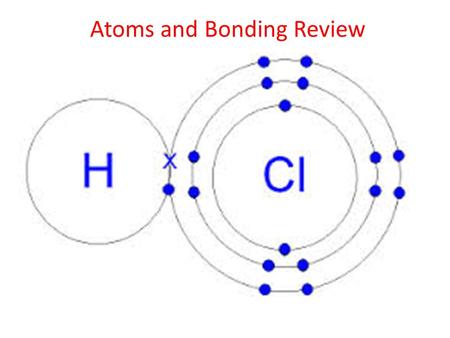
Структура Льюиса соляной кислоты
Соединение содержит
- Один атом водорода и один атом хлора. Он двухатомный.
- Имеет одну одинарную связь или пару связывающих электронов.
- Имеет три пары несвязывающих электронов.
Хлористый водород легко растворяется в воде, потому что:
- И водород, и вода полярны по своей природе из-за разницы в электроотрицательности их атомов.
- HCl обладает способностью диссоциировать на ионы. Итак, молекула воды оттягивает ионы водорода от ионов хлора.
Следующий метод приготовления соляной кислоты популярен в лабораториях, а также для получения хлористого водорода в промышленных масштабах. В этом методе хлорид натрия смешивают с горячей и концентрированной серной кислотой.
NaCl + H 2 SO 4 → NaHSO 4 + HCl
NaHSO 4 + NaCl → Na 2 SO 4 + HCl
Properties of Hydrochloric AcidHydrochloric acid is a strongly acidic, colourless, and viscous liquid with характерный резкий запах. Его отчетливый запах позволяет легко распознать его в лаборатории. HCl используется при обработке кожи и производстве желатина. Большинство физических свойств HCl, таких как плотность, pH, температура плавления и температура кипения, зависят от его молярной концентрации.
Некоторые важные свойства HCl указаны ниже:
- Молекулярный вес/Молярная масса: 36,458 г/моль
- Запах: Резкий запах
- Внешний вид: Прозрачная жидкость
- Точка кипения: зависит от концентрации
- Температура плавления: зависит от концентрации
Химические свойства соляной кислоты
Газообразный хлористый водород легко образует хлориды с активными металлами, их карбонатами, оксидами и гидроксидами.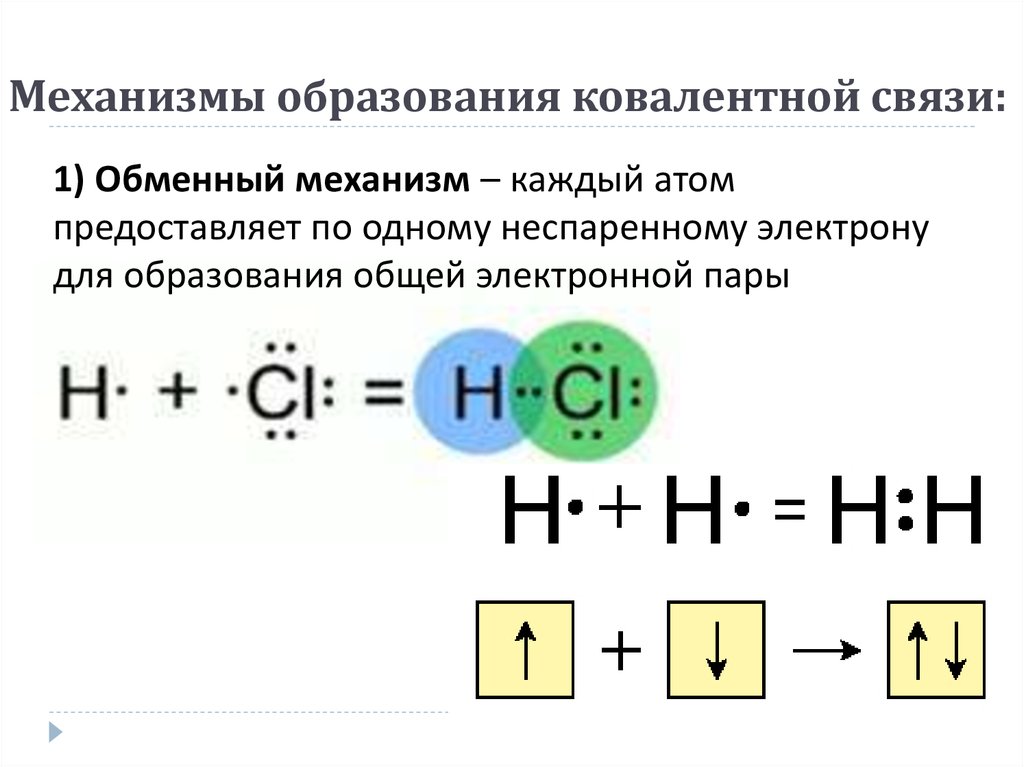 Реакции в основном протекают в присутствии влаги.
Реакции в основном протекают в присутствии влаги.
Реагирует с металлами и вытесняет газообразный водород. При взаимодействии с простыми (металлическими) оксидами и гидроксидами образует хлорид металла и воду – обычная реакция нейтрализации.
Окисление HCl
HCl реагирует с перманганатом калия или дихроматом калия с выделением газообразного хлора.
2kmno 4 + 16 HCl → 2 KCl + 2 Mncl 2 + 5 CL 2 + 8 H 2 O
2K 2 CR 2 2K 2 CR 2 2K 2 0047 O7 + 14 HCl → 2 KCl + 2 CrCl 3 + 3 Cl 2 + 7 H 2 O Соляная кислота реагирует с карбонатами с образованием диоксида углерода. Na 2 CO 3 + 2 HCl → 2 NaCl + H 2 O + CO 2 5. NaHCO 3 + HCl → NaCl + H 2 O + CO 2 Соляная кислота реагирует с сульфитами с образованием сернистого газа. NA 2 SO 3 + 2 HCL → 2 NaCl + H 2 O + SO 2 , когда концентрированная гидрохловая кислота и концентрация HNO 3 4. 1 соотношение, образуется царская водка. Эта смесь может растворять такие металлы, как платина и золото, с образованием соответствующих хлоридов. HCl — сильная кислота. Но что вы подразумеваете под сильной кислотой? Согласно Аррениусу, кислота – это вещество, которое при диссоциации образует ионы водорода или протоны. Легкость и количество высвобождения ионов водорода делают кислоту сильной или слабой. HCl классифицируется как очень сильная кислота, потому что она диссоциирует в воде. HCl + H 2 O → H 3 O + + Cl − Он используется в производстве органических соединений, таких как дихлорметан или винилхлорид, пластмассы, бисфенол А и многое другое. Используется при приготовлении соединений, используемых для очистки воды. Алюминий и соляная кислота находят применение в производстве полиалюминийхлорида (PAC), углевода алюминия и хлорида железа (III) для очистки воды. Также используется при регенерации ионообменных смол. Он также используется для промывки катионов смолы. HCl широко используется для очистки поваренной соли. Кроме того, он также используется для регулирования кислотности (pH) растворов. HCl эффективно регулирует pH пищевых продуктов, фармацевтических продуктов и воды. Служит сильным химическим средством для удаления ржавчины или пятен с железа, меди и других металлов. Однако его разбавленная форма используется для очистки, например, плитки в ванных комнатах и на кухнях. Он также используется в качестве дезинфицирующего средства или в текстильной промышленности для отбеливания одежды, обработки кожи и т.д. HCl используется при добыче нефти. Это порода, которая приводит к образованию крупнопористой структуры из-за реакций, способствующих добыче нефти. Париетальные клетки брюшной полости образуют в организме HCl. В этом процессе используется энергия АТФ для обмена ионов калия, присутствующих в желудке, с ионами водорода париетальных клеток. Следовательно, в просвете желудка присутствуют как ионы водорода, так и ионы хлора. Желудочный секрет состоит из различных ферментов и соляной кислоты. Слизистое покрытие защищает слизистую оболочку желудка от вредного воздействия HCl. HCl в желудке участвует в расщеплении пищи и ее переваривании. Желудочный сок содержит соляную кислоту, которая расщепляет белки. Он также убивает бактерии в желудке и устраняет вирусы, тем самым защищая организм человека от инфекций. Концентрация соляной кислоты в желудке 0,5%. Важно понимать, что соляная кислота, присутствующая в желудке, очень слабая по концентрации, а в лабораториях соляная кислота довольно сильная. Таким образом, нужно быть очень осторожным при использовании соляной кислоты. При попадании на кожу низких концентраций газообразного HCl или соляной кислоты это вызывает эритему и воспаление. Однако высокие концентрации могут привести к химическим ожогам кожи и даже слизистых оболочек при вдыхании. При попадании на кожу концентрированной соляной кислоты необходимо немедленно принять следующие меры: Если вы проглотили соляную кислоту, немедленно обратитесь за медицинской помощью и не вызывайте рвоту, если это не предписано или если вы не находитесь более чем в 15 минутах от больницы (вызывайте рвоту только у человека). В случае контакта с кожей снять всю загрязненную одежду, обувь и аксессуары и немедленно промыть пораженный участок большим количеством воды с мылом. Загрязненную одежду необходимо постирать, прежде чем ее можно будет снова носить. Если ваши симптомы сохраняются, обратитесь к врачу. Соляная кислота – водный раствор хлористого водорода. Это агрессивное, но полезное химическое вещество, которое находит применение в различных отраслях промышленности. HCl естественным образом присутствует в нашем организме в виде желудочного HCl, который имеет концентрацию 0,5%. A. Соляная кислота является сильнодействующим химическим реагентом для производства поливинилхлорида для пластмасс. Он часто используется для очистки и дезинфекции домашних хозяйств. Разбавленная HCl помогает в удалении накипи. A. Сильные основания реагируют с соляной кислотой с образованием соли и воды. Вы можете использовать бикарбонат натрия или пищевую соду в месте разлива соляной кислоты, чтобы нейтрализовать кислоту. Нанесите достаточно пищевой соды до того, как она начнет шипеть. Затем нейтрализованную соляную кислоту можно промыть избыточным количеством воды. A. Тяжелые кислоты полностью диссоциируют на свои ионы. Напротив, слабые кислоты диссоциируют частично. Серная кислота, соляная кислота и азотная кислота являются одними из самых популярных сильных кислот. A. Гидрохлорид – это продукт, получаемый при взаимодействии соляной кислоты с органическим основанием. Органическое основание представляет собой углеводород, который служит основанием или реципиентом протона. Химические ожоги от хлористого водорода могут быть очень тяжелыми при попадании на кожу или другие ткани. Слепота может возникнуть в результате попадания желудочной кислоты в глаза. Концентрация кислоты и то, как долго она остается в контакте с тканями, определяют, насколько серьезными будут ожоги. Соляная кислота или HCl, без сомнения, является очень сильной кислотой. Это бесцветная, едко пахнущая вода на основе хлора, содержащая кислоту. Очень часто возникает путаница в отношении хлористого водорода и соляной кислоты, поскольку HCl является химической формулой обоих. Поэтому крайне необходимо развеять это сомнение, прежде чем переходить к какой-либо новой концепции. Хлористый водород находится в газообразной форме, а соляная кислота — в водной форме. Проще говоря, соляная кислота представляет собой водный раствор хлороводорода с химической формулой HCl. Все остальные вещи такие же, кроме их физического состояния. Интересно знать, что другое название соляной кислоты — соляная кислота. Газообразный хлор (Cl2) и газообразный водород (h3) быстро смешиваются при температуре выше 250℃ с получением HCl h3 HCl быстро диссоциирует на ион гидроксония (h4O+) и хлорид (Cl-). и это делает соляную кислоту сильной кислотой. HCl + h3O ——> h4O+ + Cl- Наряду с указанным выше методом получения HCl существует еще несколько, например:- R-H + Cl2 ——> R-Cl + HCl Лабораторный метод-HCl может быть получен путем реагирования хлорида натрия с серной кислотой или с Nahso4, NaCl +H3SO4-> nahso4 +HCl Гидролиз соединений хлора. Некоторые химически активные соединения хлора, такие как хлорид фосфора, тионилхлориды и ацилхлориды, гидролизуются с образованием HCl в качестве продукта, PCl5 + , есть еще несколько основных вещей о HCl, которые мы должны знать, такие как структура Льюиса, гибридизация и т. д. Итак, давайте попробуем разобраться в этих темах подробно и получить больше знаний об этом соединении! Прежде чем приступить к изучению структуры точек Льюиса HCl, важно знать основы структуры Льюиса. Проще говоря, структура Льюиса — это распределение электронов вокруг атомов, которое помогает нам определить количество и типы связей в соединении. Есть несколько простых шагов, которые мы можем выполнить, чтобы получить структуру точек Льюиса любого соединения. Теперь давайте перейдем к HCl, HCl состоит всего из 2 атомов, поэтому создать для него структуру с точками Льюиса довольно просто! Давайте сначала узнаем общее количество валентных электронов; Хлор, будучи галогеном, нуждается в еще одном электроне, чтобы завершить свой октет. Точно так же водороду требуется еще один электрон, чтобы получить октет, потому что самая внешняя оболочка водорода может содержать до 2 электронов. Таким образом, между двумя атомами образуется одинарная связь, что приводит к образованию ковалентной связи. Изображение, прикрепленное ниже, дает гораздо более четкое представление о вышеупомянутой концепции; Согласно теории VSEPR, HCl имеет линейную молекулярную геометрию/форму и тетраэдрическую электронную геометрию. Валентный угол равен 180°. Приведенная выше схема теории VSEPR ясно показывает, что HCl представляет собой молекулу типа AXE3, где A = центральный атом = Cl здесь Теперь может возникнуть вопрос о разнице между молекулярной геометрией/формой и электронной геометрией. Давайте узнаем, что это за две геометрии! Электронная геометрия учитывает все электронные пары при определении геометрии молекулы. Проще говоря, неподеленные пары учитываются в случае электронной геометрии, но не в случае молекулярной геометрии/формы. Таким образом, мы можем видеть, что при рассмотрении неподеленных пар Cl структура соляной кислоты является тетраэдрической. А когда неподеленными парами пренебрегают, HCl показывает линейную форму. HCl не имеет гибридизации, поскольку HCl является линейной двухатомной молекулой, в которой атом H и атом Cl связаны ковалентно. Так что никакой дополнительной устойчивости не требуется. Будучи двухатомной молекулой, она имеет только один атом в качестве окружающего атома. Таким образом, может быть только одна возможность структуры, и поэтому для этой молекулы не требуется дополнительной стабильности. Гибридизация молекулы может быть предсказана либо по диаграмме теории VSEPR, либо по формуле; Здесь Теперь, если H= 2 = Sp гибридизация Реакция с карбонатами
Реакции с гидрокарбонатами с гидрокарбонатами

Реакция с сульфитами
Формирование акваров
 Таким образом, как донор протонов HCl удовлетворяет всем характеристикам кислоты. Он служит основанием только тогда, когда он является реципиентом протона, а это происходит, когда он реагирует с веществом с более высокой константой диссоциации кислоты или суперкислотой. Водная форма хлористого водорода также является кислой. Реакция диссоциации показана в следующем уравнении:
Таким образом, как донор протонов HCl удовлетворяет всем характеристикам кислоты. Он служит основанием только тогда, когда он является реципиентом протона, а это происходит, когда он реагирует с веществом с более высокой константой диссоциации кислоты или суперкислотой. Водная форма хлористого водорода также является кислой. Реакция диссоциации показана в следующем уравнении: Соляная кислота. не выпущен. Позже, с развитием научных исследований, появились основные промышленные применения, в том числе
Производство органических соединений
Производство неорганических соединений

Для очистки поваренной соли
Удаление металлических пятен
Для добычи нефти
Другое применение
Обнаружена ли соляная кислота в организме человека? 
 Сбалансированный рН желудка составляет около 1,0-2,0. Низкий рН желудка делает его свободным от микробов.
Сбалансированный рН желудка составляет около 1,0-2,0. Низкий рН желудка делает его свободным от микробов.
Безопасность при работе с соляной кислотой  кто в сознании).
кто в сознании). Он используется в производстве желатина, а также в качестве пищевой добавки в пищевой промышленности.
Он используется в производстве желатина, а также в качестве пищевой добавки в пищевой промышленности. Некоторые примеры органических оснований:
Некоторые примеры органических оснований:
5. Опасна ли соляная кислота для человека? HCl Структура Льюиса, молекулярная геометрия и гибридизация

Реакция образования HCl
Метод органического синтеза-
R-Cl + HF ——> R-F +HCL
NaCl +Nahso4 ——-> hcl. + Na2SO4
+ Na2SO4 Структура точек Льюиса HCl

Водород = 1
Хлор = 7
Всего = 8
Молекулярная геометрия HCl
X = атом, связанный с A = H здесь
E = неподеленная пара на A = 3 (Cl имеют 3 неподеленные пары)
Тогда как молекулярная геометрия включает только атомы. Гибридизация HCl
H= гибридизация
V= количество валентных электронов
M= нет. одновалентного атома
одновалентного атома
C= заряд катиона
A= заряд аниона
H= 3 = Sp2 гибридизация
H= 4 = Sp3 гибридизация 7 H= 5 = гибридизация Sp3d
H= 6 = гибридизация Sp3d2
Со всем этим мы можем очень легко найти гибридизацию любой молекулы!
Диаграмма молекулярных орбиталей HCl
Проще говоря, теория молекулярных орбиталей представляет собой образование молекулярных орбиталей путем комбинации атомных орбиталей атомов в молекуле.
Эта теория помогает нам узнать о расположении электронов на орбиталях, а также о порядке связей.
Диаграмма молекулярных орбиталей может быть объяснена как;
Мы можем ясно видеть атомные орбитали H и Cl, а также МО HCl на изображении выше.
Энергия 3s-орбитали хлора намного ниже. Поэтому взаимодействие с 1s-орбиталью водорода невозможно.
Таким образом, 3p-орбиталь (3px, 3py, 3pz) хлора с энергией, сравнимой с энергией 1s-орбитали водорода, смешивается с орбиталью водорода.
Здесь происходит только сигма-перекрытие. Это связано с тем, что, хотя 3p-орбиталь Cl и 1s H объединяются вместе, симметрия обоих различна.
В результате возможно только сигма-перекрытие.
Таким образом, мы видим, что МО HCl имеет 6 пар несвязывающих электронов и одну пару связывающих электронов, которая находится на 𝛔3pz-орбитали.
Кроме того, электроны сигма-связи будут располагаться ближе к Cl из-за его более высокого значения электроотрицательности.
Все эти понятия важны для полного понимания диаграммы молекулярных орбит HCl.
Полярность HCl
Молекула HCl является полярной из-за более высокой электроотрицательности хлора, чем водорода.
Хлор оттягивает основной заряд в сторону и становится отрицательным полюсом, а водород становится положительным. Таким образом, молекула считается полярной молекулой.
Таким образом, молекула считается полярной молекулой.
Для получения более подробной информации необходимо также прочитать статью о полярности HCl.
Физические свойства HCl
Теперь поговорим немного о физических свойствах этого соединения. Молярная масса HCl составляет 36,46 г/моль. Кроме того, HCl имеет очень низкую температуру кипения, то есть -85,05 ℃, а температура плавления составляет -114,2 ℃.
Можно сказать, что свойства могут меняться в зависимости от молярности HCl.
Это соединение находит широкое применение в различных областях, начиная от производства поливинилхлорида для формования пластика в промышленности и заканчивая домашним хозяйством, где разбавленная HCl используется в качестве средства для удаления накипи.
HCl используется при производстве желатина в пищевой промышленности. Он также используется в пищевых добавках и обработке кожи.
Рафинирование металлов, травление стали, производство органических и неорганических соединений, контроль pH – вот еще несколько вариантов использования HCl.

