Строение молекул воды и их ассоциаты
«Мир чарующий и фантастический», — такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
Итак, молекула воды (1H216O) состоит из двух атомов водорода (1H) и одного атома кислорода (16O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
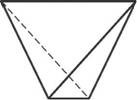
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его – сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, – по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно – в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром -ядром O
Рис. 1.5. Строение молекулы воды
а – угол между связями O-H;
б – расположение полюсов заряда;
в – внешний вид электронного облака молекулы воды.

двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра – протоны – оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким ди-польным моментом – 1,87 дебая1. Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
Дебай – внесистемная единица электрического дипольного 3,33564·1030 Кл·м.
В пресных природных водах – речных, озерных – содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном – 18, а в Красном море – около 40 г/л. В среднем в 1 л океанской воды растворено 34…35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно – натрия и кальция), на 10% – из сульфатов (натрия, калия и магния), на 1% – из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) – до 80%. Сульфатов (натрия, кальция и магния) – около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода – до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты – растворимые соединения типа белков, сахаров, спиртов, углеводородов и т.п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» – ассоциаты. Оказывается, полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (H
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
x·H2O↔ (H2O)x
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес-кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоци-атов (рис. 1.6).
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные рои довольно
стабильного состава. Пространства между ро-ямизаполняютмономерныемолекулыводы.
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподоб-ной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры – нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
Информация о воде: Строение молекулы воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его — сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, — по одному ядру водорода.
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно — в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром — ядром O2-. Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра — ядра O2-. Каждый из оставшихся двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра — протоны — оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким дипольным моментом — 1,87 Дебая (Дебай — внесистемная единица электрического дипольного момента молекул, обозначается Д. 1Д = 1*1018 ед. СГСЭ = 3,33564*10-30 Кл*м.). Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений. Во многом благодаря этому, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
В периодической системе элементов Д.И. Менделеева кислород образует отдельную подгруппу. Она так и называется: подгруппа кислорода.
Входящие в нее кислород, сера, селен и теллур имеют много общего в физических и химических свойствах. Общность свойств прослеживается, как правило, и для однотипных соединений, образованных членами подгруппы. Однако для воды характерно отклонение от правил.
Из самых легких соединений подгруппы кислорода (а ими являются гидриды) вода — легчайшее. Физические характеристики гидридов, как и других типов химических соединений, определяются положением в таблице элементов соответствующей подгруппы. Так, чем легче элемент подгруппы, тем выше летучесть его гидрида. Поэтому в подгруппе кислорода самой высокой должна быть летучесть воды — гидрида кислорода.
Это же свойство очень явственно проявляется и в способности воды «прилипать» ко многим предметам, то есть смачивать их. При изучении этого явления установили, что все вещества, которые легко смачиваются водой (глина, песок, стекло, бумага и др.), непременно имеют в своем составе атомы кислорода. Для объяснения природы смачивания этот факт оказался ключевым: энергетически неуравновешенные молекулы поверхностного слоя воды получают возможность образовывать дополнительные водородные связи с «посторонними» атомами кислорода.
Благодаря поверхностному натяжению и способности к смачиванию, вода может подниматься в узких вертикальных каналах на высоту большую чем та, которая допускается силой тяжести, то есть вода обладает свойством капиллярности.
Капиллярность играет важную роль во многих природных процессах, происходящих на Земле. Благодаря этому вода смачивает толщу почвы, лежащую значительно выше зеркала грунтовых вод и доставляет корням растений растворы питательных веществ. Капиллярностью обусловлено движение крови и тканевых жидкостей в живых организмах.
Самыми высокими оказываются у воды как раз те характеристики, которые должны были бы быть самыми низкими: температуры кипения и замерзания, теплоты парообразования и плавления.
Температуры кипения и замерзания гидридов элементов кислородной подгруппы графически представлены на рис. У самого тяжелого из гидридов h3Te они отрицательны: выше 0 °С это соединение газообразно. По мере перехода к гидридам более легким (h3Se, h3S) температуры кипения и замерзания все более снижаются. Сохранись и далее эта закономерность, можно было бы ожидать, что вода должна кипеть при -70 °С и замерзать при -90 °C. В таком случае в земных условиях она никогда не могла бы существовать ни в твердом, ни в жидком состояниях. Единственно возможным было бы газообразное (парообразное) состояние. Но на графике зависимости температуры неожиданно резкий подъем — температура кипения воды +100 °С, замерзания -0 °C. Это наглядное преимущество ассоциативности — широкий температурный интервал существования, возможность осуществить все фазовые состояния в условиях нашей планеты. Ассоциативность воды сказывается и на очень высокой удельной теплоте ее парообразования. Чтобы испарить воду, уже нагретую до 100 °С, требуется вшестеро больше количества теплоты, чем для нагрева этой же массы воды на 80 °С (от 20 до 100 °С).
Каждую минуту миллион тонн воды гидросферы испаряется от солнечного нагрева. В результате в атмосферу постоянно поступает колоссальное количество теплоты, эквивалентное тому, которое бы вырабатывали 40 тысяч электростанций мощностью 1 млрд. киловатт каждая.
При плавлении льда немало энергии уходит на преодоление ассоциативных связей ледяных кристаллов, хотя и вшестеро меньше, чем при испарении воды. Молекулы Н2O фактически остаются в той же среде, меняется лишь фазовое состояние воды.
Удельная теплота плавления льда более высокая, чем у многих веществ, она эквивалентна расходу количества теплоты при нагреве 1г воды на 80 °С (от 20 до 100 °С). При замерзании воды соответствующее количество теплоты поступает в окружающую среду, при таянии льда — поглощается. Поэтому ледяные массы, в отличие от масс парообразной воды, являются своего рода поглотителями тепла в среде с плюсовой температурой.
Аномально высокие значения удельной теплоты парообразования воды и удельной теплоты плавления льда используются человеком в производственной деятельности. Знание природных особенностей этих физических характеристик иногда подсказывает смелые и эффективные технические решения. Так, воду широко применяют в производстве как удобный и доступный охладитель в самых разнообразных технологических процессах. После использования воду можно возвратить в природный водоем и заменить свежей порцией, а можно снова направить на производство, предварительно охладив в специальных устройствах — градирнях.
Среди необычных свойств воды трудно обойти вниманием еще одно — ее исключительно высокое поверхностное натяжение 0,073 Н/м (при 20 °С). Из всех жидкостей более высокое поверхностное натяжение имеет только ртуть. Оно проявляется в том, что вода постоянно стремится стянуть, сократить свою поверхность, хотя она всегда принимает форму емкости, в которой находится в данный момент. Вода лишь кажется бесформенной, растекаясь по любой поверхности. Сила поверхностного натяжения заставляет молекулы ее наружного слоя сцепляться, создавая упругую внешнюю пленку. Свойства пленки также определяются замкнутыми и разомкнутыми водородными связями, ассоциатами различной структуры и разной степени упорядоченности. Благодаря пленке некоторые предметы, будучи тяжелее воды, не погружаются в воду (например, осторожно положенная плашмя стальная иголка). Многие насекомые (водомерки, ногохвостки и др.) не только передвигаются по поверхности воды, но взлетают с нее и садятся, как на твердую опору. Более того, живые существа приспособились использовать даже внутреннюю сторону водной поверхности. Личинки комаров повисают на ней с помощью несмачиваемых щетинок, а маленькие улитки — прудовики и катушки — ползают по ней в поисках добычи.
Высокое поверхностное натяжение позволяет воде принимать шарообразную форму при свободном падении или в состоянии невесомости: такая геометрическая форма имеет минимальную для данного объема поверхность.
Строение молекулы воды
К.х.н. О.В. Мосин
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В АНАЛИЗЕ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ
Если нам захочется посмотреть, как устроена молекула воды, то придется в первую очередь вспомнить ее состав. Молекула воды состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода H2O (формула воды). В молекуле воды главное действующее лицо — атом кислорода. Вспомним его энергетическую диаграмму (рисунок слева):
Два неспаренных р-электрона атома кислорода О очень реакционноспособны. Они всегда готовы образовать химические связи с двумя s-электронами атомов водорода.
Рис. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода (рисунок справа):
Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды которую можно условно изобразить еще так:
Рис. Молекула воды имеет угловую форму (ниже слева)
Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород — кислород не прямой (90°), а немного больше — 104,5°. Химические связи эти полярные: кислород гораздо электроотрицательнее водорода и подтягивает к себе электронные облака, образующие химические связи. Вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода — положительный. Поэтому и вся молекула воды тоже попадает в отряд «химических полярников» — веществ, молекулы которых представляют собой электрические диполи.
Строение молекулы воды Н2О можно проанализировать с помощью метода молекулярных орбиталей (МО). Схема молекулярных орбиталей молекулы воды приведена ниже.
Рис. Схема расположения координатных осей (а) и энергетическая диаграмма орбиталей молекулы Н2О (б).
Для построения схемы молекулярной орбитали молекулы воды Н2О совместим начало координат с атомом кислорода, а атомы водорода расположим в плоскости xz (Подробнее см. Г.Грей «Электроны и химическая связь»,М., изд-во «Мир», 1967, с.155-62 и G.L.Miessier, D.A.Tarr, «Inorganic Chemistry», Prantice Hall Int.Inc., 1991, p.153-57).
В формировании суммарной молекулярной орбитали воды принимают участие отдельные атомные орбитали водорода и кислорода, обладающие одинаковой симметрией и близкими энергиями. Однако вклад атомных орбиталей атомов водорода и кислорода в образование общей молекулярной орбитали молекулы воды разный, что отражается в разных величинах коэффициентов в соответствующих линейных комбинациях атомных орбиталей. Взаимодействие (перекрывание) 1sатомной орбитали водорода, 2sи 2рzатомной орбитали кислорода приводит к образованию 2a1-связывающей и 4a1-разрыхляющей молекулярной орбиталей.
Рис. Перекрывание 2s(а), 2px- (б) и 2pя(в) орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
Из этих данных и умозаключений можно сделать следующие выводы.
1. Молекула Н2О диамагнитна.
2. Электроны на связывающих 2а1 и 1b1 орбиталях обеспечивают связи ОН, а на несвязывающих (3а1 и 1b2) орбиталях соответствуют свободным электронным парам в молекуле Н2О, как это описывается в рамках метода валентных связей.
3. Принципиальным отличием метода молекулярных орбиталей от метода валентных связей является разная энергия ионизации занятых молекулярных орбиталей, составляющая (в эВ) 27.3 (2а1), 16.2 (1b1), 14.5 (3а1) и 12.6 (1b2), соответственно.
4. Метод молекулярных связей (в отличие от метода валентных связей) позволяет оценить разницу в энергиях молекулярных орбиталей. В частности, существенным является различие в энергии двух несвязывающих орбиталей 3а1 и 1b2. Это связано с различной природой орбиталей — 1b2 локализована на атоме кислорода, тогда как 3а1 образована с участием атомной орбитали водорода и кислорода и не является локализованной. Локализация электронов на 1b2 молекулярной орбитали приводит к тому, что отрицательный заряд в молекуле Н2О сосредоточен вблизи атома кислорода, а положительный — вблизи атомов водорода. Таким образом, молекула Н2О оказывается полярной (дипольный момент μ = l. q = 1.84D). Это соответствует и простым соображениям электроотрицательности: связывающие электроны смещаются к более электроотрицательному атому.
Так как у молекулы Н2О в образовании связей принимают в основном участие 2р-орбитали кислорода и 1s-орбитали водорода, то можно ожидать, что угол НО- Н должен быть близким к 90о. Однако из эксперимента следует, что этот угол равен 104.5о. Причина такого различия заключается в том, что этот угол соответствует минимуму энергии. Согласно квантово-механическим расчетам, энергия молекулы зависит не только от энергии молекулярных орбиталей и числа электронов на них, но и от валентного угла НО- Н. В приближении метода валентных связей увеличение угла НО- Н от 90о (характерного для взаимодействия р-орбиталей) до 104.5о связано с взаимным отталкиванием положительно заряженных атомов водорода.
При переходе от Н2О к другим двухатомным молекулам Н2S, H2Se и H2Te диаграммы молекулярных орбиталей изменяются, что обусловлено увеличением энергий исходных АО халькогенов: Е3s = -20.7 эВ; Е3р = -12.0 эВ; Е4s = 20.8 эВ; Е4р = 11.9 эВ. Поэтому растет участие ns-атомных орбиталей халькогена в образовании молекулярных орбиталей. При этом несвязывающий характер орбиталей nb2 сохраняется, а связывающий характер орбиталей 2а1 усиливается. В целом, по мере увеличения энергии атомных орбиталей nsи nруменьшается разность сумм энергий молекулярных и атомных орбиталей, которые характеризуют прочность молекул Н2Э. Вклады nратомных орбиталей атомов халькогенов в энергию молекулярной орбитали уменьшаются, и соответственно понижается локализация электронов на атомах и полярность молекул. Вероятно, благодаря этому уменьшаются валентные углы НЭ- Н в молекулах халькогенов. Именно так, с точки зрения теории молекулярных орбиталей, объясняется понижение устойчивости молекул H2S, H2Sе, H2Te по сравнению с молекулой Н2О.
К.х.н. О.В. Мосин
Строение молекул воды и их ассоциаты
разное
«Мир чарующий и фантастический», — такими словами лауреат Нобелевской премии Альберт Сент-Дьердьи характеризует ощущения исследователя, изучающего структуру воды. Результаты тем сильнее впечатляют, что очень уж обычен сам объект изучения.
Итак, молекула воды (1h316O) состоит из двух атомов водорода (1H) и одного атома кислорода (16O). Оказывается, что едва ли не все многообразие свойств воды и необычность их проявления определяется, в конечном счете, физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
В отдельно рассматриваемой молекуле воды атомы водорода и кислорода, точнее их ядра, расположены так, что образуют равнобедренный треугольник. В вершине его — сравнительно крупное кислородное ядро, в углах, прилегающих к основанию, — по одному ядру водорода. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.5.
В соответствии с электронным строением атомов водорода и кислорода молекула воды располагает пятью электронными парами. Они образуют электронное облако. Облако неоднородно — в нем можно различить отдельные сгущения и разрежения. У кислородного ядра создается избыток электронной плотности. Внутренняя электронная пара кислорода равномерно обрамляет ядро: схематически она представлена окружностью с центром — ядром O2- (рис. 1.5а). Четыре внешних электрона группируются в две электронные пары, тяготеющие к ядру, но частично не скомпенсированные. Схематически суммарные электронные орбитали этих пар показаны в виде эллипсов, вытянутых от общего центра — ядра O2-. Каждый из оставшихся
А — угол между связями O—H;
Б — расположение полюсов заряда;
|
Рис. 1.5. Строение молекулы воды |
В — внешний вид электронного облака молекулы воды.
Двух электронов кислорода образует пару с одним электроном водорода. Эти пары также тяготеют к кислородному ядру. Поэтому водородные ядра — протоны — оказываются несколько оголенными, и здесь наблюдается недостаток электронной плотности.
Таким образом, в молекуле воды различают четыре полюса зарядов: два отрицательных (избыток электронной плотности в области кислородного ядра) и два положительных (недостаток электронной плотности у двух водородных ядер). Для большей наглядности можно представить, что полюса занимают вершины деформированного тетраэдра, в центре которого находится ядро кислорода (рис. 1.5б).
Общий вид электронного облака молекулы воды показан на рис. 1.5в.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула воды является миниатюрным диполем с высоким ди — польным моментом — 1,87дебая1. Под воздействием диполей воды в 80 раз ослабевают межатомные или межмолекулярные силы на поверхности погруженного в нее вещества. Иначе говоря, вода имеет высокую диэлектрическую проницаемость, самую высокую из всех известных нам соединений.
Во многом благодаря этому, вода проявляет себя как универсальный растворитель. Ее растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
Постоянно соприкасаясь со всевозможными веществами, вода фактически всегда представляет собой раствор различного, зачастую очень сложного состава.
Даже из свежевыпавшей дождевой воды можно выделить различные минеральные и органические вещества, растворенные в ней (до нескольких десятков миллиграммов на литр).
В пресных природных водах — речных, озерных — содержание растворенных веществ обычно не превышает 1 г/л. От нескольких единиц до десятков граммов на литр колеблется содержание солей в морской воде: например, в Балтийском море их не более 5 г/л, в Черном — 18, а в Красном море — около 40 г/л. В среднем в 1 л океанской воды растворено 34…35 г солей. Общее количество их настолько велико, что, выделенные из воды, они покрыли бы поверхность земного шара слоем стометровой толщины.
Солевой состав речных и морских вод различен не только количественно, но и качественно. На 89% морские соли состоят из хлоридов (преимущественно — натрия и кальция), на 10% — из сульфатов (натрия, калия и магния), на 1% — из карбонатов (натрия и кальция), а также незначительных количеств других солей. В пресных водах набор минеральных примесей выглядит иначе. Больше всего здесь карбонатов (натрия и кальция) — до 80%. Сульфатов (натрия, кальция и магния) — около 13%. Остальные 7% приходятся на хлориды (натрия и кальция) и другие соли.
Из газов в пресных и морских водах наиболее широко представлены кислород, азот, углекислый газ, сероводород. В чистых холодных истоках горных рек содержание кислорода может достигать 6 мг/л. В глубинных слоях Черного моря высока концентрация сероводорода — до 100 мг/л. Этот ядовитый газ присутствует и в нижних слоях некоторых озер.
В пресных и морских водах в небольших количествах имеются и разнообразные органические компоненты — растворимые соединения типа белков, сахаров, спиртов, углеводородов и т. п. Это продукты жизнедеятельности и распада животных и растительных организмов, населяющих водоемы и их берега, а также отходы промышленности и сельского хозяйства.
Дебай — внесистемная единица электрического дипольного момента молекул, обозначается Д. 1Д = 1-10 ед. СГСЭ = 3,33564-10-» Кл-м. |
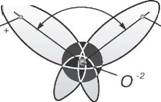
Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества»
^ Кислород J Водород
— Химическая связь Водородная связь
|
Рис. 1.6. Схема объединения молекул воды
— ассоциаты. Оказывается, полностью соответствует формуле Н20 лишь вода, находящаяся в парообразном состоянии. Это показали результаты определения молекулярной массы водяного пара. В температурном интервале от 0 до 100°С концентрация отдельных (мономерных молекул) жидкой воды не превышает 1%. Все остальные молекулы воды объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой (h30)x.
Непосредственной причиной образования ассоциатов являются водородные связи. Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа. Возникновение и распад ассоциатов можно выразить схемой:
X h3O ~ (h30)x
Поскольку электронные орбитали в каждой молекуле воды образуют тетраэдричес — кую структуру, водородные связи могут упорядочить расположение молекул воды в виде тетраэдрических координированных ассоци — атов (рис. 1.6).
Возможны и другие модели водной структуры. Тетраэдрически связанные молекулы воды образуют своеобразные рои довольно стабильного состава. Пространства между роями заполняют мономерные молекулы воды.
Исследователи раскрывают все более тонкие и сложные механизмы «внутренней организации» водной массы. Кроме льдоподоб — ной структуры, жидкой воды и мономерных молекул, описан и третий элемент структуры — нететраэдрической.
Определенная часть молекул воды ассоциирована не в трехмерные каркасы, а в линейные кольцевые объединения. Кольца, группируясь, образуют еще более сложные комплексы ассоциатов.
Изучение структуры жидкой воды еще не закончено; оно дает все новые факты, углубляя и усложняя наши представления об окружающем мире. Развитие этих представлений помогает нам понять многие аномальные свойства воды и особенности взаимодействия ее, как растворителя, с другими веществами.
+7 908 128-88-81 Алексаей г.Курск вся история переписки с вацапа и вайбера: [14:45, 30.12.2019] +7 908 128-88-81: С наступающим [14:45, 30.12.2019] +7 908 128-88-81: Возможно сделать хон под диаметр 38-68? …
С каждым годом становится всё популярнее здоровый стиль жизни. Люди бросают курить, начинают заниматься спортом, подсчитывают калории в продуктах, которые употребили за день, контролируют лишний вес. Существует ряд видов спорта …
Строение молекулы и свойства воды, Взаимодействие воды с группами
Строение молекулы и свойства воды, Взаимодействие воды с растворенным веществом
Аномальные свойства воды предполагают существование прочных сил между молекулами воды. Это можно объяснить уже при рассмотрении природы единичной молекулы воды, а затем и группы молекул.
Молекула воды имеет два отрицательных и два положительных заряда по углам тетраэдра. Вследствие этого, каждая молекула воды тетраэдрически координирована с четырьмя другими молекулами воды благодаря водородным связям (см. рис.)
Одновременное присутствие в молекуле воды двух доноров и двух акцепторов делает возможной ассоциацию в трехмерную сеть, стабилизированную водородными связями, что обеспечивает большую силу взаимодействия между молекулами. Эта структура объясняет особые физические свойства воды, необычные для малых молекул.
Способность воды образовывать трехмерные водородные связи, для разрушения которых необходима дополнительная энергия, объясняет рассмотренные выше необычные свойства воды, например высокие значения теплоемкости, точек плавления и кипения, поверхностного натяжения и теплот фазовых переходов.
С химической точки зрения вода является весьма реакционноспособным веществом. Она соединяется со многими оксидами металлов и неметаллов, взаимодействует с активными металлами и вступает в различные другие реакции самого разнообразного характера.
Превращения белков, липидов, углеводов с участием воды имеют важное значение в пищевых технологиях.
Помимо химических реакций, в которые вступает вода, при растворении веществ в воде имеют место взаимодействия физико-химического характера.
При добавлении различных веществ к воде изменяются свойства как самого вещества, так и воды. Гидрофильные вещества взаимодействуют с водой путем ион-дипольного или диполь-дипольного механизма, вызывая изменения в структуре воды, ее подвижности, а также в структуре и реакционной способности гидрофильных веществ. Гидрофобные группы добавленных веществ взаимодействуют с близлежащей водой слабо, предпочитая неводное окружение. Молекулы около гидрофобных групп становятся более упорядоченными, что приводит к уменьшению энтропии. Чтобы уменьшить контакт с водой, гидрофобные группы агрегируются.
Взаимодействие воды с ионами и ионными группами
Вода, взаимодействующая с ионами и ионными группами, является наиболее прочно связанной в пищевых продуктах. Нормальная структура чистой воды (основанная на водородных связях тетраэдрическая конфигурация) нарушается при добавлении диссоциирующих веществ. Для простых неорганических ионов, которые не обладают донорными или акцепторными местами для образования водородных связей, связь просто полярна. Простейший пример – гидратированные ионы хлорида натрия. Вода в мультислое существует в структурно разрушенном состоянии из-за конкурирующего влияния, с одной стороны, монослоя, с другой – внешней массы воды.
Способность ионов изменять структуру воды тесно связана с силой электрического поля иона. Малые и (или) многовалентные (главным образом, положительные) ионы, такие как Li+, Na+, h4O+, Ca2+, Ba2+, Mg2+, Al3+, F-, OH- имеют сильное электрическое поле и являются образователями сетчатой структуры. Около каждого из этих ионов расположено от 4 до 6 молекул воды. Связанная вода менее лабильна и обладает более плотной структурой по сравнению с чистой водой.
Большие и моновалентные ионы (главным образом, отрицательно заряженные ионы и большие положительные ионы), такие как K+, Cs+, Nh5+, Cl-, Br-, I-, NO3-, BrO3-, IO3- и ClO4-, имеют относительно слабое электрическое поле и являются разрушителями сетчатой структуры, хотя для К+ этот эффект очень слаб.
Благодаря различной способности ионов гидратироваться, изменять водную структуру, влиять на диэлектрическую постоянную водной среды и толщину двойного электрического слоя около коллоидов, они сильно воздействуют на суспендированные и другие растворенные вещества в среде. Поэтому, например, конформация белков и стабильность коллоидов сильно зависят от вида и количества присутствующих ионов.
Взаимодействие воды с нейтральными группами
Взаимодействие воды с нейтральными группами, обладающими способностью образовывать водородные связи.
Водородные связи вода – растворенное вещество являются более слабыми, чем при вода – ион взаимодействиях. Тем не менее, вода, связанная посредством водородных связей с растворенным веществом, может быть классифицирована как «органически связанная» или «близлежащая» и должна проявлять пониженную подвижность по сравнению с водой в массе раствора (водной фазы).
Можно ожидать, что вещества, способные к образованию водородных связей, не повышают или, по крайней мере, не разрушают нормальную структуру чистой воды. Однако в ряде случаев отмечается ориентация водородных связей, отличная от нормальной воды.
Водородные связи воды образуются с различными группами (гидроксил-, амино-, карбонил-, амид- или имино-). Например, вода образует водородные связи с двумя видами функциональных групп белков. Эти связи могут быть как в одной макромолекуле между различными группами, так и между разными макромолекулами:
Взаимодействия, вода – неполярное вещество
В системе вода — неполярное вещество важны два аспекта структурных образований: образование клатратных гидратов и гидрофобные взаимодействия в белках.
Клатратные гидраты являются соединениями включения, то есть это соединения, имеющие молекулу – «хозяина», образующуюся за счет водородных связей, и молекулу – «гостя». Образования такого типа имеют место в биологических материалах.
«Гости» в клатратных гидратах являются низкомолекулярными соединениями, а «хозяин» представляет собой «сетку» из 20-74 водных молекул.
Типичные «гости» – это низкомолекулярные углеводороды, галогенуглеводороды, диоксид углерода, этиленоксид, этиловый спирт, короткоцепочные первичные, вторичные и третичные амины, алкил-аммоний. Взаимодействие между водой и «гостем» часто обусловлено слабыми Ван-дер-ваальсовыми силами, но может иметь место и электростатическое взаимодействие.
Клатратные гидраты имеют важное значение, т.к. влияют на конформацию, реакционноспособность и стабильность таких молекул, как белки.
Гидрофобные взаимодействия в водном окружении также важны, так как примерно 40% общих аминокислот в большинстве белков имеют неполярные группы. Неполярные группы других компонентов, таких как спирты, жирные кислоты, свободные аминокислоты, также могут участвовать в гидрофобных взаимодействиях. Эти взаимодействия являются слабыми, по силе они примерно такие же, как силы Ван-дер-Ваальса. Гидрофобные взаимодействия важны для четвертичной структуры многих белков, поэтому вода (и водная структура) играет важную роль в конформации белка.
Молекулы воды строение — Справочник химика 21
С позиций теории молекулярных орбиталей строение молекулы Н2О можно объяснить следующим образом. Взаимное расположение атомов водорода и кислорода в молекуле воды можно представить с.хемой [c.312]
Растворы солей хрома (III) обычно имеют сине-фиолетовым цвет, но при нагревания становятся зелеными, а спустя некоторое время после охлаждения снова приобретают прежнюю окраску. Это изменение окраски объясняется образованием изомерных гидратов солей, представляющих собой комплексные соединения, в которых все или часть молекул воды координационно связаны во внутренней сфере комплекса. В некоторых случаях такие гидраты удалось выделить в твердом виде. Так, кристаллогидрат хлорида хрома (JII) r ls- HjO известен в трех изомерных формах в виде сине-фиолетовых, темно-зеленых н светло-зеленых кристаллов одинакового состава. Строение тих изомеров можно установить на основании различного отношения их свежеприготовленных растворов к нитрату серебра. При действии последнего на раствор сине-фиолетового [c.655]
Эти выводы о взаимном расположении атомов в молекулах N 1.1 и Н О соответствуют действительности. Значител[>пая полярносп. молекул воды ((1= 1,84 0) и аммиака ( 1=1,48 0), а также данные структурных исследований, свидетельствуют о том, что молекула Н2О имеет угловое строение, а молекула ЫНз построена в форме пирамиды. Однако углы между связями (валентные углы) отличаются от 90° в молекуле воды угол НОН составляет 104,3°, а в молекуле аммиака угол НЫН равен 107,8°. [c.135]
Рассмотрим направленность ковалентных связей в молекуле воды. Строение электронной оболочки атома кислорода, входящего в состав молекул воды, выражается формулой [c.52]
Рнс. 2.1. Строение молекулы воды [c.58]
На некотором малом расстоянии от поверхности полимера, где на раствор влияет силовое поле мембраны, слой, находящийся в термодинамически менее выгодном состоянии, стремится к достижению устойчивого состояния, т. е. к полной или же к максимально возможной компенсации межмолекулярных сил. В данном случае это достигается в результате преимущественной сорбции молекул неполярных веществ на полимере. Следовательно, слой связанной жидкости и в этом случае также состоит как из молекул воды, так и из молекул растворенного вещества. Однако в этом слое, в отличие от связанного слоя водных растворов полярных веществ, компоненты сильно отличаются по подвижности, что обусловлено их свойствами, размером, молекулярным строением, а также природой межмолекулярных сил связи с полимером. При этом менее подвижными становятся молекулы неполярных веществ. [c.220]
Молекула воды нмеет угловое строение входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине — ядро атома кислорода. Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода [c.206]
Чаще всего встречаются координационные числа 2, 3, 4 и 6 (табл. 1-6). Ион или молекула с центральным атомом, имеющим координационное число 2, может иметь линейное строение (как диоксид.углерода, О—С—О, в котором атомы расположены на одной прямой) либо изогнутое строение, как молекула воды, Н О. Возможные структуры ионов или молекул с координационными числами 3, 4 и 6 показаны на рис. 1-6. [c.34]
Как видно из формулы, молекула образующегося полимера состоит из многократно повторяющихся остатков е-капроновой кислоты, а связи между остатками возникают в результате отщепления молекул воды. Строение полученного полимера можно выразить формулой [c.378]Точность приближенных расчетов оценивается мерой их совпадения с экспериментально полученными сведениями о строении вещества и его свойствах. Результат одного из приближенных расчетов для молекулы воды показан на рис. 19. Контурные линии соединяют места одинаковой электронной плотности. [c.42]
Таким образом, молекула воды имеет угловую форму (рис. 19). Для наглядности можно принять, что в ней две химические связи О—Н (длиной он = 0,096 нм), расположенные под углом НОН = ==104,5 . Строение молекулы воды можно выразить следующей структурной формулой [c.42]
Для описания структуры граничных слоев воды была предложена [71] модель анизотропных доменов, размеры которых вдоль осей а ъ Ь (вдоль плоских поверхностей частиц слоистых силикатов) существенно больше, чем вдоль оси с (перпендикулярно поверхности пластинчатых частиц). Такое строение граничных слоев позволяет объяснить, с одной стороны, их повышенную вязкость (при приложении внешней нагрузки текут не индивидуальные молекулы, а домены), а с другой,— меньшее число водородных связей, в которых участвует каждая молекула воды (этот вы
Вода. Химические свойства. Природа межмолекулярных водородных связей. Аномальные свойства воды. Строение молекулы воды. Молекула воды
Покольку вода является универсальным растворителем, рассмотрим свойства воды. Самое распространенное вещество на земле – это вода. Почти 3\4 поверхности земного шара покрыта водой. Она является средой в которой протекают химические процессы в живых организмах и сама же участвует в биохимических процессах.
Вода главный катализатор всех жизненных процессов. Наш организм на 65-75% состоит из воды. Суточная потребность человека в воде составляет от 2 до 6 л и зависимость от нее намного сильнее чем от пищи. Многие пищевые продукты (овощи, фрукты, молоко, мясо) на 95-65% состоят из воды. Человечество широко использует для своих нужд природную воду. Основная часть воды приходится на Мировой океан. Запасы пресной воды, доступной для использования, составляют 0,15% объема гидросферы.
Физические свойства. Это жидкость без цвета и запаха. Рассмотрим особенности физико- химических свойств (аномалии) воды.
1. У воды аномально высокая полярность как растворителя.
µ = 1,84·10-29Клм (у Н2S — µ = 0,93·10-29Клм).
2. Вода имеет аномально высокую теплоемкость с = 75,3 Дж/моль К, у спирта в 1.5 раза больше, поэтому в ночное время и при переходе от лета к зиме она остывает медленно, а при обратном переходе нагревается медленно, т.о. регулируя температуру на земном шаре. При нагревании любого вещества кроме воды от 0 до 37оС теплоемкость увеличивается, а у воды уменьшается, далее увеличивается. Именно при 37оС организм затрачивает меньше энергии для поддержания температуры тела.
3. Аномально высокие температура Тпл = 0оС и температура Ткип = 100оС по сравнению с аналогами.
4. При 0оС вода замерзает. Плотность льда меньше чем у воды. При этом объем льда увеличивается на 9% .У других веществ уменьшается.
5. Плотность воды при переходе из твердого состояния в жидкое не уменьшается, а увеличивается. При нагревании воды от 0 до 4оС ее плотность также увеличивается. Плотность воды достигает максимального значения при 4оС — ρ = 0,998г/см3 .
Аномалии связаны со строением молекулы воды и образованием водородной связи между ними.
Молекула воды имеет угловое строение. Атом кислорода в молекуле воды находится в состоянии sp3- гибридизации. Поэтому валентный угол близок к тетраэдрическому (109о28′).
Образование водородной связи приводит к ассоциации молекул. Каждый атом кислорода участвует в образовании двух водородных связей. Молекулы при кристаллизации образуют слои, причем каждая связана с тремя молекулами в этом слое и с одной из соседнего. Это приводит к образованию пустот.
При плавлении льда разрушается лишь часть водородных связей и объем воды уменьшается. При 0оС вода содержит остатки структуры льда. От 0 до 4оС плотность воды увеличивается за счет разрушения льда.
Высокая теплоемкость воды объясняется затратой тепла на разрыв водородных связей.
Химические свойства. Молекула Н2O устойчива к нагреванию. При температуре выше 1000оС она подвергается термической диссоциации, т.е. разложению
Н2O ↔ 2 Н2 + О2
Этот процесс протекает с поглощением тепла.
Вода очень реакционноспособное вещество. Оксиды многих металлов и неметаллов соединяются с Н2O образуя:
СаО + Н2O = Са(ОН)2
SО3 + Н2O = Н2SО4
Активные металлы реагируют с водой с выделением Н2.
Вода образует соединения с веществами не обладающими химической активностью (гидрат ксенона – Хе6Н2O). Хе заполняет межмолекулярное пространство в структуре Н2O, образуя соединения, которые называются клатратами.
В аквакомплексах лигандами является h3O. Вода по классификации Льюиса является ДЭП (донором электронных пар), т.к. у атома кислорода в молекуле h3O есть 2 неподеленные электронные пары. За счет одной из них атом кислорода координируется к катиону металла.
Пероксид водорода. Состав и строение молекулы. Пероксиды. Надкислоты и надоснования. Получение пероксида водорода. Химические свойства. Окислительно-восстановительные свойства пероксидов. Пероксопроизводные d-элементов в высших степенях окисления. Их особенности.
Перокси́д водоро́да (перекись водорода), h3O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид
водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата h3O2•2h3O.
Состав и строение молекулы. Молекула Н2O2 содержит в своем составе пероксидный анион O2-2 . Каждый атом кислорода образует 2 ковалентные связи, но имеет степень окисления, равную -1. В упрощенном виде строение молекулы отражает графическая формула:
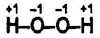
Физические свойства. В чистом безводном виде Н2O2 — бесцв. сиропообразная жидкость с плотностью 1,45 г/см3 (т. пл. -0,41°С, т. кип. 150,2°С). Смешивается с водой в любых соотношениях, растворяется также в спирте, эфире. 30%-ный р-р Н2O2 называют пергидролем. Подобно воде, Н2O2 — хороший полярный растворитель, в котором вещества с ионной и полярной ковалентной связью диссоциируют на ионы.
Химические свойства. Разложение Н2O2 (диспропорционирование)
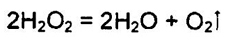
При Т > 90° С пероксид водорода разлагается практически полностью. Причиной непрочности молекул Н2O2 является неустойчивость атома кислорода в степепени окисления -1.
Вода и ее структура
↑ [изображение] Примечание: в этом документе будет напечатано в соответствующим образом измененном формате (14 страниц)
Молекула воды
Молекула представляет собой совокупность атомных ядер и электронов , которая достаточно стабильна, чтобы обладать наблюдаемыми свойствами — и есть несколько молекул, которые более стабильны и трудны для разложения, чем H 2 O.В воде каждое ядро водорода связано с центральным атомом кислорода парой электронов, общих между ними; химики называют эту общую электронную пару ковалентной химической связью. В H 2 O только два из шести электронов кислорода внешней оболочки используются для этой цели, оставляя четыре электрона, которые организованы в две несвязывающие пары. Четыре пары электронов, окружающие кислород, стремятся располагаться как можно дальше друг от друга, чтобы минимизировать отталкивание между этими облаками отрицательного заряда.Обычно это приводит к тетраэдрической геометрии, в которой угол между электронными парами (и, следовательно, валентный угол H-O-H ) составляет 109,5 °. Однако, поскольку две несвязывающие пары остаются ближе к атому кислорода, они оказывают более сильное отталкивание по отношению к двум ковалентным парам связи, эффективно сближая два атома водорода. В результате получается искаженное тетраэдрическое расположение, в котором угол H-O-H равен 104,5 °.
Хотя молекула воды не несет общего электрического заряда, ее восемь электронов распределены неравномерно; у кислородного конца молекулы немного больше отрицательного заряда (фиолетовый), а у водорода — компенсирующего положительного заряда (зеленый).Получающаяся в результате полярность в значительной степени отвечает за уникальные свойства воды.
Поскольку молекулы меньше световых волн, их нельзя наблюдать напрямую, и их необходимо «визуализировать» альтернативными способами. Это изображение, созданное компьютером, получено в результате расчетов, моделирующих распределение электронов в молекуле H 2 O. Внешняя оболочка показывает эффективную «поверхность» молекулы, определяемую размером облака отрицательного электрического заряда, созданного восемью электронами.
Дополнительную информацию об этой модели см. На сайте SBU Water Site.
Водородная связь
Молекула H 2 O электрически нейтральна, но положительный и отрицательный заряды распределены неравномерно. Это иллюстрируется градацией цвета на схематической диаграмме. Электронный (отрицательный) заряд концентрируется на кислородном конце молекулы, частично из-за несвязывающих электронов (сплошные синие кружки), а также из-за высокого ядерного заряда кислорода, который сильнее притягивает электроны.Это смещение заряда представляет собой электрический диполь , представленный стрелкой внизу; вы можете думать об этом диполе как об электрическом «изображении» молекулы воды.
Как мы все в школе учили, противоположные заряды притягиваются, поэтому частично положительный атом водорода на одной молекуле воды электростатически притягивается к частично отрицательному кислороду на соседней молекуле. Этот процесс называется (несколько ошибочно) водородными связями . Обратите внимание, что водородная связь (показана пунктирной зеленой линией) несколько длиннее, чем ковалентная связь O-H.Это означает, что значительно слабее ; на самом деле она настолько слаба, что данная водородная связь не может существовать дольше, чем крошечная доля секунды.
Подробнее о водородных связях см. Здесь.
Аномальные свойства воды
Давно известно, что вода проявляет множество физических свойств, которые отличают ее от других небольших молекул сопоставимой массы. Химики называют это «аномальными» свойствами воды, но они ни в коем случае не являются загадочными; все это вполне предсказуемые последствия того, как размер и ядерный заряд атома кислорода искажают облака электронных зарядов атомов других элементов, когда они химически связаны с кислородом.
Вода — одно из немногих известных веществ, твердая форма которого менее плотна, чем жидкость. График справа показывает, как объем воды изменяется в зависимости от температуры; большое увеличение (около 9%) при замерзании показывает, почему лед плавает на воде и почему трубы лопаются при замерзании. Расширение от –4 ° до 0 ° связано с образованием более крупных агрегатов с водородными связями. Выше 4 ° наступает тепловое расширение, поскольку колебания связей О-Н становятся более сильными, стремясь отодвинуть молекулы дальше друг от друга.
Другое широко упоминаемое аномальное свойство воды — это высокая точка кипения . Как видно из этого графика, такая легкая молекула, как H 2 O, «должна» закипать при температуре около –90 ° C; то есть, он существовал бы в мире в виде газа, а не жидкости, если бы водородных связей не было. Обратите внимание, что водородная связь также наблюдается с фтором и азотом.
«Сорок одна аномалия воды» — некоторые из них довольно загадочные
Поверхностное натяжение и смачивание
Вы когда-нибудь наблюдали, как насекомое бродит по поверхности пруда? Водомер использует преимущество того факта, что поверхность воды действует как эластичная пленка, которая сопротивляется деформации, когда на нее помещается небольшой груз.(Если вы будете осторожны,
.Определение, преимущества, исследования и многое другое
Структурированная вода, иногда называемая намагниченной или гексагональной водой, относится к воде со структурой, которая была изменена для образования гексагонального кластера. Считается, что этот кластер молекул воды имеет сходство с водой, которая не была загрязнена или загрязнена в результате деятельности человека.
Теория структурированной воды предполагает, что эти качества делают ее более здоровой, чем водопроводная или фильтрованная вода.
Согласно сторонникам структурированной воды, этот тип воды естественным образом существует в горных источниках, таянии ледников и других нетронутых источниках.
Другие считают, что вы можете превратить обычную воду в структурированную воду:
- намагничивая ее с помощью процесса, называемого вихревой
- подвергая ее воздействию ультрафиолетового или инфракрасного света
- подвергая ее воздействию естественного тепла и энергии, например солнечного света
- храня ее в бутылках с водой из драгоценных камней
Но действительно ли структурированная вода оправдывает ажиотаж? Читай дальше что бы узнать.
Сторонники структурированной воды считают, что она приносит много пользы для здоровья, утверждая, что она:
- увеличивает энергию
- улучшает концентрацию и память
- способствует снижению веса и поддержанию веса
- способствует лучшему сну
- поддерживает здоровую иммунную систему
- способствует детоксикации организма
- способствует хорошему пищеварению и уменьшает запоры
- способствует увеличению продолжительности жизни
- улучшает цвет кожи и кровообращение
- помогает стабилизировать уровень сахара в крови
Согласно теории структурированной воды, взбалтывание воды заряжает ее, позволяя ей расти. удерживать энергию.Эта энергия может предположительно перезарядить тело и увлажнить его более тщательно, чем обычная питьевая вода.
Отсутствуют какие-либо качественные исследования на людях, которые подтверждали бы многие заявления о здоровье структурированной воды.
Некоторые сторонники цитируют исследование намагниченной структурированной воды 2013 года. Согласно исследованию, намагниченная вода, по-видимому, снижает уровень глюкозы в крови и уменьшает повреждение ДНК крови и печени у крыс с индуцированным диабетом через восемь недель.
Хотя эти результаты обнадеживают, исследование было небольшим, и результаты не были воспроизведены на людях.Кроме того, вода, использованная в исследовании, была предоставлена Korea Clean System Co., компанией, которая продает структурированную воду.
Кроме того, современные научные знания могут опровергнуть большинство заявлений о структурированной воде.
Например:
- Химическая формула воды H 2 O, что означает, что каждая молекула воды содержит два атома водорода и один атом кислорода. Формула структурированной воды называется H 3 O 2. Но химическая формула воды всегда была H 2 O.Другая химическая формула указала бы на другое вещество, которое химики не идентифицировали.
- Сторонники структурированной воды утверждают, что она имеет уникальную шестиугольную форму. Но молекулы воды находятся в постоянном движении. Это означает, что его структура часто меняется.
- В исследовании 2008 года, проведенном студентами и опубликованном в «Журнале химического образования», изучалась вода до и после намагничивания, чтобы увидеть, действительно ли намагничивание воды изменило ее состав.Согласно их результатам, намагниченная вода не показала каких-либо значительных изменений жесткости, pH или проводимости.
Медицинские исследования уже давно подтверждают пользу воды для здоровья. И его не нужно структурировать для поддержания хорошего здоровья.
Вы, наверное, слышали рекомендацию выпивать восемь стаканов воды в день, но это не твердое правило.
Например, вам может потребоваться пить больше воды, если вы:
- очень активны
- беременны или кормите грудью
- живете в жарком или влажном климате
- болеете, включая вирусную или бактериальную инфекцию
Но в целом вы, скорее всего, получаете достаточно воды, если:
- пьете воду в течение дня или когда чувствуете жажду
- ешьте много фруктов и овощей, которые, естественно, содержат воду
- не часто испытываете жажду
- обычно бледная или прозрачная моча
Сохранять водный баланс очень важно, но можно пить слишком много воды.Гипергидратация — противоположность обезвоживания — имеет тенденцию влиять на спортсменов, особенно тех, кто тренируется в теплую погоду.
Чтобы избежать гипергидратации, ограничьтесь двумя или тремя стаканами воды прямо перед тренировкой, после тренировки и каждый час, который вы проводите за тренировкой. Это поможет сохранить ваше тело гидратированным, не переусердствуя.
Компании, продающие структурированную воду, делают ряд убедительных заявлений о ее преимуществах. Однако за ними стоит не так много доказательств. Обычная питьевая вода, фильтрованная и водопроводная, предлагает многие из тех же преимуществ за небольшую часть цены.
.Структура воды и наука: Содержание
«мудрость наслаждается водой»
Конфуций (Аналитики VI.21)
Введение
Водопад Игуасу, Бразилия
Водопад Виктория, из Замбии
Ледяная скала, Шпицберген
Дердл-Дор, Англия
Аннапурна, Непал
Angel Falls, Венесуэла
Остров Рэмси, Уэльс
Британская Антарктида
Таллоу-Бэй, Австралия
Фумарола Йеллоустоун, США
Южный остров, Новая Зеландия
Молекула воды
Вода: краткая ранняя история науки
Жидкая вода
Водное сооружение
Более простое знакомство с молекулой воды
Чистая вода и растворимость
орто — вода и пара — вода
Молекулярные орбитали воды, H 2 O
Водород соединение
Водород облигации
Водород
соединение в воде
водородная связь и передача информации
Димер воды и малые кластеры
Молекулярные орбитали димера воды, (H 2 O) 2
Молекулярные орбитали циклического пентамера воды, (H 2 O) 5
Фазовая диаграмма воды
Изменение плотности
Пар, газообразная вода и водяной пар
Сверхкритическая вода
Переохлажденная вода
Ледяные фазы
Данные кристаллов льда
Гексагональный лед
Кубический лед (Ic / XIc)
Укладка неупорядоченного льда; Ледяной я SD
Ice-two
Ледяная тройка
Ледяная четверка
Ледяная пятерка
Ледяная шестерка
Ледяная семерка
Ледяная восьмерка
Ледяная девятка
Ice-ten
Ice-eleven
Айс-двенадцать
Айс-тринадцать
Айс-четырнадцать
Айс-пятнадцать
Ice-sixteen и прочие льды низкой плотности
Айс-семнадцать
Лед-восемнадцать и льды очень высокого давления
Айс-девятнадцать
Аморфный лед и стеклянная вода
Клатратные льды I, II и H
Молекулярная вибрация и поглощение воды
Диссоциация воды, 2H 2 O = H 3 O + + OH —
Ионы водорода
Ионы гидроксида
Механизм Grotthuss
Молекулярные орбитали ионов H 3 O + и OH —
Молекулярные орбитали гидратированного гидроксид-иона, H 3 O 2 —
Молекулярные орбитали ионов дигидрония, H 5 O 2 +
Вода на границах раздела и нанопузырьки
Закрытая вода
Капилляры
Межфазные границы раздела вода и вода-газ
Нанопузырьки (ультратонкие пузырьки)
Семьдесят пять аномальных свойств воды
Фазовые аномалии P1-P14
Аномалии плотности D1-D22
Аномалии материала M1-M18
Термодинамические аномалии T1-T11
Физические аномалии F1-F10
Свойства воды и ее изотопологов
Неожиданные свойства воды
Краткий перечень свойств жидкости H 2 O
Изменения в некоторых свойствах при температуре (-30 ° C — 100 ° C)
Изменения в некоторых других свойствах при температуре (0 — 373 ° C)
Молекулы, связанные с водой; сравнительные данные
Термодинамика, введение
Важные константы и коэффициенты преобразования
Греческие буквы и символы
Периодическая таблица
Молекулярные модели воды
Кластеризация воды в жидкой воде
Обзор структурирования жидкой воды
Введение в кластеризацию воды
История кластера с двумя состояниями Water
Схема методов исследования структуры воды
Икосаэдр (H 2 O) 280 кластеры воды
Равновесие кластеров воды, сморщивание и температурные эффекты
Водная кластерная архитектура икосаэдра
Сферические координаты скоплений воды икосаэдра
Радиусы оболочки и заселенность икосаэдрических скоплений воды
Суперкластеры молекул воды
Альтернативная икосаэдрическая группировка воды
Альтернативная тетраэдрическая кластеризация воды
Архитектура водного кластера на основе газовых клатратов
Бумажная модель икосаэдрической водной структуры
Бумажная модель усеченной икосаэдрической водной структуры
Обычная бумажная модель усеченной икосаэдрической структуры воды
Доказательства для икосаэдрических кластеров воды
Выводы водного кластера
Гидратация
белка гидратация
белка
сворачивание и денатурация
нуклеиновый кислотная гидратация
Гидратация биомембраны
Сахар гидратация
Водные свойства циклодекстринов
полисахарид
гидратация
Введение к полисахаридам
Фуран псевдовращательный углы рибозы и дезоксирибозы
Гидроколлоиды и камеди
Агар
Альгинат
Арабиноксилан
Каррагинан
Карбоксиметилцеллюлоза
Курдлан
Желатин
Геллан
β-Глюкан
Гуммиарабик
Гуаровая камедь
Камедь рожкового дерева
Пектин
Крахмал
Ксантановая камедь
Реология гидроколлоидов
Гидроколлоиды и здоровье (Пищевые волокна)
Ионная гидратация и водные растворы солей
H 3 O + магическое число кластерных ионов
Водные кластеры вокруг SO 4 2- кластеры
Кластеры воды вокруг скопления CO 2
Аммиак водный
Водный H 2 S
Галогениды водорода водные
Фосфат водный
Силикаты водные
Бораты водные
Серия Hofmeister
Космотропы и хаотропы
гидрофобный
гидратация
Растворы спиртовые
внутриклеточный вода
Вода и астробиология
Вода на Земле
Жесткая вода, удаление накипи и опреснение
Опреснение
Вода и жизнь
Вода и здоровье
Редокс-процессы воды
Электролиз
Автомобили с водным приводом
Магнитный
и электрические воздействия на воду
Вода и микроволновые печи
Диэлектрическая проницаемость и поляризация
Сложный диэлектрик диэлектрическая проницаемость воды
Кислород и вода
Вода деятельность
Моли, молярность и моляльность
Коллигативные свойства воды
Осмотическое давление
Распространение
Броуновское движение
Самостоятельное создание осмотического давления на границах раздела
водный двухфазные системы
Полиоксомолибдатные системы
{Mo 132 } нанокапсула и водные нанокапли
Наноколесо синего молибдена {Mo 154 }
водный растворы фьюиллеренов C 60 и C 70
Часто задаваемые вопросы по жидкой воде
Связанные с водой материал
Гомеопатия
Память воды
Поливатер и EZ-вода
Странные воды
Фуллерены
C 18 и другие угли
Платонический твердые вещества, вода и золотое сечение
Внесено документы
Дж.Уоттерсон Г., Функция фермента: случайные события или согласованное действие?
Рецензия на книгу
Водные системы при повышенных температурах и давлениях
Справочник по показателю преломления и дисперсии воды для ученых
и инженеров
ссылок (в настоящее время 4700+, включая несколько ссылок в записях;
+ ≈ 400 ссылок на внешние сайты)
Посетитель Книга, последние объявления
Посетитель Книжный архив, 2000-2003 гг.
Посетитель Книжный архив 2004-2006 гг.
В книгу посетителей
Ссылки, связанные с водойМартин Чаплин CV
Хайку
Новости сайта
Мелкие правки
Содержание сайта
Поиск
Электронная книга Enzyme Technology
.научных открытий, объясняющих структурированную воду, воду EZ, гексагональную и многое другое
Наука за традиционными фильтрами: химия
Молекула воды меньше световой волны, и многие загрязнители измеряются в частях на миллион, миллиард или даже триллион. Эти маленькие размеры делают науку о фильтрации воды намного менее точной, чем думают люди. После работы в шести различных компаниях, занимающихся фильтрами, и проведения комплексной проверки многих других, мы считаем важным принять во внимание следующие научные и практические аспекты.
- традиционные фильтры не столько удаляют загрязнения, сколько уменьшают их количество
- стоит дорого, и компании делают все возможное, чтобы не тестировать больше, чем минимум .
- Тестирование
- компаний, которые часто заявляют об удалении токсинов, основаны на экстраполяции, а не на лабораторных исследованиях. Например, мы знаем о публичной компании, торгующей традиционными фильтрами, которая заявляет об изъятии фармацевтических препаратов на основе экстраполяции, а не тестирования.
- традиционные фильтры могут нас не защитить
Не менее 100 миллиардов долларов ежегодно тратится на традиционные фильтры для воды и воду в пластиковых бутылках. Многие деньги зарабатываются на нашем страхе за безопасность нашей питьевой воды. Большая часть этих денег идет на маркетинговые кампании, которые проникают в наше мышление и заставляют нас прийти к такому же выводу.
Я потратил очень много времени на размышления о том, почему почти у всех людей одни и те же вопросы и опасения по поводу воды, и я пришел к выводу, что это потому, что маркетинг запрограммирован таким образом.
Вы, вероятно, начали разговор о защите себя от загрязняющих веществ в воде с озабоченностью по поводу фтора и хлора. Какая-то ирония в том, что нас беспокоят именно эти токсины, потому что они намеренно добавляются в воду. Независимо от того, что вы думаете, мы предлагаем вам рассмотреть следующую логику как более вероятную истину о безопасной питьевой воде.
Все — энергия, включая все загрязнения в вашей воде.
Гомеопатия доказывает, что когда физическое вещество удаляется из воды (как это делают традиционные фильтры), энергия этого вещества остается.
Традиционные фильтры даже не признают, не говоря уже о сокращении или удалении токсичных энергетических остатков в вашей воде.
Структурирование воды изменяет энергию воды и очищает всю токсичную память.
Чтобы иметь безопасную питьевую воду, как минимум, вы должны обращаться с ней как с энергией, и если она соответствует вашему бюджету, ценностям и убеждениям, вы также можете добавить традиционный фильтр.
Отчеты с мест:
Согласно известным научным принципам, результатов отчета Bio Chem Lab «не должно» существовать.И, Bio Chem является лабораторией, аккредитованной NELAP, и результаты получены с ноября 2012 года. Щелкните здесь, чтобы просмотреть отчет
Результаты показывают, что вода, пропущенная через структурирующее устройство, которое, как ожидается, не окажет влияния на химию, показала снижение содержания Ecoli в воде на 25% и TDS или общего количества растворенных твердых веществ на 40,2%.
Ожидаемые результаты при прохождении через устройство включают изменения энергетических свойств, но не химического состава. Тем не менее, существенного изменения не произошло.Мы спросили об этом Клейтона Нолти, и он сказал, что, структурируя воду, она вращается в двойном вихре, и когда это происходит, твердые частицы дробятся и трансформируются. Следствием этого является то, что химический состав воды может измениться без добавления или удаления чего-либо из воды.
Результаты такого типа становятся все более распространенными.
Ханна Ноэль — фермер, занимающийся органическими продуктами, и редактор журнала Organic Life. Несколько лет назад штат Вермонт проверил ее хорошо и сказал, что ей придется использовать отбеливатель, чтобы избавиться от хлороформа, который был в воде.Для нее, как для пережившей онкологическое заболевание и органического фермера, это было неприемлемо.
Вместо того, чтобы использовать традиционный метод физической фильтрации, Ханна хорошо обработала ее энергичным процессом. Ничего не было физически добавлено или удалено из ее колодца, и в результате сотрудники штата вернулись и снова проверили хлороформ и обнаружили, что его больше нет.
Как это может случиться? Наше научное оборудование основано на наблюдении за физическим миром, и мы все больше и больше узнаем о том, что значит жить как энергичные существа.В ближайшие годы, когда квантовая физика докажет, что мы — энергичные существа, мы захотим иметь оборудование, которое измеряет в соответствии с тем, кем и чем мы являемся.
Правдоподобное объяснение
Как отдельные части человечества, мы часто забываем присущую нам взаимосвязь и возможность того, что их сознание в этой вселенной выходит за рамки того, что происходит внутри нашего личного мировоззрения. Это имеет смысл, поскольку кажется, что мы запрограммированы на самосохранение, и это может включать в себя чрезмерно важное чувство собственного достоинства.Тем не менее появляется новая правда.
Многие испытывают связь с другими и вселенной через энергию. Мы находим доказательства, которые показывают, что в жизни есть гораздо больше, чем то, что можно увидеть с помощью наших традиционных пяти чувств. В рамках этого возникающего мировоззрения имеет смысл учитывать, что вода живая, то есть имеет собственное сознание, что она наш партнер и носитель в создании нашей жизни.
Сегодня мы слышим, как многие люди говорят о понимании себя как существ, созданных из света.Эта мысль кажется нам несколько сбивающей с толку, поскольку, глядя друг на друга, мы видим твердые тела, а не то, что мы считаем светом. Тем не менее, многие люди могут видеть ауры других людей, и, по словам доктора Джо Меркола, этот свет в 1000 раз менее интенсивен, чем уровни, которые можно увидеть невооруженным глазом.
Доктор Меркола известен своими энергичными исследованиями и объясняет работу доктора Фрица Альберта Поппа, который в 1974 году доказал, что свет в форме биофотонов участвует во всех процессах в организме, включая исцеление.
«Каждый живой организм излучает биофотоны. Считается, что чем выше уровень световой энергии, излучаемой клеткой, тем выше ее жизнеспособность и потенциал для передачи этой энергии человеку, который ее потребляет … Чем больше у вас запас световой энергии … тем больше мощность вашего общего электромагнитное поле, и, следовательно, больше энергии доступно для исцеления и поддержания оптимального здоровья.
Я твердо верю, что это только вопрос времени, когда важность световой энергии для вашего здоровья и благополучия станет более широко признанной и примененной в области медицины.А пока помните, что ваше тело состоит не только из тканей, кровеносных сосудов и органов. Он также состоит из света «. — Доктор Меркола
Согласно доктору Поллоку (исследователю, рассказывающему о 4-й фазе воды) вода может быть структурирована разными способами, в том числе за счет добавления лучистого света. Объединив все это вместе, мы видим, что, возможно, преимущество проведения времени на солнце, помимо получения витамина D, заключается в том, что добавление солнечного света к нашему телу увеличивает структуру воды внутри нас.
Возвращаясь к доктору Поппу, он немецкий физик, который написал 150 статей в научных журналах и восемь книг, и его исследования показывают, что структурированная вода инкапсулирует микрочастицы.
 На этой диаграмме показаны различия в световом излучении структурированной и водопроводной воды. Загрязненная вода более электролитична, потому что в ней больше микрочастиц. Показания структурированной воды демонстрируют, что они менее электролитичны, что доказывает отсутствие микрочастиц (токсинов).Законы химии подвергаются сомнению и оказываются недостаточными для понимания внутреннего устройства молекул воды.
На этой диаграмме показаны различия в световом излучении структурированной и водопроводной воды. Загрязненная вода более электролитична, потому что в ней больше микрочастиц. Показания структурированной воды демонстрируют, что они менее электролитичны, что доказывает отсутствие микрочастиц (токсинов).Законы химии подвергаются сомнению и оказываются недостаточными для понимания внутреннего устройства молекул воды.
Отчет лаборатории Bio Chem, показанный выше, тестирование в штате Вермонт с Ханной Ноэль и это исследование доктора Поппа показывают, что вода способна инкапсулировать или взрывать токсины и делать воду безопасной. Независимо от того, верите ли вы, что токсины попадают в центр молекулы воды (как учил Клейтон Нолти) или трансформируются путем перемешивания, как показано в отчете Bio Chem, ясно одно: здесь их больше, чем кажется на первый взгляд.
Вода действительно защищает нас от токсинов, когда она находится в состоянии водоворота, как в природе.
.