Строение молекулы – физические и химические свойства, определение (физика, 7 класс)
4.1
Средняя оценка: 4.1
Всего получено оценок: 102.
Обновлено 30 Июля, 2021
4.1
Средняя оценка: 4.1
Всего получено оценок: 102.
Обновлено 30 Июля, 2021
Идея о том, что всё вещество состоит из мельчайших частиц и не делится бесконечно, высказывалась ещё в античности. Однако строгое доказательство существования мельчайших частиц вещества — молекул — было получено лишь в середине XIX в. Тогда же было установлено и сложное строение молекулы. Рассмотрим эту тему более подробно, дадим определение молекулы и атома.
Атомы и молекулы
Из курса физики 7 класса известно, что все тела состоят из молекул. Молекула является наименьшей частью вещества, определяющей его физические и химические свойства. Все огромное разнообразие веществ в природе — это следствие огромного числа различных видов молекул.
Но молекула не является наименьшей частью вещества. Химические превращения веществ (а значит, и молекул) доказывают, что молекулы имеют сложное строение. Большинство молекул могут быть разложены или синтезированы с помощью химических воздействий.
Химические превращения веществ (а значит, и молекул) доказывают, что молекулы имеют сложное строение. Большинство молекул могут быть разложены или синтезированы с помощью химических воздействий.
Мельчайшая частица вещества, которая не может быть разложена с помощью любых химических воздействий, называется атомом. Каждая молекула состоит из одного и более атомов. Все молекулы одного вещества имеют одинаковый состав и строение.
В отличие от многих миллионов видов молекул, число видов атомов в природе невелико. К середине XIX в. их было известно менее сотни. К настоящему времени в природе было найдено 94 элемента, и ещё 24 синтезированы искусственно.
Рис. 1. Атомы и молекулы.Строение молекулы
В мире существует огромное множество различных молекул с самыми разными свойствами. Самые простые молекулы состоят из одного атома. Пример такой одноатомной молекулы — благородные газы: гелий, неон, аргон, криптон, ксенон, радон. Большая часть молекул состоит из нескольких атомов, при этом атомы могут быть одинаковы, такими, к примеру, являются двухатомные молекулы кислорода, азота, многих других газов.
Атомы внутри молекулы удерживаются электростатическими силами на определённых расстояниях, в зависимости от видов этих атомов. Более того, каждая молекула имеет свою пространственную структуру. Например, молекула углекислого газа состоит из трёх атомов, лежащих на одной прямой. А молекула воды — из трёх атомов, лежащих в вершинах равнобедренного треугольника, причём угол при вершине (атоме кислорода) составляет около 105 градусов.
При сжатии молекулы возрастают силы отталкивания между атомами, при растяжении молекулы возрастают силы притяжения. Это обеспечивает стабильность молекул. Чтобы её разрушить, необходимо приложить энергию — химическую, термическую или электрическую.
Наиболее сложно устроены молекулы органических веществ. Эта сложность обуславливается тем, что атомы углерода могут соединяться друг с другом в длинные цепочки, одновременно присоединяя атомы других элементов.
Что мы узнали?
Молекула — это мельчайшая частица вещества, сохраняющая физические и химические свойства. Она состоит из одного и более атомов. Атомы образуют определённую пространственную структуру молекулы и удерживаются в таком виде электростатическими силами.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Катя Зысман
5/5
Оценка доклада
4.1
Средняя оценка: 4.1
Всего получено оценок: 102.
А какая ваша оценка?
Строение молекул. Химическая связь
Молекула — электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого.
Химическая связь может образовываться путем предоставления от каждого из атомов по одному или нескольким неспаренным электронам (кратные связи) с образованием электронных пар (ковалентная связь). В образовании химической связи участвуют только электроны внешней электронной оболочки, а внутренние электронные уровни не затрагиваются. В результате, при образовании химической связи у каждого атома образуется заполненная электронная оболочка внешнего электронного уровня, состоящая из двух (дуплет) или восьми (октет) электронов.
Химическая связь характеризуется длиной и энергией. Длина химической связи это расстояние между ядрами связанных атомов. Энергия химической связи показывает сколько необходимо затратить энергии на разведение двух атомов, между которыми существует химическая связь, на расстояние, при котором эта химическая связь будет разорвана.
Виды химической связи
Ионная химическая связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.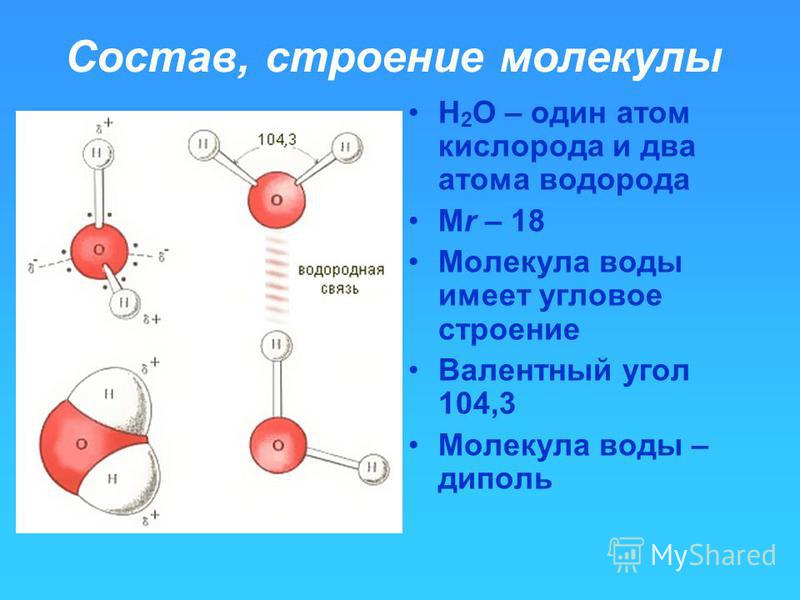
Результатом этого является образование соединения противоположно заряженных ионов:
Это притяжение ионов как разноимённо заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Образуется между типичными металлом и неметаллом (Me + неМе).
При этом электроны у металла полностью переходят к неметаллу, образуются ионы (частицы, имеющие заряд).
Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Ковалентная химическая связь
Ковалентная полярная химическая связь образуется при взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому.
Электроотрицательность (ЭО) — способность атома химических элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Ковалентная полярная связь образуется между разными неметаллами (неМе + неMe).
Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Такая связь существует в молекулах следующих сложных веществ: Н2О, h3S, Nh4 и др.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония (Н3О+) и аммония (Nh5+).
Металлическая химическая связь
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов называется металлической.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Металлическая химическая связь образуется в простых веществах-металлах (Me).
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу.
В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ» , обеспечивающий связь между атомами металла.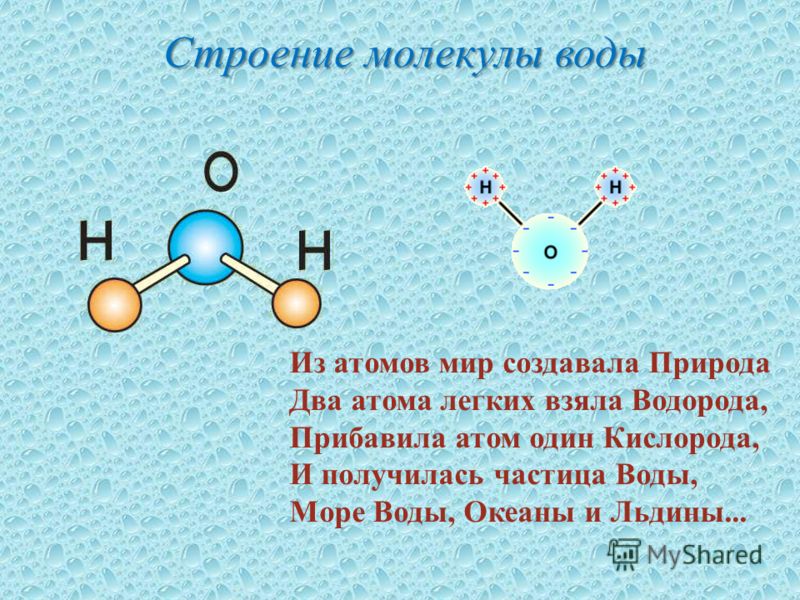
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов.
В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Обобщение материала
Типы химической связи
Полезные ссылки
Источник материала
Ионная связь и её характеристики (видео)
Ковалентная связь и её характеристики (видео)
Металлическая связь и её характеристики (видео)
Схемы образования веществ с различным типом связи (видео)
Разбор видов связи
Ионная химическая связь (видео)
Ковалентная неполярная химическая связь (видео)
Ковалентная полярная химическая связь (видео)
Металлическая химическая связь (видео)
Дополнительные материалы
Ковалентная и ионная химическая связь (видео)
Металлическая и водородная химические связи (видео)
Ионная связь (видео)
Ковалентная связь (видео)
Ковалентная полярная связь (видео)
молекул | Определение, примеры, структуры и факты
представления молекулярной структуры
Просмотреть все средства массовой информации
- Ключевые люди:
- Дж.
 Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А. Хауптман
Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А. Хауптман
- Похожие темы:
- радикальный биомолекула конфигурация конформация гомоядерная молекула
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
молекула , группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую можно разделить чистое вещество, сохраняя при этом состав и химические свойства этого вещества.
Характеристики молекул
Деление образца вещества на все более мелкие части не приводит ни к изменению его состава, ни к химическим свойствам до тех пор, пока не будут получены части, состоящие из отдельных молекул. Дальнейшее подразделение вещества приводит к еще более мелким частям, которые обычно отличаются от исходного вещества по составу и всегда отличаются от него химическими свойствами. На этой последней стадии фрагментации химические связи, удерживающие атомы в молекуле, разрываются.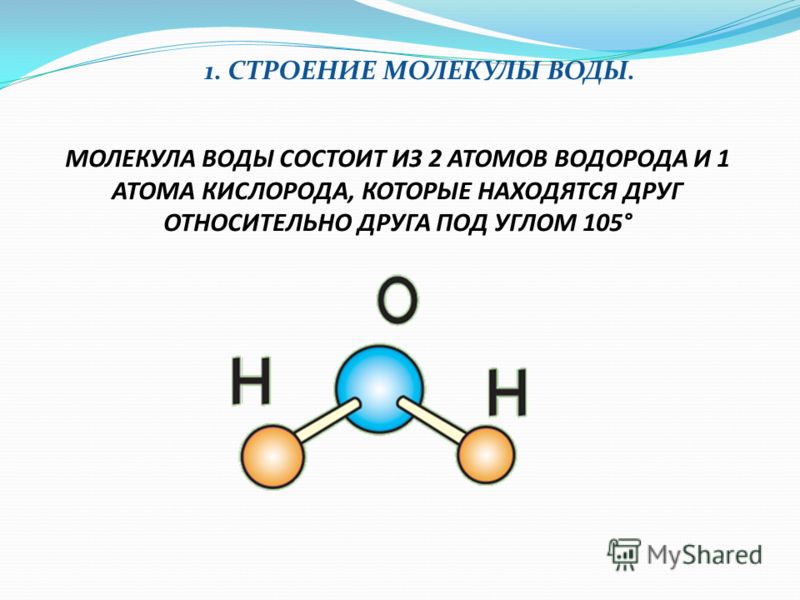
Атомы состоят из одного ядра с положительным зарядом, окруженного облаком отрицательно заряженных электронов. Когда атомы близко подходят друг к другу, электронные облака взаимодействуют друг с другом и с ядрами. Если это взаимодействие таково, что общая энергия системы снижается, то атомы связываются вместе, образуя молекулу. Таким образом, со структурной точки зрения молекула состоит из скопления атомов, удерживаемых вместе валентными силами. Двухатомные молекулы содержат два атома, которые химически связаны. Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Молекулярная связь
Отношение числа атомов, которые могут быть связаны друг с другом для образования молекул, является фиксированным; например, каждая молекула воды содержит два атома водорода и один атом кислорода. Именно эта особенность отличает химические соединения от растворов и других механических смесей. Таким образом, водород и кислород могут присутствовать в любых пропорциях в механических смесях, но при искровом разряде они будут соединяться только в определенных пропорциях, образуя химическое соединение вода (H 2 О). Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H 2 O 2 ). Кроме того, атомы могут связываться друг с другом в одинаковых пропорциях, образуя разные молекулы. Такие молекулы называются изомерами и отличаются только расположением атомов внутри молекул. Например, этиловый спирт (СН 3 CH 2 OH) и метиловый эфир (CH 3 OCH 3 ) содержат один, два и шесть атомов кислорода, углерода и водорода соответственно, но эти атомы связаны по-разному.
Именно эта особенность отличает химические соединения от растворов и других механических смесей. Таким образом, водород и кислород могут присутствовать в любых пропорциях в механических смесях, но при искровом разряде они будут соединяться только в определенных пропорциях, образуя химическое соединение вода (H 2 О). Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H 2 O 2 ). Кроме того, атомы могут связываться друг с другом в одинаковых пропорциях, образуя разные молекулы. Такие молекулы называются изомерами и отличаются только расположением атомов внутри молекул. Например, этиловый спирт (СН 3 CH 2 OH) и метиловый эфир (CH 3 OCH 3 ) содержат один, два и шесть атомов кислорода, углерода и водорода соответственно, но эти атомы связаны по-разному.
Викторина «Британника»
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Не все вещества состоят из отдельных молекулярных единиц. Хлорид натрия (поваренная поваренная соль), например, состоит из ионов натрия и ионов хлора, расположенных в решетке так, что каждый ион натрия окружен шестью равноудаленными ионами хлора, а каждый ион хлора окружен шестью равноудаленными ионами натрия. Силы, действующие между любым натрием и любым соседним ионом хлора, равны. Следовательно, не существует отдельного агрегата, идентифицируемого как молекула хлорида натрия. Следовательно, в хлориде натрия и во всех твердых телах подобного рода понятие химической молекулы не имеет значения. Поэтому формула такого соединения дается как простейшее соотношение атомов, называемое формульной единицей, в случае хлорида натрия — NaCl.
Молекулы удерживаются вместе общими электронными парами или ковалентными связями. Такие связи являются направленными, что означает, что атомы занимают определенное положение относительно друг друга, чтобы максимизировать силу связи. В результате каждая молекула имеет определенную, достаточно жесткую структуру или пространственное распределение ее атомов. Структурная химия имеет дело с валентностью, которая определяет, как атомы объединяются в определенных соотношениях и как это связано с направлениями и длинами связей. Свойства молекул коррелируют с их строением; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула углекислого газа является линейной и не имеет дипольного момента. Выяснение того, каким образом атомы реорганизуются в ходе химических реакций, имеет важное значение. В некоторых молекулах структура может быть нежесткой; например, в этане (H 3 CCH 3 ) существует практически свободное вращение вокруг простой связи углерод-углерод.
Такие связи являются направленными, что означает, что атомы занимают определенное положение относительно друг друга, чтобы максимизировать силу связи. В результате каждая молекула имеет определенную, достаточно жесткую структуру или пространственное распределение ее атомов. Структурная химия имеет дело с валентностью, которая определяет, как атомы объединяются в определенных соотношениях и как это связано с направлениями и длинами связей. Свойства молекул коррелируют с их строением; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула углекислого газа является линейной и не имеет дипольного момента. Выяснение того, каким образом атомы реорганизуются в ходе химических реакций, имеет важное значение. В некоторых молекулах структура может быть нежесткой; например, в этане (H 3 CCH 3 ) существует практически свободное вращение вокруг простой связи углерод-углерод.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.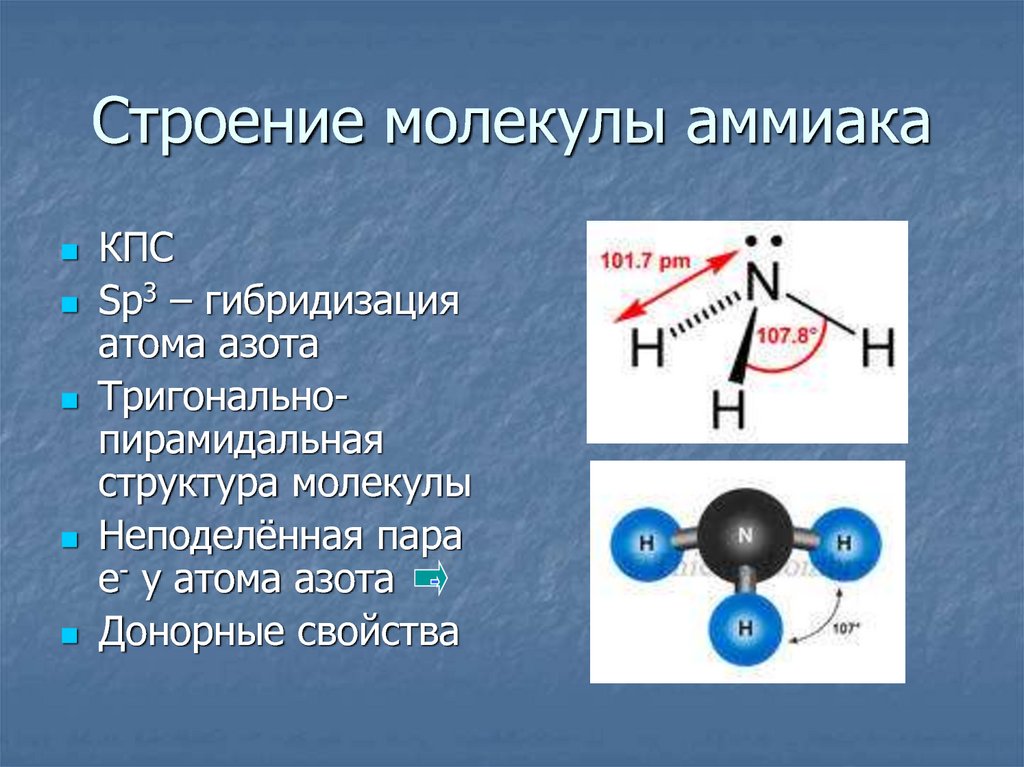 Подпишитесь сейчас
Подпишитесь сейчас
Атомы, молекулы, ионы и связи
Материя — это все, что занимает место и имеет массу. Материя состоит из элементов, обладающих уникальными физическими и химическими свойствами. Элементы представлены химическими символами из одной или двух букв, такими как C (углерод), Ca (кальций), H (водород), O (кислород), N (азот) и P (фосфор). Наименьшее количество элемента, которое все еще обладает характеристиками этого элемента, — это атом. Атомы химически связываются вместе, образуя молекул, , а состав молекулы определяется ее химической формулой (O 2 , H 2 O, C 6 H 12 O 6 ). Когда атомы в молекуле разные, молекула представляет собой соединение (H 2 O и C 6 H 12 O 6 , но не O 2 ). Атомы элементов состоят из ядра, содержащего положительно заряженных протонов и нейтрально заряженных нейтронов. Отрицательно заряженные электронов расположены вне ядра.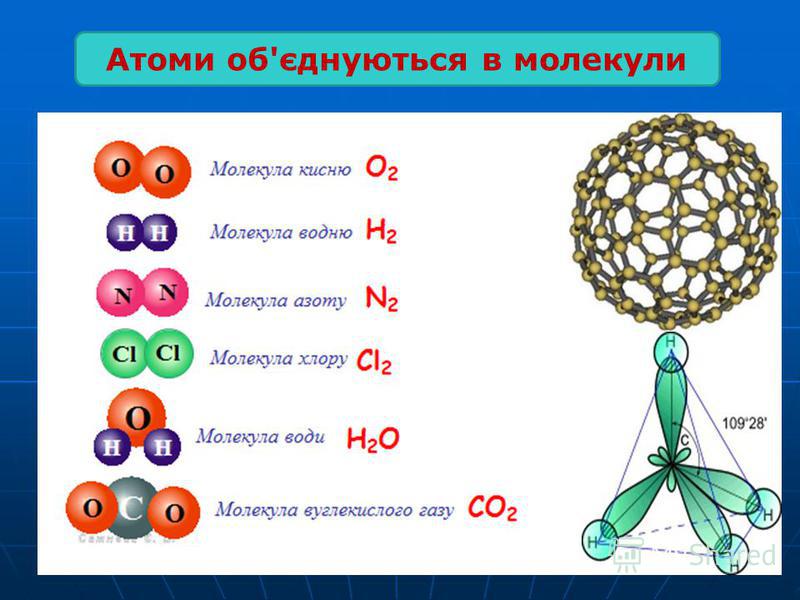 Атомы каждого элемента различаются по количеству протонов, нейтронов и электронов. Например, у водорода один протон, один электрон и нет нейтронов, а у углерода шесть протонов, шесть нейтронов и шесть электронов. Количество и расположение электронов в атоме определяют виды химических связей, которые он образует, и то, как он реагирует с другими атомами с образованием молекул. Различают три вида химической связи:
Атомы каждого элемента различаются по количеству протонов, нейтронов и электронов. Например, у водорода один протон, один электрон и нет нейтронов, а у углерода шесть протонов, шесть нейтронов и шесть электронов. Количество и расположение электронов в атоме определяют виды химических связей, которые он образует, и то, как он реагирует с другими атомами с образованием молекул. Различают три вида химической связи:
Ионные связи образуются между двумя атомами, когда один или несколько электронов полностью переходят от одного атома к другому. Атом, который получает электроны, имеет общий отрицательный заряд, а атом, отдающий электроны, имеет общий положительный заряд. Из-за их положительного или отрицательного заряда эти атомы представляют собой ионов. Притяжение положительного иона к отрицательному иону образует ионную связь. Натрий (Na) и хлор (Cl) образуют ионы (Na + и Cl – ), которые притягиваются друг к другу с образованием ионной связи в молекуле хлорида натрия (NaCl).
 Знак плюс или минус после химического символа указывает на ион с положительным или отрицательным зарядом, что является результатом потери или приобретения одного или нескольких электронов соответственно. Цифры перед зарядами обозначают ионы, заряды которых больше единицы (Ca 2+ , PO 4 3– ).
Знак плюс или минус после химического символа указывает на ион с положительным или отрицательным зарядом, что является результатом потери или приобретения одного или нескольких электронов соответственно. Цифры перед зарядами обозначают ионы, заряды которых больше единицы (Ca 2+ , PO 4 3– ).
Ковалентные связи образуются, когда электроны распределяются между атомами. То есть ни один из атомов полностью не сохраняет владение электронами (как это происходит с атомами, образующими ионные связи). Одинарная ковалентная связь возникает, когда два электрона являются общими (по одному от каждого атома). Двойная или тройная ковалентная связь образуется, когда четыре или шесть общих электронов соответственно. Когда два атома имеют одинаковые общие электроны, как в молекуле газообразного кислорода (два атома кислорода образуют O 2 ), электроны делятся поровну, и связь является неполярной ковалентной связью.



 Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А. Хауптман
Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А. Хауптман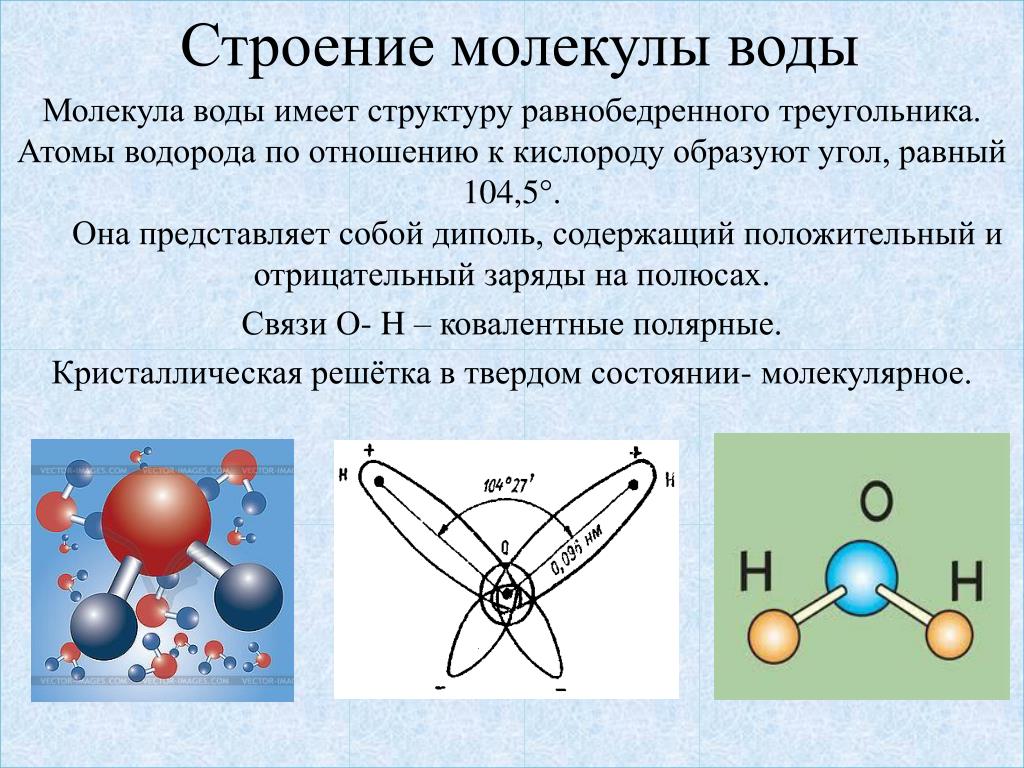 Знак плюс или минус после химического символа указывает на ион с положительным или отрицательным зарядом, что является результатом потери или приобретения одного или нескольких электронов соответственно. Цифры перед зарядами обозначают ионы, заряды которых больше единицы (Ca 2+ , PO 4 3– ).
Знак плюс или минус после химического символа указывает на ион с положительным или отрицательным зарядом, что является результатом потери или приобретения одного или нескольких электронов соответственно. Цифры перед зарядами обозначают ионы, заряды которых больше единицы (Ca 2+ , PO 4 3– ).