Физические свойства н2о и строение ее молекул
При комнатных условиях чистая вода – жидкость без запаха и вкуса. Температура кипения Н2О (при р=101,325 кПа) равна 100оС, температура замерзания 0оС. В тонком слое вода бесцветна, однако при толщине более двух метров приобретает голубоватый оттенок. Вода является хорошим растворителем для многих веществ, поэтому чистой Н2О в природе нет. Она всегда содержит многочисленные примеси растворенных веществ. Для очистки от них воду доводят до кипения, а образовавшиеся при этом водяные пары путем охлаждения вновь конденсируют в жидкость. Этот процесс называют «перегонкой», а получившуюся Н2О – дистиллированной водой.
Молекулы Н2О
состоят из двух атомов водорода Н и
одного атома кислорода О, соединенных
между собой ковалентными полярными
связями. На атоме О, как на более
электроотрицательном сосредоточен
частичный отрицательный заряд |δ

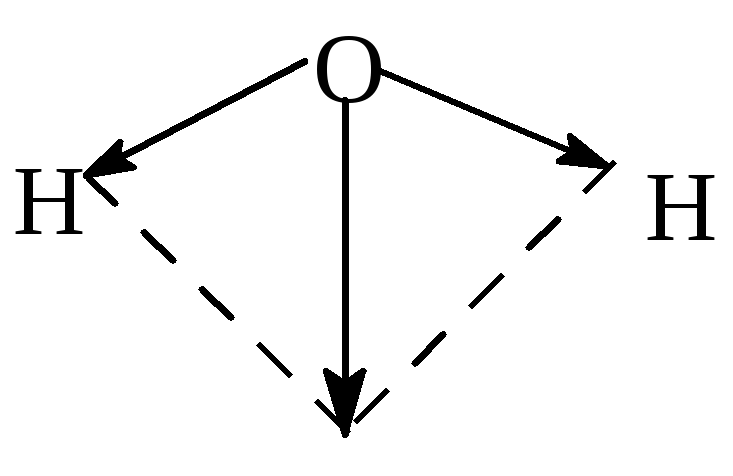
Рис. 16.Схема образования молекулы Н2О
Вследствие своего строения молекула Н2О обладает значительным дипольным моментом (рис. 17) и является сильнополярной. В связи с этим вода имеет большую диэлектрическую проницаемость и в ее среде значительно уменьшаются (приблизительно в 80 раз) кулоновские силы взаимодействия между электрическими зарядами. Это приводит к тому, что прочность связей в ионной кристаллической решетке, а также между полярными молекулами твердых и жидких веществ и между атомами в самих этих молекулах тоже понижается ≈ в 80 раз.
-
 ≠ 0
≠ 0
Рис. 17.Дипольный момент молекулы Н2О
Благодаря этому свойству вода хорошо растворяет вещества, образованные ионными и ковалентными полярными связями, вызывая при этом электролитическую диссоциацию электролитов и реакции гидролитического разложения веществ.
Вода по сравнению с другими водородными соединениями элементов IVA–VIIAгрупп (HCl,H2S,CH4,HF,NH3) имеет аномально высокие температуры кипения и плавления, обладает высокой теплоемкостью и удельной теплотой испарения.
Эти свойства воды объясняются способностью ее молекул образовывать друг с другом прочные водородные связи. Причем одна молекула Н2О может образовать водородные связи с четырьмя другими молекулами воды. Это создает возможность построения сложной трехмерной пространственной структуры из ассоциированных молекул Н2О, в которой имеется много пустот. Благодаря этому плотность льда меньше плотности жидкой воды, т.к. в последнем случае вследствие теплового движения происходит частичное разрушение водородных связей и образовавшиеся свободные молекулы воды могут заполнять имеющиеся полости, увеличивая тем самым плотность жидкости.
Водородные связи молекулы Н2О могут образовывать не только между собой, но и с полярными функциональными группами органических веществ: спиртов, аминов, карбоновых кислот, различных гетеро- и полифункциональных соединений, способствуя тем самым их растворению.
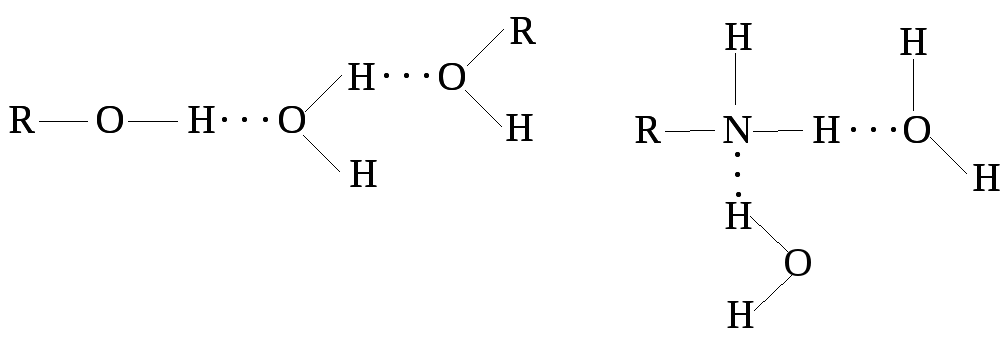
Таким образом, вода является универсальным растворителем и способна растворять в себе как многочисленные неорганические, так и органические соединения.
Химическое строение воды
Из школьного курса химии мы знаем, что вода — это неорганическое соединение двух элементов. Формула проста — h3O, то есть два атома водорода и один атом кислорода. Вода имеет несколько агрегатных состояний, самое распространенное из них — жидкость. Два других состояния: твердое — лед и газообразное — пар.

Значение воды для жизни на Земле трудно переоценить. Без этой субстанции в принципе невозможно существование биологических форм. Кроме того, она участвует в обменных процессах на самой планете и в организмах живых существ.
Получение воды
Воду можно получить не только путем соединения водорода и кислорода. Например, разложением пероксида углерода получают 2Н2О и О2, гидрокарбонат натрия при контакте с уксусной кислотой дает воду, ацетат натрия и углекислый газ. Жидкость можно получить при взаимодействии кислоты и щелочи — химическая реакция называется нейтрализация, или путем восстановления оксидов металла водородом.
Как вода участвует в химических реакциях?
Н2О взаимодействует со всеми веществами на Земле. Например, с металлами, неметаллами и их соединениями. При контакте с металлами выделяется кислород, правда, для этой реакции подходят только щелочноземельные и щелочные группы I и II. Реакция с неметаллами проходит менее активно и только путем нагревания.
При соединении с оксидами образуются новые химические реагенты. Так при контакте с оксидом серы IV группы — сернистая кислота, а с тем же оксидом VI группы — серная кислота, с диоксидом углерода — угольная кислота. Химическое соединение воды с оксидом кальция дает гашеную известь. Однако не все оксиды хорошо взаимодействуют с водой. Например, оксиды титана, цинка, хрома не растворяются в жидкой среде. Именно поэтому их используют для защиты металлических поверхностей от влаги и коррозии.
При пропускании электрического тока через воду происходит окислительно-восстановительная реакция, в которой вода выполняет сразу две функции — окисляет и восстанавливает. Результатом таких реакций с оксидом металла получаются водород и кислород.
h3O участвует в биосинтезе, в ходе которого выделяется кислород. Данная реакция происходит при помощи двуокиси углерода и солнечного света.
Чистая вода — доступность для человека
Воздействие воды на человеческий организм изучается не первое столетие. Современная наука установила, что вода активно участвует в обменных процессах. Именно поэтому жидкость может нести в себе не только пользу, но и угрозу. Например, если в составе содержатся различные примеси, бактерии и опасные химические соединения. Если Вы заботитесь о своем здоровье и здоровье близких, необходимо обеспечить доступ к чистой питьевой воде дома и в офисе. Это сделать не так уж и сложно – достаточно позвонить в нашу компанию «Воды здоровья» и заказать продукт в 19-литровых бутылях, добытый из артезианских скважин или природных источников.
Помимо доставки чистой и полезной воды, мы предлагаем в аренду водораздаточные устройства — кулеры с опцией подогрева и охлаждения жидкости. Специалисты установят оборудование и будут вовремя его обслуживать, очищать и проводить санацию. Звоните по телефонам на сайте, заказывайте воду. Доставим в любое удобное время в Москве и Санкт-Петербурге!
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц оформив подписку. Новым читателям предлагаем попробовать нашу воду бесплатно, при первом заказе выберите 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с Вами и уточнят детали. Тел. 8 (800) 100-15-15
* Акция для Москвы, МО, Санкт-петербурга, ЛО
Спасибо за подписку на нашу рассылку
Триоксид диводорода — Википедия
Триоксид диводорода (триоксид водорода, триоксидан) — неорганическое соединение состава H2O3, простейший представитель класса полиоксидов (в т.ч. гидротриоксидов и триоксидов). Может рассматриваться как высший гомолог пероксида водорода H
Впервые о существовании триоксида водорода предположил М. Бертло, который, выступая в 1880 году перед Французской академией наук, заявил об этом веществе как о возможном промежуточном продукте в реакции разложения пероксида водорода. В 1895 году Д. И. Менделеев предложил другой полиоксид — тетраоксид водорода H2O4, в качестве ещё одного промежуточного продукта в этой реакции. Подтверждений этим предположениям в то время приведено не было из-за отсутствия методов, позволивших бы детектировать такие короткоживущие соединения[1].
Косвенное подтверждение существования полиоксидов было получено в результате экспериментов, в которых через водяной пар, пары пероксида водорода либо смесь водорода с кислородом пропускался электрический разряд, а затем следовало резкое охлаждение до −190 °C. После нагревания таких конденсатов до комнатной температуры происходило выделение большого количества кислорода и пероксида водорода, что свидетельствует о наличии в конденсатах соединений с большим содержанием кислорода. Тогда же было снова выдвинуто предположение об образовании триоксида водорода в данных условиях
В 1960—1970-х годах И. И. Некрасовым было проведено изучение полиоксидов методом ИК-спектроскопии. В частности, изучению подверглась реакция между озоном и атомарным водородом при −198 °C, а также диссоциация паров воды и пероксида водорода с последующим замораживанием продуктов. Появившиеся новые полосы в ИК-спектрах были приписаны колебаниям в молекулах HOOOH и HOOOOH, однако убедительной аргументации Некрасов не приводил[2].
В 1963 году Чапски (Czapski) и Бельски (Bielski) обнаружили триоксид водорода в водных растворах, подкисленных хлорной кислотой и облучаемых пучком электронов. Тогда же на основе кинетических данных был установлен максимальный период полуразложения данного соединения в водных растворах, который составил 17 секунд (0,027 М кислота, 0 °C)[2][3].
В 1990-е годы были разработаны методы получения достаточно концентрированных растворов триоксида водорода, что позволило провести его характеризацию физико-химическими методами, а также изучить процессы его разложения и реакционную способность. Эти методы можно разделить на три группы:
- восстановление озона;
- разложение гидротриоксидов ROOOH;
- реакция озона с пероксидом водорода[2].
Восстановление озона[править | править код]
Реакции насыщенных органических соединений с озоном изучались с 1970-х годов. Оказалось, что некоторые из них (изопропиловый спирт, метилизопропиловый эфир, кумол, норкаранол, тетралин, гидразины) реагируют с озоном как восстановители типа AH2, давая в качестве одного из продуктов триоксид водорода HOOOH[2]:
Ah3+O3→HOOOH+A.{\displaystyle {\mathsf {AH_{2}+O_{3}}}\rightarrow {\mathsf {HOOOH+A.}}}
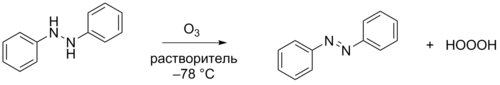
Для данного превращения предлагались различные механизмы. Наиболее вероятной является последовательность стадий, при которой вначале озон отщепляет от органического соединения атом водорода H• (либо — в альтернативном варианте — гидрид-ион H—), а образующаяся радикальная пара (ионная пара) либо превращается в гидротриоксид ROOOH, либо отщепляет атом водорода H• (протон H+) с образованием триоксида водорода. Считается, что в зависимости от природы субстрата, растворителя, температуры и других условий реакции реализуется либо радикальный, либо ионный механизм. В случае реакций изопропилового спирта и гидразобензола (1,2-дифенилгидразина) показан радикальный механизм реакции[4].
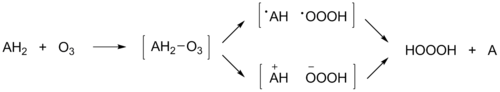
Реакция 1,2-дифенилгидразина с озоном в различных органических растворителях (ацетон-d6, метилацетат, трет-бутилметиловый эфир) при −78 °C даёт триоксид водорода и азоксибензол. Этот метод является основным для приготовления относительно концентрированных растворов триоксида водорода (до 0,1 М) без примесей органических гидротриоксидов ROOOH. Описан метод синтеза чистого продукта путём озонирования гидразобензола, привязанного к нерастворимой полимерной смоле, что позволило отфильтровать в токе аргона образующийся продукт восстановления и получить чистый водный раствор триоксида водорода с примесью лишь пероксида водорода[5][6].
Разложение гидротриоксидов[править | править код]
Триоксид водорода можно получать по реакции разложения гидротриоксидов силанов и германов вида R3XOOOH (X — кремний или германий, R — органический заместитель), сгенерированных путём озонирования соответствующих исходных соединений при температуре от –85 до –10 °C. Обычно реакция разложения гидротриоксидов силанов и германов в органических растворителях даёт триоксид водорода с выходом 40 ± 20 %, а также соответствующие силанолы и германолы, дисилоксаны и дигермоксаны и синглетный кислород. Однако если к растворам гидротриоксидов добавлять воду, то выход существенно увеличивается (80 ± 20 %)[7].
R3SiOOOH+h3O→HOOOH+R3SiOH{\displaystyle {\mathsf {R_{3}SiOOOH+H_{2}O}}\rightarrow {\mathsf {HOOOH+R_{3}SiOH}}}
В 2008 году сообщалось о более эффективном процессе получения триоксида водорода, который заключается в превращении гидротриоксидов под действием каталитических количеств метилтриоксорения(VII) CH3ReO3 при –70 °C. Этот метод позволяет получать чистый триоксид водорода без примесей пероксида водорода и органических гидротриоксидов[8][9].
Реакция пероксида водорода с озоном[править | править код]
Взаимодействие пероксида водорода с озоном изучено давно, а сама смесь используется как сильный окислитель при антибактериальной обработке и очистке почв, грунтовых и сточных вод от различных промышленных загрязнителей (полициклических ароматических углеводородов, бензола, толуола, хлорорганических соединений и др.). Дальнейшее изучение этой реакции показало, что если смешать озон и пероксид водорода в аргоновой матрице, то образуется комплекс, дающий значительные концентрации HOOOH при облучении светом с длиной волны 266 нм. Образование триоксида водорода было подтверждено методом ЯМР-спектроскопии[8][6].
Триоксид водорода был охарактеризован методом ИК-спектроскопии в аргоновой матрице. При этом были обнаружены все 9 фундаментальных колебаний этой молекулы, которые практически совпали с рассчитанными:
- 3529,6 см-1 — симметричное валентное колебание OH;
- 3529,6 см-1 — антисимметричное валентное колебание OH;
- 1359,1 см-1 — антисимметричное деформационное колебание HOO;
- 1347,4 см-1 — симметричное деформационное колебание HOO;
- 821,0 см-1 — симметричное валентное колебание OO;
- 776,3 см-1 — антисимметричное валентное колебание OO;
- 509,1 см-1 — колебание OOO;
- 387,0 см-1 — антисимметричное торсионное колебание;
- 346,4 см-1 — симметричное торсионное колебание[10].
Наиболее важным является колебание при 776 см-1, поскольку в этой области отсутствуют колебания молекул, составляющих атмосферу, а также колебания молекул воды, что делает возможным определение наличия HOOOH в атмосфере и растворах по этой полосе поглощения[11].
В спектрах ЯМР на ядрах 1H триоксид водорода даёт характеристический сигнал при 13,4 ± 0,3 м. д. (калибровка по ТМС). Триоксид дейтерия, полученный путём озонирования дейтерированных органических восстановителей в ацетоне-d6, даёт более широкий сигнал при 13 м. д. в спектрах 2H ЯМР. В спектрах 17O ЯМР соединение даёт два сигнала при 421 и 305 м. д., относящихся к центральному и двум эквивалентным терминальным атомам кислорода соответственно. Если сравнить эти значения с величиной химического сдвига для атомов кислорода в пероксиде водорода (187 м. д.), можно отметить существенное разэкранирование атомов HOOOH за счёт появления ещё одного акцепторного атома кислорода[12].
В 2005 году были получены первые вращательные спектры триоксида водорода, благодаря чему удалось установить точную геометрическую структуру этого полиоксида. Экспериментально определённые вращательные постоянные совпадают с расчётными и могут быть использованы для обнаружения триоксида водорода в атмосфере и межзвёздном пространстве (A0 = 51 149 МГц, B0 = 10 688 МГц, C0 = 9355 МГц)[12].
Долгое время строение HOOOH изучалось квантовохимическими методами ab initio различной сложности, а затем было подтверждено методом вращательной спектроскопии. Все данные свидетельствуют о том, что молекула триоксида водорода представляет собой зигзагообразную цепь, напоминающую винт, с группой симметрии С2 и одинаковыми двугранными углами HOOO, равными 81,8°. Дипольный момент не определён экспериментально, но расчёты дают значение 1,0 ± 0,1 Д, что ожидаемо меньше значений дипольных моментов для HOOH (1,572 Д) и HOH (1,847 Д). цис-Изомер триоксида водорода лишь ненамного менее устойчив (расчётное значение 2,5 ± 0,1 ккал/моль). Энергия перехода от цис— к транс-изомеру (вращение flip-flop, геминальный двойной ротор) оценивается в 3,3 и 2,9 ккал/моль, а энергия обратного перехода — в 5,7 и 5,3 ккал/моль. Таким образом, при комнатной температуре молекула HOOOH испытывает быстрое внутреннее вращение[13].
Триоксид водорода разлагается в различных органических растворителях с образованием воды и синглетного кислорода O2 (1Δg). Последний можно детектировать при помощи специального акцептора — 9,10-диметилантрацена, образующего при этом 9,10-эндопероксид, либо по хемилюминесценции в инфракрасной области с максимумом при 1272 нм (ацетон, –10 °С). Было также обнаружено, что изотопная метка 17О, по крайней мере, частично переходит из триоксида водорода в образующуюся из него воду. Изучение кинетики реакции показало, что реакция разложения имеет псевдопервый порядок, а существенную роль выполняет комплексообразование с присутствующим в реакционной смеси избытком воды. Оценочное время полуразложения HOOOH при комнатной температуре в полярных органических растворителях составляет 16 ± 2 минуты, тогда как в воде это значение гораздо меньше и составляет 20 миллисекунд[14].
Очень немногое известно о реакционной способности триоксида водорода. Эксперименты с тиантрен-5-оксидом (химическим реагентом, позволяющим различить нуклеофильные и электрофильные окислители) показали, что триоксид водорода реагирует как электрофил, являясь даже более электрофильным, чем озон[15].
Окисление замещённых метилфенилсульфидов в ацетоне при –40 °С приводило к образованию соответствующих сульфоксидов. Перекись водорода в этих условиях, напротив, не вступала в реакцию с сульфидами[15].
Триоксид водорода также быстро реагирует с пиридином, диазабицикло[2.2.2]октеном и триэтиламином. Реакции протекают бурно даже при низких температурах и дают соответствующие N-оксиды[15].
- ↑ Cerkovnik, Plesničar, 2013, p. 7930.
- ↑ 1 2 3 4 5 Cerkovnik, Plesničar, 2013, p. 7931.
- ↑ Czapski, Bielski, 1963.
- ↑ Cerkovnik, Plesničar, 2013, p. 7931—7933.
- ↑ Cerkovnik, Plesničar, 2013, p. 7932—7933.
- ↑ 1 2 Nyffeler et al., 2004.
- ↑ Cerkovnik, Plesničar, 2013, p. 7933.
- ↑ 1 2 Cerkovnik, Plesničar, 2013, p. 7934.
- ↑ Bergant et al., 2008.
- ↑ Engdahl, Nelander, 2002.
- ↑ Cerkovnik, Plesničar, 2013, p. 7936.
- ↑ 1 2 Cerkovnik, Plesničar, 2013, p. 7937.
- ↑ Cerkovnik, Plesničar, 2013, p. 7938.
- ↑ Cerkovnik, Plesničar, 2013, p. 7942.
- ↑ 1 2 3 Cerkovnik, Plesničar, 2013, p. 7945—7946.
Обзоры[править | править код]
- Cerkovnik J., Plesničar B. Recent Advances in the Chemistry of Hydrogen Trioxide (HOOOH) (англ.) // Chem. Rev. — 2013. — Vol. 113, no. 10. — P. 7930—7951. — DOI:10.1021/cr300512s.
Оригинальные работы[править | править код]
- Bergant A., Cerkovnik J., Plesničar B., Tuttle T. An Efficient Methyltrioxorhenium(VII)-Catalyzed Transformation of Hydrotrioxides (ROOOH) into Dihydrogen Trioxide (HOOOH) (англ.) // J. Am. Chem. Soc. — 2008. — Vol. 130, no. 43. — P. 14086—14087. — DOI:10.1021/ja806411a. — PMID 18834116.
- Czapski G., Bielski B. H. J. The formation and decay of H2O3 and HO2 in electron-irradiated aqueous solutions (англ.) // J. Phys. Chem. — 1963. — Vol. 67, no. 10. — P. 2180—2184. — DOI:10.1021/j100804a050.
- Engdahl A., Nelander B. The Vibrational Spectrum of H2O3 (англ.) // Science. — 2002. — Vol. 295. — P. 482—483. — DOI:10.1126/science.1067235. — PMID 11799239.
- Nyffeler P. T., Boyle N. A., Eltepu L., Wong C.-H., Eschenmoser A., Lerner R. A., Wentworth P. Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone (англ.) // Angew. Chem. Int. Ed. — 2004. — Vol. 43, no. 35. — P. 4656—4659. — DOI:10.1002/anie.200460457. — PMID 15317003.
Фтороводород — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 октября 2019; проверки требуют 12 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 октября 2019; проверки требуют 12 правок. Не следует путать с Hf.| Фтороводород | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
| Систематическое наименование | Фтороводород | ||
| Традиционные названия | фтористый водород, гидрофторид; водорода фторид | ||
| Хим. формула | HF | ||
| Рац. формула | HF | ||
| Состояние | газ или подвижная жидкость | ||
| Молярная масса | 20,01 г/моль | ||
| Плотность | 0,99 г/см³ | ||
| Энергия ионизации | 15,98 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −83,4 °C | ||
| • кипения | 19,54 °C | ||
| Критическая точка | 188 | ||
| Энтальпия | |||
| • образования | −273,3 кДж/моль | ||
| Давление пара | 783 ± 1 мм рт.ст.[1] | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 3,17 | ||
| Растворимость | |||
| • в воде | 72,47 (20 °C) | ||
| Рег. номер CAS | 7664-39-3 | ||
| PubChem | 14917 | ||
| Рег. номер EINECS | 231-634-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | MW7875000 | ||
| ChEBI | 29228 | ||
| ChemSpider | 14214 | ||
| Токсичность | Чрезвычайно ядовит, СДЯВ | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
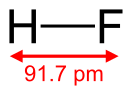
Фтороводоро́д (фтористый водород, гидрофторид, фторид водорода, HF) — бесцветный токсичный (очень ядовитый) газ (при стандартных условиях) с резким запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная летучая жидкость. Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует с водой азеотропную смесь с концентрацией 35,4 % HF.
Молекула фтороводорода сильно полярна, μ = 0,64⋅10−29 Кл·м. Фтороводород в жидком и газообразном состояниях имеет большую склонность к ассоциации вследствие образования сильных водородных связей. Энергия водородных связей FH•••FH приблизительно составляет 42 кДж/моль, а средняя степень полимеризации в газовой фазе (при температуре кипения) ≈4. Даже в газообразном состоянии фтороводород состоит из смеси полимеров H2F2, H3F3, H4F4, H5F5, H6F6. Простые молекулы HF существуют лишь при температурах выше 90 °C. Вследствие высокой прочности связи термический распад фтороводорода становится заметным лишь выше 3500 °C (что выше температуры плавления вольфрама — самого тугоплавкого из металлов). Для сравнения — у воды термический распад становится заметным при температурах выше 2000 °C.
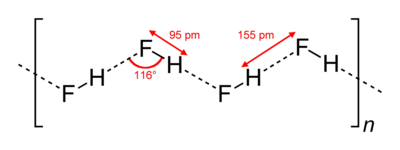
В кристаллическом состоянии HF образует орторомбические кристаллы, состоящие из цепеобразных структур: угол HFH = 116 °, d(F-H) = 95 пм, d(F•••H) = 155 пм. Аналогичные зигзагообразные
цепи с углом HFH = 140°) имеют и полимеры HF, существующие в газовой фазе.
Физические свойства[править | править код]
- Химические свойства HF зависят от присутствия воды. Сухой фтористый водород не действует на большинство металлов и не реагирует с оксидами металлов. Однако если реакция начнется, то дальше она некоторое время идет с автокатализом, так как в результате взаимодействия количество воды увеличивается:
- MgO+2HF→MgF2+h3O{\displaystyle {\mathsf {MgO+2HF\rightarrow MgF_{2}+H_{2}O}}}
- Жидкий HF — сильный ионизирующий растворитель. Все электролиты, растворённые в нём, за исключением хлорной кислоты HClO4, являются основаниями:
- HCl+2HF⇄h3Cl++HF2−{\displaystyle {\mathsf {HCl+2HF\rightleftarrows H_{2}Cl^{+}+HF_{2}^{-}}}}
- В жидком фтороводороде кислотные свойства проявляют соединения, которые являются акцепторами фторид-ионов, например, BF3, SbF5:
- BF3+2HF→h3F++[BF4]−{\displaystyle {\mathsf {BF_{3}+2HF\rightarrow H_{2}F^{+}+[BF_{4}]^{-}}}}
- Амфотерными соединениями в среде жидкого фтороводорода являются, например, фториды алюминия и хрома(III):
- 3NaF+AlF3→3Na++[AlF6]3−{\displaystyle {\mathsf {3NaF+AlF_{3}\rightarrow 3Na^{+}+[AlF_{6}]^{3-}}}}
- (AlF3 — как кислота)
- AlF3+3BF3→Al3++3[BF4]−{\displaystyle {\mathsf {AlF_{3}+3BF_{3}\rightarrow Al^{3+}+3[BF_{4}]^{-}}}}
- (AlF3 — как основание)
- Фтороводород в газообразном состоянии и в виде водного раствора реагирует с диоксидом кремния:
- При условии, если фтороводород в газообразном состоянии:
- 4HF+SiO2→SiF4+2h3O{\displaystyle {\mathsf {4HF+SiO_{2}\rightarrow SiF_{4}+2H_{2}O}}}
- При условии, если фтороводород в виде водного раствора:
- 6HF+SiO2→h3[SiF6]+2h3O{\displaystyle {\mathsf {6HF+SiO_{2}\rightarrow H_{2}[SiF_{6}]+2H_{2}O}}}
- Фтороводород неограниченно растворяется в воде, при этом происходит ионизация молекул HF:
- 2HF+h3O⇄HF2−+h4O+{\displaystyle {\mathsf {2HF+H_{2}O\rightleftarrows HF_{2}^{-}+H_{3}O^{+}}}}
- Kd= 7,2⋅10−4
- HF+F−⇄HF2−{\displaystyle {\mathsf {HF+F^{-}\rightleftarrows HF_{2}^{-}}}}
- Kd= 5,1
- 2HF+h3O⇄HF2−+h4O+{\displaystyle {\mathsf {2HF+H_{2}O\rightleftarrows HF_{2}^{-}+H_{3}O^{+}}}}
- Водный раствор фтороводорода (плавиковая кислота) является кислотой средней силы. Соли плавиковой кислоты называются фторидами. Большинство их труднорастворимо в воде, хорошо растворяются лишь фториды NH4, Na, К, Ag(I), Sn(II), Ni(II) и Mn(II). Все растворимые соли плавиковой кислоты очень ядовиты (в больших дозах).
Фтор со взрывом взаимодействует с водородом даже при низких температурах и (в отличие от хлора) в темноте с образованием фтороводорода:
- h3+F2→2HF{\displaystyle {\mathsf {H_{2}+F_{2}\rightarrow 2HF}}}
В промышленности фтороводород получают при взаимодействии плавикового шпата и сильных нелетучих кислот (например, серной):
- CaF2+h3SO4→CaSO4+2HF{\displaystyle {\mathsf {CaF_{2}+H_{2}SO_{4}\rightarrow CaSO_{4}+2HF}}}
Процесс проводят в стальных печах при 120—300 °C, по сравнению с аналогичными реакциями получения других галогеноводородов, реакция получения фтороводорода из фторидов идет очень медленно. Части установки, служащие для поглощения фтороводорода, делаются из свинца.
Фтористый водород (гидрофторид) обладает резким запахом, очень ядовит, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей. Фтороводород обладает слабыми наркотическими свойствами.
Как и некоторые другие производные фтора, HF высокоопасен в обращении.
Подробнее о токсикологии фтороводорода см в ст. Плавиковая кислота.
Применяют для получения криолита, фтористых производных урана, фреонов, фторорганических веществ, матового травления силикатного стекла (плавиковую кислоту — для прозрачного травления). Необычная растворимость биологических молекул в жидком фтороводороде без разложения (напр., белков) используется в биохимии. Добавление в жидкий фтороводород акцепторов фтора позволяет создавать сверхкислые среды.
- Известный писатель-фантаст Иван Ефремов написал повесть «Сердце змеи», в которой описал гипотетическую жизнь, образовавшуюся на планете, где основную роль в природе играет не кислород, а фтор, а вместо воды поверхность планеты покрыта океанами фтороводорода. На эту мысль писателя навела глубокая аналогия между свойствами воды и фтороводорода.
- Фтороводород реагирует со стеклом, поэтому он хранится в пластмассовых ёмкостях. При хранении фтороводорода в стеклянной посуде прибегают к покрытию стекла парафином для защиты его от фтороводорода.
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1994.
Сероводород — Википедия
| Сероводород | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
| Систематическое наименование | сульфид водорода | ||
| Традиционные названия | сероводород, сернистый водород | ||
| Хим. формула | H2S | ||
| Рац. формула | H2S | ||
| Состояние | газ | ||
| Молярная масса | 34.082 г/моль | ||
| Плотность | 1.5206 (н.у.)г/литр | ||
| Энергия ионизации | 10,46 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −82.30 °C | ||
| • кипения | −60.28 °C | ||
| Пределы взрываемости | 4 ± 1 об.%[1] | ||
| Давление пара | 17,6 ± 0,1 атм[1] | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 6.89, 19±2 | ||
| Растворимость | |||
| • в воде | 0.025 (40 °C) | ||
| Рег. номер CAS | 7783-06-4 | ||
| PubChem | 402 | ||
| Рег. номер EINECS | 231-977-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | MX1225000 | ||
| ChEBI | 16136 | ||
| Номер ООН | 1053 | ||
| ChemSpider | 391 | ||
| ЛД50 | 713 ppm (крыса, 1 час) | ||
| Токсичность | Высокотоксичен, СДЯВ | ||
| Пиктограммы ECB |    | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да, дигидросульфи́д) — бесцветный газ со сладковатым вкусом, обеспечивающий характерный неприятный тяжёлый запах тухлых яиц (тухлого мяса). Бинарное химическое соединение водорода и серы. Химическая формула — H2S. Плохо растворим в воде, хорошо — в этаноле. В больших концентрациях ядовит. Огнеопасен. Концентрационные пределы воспламенения в смеси с воздухом составляют 4,5—45 % сероводорода. Используется в химической промышленности для синтеза некоторых соединений, получения элементарной серы, серной кислоты, сульфидов. Сероводород также используют в лечебных целях, например в сероводородных ваннах[2].
В природе встречается редко в составе попутных нефтяных газов, природного газа, вулканических газах, в растворённом виде в природных водах (например, в Чёрном море слои воды, расположенные глубже 150—200 м, содержат растворённый сероводород). Образуется при гниении белков, которые содержат в составе серосодержащие аминокислоты метионин и/или цистеин. Небольшое количество сероводорода содержится в кишечных газах человека и животных.
Термически устойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2). Молекула сероводорода имеет изогнутую форму, поэтому она полярна (μ = 0,34⋅10−29 Кл·м). В отличие от воды, в сероводороде не образуются водородные связи, поэтому сероводород в обычных условиях не сжижается. Раствор сероводорода в воде — очень слабая сероводородная кислота. Является сверхпроводником при температуре 203 К (−70 °C) и давлении 150 ГПа[3].
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
- h3S→HS−+H+{\displaystyle {\mathsf {H_{2}S\rightarrow HS^{-}+H^{+}}}} Ka = 6,9⋅10−7 ; pKa = 6,89.
Реагирует со щелочами:
- h3S+2NaOH→Na2S+2h3O{\displaystyle {\mathsf {H_{2}S+2NaOH\rightarrow Na_{2}S+2H_{2}O}}} (средняя соль, при избытке NaOH)
- h3S+NaOH→NaHS+h3O{\displaystyle {\mathsf {H_{2}S+NaOH\rightarrow NaHS+H_{2}O}}} (кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. Окислительно-восстановительные потенциалы:
- S+2e−→S2−(Eh=−0.444B){\displaystyle {\mathsf {S+2e^{-}\rightarrow S^{2-}(Eh=-0.444B)}}}
- S+2H++2e−→h3S(Eh=0.144B){\displaystyle {\mathsf {S+2H^{+}+2e^{-}\rightarrow H_{2}S(Eh=0.144B)}}}
В воздухе горит синим пламенем:
- 2h3S+3O2→2h3O+2SO2{\displaystyle {\mathsf {2H_{2}S+3O_{2}\rightarrow 2H_{2}O+2SO_{2}}}}
при недостатке кислорода:
- 2h3S+O2→2S+2h3O{\displaystyle {\mathsf {2H_{2}S+O_{2}\rightarrow 2S+2H_{2}O}}} (на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или ион SO42−, например:
- 3h3S+4HClO3→3h3SO4+4HCl{\displaystyle {\mathsf {3H_{2}S+4HClO_{3}\rightarrow 3H_{2}SO_{4}+4HCl}}}
- 2h3S+SO2→2h3O+3S{\displaystyle {\mathsf {2H_{2}S+SO_{2}\rightarrow 2H_{2}O+3S}}}
Качественной реакцией на сероводородную кислоту и её соли является их взаимодействие с солями свинца, при котором образуется чёрный осадок сульфида свинца, например[4]:
- h3S+Pb(NO3)2→PbS↓+2HNO3{\displaystyle {\mathsf {H_{2}S+Pb(NO_{3})_{2}\rightarrow PbS{\downarrow }+2HNO_{3}}}}
При пропускании сероводорода через человеческую кровь она чернеет, поскольку гемоглобин разрушается и железо, входящее в его состав и придающее крови красный цвет, вступает в реакцию с сероводородом и образует чёрный сульфид железа[4].
Сульфиды[править | править код]
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок при введении в растворы солей металлов и растворимой соли сероводородной кислоты, например сульфида аммония (NH4)2S. Многие сульфиды ярко окрашены.
Для всех щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са2+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, в водном растворе растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями (например, Al2S3, Cr2S3 и др.), часто проходит необратимо с выпадением в осадок нерастворимого гидроксида.
Сульфиды применяются в технике, например полупроводники и люминофоры (сульфид кадмия, сульфид цинка), смазочные материалы (дисульфид молибдена) и др.
Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь, молибденит).
Пример окисления сульфида перекисью водорода:
- PbS+4h3O2=PbSO4+4h3O{\displaystyle {\mathsf {PbS+4H_{2}O_{2}=PbSO_{4}+4H_{2}O}}}
- Взаимодействием разбавленных кислот с сульфидами:
FeS+2 HCl⟶ FeCl2+ h3S↑{\displaystyle {\mathsf {FeS+2\ HCl\longrightarrow \ FeCl_{2}+\ H_{2}S\uparrow }}}
Al2S3+6 h3O⟶2 Al(OH)3↓+3 h3S↑{\displaystyle {\mathsf {Al_{2}S_{3}+6\ H_{2}O\longrightarrow 2\ Al(OH)_{3}\downarrow +3\ H_{2}S\uparrow }}}
- Сплавлением парафина с серой.
Соединения, генетически связанные с сероводородом[править | править код]
Является первым членом в ряде полисероводородов (сульфанов) — H2Sn (выделены полисероводороды с n=1÷8)[5].
Сероводород из-за своей токсичности находит ограниченное применение.
В норме[править | править код]
Эндогенный сероводород производится в небольших количествах клетками млекопитающих и выполняет ряд важных биологических функций, в том числе сигнальную. Это третий из открытых «газотрансмиттеров» (после окиси азота и угарного газа).
Эндогенный сероводород образуется в организме из цистеина при помощи ферментов цистатионин-β-синтетазы и цистатионин-γ-лиазы. Он является спазмолитиком (расслабляет гладкие мышцы) и вазодилататором, подобно окиси азота и угарному газу[6]. Он также проявляет активность в ЦНС, где он повышает NMDA-опосредованную нейротрансмиссию и способствует долговременному запоминанию информации[7].
В дальнейшем сероводород окисляется до сульфит-иона в митохондриях при помощи фермента тиосульфат-редуктазы. Сульфит-ион в дальнейшем окисляется до тиосульфат-иона и затем в сульфат-ион ферментом сульфит-оксидазой. Сульфаты, как конечный продукт метаболизма, экскретируются с мочой[8].
Благодаря свойствам, сходным со свойствами окиси азота (но без её способности образовывать пероксиды, реагируя с супероксидом), эндогенный сероводород считается сейчас одним из важных факторов, защищающих организм от сердечно-сосудистых заболеваний[6]. Известные кардиопротективные свойства чеснока связаны с катаболизмом полисульфидных групп аллицина в сероводород, причём эта реакция катализируется восстановительными свойствами глютатиона[9].
Хотя и оксид азота(II) NO, и сероводород способны расслаблять мышцы и вызывать вазодилатацию, их механизмы действия, судя по всему, различны. В то время как оксид азота активирует фермент гуанилатциклазу, сероводород активирует АТФ-чувствительные калиевые каналы в гладкомышечных клетках. Исследователям до настоящего времени неясно, как распределяются физиологические роли в регулировании тонуса сосудов между окисью азота, угарным газом и сероводородом. Однако существуют некоторые данные, позволяющие предположить, что окись азота в физиологических условиях в основном расширяет крупные сосуды, в то время как сероводород ответствен за аналогичное расширение мелких кровеносных сосудов[10].
Последние исследования заставляют предполагать значительное внутриклеточное кросс-общение между сигнальными путями оксида азота(II) и сигнальными путями сероводорода[11], демонстрирующие, что вазодилатирующие, спазмолитические, противовоспалительные и цитопротективные свойства этих газов взаимозависимы и взаимодополняющи. Кроме того, показано, что сероводород способен реагировать с внутриклеточными S-нитрозотиолами, в результате чего образуется наименьший возможный S-нитрозотиол — HSNO. Это заставляет предполагать, что сероводород играет роль в контроле за уровнем внутриклеточного содержания S-нитрозотиолов[12].
Подобно окиси азота, сероводород играет роль в расширении сосудов полового члена, необходимом для осуществления эрекции, что создаёт новые возможности для терапии эректильной дисфункции при помощи тех или иных средств, повышающих продукцию эндогенного сероводорода[13][14].
При патологических состояниях[править | править код]
При инфаркте миокарда обнаруживается выраженный дефицит эндогенного сероводорода, что может иметь неблагоприятные последствия для сосудов.[15] Инфаркт миокарда приводит к некрозу сердечной мышцы в зоне инфаркта через два различных механизма: один — это повышенный оксидативный стресс и повышенное образование свободных радикалов, и другой — это сниженная биодоступность эндогенных вазодилататоров и «защитников» тканей от свободнорадикального повреждения — окиси азота и сероводорода.[16] Повышенное образование свободных радикалов происходит вследствие повышенного несвязанного электронного транспорта в активном сайте фермента эндотелиальной синтазы оксида азота — фермента, ответственного за превращение L-аргинина в окись азота.[15][16] Во время инфаркта, окислительная деградация тетрагидробиоптерина, кофактора в процессе производства окиси азота, ограничивает доступность тетрагидробиоптерина и соответственно ограничивает способность синтазы оксида азота к производству NO.[16] В результате синтаза оксида азота реагирует с кислородом, другим косубстратом, необходимым для производства окиси азота. Результатом этого является образование супероксидов, повышенное образование свободных радикалов и внутриклеточный оксидативный стресс.[15] Дефицит сероводорода ещё более ухудшает эту ситуацию, нарушая активность синтазы оксида азота за счёт ограничения активности Akt и угнетения фосфорилирования Akt синтазы оксида азота в сайте eNOSS1177, необходимом для её активации.[15][17] Вместо этого при дефиците сероводорода активность Akt изменяется таким образом, что Akt фосфорилирует ингибирующий сайт синтазы оксида азота — eNOST495 — что приводит к ещё большему угнетению биосинтеза окиси азота.[15][17]
«Сероводородная терапия» использует донор или прекурсор сероводорода, такой как диаллил-трисульфид, для того, чтобы повысить содержание сероводорода в крови и тканях пациента с инфарктом миокарда. Доноры или прекурсоры сероводорода уменьшают повреждение миокарда после ишемии и реперфузии и риск осложнений инфаркта миокарда.[15] Повышенные уровни сероводорода в тканях и крови реагируют с кислородом, содержащимся в крови и тканях, в результате чего образуется сульфан-сера, промежуточный продукт, в составе которого сероводород «запасается», хранится и транспортируется в клетки.[15] Пулы сероводорода в тканях реагируют с кислородом, повышение содержания сероводорода в тканях активирует синтазу оксида азота и тем самым повышает продукцию окиси азота.[15] Вследствие повышения использования кислорода для производства окиси азота, меньше кислорода остаётся для реагирования с эндотелиальной синтазой оксида азота и производства супероксидов, повышенного при инфаркте, что в итоге приводит к уменьшению образования свободных радикалов.[15] Кроме того, меньшее образование свободных радикалов понижает оксидативный стресс в гладкомышечных клетках сосудов, понижая тем самым окислительную деградацию тетрагидробиоптерина.[16] Повышение доступности кофактора синтазы оксида азота — тетрагидробиоптерина — также способствует увеличению продукции окиси азота в организме.[16] Кроме того, более высокие концентрации сероводорода непосредственно повышают активность синтазы оксида азота через активацию Akt, что приводит к повышению фосфорилирования активирующего сайта eNOSS1177 и снижению фосфорилирования ингибирующего сайта eNOST495.[15][17] Это фосфорилирование приводит к повышению каталитической активности синтазы оксида азота, что приводит к более эффективному и более быстрому превращению L-аргинина в окись азота и повышению концентрации окиси азота.[15][17] Повышение концентрации окиси азота повышает активность растворимой гуанилатциклазы, что, в свою очередь, приводит к повышению образования циклического гуанозинмонофосфата цГМФ из ГТФ.[18] Повышение уровня циклического ГМФ приводит к повышению активности протеинкиназы G (PKG).[19] А протеинкиназа G приводит к снижению уровня внутриклеточного кальция в гладких мышцах стенок сосудов, что приводит к их расслаблению и усилению кровотока в сосудах.[19] Кроме того, протеинкиназа G также ограничивает пролиферацию гладкомышечных клеток стенок сосудов, уменьшая тем самым утолщение интимы сосудов. В конечном итоге «сероводородная терапия» приводит к уменьшению размеров зоны инфаркта.[15][18]
При болезни Альцгеймера уровень сероводорода в мозгу резко понижен.[20] В модели на крысах болезни Паркинсона концентрация сероводорода в мозгу крыс также оказалась пониженной, причём введение крысам доноров или прекурсоров сероводорода улучшало состояние животных вплоть до полного исчезновения симптомов.[21] При трисомии 21 (синдроме Дауна) организм, напротив, вырабатывает избыточное количество сероводорода.[8] Эндогенный сероводород также вовлечён в патогенез сахарного диабета 1-го типа. Бета-клетки поджелудочной железы больных сахарным диабетом 1-го типа вырабатывают чрезмерно повышенные количества сероводорода, что приводит к гибели этих клеток и к понижению секреции инсулина соседними, пока ещё живыми, клетками.[10]
Использование для гибернации и анабиоза[править | править код]
В 2005 году было показано, что мышь можно погрузить в состояние почти анабиоза: искусственной гипотермии, подвергнув её воздействию низких концентраций сероводорода (81 ppm) во вдыхаемом воздухе. Дыхание животных замедлилось со 120 до 10 дыхательных движений в минуту, а их температура тела упала с 37 градусов Цельсия до уровня, всего на 2 градуса Цельсия превышающего температуру окружающей среды (то есть эффект был таков, как будто теплокровное животное внезапно стало холоднокровным). Мыши пережили эту процедуру в течение 6 часов, причём после этого у них не наблюдалось никаких негативных последствий для здоровья, нарушений поведения или каких-либо повреждений внутренних органов[22] В 2006 году было показано, что артериальное давление у мыши, подвергнутой подобным образом воздействию сероводорода, существенно не снижается[23].
Сходный процесс, известный как гибернация или «зимняя спячка», наблюдается в природе у многих видов млекопитающих, а также у жаб, но не у мыши (хотя мышь может впадать в ступор при долгом отсутствии еды). Было показано, что во время «зимней спячки» продукция эндогенного сероводорода у тех животных, которые впадают в зимнюю спячку, значительно повышается. Теоретически, если бы удалось заставить вызываемую сероводородом гибернацию столь же эффективно работать у людей, это могло бы быть очень полезным в клинической практике для спасения жизни тяжело травмированных или перенёсших тяжёлую гипоксию, инфаркты, инсульты больных, а также для консервации донорских органов. В 2008 году было показано, что гипотермия, вызванная сероводородом в течение 48 часов, у крыс способна уменьшать степень повреждения головного мозга, вызываемого экспериментальным инсультом или травмой мозга[24].
Сероводород связывается с цитохромоксидазой C и тем самым предотвращает связывание с нею кислорода, что приводит к резкому замедлению метаболизма, но в больших количествах «парализует» клеточное дыхание и приводит к «удушью» на уровне клетки — к клеточной гипоксии. И у человека, и у животных все клетки организма в норме производят некоторое количество сероводорода. Ряд исследователей предположили, что, помимо других физиологических ролей, сероводород также используется организмом для естественной саморегуляции скорости метаболизма (метаболической активности), температуры тела и потребления кислорода, что может объяснить вышеописанное наступление гибернации у мышей и крыс при повышенных концентрациях сероводорода, а также повышение его концентрации при физиологической спячке у животных[25].
Однако два последних исследования вызывают сомнения в том, что этого эффекта гибернации и индукции гипометаболизма при помощи сероводорода возможно достичь у более крупных животных. Так, исследование 2008 года не смогло воспроизвести этот же эффект на свиньях, что привело исследователей к заключению, что эффект, наблюдаемый у мышей, не наблюдается у более крупных животных[26]. Аналогично другая статья отмечает, что эффекта индукции гипометаболизма и гибернации при помощи сероводорода, легко достижимого у мышей и крыс, не удаётся достичь у овец[27].
В феврале 2010 года учёный Марк Рот заявил на конференции, что вызванная сероводородом гипотермия у человека прошла I фазу клинических испытаний[28]. Однако решение о проведении дальнейших клинических испытаний на больных с инфарктом было отозвано основанной им компанией Ikaria в августе 2011 года ещё до начала набора участников испытаний без объяснения причин со ссылкой на «решение компании»[29][30].
Очень токсичен. Вдыхание воздуха с небольшим содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При вдыхании воздуха с небольшими концентрациями у человека довольно быстро возникает адаптация к неприятному запаху «тухлых яиц» и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус[31].
При вдыхании воздуха с большой концентрацией из-за паралича обонятельного нерва запах сероводорода почти сразу перестаёт ощущаться.
Порог запаха сероводорода (концентрации, при которых начинает ощущаться запах) по данным Всемирной Организации Здравоохранения («Рекомендации по качеству воздуха для Европы») составляет 0,007 мг/м3.
В Российской Федерации предельно-допустимая максимально-разовая концентрация сероводорода в атмосферном воздухе (ПДКм.р.) установлена на уровне порога запаха и составляет 0,008 мг/м3.
Концентрации сероводорода в воздухе, при которых начинаются обратимые реакции у чувствительных групп населения, значительно выше порога запаха.
В рекомендациях Всемирной Организации Здравоохранения по качеству атмосферного воздуха для Европы рекомендуемое значение, при котором могут возникнуть первые обратимые от воздействия сероводорода (раздражение глаз), составляет 0,15 мг/м3 — в 18,75 раз больше, чем порог запаха. Согласно отдельному докладу Всемирной Организации Здравоохранения, посвященному исследованиям воздействия сероводорода на здоровье населения, обратимая реакция у чувствительных групп населения (астматиков и аллергиков) начинается с концентрации 2,8 мг/м3, что в 350 раз выше порога запаха.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0337.html
- ↑ Польза сероводородных ванн
- ↑ A. P. Drozdov, M. I. Eremets, I. A. Troyan, V. Ksenofontov, S. I. Shylin. Conventional superconductivity at 203 kelvin at high pressures in the sulfur hydride system (англ.) // Nature. — Vol. 525, iss. 7567. — P. 73—76. — DOI:10.1038/nature14964.
- ↑ 1 2 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 88. Сероводород // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 206—207. — 240 с. — 1 630 000 экз.
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
- ↑ 1 2 Lefer, David J. A new gaseous signaling molecule emerges: Cardioprotective role of hydrogen sulfide (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — November (vol. 104, no. 46). — P. 17907—17908. — DOI:10.1073/pnas.0709010104. — Bibcode: 2007PNAS..10417907L. — PMID 17991773.
- ↑ Kimura, Hideo. Hydrogen sulfide as a neuromodulator (неопр.) // Molecular Neurobiology. — 2002. — Т. 26, № 1. — С. 13—19. — DOI:10.1385/MN:26:1:013. — PMID 12392053.
- ↑ 1 2 Kamoun, Pierre. H2S, a new neuromodulator (неопр.) // Médecine/Sciences. — 2004. — July (т. 20, № 6—7). — С. 697—700. — DOI:10.1051/medsci/2004206-7697. — PMID 15329822.
- ↑ Benavides, Gloria A; Squadrito, Giuseppe L; Mills, Robert W; Patel, Hetal D; Isbell, T Scott; Patel, Rakesh P; Darley-Usmar, Victor M; Doeller, Jeannette E; Kraus, David W. Hydrogen sulfide mediates the vasoactivity of garlic (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — 13 November (vol. 104, no. 46). — P. 17977—17982. — DOI:10.1073/pnas.0705710104. — Bibcode: 2007PNAS..10417977B. — PMID 17951430.
- ↑ 1 2 «Toxic Gas, Lifesaver», Scientific American, March 2010
- ↑ Coletta C., Papapetropoulos A., Erdelyi K., Olah G., Módis K., Panopoulos P., Asimakopoulou A., Gerö D., Sharina I., Martin E., Szabo C. Hydrogen sulfide and nitric oxide are mutually dependent in the regulation of angiogenesis and endothelium-dependent vasorelaxation. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2012. — Vol. 109, no. 23. — P. 9161—9166. — DOI:10.1073/pnas.1202916109. — PMID 22570497. [исправить]
- ↑ Filipovic M. R., Miljkovic J. Lj, Nauser T., Royzen M., Klos K., Shubina T., Koppenol W. H., Lippard S. J., Ivanović-Burmazović I. Chemical characterization of the smallest S-nitrosothiol, HSNO; cellular cross-talk of h3S and S-nitrosothiols. (англ.) // Journal of the American Chemical Society. — 2012. — Vol. 134, no. 29. — P. 12016—12027. — DOI:10.1021/ja3009693. — PMID 22741609. [исправить]
- ↑ Roberta d’Emmanuele di Villa Biancaa, Raffaella Sorrentinoa, Pasquale Maffiaa, Vincenzo Mironeb, Ciro Imbimbob, Ferdinando Fuscob, Raffaele De Palmad, Louis J. Ignarroe und Giuseppe Cirino. Hydrogen sulfide as a mediator of human corpus cavernosum smooth-muscle relaxation (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2009. — Vol. 106, no. 11. — P. 4513—4518. — DOI:10.1073/pnas.0807974105. — Bibcode: 2009PNAS..106.4513D. — PMID 19255435.
- ↑ Hydrogen Sulfide: Potential Help for ED (неопр.). WebMD (2 марта 2009).
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 King, Adrienne; Polhemus, Bhushan, Otsuka, Kondo, Nicholson, Bradley, Islam, Calvert, Tao, Dugas, Kelley, Elrod, Huang, Wang, Lefer; Bhushan, S.; Otsuka, H.; Kondo, K.; Nicholson, C. K.; Bradley, J. M.; Islam, K. N.; Calvert, J. W.; Tao, Y.-X.; Dugas, T. R.; Kelley, E. E.; Elrod, J. W.; Huang, P. L.; Wang, R.; Lefer, D. J. Hydrogen sulfide cytoprotective signaling is endothelial nitric oxide synthase-nitric oxide dependent (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2014. — January (vol. 111, no. Early Edition). — P. 1—6. — DOI:10.1073/pnas.1321871111. — Bibcode: 2014PNAS..111.3182K.
- ↑ 1 2 3 4 5 Alp, Nicholas; Channon. Regulation of endothelial nitric oxide synthase by tetrahydrobiopterin in vascular disease (англ.) // Journal of the American Heart Association (англ.)русск. : journal. — 2003. — Vol. 24. — P. 413—420. — DOI:10.1161/01.ATV0000110785.96039.f6.
- ↑ 1 2 3 4 Coletta, Ciro; Papapetropoulos, Erdelyi, Olah, Modis, Panopoulos, Asimakopoulou, Gero, Sharina, Martin, Szabo; Erdelyi, K.; Olah, G.; Modis, K.; Panopoulos, P.; Asimakopoulou, A.; Gero, D.; Sharina, I.; Martin, E.; Szabo, C. Hydrogen sulfide and nitric oxide are mutually dependent in the regulation of angiogenesis and endothelium-dependent vasorelaxation (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2012. — April (vol. 109, no. 23). — P. 9161—9166. — DOI:10.1073/pnas.1202916109. — Bibcode: 2012PNAS..109.9161C. — PMID 22570497.
- ↑ 1 2 Boerth, N. J.; Dey, Cornwell, Lincoln. Cyclic GMP-dependent protein kinase regulates vascular smooth muscle cell phenotype (англ.) // Journal of Vascular Research : journal. — 1997. — Vol. 34, no. 4. — P. 245—259. — DOI:10.1159/000159231. — PMID 9256084.
- ↑ 1 2 Lincoln, T. M.; Cornwell, Taylor. cGMP-dependent protein kinase mediates the reduction of Ca2+ by cAMP in vascular smooth muscle cells (англ.) // American Physiological Society (англ.)русск. : journal. — 1990. — March (vol. 258, no. 3). — P. C399—C407. — PMID 2156436.
- ↑ Eto, Ko; Takashi Asada; Kunimasa Arima; Takao Makifuchi; Hideo Kimura. Brain hydrogen sulfide is severely decreased in Alzheimer’s disease (англ.) // Biochemical and Biophysical Research Communications (англ.)русск. : journal. — 2002. — 24 May (vol. 293, no. 5). — P. 1485—1488. — DOI:10.1016/S0006-291X(02)00422-9. — PMID 12054683.
- ↑ Hu L. F., Lu M., Tiong C. X., Dawe G. S., Hu G., Bian J. S. Neuroprotective effects of hydrogen sulfide on Parkinson’s disease rat models. (англ.) // Aging cell. — 2010. — Vol. 9, no. 2. — P. 135—146. — DOI:10.1111/j.1474-9726.2009.00543.x. — PMID 20041858. [исправить]
- ↑ Mice put in ‘suspended animation’, BBC News, 21 April 2005
- ↑ Gas induces ‘suspended animation’, BBC News, 9 October 2006
- ↑ Florian B., Vintilescu R., Balseanu A. T., Buga A-M, Grisk O., Walker L. C., Kessler C., Popa-Wagner A; Vintilescu; Balseanu; Buga; Grisk; Walker; Kessler; Popa-Wagner. Long-term hypothermia reduces infarct volume in aged rats after focal ischemia (англ.) // Neuroscience Letters (англ.)русск. : journal. — 2008. — Vol. 438, no. 2. — P. 180—185. — DOI:10.1016/j.neulet.2008.04.020. — PMID 18456407.
- ↑ Mark B. Roth and Todd Nystul. Buying Time in Suspended Animation. Scientific American, 1 June 2005
- ↑ Li, Jia; Zhang, Gencheng; Cai, Sally; Redington, Andrew N. Effect of inhaled hydrogen sulfide on metabolic responses in anesthetized, paralyzed, and mechanically ventilated piglets (англ.) // Pediatric Critical Care Medicine (англ.)русск. : journal. — 2008. — January (vol. 9, no. 1). — P. 110—112. — DOI:10.1097/01.PCC.0000298639.08519.0C. — PMID 18477923.
- ↑ Haouzi P., Notet V., Chenuel B., Chalon B., Sponne I., Ogier V; and others. H2S induced hypometabolism in mice is missing in sedated sheep (англ.) // Respir Physiol Neurobiol : journal. — 2008. — Vol. 160, no. 1. — P. 109—115. — DOI:10.1016/j.resp.2007.09.001. — PMID 17980679.
- ↑ Mark Roth: Suspended animation is within our grasp (неопр.).
Теллуроводород — Википедия
| Теллуроводород | |||
|---|---|---|---|
| |||
| Традиционные названия | гидрид теллура, теллурид водорода, дигидрид теллура, дигидротеллурид | ||
| Хим. формула | H2Te | ||
| Состояние | газ | ||
| Молярная масса | 129,6159 г/моль | ||
| Плотность | 3,310 г/см³ | ||
| Температура | |||
| • плавления | −49 °C | ||
| • кипения | −2,2 °C | ||
| Энтальпия | |||
| • образования | 99,60 кДж/моль | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 2,6 | ||
| Растворимость | |||
| • в воде | 0,7 г/100 мл | ||
| • в этаноле | растворим | ||
| Рег. номер CAS | 7783-09-7 | ||
| PubChem | 21765 | ||
| Рег. номер EINECS | 231-981-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 49907 | ||
| ChemSpider | 20455 | ||
| Пиктограммы ECB |    | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Теллуроводоро́д (теллуран) — бинарное неорганическое соединение водорода и теллура с формулой H2Te. Представляет собой при нормальных условиях бесцветный, горючий, легкоразлагающийся газ с весьма неприятным запахом (напоминает чесночный запах арсина). Очень ядовит.
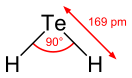
Молекула H2Те подобна молекуле сероводорода, имеет «изогнутую» структуру H-Те-H с углом между атомами водорода 89,5° и с расстоянием между атомами H и Te 0,169 нм.
Химические свойства теллуроводорода схожи со свойствами сероводорода, но в водных растворах H2Te более диссоциирован.
H2Те, как и селеноводород является очень сильным восстановителем, например, обесцвечивает раствор иода:
- h3Te+I2→2HI↑+Te{\displaystyle {\mathsf {H_{2}Te+I_{2}\rightarrow 2HI\uparrow +Te}}}
H2Те очень нестойкое соединение, уже при 0 °C в темноте медленно разлагается на элементы, при освещении скорость разложения нарастает (фотодиссоциация). Жидкий H2Те на свету разлагается очень быстро, именно от этого он на свету весьма быстро приобретает зеленовато-жёлтый цвет из-за растворения в нём элементарного теллура:
- h3Te→Te+h3↑{\displaystyle {\mathsf {H_{2}Te\rightarrow Te+H_{2}\uparrow }}}
Теллуроводород горит в воздухе или кислороде синим пламенем, с образованием диоксида теллура и воды:
- 2h3Te+3O2→2h3O+2TeO2{\displaystyle {\mathsf {2H_{2}Te+3O_{2}\rightarrow 2H_{2}O+2TeO_{2}}}}
Окисляется кислородом воздуха, особенно во влажном воздухе, до элементарного теллура даже при 0 °C:
- 2h3Te+O2→2Te+2h3O{\displaystyle {\mathsf {2H_{2}Te+O_{2}\rightarrow 2Te+2H_{2}O}}}
Для получения H2Те практически непригодны реакции взаимодействия теллуридов с водой или кислотами, так как из-за разложения образующегося H2Те его выход очень мал.
- Al2Te3+6HCl→3h3Te↑+2AlCl3{\displaystyle {\mathsf {Al_{2}Te_{3}+6HCl\rightarrow 3H_{2}Te\uparrow +2AlCl_{3}}}}
Поэтому используется электролитический метод с применением теллурового катода, платинового анода и серной (или ортофосфорной) кислот в качестве электролита при плотности тока несколько А/дм2 Процесс ведут при температуре около или немного ниже 0 °C.
Очистка[править | править код]
Выходящий из электролизёра газ (смесь H2Те, водорода, азота и водяного пара) предварительно глубоко осушают, пропуская последовательно через 2 колонки, наполненные плавленым хлоридом кальция и пентоксидом фосфора, затем, для отделения водорода и азота, газ пускают в приёмник, охлаждаемый жидким азотом или твердой углекислотой, где H2Те кристаллизуется. Процесс ведут в темноте или при очень слабом освещении.
Хранение[править | править код]
В твердом состоянии, при температуре жидкого азота. При этом H2Те разлагается очень медленно.
Предосторожности[править | править код]
Ввиду чрезвычайно высокой токсичности все работы с применением H2Те ведут в вытяжных шкафах.
Раствор H2Те в воде называют теллуроводородной кислотой. Её соли называют теллуридами. Как правило, эти соли — устойчивые соединения. Практически все теллуриды плохо растворимы в воде и окрашены в чёрный либо серый цвет. Исключение составляют теллуриды щелочных металлов и аммония, а также теллурид бериллия — бесцветные гигроскопические кристаллы, образующие кристаллогидраты. Растворы теллуридов в результате гидролиза имеют щелочную реакцию.
Пример реакции, не имеющей практического значения из-за трудности получения H2Те:
- CaO+h3Te→CaTe+h3O{\displaystyle {\mathsf {CaO+H_{2}Te\rightarrow CaTe+H_{2}O}}}
Поэтому теллуриды получают, как правило, прямым синтезом из элементов:
- 2K+Te→K2Te{\displaystyle {\mathsf {2K+Te\rightarrow K_{2}Te}}}
Так как H2Те — двухосновная кислота, можно было бы ожидать существование наряду со средними кислых солей, например как у селенидов, однако гидротеллуриды неизвестны.
Многие теллуриды металлов, особенно II группы таблицы Менделеева, обладают полезными термоэлектрическими, полупроводниковыми и фотополупроводниковыми свойствами.
H2Те применяется в электронной технологии для получения тончайших плёнок металлического теллура на различных подложках в процессах разложения или окисления: (1), (2). Также применяется для легирования из газовой фазы арсенида галлия, придавая ему электронный тип проводимости.
Теллуроводород очень токсичен, является гемолитическим ядом. Вдыхание теллуроводорода вызывает головную боль, тошноту и общую слабость; в дальнейшем присоединяются нарушения дыхания и кровообращения.
1-й класс опасности по ГОСТ 12.1.007-76.
- Гринвуд Н., Эрншо А. «Химия элементов». — Т.1. — М.: БИНОМ. Лаборатория знаний, 2008 стр. 56
- Гринвуд Н., Эрншо А. «Химия элементов». — Т.2. — М.: БИНОМ. Лаборатория знаний, 2008 стр. 117
- Некрасов Б. В. «Основы общей химии». — Т.1. — М.: Химия, 1973 стр. 352
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник». — Л.: Химия, 1977 стр. 104
- Gal, J.-F.; Maria, P.-C.; Decouzon, M., The Gas-Phase Acidity and Bond Dissociation Energies of Hydrogen Telluride, Int. J. Mass Spectrom. Ion Proc., 1989, 93, 87.
- Новый справочник химика и технолога. Основные свойства неорганических, органических и элементорганических соединений / Редкол.: Скворцов Н. К. и др.. — СПб.: АНО НПО «Мир и семья», 2002. — 1280 с.
Угольная кислота — Википедия
У́гольная кислота́ — слабая двухосновная кислота с химической формулой H2CO3, образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. В водных растворах неустойчива. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 г. австрийскими химиками[2].
Равновесие в водных растворах и кислотность[править | править код]
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
- CO2⋅h3O(p)⇄h3CO3(p){\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows H_{2}CO_{3(p)}}}}, константа равновесия при 25 °C Kp=[h3CO3][CO2⋅h3O]=1,70⋅10−3{\displaystyle K_{p}={\frac {\mathsf {[H_{2}CO_{3}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=1,70\cdot 10^{-3}}
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
- CO2⋅h3O(p)⇄CO2↑+ h3O{\displaystyle {\mathsf {CO_{2}\cdot H_{2}O_{(p)}\rightleftarrows CO_{2}\uparrow +\ H_{2}O}}}
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
- h3CO3+ h3O⇄HCO3−+ h4O+{\displaystyle {\mathsf {H_{2}CO_{3}+\ H_{2}O\rightleftarrows HCO_{3}^{-}+\ H_{3}O^{+}}}}, константа кислотности при 25 °C Ka1=[HCO3−]⋅[h4O+][h3CO3]=2,5⋅10−4{\displaystyle K_{a1}={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[H_{2}CO_{3}]}}}=2,5\cdot 10^{-4}}
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
- Ka′=[HCO3−]⋅[h4O+][CO2⋅h3O]=4,27⋅10−7{\displaystyle K_{a}’={\frac {\mathsf {[HCO_{3}^{-}]\cdot [H_{3}O^{+}]}}{\mathsf {[CO_{2}\cdot H_{2}O]}}}=4,27\cdot 10^{-7}}
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
- HCO3−+ h3O⇄CO32−+ h4O+{\displaystyle {\mathsf {HCO_{3}^{-}+\ H_{2}O\rightleftarrows CO_{3}^{2-}+\ H_{3}O^{+}}}}, константа кислотности при 25 °C Ka2=[CO32−]⋅[h4O+][HCO3−]=4,68⋅10−11{\displaystyle K_{a2}={\frac {\mathsf {[CO_{3}^{2-}]\cdot [H_{3}O^{+}]}}{\mathsf {[HCO_{3}^{-}]}}}=4,68\cdot 10^{-11}}
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
- CO2⇄h3OCO2⋅h3O⇄h3CO3⇄−H+HCO3−⇄−H+CO32−(∗){\displaystyle {\mathsf {CO_{2}{\stackrel {H_{2}O}{\rightleftarrows }}CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}{\stackrel {-H^{+}}{\rightleftarrows }}HCO_{3}^{-}{\stackrel {-H^{+}}{\rightleftarrows }}CO_{3}^{2-}(*)}}}
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
- pH≈−12lg(Ka′⋅L)=3,9{\displaystyle {\mathsf {pH}}\approx -{\frac {1}{2}}\lg(K_{a}’\cdot L)=3,9}, где L = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение[править | править код]
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
- h3CO3⟶h3O+CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\longrightarrow H_{2}O+CO_{2}\uparrow }}}
Взаимодействие с основаниями и солями[править | править код]
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
- h3CO3+2NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+2NaOH}}}(конц.)⟶Na2CO3+2h3O{\displaystyle {\mathsf {\longrightarrow Na_{2}CO_{3}+2H_{2}O}}}
- h3CO3+NaOH{\displaystyle {\mathsf {H_{2}CO_{3}+NaOH}}}(разб.)⟶NaHCO3+h3O{\displaystyle {\mathsf {\longrightarrow NaHCO_{3}+H_{2}O}}}
- h3CO3+ Ca(OH)2⟶CaCO3↓+ 2h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ Ca(OH)_{2}\longrightarrow CaCO_{3}\downarrow +\ 2H_{2}O}}}
- h3CO3+ Nh4⋅h3O⟶Nh5HCO3+h3O{\displaystyle {\mathsf {H_{2}CO_{3}+\ NH_{3}\cdot H_{2}O\longrightarrow NH_{4}HCO_{3}+H_{2}O}}}
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
- h3CO3+Na2CO3⟶2NaHCO3{\displaystyle {\mathsf {H_{2}CO_{3}+Na_{2}CO_{3}\longrightarrow 2NaHCO_{3}}}}
- h3CO3+ CaCO3⟶Ca(HCO3)2{\displaystyle {\mathsf {H_{2}CO_{3}+\ CaCO_{3}\longrightarrow Ca(HCO_{3})_{2}}}}
Угольная кислота образуется при растворении в воде диоксида углерода:
- CO2+h3O⇄CO2⋅h3O⇄h3CO3{\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows CO_{2}\cdot H_{2}O\rightleftarrows H_{2}CO_{3}}}}
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
- Na2CO3+2HCl⟶2NaCl+h3CO3{\displaystyle {\mathsf {Na_{2}CO_{3}+2HCl\longrightarrow 2NaCl+H_{2}CO_{3}}}}
- h3CO3→h3O+CO2↑{\displaystyle {\mathsf {H_{2}CO_{3}\rightarrow H_{2}O+CO_{2}\uparrow }}}
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора. Также применяется для производства хладагента, солнечных генераторов и морозильников.
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ International first: Gas-phase carbonic acid isolated
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.


 (
(
 (
(
 (
(