Могут ли существовать молекулы без химической связи?
Как мы учили в школе на уроках химии, атомы в молекулах удерживаются химической связью: ковалентной полярной, ковалентной неполярной… Бывает ионная связь — в кристаллах,— бывают связи двухцентровые и многоцентровые… Как же можно построить классическую молекулу, например, органического вещества, без химической связи? Мы задали этот вопрос главному редактору журнала «За науку» Алексею Паевскому, по образованию — химику-органику.
Как ни странно, правильный ответ на этот вопрос «отчасти – да». Бывают молекулы, разные части которых удерживаются исключительно механически.
Для начала вспомним одного из трех лауреатов Нобелевской премии по химии 1987 года Дональда Джеймса Крама, который, развивая идею комплексов «гость-хозяин», создал новый тип молекул, карцеранды — органическая молекула представляет собой «клетку», «карцер», внутри которого заключена другая молекула, будь то большой атом инертного газа или, скажем, нитробензол (рис. 1).
1).
Рисунок 1. Молекула нитробензола в полости карцеранда
Однако это все-таки не совсем то: части молекулы неравноправны, одна «спрятана» внутри другой. Возможны еще более восхитительные варианты. Существует (и синтезировано в лабораториях) целых четыре типа молекул с настоящей механической связью. Их называют катенаны, ротаксаны, молекулярные узлы и молекулярные кольца Борромео. Все эти молекулы отличает то, что некоторые связи между частями молекул исключительно механические, то есть физическое соприкосновение частей молекулы не дает им распасться или изменить взаимоположение. Давайте посмотрим, что это за молекулы.
Катенаны.
Латинское слово «catena» означает «цепь». Именно это и отличает катенаны — они представляют собой два или более цикла, продетых друг в друга. Первые синтезы катенанов представляли собой реакции циклизации длинных цепочек в присутствии других кольцевых молекул. Надеялись лишь на случай: вдруг какая-то часть молекул во время замыкания циклов окажется продетой в уже существующий цикл. Однако выходы таких реакций всегда оказываются микроскопическими. Поэтому Генри Шиллом, первопроходцем этой темы, был разработан направленный метод синтеза, когда сперва будущие кольца были соединены перемычками, а посте того, как два или три звена цепочки колец собраны, перемычки разрушались.
Однако выходы таких реакций всегда оказываются микроскопическими. Поэтому Генри Шиллом, первопроходцем этой темы, был разработан направленный метод синтеза, когда сперва будущие кольца были соединены перемычками, а посте того, как два или три звена цепочки колец собраны, перемычки разрушались.
За последние годы прогресс в синтезе катенанов оказался огромным. Ученые сумели соединить, подобно известной эмблеме, пять колец. Разумеется, такое вещество назвали «олимпиаданом».
Рисунок 2. Олимпиадан
Кроме того, появились новые типы катенанов: претцеланы, в которых кольца продеты друг в друга, но еще и соединены молекулярным мостиком. Также есть «катенаны в форме наручников» (это вполне официальное название — handcuff-shaped catenanes). Почему они так названы, можно понять, посмотрев на их топологию.
Рисунок 3. Топология обычного катенана
Рисунок 4. Топология претцелана
Рисунок 5. Топология катенана в форме наручников
Кстати, существуют катенаны и в природе — молекулярным биологам давно известны катенановые ДНК.
Ротаксаны.
Это название образовано из двух слов: «rotor» — вращение и «axis» — ось. Такие молекулы представляют собой длинную молекулярную цепочку, продетую сквозь цикл. Однако соскользнуть с оси циклу мешают массивные группы атомов на концах цепи. Современные ученые рассматривают такие структуры как элементы молекулярных машин.
Рисунок 6. Ротаксан
Молекулярные узлы.
Здесь все просто — молекула представляет собой неразрывную замкнутую структуру, к тому же, завязанную в узел. Органики научились синтезировать и такое!
Рисунок 7. Молекулярный узел
Молекулярные кольца Борромео.
Простые кольца Борромео видели все, хотя и не знали, что они так называются. Это просто три кольца, попарно продетые друг в друга. Представляете себе, сравнительно недавно химики научились синтезировать и такие молекулы. Вот, посмотрите на структуру.
Рисунок 8. Молекулярные кольца Борромео
Молекула-рука поможет сортировать зеркальные изомеры
22 июня, 2021 16:09
Источник:
Полит. ру
ру
Химики из Института элементоорганических соединений имени А. Н. Несмеянова предложили новый метод получения «зеркальных» катализаторов, которые используются для создания ценных органических соединений — например, противогрибковых препаратов. Это поможет решить проблему тестирования лекарств, у которых есть вторая форма — зеркально симметричный «близнец», способный вызывать опасные побочные эффекты. Статья об исследовании, поддержанном грантом Российского научного фонда, опубликована в журнале Angewandte Chemie, кратко о результатах рассказала пресс-служба фонда.
Рисунок, показывающий избирательное связывание молекулы-руки с одной из форм катализатора. Источник: Дмитрий Перекалин
Кристаллы «зеркальных» родиевых катализаторов.![]() Желтый — катализатор, связанный со вспомогательным лигандом, оранжевый — его зеркальный антипод, оставшийся свободным. Источник: Дмитрий Перекалин
Желтый — катализатор, связанный со вспомогательным лигандом, оранжевый — его зеркальный антипод, оставшийся свободным. Источник: Дмитрий Перекалин
Молекулы целого ряда веществ делятся на два типа, представляющие собой зеркальные отражения друг друга. Такие молекулы можно сравнить с левой и правой ладонями человека, строение которых совпадает, но пространственная ориентация различается, и совместить их в пространстве невозможно. В химии подобное свойство молекул называется хиральностью (от греческого слова χείρ — «рука»), а молекулы, представляющие собой отражение друг друга, — энантиомерами. Подробнее о них можно прочитать в очерке «Молекула перед зеркалом».
Энантиомеры одинаково реагируют с веществами, не имеющими зеркальных изомеров. Но если другое вещество тоже обладает хиральными свойствами или же это качество присуще катализатору, при котором идет реакция, то результаты реакции энантиомеров будут различны. Обычно это происходит в биохимических процессах.
Получение энантиомеров — серьезная проблема для фармацевтических компаний. Их часто синтезируют из природных соединений, однако в этом случае обычно есть только одна из зеркальных копий молекулы — либо «правая», либо «левая». Из-за ограниченного доступа к обеим копиям веществ многие специалисты и вовсе отказались от разработки препаратов, для которых возможно потенциальное существование энантиомеров. Решить эту проблему можно с помощью «зеркальных» катализаторов, которые позволяют синтезировать оба энантиомера лекарственных молекул. Такие катализаторы стали популярны благодаря японским исследователям в конце XX века и в настоящее время широко используются в лабораториях по всему миру.
Из-за ограниченного доступа к обеим копиям веществ многие специалисты и вовсе отказались от разработки препаратов, для которых возможно потенциальное существование энантиомеров. Решить эту проблему можно с помощью «зеркальных» катализаторов, которые позволяют синтезировать оба энантиомера лекарственных молекул. Такие катализаторы стали популярны благодаря японским исследователям в конце XX века и в настоящее время широко используются в лабораториях по всему миру.
Авторы исследования предложили новый необычный способ получения «зеркальных» катализаторов. В его основе лежит разделение доступной смеси родиевых катализаторов на «правые» и «левые» молекулы. Из природной «левой» аминокислоты ученые синтезировали специальную молекулу-руку, которая схватывает только «правые» катализаторы и не трогает «левые». Такая избирательность обеспечивается отталкиванием между фрагментами молекул при попытке руки схватить «левый» катализатор. Ошибки сортировки случаются очень редко — не чаще чем в одном случае из двухсот.
«Разработанный подход применим для сортировки совершенно разных соединений. При этом важно подчеркнуть, что оптимальную геометрию вспомогательной молекулы можно заранее подобрать с помощью быстрых расчетов даже на обычном домашнем компьютере. Это позволяет проводить исследование более рационально и избежать поиска методом проб и ошибок. Таким образом мы сможем создавать новые катализаторы для получения лекарственных препаратов и других ценных органических соединений», — рассказывает руководитель проекта по гранту РНФ Дмитрий Перекалин, заведующий лабораторией функциональных элементоорганических соединений ИНЭОС РАН
Теги
Президентская программа, Химия и материалы, Молодежные группы
Структура органических молекул — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 844
Здесь вы научитесь понимать, писать, рисовать и говорить об органических молекулах. Почему были разработаны различные техники рисования? Органические молекулы могут стать сложными и большими. Утомительно постоянно вытягивать каждую деталь, особенно когда в этом нет необходимости, поэтому о-химики прошлого разработали эти методы, чтобы сделать их более удобными и простыми. Кроме того, некоторые из этих сокращенных способов рисования молекул дают нам представление об углах связи, относительном положении атомов в молекуле, а некоторые устраняют многочисленные атомы водорода, которые могут мешать смотреть на основу структуры.
Почему были разработаны различные техники рисования? Органические молекулы могут стать сложными и большими. Утомительно постоянно вытягивать каждую деталь, особенно когда в этом нет необходимости, поэтому о-химики прошлого разработали эти методы, чтобы сделать их более удобными и простыми. Кроме того, некоторые из этих сокращенных способов рисования молекул дают нам представление об углах связи, относительном положении атомов в молекуле, а некоторые устраняют многочисленные атомы водорода, которые могут мешать смотреть на основу структуры.
Введение
Обратите внимание на следующие рисунки структуры ретинола, наиболее распространенной формы витамина А. Первый рисунок следует прямолинейной (также известной как Кекуле) структуре, которая полезна, когда вы хотите рассмотреть каждый отдельный атом; однако отображение всех атомов водорода затрудняет сравнение общей структуры с другими подобными молекулами и затрудняет сосредоточение внимания на двойных связях и группе ОН.
Ретинол: прямолинейный рисунок Кекуле
Ниже приведена формула ретинола в виде линии связи (также известной как зигзаг).![]() При таком упрощенном представлении можно легко увидеть углерод-углеродные связи, двойные связи, группу ОН и группы CH 3 , отходящие от основного кольца и цепи. Кроме того, это намного быстрее нарисовать, чем тот, что выше. Вы научитесь ценить этот тип написания формулы после того, как нарисуете бесчисленное количество органических молекул.
При таком упрощенном представлении можно легко увидеть углерод-углеродные связи, двойные связи, группу ОН и группы CH 3 , отходящие от основного кольца и цепи. Кроме того, это намного быстрее нарисовать, чем тот, что выше. Вы научитесь ценить этот тип написания формулы после того, как нарисуете бесчисленное количество органических молекул.
Ретинол: формула Bond-Line или зигзаг
Важность структуры
Изучение и применение на практике основ органической химии очень поможет вам в долгосрочной перспективе, когда вы будете изучать новые концепции и реакции. Некоторые люди говорят, что органическая химия похожа на другой язык, и в некоторых аспектах это так. Поначалу это может показаться трудным или непосильным, но чем больше вы будете практиковаться в рассмотрении и рисовании органических молекул, тем лучше вы будете знакомиться со структурами и формулами. Еще одна хорошая идея — приобрести комплект моделей и физически создать молекулы, которые вам сложно представить в голове.
Изучая общую химию, вы, возможно, уже изучали молекулярную структуру. Различные способы рисования органических молекул включают Кекуле (прямая линия), сокращенные формулы и формулы линий связи (зигзаг). Будет полезнее, если вам будет удобно переходить от одного стиля рисования к другому, смотреть на рисунки и понимать, что они означают, чем знать, какой вид рисунка как называется.
Примером рисунка, который включает в себя все три способа рисования органических молекул, может быть следующий дополнительный рисунок ретинола. Большая часть рисунка выполнена по формуле Bond-line (зигзаг), но -CH 3 записываются в виде сокращенных формул, а группа -ОН записывается в форме Кекуле.
Широко используемый способ отображения трехмерной структуры молекул — использование штрихов, клиньев и прямых линий. Этот метод рисования важен, потому что размещение разных атомов может дать разные молекулы, даже если молекулярные формулы будут точно такими же. Ниже приведены два рисунка четырехуглеродной молекулы с двумя присоединенными атомами хлора и двумя атомами брома.
Ниже приведены два рисунка четырехуглеродной молекулы с двумя присоединенными атомами хлора и двумя атомами брома.
4-углеродная молекула с 2 атомами хлора и 2 бромами 4-углеродная молекула с 2 атомами хлора и 2 бромами
Оба рисунка выглядят так, как будто они представляют одну и ту же молекулу; однако, если мы добавим черточки и заштрихуем, то увидим, что можно изобразить две разные молекулы:
Две вышеуказанные молекулы разные, докажите это себе, построив модель. Более простой способ сравнить две молекулы — повернуть одну из связей (здесь это связь справа):
Обратите внимание, что молекула справа имеет бром на одной стороне и хлор на одной стороне, тогда как первая молекула отличается. Прочтите о структурах пунктирно-клинообразных линий внизу страницы, чтобы понять, о чем было сказано выше. Вы узнаете больше о важности связи атомов в молекулах, продолжая изучать стереохимию.
Рисунок структуры органических молекул
Хотя более крупные молекулы могут показаться сложными, их можно легко понять, разбив их на части и рассмотрев более мелкие компоненты.
Все атомы хотят, чтобы их валентная оболочка была полной, «закрытой оболочкой». Водород хочет иметь 2 e — , тогда как углерод, кислород и азот хотят иметь 8 e — . Рассматривая различные представления молекул, помните о правиле октетов. Также помните, что водород может связать один раз, кислород может связать до двух раз, азот может связать до трех раз, а углерод может связать до четырех раз.
Кекуле (также известные как прямолинейные конструкции)
Структуры Кекуле аналогичны структурам Льюиса, но вместо ковалентных связей, представленных электронными точками, два общих электрона показаны линией.
(A) (B)(C)
Неподеленные пары остаются в виде двух электронных точек или иногда не учитываются, даже если они все еще существуют . Обратите внимание, что три неподеленные пары электронов не были втянуты вокруг хлора в примере B.
Сокращенные формулы
Сокращенная формула состоит из символов элементов. Порядок атомов предполагает связность. Сокращенные формулы можно читать с любого направления и H 3 C совпадает с CH 3 , хотя последний более распространен, потому что посмотрите на примеры ниже и сопоставьте их с их идентичной молекулой по структурам Кекуле и формулам линий связи.
Порядок атомов предполагает связность. Сокращенные формулы можно читать с любого направления и H 3 C совпадает с CH 3 , хотя последний более распространен, потому что посмотрите на примеры ниже и сопоставьте их с их идентичной молекулой по структурам Кекуле и формулам линий связи.
(a) Ch 3 CH 2 OH (B) CLCH 2 CH 2 CH (OCH 3 ) CH 3 (C) H 3 CNHCH 2 (C) H 3 CNHCH 2 (C) H 3 CNHCH 2 (C) H 3 CNHCH 2 (C) H 3 CNHCH 2 (C) H 3 CNHCH 2 (C). Давайте внимательно посмотрим на пример B. Когда вы работаете с сокращенной формулой, вы хотите сосредоточиться на углероде и других элементах, которые не являются водородом. Водороды важны, но обычно они используются для завершения октетов. Также обратите внимание на -OCH 3 написано в круглых скобках, что говорит вам, что это не часть основной цепи углерода. Название говорит о том, как работает эта формула. Эта формула полна связей и линий, и из-за типичных (более стабильных) связей, которые атомы склонны образовывать в молекулах, они часто в конечном итоге выглядят как зигзагообразные линии. Если вы работаете с набором молекулярных моделей, вам будет трудно собрать прямые молекулы (если только они не содержат sp-тройные связи), тогда как зигзагообразные молекулы и связи гораздо более осуществимы. (А) (Б) (В) Эти молекулы соответствуют точно таким же молекулам, которые изображены для структур Кекуле и сокращенных формул. Как вы уже догадались, структура штрих-клиновидной линии состоит из линий, штрихов и клиньев. Поначалу это может показаться запутанным, но с практикой понимание структуры штриховых линий станет для вас второй натурой. Ниже приведены примеры каждого и то, как их можно использовать вместе. Выше приведены 4-углеродные цепи с присоединенными ОН-группами или атомами Cl и Br. Синий шарик = группа ОН; Белая бусина=H Клинообразные линии иллюстрируют связи и атомы, которые выходят из страницы перед плоскостью к вам. На двухмерной диаграмме выше группа ОН выходит из плоскости бумаги, а водород входит внутрь (пунктир). Синяя бусина = группа ОН; Белая бусина = H Как указывалось ранее, прямые линии иллюстрируют атомы и связи, которые находятся в той же плоскости, что и бумага, но в двумерном примере прямая линия связи для OH означает, что неясно или не имеет значения, уходит ли OH или к вам. Синий шарик = группа ОН; H не показана Попробуйте с помощью комплекта моделей убедиться, что группа ОН не может лежать в одной плоскости в углеродной цепи (не забудьте свои атомы водорода!). В последнем примере 2D используются как пунктирные, так и клиновидные линии, поскольку присоединенные атомы не являются атомами водорода (хотя пунктирные и клиновидные линии можно использовать для водорода ). Хлор выходит из страницы, а бром входит в страницу. Синий шарик=Cl; Красная бусина=Br Structure of Organic Molecules распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts. Перейти к содержимому Органические молекулы могут быть большими и содержать несколько атомов углерода, водорода и других элементов. Их архитектура может быть сложной, с цепочками различной длины и кольцевой структурой. Рассмотрим структуры, показанные здесь: Обе эти структуры являются представлениями органических молекул. Каждый содержит 5 атомов углерода и 12 атомов водорода. Но выглядят они по-разному, и оказывается, что так оно и есть: свойства этих веществ схожи, но не совсем одинаковы. Вещество слева имеет температуру кипения 9,5 ºC, что делает его газом при комнатной температуре. Когда мы начинаем рассматривать и изучать органические молекулы, мы очень быстро сталкиваемся с этим фактом: молекулярные структуры (показывающие количество и типы атомов в молекуле, такие как H 2 O) не подходят для описания этих веществ. По этой причине в органической химии мы используем различные типы формул. Есть несколько типов, в том числе Вышеуказанные структуры показаны в виде структурных формул, но могут быть также представлены в виде структур с конденсированными или линейными связями. Можете ли вы сказать, какая из двух структур показана в приведенных здесь примерах? CH 3 CH(CH 3 )CH 2 CH 3 Составление структурных формул является хорошей отправной точкой для начинающих химиков-органиков и работает при работе с небольшими простыми структурами. Такие большие молекулы обычно рассматриваются в органической химии и биохимии. В таких ситуациях действительно помогают структуры Line-bond. Чтобы научиться точно рисовать их, вам сначала нужно ознакомиться с некоторыми распространенными механизмами связи, включающими элементы, часто встречающиеся в органических молекулах. Начнем с углерода. Углерод считается четырехвалентным, что означает, что он имеет тенденцию образовывать четыре связи. Если вы посмотрите на различные структуры, включая углерод, вы увидите, что почти всегда каждый атом углерода имеет четыре связывающие пары электронов, каждая из которых представлена в виде линии, окружающей его. Это закономерность, которая характерна для большинства органических молекул, которые мы увидим. Если углерод имеет другое расположение электронов в своей валентной оболочке (другими словами, если он не удовлетворяет правилу октета), он будет иметь формальный заряд или существовать как радикал: Если вы сможете быстро распознать эти закономерности (и описанные ниже закономерности для других атомов), это очень поможет вам в изучении органической химии. Модель водорода проста: атомы водорода имеют только одну связь и не имеют формального заряда. Как правило, все атомы водорода в органических молекулах имеют одну связь и не имеют формального заряда. Для кислорода вы увидите связь атома тремя способами, каждый из которых соответствует правилу октета. В большинстве случаев атом кислорода имеет две связи и две неподеленные пары, как и в воде. При таком расположении он будет иметь формальный заряд, равный нулю. Если он имеет одну связь и три неподеленные пары, как в гидроксид-ионе, он будет иметь формальный заряд -1. Если у него три связи и одна неподеленная пара, формальный заряд будет +1. Опять же, есть некоторые дополнительные возможности. Однако эти три примера объяснят практически все, что мы видим. Азот имеет две основные схемы связывания, каждая из которых соответствует правилу октета: Если азот имеет три связи и неподеленную пару, он имеет формальный заряд, равный нулю. Если у него четыре связи (и нет неподеленной пары), формальный заряд +1. В довольно необычной модели связи отрицательно заряженный азот имеет две связи и две неподеленные пары. Два элемента третьего ряда обычно встречаются в важных органических молекулах: сера и фосфор. Хотя оба этих элемента имеют другие схемы связывания, которые имеют значение для лабораторной химии, в биологическом контексте сера почти всегда следует той же схеме связи/формального заряда, что и кислород, в то время как фосфор присутствует в форме иона фосфата (PO 4 ). 3-), где у него пять связей (почти всегда с кислородом), нет неподеленных пар и формальный заряд равен нулю. Наконец, галогены (фтор, хлор, бром и йод) очень важны в лабораторной и медицинской органической химии, но менее распространены в природных органических молекулах. Галогены в органических соединениях обычно имеют одну связь, три неподеленных пары и формальный заряд, равный нулю. Иногда, особенно в случае брома, мы сталкиваемся с реакционноспособными частицами, в которых галоген имеет две связи (обычно в трехчленном кольце), две неподеленные пары и формальный заряд +1. Эти правила, если их выучить и усвоить так, что вам даже не нужно будет о них думать, позволят вам довольно быстро рисовать большие органические структуры с формальными зарядами. Типы органической структуры часто не включают неподеленные пары, поскольку вы можете предположить, что вокруг каждого атома присутствует надлежащее количество электронов, чтобы соответствовать указанному формальному заряду (или его отсутствию). Если вы посмотрите в этой и других книгах на то, как изображаются органические соединения, вы увидите, что рисунки несколько отличаются от структур Льюиса, которые вы привыкли видеть в общей химии. книга. В некоторых источниках вы увидите 90 140 сокращенных структур 90 141 для более мелких молекул вместо полных структурных формул, включающих каждую связь: Чаще химики-органики и биологические химики используют сокращенное обозначение, называемое линейно-связующие структуры, также иногда называют скелетными структурами. Условное обозначение облегчает рисование молекул, но его необходимо изучить. Вот как это работает: атомы углерода изображаются не символом элемента, а вершиной (углом) или свободным концом связи. Молекулы с открытой цепью обычно вытянуты в форме «зигзага». Водороды, присоединенные к углероду, обычно не показаны: скорее, как и одинокие пары, предполагается, что человек, наблюдающий за структурой, знает, где они находятся. Структуры с линейными связями позволяют намного легче увидеть основную структуру молекулы и места, где есть что-то кроме одинарных связей C-C и C-H. Его также можно быстро нарисовать. Иногда один или несколько атомов углерода в линейной структуре изображаются с заглавной буквы C, если это облегчает понимание объяснения. Если вы обозначите углерод буквой C, вы также должны нарисовать атомы водорода для этого углерода . Упражнение 2.1.1 Хороший способ проверить свое понимание линейной структуры — посмотреть, сможете ли вы точно определить число атомов водорода в молекуле по ее линейчатой структуре. Сделайте это для структур здесь. Упражнение 2.1.2 Нарисуйте линейными структурами гистидин (аминокислота) и пиридоксин (витамин B 6 ).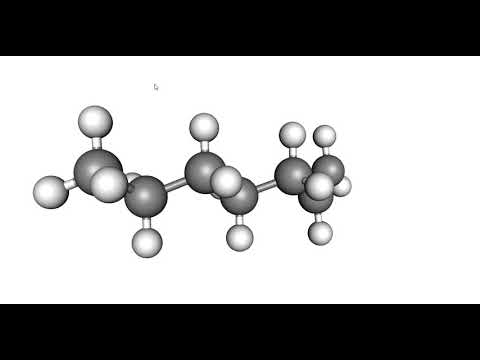 Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи. В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что углерод не имеет полного октета и кислорода.
Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи. В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что углерод не имеет полного октета и кислорода. Bond-Line (также известный как зигзаг) Формулы
 Обратите внимание, что углероды больше не нарисованы и заменены концами и изгибами линий. Кроме того, водороды были опущены, но их можно было легко втянуть (см. Практические задачи). Хотя мы обычно не рисуем Н, которые связаны с углеродом, мы рисуем их, если они связаны с другими атомами, помимо углерода (примером является группа ОН выше в примере А). Это делается потому, что не всегда ясно, окружен ли неуглеродный атом неподеленными парами или атомами водорода. Также в примере A обратите внимание, как ОН нарисован со связью со вторым углеродом, но это не означает, что на конце этой связи/линии есть третий углерод.
Обратите внимание, что углероды больше не нарисованы и заменены концами и изгибами линий. Кроме того, водороды были опущены, но их можно было легко втянуть (см. Практические задачи). Хотя мы обычно не рисуем Н, которые связаны с углеродом, мы рисуем их, если они связаны с другими атомами, помимо углерода (примером является группа ОН выше в примере А). Это делается потому, что не всегда ясно, окружен ли неуглеродный атом неподеленными парами или атомами водорода. Также в примере A обратите внимание, как ОН нарисован со связью со вторым углеродом, но это не означает, что на конце этой связи/линии есть третий углерод. Структура штрих-клиновидной линии
 Помните, что каждая линия представляет собой связь, а атомы углерода и водорода опущены. Когда вы смотрите на эти структуры или рисуете их, прямые линии изображают атомы и связи, находящиеся в одной плоскости, плоскости бумаги (в данном случае экрана компьютера). Пунктирные линии показывают атомы и связи, которые уходят на страницу, за плоскость, от вас. В приведенном примере группа ОН уходит в плоскость, в то же время выходит (заклинивается) водород.
Помните, что каждая линия представляет собой связь, а атомы углерода и водорода опущены. Когда вы смотрите на эти структуры или рисуете их, прямые линии изображают атомы и связи, находящиеся в одной плоскости, плоскости бумаги (в данном случае экрана компьютера). Пунктирные линии показывают атомы и связи, которые уходят на страницу, за плоскость, от вас. В приведенном примере группа ОН уходит в плоскость, в то же время выходит (заклинивается) водород. Также предполагается, что водород также связан с тем же углеродом, на котором находится ОН.
Также предполагается, что водород также связан с тем же углеродом, на котором находится ОН. Практические задачи

(подсказка: все ли атомы углерода имеют 4 связи? Все атомы кислорода имеют полный октет?) Ответы

Ссылки
Авторы

На этой странице нет тегов.
2.1 Рисование и интерпретация органических формул – введение в органическую химию
 Вещество справа имеет температуру кипения 28 ºC, поэтому оно является жидкостью при комнатной температуре.
Вещество справа имеет температуру кипения 28 ºC, поэтому оно является жидкостью при комнатной температуре. Существуют различные уровни сжатия, и есть некоторые правила правильного сокращения формул. Вы будете читать их чаще, чем писать, поскольку все эти правила сложно выучить.
Существуют различные уровни сжатия, и есть некоторые правила правильного сокращения формул. Вы будете читать их чаще, чем писать, поскольку все эти правила сложно выучить. Общие схемы связывания в органических структурах
 Но когда вы начинаете иметь дело с более крупными структурами, это становится все труднее и требует больше времени. Представьте себе, что вы пытаетесь нарисовать все атомы и связи каждый раз, когда хотите обсудить приведенную ниже структуру, которая представляет собой один маленький фрагмент ДНК:
Но когда вы начинаете иметь дело с более крупными структурами, это становится все труднее и требует больше времени. Представьте себе, что вы пытаетесь нарисовать все атомы и связи каждый раз, когда хотите обсудить приведенную ниже структуру, которая представляет собой один маленький фрагмент ДНК:

 Помните, что атомы элементов в третьем ряду и ниже в периодической таблице имеют «расширенные валентные оболочки» с d орбиталей, доступных для связывания, и правило октета не всегда применяется.
Помните, что атомы элементов в третьем ряду и ниже в периодической таблице имеют «расширенные валентные оболочки» с d орбиталей, доступных для связывания, и правило октета не всегда применяется. Однако иногда вытягиваются одиночные пары, если это помогает сделать объяснение более ясным.
Однако иногда вытягиваются одиночные пары, если это помогает сделать объяснение более ясным. Использование условного обозначения «линейная структура связей»
 Водороды, связанные с азотом, кислородом, серой или чем-то еще, кроме углерода показаны , но обычно нарисованы без изображения связи. Следующие примеры иллюстрируют соглашение.
Водороды, связанные с азотом, кислородом, серой или чем-то еще, кроме углерода показаны , но обычно нарисованы без изображения связи. Следующие примеры иллюстрируют соглашение.

