ХиМиК.ru — РЕЗОНАНСА ТЕОРИЯ — Химическая энциклопедия
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
РЕЗОНАНСА ТЕОРИЯ, теория
электронного строения хим. соединений, в основе к-рой лежит представление о
том, что электронное распределение, геометрия и все др. физ. и хим. св-ва молекул
должны быть описаны не одной возможной структурной ф-лой, а сочетанием (резонансом)
всех альтернативных структур. Идея такого способа описания электронного строения
принадлежит Л. Полингу (1928). Резонанса теория является развитием классич. теории хим.
строения для молекул, ионов, радикалов, строение к-рых можно представить в виде
неск. разл. структурных ф-л, отличающихся способом распределения электронных
пар между атомными ядрами.
Для соед. с сопряженными
связями из всех возможных структур с разл. типами спаривания электронов кратных
связей достаточно рассмотреть лишь структуры с неперекрещивающимися связями
(канонич. структуры). Электронное строение бензола описывается резонансом пяти
канонич. структур:
Волновая ф-ция молекулы
бензола по Полингу представляет линейную комбинацию:
Y = 0,624(Y
Откуда следует, что осн.
вклад (примерно 80%) в волновую ф-цию вносят кекулевские структуры I и II. Их
эквивалентность и эквивалентность структур III-V объясняют вырав-ненность всех
углерод-углеродных связей в молекуле бензола и их промежут. (примерно полуторный)
характер между простой и двойной связями углерод-углерод. Это предсказание
находится в полном соответствии с экспериментально найденными длиной связи С—С
в бензоле (0,1397 нм) и св-вами симметрии его молекулы (группа симметрии D
(примерно полуторный)
характер между простой и двойной связями углерод-углерод. Это предсказание
находится в полном соответствии с экспериментально найденными длиной связи С—С
в бензоле (0,1397 нм) и св-вами симметрии его молекулы (группа симметрии D
Резонанса теорию с успехом применяют
для описания строения и св-в ионов и радикалов. Так, строение карбонат-иона
представляют как резонанс (обозначается двусторонней стрелкой) трех структур,
каждая из к-рых вносит одинаковый вклад в волновую ф-цию:
Поэтому ион
обладает тригональной симметрией (группа
симметрии V3h), и каждая связь С—О имеет на
1/3 характер двойной связи.
Строение аллильного радикала
не соответствует ни одной из классич. структур VI и VII и должно описываться
их резонансом:
Спектр ЭПР аллильного радикала
свидетельствует о том, что неспаренный электрон не локализован ни на одной из
концевых метиленовых групп, а распределен между ними так, что радикал имеет
группу симметрии С барьер вращения концевых
метиленовых групп (63 кДж/моль) имеет промежут. значение между величинами, характерными
для барьеров вращения вокруг простой и двойной связи С—С.
барьер вращения концевых
метиленовых групп (63 кДж/моль) имеет промежут. значение между величинами, характерными
для барьеров вращения вокруг простой и двойной связи С—С.
В соед., включающих связи
между атомами с существенно разл. электроотрицательностями, значит. вклад в
волновую ф-цию вносят резонансные структуры ионного типа. Строение СО
Длина связи между атомами
С и О в этой молекуле меньше, чем длина двойной связи С=О.
Поляризация связей в молекуле
формамида, приводящая к потере мн. св-в, характерных для карбонильной группы,
объясняется резонансом:
Резонанс структур ведет
к стабилизации осн. состояния молекулы, иона или радикала. Мерой этой стабилизации
служит энергия резонанса, к-рая тем больше, чем больше число возможных резонансных
структур и чем больше число резонирующих низкоэнергетич.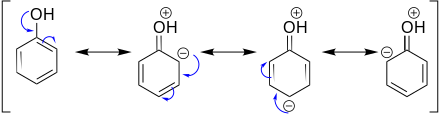
По своей осн. идее резонанса теория
очень близка к теории мезомерии (см. Мезомерия), однако носит
более количеств. характер, ее символика вытекает непосредственно из классич.
структурной теории, а квантовомех. метод валентных связей служит прямым продолжением
резонанса теории. В силу этого резонанса теория продолжает сохранять определенное значение как удобная
и наглядная система структурных представлений.
Лит.: Паулинг Л.,
Природа химической связи, пер. с англ., М.-Л., 1947; Уэланд Дж., Теория резонанса
и ее применение в органической химии, пер. с
англ., М., 1948; Полинг Л. , «Ж. Весе. Хим. об-ва им. Д. И. Менделеева»,
1962 т. 7, № 4, с. 462-67. В. И. Минкин.
, «Ж. Весе. Хим. об-ва им. Д. И. Менделеева»,
1962 т. 7, № 4, с. 462-67. В. И. Минкин.
А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
Химический резонанс | это… Что такое Химический резонанс?
Резонансные структуры бензолаТеория резонанса — теория электронного строения химических соединений, в соответствие с которой распределение электронов в молекулах (в т.ч. сложных ионах или радикалах), является комбинацией (резонансом) канонических структур с различной конфигурацией двухэлектронных ковалентных связей. Резонансная волновая функция, описывающая электронную структуру молекулы, является линейной комбинацией волновых функций канонических структур[1].
Иными словами, молекулярная структура описывается не одной возможной структурной формулой, а сочетанием (резонансом) всех альтернативных структур.
Следствием резонанса канонических структур является стабилизация основного состояния молекулы, мерой такой резонансной стабилизации является энергия резонанса — разность между наблюдаемой энергией основного состояния молекулы и расчетной энергии основного состояния канонической структуры с минимальной энергией[2].
Резонансные структуры циклопентадиенид-ионаИстория
Идея резонанса был введена в квантовую механику Вернером Гейзенбергом в 1926 году при обсуждении квантовых состояний атома гелия. Он сравнил структуру атома гелия с классической системой резонирующего гармонического осциллятора.
Модель Гейзенберга была применена Лайнусом Полингом (1928 год) к описанию электронной структуры молекулярных структур. В рамках метода валентных схем Полинг успешно объяснил геометрию и физико-химические свойства целого ряда молекул через механизм делокализации электронной плотности π-связей.
Сходные идеи для описания электронной структуры ароматических соединений были предложены Кристофером Ингольдом.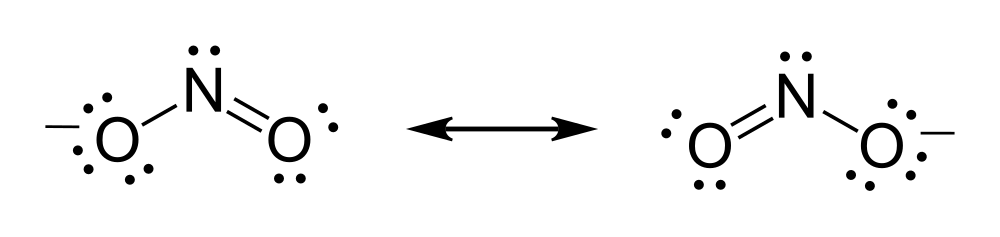 В 1926-1934 годах Ингольд заложил основы физической органической химии, развив альтернативную теорию электронных смещений (теорию мезомерии), призванную объяснить структуру молекул сложных органических соединений, не укладывающуюся в обычные валентные представления. Предложенный Ингольдом для обозначения явления делокализации электронной плотности термин «
В 1926-1934 годах Ингольд заложил основы физической органической химии, развив альтернативную теорию электронных смещений (теорию мезомерии), призванную объяснить структуру молекул сложных органических соединений, не укладывающуюся в обычные валентные представления. Предложенный Ингольдом для обозначения явления делокализации электронной плотности термин «
В послевоенном СССР теория резонанса стала объектом гонения в рамках идеологических кампаний и была объявлена «идеалистической», чуждой диалектическому материализму — и поэтому неприемлемой для использования в науке и образовани:
«Теория резонанса», будучи идеалистической и агностической, противостоит материалистической теории Бутлерова, как несовместимая и непримиримая с ней;… сторонники «теории резонанса» игнорировали ее и извращали ее существо.«Теория резонанса», будучи насквозь механистической. отрицает качественные, специфические особенности органического вещества и совершенно ложно пытается сводить закономерности органической химии к закономерностям квантовой механики…
…Мезомерийно-резонансная теория в органической химии представляет собою такое же проявление общей реакционной идеологии, как и вейсманизм-морганизм в биологии, как и современный «физический» идеализм, с которыми она тесно связана. — Кедров Б.М. Против «физического» идеализма в химической науке. Цит. по [3]
В 1951 году на Всесоюзной конференция по состоянию теории химического состава органической химии под руководством академика А. Н. Несмеянова резонансная теория Полинга и теория мезомери Ингольда были объявлены буржуазными и лженаучными[4].
Гонения на теорию резонанса получили негативную оценку в мировой научной среде. В одном из журналов Американского химического общества в обзоре, посвящённом положению в советской химической науке, в частности, отмечалось[5]:
В большинстве русских статей на эти темы (…), по-видимому, преобладает шовинистическая идея, что теория резонанса Лайнуса Полинга противоречит догмам диалектического материализма и поэтому должна быть отвергнута. |
См. также
- Мезомерный эффект
- Ароматичность
Примечания
- ↑ resonance // IUPAC Gold Book
- ↑ resonance energy // IUPAC Gold Book
- ↑ Операция «Теория резонанса» / Лисичкин В. А., Шелепин Л. А. Третья мировая (информационно-психологическая) война. — М.: Эксмо, Алгоритм, 2003. — 448 с.
- ↑ Лорен Грэхэм «Естествознание, философия и науки о человеческом поведении в Советском Союзе, Глава IX. Химия»
- ↑ I.
 Moyer Hunsberger (1954). «Theoretical chemistry in Russia». J. Chem. Educ. 31 (10): 504 — 514. DOI:10.1021/ed031p504.
Moyer Hunsberger (1954). «Theoretical chemistry in Russia». J. Chem. Educ. 31 (10): 504 — 514. DOI:10.1021/ed031p504.
Резонанс — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 2006
Резонанс — это умственное упражнение в рамках теории связи валентных связей, которое описывает делокализацию электронов внутри молекул. Он включает в себя построение нескольких структур Льюиса, которые в сочетании представляют полную электронную структуру молекулы. Резонансные структуры используются, когда одна структура Льюиса не может полностью описать связь; комбинация возможных резонансных структур определяется как -резонансный гибрид , который представляет общую делокализацию электронов внутри молекулы. В общем, молекулы с несколькими резонансными структурами будут более стабильными, чем молекулы с меньшим количеством резонансных структур, и некоторые резонансные структуры вносят больший вклад в стабильность молекулы, чем другие — формальные заряды помогают определить это.
В общем, молекулы с несколькими резонансными структурами будут более стабильными, чем молекулы с меньшим количеством резонансных структур, и некоторые резонансные структуры вносят больший вклад в стабильность молекулы, чем другие — формальные заряды помогают определить это.
Введение
Резонанс — это способ описания делокализованных электронов в определенных молекулах или многоатомных ионах, где связь не может быть выражена одной формулой Льюиса. Молекула или ион с такими делокализованными электронами представлена несколькими резонансными структурами. Ядерный скелет структуры Льюиса этих резонансных структур остается прежним, различаются только положения электронов. Так обстоит дело с озоном (\(\ce{O3}\)), аллотропом кислорода с V-образной структурой и углом O–O–O 117,5°. Давайте мотивируем обсуждение, построив структуру Льюиса для озона.
1. Мы знаем, что озон имеет V-образную структуру, поэтому один атом О является центральным:
2. Каждый атом О имеет 6 валентных электронов, всего 18 валентных электронов.
3. Присвоение одной связывающей пары электронов каждой связи кислород-кислород дает
с 14 оставшимися электронами.
4. Если мы поместим три неподеленные пары электронов на каждый концевой кислород, мы получим
и у нас останется 2 электрона.
5. В этот момент оба концевых атома кислорода имеют октеты электронов. Поэтому мы помещаем последние 2 электрона на центральный атом:
6. Центральный кислород имеет только 6 электронов. Мы должны преобразовать одну неподеленную пару на концевом атоме кислорода в связывающую пару электронов — но какую? В зависимости от того, что мы выбираем, мы получаем либо
, либо Что правильно? На самом деле ни то, ни другое не верно. Оба предсказывают одну одинарную связь O – O и одну двойную связь O = O. Как вы узнаете, если бы связи были разных типов (например, одна одинарная и одна двойная), они имели бы разную длину. Однако оказывается, что оба расстояния связи O–O одинаковы и составляют 127,2 пм, что меньше, чем типичная одинарная связь O–O (148 пм), и длиннее, чем двойная связь O=O в O 2 (120,7 вечера).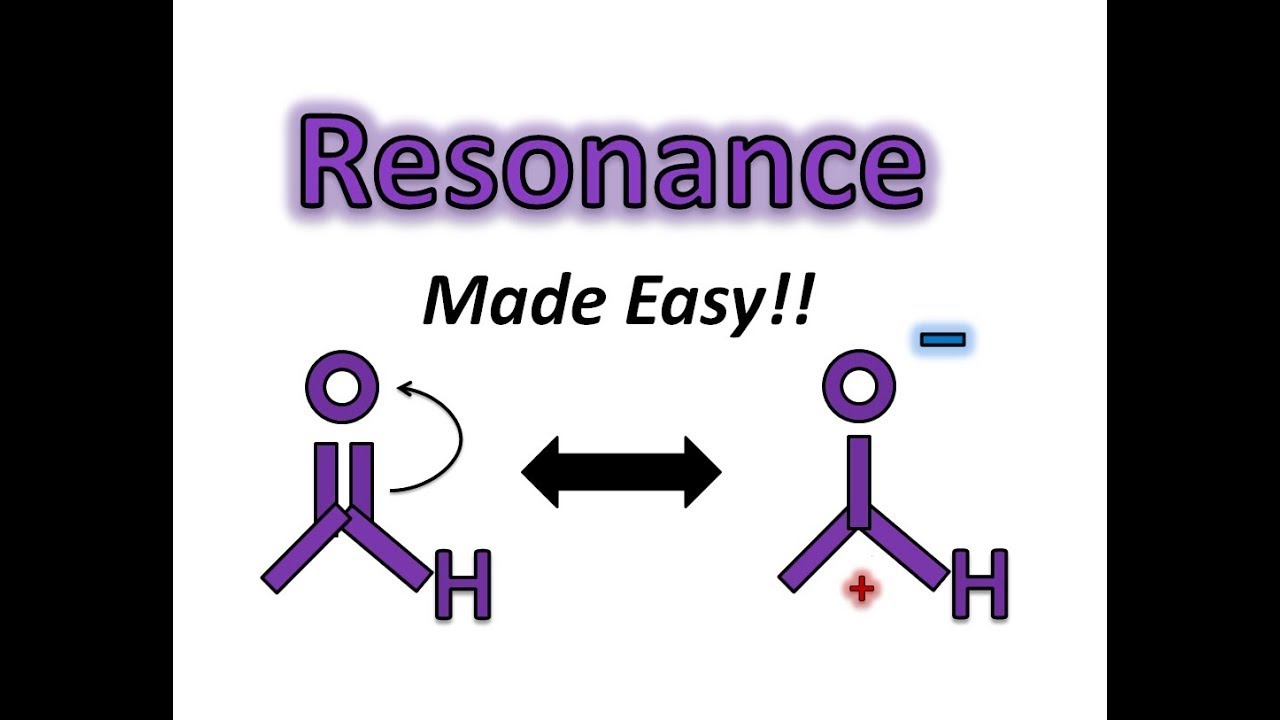
Эквивалентные точечные структуры Льюиса, такие как структуры озона, называются резонансными структурами . Положение атомов одинаково в различных резонансных структурах соединения, но положение электронов отличается. Двунаправленные стрелки связывают различные резонансные структуры соединения:
Двунаправленная стрелка указывает на то, что фактическая электронная структура представляет собой среднее показанных, а не на то, что молекула колеблется между двумя структурами.
Когда для молекулы или иона можно написать более одной эквивалентной резонансной структуры, фактическая структура представляет собой среднее значение резонансных структур.
Электроны, по-видимому, «перемещаются» между различными резонансными структурами, и хотя это не совсем правильно, поскольку каждая резонансная структура является просто ограничением использования точки зрения структуры Льюиса для описания этих молекул.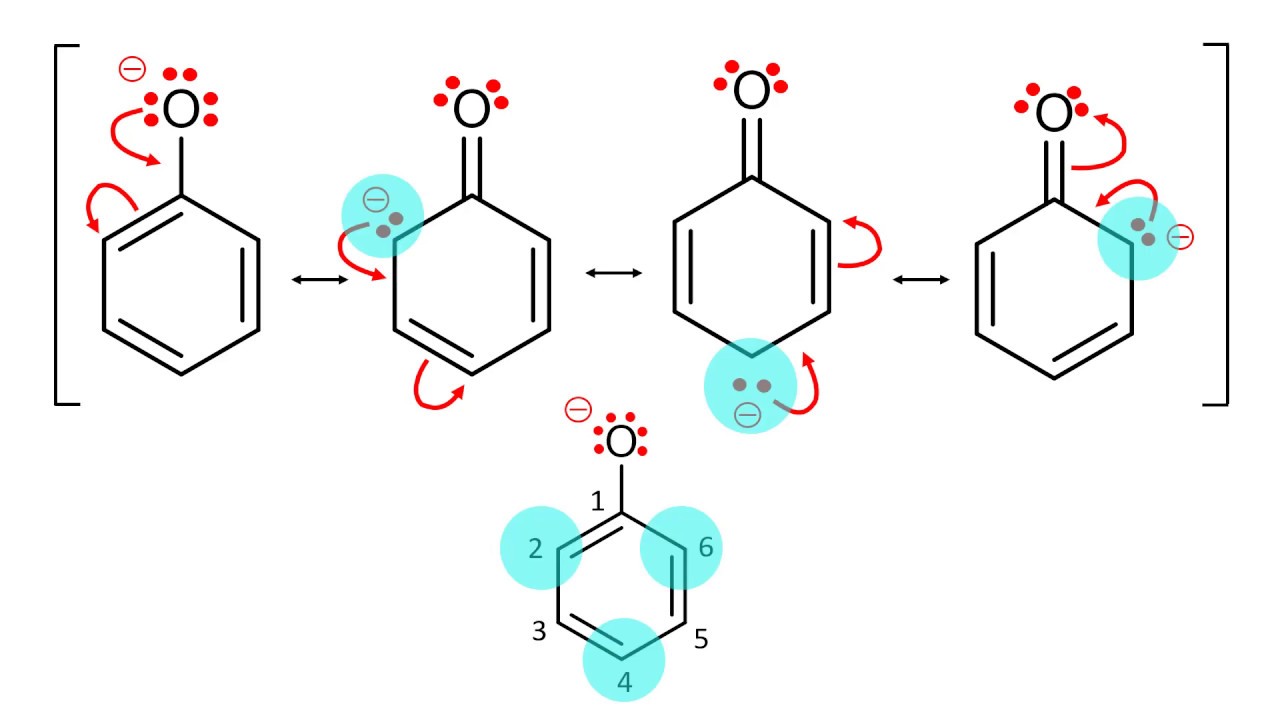 Более точное описание электронной структуры молекулы требует одновременного рассмотрения нескольких резонансных структур.
Более точное описание электронной структуры молекулы требует одновременного рассмотрения нескольких резонансных структур.
Делокализация и резонансные структуры Правила
- Резонансные структуры должны иметь одинаковое количество электронов, не добавлять и не вычитать электроны. (проверьте количество электронов, просто посчитав их).
- Каждая резонансная структура следует правилам написания структур Льюиса.
- Гибридизация структуры должна остаться прежней.
- Каркас конструкции не может быть изменен (двигаются только электроны).
- Резонансные структуры также должны иметь одинаковое количество одиночных пар.
«Выберите правильную стрелку для работы»
Большинство стрелок в химии нельзя использовать взаимозаменяемо, и необходимо уделить внимание выбору правильной стрелки для работы.
- \(\leftrightarrow\): двунаправленная стрелка на обоих концах стрелки между структурами Льюиса используется для обозначения резонанса
- \(\rightleftharpoons\): Двойные гарпуны используются для обозначения равновесия 9{2-}}\).

Решение
1. Поскольку углерод является наименее электроотрицательным элементом, мы помещаем его в центральное положение:
2. У углерода 4 валентных электрона, у каждого кислорода 6 валентных электронов, и еще 2 приходится на заряд -2 . Это дает 4 + (3 × 6) + 2 = 24 валентных электрона.
3. Шесть электронов используются для образования трех пар связи между атомами кислорода и углерода:
4. Разделим оставшиеся 18 электронов поровну между тремя атомами кислорода, поместив три неподеленные пары на каждый и указав заряд -2 :
5. У центрального атома не осталось электронов.
6. На данный момент атом углерода имеет только 6 валентных электронов, поэтому мы должны взять одну неподеленную пару из кислорода и использовать ее для образования двойной связи углерод-кислород. В этом случае, однако, есть три возможных варианта:
Как и в случае с озоном, ни одна из этих структур точно не описывает связывание. Каждый предсказывает одну двойную связь углерод-кислород и две одинарные связи углерод-кислород, но экспериментально все длины связи C-O идентичны.
 Мы можем написать резонансные структуры (в данном случае три) для карбонат-иона:
Мы можем написать резонансные структуры (в данном случае три) для карбонат-иона:Фактическая структура представляет собой среднее значение этих трех резонансных структур.
Подобно озону, электронная структура иона карбоната не может быть описана одной электронной структурой Льюиса. Однако, в отличие от O 3 , фактическая структура CO 3 2− представляет собой в среднем трех резонансных структур.
Использование формальных зарядов для идентификации жизнеспособных резонансных структур
Хотя каждая резонансная структура вносит свой вклад в общую электронную структуру молекулы, они могут не вносить одинаковый вклад. Присвоение формальных зарядов атомам в молекулах является одним из механизмов определения жизнеспособности резонансной структуры и определения ее относительной величины среди других структур. Формальный заряд атома в ковалентных частицах — это суммарный заряд, который атом нес бы, если бы электроны во всех связях с атомом были поровну разделены.
 В качестве альтернативы формальный заряд атома в ковалентных частицах представляет собой суммарный заряд, который атом нес бы, если бы все связи с атомом были неполярными ковалентными связями. Чтобы определить формальный заряд данного атома в ковалентной разновидности, используйте следующую формулу:
В качестве альтернативы формальный заряд атома в ковалентных частицах представляет собой суммарный заряд, который атом нес бы, если бы все связи с атомом были неполярными ковалентными связями. Чтобы определить формальный заряд данного атома в ковалентной разновидности, используйте следующую формулу:\[\text{Формальный заряд} = (\text{количество валентных электронов на свободной орбите}) — (\text{количество электронов неподеленной пары}) — \frac{1}{2} (\text{ количество электронов связи пары}) \label{FC}\]
Правила оценки стабильности резонансных структур
- Чем больше число ковалентных связей , тем выше стабильность, поскольку больше атомов будет иметь полные октеты
- Структура с наименьшим количеством формальных сборов более стабилен
- Структура с наименьшим разделением формального заряда более стабильна
- Структура с отрицательным зарядом на более электроотрицательном атоме будет более стабильной
- Положительный заряд на наименее электроотрицательном атоме (наиболее электроположительный) более стабилен
- Эквивалентные резонансные формы не отличаются стабильностью и вносят одинаковый вклад (например, бензол) 9-\)) ион.

Решение
1. Найдите структуру Льюиса молекулы. (Вспомните правила структуры Льюиса.)
2. Резонанс: Всем элементам нужен октет, и мы можем сделать это несколькими способами, перемещая электроны концевого атома (связи тоже).
3. Назначьте официальные расходы с помощью уравнения \ref{FC}.
Формальный заряд = (число валентных электронов на свободной орбите) — (число неподеленных пар электронов) — ( \( \frac{1}{2} \) число электронов пары связи)
Не забудьте определить количество валентных электронов у каждого атома перед назначением формальных зарядов
C = 4 валентности e — , N = 5 валентностей e — , S = 6 валентностей e — , также добавьте дополнительный электрон для заряда (-1). Всего валентных электронов 16.
4. Найдите наиболее идеальную резонансную структуру. (Примечание: это заряд с наименьшим формальным зарядом, который в сумме дает ноль или общий заряд молекулы.
 )
)5. Теперь нам нужно посмотреть на электроотрицательность «правильной» структуры Льюиса.
Наиболее электроотрицательный атом обычно имеет отрицательный формальный заряд, тогда как наименее электроотрицательный атом обычно имеет положительный формальный заряд.
Полезно объединить резонансные структуры в единую структуру, называемую Resonance Hybrid , которая описывает связывание молекулы. Общий подход описан ниже:
- Нарисуйте структуру и резонанс Льюиса для молекулы (используя сплошные линии для связей).
- Там, где может быть двойной или тройной связью, нарисуйте пунктирную линию (——) для связи.
- Нарисуйте только неподеленные пары, имеющиеся во всех резонансных структурах, не включая неподеленные пары, которых нет во всех резонансных структурах.
Пример \(\PageIndex{4}\): Бензол
Бензол — это обычный органический растворитель, который ранее использовался в бензине; Однако он больше не используется для этой цели, потому что теперь известно, что он является канцерогеном.
 Молекула бензола (\(\ce{C6H6}\)) состоит из правильного шестиугольника атомов углерода, каждый из которых также связан с атомом водорода. Используйте резонансные структуры для описания связи в бензоле.
Молекула бензола (\(\ce{C6H6}\)) состоит из правильного шестиугольника атомов углерода, каждый из которых также связан с атомом водорода. Используйте резонансные структуры для описания связи в бензоле.Дано: Молекулярная формула и молекулярная геометрия
Стратегии: Резонансные структуры
Стратегия:
- Нарисуйте структуру для бензена, иллюстрирующих связанные атосомы. Затем подсчитайте количество валентных электронов, используемых на этом рисунке.
- Вычтите это число из общего числа валентных электронов в бензоле, а затем расположите оставшиеся электроны так, чтобы каждый атом в структуре достиг октета.
- Нарисуйте резонансные структуры для бензола.
Решение:
A Каждый атом водорода дает 1 валентный электрон, а каждый атом углерода дает 4 валентных электрона, всего (6 × 1) + (6 × 4) = 30 валентных электронов.
 Если мы поместим одну пару связывающих электронов между каждой парой атомов углерода и между каждым углеродом и атомом водорода, мы получим следующее:
Если мы поместим одну пару связывающих электронов между каждой парой атомов углерода и между каждым углеродом и атомом водорода, мы получим следующее:Каждый атом углерода в этой структуре имеет только 6 электронов и имеет формальный заряд +1, но мы использовали только 24 из 30 валентных электронов.
B Если 6 оставшихся электронов равномерно распределить попарно на чередующихся атомах углерода, мы получим следующее:
Три атома углерода теперь имеют октетную конфигурацию и формальный заряд -1, в то время как три атома углерода имеют только 6 электронов и формальный заряд +1. Мы можем преобразовать каждую неподеленную пару в пару связывающих электронов, которая дает каждому атому октет электронов и формальный заряд, равный 0, путем образования трех двойных связей C=C.
C Однако это можно сделать двумя способами:
Каждая структура имеет чередующиеся двойные и одинарные связи, но эксперименты показывают, что каждая углерод-углеродная связь в бензоле идентична, а длина связи (139,9 пм) является промежуточной между длинами, обычно находимыми для одинарной связи С-С (154 пм) и Двойная связь C=C (134 пм).
 Мы можем описать связь в бензоле, используя две резонансные структуры, но фактическая электронная структура является средней из двух. Существование множественных резонансных структур для ароматических углеводородов, таких как бензол, часто обозначается кружком или пунктирными линиями внутри шестиугольника: 9{-}}\).
Мы можем описать связь в бензоле, используя две резонансные структуры, но фактическая электронная структура является средней из двух. Существование множественных резонансных структур для ароматических углеводородов, таких как бензол, часто обозначается кружком или пунктирными линиями внутри шестиугольника: 9{-}}\).Раствор
1. Подсчитайте валентные электроны: (1*5) + (3*6) + 1(ион) = 24 электронов
2. Нарисуйте соединения связей:
3. Добавить октетов электронов к атомам, связанным с центральным атомом:
4. Поместите оставшиеся электроны (24-24 = 0 ) на центральный атом:
5. Есть ли у центрального атома октет?
- НЕТ , у него 6 электронов 9{-}}\) ион должен быть несколько короче одинарной связи.
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения . Нью-Джерси: Пирсон Прентис Холл, 2007.
 .
. - Ахмад, Ван-Якоб и Закария, Мэт Б. «Рисование структур Льюиса из символов Льюиса: подход прямого спаривания электронов». Журнал химического образования: Журнал 77.3.
- Верно или нет. На рисунке ниже изображена резонансная структура?
- Нарисуйте точечную структуру Льюиса для SO 4 2 — и все возможные резонансные структуры. Какая из следующих резонансных структур не является предпочтительной среди структур Льюиса? Объяснить, почему. Назначение официальных обвинений.
- Нарисуйте точечную структуру Льюиса для CH 3 COO — и всех возможных резонансных структур. Назначение официальных обвинений. Выберите наиболее благоприятную структуру Льюиса.
- Нарисуйте точечную структуру Льюиса для H PO 3 2 — 9013 4 и все возможные резонансные структуры.
 Назначение официальных обвинений.
Назначение официальных обвинений. - Нарисуйте точечную структуру Льюиса для CHO 2 1 — и всех возможных резонансных структур. Назначение официальных обвинений.
- Нарисуйте резонансную гибридную структуру для P O 4 3 — .
- Нарисуйте резонансную гибридную структуру для N O 3 — .
- Шарон Вей (UCD), Лиза Чу (UCD)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- официальное обвинение
- резонанс
- Эта статья о резонансе в химии.
- Мы рассмотрим пример резонанса, прежде чем узнаем, как рисовать резонансные структуры.
- Затем мы исследуем доминирование в резонансе и посмотрим на расчеты по заказу облигаций .
- После этого мы воспользуемся нашими знаниями для создания некоторых правил резонанса.

- Мы закончим еще несколькими примерами резонанса.
- Определите общее количество валентных электронов молекулы.
- Нарисуйте примерное положение атомов в молекуле.
- Соединение атомов с помощью одинарных ковалентных связей.
- Добавляйте электроны к внешним атомам, пока они не будут иметь полную внешнюю оболочку электронов.
- Подсчитайте, сколько электронов вы добавили, и вычтите это из общего числа валентных электронов молекулы, которое вы подсчитали ранее. Это говорит вам, сколько электронов у вас осталось.
- Добавьте оставшиеся электроны к центральному атому.
- Используйте неподеленные пары электронов от внешних атомов для образования двойных ковалентных связей с центральным атомом, пока все атомы не будут иметь полные внешние оболочки.

- Некоторые молекулы могут быть представлены множественной альтернативной структурой Льюиса s с тем же расположением атомов, но другим распределением электронов .
 Эти молекулы показывают резонанс .
Эти молекулы показывают резонанс . - Альтернативные структуры Льюиса известны как резонансные структуры . Они объединяются, чтобы создать гибридную молекулу. Общая гибридная молекула не переключается между каждой структурой, а скорее приобретает совершенно новую идентичность, которая представляет собой комбинацию их всех.
- Нарисуйте все резонансные структуры молекулы.
- Определите порядок выбранной вами связи в каждой из резонансных структур и сложите их вместе.

- Разделите общее количество связей на количество резонансных структур.
- Молекулы, демонстрирующие резонанс, представлены множественными резонансными структурами. Все они должны быть допустимыми структурами Льюиса.
- Резонансные структуры имеют одинаковое расположение атомов, но разное расположение электронов.
- Резонансные структуры различаются только положением пи-связей. Все сигма-связи остаются неизменными.
- Резонансные структуры составляют одну общую гибридную молекулу. Не все резонансные структуры вносят одинаковый вклад в гибридную молекулу; более доминирующей структурой является структура с формальными зарядами, ближайшими к +0.

Некоторые молекулы можно описать с помощью несколько диаграмм Льюиса , которые составляют одну общую гибридную молекулу . Это известно как резонанс .
Гибридные молекулы — это уникальные молекулы . Они представляют собой среднее значение всех различных резонансных структур молекулы.
Не все резонансные структуры вносят одинаковый вклад в общую структуру молекулы.

Ссылки
Проблемы
Задачи #2
Ответы
1. Неверно, потому что электроны не двигались, а только атомы (это нарушает правила резонансной структуры).
2. Ниже представлена структура всех точек Льюиса с формальными зарядами (выделены красным) для сульфата ( SO 4 2 — ). Не существует наиболее благоприятного резонанса сульфат-иона, потому что все они имеют одинаковый заряд и между атомами кислорода нет изменений в электроотрицательности.

3. Ниже резонанс для CH 3 COO — , формальные обвинения отображаются красным цветом. Структура Льюиса с наиболее формальными зарядами нежелательна, потому что нам нужна структура Льюиса с наименьшим формальным зарядом.
4. Резонанс для HPO 3 2 — и формальные обвинения (выделены красным).
5. Резонанс для CHO 2 1 — и формальные обвинения (выделено красным).
6. Резонансный гибрид для PO 4 3 — , гибридные облигации выделены красным цветом.
7. Резонансный гибрид на NO 3 — , гибридные облигации выделены красным.
Проблемы #2
Авторы и авторство
Resonance распространяется под лицензией CC BY-NC-SA 4.
 0, автор, ремикс и/или куратор LibreTexts.
0, автор, ремикс и/или куратор LibreTexts.Резонансная химия: значение и примеры
Медведи Пиззли — редкое гибридное животное, помесь белого медведя и медведя гризли.
 Их успешно разводят в неволе в течение многих лет, а также находят в дикой природе: первое наблюдение дикой пиззли было подтверждено в 2006 году. Но хотя пиззли состоят из двух разных видов медведей, полярного и гризли, являются их собственным уникальным организмом. Вы не видите в них то белого медведя, то гризли. Вместо этого они совершенно другой медведь. Это похоже на резонансных структур в химии.
Их успешно разводят в неволе в течение многих лет, а также находят в дикой природе: первое наблюдение дикой пиззли было подтверждено в 2006 году. Но хотя пиззли состоят из двух разных видов медведей, полярного и гризли, являются их собственным уникальным организмом. Вы не видите в них то белого медведя, то гризли. Вместо этого они совершенно другой медведь. Это похоже на резонансных структур в химии.Резонанс — это способ описания связи в химии. Он описывает, как несколько эквивалентных структур Льюиса вносят вклад в одну общую гибридную молекулу .
Что такое резонанс?
Некоторые молекулы невозможно точно описать одной диаграммой Льюиса. Возьмем, к примеру, озон O 3 . Давайте нарисуем ее структуру Льюиса, используя следующие шаги:
Это краткое изложение того, как нарисовать структуру Льюиса. Для более подробного ознакомления ознакомьтесь со статьей «Структуры Льюиса».
Во-первых, кислород находится в группе VI, поэтому каждый атом имеет шесть валентных электронов. Это означает, что молекула имеет 3(6) = 18 валентных электронов.
Далее нарисуем грубую версию молекулы. Он состоит из трех атомов кислорода. Мы соединим их с помощью одинарных ковалентных связей.
Резонанс в озоне. StudySmarter Originals
Добавляйте электроны к двум внешним атомам кислорода, пока они не заполнят внешние оболочки. В этом случае мы добавляем по шесть электронов к каждому.
Резонанс в озоне. StudySmarter Originals
Подсчитайте, сколько электронов вы добавили. Есть две связанные пары и шесть неподеленных пар, что дает 2 (2) + 6 (2) = 16 электронов. Мы знаем, что у озона 18 валентных электронов. Таким образом, у нас осталось два, которые нужно добавить к центральному атому кислорода.

Резонанс в озоне. StudySmarter Originals
Теперь мы достигли 18 валентных электронов — мы не можем больше добавить. Но у кислорода еще нет полноценной внешней оболочки — ему нужны еще два электрона. Чтобы решить эту проблему, мы используем неподеленную пару электронов от одного из внешних атомов кислорода для образования двойной связи между собой и центральным кислородом. Но какой внешний кислород образует двойную связь? Это может быть либо кислород слева, либо кислород справа. На самом деле оба варианта равновероятны. Эти два варианта имеют одинаковое расположение атомов но другое распределение электронов . Мы называем их резонансными структурами .
Резонанс в озоне. StudySmarter Originals
Однако есть проблема. Две приведенные выше резонансные структуры подразумевают, что связи в озоне, одна двойная и одна одинарная, различны. Мы ожидаем, что двойная связь будет намного короче и прочнее, чем одинарная связь.
 Но химический анализ говорит нам, что связи в озоне равны, то есть озон не принимает форму ни одной из резонансных структур. На самом деле, вместо того, чтобы обнаруживаться в виде той или иной резонансной структуры, озон принимает то, что известно как гибридная структура . Это структура находится где-то между обеими резонансными структурами и показана двунаправленной стрелкой. Вместо того, чтобы содержать одну одинарную связь и одну двойную связь, он содержит две промежуточных связи , которые представляют собой среднее значение одинарной и двойной связи. На самом деле, вы можете думать о них как о полуторных облигациях.
Но химический анализ говорит нам, что связи в озоне равны, то есть озон не принимает форму ни одной из резонансных структур. На самом деле, вместо того, чтобы обнаруживаться в виде той или иной резонансной структуры, озон принимает то, что известно как гибридная структура . Это структура находится где-то между обеими резонансными структурами и показана двунаправленной стрелкой. Вместо того, чтобы содержать одну одинарную связь и одну двойную связь, он содержит две промежуточных связи , которые представляют собой среднее значение одинарной и двойной связи. На самом деле, вы можете думать о них как о полуторных облигациях.Резонанс в озоне, включая его гибридную структуру. StudySmarter Originals
Резонансные структуры всегда включают двойную связь. Единственная разница между множественными резонансными структурами заключается в положении этой двойной связи.
Причины резонанса
Резонанс вызван пи-связью. Возможно, вы знаете, что одинарные связи всегда являются сигма-связями.
 Они образованы лобовым перекрытием атомных орбиталей, таких как s-, p- или sp-гибридные орбитали. Напротив, пи-связи образуются путем бокового перекрытия р-орбиталей. Но когда дело доходит до молекул, которые демонстрируют резонанс, вместо того, чтобы возникать только между двумя атомами, вы обнаружите пи-связь между несколькими атомами в структуре. Их р-орбитали сливаются в одну большую перекрывающуюся область. Электроны с этих орбиталей рассредоточены по области перекрытия и не принадлежат какому-то одному конкретному атому. Мы говорим, что их делокализованный . Когда молекула делокализует свои электроны, она уменьшает свою электронную плотность, что помогает ей стать более стабильной.
Они образованы лобовым перекрытием атомных орбиталей, таких как s-, p- или sp-гибридные орбитали. Напротив, пи-связи образуются путем бокового перекрытия р-орбиталей. Но когда дело доходит до молекул, которые демонстрируют резонанс, вместо того, чтобы возникать только между двумя атомами, вы обнаружите пи-связь между несколькими атомами в структуре. Их р-орбитали сливаются в одну большую перекрывающуюся область. Электроны с этих орбиталей рассредоточены по области перекрытия и не принадлежат какому-то одному конкретному атому. Мы говорим, что их делокализованный . Когда молекула делокализует свои электроны, она уменьшает свою электронную плотность, что помогает ей стать более стабильной.Вот краткое изложение того, что мы уже узнали:
Как рисовать резонансные структуры?
Мы уже узнали, что когда вы хотите изобразить молекулу, демонстрирующую резонанс, вы рисуете все ее резонансные структуры в виде диаграмм Льюиса с двунаправленными стрелками между ними. Вы также можете добавить фигурные стрелки, чтобы показать движение электронов, когда молекула «переключается» с одной резонансной структуры на другую. Давайте посмотрим, как это относится к озону, O 3 .
Движение электронов в резонансе. StudySmarter Originals
Чтобы перейти от резонансной структуры слева к резонансной структуре справа, неподеленная пара электронов от атома кислорода слева используется для создания двойной связи O=O.
 В то же время исходная двойная связь O=O, обнаруженная между центральным кислородом и атомом кислорода справа, разрывается, и электронная пара переносится на атом кислорода справа. Чтобы перейти от резонансной структуры справа к резонансной структуре слева, вы делаете обратное.
В то же время исходная двойная связь O=O, обнаруженная между центральным кислородом и атомом кислорода справа, разрывается, и электронная пара переносится на атом кислорода справа. Чтобы перейти от резонансной структуры справа к резонансной структуре слева, вы делаете обратное.Однако эти диаграммы могут ввести в заблуждение . Они подразумевают, что молекулы, демонстрирующие резонанс, проводят часть своего времени в качестве одной резонансной структуры, а часть — в другой. Мы знаем, что это не так. Вместо этого молекулы, демонстрирующие резонанс, принимают форму гибридной молекулы : уникальная структура, представляющая собой среднее значение всех резонансных структур молекулы. Резонансные структуры — это просто наш способ представить такую молекулу, и их не следует воспринимать слишком буквально.
Резонансная структура и доминирование
В некоторых примерах резонанса множественные резонансные структуры вносят равный вклад в общую гибридную структуру.
 Например, ранее мы рассматривали озон. Его можно описать с помощью двух резонансных структур. Общая гибридная структура представляет собой идеальное среднее из двух. Однако в некоторых случаях одна структура имеет большее влияние, чем другие. Мы говорим, что эта структура является доминирующей . Доминантная структура определяется с помощью официальные сборы .
Например, ранее мы рассматривали озон. Его можно описать с помощью двух резонансных структур. Общая гибридная структура представляет собой идеальное среднее из двух. Однако в некоторых случаях одна структура имеет большее влияние, чем другие. Мы говорим, что эта структура является доминирующей . Доминантная структура определяется с помощью официальные сборы .Формальные заряды — это заряды, присвоенные атомам, при условии, что все связанные электроны равномерно распределены между двумя связанными атомами.
У нас есть целая статья, посвященная формальным зарядам, где вы можете узнать, как их рассчитать для всевозможных молекул. Перейдите к разделу «Формальные обвинения», чтобы узнать больше.
В общем, мы предполагаем, что структура Льюиса с формальными зарядами, ближайшими к нулю , является доминирующей структурой. Если две резонансные структуры имеют одинаковые формальные заряды, мы предполагаем, что структура Льюиса с отрицательным формальным зарядом на более электроотрицательном атоме является доминирующей структурой.

Взгляните на три возможные резонансные структуры углекислого газа, показанные ниже. В двух структурах, показанных в середине и справа, один из атомов кислорода имеет формальный заряд +1, а другой — формальный заряд -1. В другой резонансной структуре, показанной слева, все атомы имеют формальный заряд +0. Таким образом, это доминирующая структура.
Доминирующая структура в резонансе. StudySmarter Originals
Но если все резонансные структуры имеют одинаковые формальные заряды, мы говорим, что они эквивалентны . Это касается озона. В обеих его резонансных структурах есть один атом кислорода с формальным зарядом +1, один с формальным зарядом -1 и один с формальным зарядом +0. Эти две структуры в равной степени вносят вклад в гибридную структуру озона.
Эквивалентные конструкции в резонансе. StudySmarter Originals
Повторим еще раз: важно отметить, что озон не переключается между одной резонансной структурой и другой. Вместо этого он приобретает совершенно новую идентичность, которая находится где-то посередине между ними.
 Точно так же, как пиззли-медведи иногда не белые медведи, а иногда гризли, а скорее смесь обоих видов, озон не является иногда одной резонансной структурой, а иногда другой. Вы должны объединить обе структуры, чтобы сформировать что-то еще. Мы говорим, что молекулы, которые не могут быть представлены только одной структурой Льюиса, показывают резонанс .
Точно так же, как пиззли-медведи иногда не белые медведи, а иногда гризли, а скорее смесь обоих видов, озон не является иногда одной резонансной структурой, а иногда другой. Вы должны объединить обе структуры, чтобы сформировать что-то еще. Мы говорим, что молекулы, которые не могут быть представлены только одной структурой Льюиса, показывают резонанс .Резонанс — это способ описания связи в химии. Он описывает, как несколько эквивалентных структур Льюиса вносят вклад в одну общую гибридную молекулу .
Расчет резонанса и порядка связи
Порядок связи говорит вам о количестве связей между двумя атомами в молекуле. Например, одинарная связь имеет порядок связи 1, а двойная связь имеет порядок связи 2. Вот как можно рассчитать порядок связи конкретной связи в гибридной молекуле:
Например, давайте попробуем найти порядок самой левой связи O-O в озоне, как показано выше. Эта связь в левой резонансной структуре имеет порядок связи 1, в то время как в правой резонансной структуре она имеет порядок связи 2. Таким образом, общий порядок связи равен 1+22=1,5.
Правила резонанса
Мы можем объединить то, что мы узнали до сих пор, чтобы составить некоторые правила резонанса:
Примеры резонанса
Чтобы завершить эту статью, давайте рассмотрим еще несколько примеров резонанса. Сначала: нитрат-ион, NO 3 — . Он состоит из трех атомов кислорода, связанных с центральным атомом азота, и имеет три эквивалентные резонансные структуры, различающиеся положением двойной связи N=O. Порядок связи NO в полученной гибридной молекуле равен 1,33.
Резонанс в нитрат-ионе. StudySmarter Originals
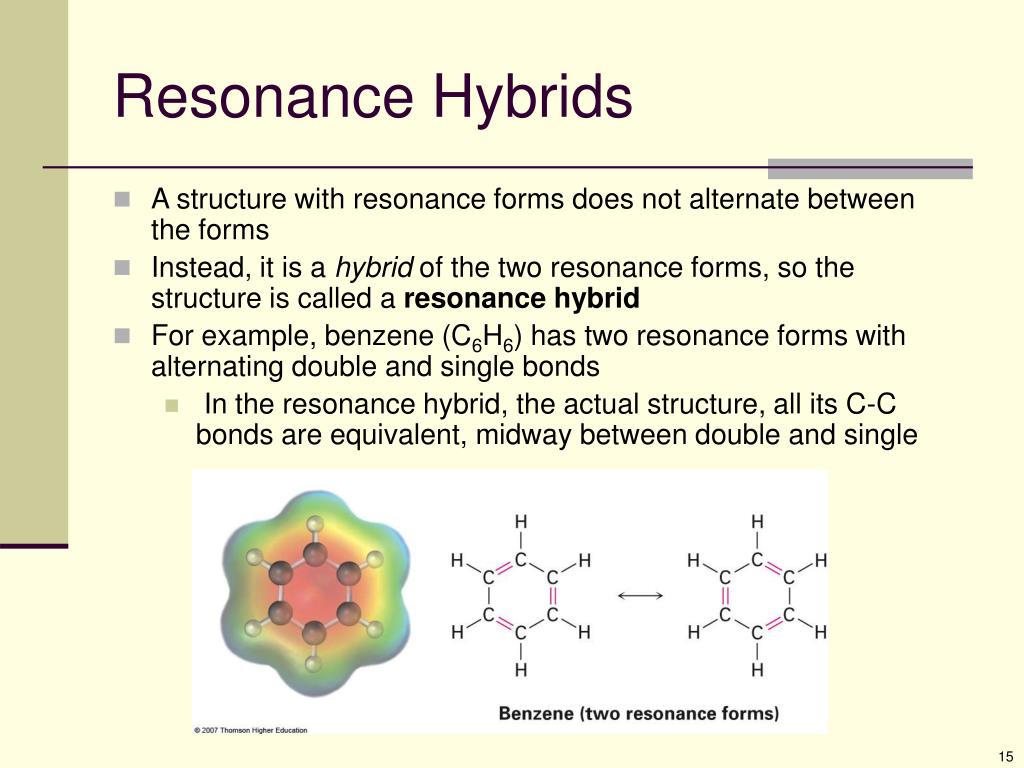
Другим распространенным примером резонанса является бензол, C 6 Н 6 . Бензол состоит из кольца атомов углерода, каждый из которых связан с двумя другими атомами углерода и одним атомом водорода. Он имеет две резонансные структуры; полученная связь CC имеет порядок связи 1,5.
Резонанс в бензоле. commons.wikimedia.org
Наконец, вот ион карбоната, CO 3 2-. Как и нитрат-ион, он имеет три резонансные структуры, а порядок связи СО равен 1,33.
Резонанс в карбонат-ионе.
 commons.wikimedia.org
commons.wikimedia.orgМы подошли к концу этой статьи о резонансе в химии. К настоящему времени вы должны понимать, что такое резонанс, и быть в состоянии объяснить, как резонансные структуры вносят вклад в общую гибридную молекулу. Вы также должны быть в состоянии нарисовать резонансные структуры для конкретных молекул, определить доминирующую резонансную структуру, используя формальные заряды, и рассчитать порядок связи в резонансных гибридных молекулах.
Резонансная химия – основные выводы



 Размах и резкость этого осуждения не имеет аналогов в истории химии
Размах и резкость этого осуждения не имеет аналогов в истории химии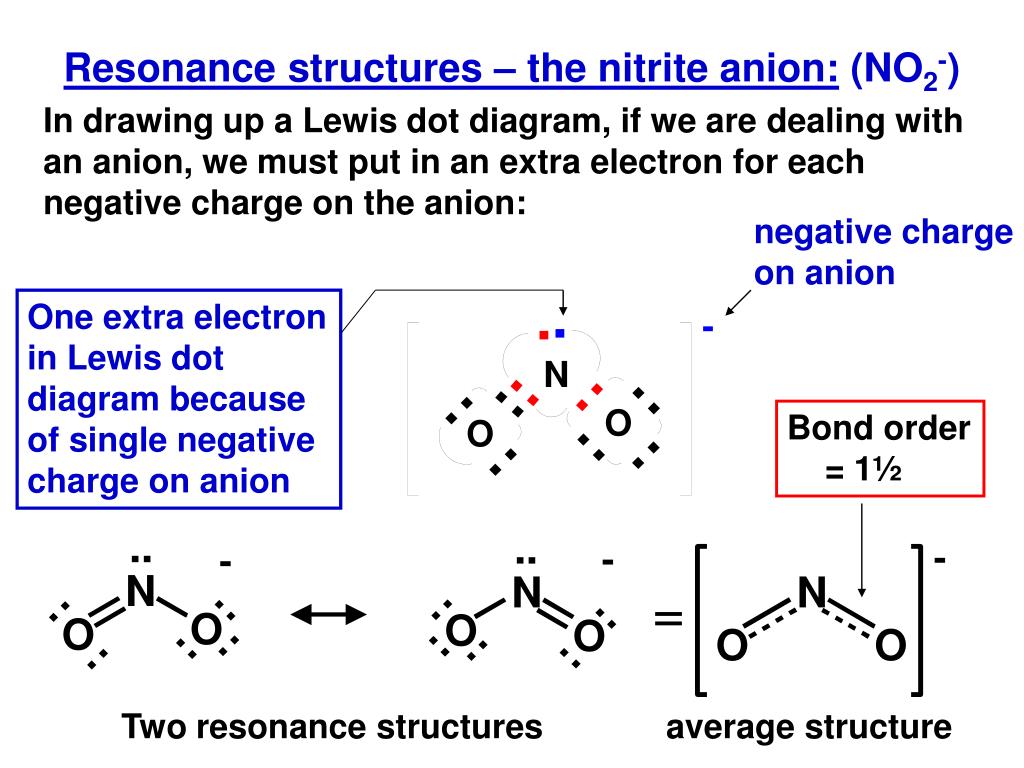 Moyer Hunsberger (1954). «Theoretical chemistry in Russia». J. Chem. Educ. 31 (10): 504 — 514. DOI:10.1021/ed031p504.
Moyer Hunsberger (1954). «Theoretical chemistry in Russia». J. Chem. Educ. 31 (10): 504 — 514. DOI:10.1021/ed031p504.
 Мы можем написать резонансные структуры (в данном случае три) для карбонат-иона:
Мы можем написать резонансные структуры (в данном случае три) для карбонат-иона: В качестве альтернативы формальный заряд атома в ковалентных частицах представляет собой суммарный заряд, который атом нес бы, если бы все связи с атомом были неполярными ковалентными связями. Чтобы определить формальный заряд данного атома в ковалентной разновидности, используйте следующую формулу:
В качестве альтернативы формальный заряд атома в ковалентных частицах представляет собой суммарный заряд, который атом нес бы, если бы все связи с атомом были неполярными ковалентными связями. Чтобы определить формальный заряд данного атома в ковалентной разновидности, используйте следующую формулу:
 )
) Молекула бензола (\(\ce{C6H6}\)) состоит из правильного шестиугольника атомов углерода, каждый из которых также связан с атомом водорода. Используйте резонансные структуры для описания связи в бензоле.
Молекула бензола (\(\ce{C6H6}\)) состоит из правильного шестиугольника атомов углерода, каждый из которых также связан с атомом водорода. Используйте резонансные структуры для описания связи в бензоле. Если мы поместим одну пару связывающих электронов между каждой парой атомов углерода и между каждым углеродом и атомом водорода, мы получим следующее:
Если мы поместим одну пару связывающих электронов между каждой парой атомов углерода и между каждым углеродом и атомом водорода, мы получим следующее: Мы можем описать связь в бензоле, используя две резонансные структуры, но фактическая электронная структура является средней из двух. Существование множественных резонансных структур для ароматических углеводородов, таких как бензол, часто обозначается кружком или пунктирными линиями внутри шестиугольника: 9{-}}\).
Мы можем описать связь в бензоле, используя две резонансные структуры, но фактическая электронная структура является средней из двух. Существование множественных резонансных структур для ароматических углеводородов, таких как бензол, часто обозначается кружком или пунктирными линиями внутри шестиугольника: 9{-}}\).
 Назначение официальных обвинений.
Назначение официальных обвинений.
 0, автор, ремикс и/или куратор LibreTexts.
0, автор, ремикс и/или куратор LibreTexts. Их успешно разводят в неволе в течение многих лет, а также находят в дикой природе: первое наблюдение дикой пиззли было подтверждено в 2006 году. Но хотя пиззли состоят из двух разных видов медведей, полярного и гризли, являются их собственным уникальным организмом. Вы не видите в них то белого медведя, то гризли. Вместо этого они совершенно другой медведь. Это похоже на резонансных структур в химии.
Их успешно разводят в неволе в течение многих лет, а также находят в дикой природе: первое наблюдение дикой пиззли было подтверждено в 2006 году. Но хотя пиззли состоят из двух разных видов медведей, полярного и гризли, являются их собственным уникальным организмом. Вы не видите в них то белого медведя, то гризли. Вместо этого они совершенно другой медведь. Это похоже на резонансных структур в химии.


 Но химический анализ говорит нам, что связи в озоне равны, то есть озон не принимает форму ни одной из резонансных структур. На самом деле, вместо того, чтобы обнаруживаться в виде той или иной резонансной структуры, озон принимает то, что известно как гибридная структура . Это структура находится где-то между обеими резонансными структурами и показана двунаправленной стрелкой. Вместо того, чтобы содержать одну одинарную связь и одну двойную связь, он содержит две промежуточных связи , которые представляют собой среднее значение одинарной и двойной связи. На самом деле, вы можете думать о них как о полуторных облигациях.
Но химический анализ говорит нам, что связи в озоне равны, то есть озон не принимает форму ни одной из резонансных структур. На самом деле, вместо того, чтобы обнаруживаться в виде той или иной резонансной структуры, озон принимает то, что известно как гибридная структура . Это структура находится где-то между обеими резонансными структурами и показана двунаправленной стрелкой. Вместо того, чтобы содержать одну одинарную связь и одну двойную связь, он содержит две промежуточных связи , которые представляют собой среднее значение одинарной и двойной связи. На самом деле, вы можете думать о них как о полуторных облигациях. Они образованы лобовым перекрытием атомных орбиталей, таких как s-, p- или sp-гибридные орбитали. Напротив, пи-связи образуются путем бокового перекрытия р-орбиталей. Но когда дело доходит до молекул, которые демонстрируют резонанс, вместо того, чтобы возникать только между двумя атомами, вы обнаружите пи-связь между несколькими атомами в структуре. Их р-орбитали сливаются в одну большую перекрывающуюся область. Электроны с этих орбиталей рассредоточены по области перекрытия и не принадлежат какому-то одному конкретному атому. Мы говорим, что их делокализованный . Когда молекула делокализует свои электроны, она уменьшает свою электронную плотность, что помогает ей стать более стабильной.
Они образованы лобовым перекрытием атомных орбиталей, таких как s-, p- или sp-гибридные орбитали. Напротив, пи-связи образуются путем бокового перекрытия р-орбиталей. Но когда дело доходит до молекул, которые демонстрируют резонанс, вместо того, чтобы возникать только между двумя атомами, вы обнаружите пи-связь между несколькими атомами в структуре. Их р-орбитали сливаются в одну большую перекрывающуюся область. Электроны с этих орбиталей рассредоточены по области перекрытия и не принадлежат какому-то одному конкретному атому. Мы говорим, что их делокализованный . Когда молекула делокализует свои электроны, она уменьшает свою электронную плотность, что помогает ей стать более стабильной. Эти молекулы показывают резонанс .
Эти молекулы показывают резонанс . В то же время исходная двойная связь O=O, обнаруженная между центральным кислородом и атомом кислорода справа, разрывается, и электронная пара переносится на атом кислорода справа. Чтобы перейти от резонансной структуры справа к резонансной структуре слева, вы делаете обратное.
В то же время исходная двойная связь O=O, обнаруженная между центральным кислородом и атомом кислорода справа, разрывается, и электронная пара переносится на атом кислорода справа. Чтобы перейти от резонансной структуры справа к резонансной структуре слева, вы делаете обратное. Например, ранее мы рассматривали озон. Его можно описать с помощью двух резонансных структур. Общая гибридная структура представляет собой идеальное среднее из двух. Однако в некоторых случаях одна структура имеет большее влияние, чем другие. Мы говорим, что эта структура является доминирующей . Доминантная структура определяется с помощью официальные сборы .
Например, ранее мы рассматривали озон. Его можно описать с помощью двух резонансных структур. Общая гибридная структура представляет собой идеальное среднее из двух. Однако в некоторых случаях одна структура имеет большее влияние, чем другие. Мы говорим, что эта структура является доминирующей . Доминантная структура определяется с помощью официальные сборы .
 Точно так же, как пиззли-медведи иногда не белые медведи, а иногда гризли, а скорее смесь обоих видов, озон не является иногда одной резонансной структурой, а иногда другой. Вы должны объединить обе структуры, чтобы сформировать что-то еще. Мы говорим, что молекулы, которые не могут быть представлены только одной структурой Льюиса, показывают резонанс .
Точно так же, как пиззли-медведи иногда не белые медведи, а иногда гризли, а скорее смесь обоих видов, озон не является иногда одной резонансной структурой, а иногда другой. Вы должны объединить обе структуры, чтобы сформировать что-то еще. Мы говорим, что молекулы, которые не могут быть представлены только одной структурой Льюиса, показывают резонанс .
 commons.wikimedia.org
commons.wikimedia.org