Диаметр молекулы воды в мм. Kvant
>>Физика: Основные положения молекулярно-кинетической теории. Размеры молекул
Молекулы очень малы, но посмотрите, как просто оценить их размеры и массу. Достаточно одного наблюдения и пары несложных расчетов. Правда, надо еще додуматься до того, как это сделать.
В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом . Каждое утверждение строго доказано с помощью опытов.
Свойства и поведение всех без исключения тел от инфузории до звезды определяются движением взаимодействующих друг с другом частиц: молекул, атомов или еще более малых образований — элементарных частиц.
Оценка размеров молекул. Для полной уверенности в существовании молекул надо определить их размеры.
Проще всего это сделать, наблюдая расплывание капельки масла, например оливкового, по поверхности воды.
Объем V слоя масла равен произведению его площади поверхности S на толщину d слоя, т. е. V=Sd . Следовательно, размер молекулы оливкового масла равен:
Перечислять сейчас всевозможные способы доказательства существования атомов и молекул нет необходимости. Современные приборы позволяют видеть изображения отдельных атомов и молекул. На рисунке 8.2 показана микрофотография поверхности кремниевой пластины, где бугорки — это отдельные атомы кремния. Подобные изображения впервые научились получать в 1981 г. с помощью не обычных оптических, а сложных туннельных микроскопов .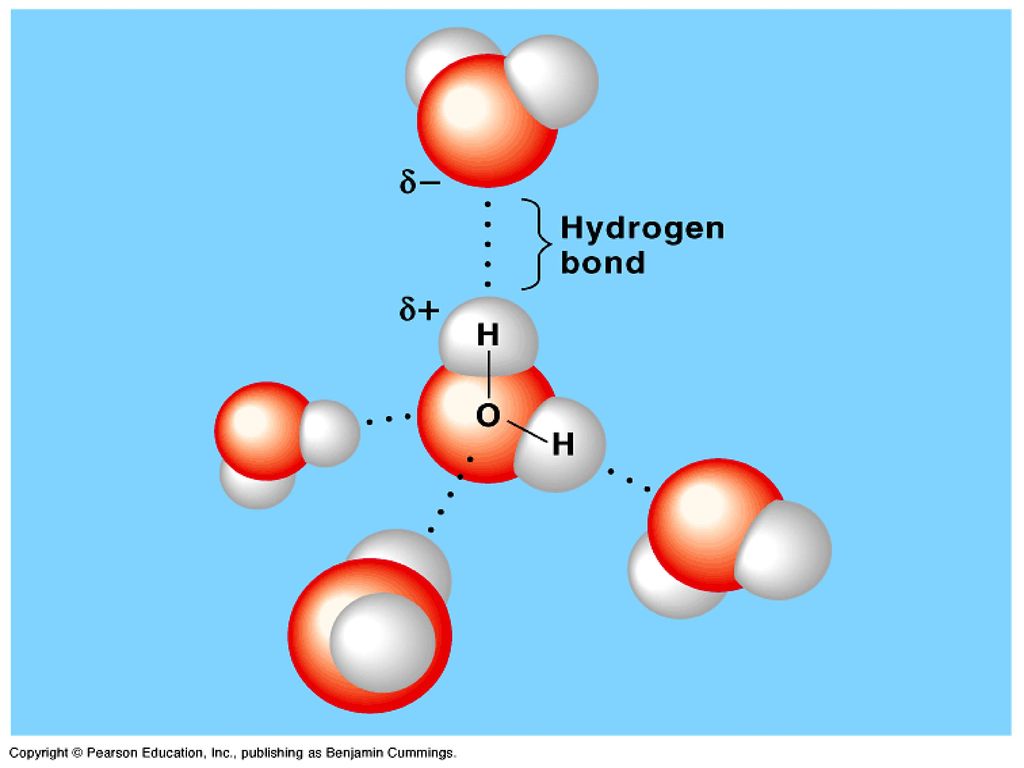
Размеры молекул, в том числе и оливкового масла, больше размеров атомов. Диаметр любого атома примерно равен 10 -8 см. Эти размеры так малы, что их трудно себе представить. В таких случаях прибегают к помощи сравнений.
Вот одно из них. Если пальцы сжать в кулак и увеличить его до размеров земного шара, то атом при том же увеличении станет размером с кулак.
Диаметр молекулы воды равен примерно 3 10 -8 см. Считая, что каждая молекула воды при плотной упаковке молекул занимает объем (3 10 -8 см) 3 , можно найти число молекул в капле, разделив объем капли (1 см 3) на объем, приходящийся на одну молекулу:
При каждом вдохе вы захватываете столько молекул, что если бы все они после выдоха равномерно распределились в атмосфере Земли, то каждый житель планеты при вдохе получил бы две-три молекулы, побывавшие в ваших легких.
Размеры атома малы: .
О трех основных положениях молекулярно-кинетической теории речь будет идти неоднократно.
???
1. Какие измерения надо произвести, чтобы оценить размеры молекулы оливкового масла?
2. Если бы атом увеличился до размеров макового зернышка (0,1 мм), то размеров какого тела при том же увеличении достигло бы зернышко?
3. Перечислите известные вам доказательства существования мо¬лекул, не упомянутые в тексте.
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие
Совершенствование учебников и уроковисправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку,
МКТ — это просто!
«Ничто не существует, кроме атомов и пустого пространства …» — Демокрит
«Любое тело может делиться до бесконечности» — Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ — это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела — это большие тела, состоящие из огромного числа молекул.
Тепловые явления — явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
— механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
Диффузия; броуновское движение частиц в жидкости под ударами молекул;
Плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
— фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение — это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
— открыто английским ботаником Р. Броуном в 1827 г.
— дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
— экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.
Число молекул в веществе
где V — объем вещества, Vo — объем одной молекулы
Масса одной молекулы
где m — масса вещества,
N — число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина — относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель — это масса молекулы, а знаменатель — 1/12 массы атома углерода
Это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
где числитель — это масса атома, а знаменатель — 1/12 массы атома углерода
Величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества (ν) определяет относительное число молекул в теле.
где N — число молекул в теле, а Na — постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль — это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) — это масса вещества, взятого в одном моле, или иначе — это масса одного моля вещества.
Масса молекулы
— постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Используя достижения современной экспериментальной техники, удалось определить линейные размеры простых атомов и молекул, которые составляют около 10-8 см. Линейные размеры сложных атомов и молекул намного больше. Например, размер молекулы белка составляет 43*10 -8 см.
Для характеристики атомов используют представление об атомных радиусах, которые дают возможность приближённо оценить межатомные расстояния в молекулах, жидкостях или твёрдых телах, так как атомы по своим размерам не имеют чётких границ. То есть атомный радиус – это сфера, в которой заключена основная часть электронной плотности атома (не менее 90…95%).
Размер молекулы настолько мал, что представить его можно только с помощью сравнений. Например, молекула воды во столько раз меньше крупного яблока, во сколько раз яблоко меньше земного шара.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса ) вещества М r – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
М r = (m 0) : (m 0C / 12)
где m 0 – масса молекулы (или атома) данного вещества, m 0C – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С 12 . Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С 12 . Точные измерения показали, что атомная единица массы составляет 1,660*10 -27 кг, то есть
1 а.е.м. = 1,660 * 10 -27 кг
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д. И. Менделеева.
И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса , которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
m 0Mg = 24,305 * 1 a.e.м. = 24,305 * 1,660 * 10 -27 = 40,3463 * 10 -27 кг
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н 2 О) будет равна:
Например, масса молекулы воды (Н 2 О) будет равна:
m 0Н2О = 2 * m 0H + m 0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10 -27 кг
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С 12 . То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества .
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / N A
где N – количество молекул в данном теле, N A – количество молекул в 1 моле вещества, из которого состоит тело.
N A – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
N A = 6,02 * 10 23 моль -1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m 0 * N A
где m 0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль -1).
Молярная масса связана с относительной молекулярной массой соотношением:
μ = 10 -3 * M r [кг*моль -1 ]
Масса любого количества вещества m равна произведению массы одной молекулы m 0 на количество молекул:
m = m 0 N = m 0 N A ν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m 0 = m / N = m / νN A = μ / N A
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10 -27 кг. Тогда молярная масса будет:
μ = m 0Mg * N A = 40,3463 * 10 -27 * 6,02 * 10 23 = 2,4288 * 10 -2 кг/моль
То есть в одном моле «помещается» 2,4288 * 10 -2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Муниципальное общеобразовательное учреждение
«Основная общеобразовательная школа №10»
Определение диаметра молекул
Лабораторная работа
Исполнитель: Масаев Евгений
7 класс «А»
Руководитель: Резник А. В.
Гурьевский район
Введение
В этом учебном году я начал изучать физику. Я узнал, что тела, которые нас окружают, состоят из мельчайших частиц – молекул. Меня заинтересовало, каковы размеры молекул. Из-за очень малых размеров молекулы нельзя увидеть невооруженным глазом или с помощью обыкновенного микроскопа. Я прочитал, что молекулы можно увидеть только с помощью электронного микроскопа. Ученые доказали, что молекулы разных веществ отличаются друг от друга, а молекулы одного и того же вещества одинаковы. Мне захотелось на практике измерить диаметр молекулы. Но к сожалению, в школьной программе не предусматривает изучение проблем такого рода, а рассмотреть её одному оказалось нелёгкой задачей и пришлось изучать литературу о методах определения диаметра молекул.
Из-за очень малых размеров молекулы нельзя увидеть невооруженным глазом или с помощью обыкновенного микроскопа. Я прочитал, что молекулы можно увидеть только с помощью электронного микроскопа. Ученые доказали, что молекулы разных веществ отличаются друг от друга, а молекулы одного и того же вещества одинаковы. Мне захотелось на практике измерить диаметр молекулы. Но к сожалению, в школьной программе не предусматривает изучение проблем такого рода, а рассмотреть её одному оказалось нелёгкой задачей и пришлось изучать литературу о методах определения диаметра молекул.
Глава I . Молекулы
1.1 Из теории вопроса
Молекула в современном понимании – это наименьшая частица вещества, обладающая всеми его химическими свойствами. Молекула способна к самостоятельному существованию. Она может состоять как из одинаковых атомов, например кислород О 2 , озон О 3 , азот N 2 , фосфор P 4 , сера S 6 и т. д., так и из различных атомов: сюда относятся молекулы всех сложных веществ. Простейшие молекулы состоят из одного атома: это молекулы инертных газов – гелия, неона, аргона, криптона, ксенона, радона. В так называемых высокомолекулярных соединениях и полимерах каждая молекула может состоять из сотен тысяч атомов.
Простейшие молекулы состоят из одного атома: это молекулы инертных газов – гелия, неона, аргона, криптона, ксенона, радона. В так называемых высокомолекулярных соединениях и полимерах каждая молекула может состоять из сотен тысяч атомов.
Экспериментальное доказательство существования молекул первым наиболее убедительно дал французский физик Ж. Перрен в 1906 г. при изучении броуновского движения. Оно, как показал Перрен, является результатом теплового движения молекул – и ничем иным.
Сущность молекулы можно описать и с другой точки зрения: молекула – устойчивая система, состоящая из ядер атомов (одинаковых или различных) и окружающих электронов, причем химические свойства молекулы определяются электронами внешних оболочек в атомах. Атомы объединяются в молекулы в большинстве случаев химическими связями. Обычно такая связь создается одной, двумя или тремя парами электронов, которыми владеют сообща два атома.
Атомы в молекулах соединены друг с другом в определенной последовательности и определённым образом распределены в пространстве.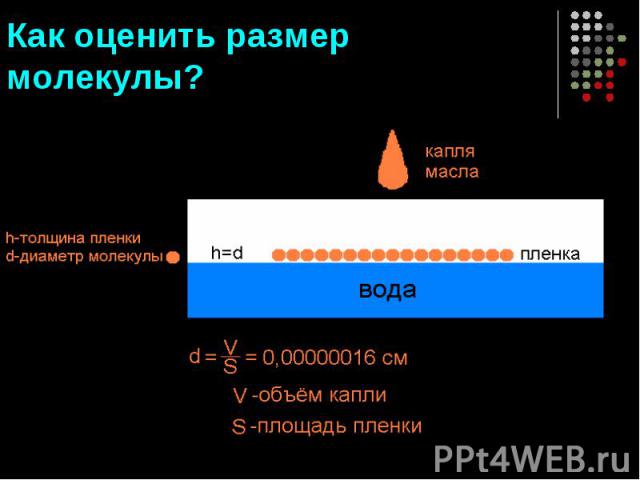 Связи между атомами имеют различную прочность; она оценивается величиной энергии, которую необходимо затратить для разрыва межатомных связей.
Связи между атомами имеют различную прочность; она оценивается величиной энергии, которую необходимо затратить для разрыва межатомных связей.
Молекулы характеризуются определёнными размером и формой. Различными способами было определено, что в 1 см 3 любого газа при нормальных условиях содержится около 2,7×10 19 молекул.
Чтобы понять, насколько велико это число, можно представить, что молекула – это «кирпич». Тогда если взять количество кирпичей, равное числу молекул в 1 см 3 газа при нормальных условиях, и плотно уложить ими поверхность суши всего земного шара, то они покрыли бы поверхность слоем высотой 120 м, что почти в 4 раза превосходит высоту 10-этажного дома. Огромное число молекул в единице объёма указывает на очень малые размеры самих молекул. Например, масса молекулы воды m=29,9 x 10 -27 кг. Соответственно малы и размеры молекул. Диаметром молекулы принято считать минимальное расстояние, на которое им позволяет сблизиться силы отталкивания. Однако понятие размера молекулы является условным, так как на молекулярных расстояниях представления классической физики не всегда оправданы.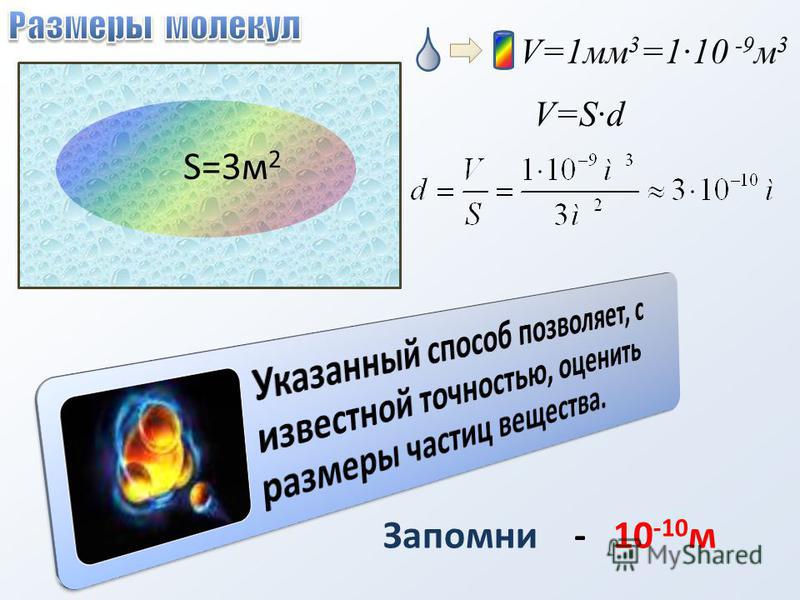 Средний размер молекул порядка 10-10 м.
Средний размер молекул порядка 10-10 м.
Молекула как система, состоящая из взаимодействующих электронов и ядер, может находиться в различных состояниях и переходить из одного состояния в другое вынужденно (под влиянием внешних воздействий) или самопроизвольно. Для всех молекул данного вида характерна некоторая совокупность состояний, которая может служить для идентификации молекул. Как самостоятельное образование молекула обладает в каждом состоянии определенным набором физических свойств, эти свойства в той или иной степени сохраняются при переходе от молекул к состоящему из них веществу и определяют свойства этого вещества. При химических превращениях молекулы одного вещества обмениваются атомами с молекулами другого вещества, распадаются на молекулы с меньшим числом атомов, а также вступают в химические реакции других типов. Поэтому химия изучает вещества и их превращения в неразрывной связи со строением и состоянием молекул.
Обычно молекулой называют электрически нейтральную частицу.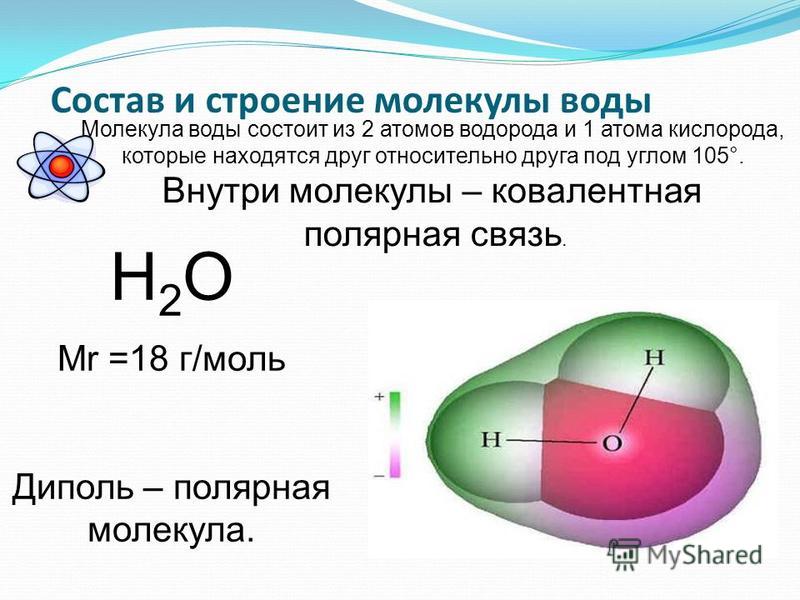 В веществе положительные ионы всегда сосуществуют вместе с отрицательными.
В веществе положительные ионы всегда сосуществуют вместе с отрицательными.
По числу входящих в молекулу атомных ядер различают молекулы двухатомные, трехатомные и т.д. Если число атомов в молекуле превосходит сотни и тысячи, молекула называется макромолекулой. Сумма масс всех атомов, входящих в состав молекулы, рассматривается как молекулярная масса. По величине молекулярной массы все вещества условно делят на низко- и высокомолекулярные.
1.2 Методы измерения диаметра молекул
В молекулярной физике главные «действующие лица» — это молекулы, невообразимо маленькие частицы, из которых состоят все на свете вещества. Ясно, что для изучения многих явлений важно знать, каковы они, молекулы. В частности, каковы их размеры.
Когда говорят о молекулах, их обычно считают маленькими упругими твердыми шариками. Следовательно, знать размер молекул, значит знать их радиус.
Несмотря на малость молекулярных размеров, физики сумели разработать множество способов их определения.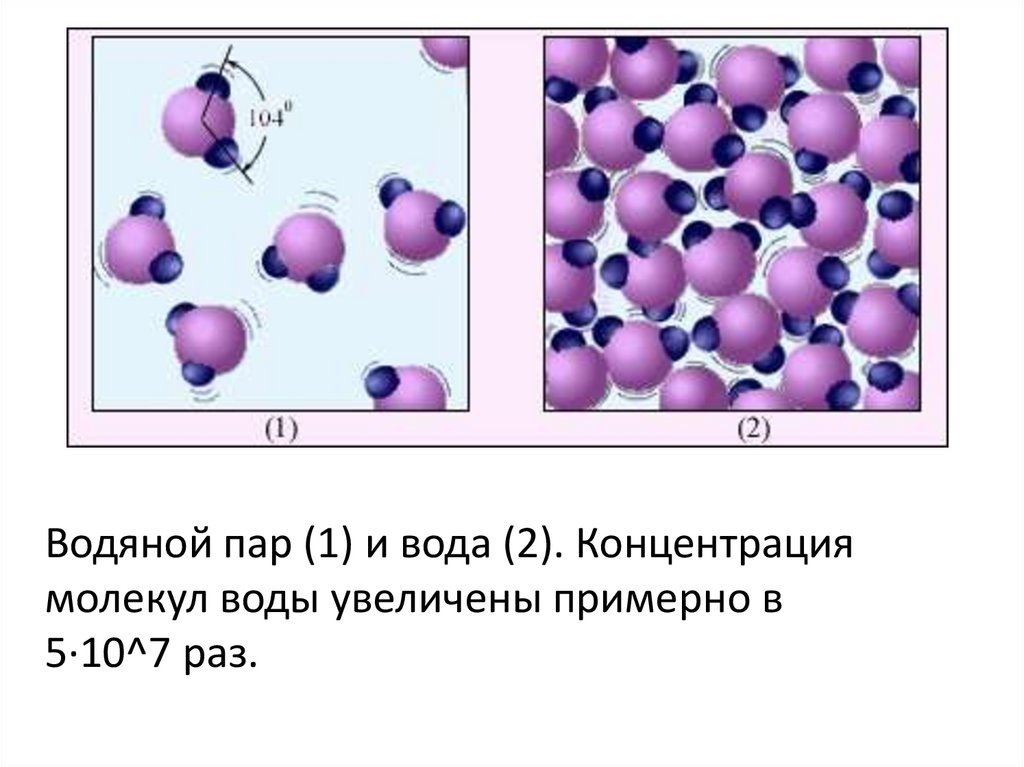 В «Физике 7» рассказывается о двух из них. В одном используется свойство некоторых (очень немногих) жидкостей растекаться в виде пленки толщиной в одну молекулу. В другом размер частицы определяется с помощью сложного прибора — ионного проектора.
В «Физике 7» рассказывается о двух из них. В одном используется свойство некоторых (очень немногих) жидкостей растекаться в виде пленки толщиной в одну молекулу. В другом размер частицы определяется с помощью сложного прибора — ионного проектора.
Строение молекул изучают различными экспериментальными методами. Электронография, нейтронография и рентгеновский структурный анализ позволяют получать непосредственную информацию о структуре молекул. Электронографии, метод, исследующий рассеяние электронов на пучке молекул в газовой фазе, позволяет рассчитать параметры геометрической конфигурации для изолированных сравнительно простых молекул. Нейтронография и рентгеновский структурный анализ ограничены анализом структуры молекул либо отдельных упорядоченных фрагментов в конденсированной фазе. Рентгенографические исследования кроме указанных сведений дают возможность получить количественные данные о пространственном распределении электронной плотности в молекулах.
Спектроскопические методы основаны на индивидуальности спектров химических соединений, которая обусловлена характерным для каждой молекулы набором состояний и отвечающих им энергетических уровней.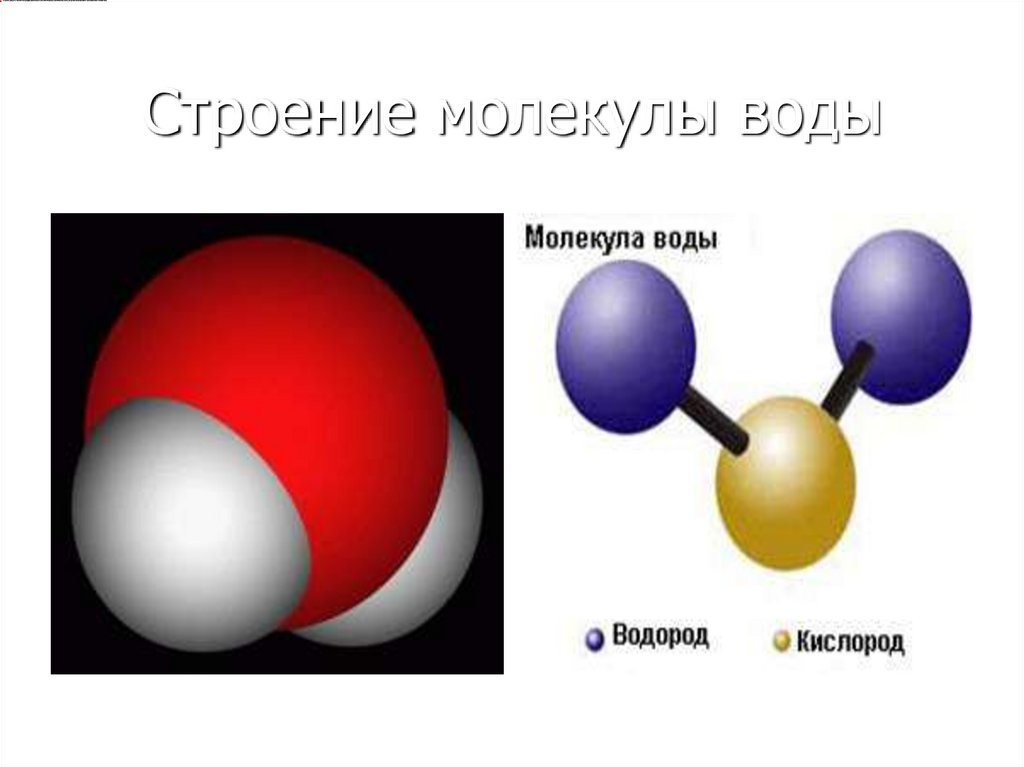 Эти методы позволяют проводить качественный и количественный спектральный анализ веществ.
Эти методы позволяют проводить качественный и количественный спектральный анализ веществ.
Спектры поглощения или испускания в микроволновой области спектра позволяют изучать переходы между вращательными состояниями, определять моменты инерции молекул, а на их основе — длины связей, валентные углы и другие геометрические параметры молекул. Инфракрасная спектроскопия исследует, как правило, переходы между колебательно-вращательными состояниями и широко используется для спектрально-аналитических целей, поскольку многие частоты колебаний определенных структурных фрагментов молекул являются характеристическими и слабо меняются при переходе от одной молекулы к другой. В то же время инфракрасная спектроскопия позволяет судить и о равновесной геометрической конфигурации. Спектры молекул в оптическом и ультрафиолетовом диапазонах частот связаны главным образом с переходами между электронными состояниями. Результатом их исследований являются данные об особенностях потенциальных поверхностей для различных состояний и значения молекулярных постоянных, определяющих эти потенциальные поверхности, также времена жизни молекул в возбужденных состояниях и вероятности переходов из одного состояния в другое.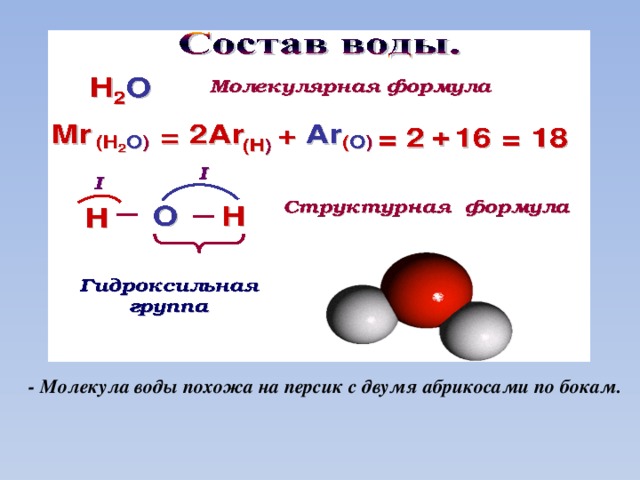
О деталях электронного строения молекул уникальную информацию дают фото- и рентгеноэлектронные спектры, а также оже-спектры, позволяющие оценить тип симметрии молекулярных орбиталей и особенности распределения электронной плотности. Широкие возможности для изучения отдельных состояний молекул открыла лазерная спектроскопия (в различных диапазонах частот), отличающаяся исключительно высокой селективностью возбуждения. Импульсная лазерная спектроскопия позволяет анализировать строение короткоживущих молекул и их превращения в электромагнитное поле.
Разнообразную информацию о строении и свойствах молекул дает изучение их поведения во внешних электрических и магнитных полях.
Существует, однако, очень простой, хотя и не самый точный, способ вычисления радиусов молекул (или атомов) Он основан на том, что молекулы вещества, когда оно находится в твердом или жидком состоянии, можно считать плотно прилегающими друг к другу. В таком случае для грубой оценки можно считать, что объем V некоторой массы m вещества просто равен сумме объемов содержащихся в нем молекул. Тогда объем одной молекулы мы получим, разделив объем V на число молекул N .
Тогда объем одной молекулы мы получим, разделив объем V на число молекул N .
Число молекул в теле массой m равно, как известно,
, где М — молярная масса вещества N A — число Авогадро. Отсюда объем V 0 одной молекулы определяется из равенства .
В это выражение входит отношение объема вещества к его массе. Обратное же отношение
Молекулы имеют размеры и разнообразные формы. Для наглядности будем изображать молекулу в виде шарика, воображая, что она охвачена сферической поверхностью, внутри которой находятся электронные оболочки ее атомов (рис. 4, а). По современным представлениям молекулы не имеют геометрически определенного диаметра. Поэтому за диаметр d молекулы условились принимать расстояние между центрами двух молекул (рис. 4, б), сблизившихся настолько, что силы притяжения между ними уравновешиваются силами отталкивания.
Из курса химии» известно, что килограмм-молекула (киломоль) любого вещества, независимо от его агрегатного состояния, содержит одинаковое количество молекул, называемое числом Авогадро, а именно N A = 6,02*10 26 молекул.
Теперь оценим диаметр молекулы, например воды. Для этого разделим объем киломоля воды на число Авогадро. Киломоль воды имеет массу 18 кг. Считая, что молекулы воды расположены плотно друг к другу и ее плотность 1000 кг / м 3 , можем сказать, что 1 кмоль воды занимает объем V = 0,018 м 3 . На долю одной молекулы воды приходится объем
Приняв молекулу за шарик и воспользовавшись формулой объема шара вычислим приблизительный диаметр, иначе линейный размер молекулы воды:
Диаметр молекулы меди 2,25*10 -10 м. Диаметры молекул газов того же порядка. Например, диаметр молекулы водорода 2,47*10 -10 м, углекислого газа — 3,32*10 -10 м. Значит, молекула имеет диаметр порядка 10 -10 м. На длине 1 см рядом могут расположиться 100 млн. молекул.
Произведем оценку массы молекулы, например сахара (C 12 H 22 О 11). Для этого надо массу киломоля сахара (μ = 342,31 кг / кмоль) разделить на число Авогадро, т. е. на число молекул в
е. на число молекул в
Изобретен графеновый фильтр для опреснения морской воды
- Пол Ринкон
- Редактор отдела науки ВВС
Автор фото, Uni Manchester
Підпис до фото,Мембраны из графена могут творить чудеса
Британские ученые создали первый в мире фильтр для опреснения морской воды, используя специальное «решето» из графена, пропускающее молекулы воды, но задерживающее ионы натрия, хлора и другие компоненты солей.
Это изобретение может помочь миллионам людей по всему миру, испытывающим проблемы с доступом к чистой питьевой воде.
- 10 крупнейших открытий в области физики за 2016 год
- Технологии будущего: новинки выставки CES-2017
Сейчас новый фильтр проходит испытания — его сравнивают с уже существующими мембранами для опреснения воды.
До последнего времени производить графеновые «сита» на промышленной основе было крайне затруднительно.
Результаты исследования команды ученых Манчестерского университета под руководством доктора Рахула Найра были опубликованы в журнале Nature Nanotechnology: физики заявляют, что им удалось разрешить многие практические проблемы производства при помощи производного вещества, оксида графена.
Графен является двумерной аллотропной модификацией углерода — это слой вещества толщиной в один атом, соединенный посредством σ- и π-связей в гексагональную двумерную кристаллическую решетку.
Графен был открыт группой исследователей из Манчестерского университета; это один из самых легких и жестких материалов с необычными свойствами теплопроводности.
Однако до сих пор возникали трудности с производством однослойного графена — как с технической, так и финансовой точки зрения.
Однако, как говорит доктор Найр, оксид графена можно с легкостью производить при помощи простого процесса окисления в лаборатории, а затем его можно нанести на пористый материал — и использовать полученный результат как фильтр.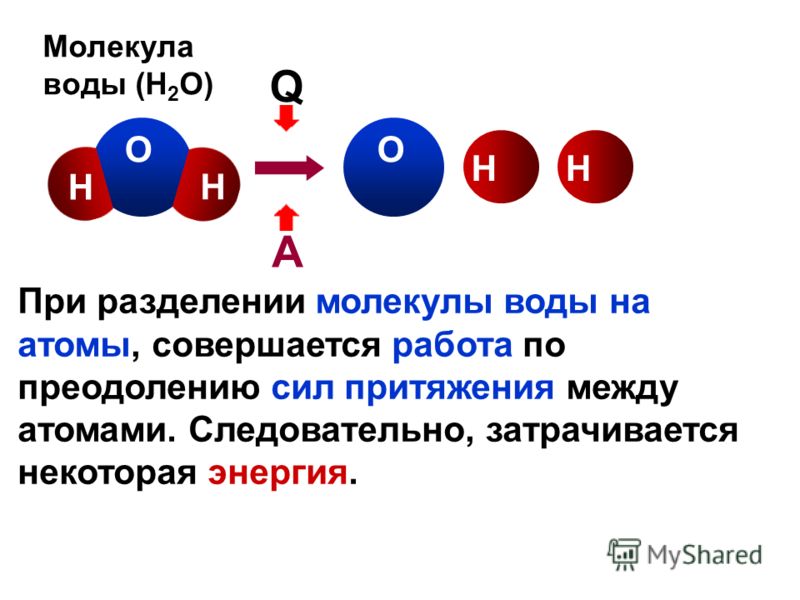
Автор фото, EPA
Підпис до фото,У миллионов людей по всему миру нет регулярного доступа к питьевой воде
Пропустити подкаст і продовжити
подкаст
Що це було
Головна історія тижня, яку пояснюють наші журналісти
Випуски
Кінець подкаст
Проблема любого фильтра, по его словам, состоит в том, что в нем необходимо «просверливать» крошечные отверстия.
«Но если диаметр отверстия окажется больше одного нанометра, соли морской воды проникнут через него, — поясняет он. — Так что, чтобы сделать мембрану пригодной для опреснения, она должна быть пронизана совершенно одинаковыми отверстиями размером меньше нанометра, а это очень сложная задача».
Мембраны из оксида графена уже были испытаны для фильтрации наночастиц, органических молекул и даже крупных солей. Но до сих пор они были непригодны для очищения воды от обычной соли, так как для этого отверстия в «сите» должны быть еще меньше.
Но до сих пор они были непригодны для очищения воды от обычной соли, так как для этого отверстия в «сите» должны быть еще меньше.
До сих пор проблема состояла в том, что пленки оксида графена немного разбухают при намачивании — и начинают пропускать не только воду, но и ионы магния, натрия и ряда других веществ. Найр и его коллеги решили эту проблему, научившись склеивать одиночные полоски из оксида графена при помощи обычной эпоксидной смолы — таким образом, они почти не разбухают при контакте с водой.
Этот метод заодно позволил ученым «настраивать» свойства мембраны — так, чтобы она пропускала больше или меньше соли.
При растворении обычных солей в воде, вокруг каждой молекулы соли образуется своеобразная оболочка из молекул воды.
Это позволяет капиллярам мембран из оксида графена пропускать вону, отсеивая морскую соль.
«Молекулы воды могут пройти через мембрану по одной, но молекулы хлорида натрия этого сделать не могут — для этого они должны быть окружены водой, а вместе с водяной оболочкой молекула соли оказывается больше, чем диаметр капилляра», — объясняет доктор Найр.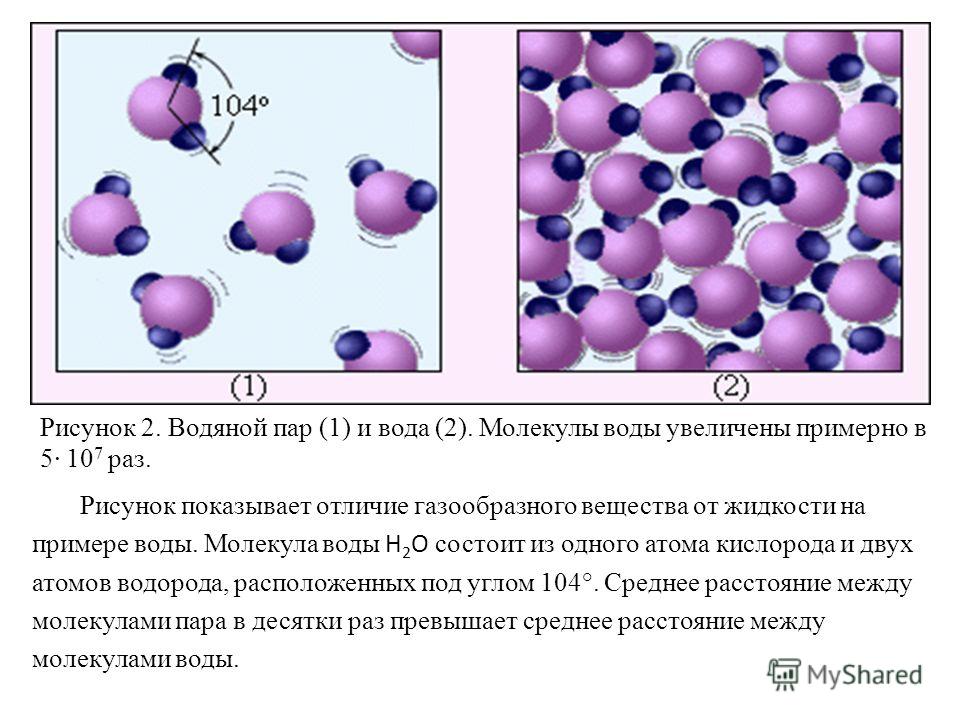
Автор фото, PHOTOSTOCK-ISRAEL/SCIENCE PHOTO LIBRARY
Підпис до фото,Теперь ученые должны сравнить, насколько хорошо новый фильтр работает по сравнению с материалами, уже существующими на рынке
Кроме того, молекулы воды проникают через мембрану с большой скоростью, что делает это изобретение идеальным для опреснения морской воды.
«Диаметр капилляра достигает около одного нанометра, что почти соответствует размеру молекулы воды, а это, в свою очередь, приводит к цепной реакции: одна молекула тянет за собой другую, и они проходят через мембрану наподобие поезда», — объясняет Рахул Найр.
«За счет этого вода движется быстрее: если увеличить давление с одной стороны, то все молекулы быстро перетекут на другую за счет водородной связи между ними. Но это происходит только в том случае, если диаметр тоннеля очень мал», — добавляет он.
По оценкам ООН, к 2025 году более 14% населения Земли будут испытывать нехватку в питьевой воде. Многие страны уже строят большие установки по опреснению воды.
Многие страны уже строят большие установки по опреснению воды.
В настоящий момент подобные установки используют мембраны из полимеров.
«Мы продемонстрировали, что можем контролировать размеры пор мембраны и за счет этого опреснять воду, что еще недавно было невозможным. Теперь мы должны изучить, как наш фильтр работает по сравнению с лучшими материалами, уже существующими на рынке», — продолжает доктор Найр.
Рам Деванатан из Тихоокеанской Северо-Западной национальной лаборатории США, говорит, что необходимо проверить новые фильтры и на предмет срока службы — выдержат ли они длительный контакт с морской водой, — а также выяснить, как они будут реагировать на загрязнения воды биологическими веществами.
Увеличиваются ли молекулы при нагревании? / Хабр
Все мы знаем, что если надуть пластиковую бутылку горячим воздухом, крепко-накрепко закрыть крышкой, а потом охладить, то бутылка сожмётся. Причина этого лежит в физике 8-го класса, или, если точнее, в законе Гей-Люссака, утверждающем, что отношение объёмов при разных температурах равно отношению абсолютных температур. То есть ещё со школьных времён (а может и раньше) нам всем известно, что при нагревании некоторого количества газа его объём увеличивается, а при охлаждении — уменьшается.
То есть ещё со школьных времён (а может и раньше) нам всем известно, что при нагревании некоторого количества газа его объём увеличивается, а при охлаждении — уменьшается.
А что насчёт того, из чего этот газ состоит? Увеличивается ли объём самих частичек газа, то есть размер атомов и молекул? Банальный ответ на этот банальный вопрос под катом.
Ха-ха, попались!
Ответ на этот вопрос весьма прост: как мы определим
размер частиц (что такое размер атома/молекулы в зависимости от температуры), такой ответ мы и получим. Поскольку атомы по-своей сути — это одноатомные молекулы, то дальше мы будем называть все эти частицы единым термином «молекула«.
Если взять бутылку с газом, и из этой бутылки взять одну единственную молекулу, то окажется, что для неё не возможно (по-честному) даже принципиально измерить температуру. Частица находится в каком-то конкретном (квантовом) состоянии, которое мы можем определить и измерить, но при этом мы не сможем засунуть ей в в неё термометр и узнать сколько там у неё градусов. Связанно это с тем, что «температура» — это свойство макроскопических (т.е. больших) систем, состоящих из большого числа частиц. А значит если молекул в системе мало, то и измерять у этой системы нечего. «Большое число частиц», конечно, это плавающее понятие, но обычно оно измеряется в молях, или в числах Авогадро (), поэтому очевидно, что одна молекула горааааздо меньше этого порядка величин, а значит само понятие температуры не применимо к одной, двум, да даже десяти молекулам.
Связанно это с тем, что «температура» — это свойство макроскопических (т.е. больших) систем, состоящих из большого числа частиц. А значит если молекул в системе мало, то и измерять у этой системы нечего. «Большое число частиц», конечно, это плавающее понятие, но обычно оно измеряется в молях, или в числах Авогадро (), поэтому очевидно, что одна молекула горааааздо меньше этого порядка величин, а значит само понятие температуры не применимо к одной, двум, да даже десяти молекулам.
Что такое температура?
Но что вообще такое температура? Ещё со школы мы знаем, что есть т.н. абсолютная температура T, измеряемая в градусах Кельвина. Именно она стоит во всех газовых законах, в частности в уравнении Менделеева-Клайперона.
Для забывших, как выглядит уравнение Менделеева-Клайперона
Это уравнение имеет вид , где P — давление, V — объём, n — количество вещества (в молях), R = 8. 314 Дж/(моль · К) — универсальная газовая постоянная, а T — абсолютная температура в Кельвинах (К).
314 Дж/(моль · К) — универсальная газовая постоянная, а T — абсолютная температура в Кельвинах (К).
Абсолютная температура связанна с относительной температурой t, измеряемой в градусах Цельсия, как , и абсолютный ноль (T=0, или же ) — это недостижимая величина. Ещё всем в голову вбивают мантру:
абсолютная температура является мерой средней кинетической энергии молекул.
Но эта мантра не объясняет, что же именно из себя представляет температура.
Попробуем разобраться. Начнём с простого примера. Закроем глаза и представим себе Африку: жаркую, солнечную, заполненную равнинными саваннами, и с горой Килиманджаро торчащей посередине. А ещё там есть слоны.
Каждый слон имеет определённую (большую) массу, и поэтому любое поднятие своей туши из равнинной местности в горную — это большая затрата энергии.
Представим, что слоны голодные, поэтому энергии у них мало. Будучи слоном, я бы в таком состоянии не попёрся бы в гору, а тусовался бы в саванне. В горы бы я ходил только по очень-очень большой нужде. В результате, если бы мы сняли фотографию Африки со спутника, она бы выглядела примерно так, как показано на картинке ниже: много-много слонов на равнине, и очень мало смелых и отчаянных в горах, причём, чем выше — меньше вероятность найти слона.
Будучи слоном, я бы в таком состоянии не попёрся бы в гору, а тусовался бы в саванне. В горы бы я ходил только по очень-очень большой нужде. В результате, если бы мы сняли фотографию Африки со спутника, она бы выглядела примерно так, как показано на картинке ниже: много-много слонов на равнине, и очень мало смелых и отчаянных в горах, причём, чем выше — меньше вероятность найти слона.
А теперь представим, что слоны хорошенько поели, да ещё какой-нибудь [Роскомнадзор] ещё для скорости им в еду подсыпали, так что энергии у слонов много. В этом случае, что равнина, что гора, слоны будут туда переться без особой устали, поэтому теперь вероятность отыскать слона на равнине и в горах будет отличаться уже меньше, чем в предыдущем примере (см. картинку ниже), хотя всё ещё будет сохраняться правило: чем выше на гору — тем меньше слонов.
Эти два примера весьма точно иллюстрируют случаи газа с низкой (первый) и высокой (второй) температурой. У каждой молекулы (слона) есть какая-то своя энергия, в нашем примере — это гравитационная энергия , где m — масса, g = 9. 8 м/c2 — ускорение свободного падения, а h — высота над равниной. Из энергии каждой конкретной частицы (места, где нашли слона) мы не можем ничего сказать о том, как всех слонов покормили в целом, но именно то, сколько на всех выделили еды, или другими словами, сколько энергии вкачали в среднем во всю систему, даст нам распределение слонов по ландшафту Африки. Собственно, температура в наших примерах — это общая величина накормленности всех слонов во всей Африке. Именно поэтому мантра из школьного курса физики и оказывается верна — температура — это то, сколько в среднем энергии (причем, как кинетической, так и потенциальной) имеет каждая молекула, или, что в данном случае эквивалентно, какова вероятность найти частицу с очень большой энергией. Но более точно, температура — это параметр распределения Больцмана (или Гиббса) — распределения частиц по состояниям с различной энергией. Это распределение говорит нам, что чем выше температура, тем больше высокоэнергетических молекул относительно числа низкоэнергетических мы имеем.
8 м/c2 — ускорение свободного падения, а h — высота над равниной. Из энергии каждой конкретной частицы (места, где нашли слона) мы не можем ничего сказать о том, как всех слонов покормили в целом, но именно то, сколько на всех выделили еды, или другими словами, сколько энергии вкачали в среднем во всю систему, даст нам распределение слонов по ландшафту Африки. Собственно, температура в наших примерах — это общая величина накормленности всех слонов во всей Африке. Именно поэтому мантра из школьного курса физики и оказывается верна — температура — это то, сколько в среднем энергии (причем, как кинетической, так и потенциальной) имеет каждая молекула, или, что в данном случае эквивалентно, какова вероятность найти частицу с очень большой энергией. Но более точно, температура — это параметр распределения Больцмана (или Гиббса) — распределения частиц по состояниям с различной энергией. Это распределение говорит нам, что чем выше температура, тем больше высокоэнергетических молекул относительно числа низкоэнергетических мы имеем.
Распределение Больцмана
Собственно, распределение Больцмана имеет вид:
где n(E) — это число частиц с энергией E, R — универсальная газовая постоянная (см. предыдущий спойлер), а T, само собой, температура.
В примере же со слонами мы иллюстрировали т.н. барометрическую формулу: частный случай распределения Больцмана, показывающий как меняется давление газа с увеличением высоты:
где P(h) — это давление на высоте h, , а M — это молярная масса газа.
Растут ли атомы от температуры?
Теперь, собственно, можно перейти к вопросу: а растут ли, например, атомы при росте температуры. Само собой, каждый конкретный атом находится в каком-то квантовом состоянии, поэтому от температуры его размер не зависит, но вот средний размер всех атомов в сосуде с газом от той самой температуры зависеть уже будет.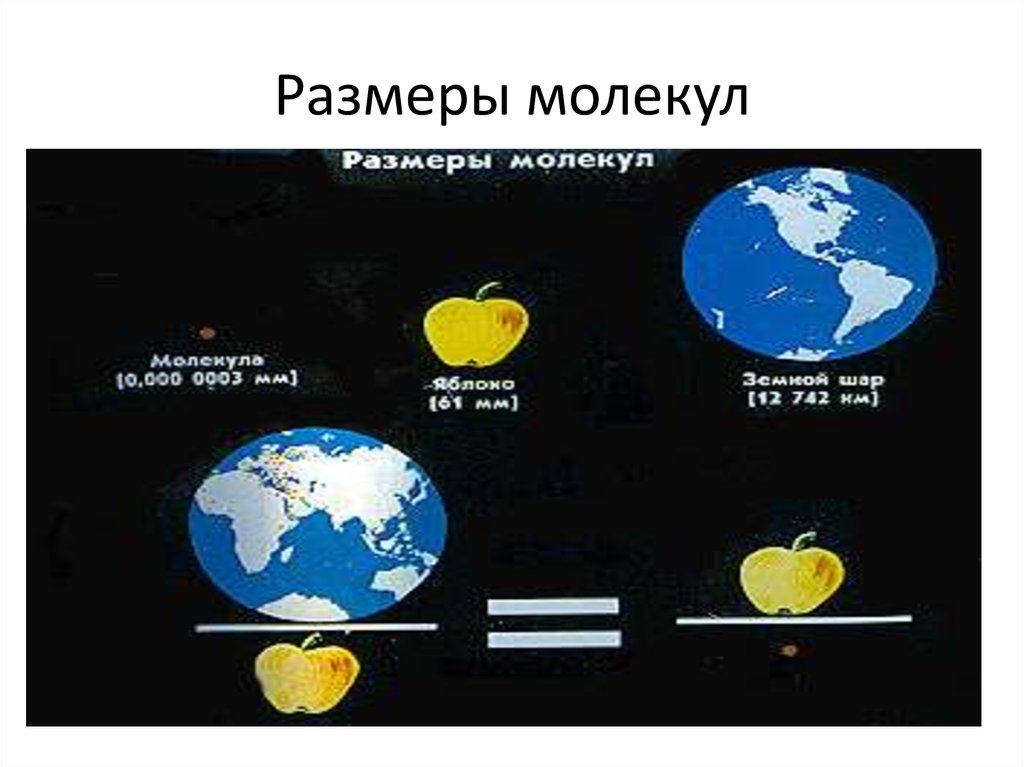
Представим себе, например, атом водорода: тяжёлый протон, а вокруг него летает электрон. Поскольку протон положительный, а электрон отрицательный, то один притягивает другой по закону Кулона, который выглядит точно так же как ньютоновская гравитация, поэтому в этом смысле атом вполне себе напоминает, например, Солнце и Землю, летающую вокруг него. Только, как говорит нам (далеко не полностью удачная, см. например, тут) атомная модель Бора, в отличие от системы «звезда + планета», электрон летает вокруг ядра только по орбитам определённого радиуса.
Так или иначе, чем больше энергии мы закачиваем в атом водорода, тем более широкая орбита будет доступна электрону для полёта вокруг ядра. Естественно, если мы возьмём один конкретный атом, мы можем узнать его орбиту, и она ничего нам о температуре всех атомов не скажет. Но вот если мы измерим радиусы у множества атомов, а потом усредним полученные величины, то у нас действительно возникнет зависимость от температуры для этого среднего числа.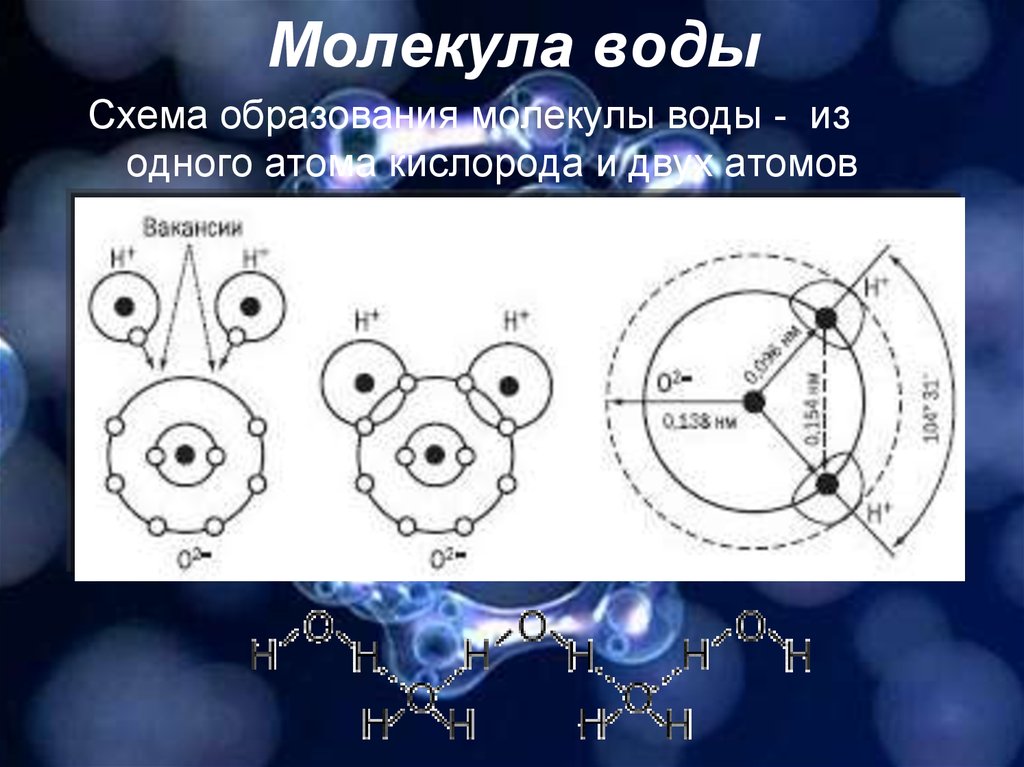 В результате получится что-то типа такой картинки:
В результате получится что-то типа такой картинки:
Из неё видно, что чтобы начать замечать хоть какие-то изменения в размере электронной оболочки, нужно ооочень сильно нагреть атом (в данном случае до более 10000 градусов). Это в целом общий тренд.
Как была посчитана эта зависимость
Подробнее о формулах можно узнать в этом посте.
Если кратко, то радиус орбиты (R) в зависимости от главного квантового числа n=1,2,3… — это
где R0=5.3×10−11 метра − это боровский радиус. Энергия (E) же орбиты имеет вид
где Eh= 4.3597447222071(85)×10−18 Джоулей − это энергия Хартри.
Далее используя распределение Больцмана для одной частицы, мы можем посчитать среднее значение радиуса от температуры как
Знаменатель у нас появляется из-за того, что полная вероятность всех исходов измерений должна быть равна единице.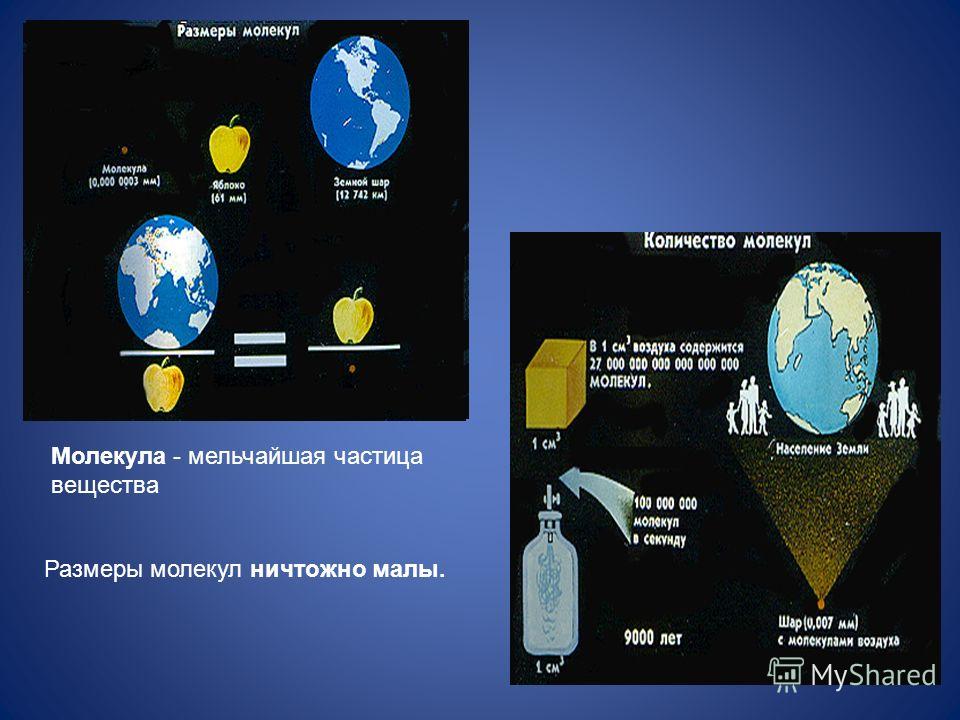
Иными словами,
ответ на вопрос поста: да, при нагревании электронные оболочки атомов (и молекул) в среднем расширяются. Но, это увеличение очень маленькое, и требует нагрева до очень высоких температур, к которым мы в обыденной жизни не привыкли.
Растут ли молекулы от температуры?
Теперь зададимся вопросом: а что если наша молекула составлена не из одного, а из двух, трёх или более атомов? Можем ли мы что-то сказать о межатомных расстояниях в ней, как ведут они себя при повышении температуры? Для простоты, естественно, ограничимся двухатомными молекулами, кои, в частности, составляют как минимум 98.7 % нашей атмосферы (азот и кислород).
У нас есть один атом, у нас есть второй атом: ммммм, и расстояние между ними, обозначим его как R. Как ведёт себя потенциальная энергия взаимодействия этих атомов в зависимости от R?
- Если мы разведём атомы оооочень далеко друг от друга, то химическая связь между ними давно будет разорвана.
 Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота.
Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота. - Если же, наоборот, мы будем пытаться впихнуть один атом в другой (R → 0), то в какой-то момент мы выгоним из пространства между этими атомами все электроны, ибо те не идиоты, чтобы тусоваться в токсичной высокоэнергетической атмосфере, и у нас останутся два голых положительно заряженных ядра, отталкивающиеся друг от друга через Кулоновскую силу. Т.е. при R → 0 у нас будет вертикальная асимптота, стремящая потенциальную энергию взаимодействия атомов в высокоэнергетическую бесконечность.
- Ну и, логично, что не будь какого-то минимума на этой потенциальной кривой между R=0 и R → ∞, то самих молекул о которых мы говорим, не существовало бы.
В итоге мы понимаем, что кривая потенциальной энергии взаимодействия имеет следующий вид:
Атомы в молекуле всегда колеблются, даже при абсолютном нуле, когда никакой лишней энергии не осталось.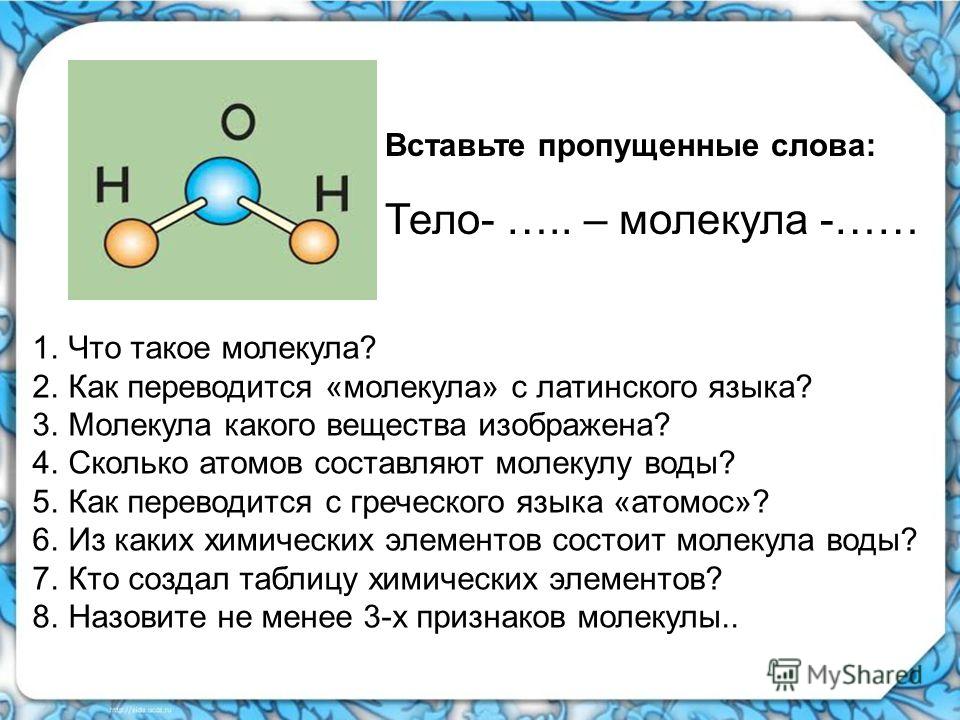 Из-за принципа неопределённости они не могут просто скатиться в минимальную по энергии точку на потенциале и
Из-за принципа неопределённости они не могут просто скатиться в минимальную по энергии точку на потенциале и сдохнуть лежать, свернувшись калачиком: им приходится совершать т.н. нулевые колебания. Если же энергия у них выше, то и колеблются они с большей амплитудой. Поэтому возникает вопрос: а как конкретно колеблются атомы?
Если бы слева и справа от точки минимума потенциал был одинаков, как, например, в случае закона Гука, то атомы во время колебаний отклонялись бы в область малых значений межатомных расстояний ровно то же количество времени, сколько и в область больших значений. В этом случае бы среднее значение межатомного расстояния при любой температуре было бы равно значению расстояния в точке минимума. Иными словами, если бы мы взяли газ, и в любой момент времени сфоткали все молекулы, а потом посчитали бы среднее значение для всех расстояний между атомами, то в итоге получили бы расстояние в точке минимума.
Но реальность у нас другая: слева от точки минимума (при R → 0) у молекулы стоит жёсткая стенка, а справа (при R → ∞) — мягкий диван. Вопрос: где будет больше времени проводить молекула: долбиться о стенку, или валяться на диване? Правильно: конечно на диване. Иными словами, распределение расстояний в молекуле, что при абсолютном нуле, что при какой-то температуре, будет несимметричным, поэтому среднее значение расстояний будет сдвинуто в сторону больших расстояний относительно минимального. Мало того, при повышении температуры, т.е. когда мы будем закачивать больше кинетической энергии в систему, увеличивая амплитуду колебаний, молекула будет видеть гораздо более жёсткую стенку, и гораздо более мягкий диван. Поэтому среднее значение межатомных расстояний будет расти с ростом температуры, а значит и средний размер молекул, причём всех, не только двухатомных, будет увеличиваться.
Вопрос: где будет больше времени проводить молекула: долбиться о стенку, или валяться на диване? Правильно: конечно на диване. Иными словами, распределение расстояний в молекуле, что при абсолютном нуле, что при какой-то температуре, будет несимметричным, поэтому среднее значение расстояний будет сдвинуто в сторону больших расстояний относительно минимального. Мало того, при повышении температуры, т.е. когда мы будем закачивать больше кинетической энергии в систему, увеличивая амплитуду колебаний, молекула будет видеть гораздо более жёсткую стенку, и гораздо более мягкий диван. Поэтому среднее значение межатомных расстояний будет расти с ростом температуры, а значит и средний размер молекул, причём всех, не только двухатомных, будет увеличиваться.
К сожалению, чтобы посчитать этот рост среднего расстояния, потребуется много больше усилий, чем в случае атома водорода. Но можно пойти другим путём, и поискать, а не исследовался ли этот вопрос в экспериментах?
И порывшись на просторах этих наших Интернетов, можно набрести на следующую работу: J.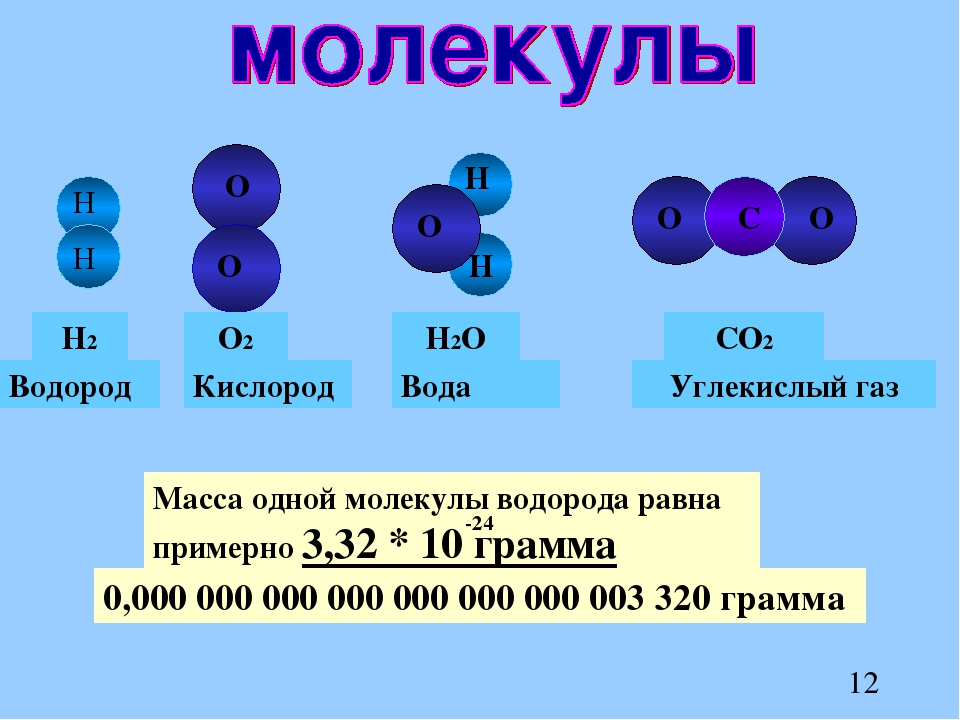 Chem. Phys. 79, 170 (1983). В ней делали эксперимент буквально описанный выше:
Chem. Phys. 79, 170 (1983). В ней делали эксперимент буквально описанный выше:
- брали кучу молекул углекислого газа (CO2) и нагревали их до разных температур, в диапазоне температур от комнатной (300 K ≈ 25oC) до «ай как горячо» (1000 К ≈ 730oC ),
- при каждой выбранной температуре делали «фотку» всех молекул при помощи электронов (этот метод зовётся газовой электронографией, о нём можно немного почитать здесь),
- ну а дальше буквально измеряли средние значения для межатомных расстояний на каждой фотке.
В результате они, в частности, получили следующую зависимость средней длины двойной связи C=O в молекуле углекислого газа (O=C=O):
Из графика видно, что при нагреве от комнатной температуры до 1000 градусов К это среднее значение выросло почти на 0.004 Å (1 ангстрем, Å, = 10—10 метров). Конечно, в наших привычных величинах это очень мало, но сама длина связи C=O в этой молекуле составляет 1. 2 Å, так что это рост на почти 0.3 %! Вполне себе заметная величина при нагреве, достижимом привычными средствами (например, газовой плитой).
2 Å, так что это рост на почти 0.3 %! Вполне себе заметная величина при нагреве, достижимом привычными средствами (например, газовой плитой).
Зачем это вообще знать?
Да хотя бы просто ради любопытства. Разве не прикольно поспорить с коллегой на чашку кофе, что при нагреве контейнера с едой в микроволновке помимо объёма газа увеличится и размер частиц газа? Ну и в практическом смысле это тоже важно. Все эти температурные расширения/уменьшения всяких макроскопических объектов, таких как рельсы, провода линий электропередач, да даже крышки банки под горячей водой, работают ровно по тому же механизму, что и для молекул газа: средние межатомные расстояния увеличиваются, т.к. в систему при увеличении температуры закачивается больше энергии движения частиц. И по-моему, осознание того, что за такими обыденными явлениями стоят такие нетривиальные процессы, вдохновляет на новые подвиги и свершения.
Всех благ, и да пребудет с Вами межатомная сила.
Кластеры молекул воды, измеренные на границе вода/воздух с помощью атомно-силовой микроскопии
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл.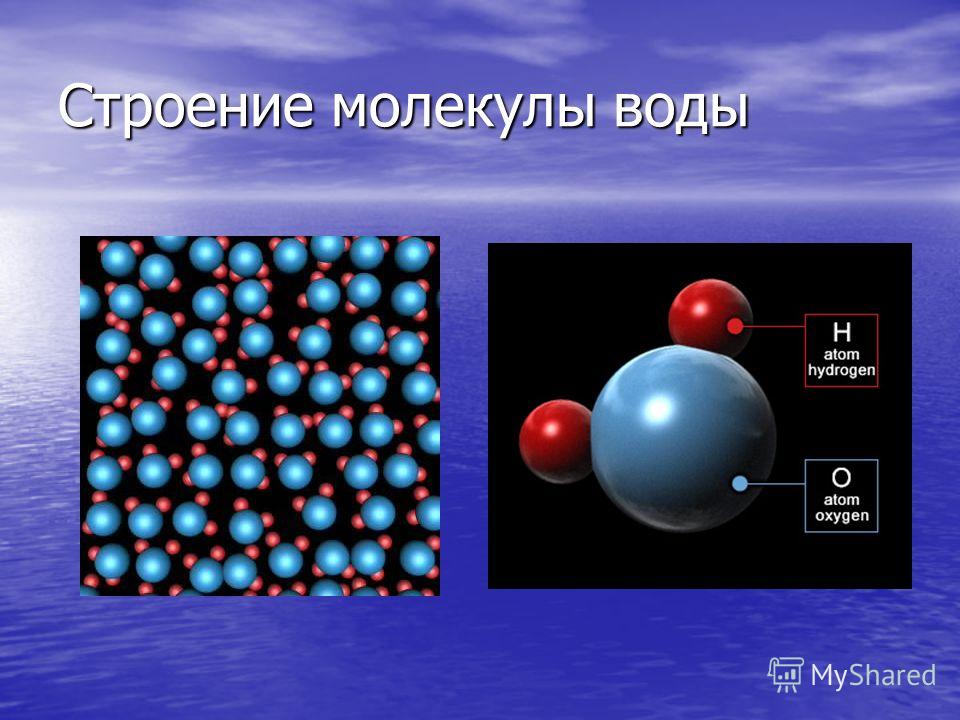 адрес:
(изменить)
адрес:
(изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: SummarySummary (text)AbstractAbstract (text)PubMed
Отправить максимум: 1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
. 2005 21 ноября; 7 (22): 3856-65.
дои: 10.1039/b511257e. Epub 2005, 20 сентября.
Epub 2005, 20 сентября.
О Тешке 1 , E F de Souza
принадлежность
- 1 Laboratorio de NanoEstruturas e Interfaces, Instituto de Física, Universidade Estadual de Campinas, 13083-970, Campinas, SP, Бразилия.
- PMID: 16358037
- DOI: 10.1039/b511257е
О Тешке и соавт. Phys Chem Chem Phys. .
. 2005 21 ноября; 7 (22): 3856-65.
дои: 10. 1039/b511257e.
Epub 2005, 20 сентября.
1039/b511257e.
Epub 2005, 20 сентября.
Авторы
О Тешке 1 , Э.Ф. де Соуза
принадлежность
- 1 Laboratorio de NanoEstruturas e Interfaces, Instituto de Física, Universidade Estadual de Campinas, 13083-970, Campinas, SP, Бразилия.
- PMID: 16358037
- DOI: 10.1039/b511257е
Абстрактный
Во время приближения наконечника к гидрофобным поверхностям, таким как граница раздела вода/воздух, измеренная сила взаимодействия показывает сильное притяжение с диапазоном примерно 250 нм в некоторых точках вдоль границы раздела.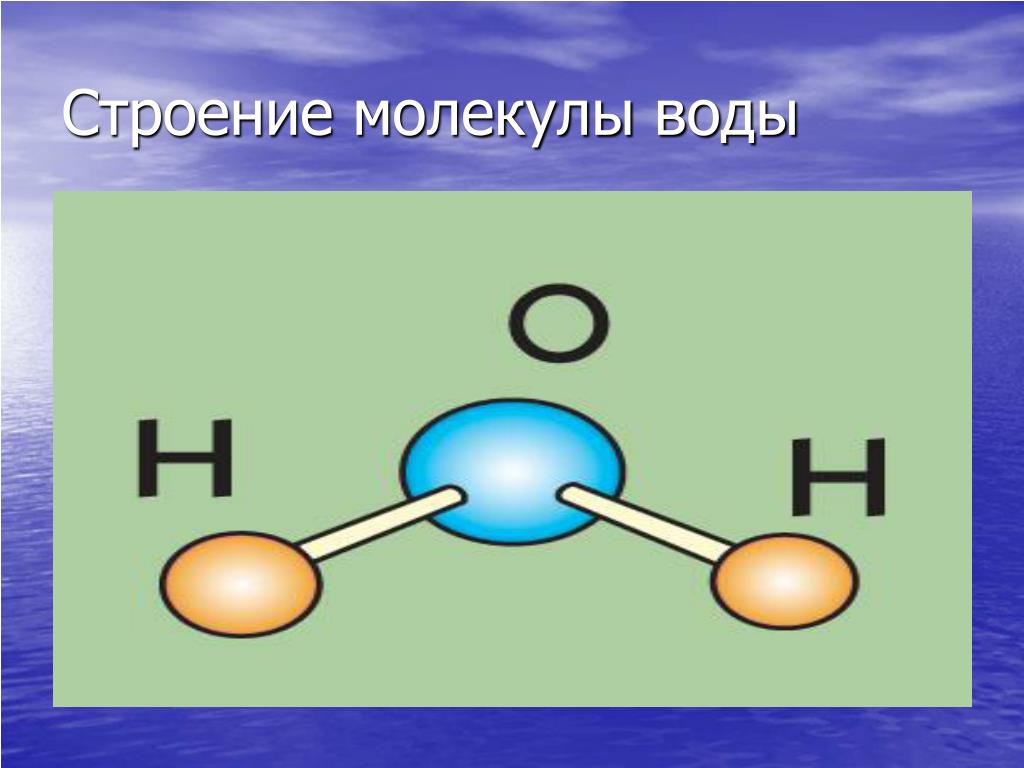 Диапазон этой силы примерно в 100 раз больше, чем измеренный для золота (примерно 3 нм), и в 10 раз больше, чем для гидрофобных поверхностей кремния (примерно 25 нм). В других точках интерфейс оказывает отталкивающую силу среднего диапазона, возрастающую ступенчато по мере приближения наконечника к плоскости интерфейса, следовательно, гидрофобная сила сильно зависит от положения. Для объяснения этих результатов мы предлагаем модель, в которой сила на острие связана с обменом небольшого объема интерфейса с диэлектрической проницаемостью epsilon(int) на острие с диэлектрической проницаемостью epsilon(tip). Предполагая колебательную пространственную зависимость диэлектрической проницаемости, можно подогнать измеренные профили силы. Это диэлектрическое пространственное изменение было связано с ориентацией расположения молекул воды в межфазной области. Небольшие наноразмерные клетки молекул воды, соединенные водородными связями, присутствующие в объемной воде на границе раздела, ориентируются межфазным электрическим полем, создаваемым разорванными связями молекул воды, одной разорванной водородной связью из каждых четырех.
Диапазон этой силы примерно в 100 раз больше, чем измеренный для золота (примерно 3 нм), и в 10 раз больше, чем для гидрофобных поверхностей кремния (примерно 25 нм). В других точках интерфейс оказывает отталкивающую силу среднего диапазона, возрастающую ступенчато по мере приближения наконечника к плоскости интерфейса, следовательно, гидрофобная сила сильно зависит от положения. Для объяснения этих результатов мы предлагаем модель, в которой сила на острие связана с обменом небольшого объема интерфейса с диэлектрической проницаемостью epsilon(int) на острие с диэлектрической проницаемостью epsilon(tip). Предполагая колебательную пространственную зависимость диэлектрической проницаемости, можно подогнать измеренные профили силы. Это диэлектрическое пространственное изменение было связано с ориентацией расположения молекул воды в межфазной области. Небольшие наноразмерные клетки молекул воды, соединенные водородными связями, присутствующие в объемной воде на границе раздела, ориентируются межфазным электрическим полем, создаваемым разорванными связями молекул воды, одной разорванной водородной связью из каждых четырех. Это межфазное поле ориентирует небольшие кластеры, образованные примерно 100 молекулами воды, в более крупные кластеры (приблизительно 100 нм). В пределе малых (толщиной менее 5 нм) клеток молекул воды мы смоделировали статическую диэлектрическую проницаемость (эпсилон) как средний отклик этих клеток. В этих областях диэлектрическая проницаемость границ раздела вода/воздух монотонно уменьшается от объемного значения эпсилон приблизительно 80 до приблизительно 2 на границе раздела. Для областей, заполненных клетками среднего размера, наконечник определяет структуру каждой клетки, а статическая диэлектрическая проницаемость согласуется с геометрическими характеристиками этих клеток размером приблизительно от 25 до 40 нм. Значения межфазной плотности электрической энергии рассчитывались с использованием напряженности электрического поля и диэлектрической проницаемости, полученных путем подгонки экспериментальных точек. Интегрирование плотности электрической энергии вдоль межфазной области дает значение 0,072 Дж м (-2) для межфазной плотности энергии для точек, где гидрофобная сила имеет диапазон приблизительно 250 нм.
Это межфазное поле ориентирует небольшие кластеры, образованные примерно 100 молекулами воды, в более крупные кластеры (приблизительно 100 нм). В пределе малых (толщиной менее 5 нм) клеток молекул воды мы смоделировали статическую диэлектрическую проницаемость (эпсилон) как средний отклик этих клеток. В этих областях диэлектрическая проницаемость границ раздела вода/воздух монотонно уменьшается от объемного значения эпсилон приблизительно 80 до приблизительно 2 на границе раздела. Для областей, заполненных клетками среднего размера, наконечник определяет структуру каждой клетки, а статическая диэлектрическая проницаемость согласуется с геометрическими характеристиками этих клеток размером приблизительно от 25 до 40 нм. Значения межфазной плотности электрической энергии рассчитывались с использованием напряженности электрического поля и диэлектрической проницаемости, полученных путем подгонки экспериментальных точек. Интегрирование плотности электрической энергии вдоль межфазной области дает значение 0,072 Дж м (-2) для межфазной плотности энергии для точек, где гидрофобная сила имеет диапазон приблизительно 250 нм. Области, образованные различными кластерами, приводят к более низким значениям межфазной плотности энергии.
Области, образованные различными кластерами, приводят к более низким значениям межфазной плотности энергии.
Похожие статьи
Пересмотр границы раздела гексан-вода с помощью моделирования молекулярной динамики с использованием неаддитивных потенциалов алкан-вода.
Patel SA, Brooks CL. Патель С.А. и др. J Chem Phys. 2006 г., 28 мая; 124(20):204706. дои: 10.1063/1.2198538. J Chem Phys. 2006. PMID: 16774363
Измерения профиля диэлектрической проницаемости межфазной поверхности воды с использованием атомно-силовой микроскопии.
Тешке О., Чеотто Г., де Соуза Э.Ф. Тешке О. и соавт. Phys Rev E Stat Nonlin Soft Matter Phys. 2001 г., июль; 64 (1 часть 1): 011605. doi: 10.1103/PhysRevE.64.011605.
 Epub 2001 27 июня.
Phys Rev E Stat Nonlin Soft Matter Phys. 2001.
PMID: 11461268
Epub 2001 27 июня.
Phys Rev E Stat Nonlin Soft Matter Phys. 2001.
PMID: 11461268Феномен обезвоживания: межфазная структура воды на хорошо организованной границе раздела золото-вода, модифицированная алкантиолом.
Субраманиан С., Сампат С. Субраманиан С. и др. J Коллоидный интерфейс Sci. 2007 Сентябрь 1; 313 (1): 64-71. doi: 10.1016/j.jcis.2007.04.019. Epub 2007 25 мая. J Коллоидный интерфейс Sci. 2007. PMID: 17531999
Дальнодействующие и короткодействующие механизмы гидрофобного притяжения и гидрофильного отталкивания в специфических и неспецифических взаимодействиях.
Ван Осс CJ. ван Осс CJ. Дж Мол Признать. 2003 г., июль-август; 16(4):177-90. doi: 10.1002/jmr.618. Дж Мол Признать. 2003.
 PMID: 12898668
Обзор.
PMID: 12898668
Обзор.Последние экспериментальные достижения в области гидрофобных взаимодействий на границах раздела твердое тело/вода и жидкость/вода.
Цзэн Х., Ши С., Хуан Дж., Ли Л., Лю Г., Чжун Х. Цзэн Х и др. Биоинтерфазы. 2015 15 марта; 11 (1): 018903. дои: 10.1116/1.4937465. Биоинтерфазы. 2015. PMID: 26671479 Обзор.
Посмотреть все похожие статьи
Цитируется
Переменные межфазные наноразмерные структуры воды, измеренные с помощью атомно-силовой микроскопии.
Тешке О., Кастро М.Р., Гомеш В.Е., Соарес Д.М. Тешке О. и соавт. АСУ Омега. 2022 9 августа; 7 (33): 28875-28884. doi: 10.1021/acsomega.2c01982. Электронная коллекция 2022 23 августа.
 АСУ Омега. 2022.
PMID: 36033701
Бесплатная статья ЧВК.
АСУ Омега. 2022.
PMID: 36033701
Бесплатная статья ЧВК.Переходы «виток-мост» самоорганизующихся цепей воды, наблюдаемые в наноскопическом мениске.
Ким Б.И., Бём Р.Д., Агруса Х. Ким Б.И. и др. Ленгмюр. 2022 19 апреля; 38 (15): 4538-4546. doi: 10.1021/acs.langmuir.1c03100. Epub 2022 8 апр. Ленгмюр. 2022. PMID: 35394791 Бесплатная статья ЧВК.
Электростатическая сольватация и подвижность в однородных и неоднородных электрических полях: от простых ионов к белкам.
Матюшов Д.В. Матюшов ДВ. Биомикрофлюидика. 2019 7 ноября; 13 (6): 064106. дои: 10.1063/1.5124390. Электронная коллекция 2019 ноябрь. Биомикрофлюидика. 2019. PMID: 31737155 Бесплатная статья ЧВК.
Визуализация ионных пар, образующих структурные устройства в межфазных областях.

Тешке О., Роберто де Кастро Х., Соарес Д.М. Тешке О. и соавт. АСУ Омега. 2019 10 сентября; 4(13):15684-15693. doi: 10.1021/acsomega.9b02299. Электронная коллекция 2019 24 сентября. АСУ Омега. 2019. PMID: 31572871 Бесплатная статья ЧВК.
Атомно-силовая микроскопия как передовой инструмент нейробиологии.
Джембрек М.Ю., Шимич Г., Хоф П.Р., Шегота С. Джембрек М.Дж. и соавт. Перевод Neurosci. 2015 11 июня; 6(1):117-130. doi: 10.1515/tnsci-2015-0011. Электронная коллекция 2015. Перевод Neurosci. 2015. PMID: 28123795 Бесплатная статья ЧВК. Обзор.
Типы публикаций
термины MeSH
вещества
Полнотекстовые ссылки
Королевское химическое общество
Укажите
Формат: ААД АПА МДА НЛМ
Отправить по номеру
Большое и маленькое › Основы Берни (ABC Science)
- Поделиться
- Печать
Основы Берни
Уложить в голове умопомрачительно большие и невообразимо маленькие вещи действительно сложно — наш мозг просто не создан для этого.
Берни Хоббс
Чтобы выжить в качестве человека, все, что требовалось в ходе эволюции от наших предков, — это способность убегать или перехитрить все, что могло их убить, прежде чем они сделают ребенка. Способность мысленно представить себе всех мамонтов на планете не входила в список основных навыков.
Благодаря деньгам или тому, что мы можем на них купить, большинство из нас может представить относительную величину в тысячу, сто тысяч и миллион. Но как только мы превысим несколько миллионов, все станет труднее представить. То же самое касается мелочей — мы знаем, что вирусы и бактерии малы, а атомы еще меньше, но понять, насколько они малы, так же трудно, как и банковский счет Руперта Мердока.
Но легко понять, насколько что-то огромно или крошечно: вы просто сравните его размер с размером вещей, с которыми мы знакомы, например мы. 9наверх
Мелочи
Наши тела состоят из клеток, и по сравнению с нами они крошечные. Средняя человеческая клетка имеет размер около 10-15 микрометров (мкм), что означает, что мы примерно в 100 000 раз больше, чем наши клетки. Если бы ваши клетки были размером с пятицентовую монету, вы были бы двухкилометрового роста.
Если бы ваши клетки были размером с пятицентовую монету, вы были бы двухкилометрового роста.
Не все клетки такие крошечные. Яйцеклетки человека имеют размер около 130 мкм, что шире человеческого волоса (100 мкм) и в 30 раз шире головки даже самого амбициозного сперматозоида. Но они ничто по сравнению с гигантами сотового мира. Нервные клетки седалищного нерва имеют длину около метра и проходят от позвоночника до стопы.
Бактерии тоже являются клетками, но их размер составляет всего одну десятую от наших клеток. И вирусы снова меньше — они примерно в одну сотую меньше наших клеток.
Итак, мы примерно в 100 000 раз больше, чем наши клетки, в миллион раз больше, чем бактерии, и в 10 миллионов раз больше, чем обычный вирус!
Если бы вирус был размером с пятицентовую монету, бактерия была бы размером с обеденную тарелку, а ваш рост был бы 200 километров!
Вирусы крошечные по сравнению со всеми другими живыми существами, но они гиганты по сравнению с атомами и молекулами. 9наверх
9наверх
Очень мелочь
Грипп — довольно типичный вирус. Это просто кусок РНК, завернутый в кусочек белка, размером около 120 нанометров (нм) в поперечнике, что делает его примерно в тысячу раз больше атома.
Атомы являются основными единицами материи. Они как кирпичики Lego, из которых сделаны все вещи, от звезд до стали и от кислорода до быков. Они крошечные. Но еще мельче атомов протоны, нейтроны и электроны, из которых они состоят. Атом водорода в 100 000 раз больше, чем протон, который находится в его середине! Это такая же разница в размерах, как между вами и одной из ваших клеток. Так что протоны крошечные, электроны и нейтроны тоже. 9наверх
Большие вещи
Когда мы думаем о больших вещах во Вселенной, мы думаем о планетах, звездах и галактиках. И хотя с того места, где мы сидим, Земля кажется большой, с точки зрения Солнечной системы она довольно крохотная: внутри Солнца может поместиться более миллиона земель.
Но и солнце не галактический гигант. Это ничто по сравнению с действительно большими звездами. Самая большая из известных звезд, VY Большого Пса, представляет собой гипергигант, примерно в 2000 раз превышающий размер Солнца. Таким образом, если бы Солнце было размером с мячик для пинг-понга, VY Большого Пса был бы почти таким же большим, как футбольное поле.
Это ничто по сравнению с действительно большими звездами. Самая большая из известных звезд, VY Большого Пса, представляет собой гипергигант, примерно в 2000 раз превышающий размер Солнца. Таким образом, если бы Солнце было размером с мячик для пинг-понга, VY Большого Пса был бы почти таким же большим, как футбольное поле.
Но велик не только размер звезд, но и их количество. Никто еще не подсчитал, но по лучшим оценкам количество звезд в Млечном Пути составляет около двухсот миллиардов. Только в нашей галактике 200 000 000 000 звезд!
И еще много галактик. На самом деле, похоже, что галактик тоже около двухсот миллиардов. Таким образом, на каждую звезду Млечного Пути приходится по крайней мере одна галактика — это время для мозговой боли!
Если вы умножите количество галактик на среднее количество звезд в них, вы получите количество звезд во Вселенной, что-то вроде миллиона миллиардов миллиардов звезд. Забудьте о богатстве Руперта — это очень большая сумма! Оно выглядит еще больше, если написать его полностью:
Во Вселенной 1 000 000 000 000 000 000 000 000 звезд.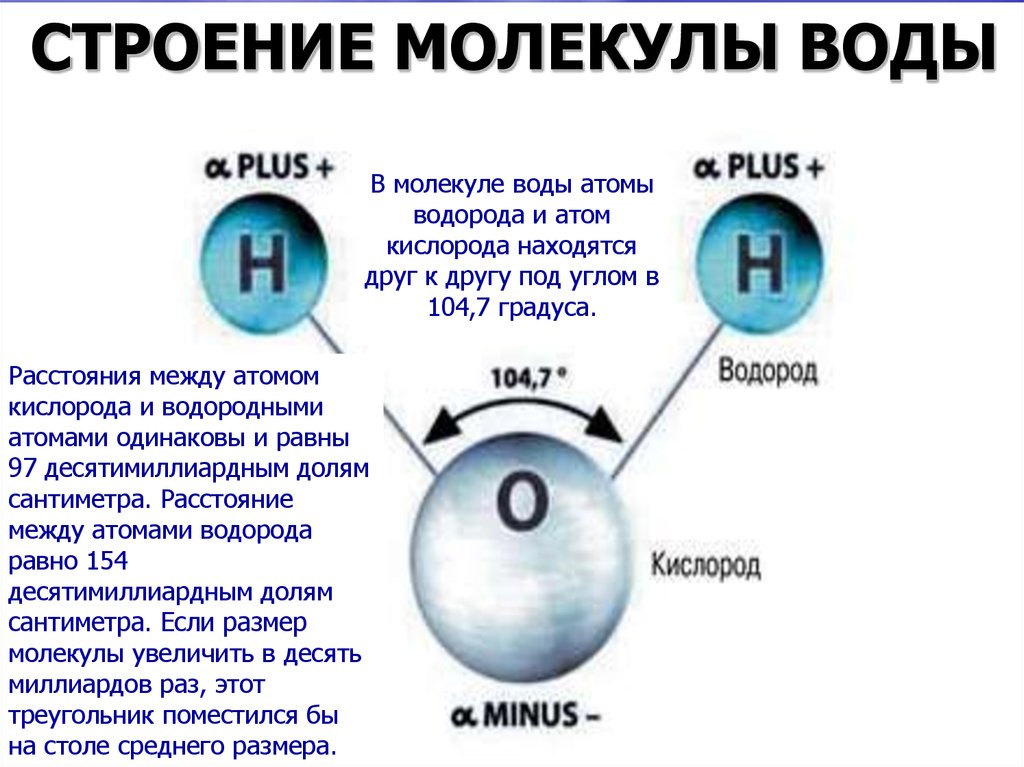
Трудно представить себе такое большое число, но вы будете удивлены, узнав, как часто вы сталкиваетесь с предметами такого размера. Каждый раз, когда вы выпиваете стакан воды, вы проглатываете 10 миллионов миллиардов миллиардов молекул воды. Итак, в стакане воды молекул в десять раз больше, чем звезд во всей Вселенной. 9наверх
Опубликовано 30 марта 2010 г.
Не будь солёным. Крошечные трубки опресняют воду по одной молекуле за раз
Новости @ Северо-восточная домашняя страница
Не будь солёным. Крошечные трубки опресняют воду по одной молекуле за раз
0%
Вверх Далее
Мени Вануну, адъюнкт-профессор физики, и его аспирант Роберт Хенли используют углеродные нанотрубки в качестве фильтра для опреснения воды. Их новая статья показывает, что этот метод работает лучше, чем любой другой существующий процесс. Фото Адама Гланцмана/Northeast University Земля на 70 процентов состоит из воды, но только крошечная часть — 0,007 процента — доступна для питья.
Поскольку источники питьевой воды истощаются, население планеты увеличивается с каждым годом. Одним из возможных решений для утоления жажды планеты является опреснение — процесс удаления соли из морской воды. Несмотря на соблазнительность, этот подход всегда был слишком дорогим и энергоемким для крупномасштабной реализации.
Теперь исследователи из Северо-Востока сделали открытие, которое может изменить ситуацию, сделав опреснение проще, быстрее и дешевле, чем когда-либо прежде. В газете, опубликованной в четверг в Science группа описывает, как углеродные нанотрубки определенного размера действуют как идеальный фильтр для соли — самого маленького и наиболее распространенного загрязнителя воды.
Фильтровать воду сложно, потому что молекулы воды стремятся склеиться. «H» в H 2 O — это водород, а водородные связи прочны, и для их разделения требуется много энергии. Вода имеет тенденцию набухать и сопротивляться фильтрации. Но нанотрубки делают это быстро и легко.
Углеродная нанотрубка похожа на невероятно маленький свернутый лист бумаги диаметром около нанометра. Для сравнения, диаметр человеческого волоса составляет от 50 до 70 микрометров — в 50 000 раз больше. Крошечный размер трубки, ровно 0,8 нм, позволяет проходить только одной молекуле воды за раз. Эта линейка в один ряд разрушает водородные связи, поэтому вода может проталкиваться по трубкам в ускоренном темпе без набухания.
«Вы можете себе представить, что если вы группа людей, пытающихся пробежать по коридору, держась за руки, это будет намного медленнее, чем бежать по коридору гуськом», — сказал соавтор Мени Вануну, доцент физики на Северо-Востоке. Вануну и докторант Роберт Хенли сотрудничали с учеными из Ливерморской национальной лаборатории Лоуренса в Калифорнии для проведения исследования.
Ученые во главе с Александром Ноем из Лоуренса Ливермора в прошлом году обнаружили, что углеродные нанотрубки являются идеальным каналом для транспорта протонов. Для этого нового исследования Хенли привнес опыт и технологии из лаборатории наноразмерной биофизики Вануну в лабораторию Ноя, и вместе они продвинулись в исследовании еще на один шаг вперед.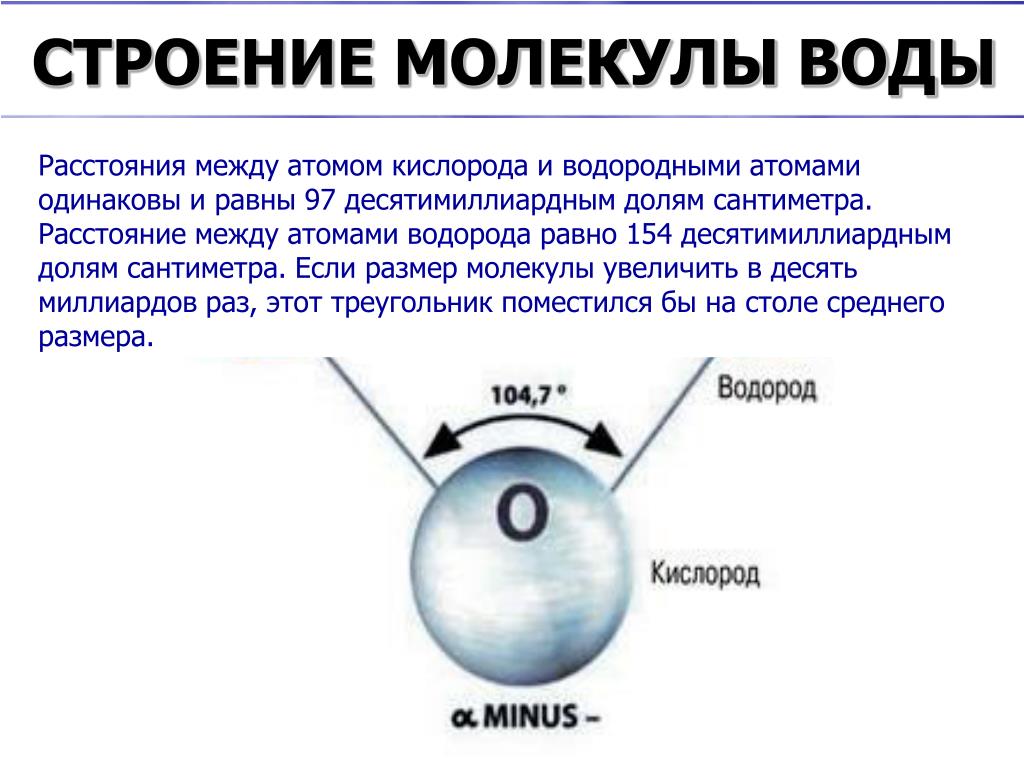
Углеродные нанотрубки не только идеально подходят для прохождения одиночных молекул воды, но и обладают отрицательным электрическим зарядом. Это заставляет их отвергать все с одинаковым зарядом, например, отрицательные ионы в соли, а также другие нежелательные частицы.
«В то время как соль с трудом проходит сквозь нее из-за заряда, вода представляет собой нейтральную молекулу и проходит легко», — сказал Вануну. Ученые из лаборатории Ноя предположили, что углеродные нанотрубки могут быть разработаны для обеспечения определенной селективности по ионам, но у них не было надежной системы измерения. К счастью, «это хлеб с маслом того, что мы делаем в лаборатории Мени», — сказал Хенли. «Это создало хорошие симбиотические отношения».
«Роберт привнес в мою лабораторию передовые возможности измерения и проектирования группы Вануну, и он был незаменим при разработке новой платформы, которую мы использовали для измерения ионной селективности нанотрубок», — сказал Ной.
Результатом стала новая система, которая может иметь большое значение для будущего водной безопасности.


 Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота.
Поэтому особой разницы от того, что расстояние мы увеличим от «очень много» до «очень много и ещё чуть-чуть», мы не заметим. Иными словами при R → ∞ у нас должна быть горизонтальная асимптота. Epub 2001 27 июня.
Phys Rev E Stat Nonlin Soft Matter Phys. 2001.
PMID: 11461268
Epub 2001 27 июня.
Phys Rev E Stat Nonlin Soft Matter Phys. 2001.
PMID: 11461268 PMID: 12898668
Обзор.
PMID: 12898668
Обзор.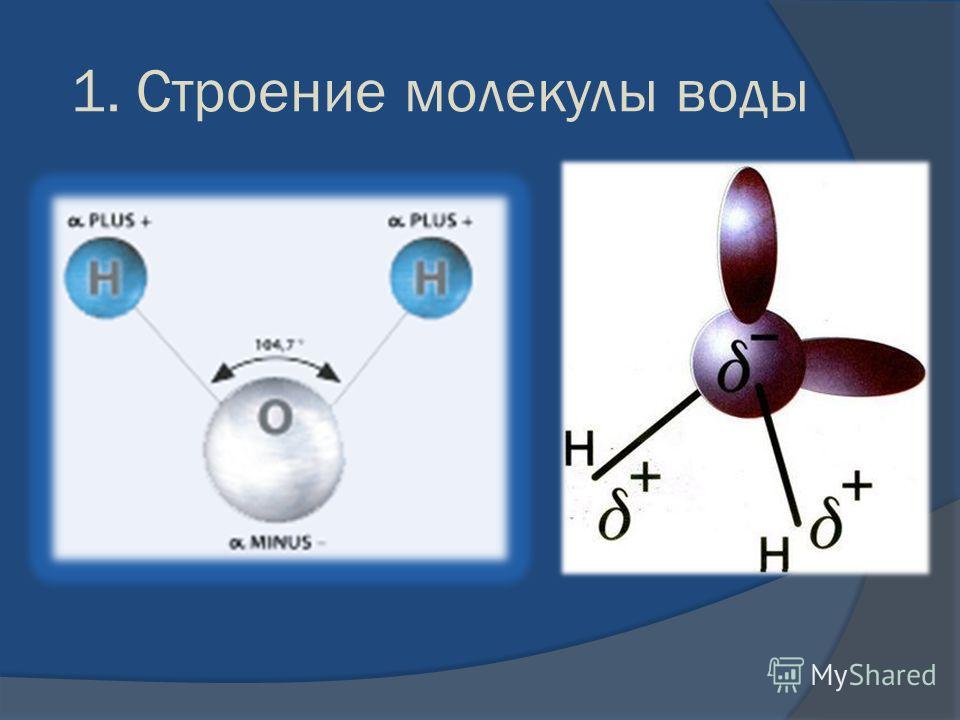 АСУ Омега. 2022.
PMID: 36033701
Бесплатная статья ЧВК.
АСУ Омега. 2022.
PMID: 36033701
Бесплатная статья ЧВК.