Ученые разработали дешевый катализатор для получения водорода из воды
https://ria.ru/20100429/228078627.html
Ученые разработали дешевый катализатор для получения водорода из воды
Ученые разработали дешевый катализатор для получения водорода из воды — РИА Новости, 29.04.2010
Ученые разработали дешевый катализатор для получения водорода из воды
Ученые предложили новый перспективный принцип создания дешевых и устойчивых катализаторов для получения водорода из воды — наиболее перспективного экологически чистого вида топлива, сообщается в статье журнала Nature.
2010-04-29T11:11
2010-04-29T11:11
2010-04-29T11:11
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/sharing/article/228078627.jpg?1877274261272525095
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
2010
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
МОСКВА, 29 апр — РИА Новости. Ученые предложили новый перспективный принцип создания дешевых и устойчивых катализаторов для получения водорода из воды — наиболее перспективного экологически чистого вида топлива, сообщается в статье исследователей, опубликованной в сегодняшнем выпуске журнала Nature.
Ученые предложили новый перспективный принцип создания дешевых и устойчивых катализаторов для получения водорода из воды — наиболее перспективного экологически чистого вида топлива, сообщается в статье исследователей, опубликованной в сегодняшнем выпуске журнала Nature.
Несмотря на то, что развитие технологий использования водорода в качестве экологически чистого топлива происходит уже несколько десятилетий, этот тип энергетики все еще остается за рамками массового использования по целому ряду причин. Одной из них является необходимость получения для энергетических целей высокочистого водорода, лишенного примесей, которые могут отравлять катализаторы и узлы энергетических установок различного типа, предназначенных для переработки водорода в тепловую или электрическую энергию.
Единственным способом получения водорода надлежащей чистоты, известным на настоящее время, является разложение воды под действием электрического тока. Этот подход имеет целый ряд недостатков, основным из которых являются неоправданно высокие энергетические затраты на производство топлива. Для снижения этих затрат (понижения электрического напряжения, при котором происходит разложение воды с выделением водорода) применяются катализаторы, наиболее известным из которых является редкая и дорогостоящая платина.
Для снижения этих затрат (понижения электрического напряжения, при котором происходит разложение воды с выделением водорода) применяются катализаторы, наиболее известным из которых является редкая и дорогостоящая платина.
Существуют более дешевые катализаторы на основе биологических молекул, содержащих в себе атомы металлов никеля и железа, преобразующих воду в водород внутри живых систем, но все подобные примеры имеют ряд недостатков — невысокую эффективность, низкую устойчивость и потребность в добавлении к разлагаемой ими воде дополнительных компонентов.
Автор новой работы, Джефри Лонг (Jeffrey Long) из калифорнийского университета в Беркли, сумел предложить кардинально новый принцип создания катализаторов для получения водорода из воды.
Его основу составляет атом металла молибдена — распространенного металла, широко использующегося в производстве легированных сталей. В катализаторе Лонга этот атом окружен пятью лигандами — присоединенными к нему фрагментами органических молекул на основе пиридина — циклической молекулы с одним атомом азота. Изначально подобные соединения заинтересовали Лонга своими магнитными свойствами, однако на определенном этапе синтетических работ группа ученого обнаружила, что одно из синтезированных соединений обладает способностью к транспорту электронов, что является ключевой характеристикой катализаторов для получения водорода.
Изначально подобные соединения заинтересовали Лонга своими магнитными свойствами, однако на определенном этапе синтетических работ группа ученого обнаружила, что одно из синтезированных соединений обладает способностью к транспорту электронов, что является ключевой характеристикой катализаторов для получения водорода.
Протестировав свое соединение на каталитическую активность, ученые обнаружили несколько приятных сюрпризов — их соединение обладает значительной эффективностью и скоростью работы как в чистой, так и в соленой морской воде, а также существенно более устойчиво к деградации по сравнению с катализаторами на основе биологических молекул. Эта стабильность обусловлена тем, что атом молибдена связан в молекуле с 5 лигандами, которые надежно его удерживают.
Недостатком этого катализатора является довольно высокое электрическое напряжение, необходимое для работы. Кроме того, скорость его работы все же уступает скорости работы природных аналогов, а потому разработка не может использоваться как коммерческий катализатор на настоящее время.
Тем не менее, данная работа демонстрирует совершенно новый и очень перспективный подход к синтезу катализаторов для получения водорода из воды.
Команда Лонга в настоящее время ищет новые сочетания металлов и лигандов, обладающие большей каталитической активностью, а также надеется в будущем совместить свою разработку с солнечными источниками энергии.
Электролитическое разложение воды — Вода и воздух — самое дешевое сырье
26 июля 2007
Для разложения воды электрическим током чаще всего используют аппарат Гофмана. Кто не располагает таким аппаратом, может сам легко построить подобное приспособление. Возьмем кусок очень широкой стеклянной трубки (например, химический стакан или широкогорлую склянку без дна. Как удалить дно, описано в главе 8, а острые края надо оплавить на пламени бунзеновской горелки). Отверстие трубки или горло склянки закроем очень плотно подогнанной резиновой пробкой. В пробке на не слишком близком расстоянии друг от друга просверлим два отверстия, в которые в качестве электродов вставим два угольных стержня. Такие стержни можно купить или взять из батарейки для электрического карманного фонаря. Перед применением очистим угольные стержни длительным кипячением в воде. К нижним концам угольных стержней присоединим токоподводы из изолированной медной проволоки. Лучше всего достать у электрика подходящие клеммы и к ним припаять зачищенные концы проводов. В крайнем случае обмотаем стержень проволокой. Изоляционный лак с проволоки необходимо тщательно счистить, а число витков должно быть достаточно большим. Провода подсоединить к батарейке для карманного фонарика или, лучше, к свинцовому аккумулятору. Если найдется переменное сопротивление в несколько ом, включим его в цепь. Тогда скорость электролиза будет хорошо регулироваться.
Такие стержни можно купить или взять из батарейки для электрического карманного фонаря. Перед применением очистим угольные стержни длительным кипячением в воде. К нижним концам угольных стержней присоединим токоподводы из изолированной медной проволоки. Лучше всего достать у электрика подходящие клеммы и к ним припаять зачищенные концы проводов. В крайнем случае обмотаем стержень проволокой. Изоляционный лак с проволоки необходимо тщательно счистить, а число витков должно быть достаточно большим. Провода подсоединить к батарейке для карманного фонарика или, лучше, к свинцовому аккумулятору. Если найдется переменное сопротивление в несколько ом, включим его в цепь. Тогда скорость электролиза будет хорошо регулироваться.
Наполним изготовленный электролизный сосуд примерно на две трети водой, в которую добавим немного разбавленной серной кислоты. Чистая вода проводит электрический ток очень плохо. Уже незначительное количество кислоты сильно повышает проводимость. Лучше всего, чтобы концентрация серной кислоты составляла 2—4 %.
Ячейка готова. Теперь замкнем электрическую цепь. На обоих электродах выделяется газ: на положительном полюсе (аноде) слабее, на отрицательном (катоде) — сильнее. Соберем газы для их изучения. Для этого поместим перевернутые наполненные водой пробирки над электродами — только, чтобы они не стояли на резиновой пробке, а то электрическая цепь прервется.
В обеих пробирках соберется газ. В идеальном случае нужно ожидать, что на аноде образуется ровно вдвое меньше газа, чем на катоде. Ведь на аноде выделяется кислород, а на катоде — водород. Так как формула воды Н2О, то на один атом кислорода приходится два атома водорода, и при разложении воды должно образовываться в два раза больше атомов водорода, чем кислорода. С другой стороны, мы знаем из школьного курса, что в равных объемах газов всегда содержится равное число молекул (закон Авогадро), а как молекула водорода, так и молекула кислорода содержат два атома элемента.
Несмотря на правильность этой теории, мы будем несколько разочарованы, когда сравним полученные объемы газов. Кислорода будет мало, так как часть его соединится с углеродом электрода. Для точных исследований необходимо применять электроды из благородного металла (лучше всего платины).
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
Электролиз воды — принцип электролиза воды, важные факторы, электролиты,
Электролиз воды — популярный метод, используемый для различных применений в различных отраслях промышленности, в основном в пищевой промышленности, металлургии, электростанциях и других. Кроме того, компоненты воды, в состав которых входят водород и кислород, имеют множество применений. Например, водород, полученный электролизом, является чистым, возобновляемым и эффективным источником топлива.
Электролиз воды в основном проводится для получения чистого водорода и газообразного кислорода. Он включает в себя пропускание электрического тока через воду, что приводит к разложению воды на водород и кислород.
Он включает в себя пропускание электрического тока через воду, что приводит к разложению воды на водород и кислород.
Содержание
- Факторы, влияющие на эффективность электролиза
- Клеточный потенциал и термодинамическая осуществимость
- Электролит для электролиза воды
- Электролиз воды в присутствии основания
- Электролиз воды в присутствии солей
- Электролиз воды с использованием электрокатализаторов
- Электролизеры
Однако электролиз воды не является простым и легким по многим причинам.
- Вода очень слабо диссоциирует на ионы водорода и гидроксида. Концентрация ионов в нейтральной воде одинакова (= моль на литр). В электролизе участвуют носители заряда, чтобы протекал ток. Итак, вода с очень малым количеством ионов — плохой проводник электричества. Итак, электролиз чистой воды будет очень медленным процессом.
- Ион водорода связан с другими молекулами воды и существует в виде иона гидроксония.

- При электролизе воды электроды представляют собой инертные твердые вещества, такие как платина/палладий, тогда как электролит представляет собой растворенное вещество в растворе, а продукт представляет собой газ.
Факторы, влияющие на эффективность электролиза
Эффективность электролиза или переноса электронов зависит от многих факторов, таких как;
i) Количество доступных катионов и анионов в растворе.
ii) Скорость подвижности ионов для достижения электрода.
iii) Энергия активации, необходимая для переноса электрона от электрода к ионам электролита.
iv) Влияние пузырька газа, окружающего электрод, на дальнейший электроперенос и т. д.
Пересечение нескольких границ раздела (растворенное вещество-жидкость, растворенное вещество-твердое вещество, твердое вещество-газ) приводит к увеличению потребности в энергии для электролиза (перенапряжению), чем предсказывает термодинамическая энергия Гиббса.
Читайте также: Свободная энергия Гиббса
Принцип электролиза воды
В воду помещают два электрода или пластины, изготовленные из инертного металла, такого как платина или иридий. К этим пластинам подключен источник постоянного тока. На катоде (где электроны попадают в воду) появится часть водорода. Со стороны анода появится кислород. Если мы рассмотрим идеальный фарадеевский КПД, то водорода будет производиться в два раза больше кислорода. С другой стороны, оба будут пропорциональны общему электрическому заряду, проводимому раствором. Однако в некоторых клетках могут происходить побочные реакции и образовываться различные продукты с далеко не идеальной фарадеевской эффективностью.
Электролиз воды – клеточный потенциал и термодинамическая осуществимость
Полуреакции при электролизе чистой воды при рН=7 и при 25°Се-
На катоде: 2H 2 O(ж) + 2e – → H 2 (g) + 2OH – E° = -0,42 В
На аноде: 2H 2 O → O 2 (ж) + 4H + + 4e – E° = +0,82 В
Суммарная реакция электролиза воды представлена как;
2ч 2 O(ж) → 2H 2 (ж) + O 2 (ж) E° = -1,24 В
Потенциал ячейки электролиза чистой воды отрицательный и, следовательно, термодинамически неблагоприятный. Из-за низкой концентрации ионов и границ раздела электронов необходимо дополнительное напряжение (перенапряжение) на каждом электроде примерно до 0,6 В.
На практике непрерывный электролиз чистой воды возможен только при внешнем напряжении 2,4В. Поскольку электролиз чистой воды термодинамически невозможен, изучаются способы сделать его кинетически возможным.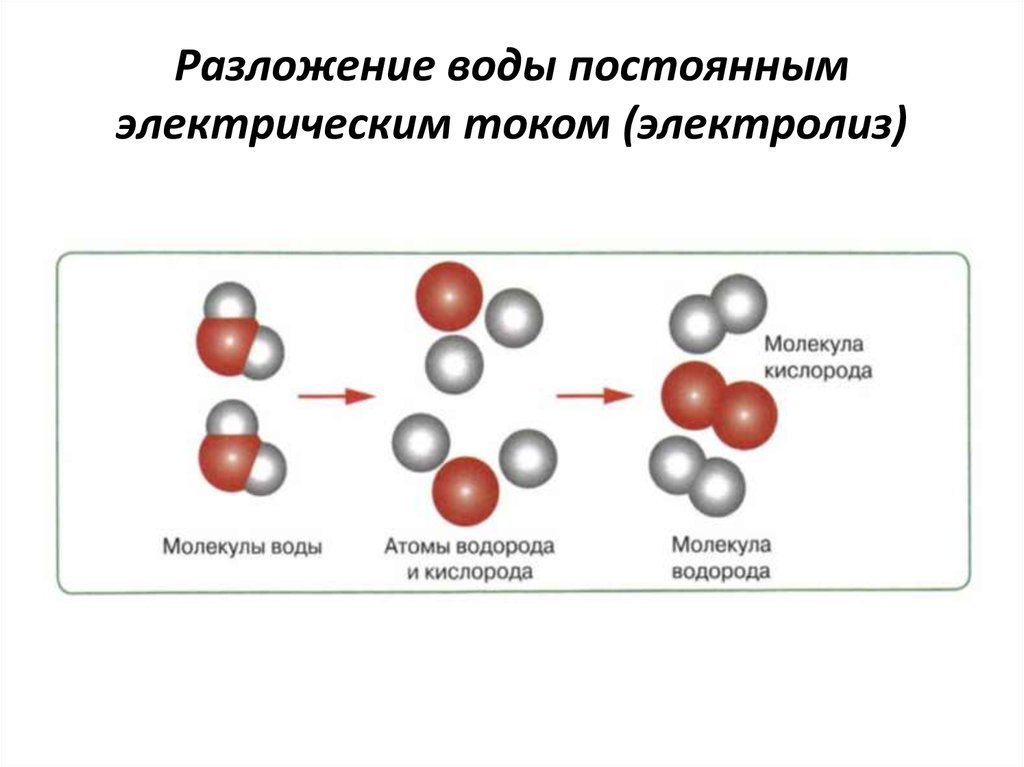
Один из методов заключается в увеличении проводимости за счет увеличения количества доступных ионов путем добавления кислоты, основания или нереагирующих солей.
Электролит для электролиза воды
Очень важно правильно подобрать электролит для электролиза воды. Почему это важно? Если мы посмотрим на анион из электролита, он обычно конкурирует с ионами гидроксида за высвобождение электрона. Если анион электролита имеет меньший стандартный электродный потенциал, чем гидроксид, он будет окисляться вместо гидроксида. Следовательно, кислород не будет производиться. В случае катиона, если он имеет больший стандартный электродный потенциал, чем ион водорода, он будет восстановлен. В этом случае газообразный водород не будет образовываться.
Электролиз воды в присутствии кислот (pH ниже 7)
Дополнительные ионы водорода из кислоты будут восстанавливаться на катоде, а вода окисляться на аноде. Полуреакции в кислой среде бывают;
На катоде: 2H + + e – → H 2 E° = +0,0 В
На аноде: 2H 2 O → O 2 (г) + 4H + + 4e – E° = +1,23 В
Чистая реакция записывается как 2H 2 O → O 2 (г) + 2H 2 E° = -1,23 В
Электролиз происходит при гораздо более низком потенциале, чем у чистой воды (2,4 В).
Электролиз воды в присутствии основания (pH выше 7)
Дополнительные ионы гидроксила отдают свои электроны аноду, в то время как электроны на катоде окисляют молекулы воды вблизи него. Полуреакции электролиза в присутствии основания –
На катоде: 2H 2 O(l) + 2e – → H 2 (г) + 2OH – E° = -0,83 В
На аноде: 4OH – → O 2 + 2H 2 O + 4e – E° = +0,4 В
Чистая реакция: 2H 2 O → O 2 (г) + 2H 2 E° = -1,23 В
Как и при электролизе в кислой среде, при электролизе в щелочной среде также требуется гораздо более низкий потенциал.
Диаграмма Пурбепоказывает области равновесия воды, водорода и кислорода при различных электродных потенциалах.
Электролиз воды в присутствии солей
Соли на 100% диссоциируют на катионы и анионы в воде и, следовательно, увеличивают концентрацию ионов для увеличения электропроводности. Но катионы и анионы из соли также будут притягиваться к электродам и, следовательно, станут конкурентами разложению воды с образованием водорода и кислорода. Таким образом, становится необходимым подбор солей с неконкурирующими ионами.
Но катионы и анионы из соли также будут притягиваться к электродам и, следовательно, станут конкурентами разложению воды с образованием водорода и кислорода. Таким образом, становится необходимым подбор солей с неконкурирующими ионами.
Соли, имеющие меньший стандартный электродный потенциал, чем ионы водорода и гидроксида, подходят для электролиза воды.
Ионы элементов первой и второй группы (Li, Na, K, Mg, Ca, Ba и др.) имеют более низкий стандартный потенциал, чем ионы водорода, и не будут восстанавливаться и пропускать ионы водорода из воды в водород.
Нереакционноспособные анионы, такие как нитрат- и сульфат-ионы, имеют меньший стандартный восстановительный потенциал, чем гидроксид-ионы. Окисление сульфата до пероксисульфата имеет восстановительный потенциал +2,1 В.
Было обнаружено, что нерастворимые твердые полимерные ионные соединения (нафион) способствуют электролизу воды при напряжении менее 1,5 В.
Электролиз воды с использованием электрокатализаторов
Электрокатализаторы — это вещества, которые ускоряют электрохимические реакции, но не расходуются в ходе реакции, подобно катализаторам в химических реакциях. Катализаторы проводят реакцию по другому пути с более низкой энергией активации. Большая площадь поверхности, большие центры активации — это способность катализатора повышать реакционную способность.
Катализаторы проводят реакцию по другому пути с более низкой энергией активации. Большая площадь поверхности, большие центры активации — это способность катализатора повышать реакционную способность.
Активность инертного электрода, например, платинового, можно повысить, модифицировав поверхность на
i) Увеличение площади поверхности с помощью наночастиц или сплавление с каталитическими элементами d-блока и изменение электронного состояния, покрытое другими каталитическими веществами, для усиления электролиза.
ii) Покрытие поверхности электрода каталитически активными веществами, такими как ферменты.
Электролизеры
Электролитическая ячейка, используемая для электролиза воды, называется электролизером. В зависимости от транспортера электролита электролизеры можно разделить на три типа;
Полимерная электролитная мембрана (ПЭМ) Электролизер Полимер, такой как нафион, разделяет электроды и позволяет ионам водорода, образующимся при окислении воды на аноде, проходить через него в катодное отделение для разряда и образования газообразного водорода.
Разбавленный водный раствор гидроксида натрия (или калия), используемый при электролизе, обеспечивает перемещение ионов гидроксида к аноду с образованием кислорода.
Твердооксидный электролизерОксид керамики разделяет электроды. На катоде вода восстанавливается до ионов водорода и оксида. Ионы оксида проходят через оксид керамики к аноду, превращаясь в газообразный кислород. Это используется при высоких температурах от 700 до 800°C для снижения внешнего напряжения, необходимого для электролиза.
Электролиз чистой воды
Для электролиза чистой воды обычно требуется избыточное количество энергии в виде перенапряжения (для преодоления различных активационных барьеров). Этот избыток энергии чрезвычайно важен, потому что без него процесс происходит очень медленно, а иногда и вовсе не происходит. Причиной тому также является ограниченная самоионизация воды. Более того, электропроводность чистой воды примерно в миллион раз меньше, чем у морской воды.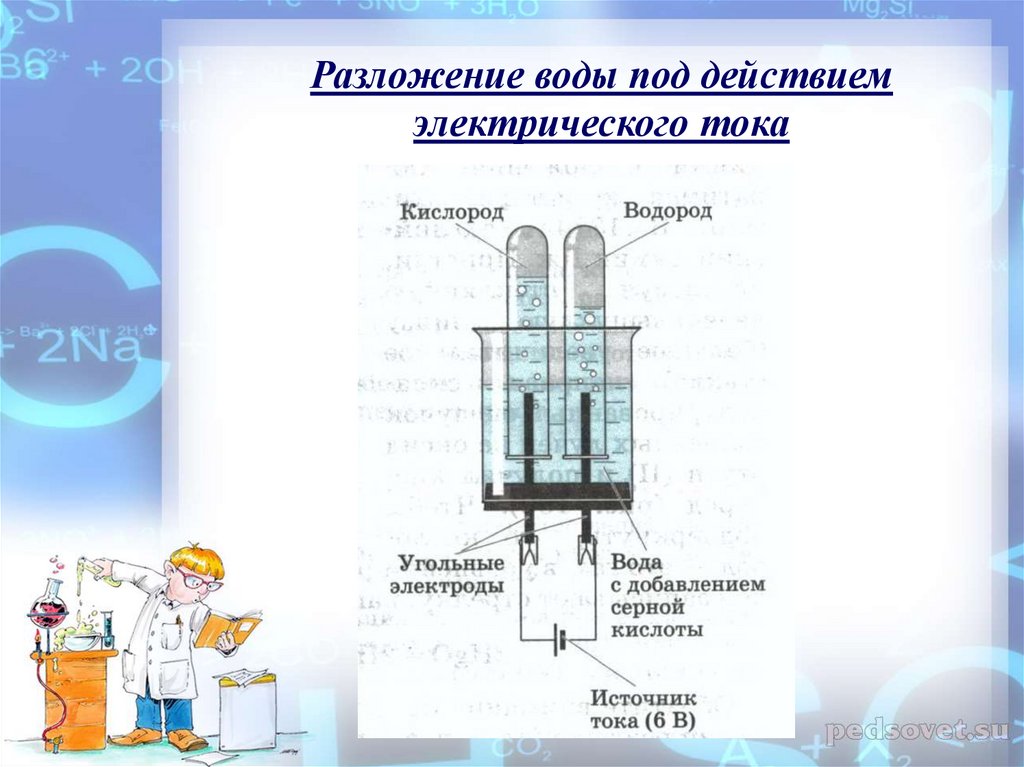 В таких случаях эффективность электролиза можно повысить, используя соответствующий электролит, такой как соль, кислота или основание, вместе с электрокатализаторами.
В таких случаях эффективность электролиза можно повысить, используя соответствующий электролит, такой как соль, кислота или основание, вместе с электрокатализаторами.
Электролиз в расплавленном состоянии
Электролиз воды: определение и уравнение
- Уравнение
- Электролиз щелочной воды
- FAQS
Процесс разлагающейся воды (H 2 O) в водород (H + ) и Hydrxid ) ионов при пропускании через них электрического тока называется электролизом. Ионы перемещаются к противоположным электродам, высвобождая чистый водород (H 2 ) и кислород (O 2 ) газы. Это несамопроизвольная окислительно-восстановительная (окислительно-восстановительная) реакция. Поскольку тепло в виде электричества поступает в электролизер, это эндотермическая реакция [1-4] .
Чистая вода не проводит электричество и требует избыточной энергии для преодоления барьера активации. Поэтому электролиз проводят в присутствии кислоты для улучшения электропроводности за счет увеличения концентрации ионов водорода (H + ). Такими электролитами являются серная кислота (H 2 SO 4 ) и соль нитрата натрия (NaNO 3 ).
Такими электролитами являются серная кислота (H 2 SO 4 ) и соль нитрата натрия (NaNO 3 ).
Уравнение
Электролиз происходит в электролитической ячейке, состоящей из положительно заряженного анода и отрицательно заряженного катода, обычно из платины. Химическую реакцию электролиза воды можно разделить на две полуреакции, происходящие на катоде и аноде [1,2] .
Реакция восстановления происходит на катоде, когда ионы водорода приобретают электроны и превращаются в газообразный водород. Полуреакция выглядит следующим образом:
2 H + (водн.) + 2 e – → H 2 (g)
Реакция окисления происходит, когда молекулы воды отдают электроны аноду и выделяют газообразный кислород на аноде. Половина реакции показана ниже.
2 H 2 O (ж) → O 2 (г) + 4 H + (водн.) + 4 e –
Суммарная химическая реакция:
2 H 2 9000 (л) + электрическая энергия → 2 H 2 (г) + O 2 (г)
Таким образом, реакция электролиза воды показывает выделение водорода и кислорода из воды. На два моля воды выделяется два моля водорода и один моль кислорода. Количество образующихся молей водорода в два раза превышает количество кислорода. Также заряды передаются между электродами и электролитом. На каждый моль водорода с катода в электролит переносится 2 электрона. На каждый моль кислорода из электролита на анод переносится 4 электрона.
На два моля воды выделяется два моля водорода и один моль кислорода. Количество образующихся молей водорода в два раза превышает количество кислорода. Также заряды передаются между электродами и электролитом. На каждый моль водорода с катода в электролит переносится 2 электрона. На каждый моль кислорода из электролита на анод переносится 4 электрона.
Электролиз щелочной воды
Электролиз воды можно также проводить в щелочной среде. В этом случае полуреакции следующие [5]:
Катод (восстановление): 2 H 2 O (ж) + 2e – → H 2 (ж) + 2 OH – (водн.)
Анод (окисление): 4 OH – (водн.) → O 2 (г) + 2 H 2 O (л) + 4 e –
Объединение двух половин -реакции дает уравнение электролиза воды.
2 H 2 O (л) + электрическая энергия → 2 H 2 (g) + O 2 (g)
Часто задаваемые вопросы
Q.


