Расщепление воды — Справочник химика 21
В то же время обратная реакция — расщепление воды на водород и кислород — требует затраты энергии (тепловой или, лучше, электрической). Расщепление молекулы воды не является самопроизвольным в отсутствие энергии расщепление вообще не происходит, и уже начавшаяся реакция тотчас же прекратится, если подачу энергии прервать. [c.110]Благодаря развитию в последние годы промышленности микробиологического синтеза ферменты стали более доступны. Это позволяет применять их не только в пищевой промышленности. Ферменты, катализирующие реакции расщепления водой белков, жиров и углеводов, в очень небольших количествах вво- дят в синтетические моющие средства, предназначен- ные для стирки, [c.113]
Напишите структурные формулы этиленовых углеводородов, озониды которых при расщеплении водой образуют [c.53]
Известно, что в ходе фотосинтеза растения используют воду и СО, для произ..,)дства углеводов и выделения кислорода. Процесс осуществляется в фотосинтезирующих структурах — хлоропластах, которые в свою очередь состоят из более мелких субклеточных структур — ламелл, В ламеллах при поглощении двух квантов света молекулами хлорофилла протекает реакция расщепления воды и СОг
Для некоторых процессов в водных растворах вода является непосредственным участником реакции. Примером наиболее изученных реакций подобного типа является гидролиз ( расщепление водой ) этилацетата с образованием уксусной кислоты и этанола (этилового спирта [c.208]
Из употребляемых для расщепления озонидов таких безводных растворителей, как спирт, эфир, безводные муравьиная и уксусная кислоты, лишь последняя оказалась особенно пригодной. В этой кислоте озонирование протекает очень равномерно, так как почти все озониды в ней растворимы и таким образом при ее употреблении eвoзмoжнo загрязнение образующегося озонида вследствие обволакивания им исходного материала. Однако для приготовления чистых озопидов ледяная уксусная кислота не особенно пригодна, так как требуется слишком высокая температура для ее полного удаления. Зто обстоятельство не имеет значения, когда озонид сразу расщепляется в самом растворе. Расщепление озонидов ледяной уксусной кислотой производится таким же образо.м, как и водой, т. е. простым нагреванием или продолжительным кипячением. При этом образуются перекпси в значительно большем количестве, чем при расщеплении водой, а при известных условиях имеют место даже все теоретически предусмотренные возможности. Так, озонид олеиновой кислоты распадается в ледяной уксусной кислоте следующим образом
Поэтому не удивителен интерес, который проявляется к использованию тепла, выделяемого в атомном реакторе для химического расщепления воды. [c.68]
Бензин предваритель ного гидрирования Бензин расщепления Вода введенная. . . Вода реакции. . . Зола 4-катализатор. Пастообразователь Непрореагировавшая масса угля. … [c.230]
Из жиров путем расщепления водой получают свободные жирные кислоты [c.294]
Прямой фотолиз воды. не. подходит для преобразования солнечной энергии, поскольку вода не поглощает в видимом спектральном диапазоне. Энергетический порог расщепления БОДЫ до радикальных фрагментов И и ОН примерно соответствует длине волны света Я = 240 нм, но даже на этой длине волны свет поглощается слабо. В то же время ионный окислительно-восстановительный механизм требует переноса четырех электронов. Для переноса каждого электрона необходима свободная энергия 472/4=118 кДж/моль, соответствующая энергии поглощаемого кванта света с длиной волны примерно 1000 нм в ближнем ИК-диапазоне (или, в терминах потенциала, около 118 000/96 500=1,22 В). Такое многоквантовое окислительновосстановительное расщепление воды представляется многообещающим. Вопрос заключается в том, как его осуществить.
Напишите структурные формулы этиленовых углеводородов, озон иды которых при расщеплении водой образуют формальдегид и 2-метил-бута-наль. [c.41]
В этом случае п — степень полимеризации — удвоилось, а соотношения масс составляют приблизительно 10 137, т. е. количество металла ничтожно мало. Но и процессы химической деструкции не требуют больших масс реагентов. Рассмотрим расщепление водой макромолекулы полиамида в определенных условиях о Н I о Н о
Донор электронов Y для фотосистемы I расположен в конце последовательности компонентов электронтранспортной цепи — после пластохинона, цитохрома / и пластоцианина. Он получает электроны, передающиеся через эти промежуточные компоненты, от соединения Q (окислительно-восстановительный потенциал 0В). Q является акцептором электронов в фотосистеме II и получает их через Р-680 от донора Z. Как уже отмечалось, восстановительный акцептор Q передает электроны фотосистеме I. Окисленный донор Z является достаточно сильным окислителем, способным окислить воду, что приводит к выделению кислорода. Таким образом, энергия для расщепления воды по- ставляется светом, улавливаемым фотосистемой II.
Важным примером делокализации и поглощения энергии является хлорофилл, который обсуждался в послесловии к гл. 20. Ароматическое кольцо, окружающее ион Mg , представляет собой протяженную делокализо-ванную систему, образуемую порфирином (см. рис. 20-19). Электронные энергетические уровни этой системы обусловливают поглощение света с одним максимумом в фиолетовой области, при 430 нм, и вторым максимумом в красной области, при 690 нм (см. рис. 20-22). При поглощении света молекулой хлорофилла ее электрон возбуждается на более высокий уровень это позволяет хлорофиллу восстанавливать ионы Ге » в ферре-доксине, белке с молекулярной массой 13000, который содержит два атома железа, координированные к сере. Последующее окисление ферредоксина служит источником энергии для протекания других реакций, которые в конце концов приводят к расщеплению воды, восстановлению диоксида углерода и, наконец, к синтезу глюкозы, С НиОв.
Побочной стадией гликолитического и спиртового брожения является так называемый пен
Простое устройство на солнечной энергии для получения водорода путем расщепления воды
Простое новое устройство на солнечной энергии, которое может создавать водород для топлива путем расщепления воды создали Исследователи из Университета Райс. Система очень похожа на другие конструкции «искусственного листа», но команда утверждает, что она самодостаточна и относительно дешева в производстве.
В консервативном сценарии роста потребления промышленного водорода его доля к 2050 году увеличится с 70 млн до 230 млн тонн в год. Также будет расти доля товарного водорода, с 4 млн до 140 млн тонн в год. При этом рынок товарного водорода, получаемого с использованием ВТГР, будет формироваться синхронно с созданием мощностей этих реакторов. Если исходить из тезиса, что этот рост будет обеспечен экологически чистым производством на основе технологий ВТГР, то для производства 140 млн тонн водорода в год к 2050 году в мире должны быть созданы энергоблоки с ВТГР общей тепловой мощностью 400 ГВт.
Водородный проект с инвестицией в 300 миллионов долларов
В Австралии ожидается массовое расширение производства возобновляемого водорода после того, как проект стоимостью 300 миллионов долларов, предназначенный для Западной Австралии, смог обеспечить финансирование инвестиций.
Проект разрабатывается компанией Infinite Blue Energy, которая планирует построить крупнейшее в Австралии предприятие по производству водорода с использованием энергии ветра и солнца.
Ожидается, что проект Arrowsmith Hydrogen, который будет построен на объекте в городе Донгара, расположенном в 320 км к северу от Перта, будет производить 25 тонн зеленого водорода в день, работающего от ветра и солнца.
Проект будет включать собственные выделенные запасы возобновляемой электроэнергии на месте, а представитель Infinite Blue Energy сообщил RenewEconomy, что завод Arrowsmith будет получать около 85 МВт солнечной энергии, дополненной 75 МВт ветрогенераторной мощности. Ожидается, что работы по проекту начнутся к середине года. Первая добыча с объекта запланирована на последний квартал 2022 года.
Infinite Blue Energy надеется, что гигантский проект поможет превратить Австралию в мирового лидера по производству и поставке водородного топлива с нулевыми выбросами.
Благодаря завершению проекта Arrowsmith и инновационной бизнес-модели IBE Австралия может продвигать свои интересы на мировой арене в качестве лидера в разработке инновационных энергетических решений Green Hydrogen и ускорить создание крупной стратегии занятости и промышленности для Австралии в ближайшее время.
В конечном счете, Infinite Blue Energy надеется увидеть интеграцию крупномасштабного накопления и выработки электроэнергии с использованием водорода, который может обеспечить круглосуточное снабжение электроэнергией.
Водород — ключевое решение для хранения энергии
В XXI веке ожидается резкий рост спроса на водород. Это связано с переходом технологических отраслей на новые методы производства качественных продуктов и развитием экологически чистого транспорта. Главными драйверами роста будут автотранспорт и системы рассредоточенного энергоснабжения, использующие водородные топливные элементы.
Исполнительный директор Bloomberg New Energy Finance (BNEF) Джон Мур прогнозирует, что еще до 2030 года «зеленый» водород ценой чуть выше $2/кг начнет конкурировать с углем и природным газом в качестве энергоносителя при производстве стали, а к 2050 году при цене $1/кг станет выгоднее газа на мировых рынках и сможет конкурировать с самым дешевым углем, сохраняя нулевую эмиссию СО2. При этом «рынок будет глобальным, возникнут крупномасштабные перевозки водорода, аналогичные тем схемам, по которым сейчас торгуется СПГ».
Уникальные свойства водорода
В основе преимуществ водорода заложен принцип более высокого уровня его удельной теплоты сгорания (120–140 МДж/кг против 50 МДж/кг у метана). Этот газ имеет малое гидродинамическое сопротивление, почти в семь раз большую теплопроводность по сравнению с воздухом и в 14 раз большую теплоемкость.
Сегодня технологические решения получения водорода стоят достаточно дорого и могут быть реализованы только при наличии государственных дотаций в той или иной форме. Круг стран, развивающих водородные направления в энергетике, пока не широк.
Япония первой в мире провозгласила курс на построение водородной экономики и приняла соответствующую стратегию. В приоритетном порядке страна развивает два направления: создание распределенной тепловой генерации на топливных элементах (ТЭ) для освещения и отопления жилых домов и офисных помещений и электромобилей с использованием водорода.
Один из наиболее перспективных путей развития водородной энергетики основан на использовании водорода, произведенного электролизом, в качестве аккумулятора энергии, при этом все большую популярность приобретает технология Power-to-Gas (P2G), а также замены углеводородных моторных топлив для большинства автомобилей. Также использование топливных элементов вместе микротурбинами и возобновляемыми энергоресурсами будет способствовать снижению стоимости и количества вредных выбросов в микросетях, при этом топливные элементы обладают большей экологической чистотой по сравнению с микротурбинами и распространение топливных элементов не оказывает негативного влияния на работу сети. Гибридные солнечно/ветро/водородные энергоустановки на топливных элементах могут способствовать максимальной конвертации солнечной и ветровой энергии в электрическую для удаленных районов.
Производство водорода: энергия и вода
Специалисты концепцию водородной энергетики определяют так: вода на входе + чистая энергия => водород => водород + кислород = чистая энергия + вода на выходе. Производство и использование водорода с помощью атомной энергии не сопровождаются вредными выбросами в атмосферу (зато предполагают крупномасштабное получение пресной воды). Вот что делает этот метод очень привлекательным для промышленности.
Сейчас бо́льшую часть водорода и водородсодержащих продуктов производят при помощи паровой конверсии природного газа: Водяной пар при температуре 700–1000 °C смешивают с метаном под давлением в присутствии катализатора. При этом половина газа тратится на сам процесс.
Дешевый водород
Проведенное компанией ARENA исследование рынка водорода показало, что интеграция установок по производству водорода с генераторами электричества на солнечной энергией на месте является ключом к производству конкурентоспособного возобновляемого водорода. Самый дешевый способ производства возобновляемого водорода целесообразно непосредственно связать с получением водорода электролизером с проектом солнечной генерации на месте.
Австралийское агентство по возобновляемым источникам энергии выделило почти 1 миллион долларов США для производителя аммония компании Дайно Нобель для проведения исследования о строительстве крупной солнечной фермы на месте, которая должна быть объединена с водородным электролизером в центре Квинсленда.
При таком расположении водород мог бы быть произведен примерно вдвое дешевле (3,19 долл. США за килограмм водорода) по сравнению с электролизером, подключенным к сети (6,08 долл. США за килограмм водорода). Стоимость может быть снижена еще больше с проектами, построенными в большем масштабе.
Такой подход откроет потенциал производства возобновляемого водорода по цене ниже 2 долл. США за килограмм к 2025 году с ожидаемым снижением, как стоимости технологий возобновляемой энергии, так и технологий электролизеров.
Это позволило бы достичь цены ниже 2 доларов США и, согласно технико-экономическому обоснованию, создаст потенциал для возобновляемого водорода в качестве альтернативы природному газу.
Исследование, проведенное консультантами ANT Energy Solutions, показало, что, хотя Австралия обладает достаточным потенциалом стать мировым лидером в производстве возобновляемого водорода, одним из ключевых барьеров будет растущий спрос на австралийский водород в краткосрочной перспективе.
В отчете говорится, что благодаря существующим инициативам Австралия готова к производству нехватки 3000 тонн возобновляемого водорода в год к 2025 году.
Солнечная энергия на месте — ключ к конкурентоспособной стоимости возобновляемого водорода
Система состоит из солнечного элемента на основе перовскита, подключенного к электродам из катализатора, который электролизует воду. Когда солнечный свет попадает на солнечный элемент, он производит электричество, которое приводит в действие катализатор, который затем расщепляет воду на кислород и водород. Они всплывают на поверхность, где их можно собирать для использования.
Эффективность солнечного света и водорода составляет около 6,7 процента, что является относительно высоким для этих типов систем. Но самая полезная особенность, по словам команды, заключается в том, насколько автономно данное устройство. Солнечный элемент и электроды — все в одном блоке — компоненты солнечного элемента заключены в полимерную оболочку, которая защищает их от повреждения водой и пропускает солнечный свет. Электроды находятся снаружи.
Схематический и вертикальный срез конструкции искусственного листа, состоящий из солнечного элемента и катализаторов.
Идея состоит в том, что это устройство может быть в опущено в воду и оставлено под прямыми солнечными лучами для работы в течение длительных периодов времени, производя водород по мере необходимости.
Таким образом, даже когда нет солнечного света, есть возможность использовать накопленную энергию в виде химического топлива. При необходимости можно поместить продукты водорода и кислорода в отдельные резервуары и включить другой модуль, например, топливный элемент, чтобы превратить это топливо обратно в электричество.
Команда исследователей утверждает, что солнечный элемент не требует дорогих компонентов, таких как платина. Вместо этого они были заменены на дешевые элементы, такие как углерод. Это должно снизить стоимость производства устройств и сделать их более жизнеспособными для коммерческого производства.

Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Новости о науке, технике, вооружении и технологиях.
Подпишитесь и будете получать свежий дайджест лучших статей за неделю!
Email*
Подписаться
Расщепления воды при комнатной температуре и получение электрического заряда

Получение водорода с использование пирокаталитических наночастиц
Ученые из Китая и Гонконга расщепили воду при комнатной температуре, используя специальный функциональный материал, способный генерировать электрический заряд под действием естественных колебаний температуры в течение суток.
Получить водород команде помогли пирокаталитические наночастицы, сообщает Energy & Environmental Science. Они могут конвертировать тепловую энергию в электрический заряд с мощностью, достаточной для расщепления молекул воды.
«Водородные топливные элементы – многообещающий альтернативный источник энергии с нулевыми выбросами парниковых газов», — объяснил Хамидех Канбарех, эксперт по функциональным материалам из британского Университета Бата, наблюдавший за этим исследованием.
Для расщепления воды часто используют солнечную энергию. Но такой подход отличается низкой эффективностью и неспособностью работать в темноте, что ограничивает его практическое применение. Решить эти проблемы может тепловая энергия.
Реализацией задачи на практике занялась команда, возглавляемая Янминем Цзя из Чжэцзянского педагогического университета и Хайтао Хуанг из Гонконгского политехнического университета. Ученые использовали пироэлектрические материалы для расщепления воды при комнатной температуре.
«В отличии от стандартной техники электролиза, наш подход не требует источника электричества. Здесь используется суточное колебание температур для производства полезного водорода», — объяснил Цзя.
Пироэлектрические наночастицы были сделаны из титаната бария-стронция. При колебаниях температур он генерировал заряд в несколько вольт – достаточно для электролиза воды. Наномерные структуры команда применила, так как, теоретически, их малый размер и большая площадь поверхности могут ускорить передачу заряда и повысить эффективность водородной эволюции.
«Исследование демонстрирует новую, качественную и экологически дружественную материальную систему, способную генерировать водород, — прокомментировал Канбарех. – Я нахожу альтернативные способы сбора энергии очень интересными. На следующих этапах команда намерена расширить функции материала, заставив его производить кислород одновременно с водородом».
Вода как топливо: ученые нашли эффективный способ расщепления воды на водород и кислород

Разработка недорогого метода создания чистого топлива для современных ученых является, чем-то вроде поисков философского камня для алхимиков прошлого. Но если у последних, судя по ценам на золото, в конечном итоге что-то не заладилось, то первые – добиваются определенных успехов в своих работах. Одним из таких способов может служить применение солнечного света, который расщепляет воду на ее составляющие – водород и кислород, а затем отделять водород и использовать его как топливо. Но процесс расщепления воды не так уж и прост.
Двое ученых из Института молекулярной инженерии (IME) и Висконсинского университета в Мадисоне серьезно продвинулись в деле создания «зеленого» топлива, значительно улучшив эффективность ключевых процессов и предложив несколько концептуально новых инструментов, которые позволят более широко применять технологии расщепления воды с помощью солнечного света. Результаты из работы опубликованы в журнале Nature Communications.
В своем исследовании, специалист в области электронных структур и симуляторов, профессор IME Джулия Галли (Giulia Galli) и профессор химии Кьйонг-Шин Чой (Kyoung-Shin Choi) Висконсинского университета нашли способ увеличить эффективность, с которой расщепляющий воду электрод адсорбирует фотоны света и, в то же время, улучшили поток электронов от одного электрода к другому. Симуляторы позволили им понять, что происходит на атомном уровне.
«Наши результаты вдохновят других исследователей в области поисков методов улучшения нескольких процессов с помощью одного подхода, — говорит Чой. – То есть, дело не только в достижении более высокой эффективности, но и создании новой стратегии в этом направлении».
Создавая электрод, который улавливает световое излучение, ученые стремились использовать как можно больше спектров солнечного света, способных возбудить электроны и преобразовать их в структуру, которая является оптимальной для реакции расщепления. Довольно важным моментом, хотя и свойственным для несколько другой области проблемы, является необходимость обеспечения легкого перемещения электронов между электродами, создающего электрический ток. До сих пор ученым приходилось прибегать к отдельным манипуляциям для улучшения адсорбции фотонов и движения электронов в тестируемых ими материалах.
По теме: Изобретен искусственный лист, использующий солнечный свет для выделения водорода в топливных элементах

Чой со своим коллегой доктором Тэ Ву Ким (Tae Woo Kim) пришли к заключению, что если нагреть электрод, изготовленный из материала на основе ванадата висмута, до 350 градусов Цельсия в азотной среде, некоторые частицы азота войдут в соединение с основным материалом. В результате была улучшена и адсорбция фотонов, и транспортировка электронов, однако, какое влияние на это оказывает азот, оставалось невыясненным. Было решено обратиться к Галли с тем, чтобы пролить свет на вопрос с помощью ее симуляторов.
С помощью тестов Галли обнаружилось, что азот воздействует на электроды несколькими способами. Нагревание в азотной среде способствует выделению атомов кислорода из ванадата висмута, создавая «дефекты», которые улучшают перенос электронов. Но позднее ученые выяснили, что помимо дефектов, перемещению заряженных частиц способствует также и сам азот, понижая порог энергии, необходимой для начала преобразования электрода в ту структуру, которая способна расщеплять воду. Это означает, что электроды могут использовать больше солнечной энергии.
«Теперь мы понимаем, что происходит на микроскопическом уровне», — отмечает Галли. – «Так что наша концепция внедрения носовых элементов и новых дефектов в материал может быть использована в других системах, в которых требуется улучшить эффективность. Более того, ее можно применять и в отношении других материалов».
Процессы, в которых теоретики и практики тесно взаимодействуют, являются естественными для науки. Но когда сотрудничество специалистов разных областей возникает на столь раннем этапе – явление, не совсем обычное. Двое ученых «нашли друг друга» с помощью Национального научного фонда и созданного им проекта CCI Solar – инновационного центра, объединяющего специалистов различных научных отраслей в поисках решений для создания технологий расщепления воды.
Читайте также: Фотоэлементы на основе нанотрубок от подводных бактерий сделают солнечные батареи на порядок эффективнее
Источник: phys.org
А вы что думаете по этому поводу? Дайте нам знать – напишите в комментариях!
Понравилась статья? Поделитесь ею и будет вам счастье!
Вода расщепление — Water splitting

Вода расщепление является химическая реакция , в которой вода разбивается на кислород и водород :
- 2 Н 2 O → 2 Н 2 + О 2
Эффективное и экономичное фотохимическое расщепление воды будет технологический прорыв , который может лежать в основе с водородной экономики . Вариант воды расщепления происходит в процессе фотосинтеза , но водород не производится. Нет практическую версия воды расщепления не была продемонстрирована, но эти два компонента реакции (Н 2 производства и О 2 производстве) хорошо известна. Обратной воды расщепления является основой водородных топливных элементов .
электролиз
Электролизер спереди с электрической панелью на переднем планеЭлектролиз воды является разложение воды (Н 2 О) в кислород (O 2 ) и водород (Н 2 ) из — за электрического тока пропускают через воду.
-
 Атмосферное электричество использование для химической реакции , в которой вода разделяется на кислород и водород. (Изображение через: Vion, патент США 28793. июня 1860.)
Атмосферное электричество использование для химической реакции , в которой вода разделяется на кислород и водород. (Изображение через: Vion, патент США 28793. июня 1860.)
- Vion, патент США 28793 , «Улучшенный способ использования атмосферного электричества», июнь 1860.
В мощности к газовым схемам производства, избыток мощности или от пиковой мощности , создаваемого ветрогенераторов или солнечных батарей используется для балансировки нагрузки энергосистемы за счет хранения , а затем инжекции водорода в сетке природного газа.

Производство водорода из воды энергоемкий. Потенциальные электрические поставки энергии включают гидроэлектростанции, ветряную турбину, или фотоэлементы. Как правило, электроэнергия потребляется более ценен , чем водород , полученный таким образом , этот метод не был широко использован. В отличии от низкотемпературного электролиза, при высокой температуре электролиз (HTE) воды преобразует больше первоначальной тепловую энергию в химическую энергию (водород), потенциально удваивая эффективность до примерно 50%. Поскольку некоторые из энергии в HTE поставляется в виде тепла, меньше энергии должны быть преобразованы в два раза (от тепла в электричество, а затем в химической форме), и поэтому этот процесс более эффективным.
Вода расщепление в процессе фотосинтеза
Вариант воды расщепления происходит в процессе фотосинтеза , но электроны шунтируется, а не протонов, а к цепи переноса электронов в фотосистемы II . Электроны используются для преобразования двуокиси углерода в сахар.
Когда фотосистемы я получаю фото-возбужденные, реакция переноса электронов получает инициирована, что приводит к снижению ряда акцепторов электронов, в конечном счете , уменьшая НАДФ + в НАДФ и PS Я окисляюсь. Окисляется фотосистемы I захватывает электроны из фотосистемы II через ряд стадий , включающих агентов , таких как пластохинона, цитохромов и plastocyanine. Фотосистемы II , затем приводит к окислению воды , в результате чего выделения кислорода, причем реакция катализируется CaMn 4 O 5 кластеров , внедренных в сложной среде белка; комплекс известен как кислород развивается комплекс (КВК).

В биологическом производстве водорода , электроны , полученные фотосистемы шунтируются не к устройству химического синтеза , но в гидрогеназа , что приводит к образованию H 2 . Это Биоводород производится в биореакторе .
Фотоэлектрохимическое расщепление воды
Используя электроэнергию , произведенную фотоэлектрических систем потенциально предлагает чистый способ получения водорода, кроме ядерного, ветра, геотермальных и гидроэлектростанций. Опять же , вода расщепляется на водород и кислород с помощью электролиза, но электрическая энергия получается с помощью фотоэлектрохимическая клеточного процесса (PEC). Система также называют искусственный фотосинтез .
Фотокаталитическое расщепление воды
Преобразование солнечной энергии в водород с помощью процесса разделения воды является одним из наиболее интересных способов достижения чистой и возобновляемой энергии. Этот процесс может быть более эффективным, если оно помогает фотокатализаторах подвешена непосредственно в воде, а не фотогальванических или электролитической системы, так что реакция протекает в одну стадию.
радиолиз
Ядерное излучение обычно разрушает водные связи, в Mponeng золотом прииске , Южной Африки , исследователи обнаружили в природе зоне высокой радиации , сообщество доминирует новый phylotype из Desulfotomaculum , питаясь в основном радиолитическому производится H 2 . Отработанное ядерное топливо / «ядерные отходы» является также рассматривается в качестве потенциального источника водорода.
Термическое разложение воды
В термолизе , молекулы воды разделены на их атомную компоненте водород и кислород . Так , например, при 2200 ° C приблизительно три процента всех H 2 O диссоциируют в различных комбинациях водорода и кислорода атомов, в основном Н, Н 2 , O, O 2 , и ОН. Другие продукты реакции , такие как H 2 O 2 или HO 2 остаются незначительными. При очень высокой температуре 3000 ° С более половины молекул воды разлагается, но при температурах окружающей среды только одна молекулы в 100 триллионов диссоциируют под действием тепла. Высокие температуры и материальные ограничения ограничили применение этого подхода.
Ядерная-тепловая
Смотрите также: NGNPОдна сторона выгоды от ядерного реактора , который производит как электричество и водород является то , что он может перенести производство между ними. Например, завод может производить электричество в течение дня и водорода в ночное время , соответствие его электрический профиля поколения для ежедневного изменения спроса. Если водород может быть получен экономически, эта схема будет конкурировать с существующими выгодно для хранения энергии сетки схем. Более того, существует достаточный спрос водорода в Соединенных Штатах , что все ежедневно поколение пика может быть обработан такими растениями.
Гибридный термоэлектрический цикл Меди-хлор является когенерационной системой с использованием отработанного тепла от ядерных реакторов, в частности, CANDU реактора сверхкритической воды .
Солнечная-термической
Высокие температуры , необходимые для расщепления воды может быть достигнуто за счет использования концентрации солнечной энергии . Гидрозоль-2 является пилотной установкой 100 киловатт на Платаформе солнечной де Альмерии в Испании , которая использует солнечный свет , чтобы получить требуемый от 800 до 1200 ° C для расщепления воды. Гидрозоль II , была в эксплуатации с 2008 года Конструкция этого пилотного завода 100 киловатт базируется на модульной концепции. В результате, это может быть возможно , что эта технология может быть легко расширена до диапазона мегаватт пути умножения доступных блоков реакторов и путем подключения завода по гелиостату полей (полей солнечного отслеживанию зеркал) подходящего размера.
Существенные трудности из-за требуемые высокие температуры уменьшаются на конструкции мембранного реактора с одновременным извлечением водорода и кислородом, который использует определенный температурный градиент и быструю диффузию водорода. С концентрированным солнечного светом в качестве источника тепла и воды только в реакционной камере, образующиеся газы очень чистые с единственной возможными заграми водой. А «Solar Water Крекер» с концентратором около 100 квадратных метров может производить почти один килограмм водорода на солнечный свет час.
Исследование
Исследования ведутся над фотокатализом , ускорение фотореакции в присутствии катализатора. Его понимание стало возможным с тех пор открытие электролиза воды с помощью диоксида титана. Искусственный фотосинтез является полем исследования , что попытки воспроизвести естественный процесс фотосинтеза, превращая солнечный свет, воду и углекислый газ в углеводы и кислород. В последнее время это было успешным в расщеплении воды на водород и кислород с помощью искусственного соединения под названием Nafion .
Высокотемпературный электролиз (также HTE или пара электролиз ) представляет собой метод в настоящее время исследуется для производства водорода из воды с кислородом в качестве побочного продукта. Другое исследование включает термолиз на дефектных углеродных субстратов, таким образом делая возможным производство водорода при температурах чуть менее 1000 ° С.
Цикла оксид железа представляет собой ряд термохимических процессов , используемых для получения водорода . Цикла оксид железа состоит из двух химических реакций , у которых чистая реагент представляет собой воду , и чьи чистые продукты являются водород и кислород . Все остальные химические вещества перерабатываются. Процесс оксида железа требует эффективного источника тепла.
Серу йода цикла (SI цикл) представляет собой ряд термохимических процессов , используемых для получения водорода . Цикл СИ состоит из трех химических реакций , у которых чистая реагент представляет собой воду и чьи чистые продукты являются водород и кислород . Все остальные химические вещества перерабатываются. Процесс СИ требует эффективного источника тепла.
Более 352 термохимических циклы были описаны для воды расщепления или термолиза ., Эти циклы обещают производить водород кислород из воды и тепла без использования электричества. Так как вся энергия входа для таких процессов тепла, они могут быть более эффективными , чем высокотемпературный электролиз. Это потому , что эффективность производства электроэнергии по своей природе ограничена. Термохимическое производство водорода с использованием химической энергии из угля или природного газа , как правило , не считаются, потому что прямой химический путь является более эффективным.
Для всех термохимических процессов, суммарная реакция является то, что при разложении воды:
- 2 ЧАС 2 О ⇌ Высокая температура 2 ЧАС 2 + О 2 {\ Displaystyle {\ се {2h3O <=> [{\ се {Тепло}}] 2h3 {} + О2}}}
Все другие реагенты перерабатываются. Ни один из термохимических процессов производства водорода не было продемонстрировано на уровне производства, хотя некоторые из них были продемонстрированы в лабораториях.
Существует также исследование жизнеспособности наночастиц и катализаторов для снижения температуры, при которой вода расщепляется.
Недавно Metal-Organic Framework (MOF) основе материалов было показано, что весьма перспективным кандидатом для воды расщепления с дешевыми, первый ряд переходных металлов .;
Исследование сосредоточено на следующих циклах:
| термохимической цикл | LHV Эффективность | Температура (° C / F) |
|---|---|---|
| Церий (IV) , оксид церия (III) , оксид цикла (СеО 2 / Се 2 О 3 ) | ? % | 2000 ° С (3630 ° F), |
| Гибридный цикл серы (HYS) | 43% | 900 ° С (+1650 ° F) |
| Сера цикл йода (СИ цикл) | 38% | 900 ° С (+1650 ° F) |
| Цикл сульфата кадмия | 46% | 1000 ° C (1830 ° F), |
| Цикл Сульфат бария | 39% | 1000 ° C (1830 ° F), |
| Марганец цикла сульфат | 35% | 1100 ° С (2010 ° F), |
| Цинк цикл оксида цинка (Zn / ZnO) | 44% | 1900 ° С (3450 ° F), |
| Гибридный цикл кадмий | 42% | 1600 ° С (2910 ° F), |
| Карбонат Кадмий цикл | 43% | 1600 ° С (2910 ° F), |
| Цикл оксида железа ( ) Fe 3 О 4 / FeO {\ Displaystyle {\ се {Fe3O4 / FeO}}} | 42% | 2200 ° С (3990 ° F), |
| цикл марганца натрия | 49% | 1560 ° С (2840 ° F), |
| Никель цикл феррита марганца | 43% | 1800 ° С (3270 ° F), |
| Цинк марганца цикл феррита | 43% | 1800 ° С (3270 ° F), |
| Цикл Медь-хлор (Cu-Cl) | 41% | 550 ° С (° F тысяча двадцать-два) |
See also =
Вода расщепление [Фотокаталитическая вода расщепление] [Вода реакция конверсии газа]
Рекомендации
внешняя ссылка
Новый способ расщепления воды | Химия в школе
Для решения проблем энергетики будущего заманчивой целью была бы разработка способа дешевого получения водорода для его применения в топливных ячейках и получения жидкого топлива.
В качестве альтернативы к существующим методам получения молекулярного водорода – обработке биомассы и электролизу воды, исследователи стараются разработать метод термического расщепления воды, который позволил бы получать Н2 за счет термической энергии Солнца и работы катализаторов на основе оксидов металлов. Однако классический подход к термическому расщеплению воды требует повторения нагревания и охлаждения, что приводит к затратам энергии.
Чарльз Масгрейв (Charles B. Musgrave) и Алан Ваймер (Alan W. Weimer) из Университета Колорадо смогли обойти проблему необходимость поддерживать режим температурного цикла, продемонстрировав первый способ термического расщепления воды при постоянной температуре.
Как отмечает эксперт по технологиям, связанным с использованием энергии Солнца, Альдо Штайнфельд (Aldo Steinfeld) заявляет, что результаты работы предлагают решение для достижения более высокой эффективности в процессе конверсии солнечной энергии в жидкое топливо и использовать энергию Солнца для промышленного получения топлива, конкурентоспособного по цене традиционным видам топлива.
Расщепление воды под действием солнечной энергии в режиме температурного цикла (сверху) и изотермическом режиме (снизу). (Рисунок из Science 2013, DOI: 10.1126/science.1239454)
При термическом расщеплении воды в рамках температурного цикла металлооксидный катализатор восстанавливается при высокой температуре – от 1200 до 1500°C, высвобождая молекулу кислорода; восстановленный оксид металла затем окисляется в присутствии воды при температуре около 400°C, в результате чего выделяется H2 и регенерируется исходный катализатор. Затем цикл повторяется.
При новом изотермическом подходе катализатор из оксида металла восстанавливается при 1350°C, высвобождая кислород, последующее окисление системы в присутствии воды, сопровождающееся выделением водорода и регенерацией катализатора происходит при этой же температуре. В соответствии с результатами нового исследования изотермический процесс эффективнее, чем процесс, в котором температура изменяется, однако исследователи признают, что новая система еще требует изучения.
Эксперт по процессам получения водород за счет использования солнечной энергии Мартин Роеб (Martin Roeb) из Института Солнечной Энергии в Кельне отмечает, что новая методика имеет хорошие шансы превзойти существующие термические методы разложения воды, протекающие в режиме чередования температуры. С ним соглашается специалист по материаловедению и химической технологии Соссина Хайле (Sossina M. Haile), соглашается с ним, подчеркивая, что термическое расщепление воды в изотермическом режиме значительно упрощает процесс, понижая нагрузку на оборудование. Немаловажно и то, что новая система демонстрирует большую эффективность в получении водорода из воды, чем существующие ныне.
Жаолинь Вонг (Zhaolin Wang), специалист по методам получения водорода из Университета Онтарио, отмечает, что переход к изотермическому режиму позволит увеличить срок службы катализатора, упросить условия процесса и увеличить выход выделяющегося водорода. Тем не менее, Вонг указывает на возможную опасность взрыва из-за совместного образования водорода и кислорода в результате самопроизвольного смешения окисленной и восстановленной формы катализатора, однако Ваймер уверен, что такого можно избежать.
Жидкое топливо, которое можно получить с помощью водорода, полученного в результате расщепления воды энергией Солнца, пока еще дороже ископаемого топлива, поэтому даже новый процесс не сможет стать началом революции в энергетике. Тем не менее, результаты нового исследования чрезвычайно важны с точки зрения фундаментальной науки, поскольку наглядно демонстрируют возможность реализации термохимических окислительно-восстановительных циклов в изотермических условиях.
Открыт способ извлечения больших количеств водорода из любого растения
Ученые обнаружили способ извлечения больших количеств водорода из любого растения. Не исключено, что этот тот самый долгожданный прорыв в энергетике, который позволит перейти на использование недорогого экологически чистого топлива.Новый процесс получения водорода основан на преобразовании энергии ксилозы, наиболее распространенного простого сахара. При этом технология позволяет произвести большое количество водорода из любых источников биомассы без выбросов парниковых газов и использования дорогостоящих металлов. Ксилоза составляет целых 30% клеточных стенок растений. Однако, несмотря на высокую долю ксилозы в растениях, до сих пор вырабатывать с помощью этого сахара водород было затруднительно.
Различные химические и физические воздействия, а также генно-модифицированные микроорганизмы не могли произвести достаточное количество водорода. Ученые из Virginia Tech взяли набор ферментов у ряда микроорганизмов и создали уникальный синтетический фермент, аналогов которому не существует в природе. Данный фермент при температуре всего 50 градусов Цельсия освобождает с помощью ксилозы беспрецедентно большой объем водорода – примерно в 3 раза больше, чем лучшие современные «микробные» методики.
Суть процесса сводится к тому, что энергия, запасенная в ксилозе и полифосфатах, расщепляет молекулы воды и позволяет получить высокочистый водород, который можно сразу отправлять в топливные ячейки, вырабатывающие электричество. Получается эффективнейший экологически чистый процесс, который требует немного энергии только на запуск реакции.
По расчетам специалистов, новая технология может получить распространение уже через 3 года благодаря своей простоте и исключительным преимуществам перед другими способами добычи водорода. Правда пока остается открытым вопрос цены производства фермента, но разработчики по этому поводу полны оптимизма.
Теоретически новая технология может использоваться повсеместно: от автономных электрогенераторов на сельхозпредприятиях, до крупных электростанций, перерабатывающих сотни тонн растительного сырья. Полученный водород можно либо сразу превращать в электричество, либо использовать как топливо для автомобильного, морского, железнодорожного и авиационного транспорта.
Катализатор расщепления воды, не похожий ни на один другой — ScienceDaily
Электричество можно вырабатывать из возобновляемых источников, таких как солнечный свет, ветер. Затем электричество можно использовать для расщепления воды, которая превращает водород в топливо для новых энергетических устройств, таких как топливные элементы. Поскольку водород является экологически чистым топливом, исследователи во всем мире прилагают много усилий для разработки катализаторов расщепления воды, которые необходимы для энергоэффективности реакции.
Основное внимание уделяется так называемой реакции выделения кислорода (OER), которая, возможно, является наиболее сложным процессом при расщеплении воды.После многих лет интенсивных исследований оксид никеля и железа в настоящее время признан основным катализатором ООР в щелочных условиях благодаря своей высокой активности и высокоземельному составу, а также потому, что он имеет самую высокую активность на реакционный участок среди всех оксиды металлов.
Около трех лет назад ученые из лаборатории Ксиле Ху в EPFL обнаружили еще один катализатор, который был значительно более активен, чем оксид никеля и железа, хотя и имел похожий состав. Тем не менее, он был надежным, простым в синтезе и открытым для промышленного применения.
Открытие возглавлял Фанг Сун, постдок из группы Ху, который с тех пор поступил на факультет Шанхайского университета Цзяотун в Китае. Признавая его технологический потенциал, Ху, Сун и их коллега Элица Петкучева подали международную патентную заявку. Они также получили финансирование от Европейского исследовательского совета для тестирования катализатора в рамках экспериментального проекта. Катализатор оказался эффективным электролизером, который мог работать в промышленных условиях, требуя при этом на 200 мВ меньше напряжения.Сейчас они ищут промышленных партнеров для передачи технологии.
Но новый катализатор также был нетрадиционным с точки зрения химии. «Мы не имели ни малейшего представления, почему катализатор был таким активным», — говорит Ху. Поэтому его команда обратилась за помощью к группе Клеменс Корминбёф из EPFL. Работая со своим постдоком Майклом Бушем и при поддержке NCCR MARVEL (Центр вычислительного проектирования и открытия новых материалов), Корминбёф использовала вычисления теории функционала плотности (DFT) для поиска возможных теоретических объяснений.DFT — это вычислительный квантово-механический метод, который моделирует и изучает структуру систем многих тел, например атомы и молекулы.
Результат был радикальным: высокая активность нового катализатора проистекает из кооперативного действия двух разделенных фазами компонентов оксидов железа и никеля, которые преодолевают ранее выявленное ограничение обычных оксидов металлов, когда реакция протекает локально только на одном металле. сайт. Они назвали это «бифункциональным механизмом».
Хотя механизм, полученный на основе DFT, был гипотетическим, он руководил экспериментальными исследованиями активности и свойств катализатора с Бенедиктом Лассалем-Кайзером в Synchrotron SOLEIL во Франции.С помощью рентгеновской абсорбционной спектроскопии (XAS) в ходе работы были обнаружены доказательства наличия двух разделенных фаз оксидов железа и никеля в катализаторе. Но поскольку катализаторы могут претерпевать структурные и композиционные изменения во время катализа, возникла необходимость изучить катализатор «в работе» с XAS.
Для этого исследователи установили долгосрочную программу сотрудничества с группой профессора Хао Мин Чена в Национальном университете Тайваня. В ходе комплексного исследования XAS Чен и его аспирант Чиа-Шуо Сюй выявили уникальную структуру катализатора: он состоит из нанокластеров? -FeOOH, ковалентно связанных с носителем? -NiOOH, что делает его катализатор на основе оксида железа-никеля, в отличие от обычного оксида никеля-железа.Хотя это не является прямым доказательством, эта структура совместима с бифункциональным механизмом, предложенным DFT.
«Это действительно междисциплинарное исследование, предполагающее плодотворное сотрудничество», — говорит Ху. «Фундаментальные исследования не только дают представление о структуре и активности этого нетрадиционного катализатора, но и приводят к наводящей на размышления механистической гипотезе».
История Источник:
Материалы предоставлены Федеральной политехнической школой Лозанны . Примечание. Содержимое можно редактировать по стилю и длине.
.Производство водорода: термохимическое расщепление воды
Вы здесь
При термохимическом расщеплении воды используются высокие температуры — от концентрированной солнечной энергии или отходящего тепла ядерных энергетических реакций — и химических реакций для производства водорода и кислорода из воды.Это долгосрочный технологический путь с потенциально низкими выбросами парниковых газов или без них.
Как это работает?
В процессах термохимического расщепления воды используется высокотемпературное тепло (500–2000 ° C) для запуска серии химических реакций с образованием водорода. Химические вещества, используемые в процессе, повторно используются в каждом цикле, создавая замкнутый цикл, который потребляет только воду и производит водород и кислород. Необходимые высокие температуры могут быть созданы следующими способами:
- Концентрация солнечного света на башне реактора с использованием поля зеркальных «гелиостатов», как показано на рисунке 1.Для получения дополнительной информации см. Главу 5 исследования SunShot Vision.
- Использование отходящего тепла современных ядерных реакторов. Для получения дополнительной информации см. План исследований и разработок ядерного водорода Министерства энергетики США.
Многочисленные циклы термохимического расщепления воды на солнечной энергии были исследованы для производства водорода, каждый с различными наборами рабочих условий, инженерными проблемами и возможностями производства водорода. Фактически, в литературе описано более 300 циклов водоразделения.Для получения дополнительной информации см. Исследования солнечного термохимического производства водорода: выбор термохимического цикла и инвестиционный приоритет.
Два примера циклов термохимического расщепления воды, «прямой» двухступенчатый термический цикл оксида церия и «гибридный» цикл хлорида меди, показаны на рисунке 2. Обычно прямые циклы менее сложны с меньшим количеством шагов, но они требуют более высоких рабочих режимов. температуры по сравнению с более сложными гибридными циклами.
Почему рассматривается этот путь?
Циклы высокотемпературного термохимического расщепления воды с использованием солнечной и ядерной энергии производят водород с почти нулевыми выбросами парниковых газов с использованием воды и солнечного света или ядерной энергии.
Исследования направлены на преодоление трудностей
Однако остаются проблемы в исследованиях, разработке и демонстрации коммерчески жизнеспособных термохимических циклов и реакторов:
- Необходимо повысить эффективность и долговечность реагентов для термохимического цикла.
- Необходимо разработать эффективные и надежные конструкции реакторов, совместимые с высокими температурами и тепловым циклом.
- Для солнечных термохимических систем необходимо снизить стоимость систем концентрирующих зеркал.
В этой области продолжается захватывающий прогресс, используя синергию с технологиями концентрированной солнечной энергии и новыми технологиями производства солнечного топлива.
.Ученые достигли идеальной эффективности полуреакции расщепления воды
 При освещении видимым светом наноразмерные фотокатализаторы выполняют половину реакции уменьшения расщепления воды со 100% эффективностью. Предоставлено: Сирень Амирав, Израильский технологический институт Техниона.
При освещении видимым светом наноразмерные фотокатализаторы выполняют половину реакции уменьшения расщепления воды со 100% эффективностью. Предоставлено: Сирень Амирав, Израильский технологический институт Техниона.(Phys.org). Разделение воды — это двухэтапный процесс, и в новом исследовании ученые выполнили один из этих шагов (сокращение) со 100% эффективностью.Результаты разбивают предыдущий рекорд производства водорода в видимом свете в 60% и подчеркивают, что будущие исследования должны быть сосредоточены на другом этапе (окислении), чтобы реализовать практическое общее расщепление воды. Основное применение разделения воды на компоненты кислорода и водорода состоит в том, что водород затем можно использовать для доставки энергии в топливные элементы для питания транспортных средств и электронных устройств.
Исследователи Филип Калисман, Ифат Накибли и Сирень Амирав из Израильского технологического института Техниона в Хайфе, Израиль, опубликовали статью об идеальной эффективности полуреакции снижения содержания воды в недавнем выпуске Nano Letters. .
«Я твердо верю, что поиск чистых и возобновляемых источников энергии имеет решающее значение», — сказал Амирав Phys.org . «Учитывая надвигающийся энергетический кризис, с одной стороны, и экологические аспекты, в основном глобальное потепление, с другой, я думаю, что наш долг — попытаться исправить эту проблему для следующего поколения.
«Наша работа показывает, что можно получить идеальную 100% эффективность производства фотонов в водород при освещении видимым светом для фотокаталитической полуреакции уменьшения расщепления воды.Эти результаты разрушают предыдущие тесты для всех систем и практически не оставляют места для улучшения этой конкретной полуреакции. При стабильной системе и частоте оборота 360 000 моль водорода в час на моль катализатора потенциал здесь реальный ».
Когда молекула H 2 O расщепляется, три атома просто не отделяются друг от друга. Полная реакция требует для начала двух молекул H 2 O, а затем протекает по двум отдельным полураакциям.В полуреакции окисления образуются четыре отдельных атома водорода вместе с молекулой O 2 (которая отбрасывается). В полуреакции восстановления четыре атома водорода объединяются в две молекулы H 2 путем добавления электронов, в результате чего образуется полезная форма водорода: газ H 2 .
 (Слева) Изображения наностержневых фотокатализаторов с помощью просвечивающего электронного микроскопа с одним (а) и двумя платиновыми наконечниками (б).(Справа) Сравнение эффективности показывает преимущество использования одного платинового наконечника. Предоставлено: Калисман и др. © Американское химическое общество, 2016 г.
(Слева) Изображения наностержневых фотокатализаторов с помощью просвечивающего электронного микроскопа с одним (а) и двумя платиновыми наконечниками (б).(Справа) Сравнение эффективности показывает преимущество использования одного платинового наконечника. Предоставлено: Калисман и др. © Американское химическое общество, 2016 г.В новом исследовании исследователи показали, что полуреакция восстановления может быть достигнута с идеальной эффективностью на специально разработанных наностержнях длиной 50 нм, помещенных в раствор на водной основе при освещении видимым светом. Свет обеспечивает энергию, необходимую для продвижения реакции, а наностержни действуют как фотокатализаторы, поглощая фотоны и, в свою очередь, высвобождая электроны, необходимые для реакции.
Эффективность 100% относится к эффективности преобразования фотона в водород, и это означает, что практически все фотоны, которые достигают фотокатализатора, генерируют электрон, а каждые два электрона производят одну молекулу H 2 . При 100% выходе в ходе полуреакции на каждом наностержне образуется около 100 H 2 молекул в секунду (или по одной каждые 10 миллисекунд), а типичный образец содержит около 600 триллионов наностержней.
Одним из ключей к достижению идеальной эффективности было выявление узкого места процесса, которое заключалось в необходимости быстро разделить электроны и дырки (свободные места в полупроводнике, оставшиеся после выхода электронов) и удалить дырки из фотокатализатора. . Чтобы улучшить разделение зарядов, исследователи переработали наностержни, чтобы они имели только один платиновый катализатор вместо двух. Исследователи обнаружили, что эффективность увеличилась с 58,5% с двумя платиновыми катализаторами до 100% с одним.
В дальнейшем исследователи планируют усовершенствовать систему. Текущая демонстрация требует очень высокого pH, но такие сильные основные условия не всегда идеальны на практике. Другая проблема заключается в том, что сульфид кадмия (CdS), используемый в наностержне, подвергается коррозии при длительном воздействии света в чистой воде. Исследователи уже решают эти проблемы с целью реализовать в будущем практическую технологию использования солнечной энергии в качестве топлива.
«Мы надеемся реализовать наши правила проектирования, опыт и накопленные знания для создания системы, способной к общему разделению воды и подлинному преобразованию солнечной энергии в топливо», — сказал Амирав.«Фотокаталитическое производство водорода, представленное здесь, еще не является подлинным преобразованием солнечной энергии в топливную, поскольку все еще требуются дырочные поглотители. К сожалению, CdS не подходит для полного расщепления воды, поскольку длительное облучение его суспензий приводит к фотокоррозии. Недавно мы продемонстрировали некоторые прорыв и в этом направлении.Добавление второго сокатализатора, такого как IrO 2 или Ru, который может поглощать дырки из полупроводника и опосредовать их перенос в воду, придает структурам на основе CdS желаемую фотохимическую стабильность.Я считаю, что это важная веха ».
Дополнительная информация: Филип Калисман и др. «Идеальная эффективность преобразования фотона в водород.» Nano Letters . DOI: 10.1021 / acs.nanolett.5b04813
© 2016 Phys.org
Ссылка : Ученые достигли идеальной эффективности полуреакции расщепления воды (2016, 26 февраля) получено 25 августа 2020 с https: // физ.org / news / 2016-02-science -fficiency-water-splitting-half-response.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, нет часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
.

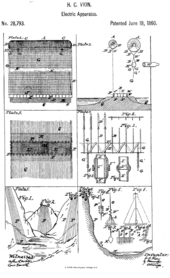 Атмосферное электричество использование для химической реакции , в которой вода разделяется на кислород и водород. (Изображение через: Vion, патент США 28793. июня 1860.)
Атмосферное электричество использование для химической реакции , в которой вода разделяется на кислород и водород. (Изображение через: Vion, патент США 28793. июня 1860.)