В статье понятным и простым языком объясняется явление ЭДС. Представлена краткая историческая справка, рассмотрены типы ЭДС и её связь с параметрами электрической цепи. Текст подкреплён элементарными формулами.
Что такое ЭДС в физике – физический смысл
Электрический ток будет проходить через проводник только в том случае, если единовременно соблюдаются два простых условия:
- В проводнике присутствуют свободные электроны (например, в металлах электронов, не связанных с атомом, большинство).
- В проводнике присутствует сила, вынуждающая электроны двигаться.
Допустим, на концы электрода подали разные по знаку заряды, которые под действием кулоновской силы начинают притягиваться друг к другу.


Однако без сторонних сил электрическое поле, появившееся в результате такого взаимодействия, исчезнет, как только электроны придут в равновесие, поэтому для поддержания в проводнике электрического тока нужен источник питания, например батарейка.
ВАЖНО: электроны могут перемещаться только силами неэлектрического происхождения (сторонними силами), ярким примером которых являются химические процессы, происходящие в батарее.
При замыкании цепи «проводник – источник тока» электроны вновь начнут движение друг к другу, но как только положительный заряд приблизится к отрицательному, сторонние силы перенесут его обратно.


Так, работа этих сторонних сил по переносу единичного положительного заряда называется ЭДС.
Что такое ЭДС в электротехнике?
В электротехнике ЭДС характеризует источники питания и создаёт и поддерживает в течение длительного периода времени разность потенциалов. Численно ЭДС равна работе, которую должны совершить либо сторонние силы, чтобы переместить положительный заряд внутри источника, либо сам источник, чтобы провести заряд по цепи. Таким образом, формула для вычисления ЭДС имеет вид:
E = A / q,
где E – ЭДС,
А – работа,
q – заряд.
ЭДС необходима для поддержания в цепи постоянного тока, причём в технике применяется несколько видов ЭДС.
| Вид | Область применения |
| Химическая | Батарейки и аккумуляторы |
| Термоэлектрическая | Холодильники и термопары |
| Индукционная | Электродвигатели, генераторы и трансформаторы |
| Фотоэлектрическая | Фотоэлементы |
| Пьезоэлектрическая | Пьезоэлементы, датчики, кварцевые генераторы |
СПРАВКА: в теории существует идеальный источник ЭДС – генератор с нулевым внутренним сопротивлением, мощность которого приравнивается к бесконечности.
Расшифровка ЭДС
Аббревиатура ЭДС общепринятая и расшифровывается как «электродвижущая сила».
СПРАВКА: понятие ЭДС введено Георгом Омом в 1827 году, а её значение определено Густавом Кирхгофом в 1857.
В чём измеряется ЭДС – единица измерения
Уже было отмечено, что ЭДС – отношение работы к заряду, то есть:
Единица измерения E = 1 джоуль (Дж) / 1 кулон (Кл) = 1 вольт (В).
Таким образом, ЭДС, как напряжение, измеряется в вольтах. Причём на практике часто используют более крупные и мелкие единицы:
- киловольт (кВ): 1 кВ = 103 В;
- милливольт (мВ): 1мВ = 10-3 В;
- микровольт (мкВ): 1 мкВ = 10-6 В.
Чем отличается ЭДС от напряжения?
Известно, что напряжение характеризует работу электрического поля по переносу положительного заряда и измеряется в вольтах. Таким образом, на первый взгляд ЭДС и напряжение мало чем отличаются друг от друга, однако различие между этими понятиями есть и весьма существенное.

 Схема с ЭДС
Схема с ЭДСВ реальной электрической цепи присутствует внутреннее сопротивление, на котором происходит падение напряжения. Причём, если разомкнуть цепь и соединить вольтметр с батареей, он покажет значение ЭДС – 1,5 В, но при подключении нагрузки, например лампочки, на клеммах будет меньшее значение. Эти процессы описываются законом Ома для полной цепи.
То есть основная разница между величинами состоит в том, что напряжение зависит от нагрузки и тока в цепи, а ЭДС – от источника питания.
СПРАВКА: в идеальной электрической цепи, где отсутствует внутреннее сопротивление, между напряжением и ЭДС не будет разницы.
ЭДС электромагнитной индукции
29 августа 1831 года Майкл Фарадей открыл электромагнитную индукцию – явление возникновения электрического тока при движении замкнутого проводящего контура в магнитном поле или при изменении в течение времени этого поля.
Фарадей в ходе эксперимента обнаружил, что возникающая ЭДС зависит от скорости изменения магнитного потока через поверхность замкнутого контура, но не зависит от причины этого изменения.
Eинд = — dФ / dt,
где Eинд – ЭДС индукции,
Ф – магнитный поток, измеряемый в веберах (Вб),
t – время.
Знак дифференциала d характеризует изменение величин, а минус перед отношением отражает правило Ленца, согласно которому индукционный ток, вызванный ЭДС индукции, направлен таким образом, чтобы противодействовать изменению магнитного потока.
ЭДС источника тока
Электродвижущая сила источника тока характеризует его способность создавать и поддерживать разность потенциалов на зажимах.
ВНИМАНИЕ: ЭДС может возникнуть в источнике и при разомкнутой цепи, при этом данную ситуацию называют «холостым ходом», а величина силы приравнивается к разнице потенциалов.
ЭДС индукции в движущихся проводниках
Пусть в однородном магнитном поле с постоянной скоростью движется проводник. Тогда на каждый свободный электрон проводника будет действовать сила Лоренца, под действием которой отрицательные частицы начнут движение. В результате один из концов проводника зарядится отрицательно, второй – положительно, то есть возникнет разница потенциалов. Исходя из этого можно сделать вывод, что данный проводник в такой ситуации будет представлять собой источник тока, а разность потенциалов на его концах, по сути, представляет собой ЭДС.
Eинд = B∙l∙v∙sinα,
где B – вектор индукции магнитного поля,
l – длина проводника,
v – скорость его перемещения в магнитном поле,
α – угол направления движения к направлению действия поля, то есть угол между B и v.
ЭДС катушки индуктивности
Особенность катушки – способность создавать магнитное поле, если по её проводу течёт электрический ток, что называется индуктивностью.

 Схема ЭДС с катушкой индуктивности
Схема ЭДС с катушкой индуктивностиДопустим, собрана схема с катушкой с железным сердечником и лампочкой, подключенной параллельно. Если сначала замкнуть цепь, дав току, протекающему в неё, установиться, а потом резко разомкнуть, лампочка резко вспыхнет. Что свидетельствует о том, что при отключении цепи от источника питания ток из катушки перешёл в лампу. То есть ток в катушке был и имел вокруг себя магнитное поле, после исчезновения которого возникла ЭДС.
Такая электродвижущая сила называется ЭДС самоиндукции, так как она появилась от собственного магнитного поля катушки.
ЭДС гальванического элемента
Гальванический элемент – это источник тока, создающий его из химической энергии. Рассмотрим элемент Даниэля-Якоби, представляющий собой цинковую и медную пластины в соответствующих растворах сульфатов, соединённые между собой электролитом. Если соединить пластины металлическим стержнем, начнётся перераспределение зарядов: свободные электроны будут перемещаться к электроду с менее отрицательным зарядом (медной пластине). То есть возникнет электрический ток. Его работа будет максимальной в том случае, когда процессы на электродах (окисление и восстановление вследствие изменения числа электронов) будут протекать бесконечно медленно.
ЭДС гальванического элемента – максимальная разность потенциалов, возможная в такой ситуации.
Мощность через ЭДС
Известно, что мощность тока – это работа, совершаемая в единицу времени, то есть:
P = A / Δt,
где P – мощность.
Кроме этого, существует формула для вычисления мощности на участке цепи, связывающая эту величину с напряжением и током:
P = U∙I,
где U – напряжение,
I – ток.
В случае, если участок цепи содержит источник тока, имеющий ЭДС, формула будет иметь вид:
P = (u1—u2)∙I + E∙I,
где u1—u2 – разность потенциалов.
ЭДС через магнитный поток
Было отмечено, что Фарадей установил соотношение зависимости ЭДС от магнитного потока:
E = — ΔФ / Δt.
Известно, что магнитный поток можно найти, опираясь на выражение:
Ф = B∙S∙cosα,
где S – площадь поверхности, через которую проходит поток,
α – угол между вектором магнитной индукции и нормалью к поверхности.
Для некоторого упрощения допустим, что плоскость контура располагается перпендикулярно к магнитному полю, то есть α = 0. Учитывая, что ΔФ = Ф2 — Ф1 = B∙(S2 — S1), формула ЭДС может иметь вид:
E = — B∙(S2 — S1) / Δt.
Напряжение через ЭДС
Согласно закону Ома для участка цепи:
I = U / R,
где R – сопротивление.
Этот же закон для полной цепи имеет вид:
I = E / (R+r),
где r – сопротивление источника питания.
Пусть количество электронов, произведённых источником тока, равно количеству зарядов, которые «ушли» в цепь. Тогда справедливо равенство:
U / R = E / (R+r).
Путём элементарных математических действий можно получить связь напряжения и ЭДС:
U = E∙R / (R+r).
СПРАВКА: для идеальной цепи: U = E.
Как обозначается ЭДС на схеме?
Источник ЭДС обычно изображается буквой «Е», расположенной рядом со стрелкой, помещённой в круг. Рассмотрим несколько схем, встречающихся на практике.

 Как обозначается ЭДС на схеме
Как обозначается ЭДС на схемеНа рисунке под буквой «а» изображён идеальный источник ЭДС, под «б» – реальный источник, обладающий внутренним сопротивлением, под «в» – элементарная электрическая цепь: реальный источник ЭДС и потребитель.
Как можно повысить точность измерения ЭДС источника тока?
Одним из способов повышения точности является проведение серии измерений, что позволит снизить риск случайных ошибок. Кроме этого, в серию испытания можно включить измерение разности потенциалов, тока, внутреннего сопротивления источника, а после вычислить среднее значение требуемой величины.
Наиболее простой способ повышение точности – использование вольтметра высокого класса точности.
Расчет ЭДС гальванического элемента
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода.
ЭДС = ЕК – ЕА.
Если условия стандартные, то ЭДС элемента Даниэля –Якоби будет равным + 1,18 В.
ЭДС = 0,34 –(–0,76) =1,18.
Если условия отличаются от стандартных, то пользуются эмпирической формулой Нернста для расчета электродных потенциалов:

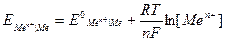 ,
,
где 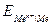
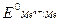 – стандартный электродный потенциал, В;
– стандартный электродный потенциал, В;
n – степень окисления металла;
R – универсальная газовая постоянная,
R = 8,31 Дж/моль К;
F – число Фарадея, F = 96500 Кл;
[Men+] – концентрация ионов металла в растворе, моль/л.
Если подставить в данную формулу значения R, F, T = 298 K и перевести натуральный логарифм в десятичный, то получится упрощенная формула Нернста:
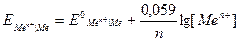 .
.
Таблица 6 – Стандартные электродные потенциалы
| Уравнение электродного процесса | Стандартный потенциал Е° при 25°С, В |
| Li+ + e ® Li | –3,045 |
| Rb+ + e ® Rb | –2,925 |
| K+ + e ® K | –2,924 |
| Cs+ + e ® Cs | –2,923 |
| Ca+2 + 2e ® Ca | –2,866 |
| Na+ + e ® Na | –2,714 |
| Mg2+ + 2e ® Mg | –2,363 |
| Al3+ + 3e ® Al | –1,663 |
| Ti2+ + 2e ® Ti | –1,630 |
| Mn2+ + 2e ® Mn | –1,179 |
| Zn2+ + 2e ® Zn | –0,763 |
| Cr3+ + 3e ® Cr | –0,744 |
| Fe2+ + 2e | –0,440 |
| Cd2+ + 2e ® Cd | –0,403 |
| Co2+ + 2e ® Co | –0,277 |
| Ni2+ + 2e ® Ni | –0,250 |
| Sn2+ + 2e ® Sn | –0,136 |
| Pb2+ + 2e ® Pb | –0,126 |
| Fe3+ + 3e ® Fe | –0,037 |
| 2H+ + 2e ® H2 | 0,000 |
| Bi | 0,215 |
| Cu2+ + 2e ® Cu | 0,337 |
| Ag+ + e ® Ag | 0,799 |
| Hg2+ + 2e ® Hg | 0,850 |
| Pd2= +2e® Pd | 0,990 |
| Pt2+ + 2e ® Pt | 1,188 |
| Au+ + e ® Au | 1,692 |
Примеры решения задач:
Задача 1.
Вычислите ЭДС гальванического элемента, состоящего из двух электродов: Ti | Ti
Решение:
ЭДС гальванического элемента можно рассчитать как разность потенциалов:
ЭДС = EК – ЕА
В данном гальваническом элементе катод — Ni° |Ni2+, а анод — Ti°|Ti2+ .
Схема гальванического элемента:
А (–) Ti | Ti2+ || Ni2+ | Ni (+) К
Процессы на электродах:
(–) А: Ti – 2e— = Ti2+;
(+) K: Ni2+ + 2e— = Ni.
По формуле Нернста рассчитываем значение электродного потенциала анода.
E Ti/Ti2+ = E0 T/|Ti2+ + 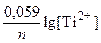 = –1,630 +
= –1,630 + 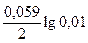 = –1,689 В;
= –1,689 В;
Значение электродного потенциала катода равно величине стандартного электродного потенциала никелевого электрода, так как концентрация ионов Ni2+ в растворе составляет 1 моль/л.
E Ni/Ni2+ = E0 Ni/Ni2+ = – 0,250 В;
ЭДС = –0,250 – ( –1,689) = 1,439 В.
Задача 2
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного оловянным и стандартным водородным электродами, если концентрация соли олова равна 0,01 моль/л.
Решение:
ЭДС гальванического элемента можно рассчитать как разность потенциалов:
ЭДС = EК – ЕА
В данном гальваническом элементе катод – стандартный водородный электрод , а анод — Sn|Sn2+ .
Схема гальванического элемента:
А (–) Sn | Sn2+ || 2H+ | H2 (Pt) (+) К
Процессы на электродах:
(–) А: Sn – 2e— = Sn2+;
(+) K: 2H+ + 2e— = H2
По формуле Нернста рассчитываем значение электродного потенциала анода.
E Sn/Sn2+ = E0 Sn/|Sn2+ + 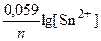 = –0,136 +
= –0,136 + 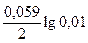 = –0,195 В;
= –0,195 В;
Значение электродного потенциала катода равно нулю.
ЭДС = 0– ( –0,195) = 0,195В.
КОНТРОЛЬНЫЕ ВОПРОСЫ
181. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=0,01 моль/л и цинкового в растворе хлорида цинка, [Mg2+]=0,01 моль/л.
182. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=0,01 моль/л и цинкового в растворе хлорида цинка, [Zn2+]=0,01 моль/л.
183. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd
184. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного цинковым и магниевым электродами, погруженными в растворы солей при концентрации (моль/л) [Zn2+]=0,1, [Mg2+]=1.
185. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым электродом в растворе хлорида кадмия, [Cd2+]=1 моль/л и цинкового в растворе хлорида цинка, [Zn2+]=0,01 моль/л.
186. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух свинцовых электродов, один из которых погружен в раствор соли свинца с концентрацией 0,1 моль/л, а другой – 0,0001 моль/л.
187. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного никелевым и палладиевым электродами, погруженными в растворы их солей, если [Ni2+]=0,01 моль/л, а [Pd2+]=0,1 моль/л.
188. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного оловянным и стандартным водородным электродами, если концентрация соли олова равна 0,0001 моль/л.
189. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы своих солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Вычислите ЭДС этого элемента, если [Zn2+]=0,0001 моль/л, а [Fe2+]=0,01 моль/л.
190. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного железным и стандартным водородным электродами, если концентрация соли [Fe3+] =0,001 моль/л.
191. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Mg2+]=0,01 моль/л, а [Pb2+]=0,1 моль/л.
192. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевым и стандартным водородным электродами, если концентрация соли кадмия равна 0,01 моль/л.
193. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Ni2+]=0,01 моль/л, а [Pb2+]=0,0001 моль/л.
194. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного алюминиевым и стандартным водородным электродами, если концентрация соли алюминия равна 0,001 моль/л.
195. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Cu + 2Ag+ = Cu2+ + 2Ag.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Cu2+]=0,01 моль/л, а [Ag+]=0,001 моль/л.
196. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного серебряным и стандартным водородным электродами, если концентрация соли серебра равна 0,0001 моль/л.
197. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Be + Pb2+ = Be2+ + Pb.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Pb2+]=0,01 моль/л, а [Be2+]=0,1 моль/л.
198. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного никелевым и стандартным водородным электродами, если концентрация соли никеля равна 0,0001 моль/л.
199. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Al + Cr3+ = Al3+ + Cr.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Al3+]=0,001 моль/л, а [Cr3+]=0,0001 моль/л.
200. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного кадмиевыми электродами, если концентрация соли кадмия при положительном электроде равна 1 моль/л, а при отрицательном – 0,0001 моль/л.
201. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Cr + FeCl3= CrCl3 + Fe.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Fe3+]=0,01 моль/л, а [Cr3+]=0,001 моль/л.
202. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного цинковым и стандартным водородным электродами, если концентрация соли цинка равна 0,0001 моль/л.
203. Составьте схему галванического элемента, в основе которого лежит реакция, протекающая по уравнению
Co + Pb(NO3)2 = Co(NO3)2 + Pb.
Напишите электронные уравнения электродных процессов и вычислите ЭДС этого элемента, если [Co2+]=0,01 моль/л, а [Pb2+]=0,0001 моль/л.
204. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, образованного хромовым и стандартным водородным электродами, если концентрация соли хрома равна 0,001 моль/л.
205. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
206. Какой гальванический элемент называется концентрационным?
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, один из которых погружен в раствор соли серебра с концентрацией 0,1 моль/л, а другой – 0,01 моль/л.
207. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
208. Составьте схемы двух гальванических элементов, в одном из которых цинк был бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
209. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
210. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Электролиз
Если рассматриваемый г.э. находится в стандартных условиях (р = 1 атм, активности ионов в растворе равны 1), то для расчетов используют стандартные электродные потенциалы j°, взятые в таблице.
Определим ЭДС г.э., состоящего из свинцовой и никелевой пластин.
Составим схему г.э., определив по таблице электродных потенциалов анод и катод. Ni находится выше, он является анодом, Pb – ниже, он катод.
(-) Ni | Ni2+ || Pb2+ | Pb (+)
ЭДС рассчитывается по формуле:
E° = j°катода – j°анода= j°( Pb2+/Pb) – j°(Ni2+/Ni) = -0,126 – (- 0,25) = 0,124 В.
Расчет ЭДС г.э. в нестандартных условиях
Потенциал электрода зависит не только от материала электрода, но и от условий – температуры и концентрации ионов в растворе.
Для любой полуреакции вида:
Ок-ль + ne- → В-ль
для расчета потенциала используют уравнение Нернста:
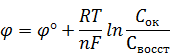
где j — потенциал данной окислительно-восстановительной пары, В; j° — стандартный потенциал, Сок. – концентрация окисленной формы, Свосст. – концентрация восстановленной формы; R – универсальная газовая постоянная, 8,314 Дж; Т – абсолютная температура, К; n – число электронов, переданных от восстановителя к окислителю.
Уравнение (4) представляет собой уравнение Нернста в общем виде. Если проводить расчет при Т=298 К, рассчитать выражение RT/F и учесть фактор пересчета натурального логарифма в десятичный (2,3), то уравнение Нернста примет вид:
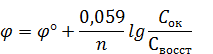
Для электродов I рода (металл – ион металла) уравнение Нернста приобретает вид:
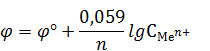
Работа № 15
КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называется самопроизвольный процесс разрушения металлов в результате их взаимодействия с окислителями из окружающей среды. Выплавка металлов из руд требует затраты энергии. При коррозии происходит самопроизвольное высвобождение из металлов накопленной свободной энергии Гиббса. Это делает металлы химически активными веществами:
Меn+ + ne— → Me (∆G > 0) Me0 – ne— → Меn+ (∆G < 0)
металлургия коррозия
Коррозия металлов есть необратимый процесс и приводит к большим прямым и косвенным потерям.
Следует отметить, что коррозии не подвержены такие металлы, как золото, серебро, платина, ртуть, так как эти металлы в природе находятся в свободном состоянии и не требуют энергетических затрат на их получение.
По механизму различают два типа коррозионных процессов: химическую и электрохимическую коррозию.
Химическая коррозия
Основным признаком этой коррозии является отсутствие в коррозионной среде конденсационной влаги. Поэтому этот тип коррозии нередко называют коррозией сухими газами или термической коррозией. При химической коррозии протекает химическая окислительно—восстановительная реакция между металлом и окислителем (коррозионным агентом) из внешней среды. При этой реакции поверхность металла окисляется, а коррозионный агент – восстанавливается.
Химической коррозии подвержены детали и узлы машин, работающих при высокой температуре – поршневые двигатели, камеры внутреннего сгорания топлива, химические реакторы и т.д.
При химической коррозии металлов происходит изменение состава поверхности металла. Рассмотрим это на примерах коррозии металла газами.
Химическая коррозия стали в среде воздуха или кислорода
В большинстве случаев активным коррозионным агентом является кислород:
Fe+ O2 ® FeO + Fe2O3 + Fe3O4
Химическая коррозия под действием сухого хлора
2Fe + 3Cl2 ® 2FeCl3
Химическую коррозию можно наблюдать при контакте металла с неводными средами, например, при контакте нефти или ее продуктов с поверхностью стальных цистерн. В составе нефти находятся органические соединения, особенно опасны соединения, содержащие хлорид-ионы и серу, они образуют легко растворимые хлориды и сульфиды металлов.
Химическая коррозия стали в неводных средах:
2R- Cl + Me → MeCl2 + R-R
R1-S-R2+ Me →MeS + R1-R2
Разрыв ковалентных связей, способствующий переходу хлорида и сульфида в ионное состояние, совершается легче при повышенных температурах.
Электрохимическая коррозия
При наличии в коррозионной среде конденсационной влаги коррозия идет по электрохимическому механизму. Этот вид коррозии самый распространенный.
Причиной протекания электрохимической коррозии является неоднородность металла из-за наличия в нем различных примесей. В результате на поверхности возникают участки, имеющие разный потенциал и образующие микрогальванические элементы. Роль анода в таком элементе выполняет металл, который окисляется, а роль катода – присутствующие в металле примеси других металлов или их соединений, а также загрязнения.
На аноде осуществляется окисление металла по реакции Me – ne— → Men+, образующиеся электроны по металлу переходят на катодный участок, где связываются окислителем из окружающей среды. В качестве окислителя выступает кислород воздуха в присутствии влаги либо ионы водорода (Н+).
На катоде могут протекать следующие процессы:
1) Если окислителем является кислород:
О2 + 2Н2О + 4е— → 4ОН— в нейтральной и щелочной среде
О2 + 4Н+ + 4е— → 2Н2О в кислой среде
Такая коррозия называется коррозией с кислородной деполяризацией.
2) Если в среде отсутствует кислород, то в качестве окислителя выступают ионы водорода (Н+) в кислой, нейтральной или щелочной средах:
2Н+ + 2е— → Н2 в кислой среде
2Н2О + 2е— → Н2 + 2ОН— в нейтральной и щелочной средах
Атмосферная коррозия углеродистой стали
Рассмотрим коррозию углеродистой стали с кислородной и водородной деполяризацией.
В углеродистой стали присутствует в качестве примеси карбид железа (Fe3C). Возникают микроконтакты Fe (анод) — Fe3C (катод).
На аноде: Fe – 2e— → Fe2+
На катоде: О2 + 2Н2О + 4е— →4ОН— (в присутствии кислорода воздуха в нейтральной среде)
Суммарное уравнение коррозии имеет вид:
Fe + О2 + 2Н2О →2Fe(ОН)2
Это уравнение первичного процесса. Образующийся гидроксид железа (II) на воздухе окисляется до Fe(OH)3 – вторичный процесс, в результате которого образуется бурая ржавчина.
2Fe(ОН)2 + 1/2О2 + Н2О →2Fe(ОН)3
Fe(OH)3 → FeOOH +H2O
ржавчина
Коррозионный процесс углеродистой стали в кислой среде в отсутствие кислорода выглядит так:
На аноде: Fe – 2e— → Fe2+
На катоде: 2Н+ + 2е— → Н2
Суммарное уравнение коррозии:
Fe + 2HCl → Н2 + FeCl2
Атмосферная коррозия на границе контакта двух разных металлов.
Рассмотрим коррозию железа в контакте с оловом.
При контакте двух металлов в среде электролита возникает макрогальванический элемент, в котором роль анода будет играть металл более активный, с меньшим значением потенциала, т.е. железо (φFe2+/Fe = -0,44 В), а катодом будет олово, имеющее больший потенциал (φSn2+/Sn = -0,136 В). Электродные процессы в этом случае описываются уравнениями:
На аноде: Fe – 2e- → Fe2+
На катоде: (Sn) О2 + 2Н2О + 4е— → 4ОН—
Fe2+ + 2ОН— → Fe(ОН)2
Коррозия при неравномерной аэрации
Схема коррозии стали при неравномерном поступлении окислителя к поверхности металла показана на рис.
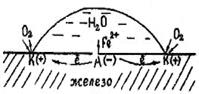
Рис. Коррозия при неравномерной аэрации
При попадании капли воды на поверхность металла на ней образуются катодные и анодные участки ввиду неодинакового поступления окислителя, в данном случае кислорода. В точках «К» кислород поступает в максимально возможном количестве и здесь будет идти катодный процесс:
О2 + 2Н2О + 4е— → 4ОН—
На участок «А» поверхности металла количество кислорода ограниченно из-за высоты слоя капли. Поэтому потенциал этого участка меньший (относительно катодного) и будет представлять анодную зону, на которой идет процесс окисления металла:
Fe – 2e— → Fe2+
Термодинамика коррозии
Возможность коррозии конкретного металла данным окислителем возможна при положительном значении ЭДС:
Е = φокис-ля – φвосст-ля > 0
Для определения возможности протекания коррозии необходимо знать потенциалы катодных процессов в различных средах. Данные приведены в таблице.
Таблица. Значения потенциалов окислителей при кислородной и водородной деполяризации в различных средах
| Катодная реакция | рН | j, В | |
| Водородная деполяризация | 2Н+ + 2е– → Н2 | ||
| 2H2O + 2e– → H2 + 2OH– | –0,413 | ||
| 2H2O + 2e– → H2 + 2OH– | –0,826 | ||
| Кислородная деполяризация | O2 + 4e– + 4H+ → 2H2O | 1,23 | |
| O2 + 4e– + 2H2O → 4OH– | 0,82 | ||
| O2 + 4e– + 2H2O → 4OH– | 0,40 |
Чтобы определить, возможна ли коррозия в данных условиях из потенциала окислителя вычитаем потенциал металла. Если ЭДС > 0, коррозия идет. Например, свинец (j° Pb2+/Pb = — 0,126 В) будет подвергаться коррозии под действием кислорода (в кислой, нейтральной и щелочной средах), под действием кислот в отсутствие кислорода и будет устойчив к коррозии во воде и растворе щелочи.
Работа № 16
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Вопрос защиты металлов от коррозии является актуальным в отраслях промышленности, связанных с эксплуатацией металлических конструкций, оборудования и машин. Поэтому на каждом этапе работы с металлом (проектировании, изготовлении и эксплуатации) осуществляется ряд мер, направленных на защиту его от коррозии.
Наиболее важными методами защиты от коррозии являются следующие:
1. Нанесение покрытий
2. Легирование металлов
3. Электрохимическая защита
4. Изменение свойств коррозионной среды
5. Рациональное конструирование изделий
Последний метод заключается в том, что необходимо избегать использования в одной конструкции контактов разных металлов. В этом случае возникает гальванический элемент, и один из металлов (анод) подвергается усиленной коррозии.
Кратко рассмотрим нанесение покрытий (металлические покрытия), электрохимическую защиту и обработку коррозионной среды.
Металлические покрытия
Металлические покрытия в зависимости от потенциала металла-покрытия делятся на анодные и катодные.
Если покрытие состоит из более активного металла, чем защищаемый металл, то такое покрытие называется анодным. Например, цинк или хром на поверхности железа. Сущность защиты состоит в том, что покрытие само защищено пленкой оксида, а в случае разрушения этой пленки, металл покрытия окисляется, т.к. является анодом по отношению к защищаемому металлу.
Коррозию оцинкованного железа можно представить схемой:
А: Zn — 2е— → Zn2+
К: (Fe) 2Н2О + 2е— → Н2 + 2ОН—
Цинковые покрытия применяют для защиты деталей машин, трубопроводов, стальных листов. Цинк дешевый и доступный металл. 20 % всех стальных деталей покрывают цинком, 50 % выплавляемого в мире цинка расходуется на гальванопокрытия.
Если изделие покрывают менее активным металлом, то такое покрытие называется катодным. Например, покрытие железа оловом (луженое железо), свинцом, никелем, медью. Суть защиты заключается в том, что металл покрытия более устойчив к коррозии, чем основной металл. Однако, при нарушении покрытия происходит окисление основного металла, как более активного, и его коррозия усиливается.
А: Fe — 2е— → Fe2+
К: (Sn) 2Н2О + 2е— → Н2 + 2ОН—
Т.о., катодное покрытие целесообразно использовать в случае, если не происходит механическое повреждение изделия. Покрытия из олова применяют в пищевой промышленности, при изготовлении печатных плат.
Электрохимическая защита
Данный способ защиты реализуется при электрохимической коррозии металла, протекающей по принципу работы гальванического элемента. При этом анодом является металлическое изделие, подвергающееся коррозии. Если на анод извне наложить больший, чем в гальваническом элементе отрицательный потенциал, то его разрушение прекратится. Этот принцип действия лежит в основе электрохимической защиты металла.
Катодная защита. При катодной защите металлическое изделие подключают к отрицательному полюсу внешнего источника постоянного тока, и оно становится катодом. В качестве анода используют вспомогательный металл, который в процессе работы образованной гальванопары будет постепенно растворяться.
Протекторная защита металла — разновидность катодной защиты, но без использования внешнего источника тока. Принцип тот же – создается гальванический элемент, в котором защищаемый металл будет играть роль катода, а анодом являться присоединяемый к нему более активный металл, имеющий более отрицательный потенциал, называемый протектором. В этом случае разрушению будет подвергаться протектор. В качестве протекторов используют сплавы на основе цинка, алюминия, магния.
Анодная защита. Анодная защита применяется только для тех металлов и сплавов, которые легко пассивируются при анодной поляризации, т.е. покрываются пассивной пленкой оксида, например:
2 Cr + 3H2O — 6е— ® Cr2O3 + 6H+
При проведении такой защиты металлическое изделие присоединяют к положительному полюсу внешнего источника постоянного тока, и оно становится анодом, на котором идет окисление с получением защитной оксидной пленки. А катодом выбирают другой металл (вспомогательный электрод), присоединяемый к отрицательному полюсу, на котором в процессе работы полученной гальванопары будут идти процессы восстановления катионов из окружающей среды.
Электродвижущая сила — Википедия
Электродвижущая сила (ЭДС) — скалярная физическая величина, характеризующая работу сторонних сил, то есть любых сил неэлектрического происхождения, действующих в квазистационарных цепях постоянного или переменного тока. В замкнутом проводящем контуре ЭДС равна работе этих сил по перемещению единичного положительного заряда вдоль всего контура[1][2].
По аналогии с напряжённостью электрического поля вводят понятие напряжённость сторонних сил E → e x {\displaystyle {\vec {E}}_{ex}} , под которой понимают векторную физическую величину, равную отношению сторонней силы, действующей на пробный электрический заряд к величине этого заряда. Тогда в замкнутом контуре L {\displaystyle L} ЭДС будет равна:
- E = ∮ L E → e x ⋅ d l → , {\displaystyle {\mathcal {E}}=\oint \limits _{L}{\vec {E}}_{ex}\cdot {\vec {dl}},}
где d l → {\displaystyle {\vec {dl}}} — элемент контура.
ЭДС так же, как и напряжение, в Международной системе единиц (СИ) измеряется в вольтах. Можно говорить об электродвижущей силе на любом участке цепи. Это удельная работа сторонних сил не во всем контуре, а только на данном участке. ЭДС гальванического элемента есть работа сторонних сил при перемещении единичного положительного заряда внутри элемента от одного полюса к другому. Работа сторонних сил не может быть выражена через разность потенциалов, так как сторонние силы непотенциальны и их работа зависит от формы траектории. Так, например, работа сторонних сил при перемещении заряда между клеммами источника тока вне самого́ источника равна нулю.
ЭДС и закон Ома
Электродвижущая сила источника связана с электрическим током, протекающим в цепи, соотношениями закона Ома. Закон Ома для неоднородного участка цепи имеет вид[1]:
- φ 1 − φ 2 + E = I R , {\displaystyle \varphi _{1}-\varphi _{2}+{\mathcal {E}}=IR,}
где φ 1 − φ 2 {\displaystyle \varphi _{1}-\varphi _{2}} — разность между значениями потенциала в начале и в конце участка цепи, I {\displaystyle I} — сила тока, текущего по участку, а R {\displaystyle R} — сопротивление участка.
Если точки 1 и 2 совпадают (цепь замкнута), то φ 1 − φ 2 = 0 {\displaystyle \varphi _{1}-\varphi _{2}=0} и предыдущая формула переходит в формулу закона Ома для замкнутой цепи[1]:
- E = I R , {\displaystyle {\mathcal {E}}=IR,}
где теперь R {\displaystyle R} — полное сопротивление всей цепи.
В общем случае полное сопротивление цепи складывается из сопротивления внешнего по отношению к источнику тока участка цепи ( R e {\displaystyle R_{e}} ) и внутреннего сопротивления самого́ источника тока ( r {\displaystyle r} ). С учётом этого следует:
- E = I R e + I r . {\displaystyle {\mathcal {E}}=IR_{e}+Ir.}
ЭДС источника тока
Если на участке цепи не действуют сторонние силы (однородный участок цепи) и, значит, источника тока на нём нет, то, как это следует из закона Ома для неоднородного участка цепи, выполняется:
- φ 1 − φ 2 = I R . {\displaystyle \varphi _{1}-\varphi _{2}=IR.}
Значит, если в качестве точки 1 выбрать анод источника, а в качестве точки 2 — его катод, то для разности между потенциалами анода φ a {\displaystyle \varphi _{a}} и катода φ k {\displaystyle \varphi _{k}} можно записать:
- φ a − φ k = I R e , {\displaystyle \varphi _{a}-\varphi _{k}=IR_{e},}
где как и ранее R e {\displaystyle R_{e}} — сопротивление внешнего участка цепи.
Из этого соотношения и закона Ома для замкнутой цепи, записанного в виде E = I R e + I r {\displaystyle {\mathcal {E}}=IR_{e}+Ir} нетрудно получить
- φ a − φ k E = R e R e + r {\displaystyle {\frac {\varphi _{a}-\varphi _{k}}{\mathcal {E}}}={\frac {R_{e}}{R_{e}+r}}} и затем φ a − φ k = R e R e + r E . {\displaystyle \varphi _{a}-\varphi _{k}={\frac {R_{e}}{R_{e}+r}}{\mathcal {E}}.}
Из полученного соотношения следуют два вывода:
- Во всех случаях, когда по цепи течёт ток, разность потенциалов между клеммами источника тока φ a − φ k {\displaystyle \varphi _{a}-\varphi _{k}} меньше, чем ЭДС источника.
- В предельном случае, когда R e {\displaystyle R_{e}} бесконечно (цепь разорвана), выполняется E = φ a − φ k . {\displaystyle {\mathcal {E}}=\varphi _{a}-\varphi _{k}.}
Таким образом, ЭДС источника тока равна разности потенциалов между его клеммами в состоянии, когда источник отключён от цепи[1].
ЭДС индукции
Причиной возникновения электродвижущей силы в замкнутом контуре может стать изменение потока магнитного поля, пронизывающего поверхность, ограниченную данным контуром. Это явление называется электромагнитной индукцией. Величина ЭДС индукции в контуре определяется выражением
- E = − d Φ d t , {\displaystyle {\mathcal {E}}=-{\frac {d\Phi }{dt}},}
где Φ {\displaystyle \Phi } — поток магнитного поля через замкнутую поверхность, ограниченную контуром. Знак «−» перед выражением показывает, что индукционный ток, созданный ЭДС индукции, препятствует изменению магнитного потока в контуре (см. правило Ленца). В свою очередь причиной изменения магнитного потока может быть как изменение магнитного поля, так и движение контура в целом или его отдельных частей.
Неэлектрический характер ЭДС
Внутри источника ЭДС ток течёт в направлении, противоположном нормальному. Это невозможно без дополнительной силы неэлектрической природы, преодолевающей силу электрического отталкиванияКак показано на рисунке, электрический ток, нормальное направление которого — от «плюса» к «минусу», внутри источника ЭДС (например, внутри гальванического элемента) течёт в противоположном направлении. Направление от «плюса» к «минусу» совпадает с направлением электрической силы, действующей на положительные заряды. Поэтому для того, чтобы заставить ток течь в противоположном направлении, необходима дополнительная сила неэлектрической природы (центробежная сила, сила Лоренца, силы химической природы) которая бы преодолевала электрическую силу.
Сторонние силы
Сторонними силами называются силы, вызывающие перемещение электрических зарядов внутри источника постоянного тока против направления действия сил электростатического поля. Например, в гальваническом элементе или аккумуляторе сторонние силы возникают в результате электрохимических процессов, происходящих на границе соприкосновения электрода с электролитом; в электрическом генераторе постоянного тока сторонней силой является сила Лоренца[3].
См. также
Примечания
расчет электродвижущей силы по формуле
Электромагнитная индукция – генерирование электротоков магнитными полями, изменяющимися во времени. Открытие Фарадеем и Генри этого феномена ввело определенную симметрию в мир электромагнетизма. Максвеллу в одной теории удалось собрать знания об электричестве и магнетизме. Его исследования предсказывали существование электромагнитных волн перед экспериментальными наблюдениями. Герц доказал их существование и открыл человечеству эпоху телекоммуникаций.
Эксперименты Фарадея
Законы Фарадея и Ленца
Электрические токи создают магнитные эффекты. А возможно ли, чтобы магнитное поле порождало электрическое? Фарадей обнаружил, что искомые эффекты возникают вследствие изменения МП во времени.
Когда проводник пересекается переменным магнитным потоком, в нем индуцируется электродвижущая сила, вызывающая электроток. Системой, которая генерирует ток, может быть постоянный магнит или электромагнит.
Явление электромагнитной индукции регулируется двумя законами: Фарадея и Ленца.
Закон Ленца позволяет охарактеризовать электродвижущую силу относительно ее направленности.
Важно! Направление индуцированной ЭДС такое, что вызванный ею ток стремится противостоять создающей его причине.
Фарадей заметил, что интенсивность индуцированного тока растет, когда быстрее изменяется число силовых линий, пересекающих контур. Другими словами, ЭДС электромагнитной индукции находится в прямой зависимости от скорости движущегося магнитного потока.
ЭДС индукции
Формула ЭДС индукции определена как:
Е = — dФ/dt.
Знак «-» показывает, как полярность индуцированной ЭДС связана со знаком потока и меняющейся скоростью.
Получена общая формулировка закона электромагнитной индукции, из которой можно вывести выражения для частных случаев.
Движение провода в магнитном поле
Когда провод длиной l движется в МП, имеющем индукцию В, внутри него будет наводиться ЭДС, пропорциональная его линейной скорости v. Для расчета ЭДС применяется формула:
- в случае движения проводника перпендикулярно направлению магнитного поля:
Е = — В x l x v;
- в случае движения под другим углом α:
Е = — В x l x v х sin α.
Индуцированная ЭДС и ток будут направлены в сторону, которую находим, пользуясь правилом правой руки: расположив руку перпендикулярно силовым линиям магнитного поля и указывая большим пальцем в сторону перемещения проводника, можно узнать направление ЭДС по оставшимся четырем распрямленным пальцам.
Перемещение провода в МП
Вращающаяся катушка
Работа генератора электроэнергии основана на вращении контура в МП, имеющего N витков.
ЭДС индуцируется в электроцепи всегда, когда магнитный поток ее пересекает, в соответствии с определением магнитного потока Ф = B x S х cos α (магнитная индукция, умноженная на поверхностную площадь, через которую проходит МП, и косинус угла, образованного вектором В и перпендикулярной линией к плоскости S).
Из формулы следует, что Ф подвержен изменениям в следующих случаях:
- меняется интенсивность МП – вектор В;
- варьируется площадь, ограниченная контуром;
- изменяется ориентация между ними, заданная углом.
В первых опытах Фарадея индуцированные токи были получены путем изменения магнитного поля В. Однако можно индуцировать ЭДС, не двигая магнит или не меняя ток, а просто вращая катушку вокруг своей оси в МП. В данном случае магнитный поток меняется из-за изменения угла α. Катушка при вращении пересекает линии МП, возникает ЭДС.
Если катушка вращается равномерно, это периодическое изменение приводит к периодическому изменению магнитного потока. Или количество силовых линий МП, пересекаемых каждую секунду, принимает равные значения с равными интервалами времени.
Вращение контура в МП
Важно! Наведенная ЭДС меняется вместе с ориентацией с течением времени от положительной до отрицательной и наоборот. Графическое представление ЭДС представляет собой синусоидальную линию.
Для формулы ЭДС электромагнитной индукции применяется выражение:
Е = В х ω х S x N x sin ωt, где:
- S – площадь, ограниченная одним витком или рамкой;
- N – количество витков;
- ω – угловая скорость, с которой вращается катушка;
- В – индукция МП;
- угол α = ωt.
На практике в генераторах переменного тока часто катушка остается неподвижной (статор), а электромагнит вращается вокруг нее (ротор).
ЭДС самоиндукции
Когда через катушку проходит переменный ток, он генерирует переменное МП, обладающее изменяющимся магнитным потоком, индуцирующим ЭДС. Этот эффект называется самоиндукцией.
Поскольку МП пропорционально интенсивности тока, то:
Ф = L x I,
где L – индуктивность (Гн), определяемая геометрическими величинами: количеством витков на единицу длины и размерами их поперечного сечения.
Для ЭДС индукции формула принимает вид:
Е = — L x dI/dt.
Взаимоиндукция
Если две катушки расположены рядом, то в них наводится ЭДС взаимоиндукции, зависящая от геометрии обеих схем и их ориентации относительно друг друга. Когда разделение цепей возрастает, взаимоиндуктивность снижается, так как уменьшается соединяющий их магнитный поток.
Взаимоиндукция
Пусть имеется две катушки. По проводу одной катушки, обладающей N1 витками, протекает ток I1, создающий МП, проходящее через катушку с N2 витками. Тогда:
- Взаимоиндуктивность второй катушки относительно первой:
М21 = (N2 x F21)/I1;
- Магнитный поток:
Ф21 = (М21/N2) x I1;
- Найдем индуцированную ЭДС:
Е2 = — N2 x dФ21/dt = — M21x dI1/dt;
- Идентично в первой катушке индуцируется ЭДС:
Е1 = — M12 x dI2/dt;
Важно! Электродвижущая сила, вызванная взаимоиндукцией в одной катушке, всегда пропорциональна изменению электротока в другой.
Взаимную индуктивность можно признать равной:
М12 = М21 = М.
Соответственно, E1 = — M x dI2/dt и E2 = M x dI1/dt.
М = К √ (L1 x L2),
где К – коэффициент связи между двумя индуктивностями.
Явление взаимоиндукции используется в трансформаторах – электроаппаратах, позволяющих изменить значение напряжения переменного электротока. Аппарат представляет собой две катушки, намотанные вокруг одного сердечника. Ток, присутствующий в первой, создает меняющееся МП в магнитопроводе и электроток в другой катушке. Если количество витковых оборотов первой обмотки меньше, чем другой, напряжение увеличивается, и наоборот.
Кроме генерирования, трансформации электроэнергии магнитная индукция применяется в иных устройствах. Например, в магнитных левитационных поездах, которые двигаются не в непосредственном контакте с рельсами, а на несколько сантиметров выше из-за электромагнитной силы отталкивания.
Видео
Оцените статью:В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Показать решение »
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg0 -2e— = Mg2+
К: Cu2+ +2e— = Cu
Mg0 + Cu2+ = Mg2+ + Cu
Mg + CuSO4 = MgSO4 + Cu
Вычислим ЭДС гальванического элемента:
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Mg2+/Mg
E0Cu2+/Cu = +0,337 В
E0Mg2+/Mg = -2,37 В
ЭДС =0,337 + 2,37 = 2,71 В
Определим энергию химической реакции:
ΔG0298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Показать решение »
Решение.
E02H+/h3 = 0,00 В
E0Pb2+/Pb = -0,126 В
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb0 -2e— = Pb2+
К: 2H+ +2e— = H2
Pb0 + 2H+= Pb2+ + H2
Определим электродный потенциал свинца:
E = E° + (0,059/n)lgC
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = E0кат — E0ан = E02H+/h3 — E0Pb2+/Pb
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Ni2+/Ni и E0Cu2+/Cu
E0Ni2+/Ni = -0,250 В
E0Cu2+/Cu = +0,337 В
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni0 -2e— = Ni2+
К: Cu2+ +2e— = Cu0
Ni0 + Cu2+ = Ni2+ + Cu0
Ni0 + CuSO4 = NiSO4 + Cu0
Составим схему гальванического элемента:
(-) Ni0|NiSO4 || CuSO4|Cu0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = E0кат — E0ан = E0Cu2+/Cu — E0Ni2+/Ni
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg2+] = 0,001 моль/л, [Pb2+] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Mg2+/Mg и E0Pb2+/Pb
E0Mg2+/Mg = -2,37 В
E0Pb2+/Pb = -0,126 В
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg0 -2e— = Mg2+
К: Pb2+ +2e— = Pb0
Mg0 + Pb2+ = Mg2+ + Pb0
Составим схему гальванического элемента:
(-) Mg0|Mg2+ || Pb2+|Pb0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
E = E° + (0,059/n)lgC
EMg2+/Mg = -2,37 + (0,059/2)lg0,001 = -2,46 В
EPb2+/Pb = -0,126 + (0,059/2)lg1 = -0,126 В
Рассчитаем стандартную ЭДС реакции
ЭДС = Eкат — Eан = EPb2+/Pb — EMg2+/Mg
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Показать решение »
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E0Mg2+/Mg, E0Co2+/Co, E0Fe2+/Fe, E0Ag+/Ag
E0Mg2+/Mg = -2,37 В
E0Fe2+/Fe = -0,440 B
E0Co2+/Co = -0,277 B
E0Ag+/Ag = +0,799 B
Протекание реакции возможно при условии, когда E0восст < E0ок.
В нашем случае восстановителем является кобальт и условие E0восст < E0ок соблюдается только для пары
Co – Ag.
Co0 + Ag+ = Co2+ + Ag0
Молекулярное уравнение, например:
Co0 + 2AgNO3 = Co(NO3)2 + 2Ag0
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Co) = 1∙59 = 59 г
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Показать решение »
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
E0Ni2+/Ni = -0,250 В
E0Cu2+/Cu = +0,337 В
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni0 -2e— = Ni2+
К: Cu2+ +2e— =
ЭДС гальванического элемента | Задания 251-255
Задание 251.
При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод — в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
Решение:
Гальванический элемент, электроды которого сделаны из одного и того же металла будет работать при условии, что электроды будут опущены в растворы солей с разной концентрацией. Схема гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой – в 0,01М растворе сульфата никеля имеет вид:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность).
Определим электродные потенциалы никелевых электродов при разных концентрациях ионов серебра Ni2+, получим:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,0295 В.
Задание 252.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb2+] = [Мg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
Решение:
Схема данного гальванического элемента
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (—2,37 В) и является анодом, на котором протекает окислительный процесс:
Мg0 — 2 = Mg2+ (1)
Свинец, потенциал которой -0,127 В — катод, т.е. электрод, на котором протекает восстановительный процесс:
Pb2+ + 2 = Pb0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg0 + Pb2+ = Mg2+ + Pb0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Если концентрацию каждого из ионов Mg2+ и Pb2+ увеличить в одинаковое число раз, то ЭДС гальванического элемента не изменится, так как при этом соответственно будут уменьшаться численные значения потенциалов металлов, а разница между значениями их не изменится. Например, при увеличении концентрации ионов в 100 раз концентрация их примет значения 1 моль/л, а потенциалы электродов станут равными стандартным потенциалам металлов, то ЭДС = -0,127 – (-2,37) = 2,243 В.
Ответ: 2,243 В.
Задание 253.
Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором никель является катодом:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg0 — 2 = Mg2+ (1)
Никель, потенциал которой -0,25 В — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ni2+ + 2 = Ni0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg0 + Ni2+ = Mg2+ + Ni0
б) Схема гальванического элемента, в котором никель является анодом:
Никель имеет меньший потенциал (-0,25 В) и является анодом, на котором протекает окислительный процесс:
Ni0 — 2 = Ni2+ (1)
Медь, потенциал которой (+0,34 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Сu2+ + 2 = Сu0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Ni0 + Cu2+ = Ni2+ + Cu0
Задание 254.
Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
Решение:
Стандартные электродные потенциалы железа и серебра соответственно равны -0,44 В и +0,80 В. Исходя из того, что железо имеет более электроотрицательный потенциал, чем водород 0,00 В, то между железом и раствором серной кислоты проходит реакция (железо вытесняет водород из кислоты), и железная пластинка при этом будет уменьшаться по массе:
Fe + H2SO4 = FeSO4 + H2
Исходя из того, что серебро имеет более электроположительный потенциал, чем водород, то между серебром и раствором серной кислоты реакция не проходит. Но так как железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты, то между ними будет проходить окислительно-восстановительный процесс, в котором железная пластина будет анодом, а серебряная – катодом.
На аноде протекает процесс:
Fe0 → Fe2+ + 2
На катоде серебряной пластинке будут разряжаться ионы водорода:
2Н+ + 2 → Н20
Схема гальванического элемента имеет вид:
(-) Fe | Fe2+ || 2H+ | H2, Ag (+)
Задание 255.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
Решение:
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg0 — 2 = Mg2+ (1)
Кадмий, потенциал которой (-0,403 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Cd2+ + 2 = Cd0 (2)
Схема гальванического элемента имеет вид:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Рассчитаем электродные потенциалы магния и кадмия при концентрации их ионов в растворе равной 0,01 моль/л:
Рассчитаем ЭДС:
Таким образом, ЭДС гальванического элемента при равном уменьшении концентрации ионов металлов в их растворах не изменяется.
Ответ: 1,967 В.
EMF Расчет и измерение электронная книга

«EMF Meter Expertise»
Расчет ЭДС может быть выполнен уверенно и легко с этим практическим обучением с самостоятельным руководством, записанным и записанным на видео профессиональным инженером-электриком Крисом Янгом, чтобы провести вас через этап оценки воздействия ЭМП шаг за шагом, начиная с советов по получению лучшего измерителя для вашей конкретной ситуации, проведения точных измерений измерителя, понимания и применения руководящих принципов EMF по биологической безопасности и многого другого.
Включает в себя множество практических видеороликов (практические руководства по потоковому видео), а также иллюстративные фотографии, ресурсы, рабочие листы и руководящие указания по безопасности на биологической основе.
Этот тренинг, написанный на английском языке, с минимумом математических понятий, предназначен для того, чтобы реальные люди измерить их дом или офис и выявить проблемы безопасности ЭДС. Даже более сложные электромагнитные вопросы «интерпретируются» шаг за шагом от инженера — говорите на знакомом языке, чтобы быть менее пугающим и более понятным, и этот подход также включает в себя полезные видео, изображения, иллюстрации.
Вы можете приступить к расчетам ЭДС в вашей среде в течение нескольких минут и найти информацию о регистрации в курсе обучения, включая варианты раздельных платежей, для EMF Meter Expertise Expertise и других высокоуровневых учебных курсов ЭДС с самостоятельным управлением в . EMF Experts Classroom
Вот Оглавление, чтобы дать вам краткий обзор содержания.
СОДЕРЖАНИЕ
ГЛАВА 1 Зачем измерять ЭДС
ГЛАВА 2 Что
измерять.
2.1 Область измерений
2.2 Электрическое поле
2.3 Магнитное поле
2.4 Радиочастотное поле.
ГЛАВА 3 Как
измерять.
3.1 Цель
3.2 Что записывать
3.3 Факторы окружающей среды
3.4 Положение.
3,5 Самостоятельно выполнено или по контракту.
3.6 Испытательные лаборатории
ГЛАВА 4 Когда
измерять.
4.1 День недели.
4.2 Время дня
4.3 Для максимума или минимума.
4.4 До и после
ГЛАВА 5 Измерительные приборы.
5.1 Типы счетчиков
5.2 Шкалы счетчиков
5.3 Точность
5.4 Чувствительность
5.5 Разрешение.
5.6 Частота
5.7 Калибровка ЭДС.
5.8 Направленность
5.9 Зонды
5.10 Мгновенно
Vs Среднее
5,11 Шум
5,12 Запись
5,13 Метр инвентаризации
ГЛАВА 6 Расчет и измерение ЭДС
6.1 Записывающие приборы
6.2 Пик против среднего
6.3 Позиция.
6.4 Направление.
6.5 Окружающая среда
6.6 Повторяемость
6.7 Единицы
6.8 Рекомендации
ГЛАВА 7 Использование
Измерения
7.1 Сравнить стандарты
7.2 Выявить горячие точки
7.3 Доказать эффективность восстановления.
7.4 Определить местонахождение источников ЭДС.
7.5 Выбор решений
ГЛАВА 8 Мониторинг изменений во времени
8.1 Циклические изменения
8.2 Прогрессивные изменения
8.3 Изменения в деятельности
ГЛАВА 9 ВИДЕОУЗЫ И РЕСУРСЫ
9.1 Учебные видеоролики (Кухня, Ванная комната, Спальня)
9.2 Контрольный список измерений для различной среды с,
мест (включая транспортные средства, общественные места и т. д. )
9.3 Эскиз плана здания для показаний счетчиков ЭДС / аннотации с
9.4 Стандарты и руководящие указания по ЭДС (текущие и предупредительные)
9.5 быстрых таблиц преобразования единиц
9.6 Формулы преобразования: EMF & EMR
EMF Руководство по расчетам и измерениям
В данное обучение включены иногда устрашающие Рекомендации по расчетам, преобразованию и измерению ЭДС и Стандарты безопасности ЭДС, которые в настоящее время используются профессионалами EMF во всем мире, но здесь вы найдете их разработанными, чтобы быть удобными для пользователя и «переведенными» с Engineer-Speak на (легко понять и следовать) простой английский.
«EMF Meter Expertise » — это 80-страничное учебное пособие по самостоятельной работе с измерительными приборами, которое включает в себя обучение счетчиков для тех, кто хочет больше узнать о различных измерительных приборах EMF и о том, как работать с их функциями и их неисправностями. Он также предлагает справочные ресурсы, рабочие листы, руководства по биологической безопасности и многое другое, и поставляется с обширной видео-библиотекой по измерительным приборам, состоящей из десятков обучающих видеороликов по обнаружению и защите от ЭМП, исследующих различные распространенные ситуации воздействия ЭМП с использованием различных легко доступных ЭДС-измерителей.
Узнав об электро-загрязнении вы
являются первым шагом к принятию надлежащих и эффективных мер по ликвидации или
хотя бы уменьшить угрозы вашему здоровью. Этот ценный тренинг, состоящий из учебного пособия и видео-библиотеки с практическими рекомендациями, которые дают исчерпывающие знания о измерителях ЭМП и их спецификациях, демонстрирует десятки исследований ЭМП с использованием различных измерителей, является одним из практических практических текстов курса. это ключ к нашему обучению сертификации.
Найдите EMF Meter Expertise и другие высокоуровневые учебные курсы по ЭДС с самоуправлением в EMF Experts Classroom
Связанное обучение EMF Meter:
EMF Meter Know How: Самостоятельный курс, разработанный для того, чтобы помочь любому, включая начинающих, заработать Как точно измерить и правильно оценить воздействие ЭМП в вашей среде с уверенностью.
Этот углубленный учебный курс, состоящий из 7 частей, предлагается в виде стоп-кадра и демонстрируется на популярном счетчике TF2 TriField, но он подходит для счетчиков с тремя полями или комбинации приборов любой марки, которые измеряют: электрические, магнитные и радио / микроволновые поля.Он включает в себя пошаговые инструкции по биологической безопасности на рабочих листах для измерения и учебную видеобиблиотеку, в которой вы узнаете, как правильно использовать измеритель ЭДС (и особенно измеритель TF2). См. Обширный список учебных тем, охватываемых учебной программой EMF Meter Know 7 Part Course.
Find EMF Meter Know-How и другие высокоуровневые учебные курсы по ЭДС с самоуправлением в EMF Experts Classroom
,
Электромагнитное поле (ЭДС)
Расчет электромагнитного поля (ЭДС) является одним из факторов , который необходимо учитывать в процессе проектирования , особенно для высоковольтных линий электропередачи. Обычно на основании этих расчетов проектировщик или планировщик может определить Право на ряд (ROW) линии электропередачи.
 Расчет электромагнитного поля (ЭДС) вокруг воздушных линий T & D, г-нМихал Лишка
Расчет электромагнитного поля (ЭДС) вокруг воздушных линий T & D, г-нМихал ЛишкаКроме того, результаты моделирования, подготовленные на этапе проектирования, могут указать на воздействие на окружающую среду, которое гарантирует, что исходящее решение не будет представлять опасность для людей и окружающей природы.
Это факт, поскольку в худшем случае неправильное решение может даже заблокировать реализацию инвестиций . Из-за предполагаемых причин важно принять во внимание расчеты ЭДС, чтобы использовать лучшее решение, касающееся как экономики, так и окружающей среды.
Представленное программное обеспечение содержит инструмент, который позволяет проводить расчеты ЭДС вокруг воздушных линий передачи и распределения . Результаты расчетов представлены на графических диаграммах в виде распределения ЭДС.
Разрешено рассчитывать ЭДС для 1 линии цепи, а также для 2 линии цепи. В каждом из случаев заземляющие провода могут быть рассмотрены. Кроме того, используя разные случаи, можно смешивать и создавать основные примеры линий электропередач, где две независимые линии взаимодействуют друг с другом.
Электромагнитное полерассчитывается в соответствии с аналитическим подходом, описанным в Красной книге EPRI «Справочник по линиям электропередачи» . Точность этих расчетов ЭДС была проверена с помощью другого коммерческого программного обеспечения.
Распределение проводов пассивного контура (PLW) и звукового шума (AN)
Помимо расчетов ЭДС добавлены и другие дополнительные функции:
Модель пассивного контура (PLW) , предназначенная для ослабления магнитного поля.Это дает возможность имитировать влияние пассивной петли, подвешенной под токоведущими проводниками в пролете. Магнитное поле смягчается посредством индуцированного тока, который протекает через замкнутый контур.
На основании литературы это решение было протестировано в некоторых реальных приложениях, поэтому его можно рассматривать как меру ограничения магнитного поля.
Распределение звукового шума (AN) вокруг линий электропередачи. Расчет звукового шума строго связан с ЭДС, потому что уровень звукового шума является еще одним фактором, влияющим на правильность процесса проектирования линии.Эта программа позволяет производить расчеты по трем различным методам, определенным тремя независимыми авторами. EPRI, BPA и PN-N-01339: 2000 (польский стандарт).
Результаты расчетов представлены в виде поперечного распределения, где изображены разные кривые и представляют разные значения показателей.
В сочетании с расчетами ЭДС проектировщик получает полный спектр информации о воздействии окружающей среды на окружающую среду линии электропередачи , а также может указывать ограничения здания.
| Программное обеспечение: | Расчет электромагнитного поля (ЭДС) вокруг линий электропередачи и распределения |
| Версия: | v.01 (включает английскую и польскую версии плюс руководство пользователя в PDF) |
| Разработчик: | г-н Михал Лишка (liszka.mliszk AT GMAIL DOT-COM) |
| Размер: | 2.20 МБ (.zip) |
| Цена: | бесплатно |
| Загрузить: | Прямо здесь | Получите Больше с Премиум Членством | Скачать Скачать обновления |
 Расчет электромагнитного поля (ЭМП) вокруг воздушных линий T & D, г-н Михал Лишка
,
Расчет электромагнитного поля (ЭМП) вокруг воздушных линий T & D, г-н Михал Лишка
,уравнение ЭДС синхронного генератора
Генератор, который работает с синхронной скоростью, известен как синхронный генератор. Синхронный генератор преобразует механическую энергию в электрическую энергию для сети. Вывод ЭДС Уравнение синхронного генератора приводится ниже.
лет,
- P — количество полюсов
- ϕ — поток на полюс в Webers
- Н — скорость вращения в минуту (об.стр.)
- f частота в герцах
- Z ph — количество проводников, соединенных последовательно на фазу
- T ph — число последовательно соединенных витков на фазу
- K c — коэффициент пролета катушки
- K d — коэффициент распределения
Поток, обрезанный каждым проводником за один оборот, задается как Pϕ Weber. Время, необходимое для завершения одного оборота, задается как 60 / N с
Средняя ЭДС, индуцированная на проводник, будет определяться уравнением, показанным ниже
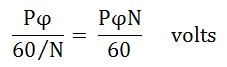
Среднее значение ЭДС, индуцированное на фазу, будет определяться уравнением, показанным ниже
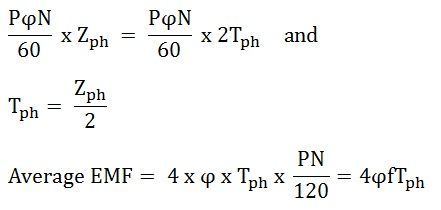
Среднее уравнение ЭДС выводится из следующих предположений, приведенных ниже.
- Катушки получили полный шаг.
- Все проводники сосредоточены в одном пазу статора.
Среднеквадратичное значение (R.M.S) ЭДС, индуцированной на фазу, определяется уравнением, показанным ниже.
E ph = среднее значение x форм-фактор
Следовательно,
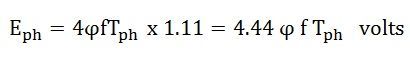
Если учитывается коэффициент размаха катушки K c и коэффициент распределения K d, , то фактическая ЭДС, индуцированная на фазу, задается как
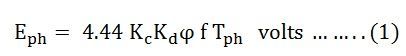
Уравнение (1), показанное выше, является уравнением ЭДС синхронного генератора.
Коэффициент пролета катушки
Коэффициент интервала катушки определяется как отношение индуцированной эдс в катушке, когда обмотка короткого шага, к индуцированной эдс в той же катушке, когда обмотка заполнена полностью.
Фактор распределения
Коэффициент распределения определяется как отношение индуцированной ЭДС в группе катушек, когда обмотка распределена в нескольких слотах, к индуцированной ЭДС в группе катушек, когда обмотка сосредоточена в одной канавке.
,Измерение и расчет ЭДС
Измерение электрических и магнитных полей
Это довольно технический обзор принципов измерения — для более простой версии см. Предыдущий переключатель.
Первые коммерческие приборы, разработанные специально для измерения частотных полей, стали доступны в 1980-х годах. В настоящее время доступно много инструментов, которые различаются по различным характеристикам:
(a) Количество осей обнаружения . Там нет датчиков, которые непосредственно оценивают результирующее поле в случайном направлении в пространстве; Датчики обычно измеряют поле в одном направлении.Счетчик может иметь один датчик. Если он выровнен пользователем по направлению максимального поля, это даст показание максимального поля в одном направлении; общее результирующее поле может в 1,0-1,41 раза превышать это значение в зависимости от степени поляризации. Если счетчик имеет три ортогональных датчика, результирующее поле может быть получено из трех значений, измеренных путем сложения корней и суммы квадратов: Resultant = (X 2 + Y 2 + Z 2 ) 1 / 2
Это результирующее значение не зависит от ориентации счетчика, что значительно упрощает его использование.
Подробнее об эллиптически поляризованных полях
(b) Мера поля . Возможны различные измерения синусоидальной волны, например, пик, выпрямленное среднее, среднеквадратичное (среднеквадратичное значение). Для одной частоты, то есть для чистой синусоидальной волны, их можно масштабировать для получения того же результата, но при наличии гармоник они могут значительно различаться. В отсутствие известного биофизического механизма нет убедительных оснований утверждать, что какая-либо мера является правильной.Однако по аналогии с другими областями науки об измерениях существует предположение, что среднеквадратическое значение является предпочтительной мерой. Некоторые метры фиксируют фактическую форму волны для последующего анализа.
(с) АЧХ . Инструменты могут быть чувствительными к одной частоте, например, 50 Гц или 60 Гц или диапазон частот. Если чувствительность к диапазону частот, отклик может быть плоским или может быть пропорционален частоте. Плоская частотная характеристика между 20 или 30 Гц и несколькими килогерцами обычно считается подходящей для многих измерений общего назначения.
(d) Размер датчиков . Датчики могут быть сделаны маленькими — несколько миллиметров — и поэтому способны исследовать изменения поля на небольших расстояниях. Однако могут также быть случаи, когда желательно использовать датчики большего размера, которые измеряют среднее поле по своей площади. Вот два разных способа изготовления прибора с магнитным полем:
Датчик слева имеет три катушки, центрированные друг на друге. Они имеют воздушную сердцевину, и для получения необходимой чувствительности у них есть тысячи витков провода.Эти примеры имеют площадь 10 см.
Датчик справа имеет намного меньшие катушки, чтобы уменьшить общий счетчик. Чтобы получить чувствительность, несмотря на меньшие размеры, катушки имеют железные сердечники. Это означает, что они не могут быть сосредоточены на одной точке; они расположены отдельно, под прямым углом друг к другу (два плоских на печатной плате внизу слева, третий, вертикальный, катушка снабжена белой механической опорой внизу справа).
(e) Считывание и регистрация .Счетчики могут иметь аналоговые или цифровые дисплеи. Они могут отображать значение только в реальном времени или могут регистрировать значения с различной степенью сложности и рассчитывать различные параметры поля, такие как средние значения или максимумы.
Учитывая различия в оборудовании, предоставляемом счетчиком, неизбежны различия в размере, весе и расходе батареи. Некоторые счетчики лучше всего подходят для детальных исследований экспертов; другие маленькие и достаточно легкие, чтобы волонтеры носили их длительное время.
Нет «правильного» или «лучшего» счетчика. Лучший счетчик для использования зависит от цели, для которой он будет использоваться.
Измерение магнитных полей
Для измерения магнитных полей широко используются три различных датчика:
(a) Поисковые катушки . Простейшие измерители измеряют напряжение, наведенное в катушке провода. Для синусоидально изменяющегося магнитного поля B частоты f напряжение V, индуцированное в катушке, определяется следующим образом:
V = -2 π f B 0 A cos (ω t)
где ω = 2 π f — частота поля, а A — площадь петли, а B 0 — компонент B, перпендикулярный петле.
Напряжение, вызванное данным полем, увеличивается с добавлением большего числа витков провода или ферромагнитного сердечника — см. Примеры выше. Для предотвращения помех от электрических полей датчик магнитного поля должен быть экранирован. Если измеритель используется для съемок или измерений личного облучения, частоты ниже приблизительно 30 Гц должны быть отфильтрованы для удаления напряжений, наведенных в зонде при движении измерителя в магнитном поле Земли.
(b) Флюсгейт магнитометры .Они обнаруживают магнитное поле по асимметрии, которую оно создает в ферромагнитном материале, намеренно приводимом в магнитное насыщение попеременно в противоположных направлениях на высокой частоте.
(с) Устройства с эффектом Холла . Датчик предназначен для измерения поперечного напряжения Холла на тонкой полоске полупроводникового материала, несущего продольный ток.
В большинстве практических приборов для измерения частот используются поисковые катушки, либо одна катушка, либо три ортогональные катушки.Сами катушки могут быть сделаны как можно меньшими, с ферромагнитным сердечником для повышения чувствительности, для использования в персональных экспонометрах, где размер и вес являются важными критериями; или они могут быть больше, часто 0,1 м в поперечнике, чтобы увеличить чувствительность и обеспечить некоторое пространственное усреднение. Магнитометры с флюксгейтом не могут быть такими же маленькими или дешевыми, но имеют то преимущество, что они реагируют как на поля постоянного тока, так и на переменный ток. Устройства Холла мало используются, так как их разрешение хуже, и они страдают от дрейфа, но имеют применение в более высоких полях.
Измерение электрических полей
Измерители электрических полей обычно используют в качестве датчиков две параллельные проводящие пластины. Альтернативные датчики, например основанные на вращении поляризованного света, встречаются реже.
Имеются трехосные счетчики электрического поля, но одноосные счетчики встречаются чаще. Это отчасти потому, что для электрических полей сделать трехосные счетчики сложнее, чем для магнитных полей, и отчасти потому, что в одной общей ситуации измерения, вблизи земли под или вблизи воздушных линий электропередачи, электрическое поле линейно поляризовано и в известной направление (вертикальное), и, следовательно, одноосного измерителя вполне достаточно.
Человек, имеющий счетчик электрического поля, возмущает поле. Чтобы измерить невозмущенное поле, измеритель обычно подвешен на конце длинного непроводящего горизонтального стержня или вертикального штатива. Показания считываются с расстояния на дисплее подходящего размера, записываются в измеритель для последующего анализа или передаются на устройство считывания по оптоволоконному кабелю. Это может снизить возмущение до приемлемых уровней. Однако, учитывая легкость возмущения электрических полей, легко проводить ошибочные измерения, особенно когда есть:
- крайних значений температуры и влажности;
- недостаточное расстояние от зонда до следователя;
- нестабильность в положении метра;
- потери непроводящих свойств опорного штока.
Электрические поля также могут быть измерены в фиксированных местах, например, под линиями электропередачи или в лабораторных камерах воздействия путем измерения тока, собираемого плоской проводящей пластиной, расположенной на уровне земли Для синусоидальных полей плотность электрического потока можно рассчитать из площади пластины (A), диэлектрической проницаемости вакуума, частоты (f) и измеренного тока, индуцированного в пластине, в выражении ниже:
E = I среднеквадратичное значение / 2πfε 0 A
Для электрических полей существуют персональные экспонометры.Однако, надевая на теле метр, возмущает измеряемое электрическое поле непредсказуемым образом. Как правило, там, где измеряется воздействие электрических полей больших групп субъектов, измеритель помещается в повязку, карман рубашки или сумку для ремня. Возмущение окружающего поля телом исключает получение абсолютного значения поля, и в лучшем случае среднее значение таких измерений отражает относительный уровень воздействия.

