Сравнение меди и стали при использовании в качестве молниеотводов, молниеприемников, заземлителей и заземляющих проводников
При прохождении тока молнии в молниеотводе происходит выделение теплоты согласно закону Джоуля-Ленца. Температура проводника увеличивается прямо пропорционально его электрическому сопротивлению.
Согласно нормативной документации молниеотводы выполняют из проволоки сечением более 50 мм2. Ближайшим стандартным калибром проволоки является проводник с круглым сечением диаметром 8 мм (50,24 мм2). В большинстве случаев именно его рекомендуют использовать специалисты.
Поскольку сопротивление меди на порядок ниже сопротивления стали, температура нагрева молниеотвода при протекании тока молнии соответственно составит: медь 122ºС и сталь около 1000ºС. Учитывая то, что температура плавления стали превышает 1300ºС, молниеотвод способен единовременно выдержать однократное воздействие молнии. Однако, при одновременных повторных ударах проводник может перегреться и расплавиться.
медь сталь
| медь | сталь | |
| температура нагрева молниеотвода ø8 мм при протекании тока молнии | 122ºС | ≈1000ºС |
| температура плавления | 1000ºС | 1300ºС |
Эти специфичные свойства стальных молниеотводов следует принимать в расчет при проектировании, выбирая конструкции крепления.
Различный состав обуславливает разную устойчивость к бактериальной коррозии. Медь устойчива к коррозии в грунте, а сталь подвержена разрушению.
Во влажном воздухе медь медленно окисляется и темнеет, образуя на поверхности слой оксида меди, который «консервирует» металл, в дальнейшем предотвращая коррозию. В аналогичных условиях сталь со временем полностью корродирует. Чтобы предотвратить окисление стали, ее покрывают слоем цинка (оцинкованная сталь).
Медь ‒ отличный проводник, проводимость меди многократно превышает проводимость стали.
медь сталь
| медь | сталь | |
| электрическая проводимость | 58,1х106 Ом/м | 7,7х106 Ом/м |
| электрическое сопротивление | 1,72х10-8 Ом*м | 13х10-8 Ом*м |
Сталь представляет собой металлический сплав, а медь ‒ чистый металл. Сталь состоит из железа и углерода, тогда как медь является химическим элементом (Cu атомный номер 29).
Просмотров: 4978| Опубликовано: Среда, 15 Февраль 2017 19:11|
| Материал | Проводимость | Сопротивление | |
| (% IACS) | (Сименс/м) | (Ом*м) | |
| Железо и чугун | |||
| Железо чистое | 18.00 | 1.044*107 | 9.579*10-8 |
| В слитке Iron Ingot (непр.назв.ignot) (99.9% Fe) | 15.60 | 9.048*106 | 1.105*10-7 |
| Низкоуглеродистый белый чугун | 5.300*10-7 | ||
|
Мартенситное хромо-никелевое (стое) железо /martensitic nickel-chromium iron |
2.16 | 8.000*10-7 | |
| Высококремнистый чугун / high-silicon iron | 3.45 | 5.000*10-7 | |
| Железо-никелевые сплавы/ h igh-nickel iron | 1.0-1.2 | 1.4*10-6—1.7*10-6 | |
| Хромо-никелевое кремнистое железо / nickel-chromium-silicon iron | 1.0-1.2 | 1.5*10-6—1.7*10-6 | |
| Алюминиево-железные сплавы/ high-aluminum iron | 0.72 | 2.400*10-6 | |
| Кремнистый чугун/ medium-silicoon ductile iron | 2.0-3.0 | 5.8*10-7—8.7*10-7 | |
| Ниель-железные сплавы / high-nickel ductile (20% Ni) | 1.69 | 1.020*10-6 | |
| Углеродистые и низколегированные стали. AISI | |||
| 1008 (Отожженная) | 11.81 | 1.460*10-7 | |
| 1010 | 12.06 | 1.430*10-7 | |
| 1015 (Отожженная) | 10.84 | ||
| 1016 (Отожженная) | 10.78 | 1.600*10-7 | |
| 1018 (Отожженная) | 10.84 | 1.590*10-7 | |
| 1020 | 10.84 | 1.590*10-7 | |
| 1022 (Отожженная) | 10.84 | 1.590*10-7 | |
| 1025 (Отожженная) | 1.590*10-7 | ||
| 1029 (Отожженная) | 10.78 | 1.600*10-7 | |
| 1030 (Отожженная) | 10.39 | 1.660*10-7 | |
| 1035 (Отожженная) | 10.58 | 1.630*10-7 | |
| 1040 (Отожженная) | 10.78 | 1.600*10-7 | |
| 1042 (Отожженная) | 10.08 | 1.710*10-7 | |
| 1043 (Отожженная) | 10.58 | 1.630*10-7 | |
| 1045 (Отожженная) | 10.64 | 1.620*10-7 | |
| 1046 | 10.58 | 1.630*10-7 | |
| 1050 (Отожженная) | 10.58 | 1.630*10 |
|
| 1055 | 10.58 | 1.630*10-7 | |
| 1060 | 9.58 | 1.800*10-7 | |
| 1065 | 10.58 | 1.630*10-7 | |
| 1070 | 10.26 | 1.680*10-7 | |
| 1078 (Отожженная) | 9.58 | ||
| 1080 | 9.58 | 1.800*10-7 | |
| 1095 | 9.58 | 1.800*10-7 | |
| 1137 | 10.14 | 1.700*10-7 | |
| 1141 | 10.14 | 1.700*10-7 | |
| 1151 | 10.14 | 1.700*10-7 | |
| 1524 | 8.29 | 2.080*10-7 | |
| 1524 (Отожженная) | 10.78 | 1.600*10-7 | |
| 1552 | 10.58 | 1.630*10-7 | |
| 4130 (Закаленная и отпущенная) | 7.73 | 2.230*10-7 | |
| 4140 (Закаленная и отпущенная) | 7.84 | 2.200*10-7 | |
| 4626 (Нормализованная и отпущенная) | 8.62 | 2.000*10-7 | |
| 4815 | 6.63 | 2.600*10-7 | |
| 5132 | 8.21 | 2.100*10-7 | |
| 5140 (Закаленная и отпущенная) | 7.56 | 2.280*10 |
|
|
Холоднодеформированные нержавеющие стали отожженные AISI |
|||
| 201 | 2.50 | 6.900*10-7 | |
| 202 | 2.50 | 6.900*10-7 | |
| 301 | 2.39 | 7.200*10-7 | |
| 302 | 7.200*10-7 | ||
| 302B | 2.39 | 7.200*10-7 | |
| 303 | 2.39 | 7.200*10-7 | |
| 304 | 2.39 | 7.200*10-7 | |
| 302Cu | 2.39 | 7.200*10-7 | |
| 304N | 2.39 | 7.200*10-7 | |
| 304 | 2.50 | 1.450*106 | 6.897*10-7 |
| 304 | 2.50 | 1.450*106 | 6.897*10-7 |
| 305 | 2.39 | 7.200*10-7 | |
| 308 | 2.39 | 7.200*10-7 | |
| 309 | 2.21 | 7.800*10-7 | |
| 310 | 2.21 | 7.800*10-7 | |
| 314 | 2.24 | 7.700*10-7 | |
| 316 | 2.33 | 7.400*10-7 | |
| 316N | 2.33 | 7.400*10-7 | |
| 316 | 2.30 | 1.334*106 | 7.496*10-7 |
| 317 | 2.33 | 7.400*10-7 | |
| 317L | 2.18 | 7.900*10-7 | |
| 321 | 2.39 | 7.200*10-7 | |
| 329 | 2.30 | 7.500*10-7 | |
| 330 | 1.69 | 1.020*10-6 | |
| 347 | 2.36 | 7.300*10-7 | |
| 347 | 2.40 | 1.392*106 | 7.184*10-7 |
| 384 | 2.18 | 7.900*10-7 | |
| 405 | 2.87 | 6.000*10-7 | |
| 410 | 3.02 | 5.700*10-7 | |
| 414 | 2.46 | 7.000*10-7 | |
| 416 | 3.02 | 5.700*10-7 | |
| 420 | 3.13 | 5.500*10-7 | |
| 429 | 2.92 | 5.900*10-7 | |
| 430 | 2.87 | 6.000*10-7 | |
| 430F | 2.87 | 6.000*10-7 | |
| 431 | 2.39 | 7.200*10-7 | |
| 434 | 2.87 | 6.000*10-7 | |
| 436 | 2.87 | 6.000*10-7 | |
| 439 | 2.74 | 6.300*10-7 | |
| 440A | 2.87 | 6.000*10-7 | |
| 440C | 2.87 | 6.000*10-7 | |
| 444 | 2.78 | 6.200*10-7 | |
| 446 | 2.57 | 6.700*10-7 | |
| PH 13-8 Mo | 1.69 | 1.020*10-6 | |
| 15-5 PH | 2.24 | 7.700*10-7 | |
| 17-4 PH | 2.16 | 8.000*10-7 | |
| 17-7 PH | 2.08 | 8.300*10-7 | |
| Холоднодеформированные и спеченные суперсплавы (супераллои, супералои) | |||
| Elgiloy | 1.73 | 9.950*10-7 | |
| Hastelloy Хастеллой «A» | 1.40 | 8.120*105 | 1.232*10-6 |
| Hastelloy Хастеллой»B» и «C» | 1.30 | 7.540*105 | 1.326*10-6 |
| Hastelloy Хастеллой»D» | 1.50 | 8.700*105 | 1.149*10-6 |
| Hastelloy Хастеллой»X» | 1.50 | 8.700*105 | 1.149*10-6 |
| Haynes 150 | 2.13 | 8.100*10-7 | |
| Haynes 188 | 1.87 | 9.220*10-7 | |
| Haynes 230 | 1.38 | 1.250*10-6 | |
| Incoloy 800 Инкаллой | 1.74 | 9.890*10-7 | |
| Incoloy 825 | 1.53 | 1.130*10-6 | |
| Incoloy 903 | 2.83 | 6.100*10-7 | |
| Incoloy 907 | 2.47 | 6.970*10-7 | |
| Incoloy 909 | 2.37 | 7.280*10-7 | |
| Inconel 600 Инконель | 1.70 | 9.860*105 | 1.014*10-6 |
| Inconel 600 | 1.67 | 1.030*10-6 | |
| Inconel 601 | 1.45 | 1.190*10-6 | |
| Inconel 617 | 1.41 | 1.220*10-6 | |
| Inconel 625 | 1.34 | 1.290*10-6 | |
| Inconel 690 | 11.65 | 1.480*10-7 | |
| Inconel 718 | 1.38 | 1.250*10-6 | |
| Inconel X750 | 1.41 | 1.220*10-6 | |
| L-605 | 1.94 | 8.900*10-7 | |
| M-252 | 1.58 | 1.090*10-6 | |
| MP35N | 1.71 | 1.010*10-6 | |
| Nimonic? 263 | 1.50 | 1.150*10-6 | |
| Nimonic 105 | 1.32 | 1.310*10-6 | |
| Nimonic 115 | 1.24 | 1.390*10-6 | |
| Nimonic 75 | 1.39 | 1.240*10-6 | |
| Nimonic 80A | 1.36 | 1.270*10-6 | |
| Nimonic 90 | 1.46 | 1.180*10-6 | |
| Nimonic PE.16 | 1.57 | 1.100*10-6 | |
| Nimonic PK.33 | 1.37 | 1.260*10-6 | |
| Rene 41 | 1.32 | 1.308*10-6 | |
| Stellite 6B Стеллит, стелит | 1.89 | 9.100*10-7 | |
| Udimet 500 | 1.43 | 1.203*10-6 | |
| Waspaloy | 1.39 | 1.240*10-6 | |
таблица удельного сопротивления меди, алюминия и других металлов
 Как нам известно из закона Ома, ток на участке цепи находится в следующей зависимости: I=U/R. Закон был выведен в результате серии экспериментов немецким физиком Георгом Омом в XIX веке. Он заметил закономерность: сила тока на каком-либо участке цепи прямо зависит от напряжения, которое к этому участку приложено, и обратно — от его сопротивления.
Как нам известно из закона Ома, ток на участке цепи находится в следующей зависимости: I=U/R. Закон был выведен в результате серии экспериментов немецким физиком Георгом Омом в XIX веке. Он заметил закономерность: сила тока на каком-либо участке цепи прямо зависит от напряжения, которое к этому участку приложено, и обратно — от его сопротивления.
Позже было установлено, что сопротивление участка зависит от его геометрических характеристик следующим образом: R=ρl/S,
где l- длина проводника, S — площадь его поперечного сечения, а ρ — некий коэффициент пропорциональности.
Таким образом, сопротивление определяется геометрией проводника, а также таким параметром, как удельное сопротивление (далее — у. с.) — так назвали этот коэффициент. Если взять два проводника с одинаковым сечением и длиной и поставить их в цепь по очереди, то, измеряя силу тока и сопротивление, можно увидеть, что в двух случаях эти показатели будут разными. Таким образом, удельное электрическое сопротивление — это характеристика материала, из которого сделан проводник, а если быть еще более точным, то вещества.
Проводимость и сопротивление
У.с. показывает способность вещества препятствовать прохождению тока. Но в физике есть и обратная величина — проводимость. Она показывает способность проводить электрический ток. Выглядит она так:
σ=1/ρ, где ρ — это и есть удельное сопротивление вещества.
Если говорить о проводимости, то она определяется характеристиками носителей зарядов в этом веществе. Так, в металлах есть свободные электроны. На внешней оболочке их не больше трех, и атому выгоднее их «отдать», что и происходит при химических реакциях с веществами из правой части таблицы Менделеева. В ситуации же, когда мы располагаем чистым металлом, он имеет кристаллическую структуру, в которой эти наружные электроны общие. Они-то и переносят заряд, если приложить к металлу электрическое поле.
В растворах носителями заряда являются ионы.
Если говорить о таких веществах, как кремний, то по своим свойствам он является полупроводником и работает несколько по иному принципу, но об этом позже. А пока разберемся, чем же отличаются такие классы веществ, как:
- Проводники;
- Полупроводники;
- Диэлектрики.
Проводники и диэлектрики
Есть вещества, которые ток почти не проводят. Они называются диэлектриками. Такие вещества способны поляризоваться в электрическом поле, то есть их молекулы могут поворачиваться в этом поле в зависимости от того, как распределены в них электроны. Но поскольку электроны эти не являются свободными, а служат для связи между атомами, ток они не проводят.
Проводимость диэлектриков почти нулевая, хотя идеальных среди них нет (это такая же абстракция, как абсолютно черное тело или идеальный газ).
Условной границей понятия «проводник» является ρ<10^-5 Ом, а нижний порог такового у диэлектрика — 10^8 Ом.
Между этими двумя классами существуют вещества, называемые полупроводниками. Но выделение их в отдельную группу веществ связано не столько с их промежуточным состоянием в линейке «проводимость — сопротивление», сколько с особенностями этой проводимости в различных условиях.
Зависимость от факторов внешней среды
Проводимость — не совсем постоянная величина. Данные в таблицах, откуда берут ρ для расчетов, существуют для нормальных условий среды, то есть для температуры 20 градусов. В реальности для работы цепи сложно подобрать такие идеальные условия; фактически у.с. (а стало быть, и проводимость) зависят от следующих факторов:
- температура;
- давление;
- наличие магнитных полей;
- свет;
- агрегатное состояние.
Разные вещества имеют свой график изменения этого параметра в разных условиях. Так, ферромагнетики (железо и никель) увеличивают его при совпадении направления тока с направлением силовых линий магнитного поля. Что касается температуры, то зависимость здесь почти линейная (существует даже понятие температурного коэффициента сопротивления, и это тоже табличная величина). Но направление этой зависимости различно: у металлов оно повышается с повышением температуры, а у редкоземельных элементов и растворов электролитов увеличивается — и это в пределах одного агрегатного состояния.
У полупроводников зависимость от температуры не линейная, а гиперболическая и обратная: при повышении температуры их проводимость увеличивается. Это качественно отличает проводники от полупроводников. Вот так выглядит зависимость ρ от температуры у проводников:
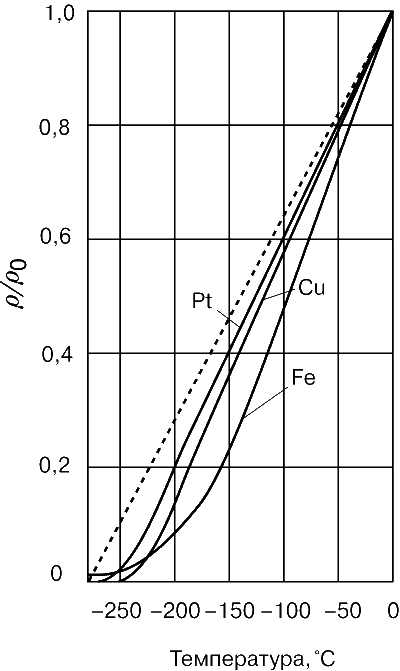
Здесь представлены удельное сопротивление меди, платины и железа. Немного другой график у некоторых металлов, например, ртути — при понижении температуры до 4 К она теряет его почти полностью (такое явление называется сверхпроводимостью).
А для полупроводников эта зависимость будет примерно такая:
При переходе в жидкое состояние ρ металла увеличивается, а вот дальше все они ведут себя по-разному. Например, у расплавленного висмута оно ниже, чем при комнатной температуре, а у меди — в 10 раз выше нормального. Никель выходит из линейного графика еще при 400 градусах, после чего ρ падает.
Зато у вольфрама температурная зависимость настолько высока, что это становится причиной перегорания ламп накаливания. При включении ток нагревает спираль, и ее сопротивление увеличивается в несколько раз.
Также у. с. сплавов зависит от технологии их производства. Так, если мы имеем дело с простой механической смесью, то сопротивление такого вещества можно посчитать по среднему, а вот оно же у сплава замещения (это когда два и более элемента складываются в одну кристаллическую решетку) будет иным, как правило, куда большим. Например, нихром, из которого делают спирали для электроплиток, имеет такую цифру этого параметра, что этот проводник при включении в цепь греется до красноты (из-за чего, собственно, и используется).
Вот характеристика ρ углеродистых сталей:
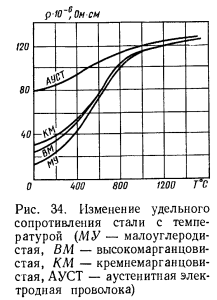
Как видно, при приближении к температуре плавления оно стабилизируется.
Удельное сопротивление различных проводников
Как бы то ни было, а при расчетах используется ρ именно в нормальных условиях. Приведем таблицу, по которой можно сравнить эту характеристику у разных металлов:
| металл | удельное сопротивление, Ом·м | температурный коэффициент, 1/°С* 10^-3 |
| медь | 1,68*10^-8 | 3,9 |
| алюминий | 2,82*10^-8 | 3,9 |
| железо | 1*10^-7 | 5 |
| серебро | 1,59*10^-8 | 3,8 |
| золото | 2,44*10^-8 | 3,4 |
| магний | 4,4*10^-8 | 3,9 |
| олово | 1,09*10^-7 | 4,5 |
| свинец | 2,2*10^-7 | 3,9 |
| цинк | 5,9*10^-8 | 3,7 |
Как видно из таблицы, лучший проводник — это серебро. И только его стоимость мешает массово применять его в производстве кабеля. У.с. алюминия тоже небольшое, но меньше, чем у золота. Из таблицы становится понятно, почему проводка в домах либо медная, либо алюминиевая.
В таблицу не включен никель, у которого, как мы уже сказали, немного необычный график зависимости у. с. от температуры. Удельное сопротивление никеля после повышения температуры до 400 градусов начинает не расти, а падать. Интересно он ведет себя и в других сплавах замещения. Вот так ведет себя сплав меди и никеля в зависимости от процентного соотношения того и другого:
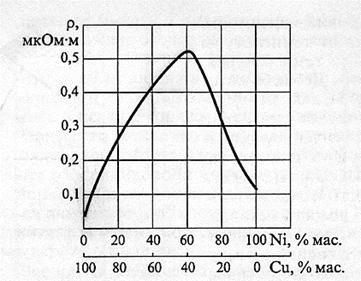
А этот интересный график показывает сопротивление сплавов Цинк — магний:
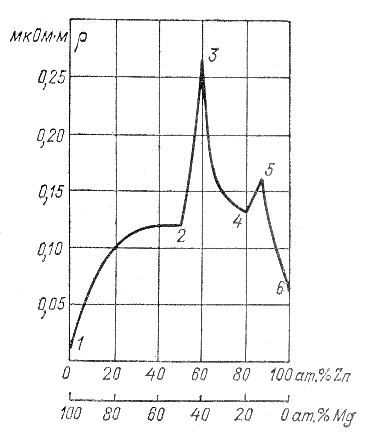
В качестве материалов для изготовления реостатов используют высокоомные сплавы, вот их характеристики:
| сплав | удельное сопротивление |
| манганин | 4,82*10^-7 |
| константан | 4,9*10^-7 |
| нихром | 1,1*10^-6 |
| фехраль | 1,2*10^-6 |
| хромаль | 1,2*10^-6 |
Это сложные сплавы, состоящие из железа, алюминия, хрома, марганца, никеля.
Что касается углеродистых сталей, то оно составляет примерно 1,7*10^-7 Ом · м.
Разница между у. с. различных проводников определяет и их применение. Так, медь и алюминий массово применяются при производстве кабеля, а золото и серебро — в качестве контактов в ряде радиотехнических изделий. Высокоомные проводники нашли свое место среди производителей электроприборов (точнее, они и создавались для этого).
Изменчивость этого параметра в зависимости от условий внешней среды легла в основу таких приборов, как датчики магнитного поля, терморезисторы, тензодатчики, фоторезисторы.
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Физический справочник / / Электрические и магнитные величины / / Электрическое сопротивление и проводимость проводников, растворов, почв…. / / Электропроводимость (электрическая проводимость) и электрическое сопротивление для железа, сталей и суперсплавов. Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
электропроводность, свойства, особенности и применение
Во многих отраслях современной промышленности очень широко используется такой материал, как медь. Электропроводность у этого металла очень высокая. Этим и объясняется целесообразность его применения прежде всего в электротехнике. Из меди получаются проводники с отличными эксплуатационными характеристиками. Конечно же, используется этот металл не только в электротехнике, но и в других отраслях промышленности. Объясняется его востребованность в том числе и такими его качествами, как стойкость к коррозионным разрушениям в ряде агрессивных сред, тугоплавкость, пластичность и т.д.
Историческая справка
Медь является металлом, известным человеку с глубокой древности. Объясняется раннее знакомство людей с эти материалом прежде всего его широкой распространенностью в природе в виде самородков. Многие ученые считают, что именно медь была первым металлом, восстановленным человеком из кислородных соединений. Когда-то горные породы просто нагревали на костре и резко остужали, в результате чего они растрескивались. Позднее восстановление меди начали производить на кострах с добавлением угля и поддувом мехами. Совершенствование этого способа в конечном итоге привело к созданию шахтной печи. Еще позже этот металл начали получать методом окислительной плавки руд.

Медь: электропроводность материала
В спокойном состоянии все свободные электроны любого металла вращаются вокруг ядра. При подключении внешнего источника воздействия они выстраиваются в определенной последовательности и становятся носителями тока. Степень способности металла пропускать сквозь себя последний и называется электропроводностью. Единицей ее измерения в Международной СИ является сименс, определяемый как 1 См = 1 Ом-1.
Электропроводность меди очень высока. По этому показателю она превосходит все известные на сегодня неблагородные металлы. Лучше нее ток пропускает только серебро. Показатель электропроводности меди составляет 57х104 см-1 при температуре в +20 °С. Благодаря такому своему свойству этот металл на данный момент является самым распространенным проводником из всех используемых в производственных и бытовых целях.
Медь отлично выдерживает постоянные электрические нагрузки и к тому же отличается надежностью и долговечностью. Помимо всего прочего, этот металл характеризуется и высокой температурой плавления (1083,4 °С). А это, в свою очередь, позволяет меди долгое время работать в нагретом состоянии. По распространенности в качестве проводника тока конкурировать с этим металлом может только алюминий.

Влияние примесей на электропроводность меди
Конечно же, в наше время для выплавки этого красного металла используются гораздо более совершенные методики, чем в древности. Однако и сегодня получить совершенно чистый Cu практически невозможно. В меди всегда присутствуют разного рода примеси. Это могут быть, к примеру, кремний, железо или бериллий. Между тем, чем больше примесей в меди, тем меньше показатель ее электропроводности. Для изготовления проводов, к примеру, подходит только достаточно чистый металл. Согласно нормативам, для этой цели можно использовать медь с количеством примесей, не превышающем 0.1 %.
Очень часто в этом металле содержится определенный процент серы, мышьяка и сурьмы. Первое вещество значительно снижает пластичность материала. Электропроводность меди и серы сильно различается. Ток эта примесь совершенно не проводит. То есть является хорошим изолятором. Однако на электропроводность меди сера не влияет практически никак. То же самое касается и теплопроводности. С сурьмой и мышьяком наблюдается обратная картина. Эти элементы электропроводность меди способны снижать значительно.
Сплавы
Разного рода добавки могут использоваться и специально для повышения прочности такого пластичного материала, как медь. Электропроводность ее они также снижают. Но зато их применение позволяет значительно продлить срок службы разного рода изделий.

Чаще всего в качестве повышающей прочность меди добавки используется Cd (0.9 %). В результате получается кадмиевая бронза. Ее проводимость составляет 90 % от проводимости меди. Иногда вместо кадмия в качестве добавки используют также алюминий. Проводимость этого металла составляет 65 % от этого же показателя меди. Для повышения прочности проводов в виде добавки могут применяться и другие материалы и вещества — олово, фосфор, хром, бериллий. В результате получается бронза определенной марки. Соединение меди с цинком называется латунью.
Характеристики сплавов
Зависеть электропроводность металлов может не только от количества имеющихся в них примесей, но и от других показателей. К примеру с повышением температуры нагрева способность меди пропускать сквозь себя ток снижается. Оказывает влияние на электропроводность такой проволоки даже способ ее изготовления. В быту и на производстве могут использоваться как мягкие отожженные медные проводники, так и твердотянутые. У первой разновидности способность пропускать сквозь себя ток выше.
Однако больше всего влияют, конечно же, используемые добавки и их количество на электропроводность меди. Таблица ниже представляет читателю исчерпывающую информацию относительно способности пропускать ток наиболее распространенных сплавов этого металла.
Сплав | Состояние (О — отожженная, Т-твердотянутая) | Электропроводность (%) |
Чистая медь | О | 101 |
Т | 98 | |
Оловянная бронза (0.75 %) | О | 55-60 |
Т | 50-55 | |
Кадмиевая бронза (0.9 %) | О | 95 |
Т | 83-90 | |
Алюминиевая бронза (2,5 % А1, 2 % Sn) | О | 15-18 |
Т | 15-18 | |
Фосфористая бронза (7 % Sn, 0,1 % Ρ) | О | 10-15 |
Т | 10-15 |
Электропроводность латуни и меди сравнима. Однако у первого металла этот показатель, конечно же, немного ниже. Но при этом он и выше, чем у бронз. В качестве проводника латунь используется довольно-таки широко. Ток она пропускает хуже меди, но при этом и стоит дешевле. Чаще всего из латуни делают контакты, зажимы и различные детали для радиоаппаратуры.
Медные сплавы высокого сопротивления
Такие проводниковые материалы применяют в основном при изготовлении резисторов, реостатов, измерительных приборов и электронагревательных устройств. Чаще всего для этой цели используются медные сплавы константан и манганин. Удельное сопротивление первого (86 % Cu, 12 % Mn, 2 % Ni) составляет 0.42-0.48 мкОм/м, а второго (60 % Cu, 40 % Ni) — 0.48-0.52 мкОм/м.
Связь с коэффициентом теплопроводности
Удельная электропроводность меди — 59 500 000 См/м. Этот показатель, как уже упоминалось, верен, однако только при температуре +20 оС. Между коэффициентом теплопроводности любого металла и удельной проводимостью существует определенная связь. Устанавливает его закон Видемана — Франца. Выполняется он для металлов при высоких температурах и выражается в такой формуле: K/γ = π2 / 3 (k/e)2T, где y — удельная проводимость, k — постоянная Больцмана, e — элементарный заряд.

Разумеется, существует подобная связь и у такого металла, как медь. Теплопроводность и электропроводность у нее очень высокие. На втором месте после серебра она находится по обоим этим показателям.
Соединение медных и алюминиевых проводов
В последнее время в быту и промышленности начало использоваться электрооборудование все более высокой мощности. Во времена СССР проводка изготавливалась в основном из дешевого алюминия. Новым требованиям ее эксплуатационные характеристики, к сожалению, уже не соответствуют. Поэтому сегодня в быту и в промышленности очень часто алюминиевые провода меняются на медные. Основным преимуществом последних, помимо тугоплавкости, является то, что при окислительном процессе их токопроводящие свойства не уменьшаются.
Часто при модернизации электросетей алюминиевые и медные провода приходится соединять. Делать это напрямую нельзя. Собственно, электропроводность алюминия и меди различается не слишком сильно. Но только у самих этих металлов. Окислительные же пленки у алюминия и меди свойства имеют неодинаковые. Из-за этого значительно снижается проводимость в месте соединения. Окислительная пленка у алюминия отличается гораздо большим сопротивлением, чем у меди. Поэтому соединение этих двух разновидностей проводников должно производиться исключительно через специальные переходники. Это могут быть, к примеру, зажимы, содержащие пасту, защищающую металлы от появления окиси. Данный вариант переходников обычно используется при соединении проводов на улице. В помещениях чаще применяются ответвительные сжимы. В их конструкцию входит специальная пластина, исключающая прямой контакт между алюминием и медью. При отсутствии таких проводников в бытовых условиях вместо скручивания проводов напрямую рекомендуется использовать шайбу и гайку в качестве промежуточного «мостика».

Физические свойства
Таким образом, мы выяснили, какая электропроводность у меди. Показатель этот может меняться в зависимости от входящих в состав этого металла примесей. Однако востребованность меди в промышленности определяется и другими ее полезными физическими свойствами, получить информацию о которых можно из представленной ниже таблицы.
Параметр | Значение |
Решетка | Гранецентрированная кубическая, а=3.6074 Å |
Атомный радиус | 1,28 Å |
Удельная теплоемкость | 385,48 дж/(кг·К) при +20 оС |
Теплопроводность | 394,279 вт/(м·К) при +20 оС |
Электрическое сопротивление | 1,68·10-8 Ом·м |
Коэффициент линейного расширения | 17,0·10-6 |
Твердость | 350 Мн/м2 |
Предел прочности при растяжении | 220 Мн/м2 |
Химические свойства
По таким характеристикам медь, электропроводность и теплопроводность которой очень высокие, занимает промежуточное положение между элементами первой триады восьмой группы и щелочными первой группы таблицы Менделеева. К основным ее химическим свойствам относят:
склонность к комплексообразованию;
способность давать окрашенные соединения и нерастворимые сульфиды.
Наиболее характерным для меди является двухвалентное состояние. Сходства с щелочными металлами она не имеет практически никакого. Химическая активность ее также невелика. В присутствии СО2 или же влаги на поверхности меди образуется зеленая карбонатная пленка. Все соли меди являются ядовитыми веществами. В одно- и двухвалентном состоянии этот металл образует очень устойчивые комплексные соединения. Наибольшее значение для промышленности имеют аммиачные.

Сфера использования
Высокая тепло- и электропроводность меди определяет ее широкое применение в самых разных отраслях промышленности. Конечно же, чаще всего этот металл используется в электротехнике. Однако это далеко не единственная сфера его применения. Помимо всего прочего, медь может использоваться:
в ювелирном деле;
в архитектуре;
при сборке водопроводных и отопительных систем;
в газопроводах.
Для изготовления разного рода ювелирных изделий используется в основном сплав меди с золотом. Это позволяет увеличить стойкость украшений к деформациям и истиранию. В архитектуре медь может использоваться при облицовке кровель и фасадов. Основным преимуществом такой отделки является долговечность. К примеру, листами именно этого металла обшита крыша широко известной архитектурной достопримечательности — католического собора в немецком городе Хильдесхайме. Медная кровля этого здания надежно защищает его внутреннее пространство вот уже почти 700 лет.

Инженерные коммуникации
Основными преимуществами медных водопроводов также являются долговечность и надежность. Кроме того, этот металл способен придавать воде особые уникальные свойства, делая ее полезной для организма. Для сборки газопроводов и систем отопления медные трубы также подходят идеально — в основном благодаря своей коррозийной стойкости и пластичности. При аварийном повышении давления такие магистрали способны выдерживать гораздо большую нагрузку, чем стальные. Единственным недостатком медных трубопроводов является их дороговизна.
Электрическая проводимость меди. Медь: характеристика
Электрическая проводимость меди напрямую зависит от наличия в этом металле разнообразных примесей. Даже в случае добавления к нему небольшого количества мышьяка, сурьмы происходит резное падение величины электрической проводимости. Но не оказывает существенного влияния на эту физическую величину свинец, теллур, селен, мышьяк.

Особенности понятия
Электрическая проводимость меди ненамного меньше, чем у серебра, что делает этот металл востребованным в современной электротехнике.
Данная физическая величина является характеристикой способности вещества проводить электрический ток. Она связана с удельным электрическим сопротивлением металла прямо пропорциональной зависимостью.
Электрическое сопротивление меди в Ом⋅мм2/м составляет при температуре 20 градусов 0,017. По числовому значению это лишь незначительно меньше, чем у серебра.
Электрическая проводимость меди является величиной, обратной сопротивляемости, применяется для характеристики электротехнических свойств данного металла. Для ее измерения используют сименсы, соответствующие 1/Ом.

Получение меди
Поскольку медь проводит электричество, существует несколько способов изготовления данного металла. Полупроводниковую медь в настоящее время получают при гальванической очистке слитков в специальных электролитических ваннах. Большая часть медных изделий, применяемых в электротехнической промышленности, производится путем проката, волочения, прессовки.
При волочении создают провода, имеющие диаметр не больше 0,005 мм, тонкую фольгу, ленту до 0,1 мм.
Медная проводка востребована не только при возведении многоквартирных домов и офисных помещений, но и в частном строительстве.

Интересные сведения
Данный металл часто встречается в природе в виде крупных самородков. Еще в древние времена люди изготавливали из него украшения, посуду, оружие. Востребованность меди объясняется легкостью ее обработки, а также распространенностью в природе.
Первоначально процесс выделения металла из его соединений был достаточно примитивным, заключался в нагревании медной руды над костром, последующем резком охлаждении. Такая обработка приводила к растрескиванию кусков руды, что позволяло людям извлекать сам металл.
По мере совершенствования технологических процессов обработки металлических руд в костры стали подавать воздух, чтобы повышать температуру нагревания природного соединения. Постепенно процесс начали осуществлять в специальных конструкциях, которые стали прототипами современных шахтных печей.
Результаты археологических раскопок свидетельствую о том, что изделия из меди использовались уже в 10 тысячелетии до нашей эры.
Природные соединения
Медные провода для проводки в настоящее время изготавливают из нескольких видов руд, распространенных в природе. Например, в составе борнита — около 65 процентов металла, в халькозине – до 80 %, а в медном колчедане (халькопирите) количество меди не превышает 30 процентов.

Физические свойства
Высокая электрическая проводимость меди является одним из важнейших свойств данного металла. Его окраска меняется от бледно-розового оттенка до насыщенного красного цвета. Медь является переходным материалом, обладающим высокой тепло- и электропроводностью.
Линейное термическое расширение этого металла составляет 0,00000017 единицы. Медные изделия имеют при растяжении предел прочности 22 кг⋅с/мм2. Удельный вес металла — 8,94 г/см3, твердость по шкале Бринелля — 35 кгс/мм2. Среди важных физических характеристик данного металла следует отметить модуль упругости, составляющий 132 000 мН/м2.
Уникальными являются и магнитные свойства этого металла, являющегося полностью диамагнитным веществом.
Температурный коэффициент сопротивления меди при комнатной температуре равен 4,3 α (10-3/K).
Удельная проводимость, ковкость сделали данный металл востребованным в изготовлении различных элементов для электротехники. Схожими физическими характеристиками обладает алюминий, поэтому он является сырьем для создания кабелей, проводов в современном электротехническом производстве.

Химические свойства
Сопротивление меди, способность данного металла проводить электрический ток объясняются особенностями строения атома этого химического элемента. Медь располагается в побочной подгруппе первой группы таблицы Менделеева, является d-элементом.
Сопротивление меди связано с электронами, располагающимися на внешнем энергетическом уровне. Особенности строения объясняют и специфику химических свойств данного металла. При незначительной влажности медь является достаточно инертным веществом, не проявляет высокой химической активности.
При эксплуатации медных изделий в условиях высокой влажности и присутствия углекислого газа происходит окисление металла.
На поверхности изделия появляется зеленоватая пленка карбоната и гидроксида меди (2), а также разнообразные сернистые соединения. Данную пленку называют патиной, она помогает защищать изделие от последующего химического разрушения.
При повышении температурного значения происходит образование медной окалины (оксида), что негативно отражается на электрической проводимости.
Медь легко вступает во взаимодействие с элементами, относящимися к подгруппе галогенов.
Если внести в металл пары серы, наблюдается воспламенение. Медь инертна к азоту, водороду, углероду даже при повышенных температурных значениях.
Интерес с технической точки зрения представляет взаимодействие этого металла с солями железа, приводящими к его восстановлению. Это химическое свойство позволяет снимать с изделий медное напыление.
Медь образует разнообразные комплексные соединения, которые отличаются высокой стойкостью.

Области использования
Применение данного металла связано с его высокой электрической проводимостью. Например, из него выпускают кабель. Медь имеет небольшое сопротивление, уникальные магнитные свойства, легкую механическую обрабатываемость, поэтому востребована в инженерных коммуникациях и административных зданиях. Способность проводить тепло позволяет применять этот материал для создания тепловых трубок, систем охлаждения и отопления воздуха.
Именно медь – материал, который незаменим при производстве кулеров, используемых для понижения температуры персональных компьютеров. Металлические конструкции, которые содержат медные элементы, имеют незначительный вес, отличные декоративные свойства, поэтому подходят и для применения в архитектуре, и для изготовления разнообразных декоративных элементов в интерьере, и для создания электрических проводов.
Особенности проводников
Для того чтобы понять суть электрической проводимости, остановимся на характеристике проводников. К ним относятся материалы, способные проводить электрический ток. Медь относится к проводникам первого рода, поскольку при повышении температуры наблюдается снижение электрической проводимости. На качество проводникового материала влияют механические, тепловые, электрические свойства. Для такого металла, как медь, все эти показатели имеют неплохие значения, что делает металл востребованным в различных сферах электротехники.
Пластичность меди, легкость ее обработки, хорошая вязкость, химическая стойкость позволяют создавать из данного металла разные виды изделий для технических нужд.
Разновидности
Для изготовления черновой меди применяют электролитическое восстановление металла из раствора медного купороса. Чистый металл необходим для радио- и электротехники. В зависимости от процентного содержания примесей, выделяют марки: М0 и М1. В первом случае количественное содержание чистого металла составляет 99,95 процента, для второго варианта – 99,9 процента.
Среди основных физических свойств, которыми характеризуются данные марки меди, отметим:
- плотность 8900 кг/м3;
- температура плавления 1083 °С;
- высокая механическая прочность;
- отличная обрабатываемость;
- высокое удельное сопротивление 1,7241⋅10-8 Ом⋅м.
При введении примесей в состав чистого металла существенно увеличивается величина удельного сопротивления, при этом снижается электрическая проводимость.
Например, в случае введения 0,5 % алюминия и никеля удельное сопротивление возрастает на 40 процентов.

Заключение
Медь отличается от других проводников тока высокой электрической проводимостью, низким показателем сопротивления, что делает ее востребованной в современном электротехническом производстве.
Токопроводящие проводниковые жилы, кабели, фольгированный гетинакс для печатных устройств, листы, полосы, проволока — это далеко не полный перечень тех изделий, которые создают из меди.
Помимо широкого использования самого металла применение находят и ее основные сплавы. К примеру, кадмиевая бронза используется для создания коллекторных пластин и электрических контактов.
Фосфористая бронза нужна для производства пружин в аппаратах и электронных приборах. Смесь меди с бериллием позволяет создавать зажимы, скользящие контакты, токоведущие пружины.
Оловянистую бронзу называют телефонной, поскольку именно из нее создают проволоку, используемую для телефонного кабеля.
Из медно-цинковых сплавов производят полосы и листы. Данный материал имеет большее удельное электрическое сопротивление, поэтому сплав обладает большой прочностью.
Среди многочисленных сфер применения меди особое значение представляет электротехническая промышленность. Из этого металла создают электрические провода разного диаметра, размера, подходящие для изготовления современных электрических и радиоприборов высочайшей точности. Для повышения электрической проводимости инженеры следят за чистотой металла, не допускают проникновения дополнительных примесей.
Медь — Википедия
| Медь | |
|---|---|
| ← Никель | Цинк → | |
| пластичный металл красно-розового цвета | |
 Самородная медь | |
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
| Атомная масса (молярная масса) | 63,546(3)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1083,4 °С) |
| Температура кипения | 2567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Медь (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк[3]. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий[4].
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
- 2CO+(CuOH)2CO3→2Cu+3CO2+h3O{\displaystyle {\mathsf {2CO+(CuOH)_{2}CO_{3}\rightarrow 2Cu+3CO_{2}+H_{2}O}}}
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике[5].
Латинское название меди Cuprum (древнелат. aes cuprium, aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется χαλκός, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди aes (санскр. ayas, готск. aiz, нем. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках: ст.‑слав. *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово[6][7]. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа — через посредство греч. Μηδία[8]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл»[8].
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра[9], и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской[9][10]. С Гумёшевским рудником Полевского, — крупнейшим в XVIII−XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломлённым народным сознанием образом богини Венеры[9].
 Самородная медь
Самородная медьСреднее содержание меди в земной коре (кларк) — (4,7—5,5)·10−3% (по массе)[2]. В морской и речной воде содержание меди гораздо меньше: 3·10−7 % и 10−7 % (по массе) соответственно[2].
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[11]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[12].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
 Кристаллы меди
Кристаллы медиМедь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[13] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5—58 МСм/м[14]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = 8,52⋅1028{\displaystyle 8,52\cdot 10^{28}} (атом/м³).
Изотопы меди[править | править код]
Природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа[15].
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод[править | править код]
- Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырьё содержит 0,5—2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400 °C :
- 2CuFeS2+O2⟶Cu2S+2FeS+SO2↑{\displaystyle {\mathsf {2CuFeS_{2}+O_{2}\longrightarrow Cu_{2}S+2FeS+SO_{2}\uparrow }}}
- 2FeS+3O2⟶2FeO+2SO2↑{\displaystyle {\mathsf {2FeS+3O_{2}\longrightarrow 2FeO+2SO_{2}\uparrow }}}
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
- FeO+SiO2⟶FeSiO3{\displaystyle {\mathsf {FeO+SiO_{2}\longrightarrow FeSiO_{3}}}}
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
- 2Cu2S+3O2⟶2Cu2O+2SO2{\displaystyle {\mathsf {2Cu_{2}S+3O_{2}\longrightarrow 2Cu_{2}O+2SO_{2}}}}
- 2Cu2O+Cu2S⟶6Cu+SO2{\displaystyle {\mathsf {2Cu_{2}O+Cu_{2}S\longrightarrow 6Cu+SO_{2}}}}
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкислённого раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
- CuO+h3↑⟶Cu+h3O+Q↑{\displaystyle {\mathsf {CuO+H_{2}\uparrow \longrightarrow Cu+H_{2}O+Q\uparrow }}}
Гидрометаллургический метод[править | править код]
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
- CuSO4+Fe⟶Cu↓+FeSO4{\displaystyle {\mathsf {CuSO_{4}+Fe\longrightarrow Cu\downarrow +FeSO_{4}}}}
Электролизный метод[править | править код]
Электролиз раствора сульфата меди:
- CuSO4⇄Cu2++SO42−{\displaystyle {\mathsf {CuSO_{4}\rightleftarrows Cu^{2+}+SO_{4}^{2-}}}}
- K−:Cu2++2e⟶Cu0{\displaystyle {\mathsf {K^{-}:Cu^{2+}+2e\longrightarrow Cu^{0}}}}
- A+:2h3O−4e⟶O2+4H+{\displaystyle {\mathsf {A^{+}:2H_{2}O-4e\longrightarrow O_{2}+4H^{+}}}}
- 2CuSO4+2h3O⟶2Cu↓+O2↑+2h3SO4{\displaystyle {\mathsf {2CuSO_{4}+2H_{2}O\longrightarrow 2Cu\downarrow +O_{2}\uparrow +2H_{2}SO_{4}}}}
Возможные степени окисления[править | править код]
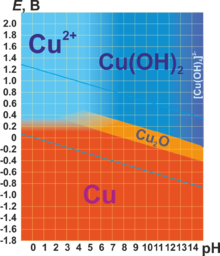
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество[править | править код]
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
- 2Cu+h3O+CO2+O2⟶ (CuOH)2CO3↓{\displaystyle {\mathsf {2Cu+H_{2}O+CO_{2}+O_{2}\longrightarrow \ (CuOH)_{2}CO_{3}\downarrow }}}
Реагирует с концентрированной холодной серной кислотой:
- Cu+h3SO4⟶ CuO+SO2↑ +h3O{\displaystyle {\mathsf {Cu+H_{2}SO_{4}\longrightarrow \ CuO+SO_{2}\uparrow \ +H_{2}O}}}
С концентрированной горячей серной кислотой:
- Cu+2h3SO4⟶ CuSO4+SO2↑ +2h3O{\displaystyle {\mathsf {Cu+2H_{2}SO_{4}\longrightarrow \ CuSO_{4}+SO_{2}\uparrow \ +2H_{2}O}}}
С безводной горячей серной кислотой:
- 2Cu+2h3SO4 →200oC Cu2SO4↓+SO2↑ +2h3O{\displaystyle {\mathsf {2Cu+2H_{2}SO_{4}\ {\xrightarrow {200^{o}C}}\ Cu_{2}SO_{4}\downarrow +SO_{2}\uparrow \ +2H_{2}O}}}
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
- 2Cu+2h3SO4+O2→t∘ 2CuSO4+2h3O{\displaystyle {\mathsf {2Cu+2H_{2}SO_{4}+O_{2}{\xrightarrow {t^{\circ }}}\ 2CuSO_{4}+2H_{2}O}}}
С концентрированной азотной кислотой:
- Cu+4HNO3⟶ Cu(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Cu+4HNO_{3}\longrightarrow \ Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
С разбавленной азотной кислотой:
- 3Cu+8HNO3⟶ 3Cu(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Cu+8HNO_{3}\longrightarrow \ 3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
С «царской водкой»:
- 3Cu+2HNO3+6HCl⟶ 3CuCl2+2NO↑+4h3O{\displaystyle {\mathsf {3Cu+2HNO_{3}+6HCl\longrightarrow \ 3CuCl_{2}+2NO\uparrow +4H_{2}O}}}
С концентрированной горячей соляной кислотой:
- 2Cu+4HCl⟶ 2H[CuCl2]+h3↑{\displaystyle {\mathsf {2Cu+4HCl\longrightarrow \ 2H[CuCl_{2}]+H_{2}\uparrow }}}
C разбавленной соляной кислотой в присутствии кислорода:
- 2Cu+4HCl+O2⟶ 2CuC

