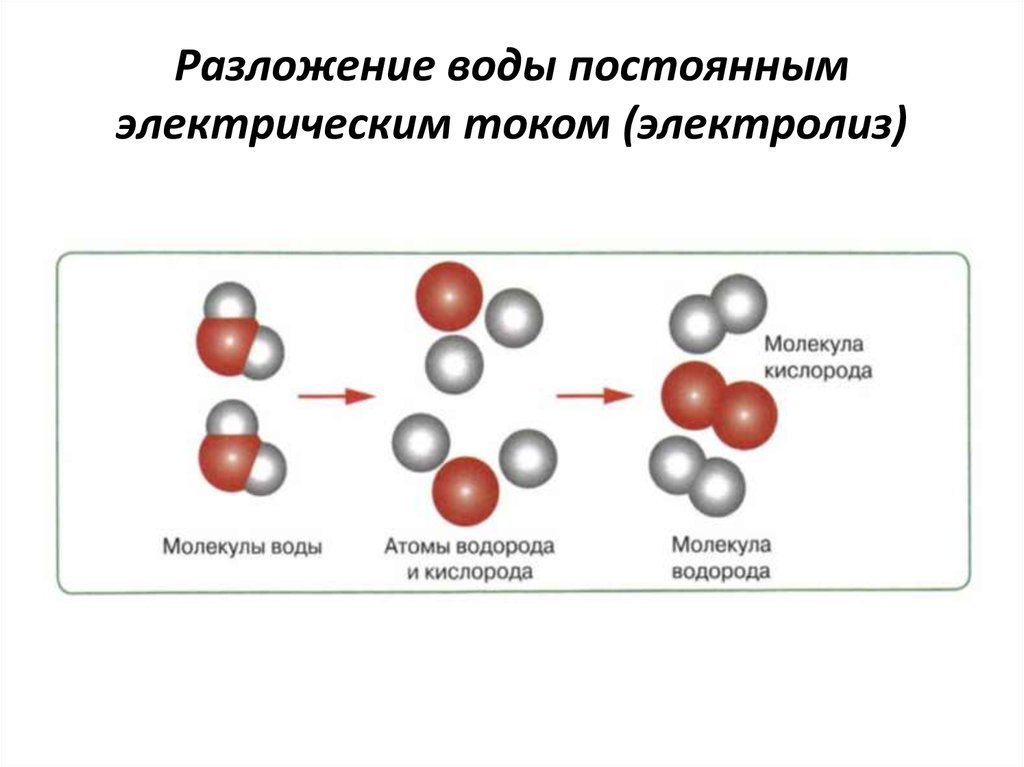
Как происходит процесс разложения воды электрическим током
Чистая, дистиллированная вода почти совершенно не проводит электрического тока.
Она обладает огромным сопротивлением. Например, сопротивление кубического сантиметра дважды перегнанной воды равно сопротивлению медной проволоки сечением в квадратный миллиметр, длина которой равна примерно 200 тысячам километров. Таким количеством проволоки можно больше чем 20 раз соединить между собой Москву и Владивосток. Для электролиза дистиллированная вода не годится. Нужна такая вода, которая бы хорошо проводила электрический ток, то есть была бы электропроводной.
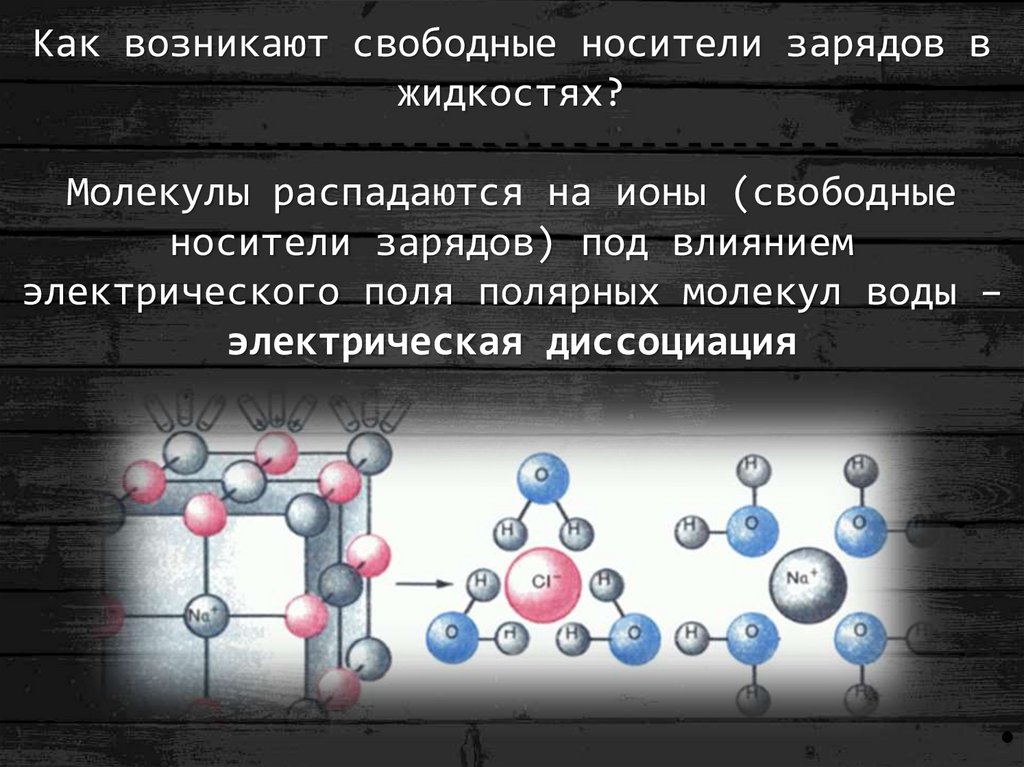
Чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Большинство химических соединений, растворяясь в воде, распадаются на части, которые приобретают при этом тот или иной заряд. Образующиеся заряженные частицы называются ионами, а разложение вещества на ионы — электролитической диссоциацией.
Обыкновенная поваренная соль (NaCl) при растворении в воде распадается на ион натрия (Na+), заряженный положительно, и ион хлора (Сl—), заряженный отрицательно. Ионы натрия и хлора, имеющие только по одному заряду, называются одновалентными ионами. Ионы, которые имеют два или три заряда, называются двух- или трехвалентными. В качестве примера двухвалентного иона можно привести ион кальция (Са). Хлористый кальций (СаСl2), диссоциируя на ионы, дает два одновалентных отрицательных иона хлора (2Сl) и один двухвалентный ион кальция (Са), заряженный положительно. Треххлористое железо (FeCl3) при диссоциации на ионы дает три одновалентных отрицательных иона хлора (3Сl—) и один трехвалентный положительный ион железа (Fe+++).
Итак, при электролитической диссоциации соли образуются отрицательно заряженные ионы, которые называются анионами, и положительно заряженные ионы — катионы.
Кислоты при диссоциации образуют положительно заряженный ион водорода и отрицательно заряженный кислотный остаток. Серная кислота (H2SO4) распадается на два положительно заряженных иона водорода (2Н+) и кислотный остаток — анион (SO4—), обладающий двумя отрицательными зарядами.
Серная кислота (H2SO4) распадается на два положительно заряженных иона водорода (2Н+) и кислотный остаток — анион (SO4—), обладающий двумя отрицательными зарядами.
Щелочи при диссоциации образуют положительный ион металла и отрицательный ион гидроксила. Положительные и отрицательные ионы, образующиеся при растворении в воде солей, кислот и оснований, переносят через раствор электрический ток.
Если в раствор, содержащий ионы, поместить две металлические пластинки и подключить к ним постоянный ток от аккумулятора, то положительные ионы — катионы — сразу же начнут передвигаться к отрицательному электроду, который называется катодом, а отрицательные ионы — анионы — направятся к положительному полюсу — аноду. Находящиеся у электрода анионы отдадут ему свои отрицательные заряды — электроны (е) — и разрядятся. В то же самое время разрядятся и катионы, получив электроны от своего электрода. Их места тут же занимают новые ионы, и через раствор начинает проходить электрический ток. Чем больше ионов в растворе, тем лучше через него будет проходить электрический ток и тем больше электропроводность такого раствора.
Чем больше ионов в растворе, тем лучше через него будет проходить электрический ток и тем больше электропроводность такого раствора.
Чтобы получить много ионов, недостаточно растворить много вещества. Необходимо, чтобы взятая соль, кислота или основание хорошо распадались на ионы, то есть хорошо диссоциировали. Имеются такие химические соединения, которые диссоциируют очень хорошо, и почти все молекулы растворенного вещества распадаются на ионы. Но есть и такие, которые диссоциируют плохо: только очень незначительная часть всех растворенных молекул распадается на ионы, а остальные остаются в виде недиссоциированных молекул.
Отношение числа распавшихся молекул к общему числу растворенных молекул называется степенью диссоциации. Чем меньше степень диссоциации, тем хуже электропроводность раствора.
К соединениям, обладающим плохой электропроводностью, относится дистиллированная вода. Подсчитано, что из 10 миллионов молекул воды на ионы распадается только одна молекула, образуя один положительно заряженный ион водорода (Н+) и один отрицательно заряженный ион гидроксила (ОН—). Понятно, что при такой малой диссоциации электропроводность дистиллированной воды должна быть совершенно ничтожной и она не может быть использована для электролиза. Вот почему для получения из воды кислорода необходимо иметь подкисленную или подщелоченную воду.
Понятно, что при такой малой диссоциации электропроводность дистиллированной воды должна быть совершенно ничтожной и она не может быть использована для электролиза. Вот почему для получения из воды кислорода необходимо иметь подкисленную или подщелоченную воду.
Прохождение электрического тока через раствор: 1 — катод; 2 — анод; 3 — положительно заряженные ионы — катионы; 4 — отрицательно заряженные ионы — анионы.
Нам уже известно, что кислота в воде диссоциирует на ионы водорода и кислотный остаток, а щелочь — на ионы металла и ионы гидроксила. Естественно было бы ожидать, что в растворе, подкисленном серной кислотой, на катоде будут разряжаться ионы водорода, а на аноде — ионы SO4—. Ионы водорода, разрядившись, перейдут в атомы, которые, соединяясь попарно, дадут молекулу водорода, а ионы SO4—, отдав свой заряд электроду, перейдут в раствор в виде незаряженного кислотного остатка — радикала SO4. Соединяясь с водой, этот радикал образует серную кислоту и кислород.
Можно было бы ожидать, что в щелочных растворах ионы натрия (Na + (e) → Na) разрядятся на катоде, переходя в атомы натрия, которые, соединяясь с водой, дадут щелочь и водород (2Na + 2H2O → 2NaOH + H2). На аноде ионы гидроксила, потеряв свои электроны, соединятся попарно, образуя из радикалов воду, освобождая кислород (4OH— — 4(e) → 2H2O + O2).
Однако в действительности в кислых и щелочных растворах процесс образования кислорода и водорода происходит иначе.
Несмотря на то, что в щелочных растворах имеется очень много ионов натрия и мало ионов водорода, на катоде в первую очередь разряжаются ионы водорода.
В растворах, подкисленных серной кислотой, на аноде прежде всего разряжаются ионы гидроксила, полученные за счет диссоциации воды, а не ионы SO4—, которых неизмеримо больше. Это объясняется тем, что разряд ионов водорода или гидроксила происходит легче, чем ионов натрия или SO4—. Поэтому в щелочных растворах, которые обычно применяются для электролиза воды, на катоде разряжаются главным образом ионы водорода, а на аноде — ионы гидроксила. Как только эти ионы разрядятся, немедленно образуются новые ионы за счет диссоциации молекул воды.
Поэтому в щелочных растворах, которые обычно применяются для электролиза воды, на катоде разряжаются главным образом ионы водорода, а на аноде — ионы гидроксила. Как только эти ионы разрядятся, немедленно образуются новые ионы за счет диссоциации молекул воды.
Таким образом, при электролитическом получении кислорода и водорода расходуется только вода. Литр воды дает примерно 1360 литров водорода и 680 литров кислорода.
Электролиз воды: 1 — банка с электролитом; 2 — катод, на котором выделяется водород; 3 — анод, на котором выделяется кислород; 4 — трубка для отвода газов; 5 — чашечка с водой.
Под руководством учителя и соблюдая меры предосторожности, можно сделать опыт, показывающий, как разлагается вода.
Возьмите банку с широким горлом и наполните ее на две трети 20-процентным водным раствором щелочи. Плотно закройте банку пробкой, в которую вставлены две никелевые проволочки с небольшими пластинками на концах — электродами. В середину пробки вставьте коротким концом загнутую стеклянную трубку, через которую будут выходить газы. Второй, длинный конец трубки опустите в чашку с водой, чтобы в нее во время опыта не попадал воздух. Подключите к верхним концам электродов постоянный ток от двухвольтового аккумулятора. На электродах под раствором сразу же появятся пузырьки газа. Это кислород и водород, которые, смешиваясь, образуют гремучий газ.
Второй, длинный конец трубки опустите в чашку с водой, чтобы в нее во время опыта не попадал воздух. Подключите к верхним концам электродов постоянный ток от двухвольтового аккумулятора. На электродах под раствором сразу же появятся пузырьки газа. Это кислород и водород, которые, смешиваясь, образуют гремучий газ.
Вспомним свойство этой смеси газов. Если ее поджечь, она легко взрывается.
Поэтому подходить с огнем к банке опасно.
Чтобы убедиться, что в банке образовались кислород и водород, пропустите сначала немного газа через чашечку с чистой водой, а затем поставьте вместо нее чашечку с мыльной водой.
Образуются мыльные пузыри, наполненные гремучим газом. Раздастся легкий взрыв.
В пузыре была гремучая смесь — смесь одного объема кислорода с двумя объемами водорода.
Мы пока только разложили воду, но не разделили образовавшиеся газы и не получили кислорода.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Ленинград. Москва. 1953
|
|
Электролиз воды | Энергетические основы для химии в старших классах
- Обзор для учителя
- Подготовка
- Демонстрация
- Обсуждение со студентами
- Пояснение
- Расширения
Краткий обзор учителя
Резюме
В этой демонстрации учащиеся исследуют идею о том, что энергию батареи можно использовать для запуска химической реакции, которая не происходит самопроизвольно, например, расщепление молекул воды с образованием газообразного водорода и кислорода.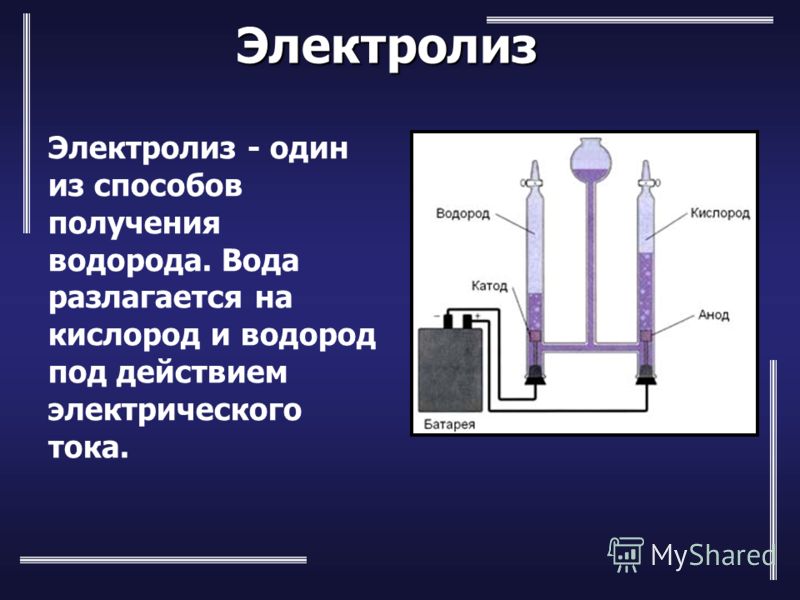
Задача
Учащиеся узнают об использовании внешнего источника энергии для запуска химической реакции.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки.
Материалы
- 9-вольтовая батарея
- Две металлические кнопки
- Вода
- Английская соль (MgSO 4 • 7 H 2 O)
- Чистая, пустая, прозрачная и бесцветная пластиковая бутылка для воды с крышкой и удаленной этикеткой
- Ножницы
- Черный перманентный маркер
- Химический стакан или пластиковая чашка
- Бумажные полотенца или глина для лепки
Необходимое время
Часть одного урока, примерно 10–15 минут.
Демонстрационные советы
Соль Эпсома можно приобрести в местных аптеках, где она продается как слабительное и как средство для добавления в ванну с теплой водой для лечения боли. Можно использовать пластиковые контейнеры, отличные от бутылки с водой, если у контейнера плоское дно для легкого подключения к контактам батареи, а пластик достаточно тонкий, чтобы легко проталкивать кнопки. Например, можно использовать маленькие пластиковые стаканчики для приправ.
Например, можно использовать маленькие пластиковые стаканчики для приправ.
Включение в учебную программу
Эта демонстрация может быть включена в раздел по химическим реакциям или термохимии.
Процедура для учителя
Подготовка
- Снимите крышку с чистой, пустой, прозрачной и бесцветной пластиковой бутылки для воды. Переверните крышку так, чтобы верхняя часть крышки касалась двух контактов 9-вольтовой батареи. Отцентрируйте крышку над двумя контактами. Используя черный перманентный маркер, сделайте две точки на внутренней стороне крышки, по одной над центром каждого контакта.
- Поместите крышку на твердую поверхность верхней частью крышки вверх. Вставьте металлическую кнопку в верхнюю часть крышки прямо над одной из точек. Вставьте вторую кнопку в крышку прямо над второй точкой. Две кнопки не должны соприкасаться.
- С помощью ножниц отрежьте верхнюю половину бутылки, чтобы она выглядела как воронка.
 Закрутите крышку обратно на бутылку.
Закрутите крышку обратно на бутылку.
Демонстрация
- Покажите учащимся верхнюю половину бутылки, особенно две металлические кнопки, продетые через крышку.
- Наполните нижнюю часть разрезанной бутылки водой примерно наполовину. Добавьте примерно чайную ложку английской соли. Помешивать, пока большая часть соли не растворится.
- Налейте раствор английской соли в верхнюю часть бутылки (держите ее крышкой вниз).
- Попросите студента-добровольца понаблюдать за решением, особенно за двумя точками металлических кнопок. Есть ли признаки реакции?
- Поместите две металлические кнопки так, чтобы каждая кнопка касалась одного из контактов на 9-вольтовая батарея. Попросите добровольца еще раз понаблюдать за раствором. Есть ли признаки реакции?
- Батарейку можно поместить на дно стакана или прозрачного бесцветного пластикового стакана, удерживая вертикально с помощью бумажных полотенец или глины для лепки.
 Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.
Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.
Обсуждение со студентами
- Какие существуют доказательства того, что реакция происходит, когда контакты батареи касаются металлических кнопок?
Пузырьки одного или нескольких газов образуются и поднимаются из каждой кнопки.
- Есть ли разница в количестве газа, образующегося при каждом контакте батареи?
Да, на одном из соединений образуется больше пузырьков.
- Может ли разница, описанная в вопросе 2, быть связана с разницей в гвоздях? Что можно сделать с аппаратом, чтобы потенциально подтвердить идею о том, что контакт батареи ответственен за 9?0141 .
Можно повернуть контакты батареи так, чтобы каждый контакт касался противоположной кнопки. Контакт батареи, который произвел больше пузырьков в первый раз, должен по-прежнему производить больше пузырьков при прикосновении к любой кнопке.

- Для чего нужен аккумулятор?
Батарея запускает реакцию, которую мы не наблюдали самопроизвольно без этого дополнительного внешнего источника энергии.
- Зачем в воду добавляют английскую соль?
Английская соль является электролитом и служит для проведения электричества через раствор. Электричество от батареи может проходить через раствор и между двумя кнопками.
6. Каково сбалансированное уравнение распада молекул воды?
7. Если наблюдаемая нами реакция представляет собой расщепление молекул воды, то какой газ может выделяться при контакте батареи и почему?
В результате реакции распада молекул воды образуются два газа: H 2 и O 2 . В уравнении получается в два раза больше газообразного водорода, чем газообразного кислорода. Контакт батареи, который производит больше пузырьков, будет производить газообразный водород.
8. Что можно сделать, чтобы собрать дополнительные доказательства того, что образуются два газа и что это H 2 и O 2 ?
Что можно сделать, чтобы собрать дополнительные доказательства того, что образуются два газа и что это H 2 и O 2 ?
Можно собирать образующиеся газы и проверять их на известные свойства H 2 и О 2 газы.
Пояснение
Разделение слова «электролиз» на составные части обобщает его значение — использование электричества (электро-) для разрушения (-лиза) чего-либо. В этой демонстрации электричество, подаваемое 9-вольтовой батареей, используется для расщепления молекул воды, в результате чего образуются газообразные водород и кислород.
Идея включения энергии в качестве реагента или продукта в химическое уравнение может быть использована для иллюстрации потребности в дополнительной внешней силе энергии для управления реакцией, которая обычно происходит
не происходит самопроизвольно и связать демонстрацию с представлениями об экзотермических и
эндотермических реакциях.
Например, Химия в Сообществе описывает:
…если конкретная химическая реакция является экзотермической (с выделением тепловой энергии), то обратная реакция является эндотермической (преобразование тепловой энергии в потенциальную). Например, сжигание газообразного водорода с образованием воды является экзотермическим процессом. Энергия, выделяемая при образовании связей H–O в молекулах воды, больше, чем необходимая для разрыва связей в молекулах h3 и O2:
Следовательно, разделение воды на элементы — обратная реакция — должна быть эндотермической, количество энергии равно количеству выделяющейся при образовании воды из газообразных Н 2 и О 2 .
Удлинители
Предложите учащимся разработать метод сбора газов для демонстрации и описать, как их можно проверить, чтобы определить, являются ли они h3 и O2, и какие именно. Стеклянные трубки, наполненные раствором английской соли, можно перевернуть над двумя кнопками для сбора газов; сбор заметного количества газа может занять значительное время.
Демонстрация обратной реакции, реакции смешивания газообразных водорода и кислорода и их сжигания, может быть использована в связи с этой демонстрацией электролиза. Эту взрывоопасную экзотермическую реакцию следует использовать с соответствующими мерами предосторожности и оборудованием.
Другая распространенная установка, используемая для демонстрации электролиза воды, использует два графитовых карандаша, заостренных с обоих концов, в качестве электродов.
Инструкции, написанные для учащихся по проведению этого исследования, доступны бесплатно в учебной программе «Химия для средней школы» Американского химического общества.
Вернуться к началу
Как вода распадается на атомы H+, электроны и газообразный O2?
Электролиз — это процесс, используемый для разложения молекул и соединений с помощью электричества. Вода разлагается электролизом на газообразный кислород и газообразный водород. Происходит следующее: вода окисляется на аноде, положительно заряженном электроде, с образованием газообразного кислорода, ионов водорода и электронов .
Происходит следующее: вода окисляется на аноде, положительно заряженном электроде, с образованием газообразного кислорода, ионов водорода и электронов .
|
Посмотреть полный ответ на homework.study.com
Что вызывает расщепление воды с образованием ионов H и кислорода?
Окисление этих органических молекул путем дыхания или горения приводит к рекомбинации накопленного водорода с кислородом, высвобождению энергии и преобразованию воды. Это расщепление воды достигается ферментной фотосистемой II (ФСII).
Запрос на удаление |
Посмотреть полный ответ на esalq.usp.br
Как разбить h3O на h3 и o2?
- H 2 O содержит молекулы кислорода и водорода и разрушается в процессе, известном как электролиз.
- Электролиз можно проводить с помощью электрического тока в жидкой воде, которая распадается на молекулы водорода и кислорода.
 Запрос на удаление
Запрос на удаление| Посмотреть полный ответ на byjus.com
Является ли расщепление воды на водород и кислород экзотермическим?
Разделить воду на два компонента гораздо проще, и это называется электролизом воды. Получение водорода или кислорода таким способом кажется простым. Но, как вы, вероятно, подозревали, эта обратная реакция требует затрат энергии, поэтому ее также называют эндотермической реакцией.
Запрос на удаление| Полный ответ см. на сайте Scientificamerican.com
Что вызывает расщепление воды?
10.2.
Расщепление воды — это процесс, при котором вода разлагается на водород и кислород. Проведение электрического тока через воду называется электролизом воды.
Запрос на удаление| Посмотреть полный ответ на sciencedirect.com
Электролиз: получение водорода из воды
youtube.com/embed/38ULHoKWZag?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Как получают водород при расщеплении воды?
При фотоэлектрохимическом (PEC) расщеплении воды водород производится из воды с использованием солнечного света и специальных полупроводников, называемых фотоэлектрохимическими материалами, которые используют световую энергию для прямого разделения молекул воды на водород и кислород.
Запрос на удаление| Полный ответ см. на сайте energy.gov
Какая реакция отвечает за расщепление воды?
Расщепление молекул воды называется фотолизом воды. При световой реакции фотосинтеза поглощение света хлорофиллом приводит к потере им электрона. Чтобы удовлетворить потребность в электронах, молекула воды расщепляется и отдает электрон хлорофиллу.
Запрос на удаление
| Посмотреть полный ответ на toppr.com
Что происходит с кислородом при расщеплении воды?
В основе этого процесса лежит самая фундаментальная реакция на Земле — расщепление воды на элементарные составляющие под действием света. Таким образом высвобождается молекулярный кислород, поддерживая аэробную атмосферу и создавая озоновый слой.
Запрос на удаление| Посмотреть полный ответ на сайте nature.com
Какие два газа выделяются при расщеплении воды?
Электролиз воды, также известный как электрохимическое расщепление воды, представляет собой процесс использования электричества для разложения воды на кислород и газообразный водород путем электролиза.
Запрос на удаление| Полный ответ см. на en.wikipedia.org
Как водяной газ превращается в водород?
Высокотемпературное расщепление воды: высокие температуры, создаваемые солнечными концентраторами или ядерными реакторами, вызывают химические реакции, в результате которых вода расщепляется с образованием водорода.
Запрос на удаление Фотобиологическое расщепление воды: микробы, такие как зеленые водоросли, потребляют воду в присутствии солнечного света и производят водород в качестве побочного продукта.
Фотобиологическое расщепление воды: микробы, такие как зеленые водоросли, потребляют воду в присутствии солнечного света и производят водород в качестве побочного продукта.| Посмотреть полный ответ на afdc.energy.gov
Как происходит процесс расщепления молекул воды?
Вы узнаете, что вода состоит из атомов водорода и кислорода, и что мы можем разделить атомы в молекуле воды на части с помощью электричества. Этот процесс использования электричества для запуска химической реакции, такой как расщепление молекул воды, известен как «электролиз».
Запрос на удаление| Посмотреть полный ответ на fi.edu
Где происходит расщепление воды?
Индуцированное светом каталитическое расщепление воды происходит на металлокомплексе, встроенном в большой мембранный белок (фотосистема II). Этот комплекс состоит из четырех атомов марганца (Mn) и одного атома кальция (Ca), которые удерживаются вместе сетью кислородных мостиков (см.
Запрос на удаление изображение).
изображение).| Посмотреть полный ответ на mpg.de
Можете ли вы снова превратить воду в водород и кислород?
Электролиз — это процесс разделения воды на водород и кислород с помощью электрического тока. Электрический заряд, прикладываемый к воде, разрывает химическую связь между атомами водорода и кислорода и производит заряженные частицы, называемые ионами.
Запрос на удаление| Посмотреть полный ответ на sciencenter.org
Можно ли отделить водород от воды без электричества?
Одним из наиболее распространенных способов получения водорода является расщепление воды на водород и кислород. Существует несколько способов расщепления воды, например, с помощью электрического тока (электролиз), нагревания, солнечного света или вещества, химически вступающего в реакцию с водой. К таким веществам относятся алюминий, цинк и кремний.
Запрос на удаление
| Посмотреть полный ответ на phys.org
Почему образовавшийся газообразный водород собирается над водой?
Газообразный водород собирается путем вытеснения воды вниз, поскольку водород нерастворим в воде. Водород легче воды, поэтому его можно собирать, вытесняя воду вниз.
Запрос на удаление| Посмотреть полный ответ на byjus.com
Что насчет воды, которая заставляет ее образовывать водородные связи?
Водородные связи — это притяжение электростатической силы, вызванное разницей в заряде между слегка положительными ионами водорода и другими, слегка отрицательными ионами. В случае воды водородные связи образуются между соседними атомами водорода и кислорода соседних молекул воды.
Запрос на удаление| Посмотреть полный ответ на usgs.gov
Выделяет ли вода газообразный водород?
К счастью, вода (h3O) содержит водород, и мы можем использовать воду для получения газообразного водорода (h3).
Запрос на удаление Расщепление молекул воды на газообразный кислород и газообразный водород с помощью электричества называется «электролиз».
Расщепление молекул воды на газообразный кислород и газообразный водород с помощью электричества называется «электролиз».| Посмотреть полный ответ на anl.gov
Почему между атомами воды образуются водородные связи?
Область вокруг кислорода несколько отрицательна по сравнению с противоположным водородосодержащим концом молекулы, который слегка положителен. Противоположности притягиваются, поэтому эта неравномерная разница в заряде позволяет образовывать связи между атомами водорода и кислорода соседних молекул H 2 O.
Запрос на удаление| Посмотреть полный ответ на nsf.gov
При какой температуре вода распадается на водород и кислород?
В процессах термохимического расщепления воды используется высокотемпературное тепло (500–2000 °C) для запуска ряда химических реакций, в результате которых образуется водород.
Запрос на удаление Химические вещества, используемые в процессе, повторно используются в каждом цикле, создавая замкнутый цикл, который потребляет только воду и производит водород и кислород.
Химические вещества, используемые в процессе, повторно используются в каждом цикле, создавая замкнутый цикл, который потребляет только воду и производит водород и кислород.| Полный ответ можно найти на сайте energy.gov
Создает ли кипящая вода водород?
Когда вода кипятится, она претерпевает физические, а не химические изменения. Молекулы воды не распадаются на водород и кислород. Вместо этого связи между молекулами воды разрываются, позволяя им физически превращаться из жидкости в газ.
Запрос на удаление| Посмотреть полный ответ на Wonderopolis.org
Какова реакция между h3 и O2?
Реакция представлена уравнением: O2(г)+h3(г)→h3O(г).
Запрос на удаление| Посмотреть полный ответ на toppr.com
Что происходит, когда реагируют h3 и O2?
Когда молекулярный водород (H 2 ) и кислород (O 2 ) объединяются и дают возможность реагировать вместе, высвобождается энергия, и молекулы водорода и кислорода могут объединяться с образованием воды или перекиси водорода.



 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав Закрутите крышку обратно на бутылку.
Закрутите крышку обратно на бутылку. Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.
Затем верхнюю часть бутылки можно поставить на батарею с большей устойчивостью, если инструктор хочет показать ее поближе к остальной части класса.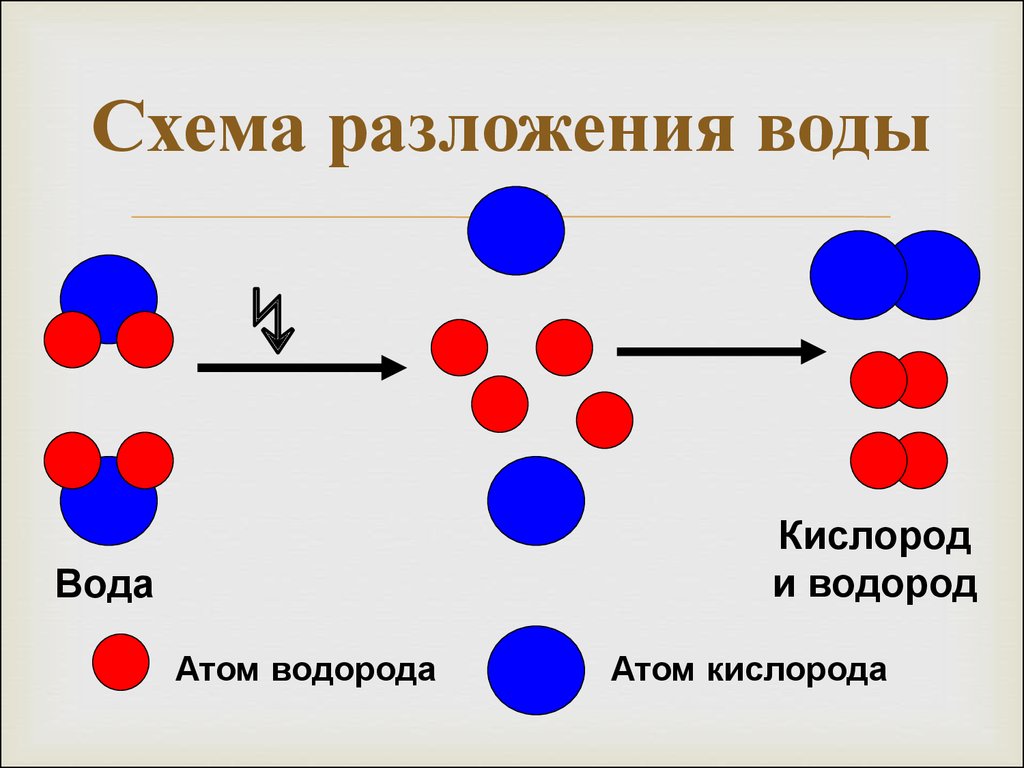
 Запрос на удаление
Запрос на удаление
 Фотобиологическое расщепление воды: микробы, такие как зеленые водоросли, потребляют воду в присутствии солнечного света и производят водород в качестве побочного продукта.
Фотобиологическое расщепление воды: микробы, такие как зеленые водоросли, потребляют воду в присутствии солнечного света и производят водород в качестве побочного продукта. изображение).
изображение).
 Расщепление молекул воды на газообразный кислород и газообразный водород с помощью электричества называется «электролиз».
Расщепление молекул воды на газообразный кислород и газообразный водород с помощью электричества называется «электролиз». Химические вещества, используемые в процессе, повторно используются в каждом цикле, создавая замкнутый цикл, который потребляет только воду и производит водород и кислород.
Химические вещества, используемые в процессе, повторно используются в каждом цикле, создавая замкнутый цикл, который потребляет только воду и производит водород и кислород.