«Что будет с водой, если нагреть ее до 1000 или выше градусов и не позволять ей превратиться в пар?» — Яндекс Кью
Популярное
Сообщества
Физика
Ever Green
·
637,6 K
Ответить19УточнитьРоман Бортников
Физика
30
Физик-солнечник, разработчик ПО · 10 авг 2021
Вода будет находиться в т.н. сверхкритической фазе — не пар и не жидкость. Для воды критическая точка — 647 Кельвин и 218,3 атмосфер. На Википедии есть фазовая диаграмма. При приближении к критической точке граница между жидкостью и паром истончается, поверхностное натяжение уменьшается, теплоты перехода тоже, при достижении критической точки разница между фазами исчезает совсем и вода превращается нечто нелинейное и бурлящее).
53,6 K
Комментировать ответ…Комментировать…
Денис Ли
Физика
28
🎓Студент экономического факультета | Интересуюсь Физикой, Философией, Менеджментом |… · 14 янв 2022
Если греть воду, не позволяя ей превращаться в пар, будет непрерывно повышаться давление. В итоге при 374°C и 218 атм будут условия, когда между жидкостью и паром нет никакой разницы — так называемую критическую точку. Поблизости от неё можно будет наблюдать рост характерных размеров флуктуаций, опалесценцию и другие физические явления. Дальше будет уже не жидкость и не… Читать далее
С удовольствием отвечу на интересующие вас вопросы.
Дмитрий Алфеев
17 января 2022
Денис, а это справедливо и для дистиллированной воды или именно для неё. Я не изучал физику настолько глубоко, но. .. Читать дальше
.. Читать дальше
Комментировать ответ…Комментировать…
Alexander Missyul
12,8 K
Химик, кристаллограф. Живу в Испании, раньше работал в Корее. · 19 апр 2018
Если вы будете греть воду, не позволяя ей превращаться в пар, вы будете непрерывно повышать давление. В итоге при 374°C и 218 атм вы попадёте в условия, когда между жидкостью и паром нет никакой разницы — так называемую критическую точку. Поблизости от неё вы будете наблюдать рост характерных размеров флуктуаций, опалесценцию и всякие другие веселости. Дальше будет уже… Читать далее
1 эксперт согласен
444,3 K
Евгений Кандзюба
подтверждает
22 июня 2021
При температуре выше 374 градусов цельсия и давлении до 22 МПа исчезает граница между газовой и жидкой фазой. В… Читать дальше
Комментировать ответ…Комментировать…
Александр Ишин
17
Безработный. Кандидат технических наук, критикую «грамотеев», когда уж совсем заврались. · 6 сент 2021
Кандидат технических наук, критикую «грамотеев», когда уж совсем заврались. · 6 сент 2021
При 1000 градусов это будет еще вода, правда, не жидкая и не пар — так называемое сверхкритическое состояние, когда отсутствует различие между паром и газом. При более высоких температурах молекулы воды будет разлагаться на составляющие -водород и кислород. Подтверждение — горящий кусок магния, брошенный в лужицу воды (чтобы не утонул), не гаснет а мощно вспыхивает за… Читать далее
1 эксперт согласен
39,9 K
Вальтер Владислав
подтверждает
11 сентября 2021
Горящий магний вступает в реакцию с водой с образованием оксида марганца. Mg + h3O = MgO + h3 Так что там в целом… Читать дальше
Комментировать ответ…Комментировать…
Стас Никитин
377
Клоун-всезнайка, «Мыслитель» с аналогичного сервиса ООО «мыловару».
В ядерных реакторах Фукусимы происходило что-то в этом роде: вода под куполом реактора распалась на кислород-водородную смесь и случайнаяискра вызвала серию мощнейших взрывов, сопровождающихся выбросами радиоактивного топлива.
Проще говоря, вода превратится во взрывоопасную смесь газов.
83,0 K
Дмитрий К.
2 марта 2020
Нет, на Фукусиме разложение воды на водород и кислород спровоцировали расплавленные циркониевые трубки в активной… Читать дальше
Комментировать ответ…Комментировать…
Александр Мынов
Я с детства хотел понять что за место такое Вселенная. Лишь с долгими годами усердных… · 12 янв 2020 ·
nuclearbot
Это называется перегретая жидкость. 1000 градусов ничего особенного. Правда чтобы нагреть воду до такой температуры, необходимо чтобы в дистилерованной воде не было ни единой частички извне. Иначе она моментально превращается в пар, высвобождая всю энергии, которая была в ней. Мы создавали воду нагретую до 200 градусов и взрывали её потом.
Правда чтобы нагреть воду до такой температуры, необходимо чтобы в дистилерованной воде не было ни единой частички извне. Иначе она моментально превращается в пар, высвобождая всю энергии, которая была в ней. Мы создавали воду нагретую до 200 градусов и взрывали её потом.
130,7 K
Андрей Иванов
Физик-ядерщик? Они теперь не читают чего пишут,опасные типы. ))
Комментировать ответ…Комментировать…
Алексей Иванов
6
Интересуюсь историей, политикой, географией · 11 мая 2020
Ребят, простите меня, тупого, но расскажите как стирается грань между жидкостью и паром? Нихрена не представляю. Вижу кипящую воду, вижу пар над ней… Но как это все вместе, не представляю)
15,5 K
Илья Царенков
19 мая 2020
Представь демонстрацию, или людей на крутом рок концерте, которые рядышком стоят в плотную их очень много в зале.
Комментировать ответ…Комментировать…
Первый
Борис Волнухин
15
пцкпцук · 26 апр 2021
при повышении давления поднимается точка кипения при достижении критической точки 374 гр и давлении 220 кг вода закипает в любом случае и испаряется , дальше идет перегретый пар, не каким давлением его не удержишь воду выше этой точки, в реакторе вода распадается на кислород и водород под действием ионизирующих излучений, чтобы устранять водород существуют печи дожига… Читать далее
18,5 K
Комментировать ответ…Комментировать…
Андрей Большаков
34
Системный администратор · 8 янв 2022
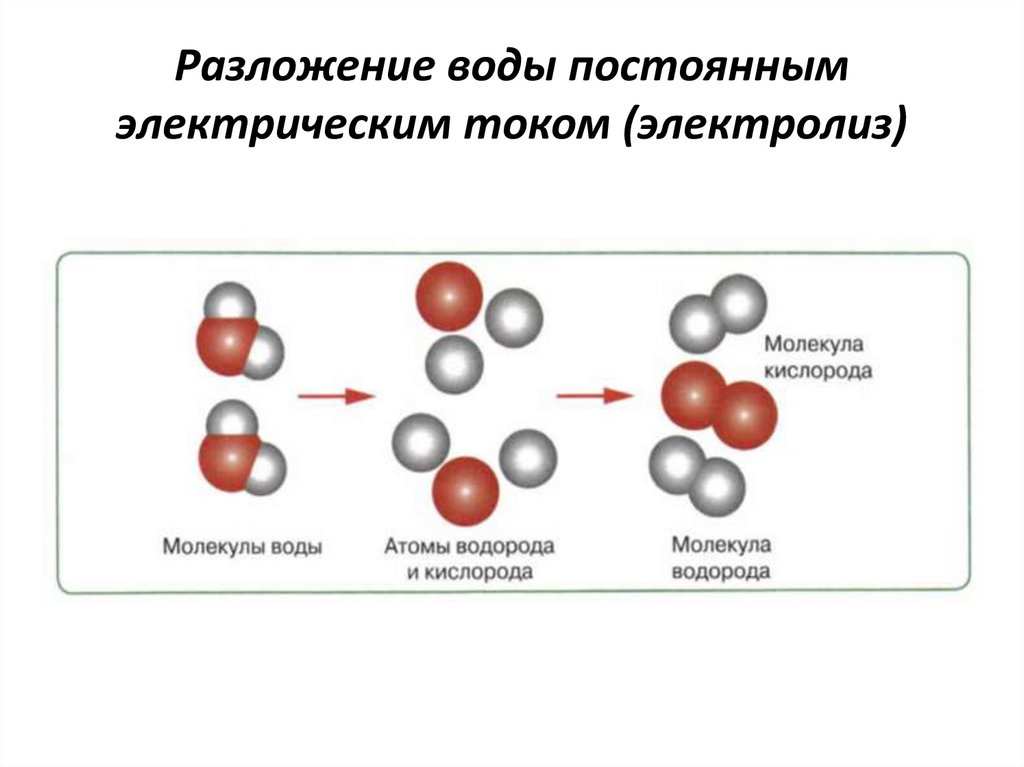
Не позволять воде испаряться при таких температурах можно лишь одним способом: повышать давление. При указанной температуре заведомо получишь сверхкритический флюид, что есть одновременно и жидкость, и пар. При удвоении температуры начинается термолиз воды по реакции 2 h3O = 2 h3 + O2, и примерно к 5000 градусов эта реакция окончательно сдвигается вправо, а вода таким… Читать далее
При указанной температуре заведомо получишь сверхкритический флюид, что есть одновременно и жидкость, и пар. При удвоении температуры начинается термолиз воды по реакции 2 h3O = 2 h3 + O2, и примерно к 5000 градусов эта реакция окончательно сдвигается вправо, а вода таким… Читать далее
10,4 K
Комментировать ответ…Комментировать…
Сергей Лабух
Временно не работаю. Увлекаюсь путешествиями, астронимией,автомобилями и пр. · 11 янв 2022
Я думаю ничто не сможет препятствовать переходу в газообразное состояние при такой температуре. Огромное давление разнесет всё. Хотя с другой стороны чисто пренебречь и представить что будет,какие процессы и при 5 млн. градусов и 50 млн градусов и может быть еще больше.
Комментировать ответ…Комментировать…
Расщепление воды с эффективностью 100%: полдела сделано / Хабр
alizarВремя на прочтение 2 мин
Количество просмотров71K
Научно-популярное Энергия и элементы питания Нанотехнологии Химия
Если найти дешёвый и простой способ электролиза/фотолиза воды, то мы получим невероятно богатый и чистый источник энергии — водородное топливо. Сгорая в кислороде, водород не образует никаких побочных выделений, кроме воды. Теоретически, электролиз — очень простой процесс: достаточно пропустить электрический ток через воду, и она разделяется на водород и кислород. Но сейчас все разработанные техпроцессы требуют такого большого количества энергии, что электролиз становится невыгодным.
Теперь учёные решили часть головоломки. Исследователи из Технион-Израильского технологического института разработали метод проведения второго из двух шагов окислительно-восстановительной реакции — восстановления — в видимом (солнечном) свете с энергетической эффективностью 100%, значительно превзойдя предыдущий рекорд 58,5%.
Осталось усовершенствовать полуреакцию окисления.
Столь высокой эффективности удалось добиться благодаря тому, что в процессе используется только энергия света. Катализаторами (фотокатализаторами) выступают наностержни длиной 50 нм. Они абсорбируют фотоны от источника освещения — и выдают электроны.
В полуреакции окисления производятся четыре отдельных атома водорода и молекула О2 (которая не нужна). В полуреакции восстановления четыре атома водорода спариваются в две молекулы H2, производя полезную форму водорода — газ H2,
Эффективность 100% означает, что все фотоны, поступившие в систему, участвуют в генерации электронов.
На такой эффективности каждый наностержень генерирует около 100 молекул H2 в секунду.
Сейчас учёные работают над оптимизацией техпроцесса, который пока что требует щелочной среды с невероятно высоким pH. Такой уровень никак не приемлем для реальных условий эксплуатации.
К тому же, наностержни подвержены коррозии, что тоже не слишком хорошо.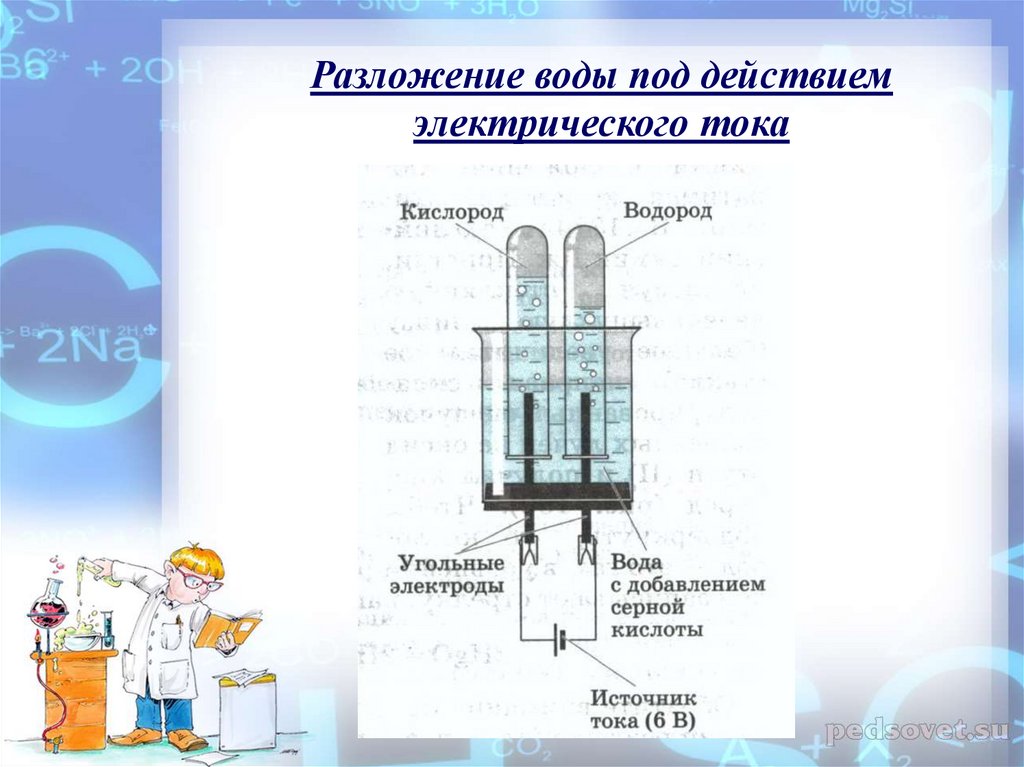
Тем не менее, сегодня человечество стало на шажок ближе к получению неиссякаемого источника чистой энергии в виде водородного топлива.
Научная работа опубликована в журнале Nano Letters (зеркало).
Теги:
- вода
- электролиз
- восстановление
- водородное топливо
- солнечная энергия
- фотолиз
Хабы:
- Научно-популярное
- Энергия и элементы питания
- Нанотехнологии
- Химия
Всего голосов 26: ↑23 и ↓3 +20
Комментарии 75
Анатолий Ализар @alizar
автор, фрилансер
Telegram
Комментарии Комментарии 75
вода — Термическое разложение пара на водород и кислород; при какой температуре наполовину разлагается и как рассчитать?
Задавать вопрос
спросил
Изменено 3 года, 3 месяца назад
Просмотрено 870 раз
$\begingroup$
В комментариях под этим ответом в Space Exploration SE я сказал:
(Википедия) говорит, что диссоциация воды стоит около 4,4 эВ на связь.
Если 𝑘𝐵𝑇= 4,4 эВ и $k_B$ равно 8,617E-05 эВ/К, то это соответствует характерной температуре примерно 50 000 К . Близок ли выхлоп ядерной ракеты к этому? (понятия не имею)
и ответ был:
, но en.wikipedia.org/wiki/Water_splitting говорит 3000 К . Кто-нибудь может прояснить?
Эта статья в Википедии на самом деле говорит:
При очень высокой температуре 3000 °C более половины молекул воды разлагается, но при температуре окружающей среды только одна молекула из 100 триллионов диссоциирует под действием тепла.
Вопрос: Если для разрыва одной водородно-кислородной связи требуется 4,4 эВ, как может половина воды диссоциировать только при 3273 К , где $k_B T$ всего около 0,28 эВ?
$$\exp \left( -\frac{0,28 \\text{эВ}}{4,4 \\\текст{эВ}} \right) \приблизительно 0,94$$
поэтому я наивно ожидал только около 6% воды диссоциировать при температуре 3000°С.
update: Я только что понял, что по своей наивности я забыл учесть, что образование h3 и O2 из свободных атомов H и O, вероятно, является экзотермическим, поэтому мои 4,4 эВ являются завышенной оценкой разницы энергий между начальными и конечные состояния. Но я не знаю, как это учесть.
- вода
- разложение
$\endgroup$
2
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Могут ли синтез и разложение воды находиться в динамическом равновесии?
$\begingroup$
При нагревании до экстремальных температур вода может самопроизвольно разлагаться.
Согласно Википедии (https://en.wikipedia.org/wiki/Water_splitting):
При термолизе молекулы воды расщепляются на атомарные составляющие водород и кислород. Например, при 2200 °С около трех процентов всего Н3О диссоциирует на различные сочетания атомов водорода и кислорода, в основном Н, Н3, О, О2 и ОН. Другие продукты реакции, такие как h3O2 или HO2, остаются незначительными. При очень высокой температуре 3000 °C более половины молекул воды разлагается , но при температуре окружающей среды только одна молекула из 100 триллионов диссоциирует под воздействием тепла.[15] Высокие температуры и материальные ограничения ограничивают применение этого подхода.
Будут ли при этих температурах водород и кислород (и их комбинация) реагировать с образованием воды? Если да, то можно ли считать это динамическим равновесием?
- равновесие
- вода
$\endgroup$
2
$\begingroup$
Рассматриваемая вами реакция:
$\ce{h3 (г) + 1/2 O2 (г) -> h3O (г)}$
Константу равновесия можно охарактеризовать стандартной свободной энергией Гиббса реакции. , который можно рассчитать из энтальпии и энтропии.
Имеем при стандартных условиях $\Delta H° =\pu{-241,83 кДж моль-1}$ и $\Delta S°= \pu{-44,16 Дж К-1 моль-1}$. При 25 ° C это дает большое отрицательное значение свободной энергии Гиббса, поэтому в равновесии мы почти всегда имеем продукт (мы говорим, что реакция необратима). 9{-\frac {\Delta G°} {RT}}$ и, поскольку энтропия отрицательна, мы получим положительное значение $\Delta G$ при некоторой (очень высокой) температуре.


 Если 𝑘𝐵𝑇= 4,4 эВ и $k_B$ равно 8,617E-05 эВ/К, то это соответствует характерной температуре примерно 50 000 К . Близок ли выхлоп ядерной ракеты к этому? (понятия не имею)
Если 𝑘𝐵𝑇= 4,4 эВ и $k_B$ равно 8,617E-05 эВ/К, то это соответствует характерной температуре примерно 50 000 К . Близок ли выхлоп ядерной ракеты к этому? (понятия не имею)