Строение, свойства и функции воды
Цель урока: сформировать представление о целостной картине мира на примере вещества воды, осуществив интеграцию знаний учащихся, полученных в курсах физики, химии и биологии.
Задачи урока:
- Образовательные: усвоение всеми учащимися стандартного минимума фактических сведений о строении и функциях воды на всех уровнях организации живого.
- Развивающие: совершенствование надпредметных умений сравнивать и анализировать, устанавливать причинно-следственные связи; переводить информацию в графический вид (таблицу), постановки и решения проблем; оперировать понятиями и связывать с ранее полученными знаниями в курсах ботаники, зоологии, анатомии; рассуждать по аналогии, развивать память, произвольное внимание.
- Воспитательные: развивать интерес к окружающим явлениям, умение работать в парах и в коллективе, вести диалог, слушать товарищей, оценивать себя и других, формировать культуру речи.

Планируемые результаты: умение характеризовать функции вещества на основе строения и свойств; обобщение полученных знаний о функциях воды на разных уровнях организации живого в форме таблицы.
Тип урока: изучение нового материала и первичное закрепление знаний.
Методы обучения: беседа, рассказ учителя, показ иллюстраций, презентации, индивидуальная работа с текстом, контроль знаний.
Формы организации учебной деятельности: работа в парах (составление обобщающей таблицы), индивидуальная, фронтальная, эксперимент.
Ход урока
Организационный момент (2 мин.): поздороваться, представиться детям.
Введение (5 мин.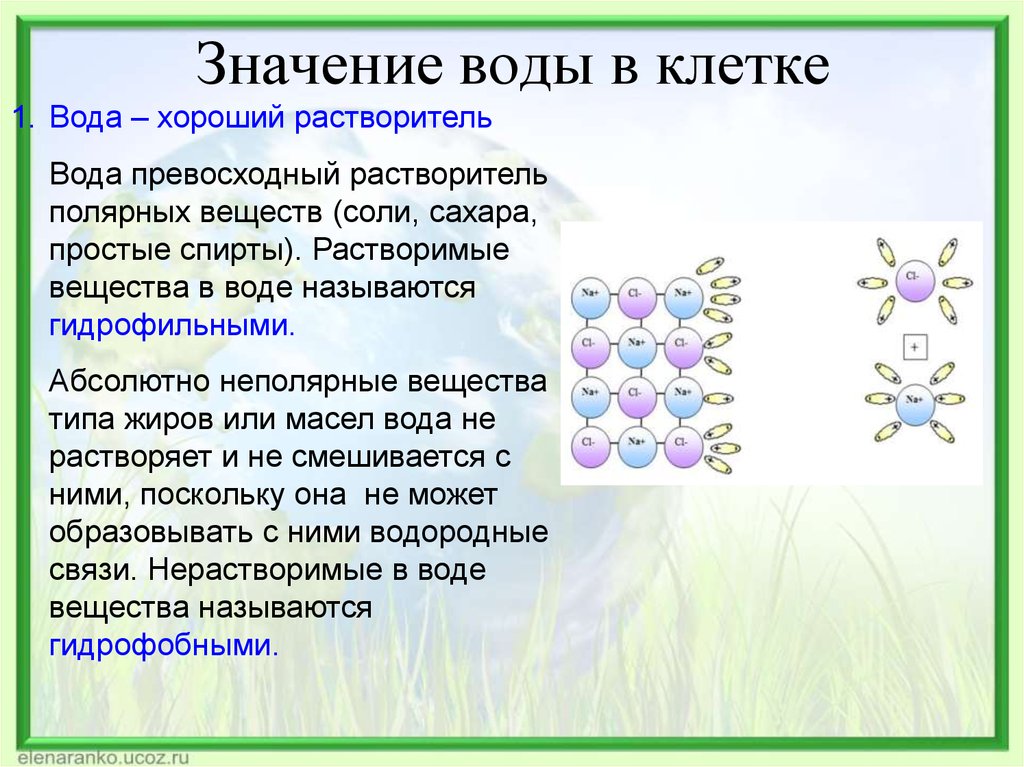 ):
):
Вода – самое распространенное и удивительное на Земле вещество (например, расширяется при охлаждении, замерзает уже при 0 0С, кипит при 100 0С, выполняет множество функций и даже может хранить информацию). Ею заполнены океаны, моря, озера и реки; пары воды входят и в состав воздуха. Вода содержится в клетках всех живых организмов (животных, растений, грибов, бактерий) в значительных количествах: организме млекопитающих массовая доля воды составляет примерно 70%, а в огурцах и арбузах ее около 90%, в костях человека – 45 %, а в мозге до 90 %.
Цели урока: почему воды больше всего в составе живых организмов? Почему вода покрывает большую часть суши? Как вода сохраняет информацию? На эти вопросы нам с вами предстоит ответить в конце урока.
Как будем работать: беседуем, я рассказываю, показываю иллюстрации и схемы (Презентация), в процессе объяснения заполняем пропущенные слова в распечатках (Приложение 1).
Демонстрационные опыты:
Опыт № 1:
Цель опыта: доказать растворимость веществ в воде.
Ход опыта: насыпать в колбу с водой соль или сахар. Размешать.
Результат: соль (сахар) полностью растворились.
Вывод: вода – хороший растворитель.
Опыт № 2
Цель опыта: доказать способность воды передвигаться по сосудам стебля за счет корневого давления и присасывающей силы испарения.
Ход опыта: поставить на сутки укоренившийся побег бальзамина в раствор чернил.
Результат: стебель и некоторые листья бальзамина окрасились в синий цвет.
Вывод: вода передвигается по сосудам стебля за счет сил сцепления между молекулами при помощи корневого давления и присасывающей силы испарения..
Опыт № 3:
Цель опыта: доказать способность воды двигаться в область меньшей концентрации растворителя.
Ход опыта: в две чашки Петри поместить одинаковые кусочки картофеля. В одну чашку налить воду, в другую – концентрированный раствор соли.
Результат: картофель в простой воде набух, а в концентрированном растворе соли сморщился.
Вывод: молекулы воды двигаются в область меньшей концентрации растворителя.
Объяснение нового материала (20 мин.):
Проводится в форме беседы. Изучаем вещества по определенному плану (пишу на доске): строение – свойства – функции на системных уровнях организации живого.
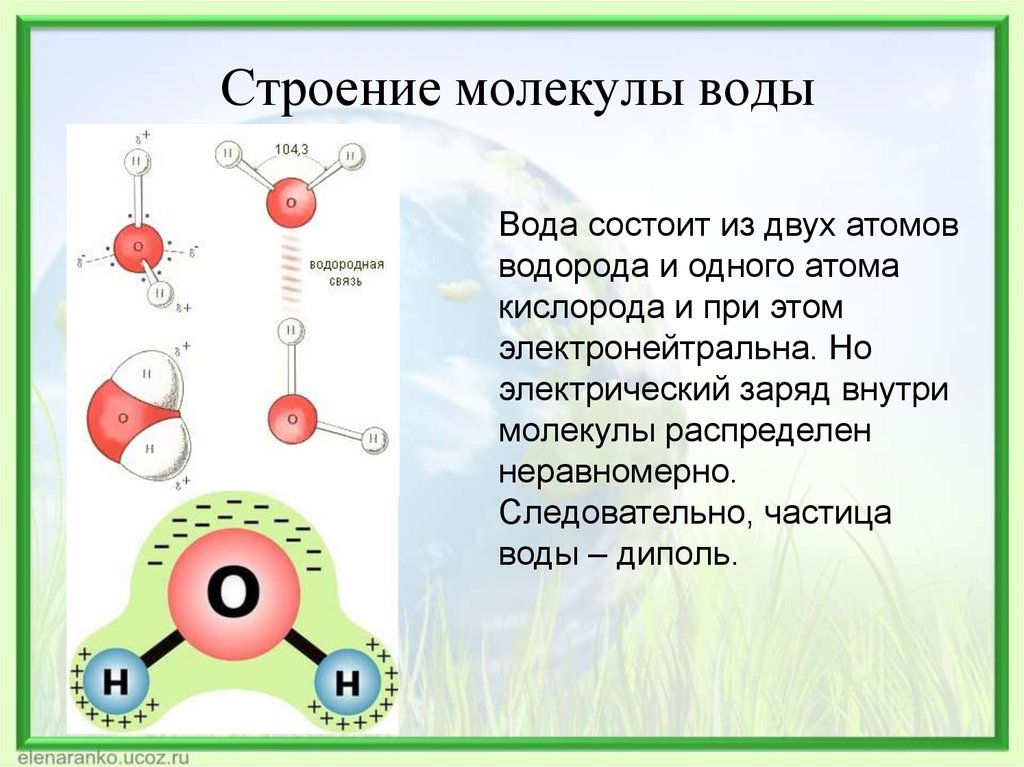
Строение молекулы и межмолекулярные связи | Свойства |
|---|---|
Молекула воды имеет угловую форму: атомы водорода по отношению к кислороду образуют угол, равный примерно 105 0. Поэтому молекула воды – диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород – отрицательно. |
Вода – хороший растворитель. Растворы образуются путем взаимодействия растворенного вещества с частицами растворителя. Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. |
|
Вода – реагент в реакциях гидролиза (разрушение сложных химических веществ под действием воды до более простых с новыми свойствами) и ряде других реакций |
Водородные связи между молекулами воды |
Растворы ряда веществ образуются за счет водородных связей между веществом и молекулами растворителя (сахара, газы) |
Водородных связей много, поэтому необходимо много энергии для их разрыва.
|
Вода обладает хорошей теплопроводностью и большой теплоемкостью. Вода медленно нагревается и медленно остывает. |
Водородные связи слабые |
Молекулы воды подвижны относительно друг друга |
Силы межмолекулярного сцепления образуют пространства между молекулами |
Вода практически не сжимается |
Образование водородных связей между молекулами воды и других веществ |
Вода характеризуется оптимальным для биологических систем значением силы поверхностного натяжения, текучесть воды Опыт № 2 |
Вода замерзает при 0 0С, при замерзании образуется много водородных связей, возникают пространства между молекулами |
Максимальная плотность воды при 4 С° равна 1 г/см3, лед имеет меньшую плотность, и всплывает на ее поверхность. |
| Функции на системных уровнях организации живого |
|---|
Вода обеспечивает диффузию — пассивный транспорт веществ в клетку и из нее в область меньшей концентрации (осмос) и пиноцитоз, а также транспорт веществ из клетки. |
|
Гидрофильные вещества проникают внутрь клетки. |
Вода – терморегулятор. |
«Смазочный материал» в суставах, плевральной полости и околосердечной сумке. |
|
Капиллярный кровоток, движение веществ в капиллярах почвы, восходящий и нисходящий ток растворов в растениях. |
Лед защищает водоемы от промерзания. |
Вода может хранить информацию (Приложение 2).
Закрепление (13 мин.):
Биологические задачи:
- Показать синюю или зеленую хризантему. Как создают такие растения? Являются ли они результатом селекционной работы?
- Почему кожа на пальцах при длительном купании сморщивается?
- Почему сморщивается яблоко, лежащее в тепле?
Разделить класс на три группы (по рядам). Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Первая группа выписывает в тетрадь функции воды на уровне живой клетки. Вторая группа – на уровне живого организма. Третья группа – на уровне экосистем и биосферы. В конце работы оценить себя по количеству найденных функций. Работа ведется по парам.
Функции воды
| В живой клетке | В живом организме | В экосистемах и биосфере |
|---|---|---|
1. Транспорт веществ в клетке. |
1. Охлаждение организмов. |
1. Дыхание и фотосинтез водных организмов. |
2. Основная среда всех биохимических процессов. |
2. «Смазочный материал» в суставе, плевральной полости, околосердечной сумке, глазном яблоке. |
2. Регуляция температуры на планете. |
3. |
3. Гидростатический скелет. |
3. Благоприятная среда обитания для живых организмов. |
4. Сохранение структуры клетки. |
4. Защита плода млекопитающих. |
4. Защита водоемов от промерзания. |
5. Тургорное давление. |
5. Капиллярный кровоток, нисходящий и восходящий ток в растениях. |
5. Часть среды обитания животных. |
|
|
6. Подъем почвенных растворов по капиллярам почвы. |
Подведение итогов урока, оценка работы (2 мин.)
Словарик (Приложение 2)
Дистанционный репетитор — онлайн-репетиторы России и зарубежья
КАК ПРОХОДЯТ
ОНЛАЙН-ЗАНЯТИЯ?
Ученик и учитель видят и слышат
друг друга, совместно пишут на
виртуальной доске, не выходя из
дома!
КАК ВЫБРАТЬ репетитора
Выбрать репетитора самостоятельно
ИЛИ
Позвонить и Вам поможет специалист
8 (800) 333 58 91
* Звонок является бесплатным на территории РФ
** Время приема звонков с 10 до 22 по МСК
ПОДАТЬ ЗАЯВКУ
Россия +7Украина +380Австралия +61Белоруссия +375Великобритания +44Израиль +972Канада, США +1Китай +86Швейцария +41
Выбранные репетиторы
Заполните форму, и мы быстро и бесплатно подберем Вам дистанционного репетитора по Вашим пожеланиям.
Менеджер свяжется с Вами в течение 15 минут и порекомендует специалиста.
Отправляя форму, Вы принимаете Условия использования и даёте Согласие на обработку персональных данных
Вы также можете воспользоваться
расширенной формой подачи заявки
Как оплачивать и СКОЛЬКО ЭТО СТОИТ
от
800 до 5000 ₽
за 60 мин.
и зависит
ОТ ОПЫТА и
квалификации
репетитора
ОТ ПОСТАВЛЕННЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
(например, подготовка к олимпиадам, ДВИ стоит дороже, чем подготовка к ЕГЭ)
ОТ ПРЕДМЕТА (например, услуги репетиторовиностранных языков дороже)
Оплата непосредственно репетитору, удобным для Вас способом
Почему я выбираю DisTTutor
БЫСТРЫЙ ПОДБОР
РЕПЕТИТОРА И
ИНДИВИДУАЛЬНЫЙ ПОДХОД
ОПТИМАЛЬНОЕ
СООТНОШЕНИЕ ЦЕНЫ И
КАЧЕСТВА
ПРОВЕРЕНЫ ДОКУМЕНТЫ ОБ ОБРАЗОВАНИИ У ВСЕХ РЕПЕТИТОРОВ
НАДЕЖНОСТЬ И ОПЫТ.
DisTTutor на рынке с 2008 года.
ПРОВЕДЕНИЕ БЕСПЛАТНОГО, ПРОБНОГО УРОКА
ЗАМЕНА РЕПЕТИТОРА, ЕСЛИ ЭТО НЕОБХОДИМО
376488 УЧЕНИКОВ ИЗ РАЗНЫХ СТРАН МИРА
уже сделали свой выбор
И вот, что УЧЕНИКИ ГОВОРЯТ
о наших репетиторах
Чулпан Равилевна Насырова
«
Я очень довольна репетитором по химии. Очень хороший подход к ученику,внятно объясняет. У меня появились сдвиги, стала получать хорошие оценки по химии. Очень хороший преподаватель. Всем , кто хочет изучать химию, советую только её !!!
«
Алина Крякина
Надежда Васильевна Токарева
«
Мы занимались с Надеждой Васильевной по математике 5 класса. Занятия проходили в удобное для обоих сторон время. Если необходимо было дополнительно позаниматься во внеурочное время, Надежда Васильевна всегда шла навстречу. Ей можно было позванить, чтобы просто задать вопрос по непонятной задачке из домашнего задания. Моя дочь существенно подняла свой уровень знаний по математике и начала демонстрировать хорошие оценки. Мы очень благодарны Надежде Васильевне за помощь в этом учебном году, надеемся на продолжение отношений осенью.
Мы очень благодарны Надежде Васильевне за помощь в этом учебном году, надеемся на продолжение отношений осенью.
«
Эльмира Есеноманова
Ольга Александровна Мухаметзянова
«
Подготовку к ЕГЭ по русскому языку мой сын начал с 10 класса. Ольга Александровна грамотный педагог, пунктуальный, ответственный человек. Она всегда старается построить занятие так, чтобы оно прошло максимально плодотворно и интересно. Нас абсолютно все устраивает в работе педагога. Сотрудничество приносит отличные результаты, и мы его продолжаем. Спасибо.
«
Оксана Александровна
Наталья Борисовна Карасева
«
Мы восторге от репетитора. Наталья Борисовна грамотный педагог, она любит свою профессию, любит учеников. Занятия с сыном (2 класс), он находится на домашнем обучении, проходят по скайпу в комфортной обстановке. Репетитор умеет заинтересовать ребенка и выстраивает занятие с учетом его способностей, доступно объясняя предметы русский язык и математику. По результатам занятий можно сразу заметить повышение уровня успеваемости ученика. Наталья Борисовна хороший педагог, умеет быстро найти общий язык с ребенком, внимательная, легко передающая знания ученику. С большим удовольствием будем продолжать наши занятия, т.к. мы всем довольны.
По результатам занятий можно сразу заметить повышение уровня успеваемости ученика. Наталья Борисовна хороший педагог, умеет быстро найти общий язык с ребенком, внимательная, легко передающая знания ученику. С большим удовольствием будем продолжать наши занятия, т.к. мы всем довольны.
«
Елена Васильевна
Клиентам
- Репетиторы по математике
- Репетиторы по русскому языку
- Репетиторы по химии
- Репетиторы по биологии
- Репетиторы английского языка
- Репетиторы немецкого языка
Репетиторам
- Регистрация
- Публичная оферта
- Библиотека
- Бан-лист репетиторов
Партнеры
- ChemSchool
-
PREPY.
 RU
RU
- Class
2.5: Свойства воды — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 74484
- OpenStax
- OpenStax
Навыки для развития
- Описать свойства воды, имеющие решающее значение для поддержания жизни
- Объясните, почему вода является отличным растворителем
- Приведите примеры когезионных и адгезивных свойств воды
- Обсудите роль кислот, оснований и буферов в гомеостазе
Почему ученые тратят время на поиски воды на других планетах? Почему вода так важна? Это потому, что вода необходима для жизни, какой мы ее знаем. Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Примерно 60–70 процентов человеческого тела состоит из воды. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Примерно 60–70 процентов человеческого тела состоит из воды. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Полярность молекулы воды и возникающие в результате водородные связи делают воду уникальным веществом с особыми свойствами, которые тесно связаны с процессами жизни. Первоначально жизнь развивалась в водной среде, и большая часть клеточной химии и метаболизма организма происходит внутри водянистого содержимого цитоплазмы клетки. К особым свойствам воды относятся ее высокая теплоемкость и теплота парообразования, способность растворять полярные молекулы, ее когезионные и адгезивные свойства, а также ее диссоциация на ионы, что приводит к образованию рН. Понимание этих характеристик воды помогает понять ее важность для поддержания жизни.
Полярность воды
Одним из важных свойств воды является то, что она состоит из полярных молекул: водород и кислород внутри молекул воды (H 2 O) образуют полярные ковалентные связи. В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный, чем водород, что повышает вероятность того, что общий электрон будет находиться рядом с ядром кислорода, а не с ядром водорода, что создает частичный отрицательный заряд вблизи кислорода.
В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Заряды воды образуются из-за того, что кислород более электроотрицательный, чем водород, что повышает вероятность того, что общий электрон будет находиться рядом с ядром кислорода, а не с ядром водорода, что создает частичный отрицательный заряд вблизи кислорода.
В результате полярности воды каждая молекула воды притягивает другие молекулы воды из-за противоположных зарядов между молекулами воды, образуя водородные связи. Вода также притягивает или притягивается к другим полярным молекулам и ионам. Полярное вещество, которое легко взаимодействует с водой или растворяется в ней, называется гидрофильным (гидро- = «вода»; -фильный = «любящий»). Напротив, неполярные молекулы, такие как масла и жиры, плохо взаимодействуют с водой, как показано на рисунке \(\PageIndex{1}\), и отделяются от нее, а не растворяются в ней, как мы видим в заправках для салатов, содержащих масло. и уксус (кислый водный раствор). Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
и уксус (кислый водный раствор). Эти неполярные соединения называются гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Образование водородных связей является важным свойством жидкой воды, которое имеет решающее значение для жизни, какой мы ее знаем. Поскольку молекулы воды образуют водородные связи друг с другом, вода приобретает некоторые уникальные химические характеристики по сравнению с другими жидкостями, и, поскольку живые существа имеют высокое содержание воды, понимание этих химических свойств является ключом к пониманию жизни. В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Разрыв этих связей вызывается движением (кинетической энергией) молекул воды за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление не наблюдается при затвердевании других жидкостей.
Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). С другой стороны, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление не наблюдается при затвердевании других жидкостей.
Более низкая плотность воды в ее твердом состоянии обусловлена тем, как ориентируются водородные связи при замерзании: молекулы воды раздвигаются дальше друг от друга по сравнению с жидкой водой. Для большинства других жидкостей затвердевание при понижении температуры включает снижение кинетической энергии между молекулами, что позволяет им упаковываться даже более плотно, чем в жидкой форме, и придает твердому телу большую плотность, чем жидкость.
Низкая плотность льда, показанная и изображенная на рисунке \(\PageIndex{2}\), представляет собой аномалию, заставляющую его плавать на поверхности жидкой воды, например, в айсберге или в кубиках льда в стакане. ледяной воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, который защищает животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
ледяной воды. В озерах и прудах лед образуется на поверхности воды, создавая изолирующий барьер, который защищает животных и растения в пруду от замерзания. Без этого слоя изолирующего льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Губительное действие замерзания на живые организмы обусловлено расширением льда относительно жидкой воды. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если вода в них временно заменена другой жидкостью, такой как глицерин.
Ссылка на обучение
Видео: Нажмите здесь, чтобы увидеть трехмерную анимацию структуры ледяной решетки.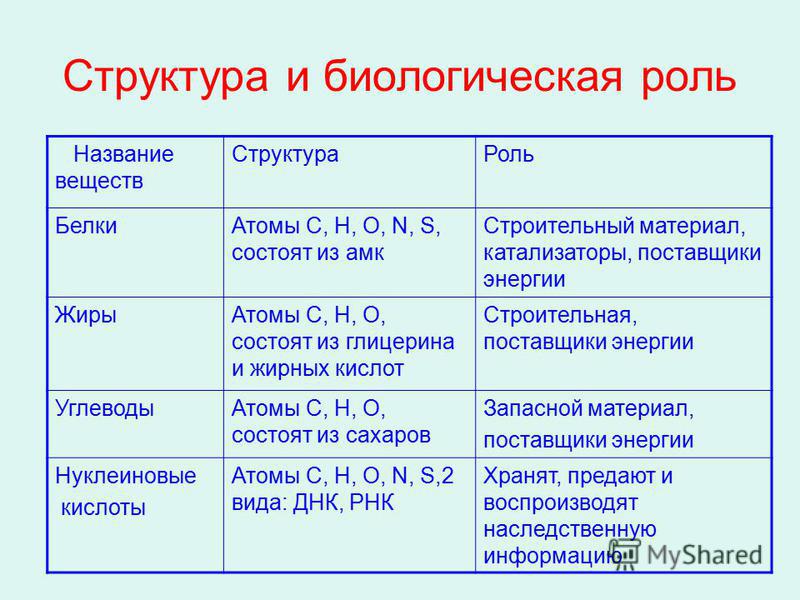 (Изображение предоставлено Джейн Уитни. Изображение создано с помощью программного обеспечения Visual Molecular Dynamics VMD. 2 )
(Изображение предоставлено Джейн Уитни. Изображение создано с помощью программного обеспечения Visual Molecular Dynamics VMD. 2 )
Высокая теплоемкость воды
Высокая теплоемкость воды является свойством, обусловленным водородными связями между молекулами воды. Вода обладает наибольшей удельной теплоемкостью среди всех жидкостей. Удельная теплоемкость определяется как количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия. Для воды это количество составляет одну калорию. Поэтому вода долго нагревается и долго охлаждается. На самом деле удельная теплоемкость воды примерно в пять раз больше, чем у песка. Это объясняет, почему суша остывает быстрее, чем море. Благодаря своей высокой теплоемкости вода используется теплокровными животными для более равномерного распределения тепла в их телах: она действует аналогично системе охлаждения автомобиля, перенося тепло из теплых мест в холодные, заставляя тело поддерживать более равномерная температура.
Теплота испарения воды
Вода также имеет высокую теплоту парообразования, количество энергии, необходимое для превращения одного грамма жидкого вещества в газ. Для осуществления этого превращения воды требуется значительное количество тепловой энергии (586 кал). Этот процесс происходит на поверхности воды. Когда жидкая вода нагревается, водородные связи затрудняют отделение молекул жидкой воды друг от друга, что необходимо для ее перехода в газообразную фазу (пар). В результате вода действует как поглотитель или резервуар тепла, и для ее кипения требуется гораздо больше тепла, чем для такой жидкости, как этанол (зерновой спирт), водородная связь которого с другими молекулами этанола слабее, чем водородная связь воды. В конце концов, когда вода достигает точки кипения 100 ° по Цельсию (212 ° по Фаренгейту), тепло может разорвать водородные связи между молекулами воды, а кинетическая энергия (движение) между молекулами воды позволяет им покинуть жидкость. как газ. Даже когда температура ниже точки кипения, отдельные молекулы воды получают достаточно энергии от других молекул воды, так что некоторые молекулы воды с поверхности могут ускользнуть и испариться: этот процесс известен как испарение.
Тот факт, что для испарения воды необходимо разорвать водородные связи, означает, что в процессе используется значительное количество энергии. Когда вода испаряется, процесс потребляет энергию, охлаждая окружающую среду, в которой происходит испарение. У многих живых организмов, в том числе и у человека, испарение пота, состоящего на 90 % из воды, позволяет организму охлаждаться для поддержания гомеостаза температуры тела.
Растворяющие свойства воды
Поскольку вода представляет собой полярную молекулу со слегка положительным и слегка отрицательным зарядом, ионы и полярные молекулы могут легко растворяться в ней. Поэтому воду называют растворителем, веществом, способным растворять другие полярные молекулы и ионные соединения. Заряды, связанные с этими молекулами, будут образовывать водородные связи с водой, окружая частицу молекулами воды. Это называется сферой гидратации или гидратной оболочкой, как показано на рисунке \(\PageIndex{3}\), и служит для разделения или диспергирования частиц в воде.
При добавлении к воде ионных соединений отдельные ионы реагируют с полярными областями молекул воды, и их ионные связи разрываются в процессе диссоциации. Диссоциация происходит, когда атомы или группы атомов отрываются от молекул и образуют ионы. Рассмотрим поваренную соль (NaCl или хлорид натрия): когда кристаллы NaCl добавляют в воду, молекулы NaCl диссоциируют на ионы Na + и Cl – , а вокруг ионов образуются сферы гидратации, как показано на рисунке \( \ИндексСтраницы{3}\). Положительно заряженный ион натрия окружен частично отрицательным зарядом кислорода молекулы воды. Отрицательно заряженный ион хлора окружен частично положительным зарядом водорода на молекуле воды.
Рисунок \(\PageIndex{3}\): Когда поваренная соль (NaCl) смешивается с водой, вокруг ионов образуются сферы гидратации.Когезионные и адгезивные свойства воды
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Когезия допускает развитие поверхностного натяжения, способности вещества противостоять разрыву при воздействии на него напряжения или напряжения. По этой же причине вода образует капли, когда ее кладут на сухую поверхность, а не расплющивают под действием силы тяжести. Когда небольшой клочок бумаги помещается на каплю воды, бумага плавает поверх капли воды, даже если бумага плотнее (тяжелее), чем вода. Когезия и поверхностное натяжение сохраняют водородные связи молекул воды неповрежденными и поддерживают плавание предмета на поверхности. Можно даже «поплавать» иглой над стаканом с водой, если положить ее осторожно, не нарушая поверхностного натяжения, как показано на рисунке \(\PageIndex{4}\).
Рисунок \(\PageIndex{4}\): Вес иглы тянет поверхность вниз; в то же время поверхностное натяжение тянет его вверх, удерживая на поверхности воды и удерживая от погружения. Обратите внимание на углубление в воде вокруг иглы. (кредит: Кори Занкер)
Обратите внимание на углубление в воде вокруг иглы. (кредит: Кори Занкер)Эти силы сцепления связаны со свойством воды прилипать или притяжением между молекулами воды и другими молекулами. Это притяжение иногда сильнее, чем силы сцепления воды, особенно когда вода подвергается воздействию заряженных поверхностей, таких как те, которые находятся внутри тонких стеклянных трубок, известных как капиллярные трубки. Адгезия наблюдается, когда вода «поднимается» вверх по трубке, помещенной в стакан с водой: обратите внимание, что вода кажется выше по бокам трубки, чем в середине. Это связано с тем, что молекулы воды притягиваются к заряженным стеклянным стенкам капилляра сильнее, чем друг к другу, и поэтому прилипают к нему. Этот тип адгезии называется капиллярным действием и показан на рисунке \(\PageIndex{5}\).
Рисунок \(\PageIndex{5}\): Капиллярное действие в стеклянной трубке вызвано силами сцепления, создаваемыми внутренней поверхностью стекла, превышающими силы сцепления между самими молекулами воды. (кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)
(кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)Почему когезионные и адгезионные силы важны для жизни? Когезионные и адгезионные силы важны для транспорта воды от корней к листьям растений. Эти силы создают «притяжение» к толще воды. Это притяжение возникает из-за тенденции молекул воды, испаряющихся на поверхности растения, оставаться связанными с молекулами воды под ними, и поэтому они притягиваются. Растения используют это природное явление, чтобы переносить воду от корней к листьям. Без этих свойств воды растения не смогли бы получать воду и растворенные минералы, которые им необходимы. В другом примере насекомые, такие как водомерка, показанная на рисунке \(\PageIndex{6}\), используют поверхностное натяжение воды, чтобы оставаться на плаву в поверхностном слое воды и даже спариваются там. 9- (aq)} \nonumber\]
лакмусовая или pH-бумага, фильтровальная бумага, обработанная натуральным водорастворимым красителем, чтобы ее можно было использовать в качестве индикатора pH для определения содержания кислоты (кислотности) или основания ( щелочность) существует в растворе. Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.
Ионы водорода спонтанно образуются в чистой воде путем диссоциации (ионизации) небольшого процента молекул воды на равное количество водорода (H + ) ионов и гидроксид (ОН — ) ионов. В то время как ионы гидроксида удерживаются в растворе за счет водородных связей с другими молекулами воды, ионы водорода, состоящие из голых протонов, немедленно притягиваются к неионизированным молекулам воды, образуя ионы гидроксония (H 3 0 + ). Тем не менее, условно ученые относятся к ионам водорода и их концентрации так, как если бы они находились в этом состоянии в жидкой воде в свободном состоянии.
Концентрация ионов водорода, диссоциирующих из чистой воды, составляет 1 × 10 -7 моль H + ионов на литр воды. Моли (mol) — это способ выражения количества вещества (которым могут быть атомы, молекулы, ионы и т. д.), при этом один моль равен 6,02 x 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
д.), при этом один моль равен 6,02 x 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 х 10 23 молекул воды. pH рассчитывается как отрицательная величина логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, которое также известно как нейтральное значение pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
Ненейтральные показания рН возникают в результате растворения кислот или оснований в воде. Используя отрицательный логарифм для получения положительных целых чисел, высокие концентрации ионов водорода дают низкое число pH, тогда как низкие уровни ионов водорода приводят к высокому pH. Кислота — это вещество, которое увеличивает концентрацию ионов водорода (H + ) в растворе, обычно за счет диссоциации одного из его атомов водорода. Основание обеспечивает либо гидроксид-ионы (OH —), либо другие отрицательно заряженные ионы, которые соединяются с ионами водорода, уменьшая их концентрацию в растворе и тем самым повышая pH. В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота (HCl) полностью диссоциирует на ионы водорода и хлора и является очень кислой, тогда как кислоты в томатном соке или уксусе полностью не диссоциируют и считаются слабыми кислотами. И наоборот, сильные основания — это те вещества, которые легко отдают OH – или поглощают ионы водорода. Гидроксид натрия (NaOH) и многие бытовые чистящие средства сильно щелочные и выделяют OH – 9.0063 быстро при помещении в воду, тем самым повышая рН. Примером слабощелочного раствора является морская вода с pH около 8,0, что достаточно близко к нейтральному pH, чтобы морские организмы, адаптированные к этой соленой среде, могли процветать в ней.
Шкала рН, как упоминалось ранее, является обратным логарифмом и находится в диапазоне от 0 до 14 (Рисунок \(\PageIndex{7}\)). Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно считаются негостеприимными для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. Так как же клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Новые клетки желудка постоянно производятся для замены мертвых клеток, которые перевариваются кислотами желудка. Подсчитано, что слизистая оболочка человеческого желудка полностью обновляется каждые семь-десять дней.
Ссылка на обучение
Посмотрите это видео для простого объяснения pH и его логарифмической шкалы.
Так как же могут организмы, тела которых нуждаются в близком к нейтральному рН, поглощать кислые и щелочные вещества (например, человек, пьющий апельсиновый сок) и выживать? Буферы — это ключ. Буферы легко поглощают избыток H + или OH – , тщательно поддерживая pH тела в узком диапазоне, необходимом для выживания. Поддержание постоянного рН крови имеет решающее значение для благополучия человека. Буфер, поддерживающий pH крови человека, включает угольную кислоту (H 2 CO 3 ), ион бикарбоната (HCO 3 – ) и углекислый газ (CO 2 ). Когда ионы бикарбоната объединяются со свободными ионами водорода и становятся угольной кислотой, ионы водорода удаляются, что замедляет изменения pH. Точно так же, как показано на рисунке \(\PageIndex{8}\), избыточная углекислота может быть преобразована в углекислый газ и выдыхаться через легкие. Это предотвращает накопление слишком большого количества свободных ионов водорода в крови и опасное снижение pH крови.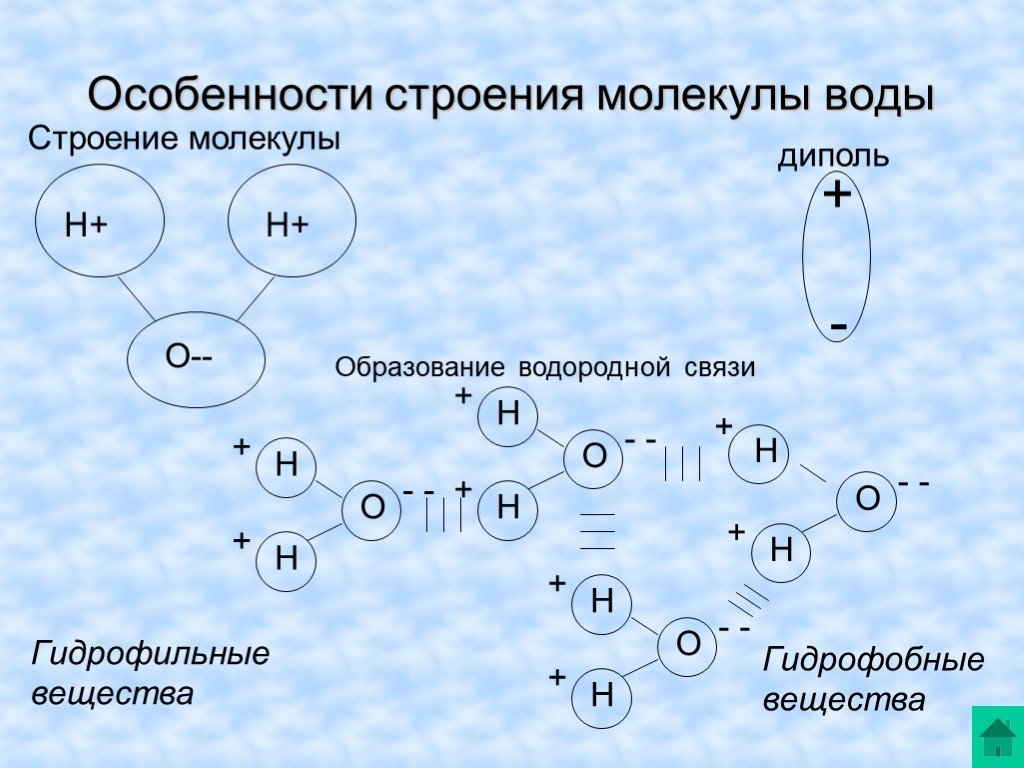 Аналогично, если слишком много OH – введен в систему, угольная кислота соединится с ним с образованием бикарбоната, понизив рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Аналогично, если слишком много OH – введен в систему, угольная кислота соединится с ним с образованием бикарбоната, понизив рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Другими примерами буферов являются антациды, используемые для борьбы с избытком желудочной кислоты. Многие из этих безрецептурных лекарств действуют так же, как буферы крови, обычно с по крайней мере одним ионом, способным поглощать водород и снижать рН, принося облегчение тем, кто страдает от «изжоги» после еды. Уникальные свойства воды, которые способствуют этой способности уравновешивать pH, а также другие характеристики воды, необходимы для поддержания жизни на Земле.
Ссылка на обучение
Чтобы узнать больше о воде. Посетите Геологическую службу США. Наука о воде для школ. Все о воде! Веб-сайт.
Резюме
Вода обладает многими свойствами, которые необходимы для поддержания жизни. Это полярная молекула, допускающая образование водородных связей. Водородные связи позволяют ионам и другим полярным молекулам растворяться в воде. Таким образом, вода является отличным растворителем. Водородные связи между молекулами воды приводят к тому, что вода обладает высокой теплоемкостью, а это означает, что для повышения ее температуры требуется много дополнительного тепла. При повышении температуры водородные связи между водой постоянно разрываются и формируются заново. Это позволяет общей температуре оставаться стабильной, хотя в систему добавляется энергия. Вода также обладает высокой теплотой испарения, что является ключом к тому, как организмы охлаждаются за счет испарения пота. Силы сцепления воды учитывают свойство поверхностного натяжения, тогда как ее адгезионные свойства проявляются, когда вода поднимается внутри капиллярных трубок. Значение pH является мерой концентрации ионов водорода в растворе и является одной из многих химических характеристик, которые строго регулируются в живых организмах посредством гомеостаза. Кислоты и основания могут изменять значения pH, но буферы имеют тенденцию смягчать вызываемые ими изменения. Эти свойства воды тесно связаны с биохимическими и физическими процессами, происходящими в живых организмах, и жизнь была бы совсем другой, если бы эти свойства изменились, если бы она вообще могла существовать.
Значение pH является мерой концентрации ионов водорода в растворе и является одной из многих химических характеристик, которые строго регулируются в живых организмах посредством гомеостаза. Кислоты и основания могут изменять значения pH, но буферы имеют тенденцию смягчать вызываемые ими изменения. Эти свойства воды тесно связаны с биохимическими и физическими процессами, происходящими в живых организмах, и жизнь была бы совсем другой, если бы эти свойства изменились, если бы она вообще могла существовать.
Сноски
- 1 W. Humphrey W., A. Dalke, and K. Schulten, «VMD—Visual Molecular Dynamics», Journal of Molecular Graphics 14 (1996): 33-38.
- 2 W. Humphrey W., A. Dalke и K. Schulten, «VMD-Visual Molecular Dynamics», Journal of Molecular Graphics 14 (1996): 33-38.
Глоссарий
- кислота
- молекула, отдающая ионы водорода и повышающая концентрацию ионов водорода в растворе
- адгезия
- притяжение между молекулами воды и другими молекулами
- база
- молекула, которая отдает ионы гидроксида или иным образом связывает избыток ионов водорода и снижает концентрацию ионов водорода в растворе
- буфер
- вещество, предотвращающее изменение pH за счет поглощения или выделения ионов водорода или гидроксида
- калорий
- количество теплоты, необходимое для изменения температуры одного грамма воды на один градус Цельсия
- капиллярное действие
- возникает из-за того, что молекулы воды притягиваются к зарядам на внутренних поверхностях узких трубчатых структур, таких как стеклянные трубки, притягивая молекулы воды к сторонам трубок
- сплоченность
- межмолекулярных сил между молекулами воды, вызванных полярной природой воды; отвечает за поверхностное натяжение
- диссоциация
- высвобождение иона из молекулы таким образом, что исходная молекула теперь состоит из иона и заряженных остатков исходной, например, когда вода диссоциирует на H + и ОХ —
- испарение
- выделение отдельных молекул с поверхности воды, листьев растений или кожи организма
- теплота парообразования воды
- требуется большое количество энергии для превращения жидкой воды в водяной пар
- гидрофильный
- описывает ионы или полярные молекулы, которые хорошо взаимодействуют с другими полярными молекулами, такими как вода
- гидрофобный
- описывает незаряженные неполярные молекулы, которые плохо взаимодействуют с полярными молекулами, такими как вода .

- лакмусовая бумага
- (также рН-бумага) фильтровальная бумага, обработанная натуральным водорастворимым красителем, который меняет свой цвет при изменении рН окружающей среды, поэтому ее можно использовать в качестве индикатора рН
- pH-бумага
- см. лакмусовую бумажку
- Шкала рН
- шкала от нуля до 14, что обратно пропорционально концентрации ионов водорода в растворе
- растворитель
- вещество, способное растворять другое вещество
- удельная теплоемкость
- Количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия
- сфера гидратации
- , когда полярная молекула воды окружает заряженные или полярные молекулы, удерживая их в растворенном состоянии и в растворе
- поверхностное натяжение
- напряжение на поверхности тела жидкости, препятствующее разделению молекул; создаваемые силами притяжения и сцепления между молекулами жидкости
Эта страница под названием 2.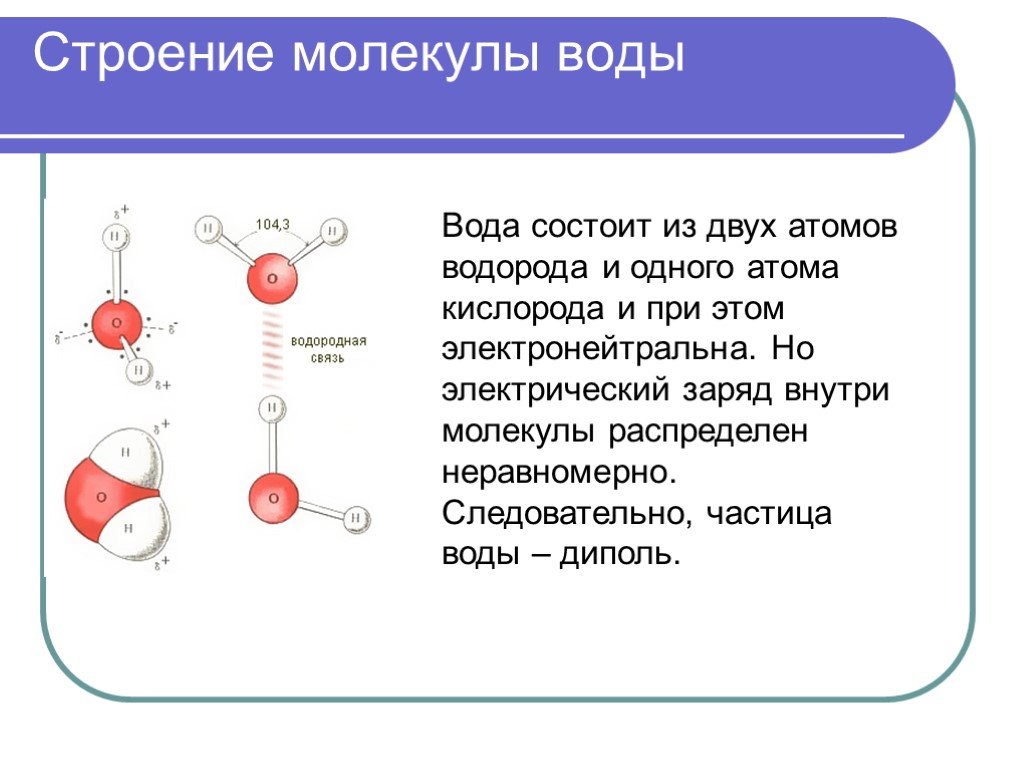 5: Свойства воды распространяется по лицензии CC BY и была создана, изменена и/или курирована OpenStax.
5: Свойства воды распространяется по лицензии CC BY и была создана, изменена и/или курирована OpenStax.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Программа OER или Publisher
- ОпенСтакс
- Показать оглавление
- нет
- Включено
- да
- Теги
- кислота
- адгезия
- база
- буфер
- капиллярное действие
- сплоченность
- диссоциация
- испарение
- теплота испарения воды
- гидрофильный
- гидрофобный
- лакмусовая бумага
- pH-бумага
- Шкала pH
- растворитель
- источник[1]-био-1785
- удельная теплоемкость
- сфера гидратации
- поверхностное натяжение
[AP Биология 1.
 1] Структура воды и водородных связей
1] Структура воды и водородных связейНЕПРЕРЫВНОЕ ПОНИМАНИЕ
SYI-1
Живые системы организованы в виде иерархии взаимодействующих структурных уровней.
ЦЕЛЬ ОБУЧЕНИЯ
SYI-1.A
Объяснить, как свойства воды, обусловленные ее полярностью и водородными связями, влияют на ее биологическую функцию.
ОСНОВНЫЕ ЗНАНИЯ
SYI-1.A.1
Субкомпоненты биологических молекул и их последовательность определяют свойства этой молекулы.
SYI-1.A.2
Живые системы зависят от свойств воды, которые являются результатом ее полярности и водородных связей.
SYI-1.A.3
Водородные связи между молекулами воды приводят к когезии, адгезии и поверхностному натяжению.
Большая идея этого первого урока AP Biology заключается в том, что жизнь существует как иерархия от атомов до всей планеты, с различными уровнями, взаимодействующими друг с другом, чтобы создать сложный биологический мир, который мы видим вокруг себя.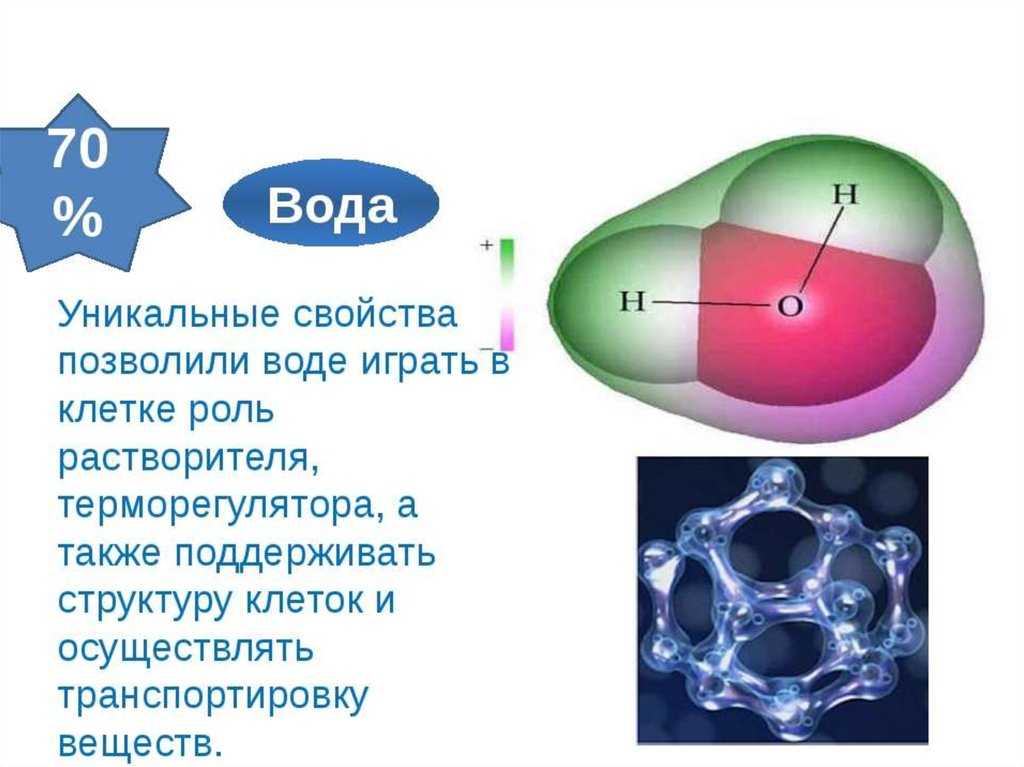
Начиная с самого маленького уровня — атомов — мы можем начать видеть правила и взаимодействия, которые создают основу для возникновения жизни. Фактически, большая часть наблюдаемой нами биологии — от поведения животных до того, как растения поворачиваются к солнцу, — является продуктом молекулярных взаимодействий внутри отдельных клеток. В общем, каждый атом по своей природе содержит ряд свойств, которые возникают из-за количества протонов, электронов и нейтронов в атоме. При объединении в молекулы , эти свойства могут взаимодействовать, создавая свойства молекулы в целом.
Пока мы все еще изучаем сложные взаимодействия между биологическими молекулами, которые помогают создавать целые организмы, есть одна молекула, которая имеет огромное значение для жизни. Мы называем это вещество водой.
Вода составляет примерно 60-90% от общей массы почти каждого организма. Вода не только составляет большую часть большинства клеток, но и является идеальным растворителем для растворения и распределения ряда молекул внутри клетки.
Вода обладает этой способностью, поскольку является полярной молекулой . Полярные молекулы не делят свои электроны поровну. Вода состоит из трех атомов — одного кислорода и двух атомов водорода — представленных химической формулой H 2 O. Атом кислорода гораздо более электроотрицательный, чем атомы водорода. Электроны внутри атома воды проводят гораздо больше времени, вращаясь вокруг атома кислорода, чем атомы водорода.
Эта водородная связь хорошо видна в структуре чистого льда. Молекулы воды внутри чистого льда образуют водородные связи друг с другом, создавая идеальную решетчатую структуру, как показано на изображении ниже. На самом деле водородные связи между молекулами удерживают каждую молекулу дальше друг от друга, чем обычно. Это делает лед менее плотным, чем жидкая вода, поэтому ваши кубики льда плавают в стакане с водой.
В результате молекула имеет более отрицательную и более положительную сторону. Более отрицательно заряженная молекула кислорода имеет тенденцию притягивать положительные заряды, а атомы водорода склонны притягивать отрицательные заряды. Именно это делает воду таким прекрасным полярным растворителем .
Именно это делает воду таким прекрасным полярным растворителем .
При растворении в воде других полярных веществ молекулы воды активно их раздвигают, равномерно распределяя введенные молекулы по всему раствору. Это называется диффузия , и это дает клеткам и организмам возможность легко распределять определенные полярные вещества по своим клеткам и телу.
С другой стороны, поскольку вода является полярным растворителем, она плохо смешивается с неполярными веществами. Клетки используют этот факт в своих интересах. Липидный бислой, окружающий все клетки, состоит из молекул с полярной головкой и неполярным хвостом. Полярные головы притягиваются к воде, а неполярные хвосты группируются вместе, чтобы исключить как можно больше воды. Полярные области «гидрофильны», потому что они притягиваются к воде, а неполярные области «гидрофобны», потому что имеют тенденцию отталкивать воду.
Кроме того, молекулы воды взаимодействуют посредством водородных связей, создавая 3 очень уникальных свойства: когезия, адгезия, и поверхностное натяжение .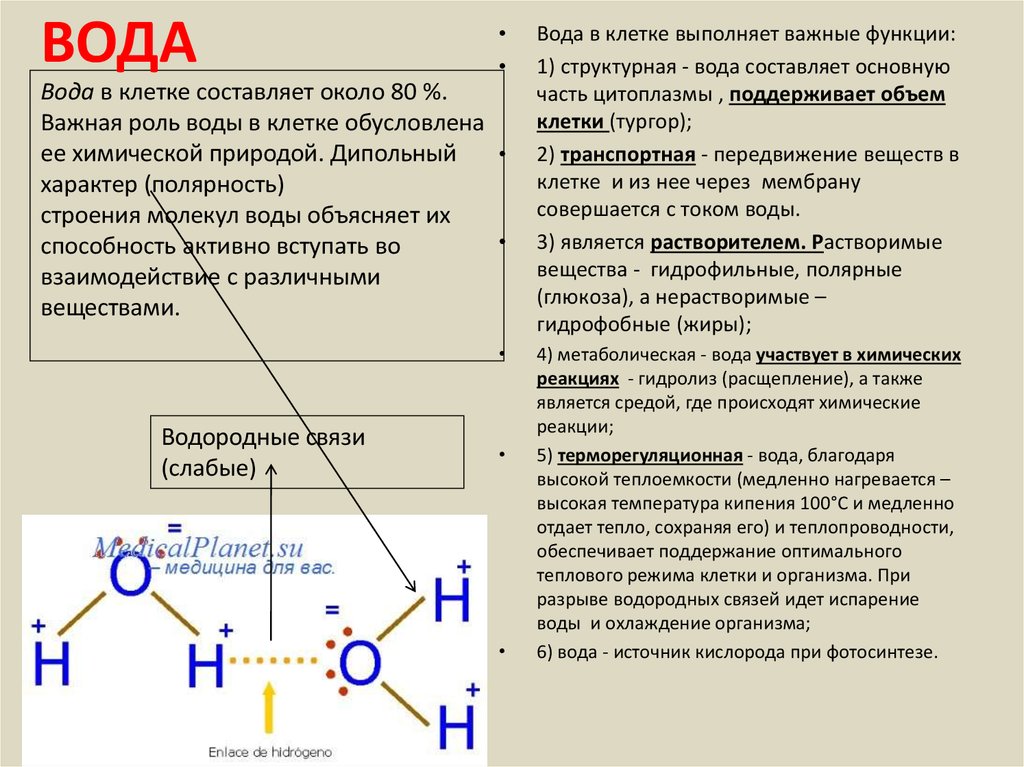
Сплоченность – это способность воды «прилипать» к самой себе. Водородные связи между молекулами воды означают, что они скорее слипнутся, чем разорвутся. Вы можете увидеть это свойство в действии в капле воды. Капли воды не распадаются и не растекаются по поверхности, а остаются целыми.
Адгезия – это способность воды прилипать к различным гидрофильным поверхностям. Это дает воде возможность проходить через определенные пористые материалы, прилипая к их поверхности. Например, если вы поместите каплю воды на бумажное полотенце, она быстро растечется и пройдет через полотенце, прилипая к отдельным волокнам и «протягивая» себя через материал.
Поверхностное натяжение свойственно не только воде, но вода обладает более высоким поверхностным натяжением по сравнению с другими жидкостями. Поверхностное натяжение — это мера того, насколько легко объект может проникнуть в жидкость. В воде это напряжение увеличивается за счет всех водородных связей между молекулами воды. По сути, это делает воду менее летучей (менее вероятной для испарения), что позволяет собирать большие водоемы и оставаться жизнеспособной средой для жизни.









 Участвует в ряде химических реакций.
Участвует в ряде химических реакций. RU
RU