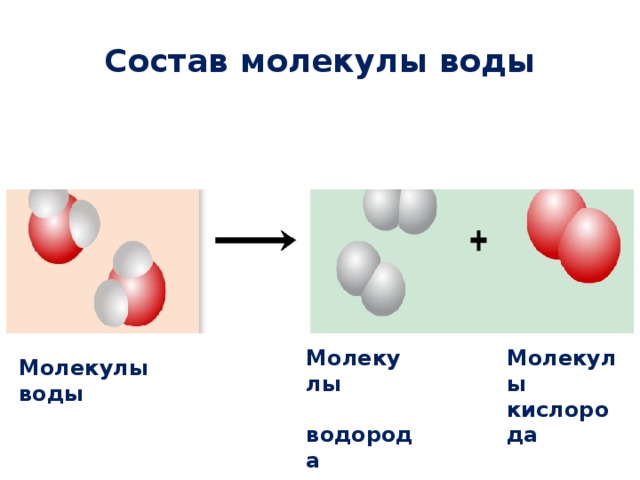
Уникальные свойства воды — Cyber Aqua на vc.ru
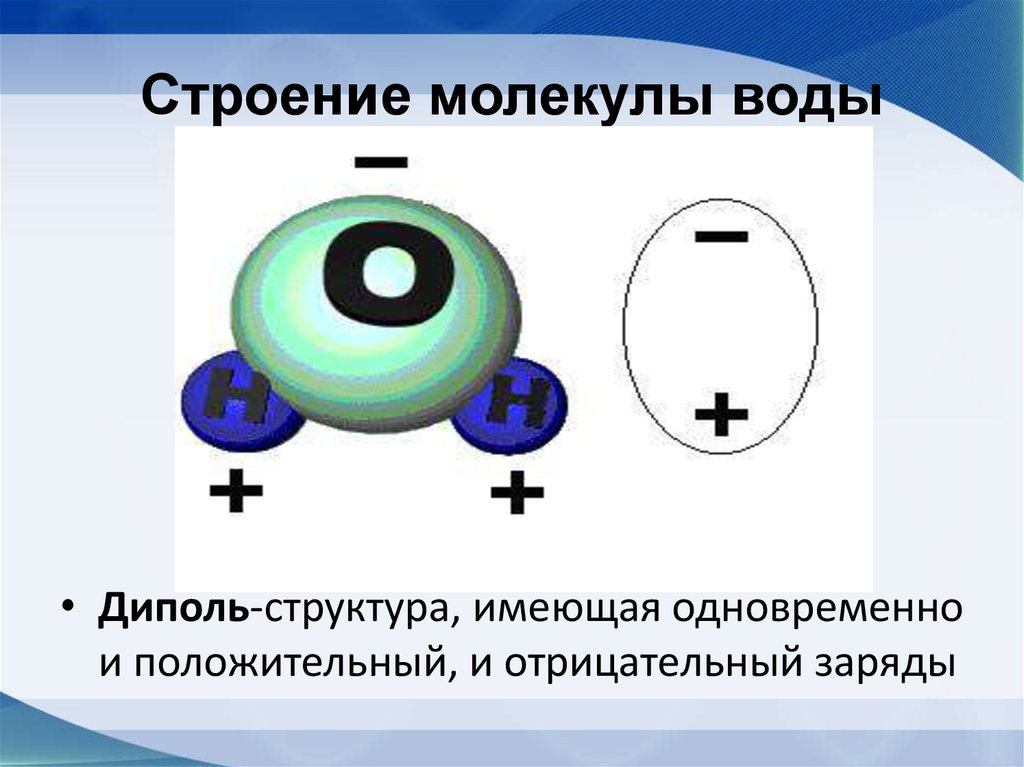
1. Вода полярная. Молекулы воды полярны, с частичным положительным зарядом на атомах водорода, частичным отрицательным зарядом на кислороде и изогнутой общей структурой. Это связано с тем, что кислород более электроотрицателен, а это означает, что он лучше, чем водород, притягивает электроны.
2. Вода отличный растворитель. Вода обладает уникальной способностью растворять многие полярные и ионные вещества. Это важно для всех живых существ, потому что, когда вода проходит через круговорот воды, она забирает с собой много ценных питательных веществ!
3. Вода обладает высокой теплоемкостью. Чтобы повысить температуру определенного количества воды на градус, требуется много энергии, поэтому вода помогает регулировать температуру в окружающей среде. Например, это свойство позволяет температуре воды в пруду оставаться относительно постоянной днем и ночью, независимо от изменения температуры воздуха.
4. Вода имеет высокую теплоту испарения.
5. Вода обладает когезионными и адгезионными свойствами. Молекулы воды обладают сильными силами сцепления из-за их способности образовывать водородные связи друг с другом. Силы сцепления ответственны за поверхностное натяжение тенденцию поверхности жидкости сопротивляться разрыву, когда она находится под напряжением или напряжением. Вода также обладает адгезионными свойствами, которые позволяют ей прилипать к другим веществам, кроме нее самой.
6. Вода менее плотная в твердом виде, чем в жидкой.
 Когда вода замерзает, молекулы образуют кристаллическую структуру, которая разделяет молекулы дальше, чем в жидкой воде. Это означает, что лед менее плотный, чем жидкая вода, поэтому он плавает.
Когда вода замерзает, молекулы образуют кристаллическую структуру, которая разделяет молекулы дальше, чем в жидкой воде. Это означает, что лед менее плотный, чем жидкая вода, поэтому он плавает.Это свойство важно, поскольку оно защищает пруды, озера и океаны от замерзания и позволяет жизни продолжать процветать под ледяной поверхностью.
• Вода растворяет все, потому что это «универсальный растворитель». Вода обладает способностью растворять многие вещества, но термин «универсальный растворитель» вводит в заблуждение. Вода способна растворять другие полярные молекулы и ионы, такие как сахара и соли. Однако неполярные молекулы, такие как масла, не имеют частичных положительных или частичных отрицательных зарядов, поэтому они не притягиваются к молекулам воды. Вот почему неполярные вещества, такие как масло, остаются отдельными при добавлении в воду.
Источник:
https://cyberaqua.ru/
18 004 просмотров
Что называется испарением? Виды, свойство, особенности
Из этой таблицы видно, что молекулы в жидкостях находятся близко друг другу, но хаотично, то есть не имеют кристаллической решетки, как в твердых телах. Эти молекулы движутся (причем, чем выше температура, тем быстрее движутся) и в ходе движения сталкиваются. Столкновения меняют направление и скорость движения — из-за этого молекулы иногда быстро устремляются к поверхности жидкости и вылетают из нее. Это и есть испарение.
Эти молекулы движутся (причем, чем выше температура, тем быстрее движутся) и в ходе движения сталкиваются. Столкновения меняют направление и скорость движения — из-за этого молекулы иногда быстро устремляются к поверхности жидкости и вылетают из нее. Это и есть испарение.
В предыдущем абзаце мы не случайно заметили, что молекулы движутся быстрее при увеличении температуры — ведь из-за этого испарение идет интенсивнее. В этом случае происходит охлаждение: нагретую жидкость уже покинули все самые быстрые молекулы и температура самой жидкости понижается.
Почему если облить человека теплой водой — ему становится холоднее?
Как раз из-за того, что нагретую жидкость быстро покидают быстрые молекулы, и температура жидкости снижается.
Интенсивность испарения
Интенсивностью испарения называют количество воды, которое испаряется с поверхности площадью 1 см2 за одну секунду.
Интенсивность испарения зависит от следующих факторов:
- Температура поверхности.
 Чем выше температура, тем больше испарение. После дождя в Санкт-Петербурге улицы долгое время остаются влажными, а вот в Таиланде даже в сезон дождей все высыхает быстро — из-за высокой температуры. Но это только если в сезон дождей дождь умудрился прекратиться 🙂
Чем выше температура, тем больше испарение. После дождя в Санкт-Петербурге улицы долгое время остаются влажными, а вот в Таиланде даже в сезон дождей все высыхает быстро — из-за высокой температуры. Но это только если в сезон дождей дождь умудрился прекратиться 🙂 - Дефицит влажности. Интенсивность испарения будет выше там, где больше дефицит влажности. Вряд ли многие из нас были Сахаре, но что это такое представляют все. В любой пустыне колоссально низкая влажность — из-за этого испарение идет интенсивнее.
- Давление. Чем больше давление, тем меньше испарение. Мы уже выяснили, что не смотря на разницу между кипением и испарением, эти два процесса между собой связаны.

Кажется, правильнее говорить «скорость испарения» вместо интенсивности? Или нет? 🤔
Скорость испарения — количество жидкости, которая испаряется со свободной поверхности в единицу времени.
Интенсивность испарения — количество жидкости, которая испаряется с единицы площади поверхности в единицу времени.
По сути, это два очень близких друг к другу понятия, поэтому разница будет лишь в величинах и единицах измерения, а суть процесса отражают обе формулировки.
Бесплатные занятия по английскому с носителем
Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни.
Насыщенный пар
Процесс испарения напрямую связан с круговоротом воды в природе.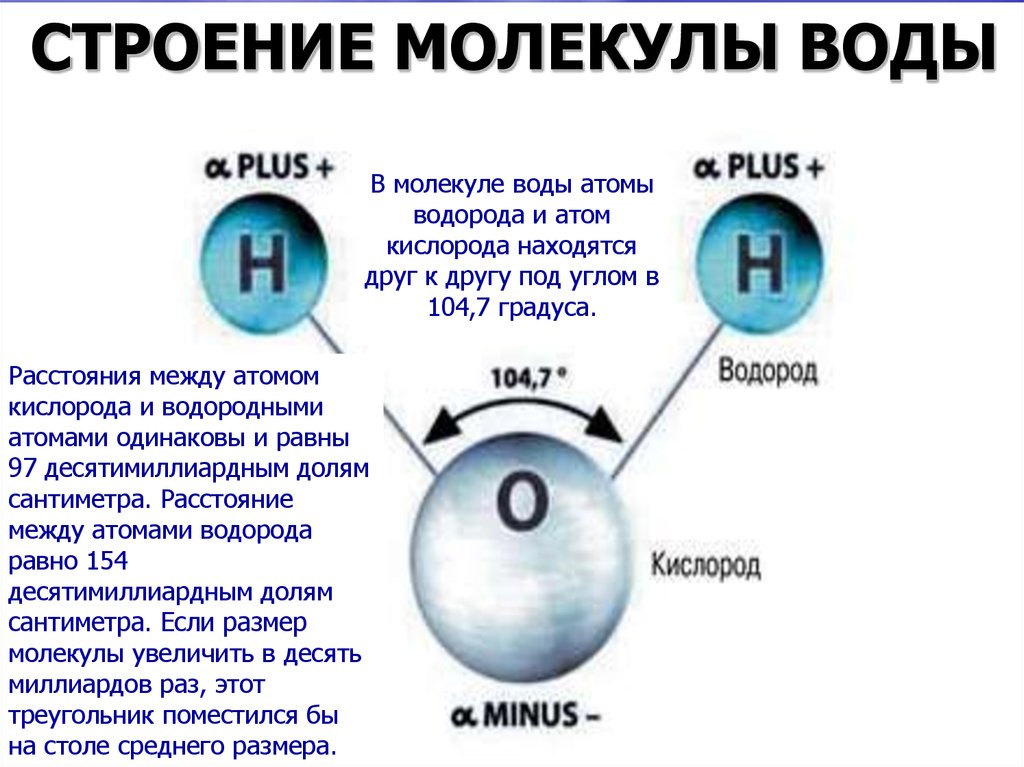 Вода, испаряясь, превращается в водяной пар и поднимается вверх, где происходит конденсация пара, образуются облака, и вода возвращается на землю в виде осадков.
Вода, испаряясь, превращается в водяной пар и поднимается вверх, где происходит конденсация пара, образуются облака, и вода возвращается на землю в виде осадков.
Вследствие конденсации водяного пара, который живет в воздухе, образуются облака и туман. По этой же причине холодное стекло запотевает, соприкасаясь с теплым воздухом.
На рисунке — процессы испарения и конденсации в плотно закрытом сосуде, когда жидкость и пар находятся в динамическом равновесии. Это значит, что одновременно конденсируется и испаряется одинаковое количество вещества.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Но бесконечное количество пара в воздух не запихнешь. Поэтому, во-первых, его там очень мало, а во-вторых, происходит
Допустим, зимой при температуре -20 градусов в 1 литре воздуха содержится 1 миллиграмм пара.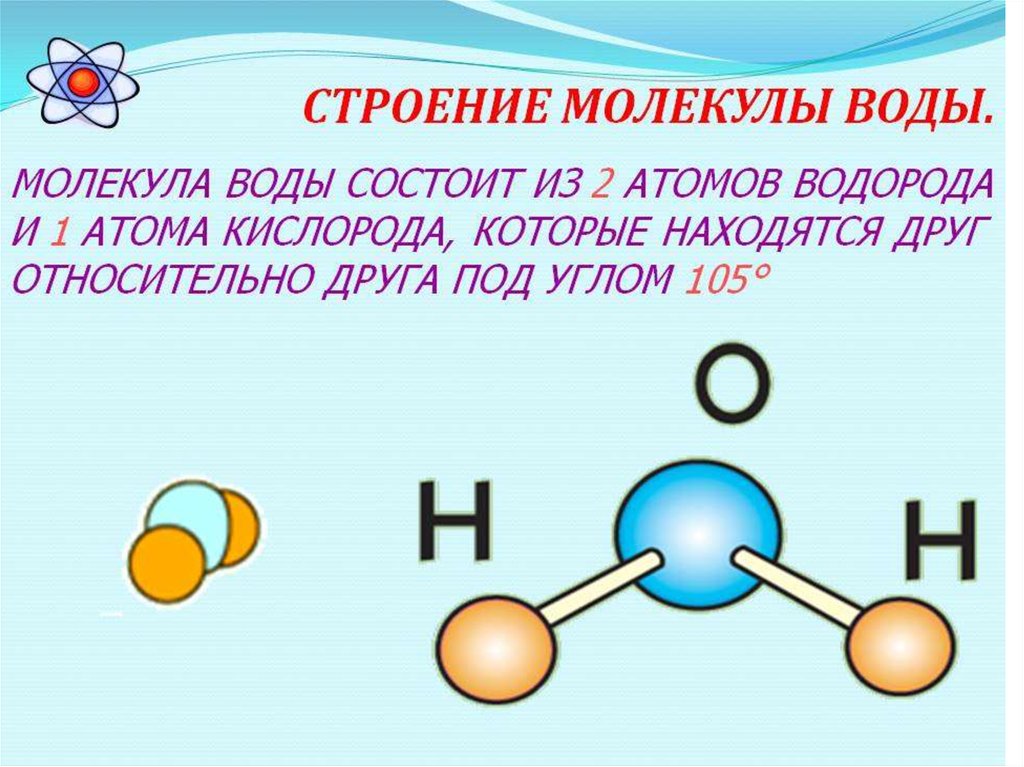 Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь.
Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь.
Но если мы тот же воздух поместим в коробку объемом 1 м3 с температурой +20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40-50%.
Попробуйте курсы подготовки к ЕГЭ по физике с опытным преподавателем в онлайн-школе Skysmart!
Испарение в жизни
И действительно: чего в этой жизни только не испаряется — мы встречаемся с этим каждый день. Давайте узнаем, зачем этот процесс вообще нужен, и как люди научились извлекать из него пользу.
Испарение в организме человека и животных
Выше мы разбирали вопрос, почему если облиться теплой водой, нам все равно станет холодно. По этому же принципу работает ощущение холода после того, как мы вспотели — в какой-то момент нам становится холодно.
Само потоотделение — важный процесс терморегуляции организма. Если мы достигаем высокой температуры (из-за внешних воздействий или же из-за болезни), то организм стремится себя охладить, чтобы не умереть из-за превращения белков в нашем организме в яичницу.
Пот выделяется через поры кожи, а затем испаряется — все это позволяет нашему организму быстро избавиться от лишней энергии, охладить тело и нормализовать температуру.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой и «скинуть» избыточное тепло, но при высокой влажности пот не может испариться. При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). |
У животных этот механизм работает схожим образом. Но, например, собакам испарения с кожи недостаточно, поэтому они часто открывают пасть, высовывают язык и дышат порой ну очень смешно 🐶
Именно гортань и язык собаки идеально подходят для испарения влаги и охлаждения тела животного.
Испарение у растений
Удивительно, но у растений механизм испарения тоже работает схожим образом. Растения очень любят воду, поэтому домашние растения мы поливаем, а в пустынях их просто нет.
Ту воду, которую цветы поглотили, они могут испарять, чтобы не перегреться под жарким солнцем. Да, вода нужна, чтобы растения питались, но в жаркие дни еще и для температурной саморегуляции. Поэтому не забывайте поливать цветы, а в очень жаркие дни делайте это еще интенсивнее.
Поэтому не забывайте поливать цветы, а в очень жаркие дни делайте это еще интенсивнее.
Испарение в природе и окружающей среде
Процесс испарения напрямую связан с круговоротом воды в природе. Именно круговоротом воды в природе обеспечивается жизнь на Земле — так как влага разносится по всему миру, растения в дикой природе способны жить без наших попыток полить большую пальму из леечки.
Испарение воды с поверхности рек, озер, морей и океанов создает дождевые тучи, которые затем, проливаясь дождем, поливают растения и деревья. Многие дождь не любят, мол, он мокрый, мерзкий и затекает в ботинки, но он очень нужен засушливым регионам — Северной Африке или Центральной Индии, которые часто страдают от засухи.
Испарение в промышленности и быту
С бытом совсем все просто: мы сушим вещи, готовим еду, покупаем увлажнители воздуха или размазываем разлитую лужу по полу.
В случае с промышленностью для нас все не так очевидно. Промышленная техника, работающая на основе испарения, разрабатывается по схожей схеме: в ней всегда максимально увеличена площадь поверхности жидкости, чтобы испарение шло интенсивно.
Промышленная техника, работающая на основе испарения, разрабатывается по схожей схеме: в ней всегда максимально увеличена площадь поверхности жидкости, чтобы испарение шло интенсивно.
Например, испаритель, изображенный на схеме, состоит из совокупности соединенных между собой испарителей. В основе его действия — пар, полученный в одной ступени, который используют в качестве источника тепла для следующей ступени. По мере того, как температура уменьшается от одной ступени к другой, вакуум увеличивается, так что температура кипения становится ниже и испарение поддерживается. Он предназначен для того, чтобы очистить воду от отходов.
4.1: Уникальные свойства воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 788
[Эта страница может использовать изображение]
[Вода «биполярна»? Возможно, имелось в виду, что вода считается полярной молекулой]
[физическое свойство – почему вода является хорошим растворителем?]
[что делает воду уникальной по отношению к другим веществам? Это называется «уникальные свойства»? Возможно, упомянуть, что если бы вода не образовалась так, как она есть, жизнь на Земле не была бы такой, какая она есть, или даже была бы возможной. ]
]
[поверхностное натяжение — следует упомянуть капиллярное действие]
Физические свойства воды
Вода — единственное встречающееся в природе вещество на Земле, которое может находиться в трех физических состояниях: твердом, жидком и газообразном. В твердом состоянии (лед) он менее плотный, чем в жидком (вот почему лед плавает в стакане с водой).
Молекула обладает когезивным свойством, что позволяет ей «прилипать» к другим молекулам воды (образуя «капли» воды, когда молекулы прилипают друг к другу под действием гравитации). Он также клейкий, что означает, что он «прилипает» к другим окружающим молекулам при контакте (примером этого является капля воды на травинке).
На уровне моря вода замерзает при 32°F (0°C) до твердого состояния и кипит при 212°F (100°C) и становится водяным паром.
Плотность: 1 грамм/кубический сантиметр (г/см) при 390,2°F (4°C) и 0,95865 г/куб.см при 212°F (100°C)
Вес: 1000 кг/куб.м (кг/м³) при 32°F (0°C) и 993 кг/м³ при 212°F (100°C)
В чистом виде вода не проводит электричество.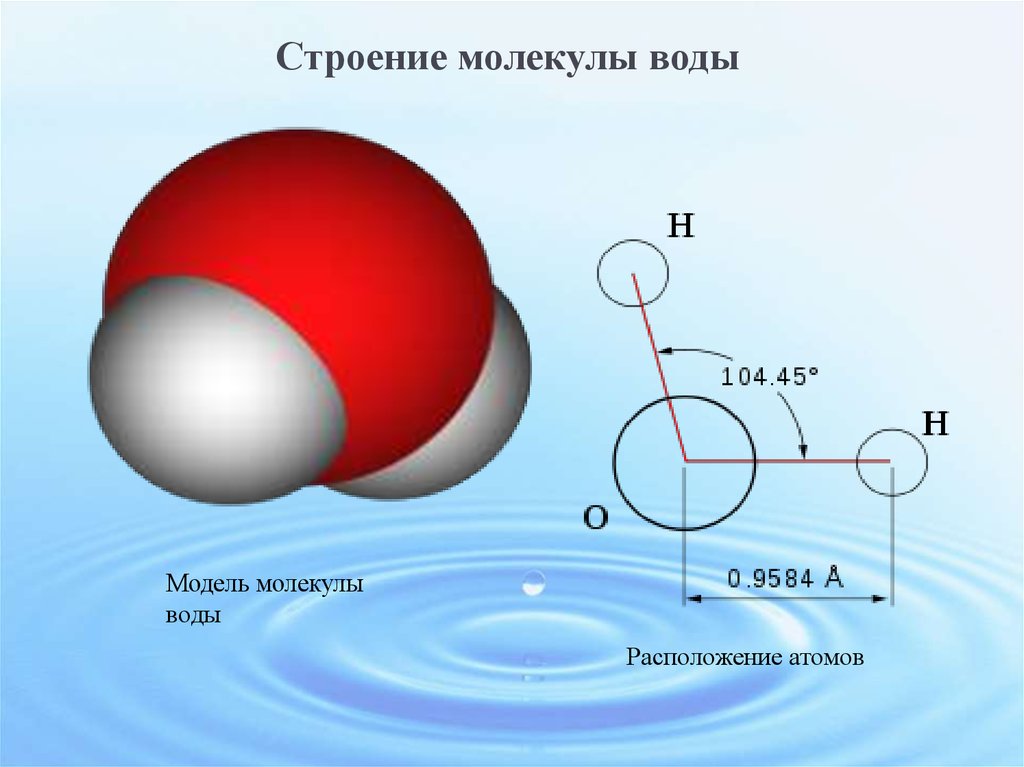 Однако он может проводить воду, когда начинает растворять окружающие его вещества. Вода — лучший растворитель из всех жидкостей — она может растворять больше веществ, чем остальные.
Однако он может проводить воду, когда начинает растворять окружающие его вещества. Вода — лучший растворитель из всех жидкостей — она может растворять больше веществ, чем остальные.
Химические свойства воды
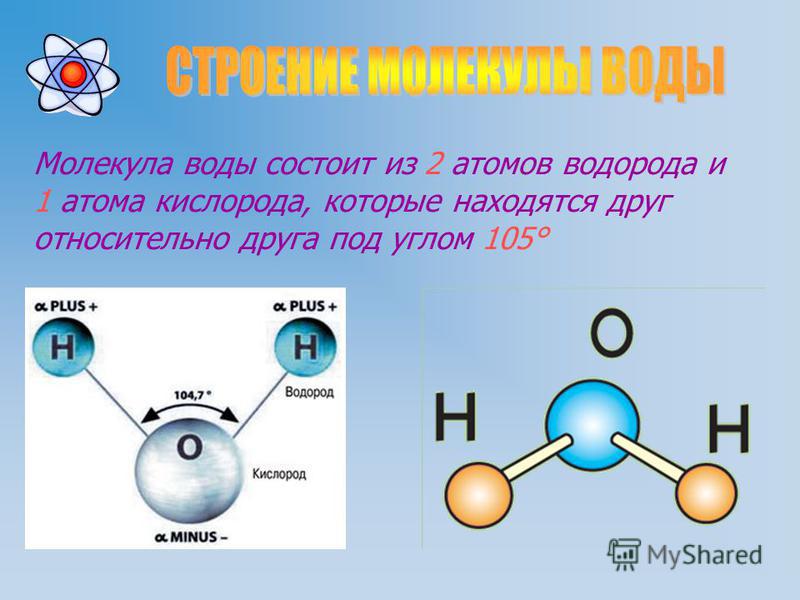
Вода состоит из двух атомов водорода (H) и атома кислорода (O). Он уникален тем, что является биполярным, где молекула имеет слегка положительный заряд с одной стороны (куда присоединены атомы водорода), а с другой — слегка отрицательный (просто кислород).
Поскольку электроны распределены в воде неравномерно, она считается полярной молекулой, несмотря на то, что имеет одинаковое количество протонов и электронов. Кроме того, из-за тетраэдрического расположения вокруг атома кислорода и наличия у атома кислорода неподеленной пары электронов считается, что вода имеет изогнутую форму.
Одна молекула воды может соединиться с другой молекулой через водородную связь (около 1/20 силы ковалентной связи) между атомом водорода одной и атомом кислорода другой.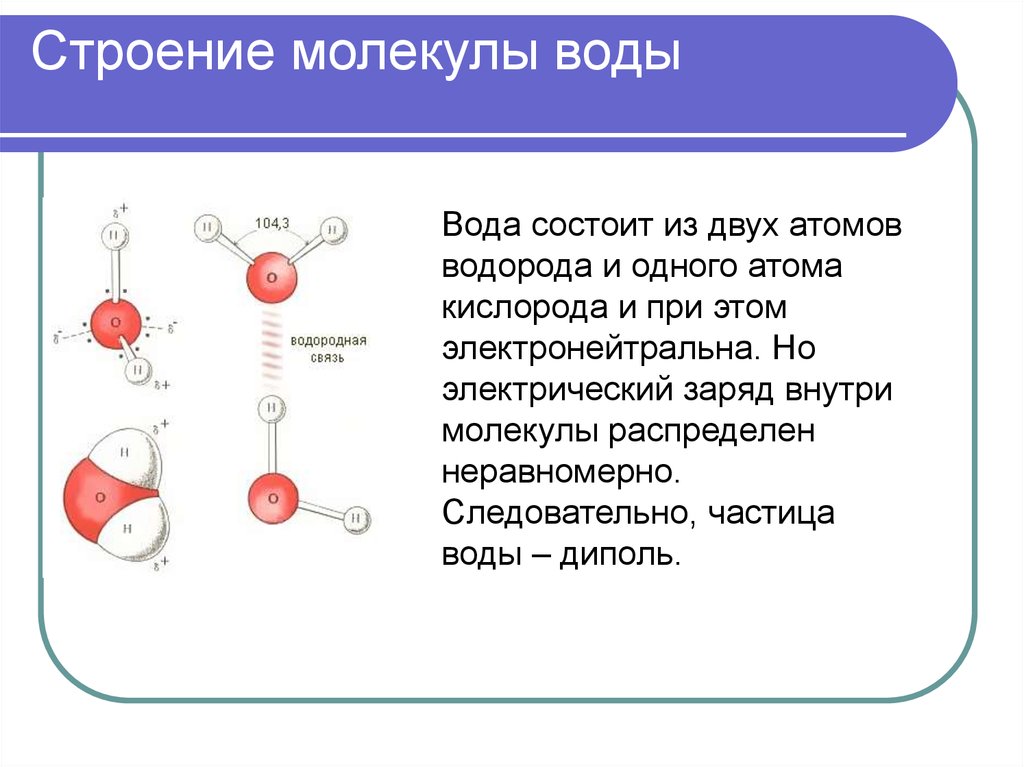 Эта водородная связь создает поверхностное натяжение в группе молекул воды.
Эта водородная связь создает поверхностное натяжение в группе молекул воды.
pH чистой воды составляет около 7 при комнатной температуре (25°C или 77°F).
http://water.usgs.gov/edu/waterproperties.html
www.ozh3o.com/h3chem.html
Каждый атом водорода в воде ковалентно связан с кислородом через общую пару электронов. Кислород также имеет две неподеленные пары электронов, таким образом, четыре пары электронов окружают атом кислорода, две пары участвуют в ковалентных связях с водородом и две неподеленные пары на противоположной стороне атома кислорода.
Вода является полярной молекулой, что означает неравномерное распределение электронной плотности. Вода имеет частичный отрицательный заряд вблизи атома кислорода из-за неподеленных пар электронов и частичный положительный заряд вблизи атомов водорода. Электростатическое притяжение между частичным положительным зарядом вблизи атомов водорода и частичным отрицательным зарядом вблизи кислорода приводит к образованию водородной связи. А способность ионов и других молекул растворяться в воде обусловлена полярностью.
А способность ионов и других молекул растворяться в воде обусловлена полярностью.
Интернет-ресурс: watereducation.utah.gov/water…es/default.asp
4.1: Уникальные свойства воды распространяются по лицензии CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги

Конфигурация молекулы воды
Модули и курсы InTeGrate > Наука о воде и общество > Материалы для учащихся > Модуль 2: Климатология воды > Уникальные свойства воды > Конфигурация молекулы воды
Узнать больше
Скрыть
Эти материалы являются частью коллекции проверенных в классе модулей и курсов, разработанных InTeGrate.
Материалы вовлекают учащихся в понимание земной системы, поскольку она переплетается с ключевыми социальными проблемами.
Коллекция находится в свободном доступе и готова к адаптации преподавателями бакалавриата для различных курсов, включая:
общеобразовательные или профильные курсы по дисциплинам, связанным с Землей, таким как геонауки или науки об окружающей среде,
обществознание, инженерия и другие науки, а также курсы по междисциплинарным программам.
Ознакомьтесь с коллекцией »
Для инструктора
Эти материалы для учащихся дополнить Наука о воде и общество Инструкторские материалы. Если вы хотите, чтобы ваши ученики имели доступ к учебным материалам, мы предлагаем вам либо
укажите их на студенческую версию
который опускает обрамляющие страницы с информацией, предназначенной для
факультет (и этот ящик). Или вы можете скачать эти страницы в нескольких форматах
которые вы можете включить на веб-сайт своего курса или в локальную систему управления обучением.
Узнайте больше об использовании,
изменение и обмен учебными материалами InTeGrate.
Если вы хотите, чтобы ваши ученики имели доступ к учебным материалам, мы предлагаем вам либо
укажите их на студенческую версию
который опускает обрамляющие страницы с информацией, предназначенной для
факультет (и этот ящик). Или вы можете скачать эти страницы в нескольких форматах
которые вы можете включить на веб-сайт своего курса или в локальную систему управления обучением.
Узнайте больше об использовании,
изменение и обмен учебными материалами InTeGrate. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Одно-единственное электронное кольцо вокруг ядра каждого атома водорода имеет только один электрон. Отрицательный заряд электрона уравновешивается положительным зарядом одного протона в ядре водорода. Электронное кольцо водорода на самом деле предпочло бы иметь два электрона для создания стабильной конфигурации. Кислород, с другой стороны, имеет два электронных кольца с внутренним кольцом, имеющим 2 электрона, что круто, потому что это стабильная конфигурация.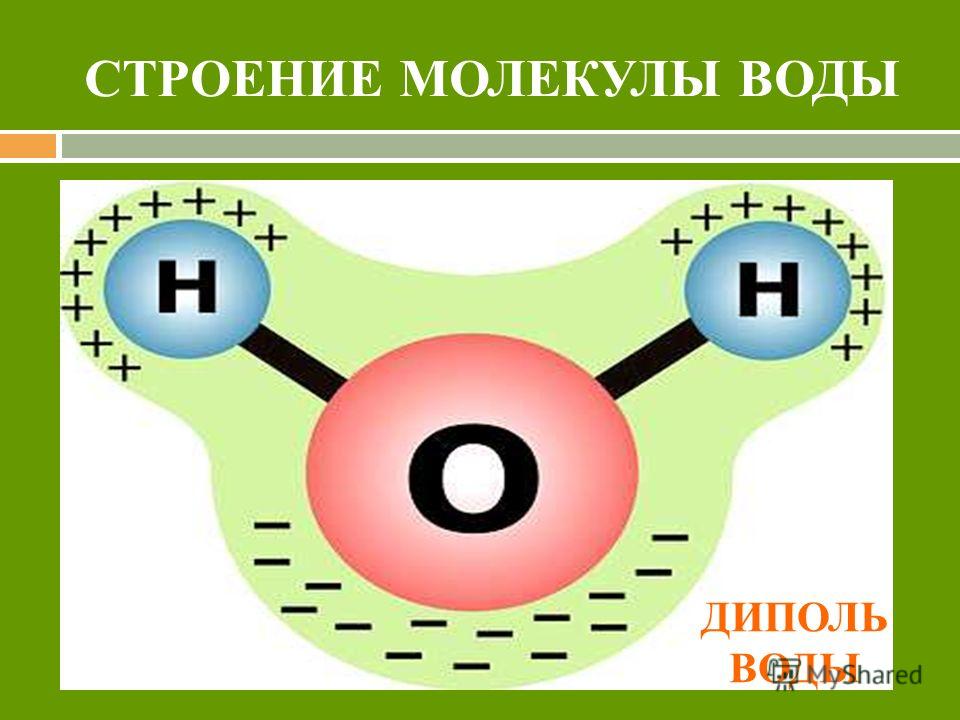 С другой стороны, внешнее кольцо имеет 6 электронов, но хотелось бы иметь еще 2, потому что во втором электронном кольце 8 электронов являются стабильной конфигурацией. Чтобы уравновесить отрицательный заряд 8 (2+6) электронов, ядро кислорода имеет 8 протонов. Водород и кислород хотели бы иметь стабильные электронные конфигурации, но не как отдельные атомы. Они могут выбраться из этого затруднительного положения, если согласятся поделиться электронами (своего рода энергетический «договор»). Итак, кислород делит один из своих внешних электронов с каждым из двух атомов водорода, и каждый из двух атомов водорода делит свой единственный электрон с кислородом. Это называется ковалентной связью. Каждый атом водорода думает, что у него есть два электрона, а атом кислорода думает, что у него 8 внешних электронов. Все довольны, нет?
С другой стороны, внешнее кольцо имеет 6 электронов, но хотелось бы иметь еще 2, потому что во втором электронном кольце 8 электронов являются стабильной конфигурацией. Чтобы уравновесить отрицательный заряд 8 (2+6) электронов, ядро кислорода имеет 8 протонов. Водород и кислород хотели бы иметь стабильные электронные конфигурации, но не как отдельные атомы. Они могут выбраться из этого затруднительного положения, если согласятся поделиться электронами (своего рода энергетический «договор»). Итак, кислород делит один из своих внешних электронов с каждым из двух атомов водорода, и каждый из двух атомов водорода делит свой единственный электрон с кислородом. Это называется ковалентной связью. Каждый атом водорода думает, что у него есть два электрона, а атом кислорода думает, что у него 8 внешних электронов. Все довольны, нет?
Рисунок 1. Молекула воды
Источник: Climate Science Investigations (CSI), НАСА
Однако два атома водорода находятся на одной стороне атома кислорода, так что положительно заряженные ядра атомов водорода остаются открытыми. , так сказать, оставив тот конец молекулы воды со слабым положительным зарядом. Между тем на другой стороне молекулы избыточные электроны атома кислорода дают этому концу молекулы слабое отрицательное изменение. По этой причине молекула воды называется «диполярной» молекулой. Вода является примером полярного растворителя (одного из лучших), способного растворять большинство других соединений из-за неравномерного распределения заряда молекулы воды. В растворе слабая положительно заряженная сторона одной молекулы воды будет притягиваться к слабой отрицательно заряженной стороне другой молекулы воды, и две молекулы будут удерживаться вместе за счет так называемой слабой водородной связи. В диапазоне температур морской воды слабые водородные связи постоянно разрываются и вновь образуются. Это придает воде некоторую структуру, но позволяет молекулам легко скользить друг по другу, превращая воду в жидкость.
, так сказать, оставив тот конец молекулы воды со слабым положительным зарядом. Между тем на другой стороне молекулы избыточные электроны атома кислорода дают этому концу молекулы слабое отрицательное изменение. По этой причине молекула воды называется «диполярной» молекулой. Вода является примером полярного растворителя (одного из лучших), способного растворять большинство других соединений из-за неравномерного распределения заряда молекулы воды. В растворе слабая положительно заряженная сторона одной молекулы воды будет притягиваться к слабой отрицательно заряженной стороне другой молекулы воды, и две молекулы будут удерживаться вместе за счет так называемой слабой водородной связи. В диапазоне температур морской воды слабые водородные связи постоянно разрываются и вновь образуются. Это придает воде некоторую структуру, но позволяет молекулам легко скользить друг по другу, превращая воду в жидкость.
« Предыдущая страница Следующая страница »
Эти материалы являются частью набора проверенных в классе модулей и курсов, разработанных InTeGrate.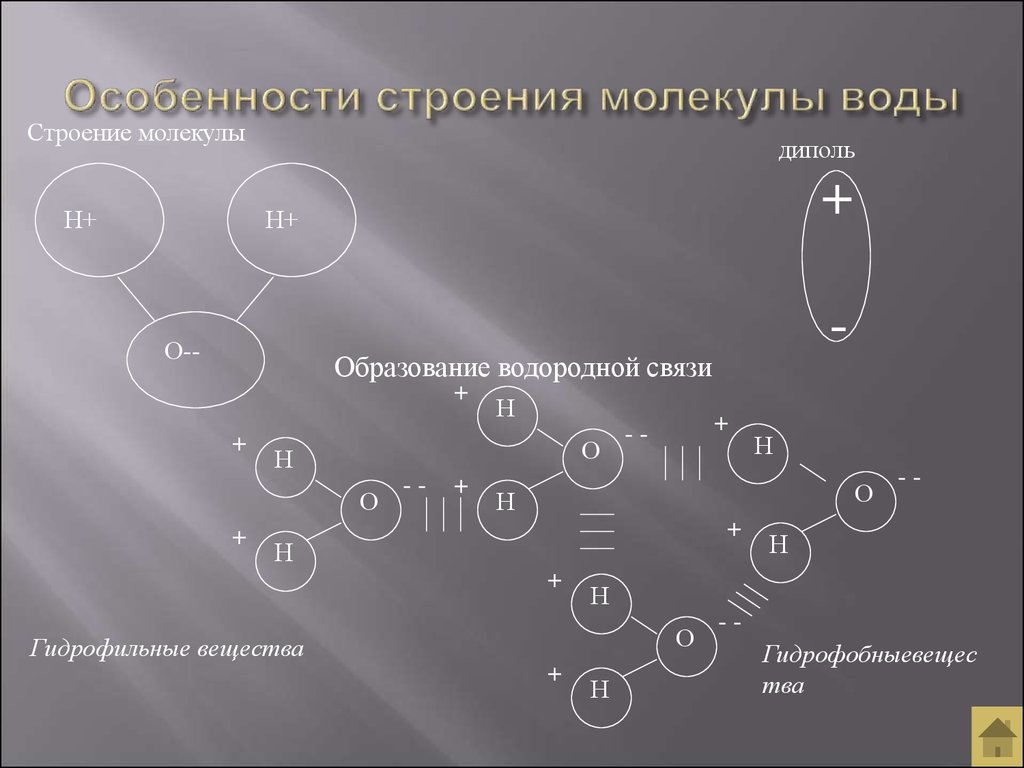


 Чем выше температура, тем больше испарение. После дождя в Санкт-Петербурге улицы долгое время остаются влажными, а вот в Таиланде даже в сезон дождей все высыхает быстро — из-за высокой температуры. Но это только если в сезон дождей дождь умудрился прекратиться 🙂
Чем выше температура, тем больше испарение. После дождя в Санкт-Петербурге улицы долгое время остаются влажными, а вот в Таиланде даже в сезон дождей все высыхает быстро — из-за высокой температуры. Но это только если в сезон дождей дождь умудрился прекратиться 🙂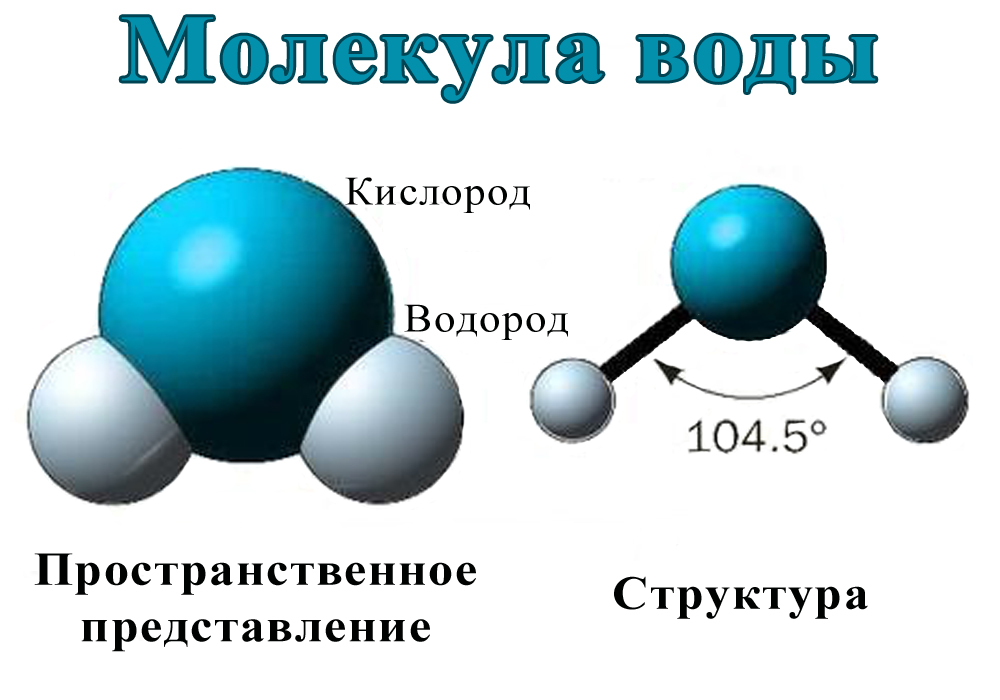
 Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно. А при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно. А при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.