МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ — Студопедия
Поделись с друзьями:
Метод МО является более совершенным методом описания строения молекул. Если метод ВС позволяет судить о направленности строения молекул, определяет форму молекулы или иона, то метод МО дает более полную информацию о строении, указывает на прочность связи, возможность существования молекулы, магнитные свойства вещества.
В основе этого метода лежит представление о том, что все электроны данной молекулы или иона (как и в атоме) распределяются по соответствующим молекулярным орбиталям. По аналогии с атомными s-, p-, d-, f- орбиталями, молекулярные орбитали обозначаются греческими буквами s-, p-, d-, j-, ….
Описать молекулу по теории МО – это значит определить ее орбитали, их энергию и выяснить характер распределения электронов по орбиталям в порядке возрастания их энергии. Образование молекулярных орбиталей можно представить как результат сложения и вычитания взаимодействующих атомных орбиталей. Метод МО основан на следующих правилах:
1. При сближении атомов до расстояния химических связей, из атомных орбиталей (АО) образуются молекулярные, число полученных молекулярных орбиталей равно числу исходных атомных.
При сближении атомов до расстояния химических связей, из атомных орбиталей (АО) образуются молекулярные, число полученных молекулярных орбиталей равно числу исходных атомных.
2. Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
3. При перекрывании атомных орбиталей возможно образование и s -связи (перекрывание по оси химической связи), и p- связи (перекрывание по обе стороны от оси химической связи).
5. На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов (принцип Паули).
6. Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
7. Заполнение орбиталей вырожденных (с одинаковой энергией) происходит последовательно по одному электрону на каждую из них.
Схема образования и форма данных молекулярных орбиталей с учётом изложенного выше представлена на рис.3.7:
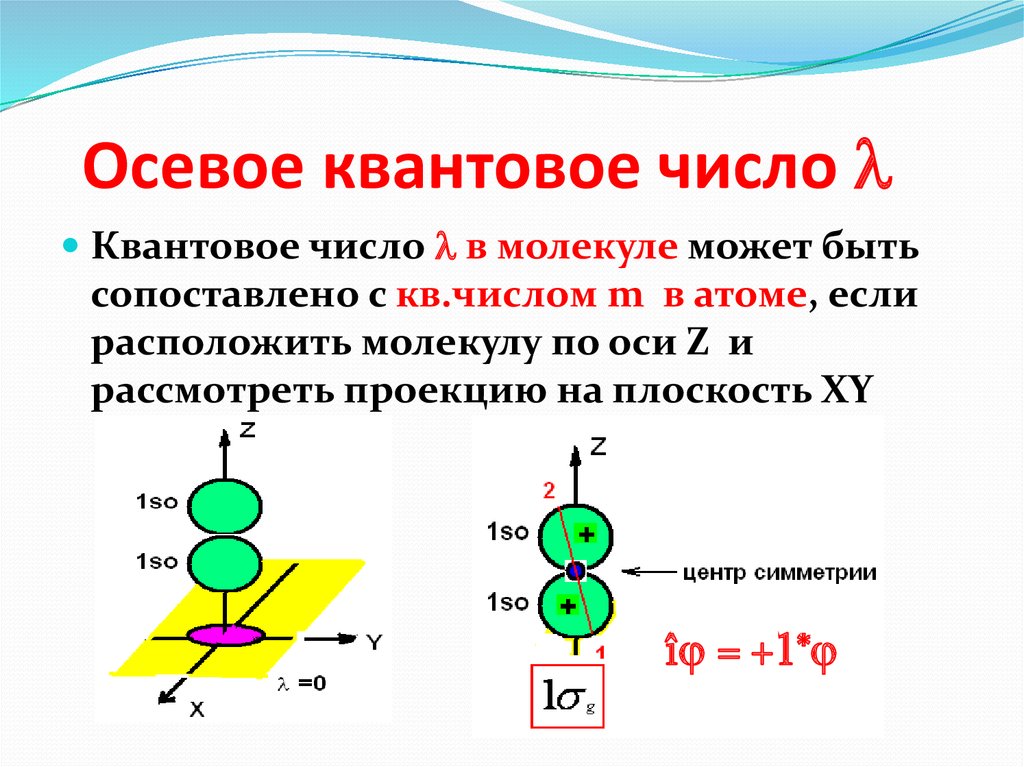
В силу осевой симметрии обеих молекулярных орбиталей относительно линии, связывающей ядра атомов, это σ-орбитали. В общем случае обозначение МО, кроме типа связи (σ-, π-, δ-) содержит также указание на их характер (связывающие, разрыхляющие, несвязывающие) и вид исходных АО: например, и или
Результаты линейной комбинации исходных АО в методе МО нагляднее демонстрировать в виде энергетической диаграммы. Для рассмотренного выше случая энергетическая диаграмма представлена на рис.3.6.
Заполнение молекулярных орбиталей электронами подчиняется тем же основным принципам, что и атомных орбиталей. В соответствии с этим энергетическая диаграмма молекулы водорода будет выглядеть так, как представлено на рис.
В нормальном состоянии молекулы водорода оба её электрона согласно принципу минимума энергии занимают наиболее низкую орбиталь и согласно принципу Паули имеют противоположные спины. Таким образом, ёмкость МО так же, как и АО составляет два электрона. Суммарный спин при этом равен нулю, т.е. молекула должна быть диамагнитной, что и наблюдается в действительности.
Изучение молекулярных спектров двуядерных молекул образованных элементами начала 2-ого периода вплоть до азота N
σ1s < σ1s* < σ2s < σ2s* < πy = πz < σx < πy* = πz* < σx* (11)
Другим характерным примером, который обычно используют для того, чтобы продемонстрировать дополнительные возможности метода МО, недоступные МВС, является описание строения молекулярного кислорода О2.
В действительности молекулярный кислород парамагнитен. Метод МО позволяет объяснить это, как видно из рис. 14, наличием двух неспаренных электронов на π-разрыхляющих орбиталях (πy* и πz*).
Порядок связи (кратность связи) оценивается полуразностью числа связывающих и разрыхляющих электронов:
е
Порядок связи = ———————;
где:
е —(связ.) — число связывающих электронов;
е —(разр.) – число разрыхляющих электронов.
Характер распределения электронов по молекулярным орбиталям позволяет объяснить магнитные свойства молекул.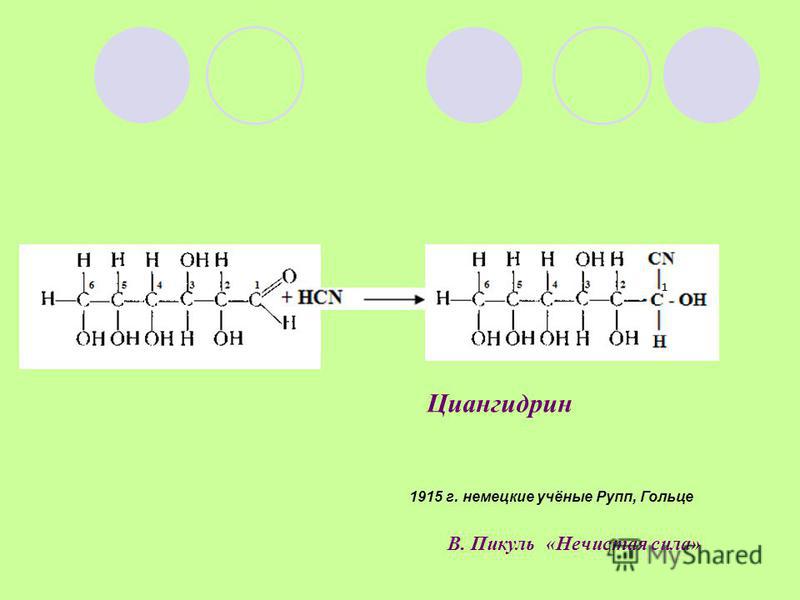 По магнитным свойствам различают парамагнитные (обладают собственным магнитным полем) и диамагнитные вещества (не обладают собственным магнитным полем). Парамагнитными считаются те молекулы или ионы, у которых имеются непарные электроны на молекулярных орбиталях (МО), у диамагнитных – все электроны парные.
По магнитным свойствам различают парамагнитные (обладают собственным магнитным полем) и диамагнитные вещества (не обладают собственным магнитным полем). Парамагнитными считаются те молекулы или ионы, у которых имеются непарные электроны на молекулярных орбиталях (МО), у диамагнитных – все электроны парные.
Как определить, связи какого типа образуют атомы элементов в определенном веществе? Рассмотрим примеры.
1. Хлорид цезия CsCl. Атом цезия (IА группа) большой, с низким значением электроотрицательности, легко отдает электрон, а атом хлора (VIIА группа) небольшой с большим значением ЭО легко его принимает, следовательно, связь в хлориде цезия ионная (типичный металл с типичным неметаллом).
2. Гидрид азота (аммиак) NH3 Атомы азота (VА группа) и водорода (IА группа) отличаются по размерам – оба небольшие по размеру (неметаллы). По склонности принимать электроны они отличаются, связь в молекуле 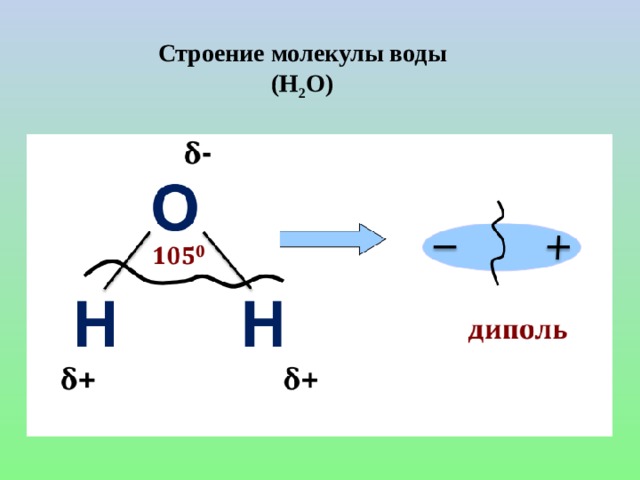
3. Азот N2. Простое вещество. Связываемые атомы одинаковые и при этом небольшие, следовательно, связь в молекуле азота ковалентная неполярная.
4. Кальций Са. Простое вещество. Связываемые атомы одинаковые и довольно большие, следовательно связь в кристалле кальция металлическая.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
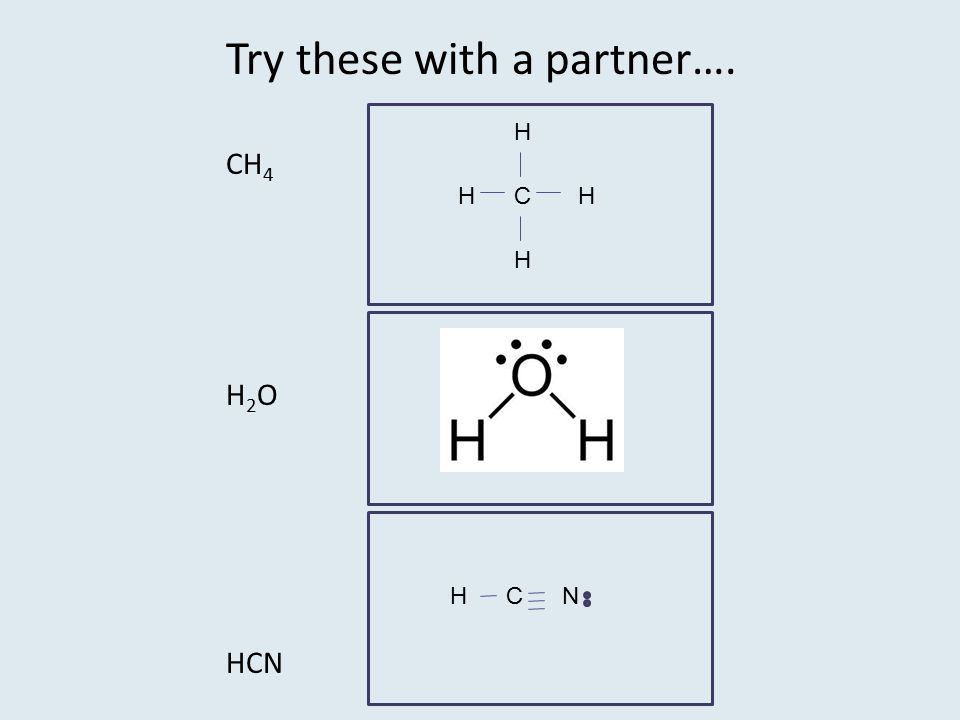
61. Исходя из теории ковалентной связи, изобразите в виде валентных схем строение молекул: HCl, H
62. Почему энергия двойной связи С = С (613,2 кДж) не равна удвоенному значению энергии одинарной связи С — С (348,6 кДж)?
63. Как изменяется полярность связи и прочность молекул в ряду HF, HCl, HBr, HI?
64. Какие химические связи имеются в ионах [NH4]+, [BF4]—?
65. Какую валентность, обусловленную не спаренными электронами (спин-валентность), может проявлять фосфор в нормальном и возбужденном состояниях?
66.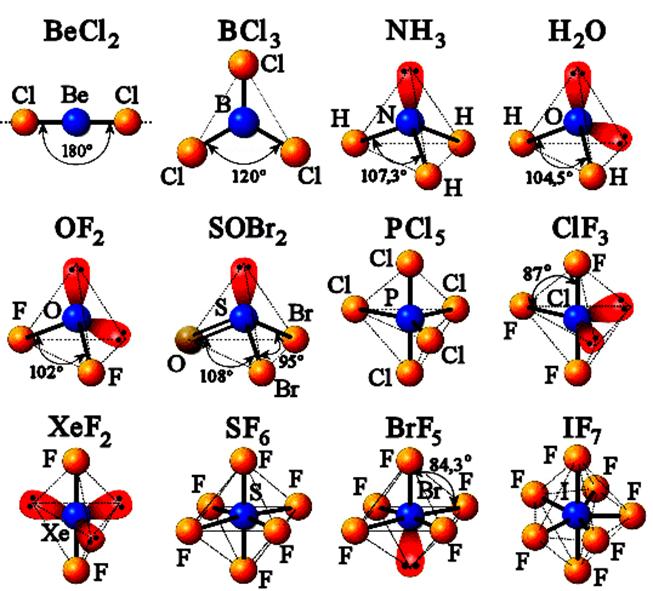 Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа
Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа
67. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов, второго периода?
68. Пользуясь таблицей относительных электроотрицательностей, вычислить их разность для связей Н–О и О–Rb в гидроксиде RbОН и определить: а) какая из связей в молекуле характеризуется большей степенью ионности; б) каков характер диссоциации этих молекул в водном растворе.
69. Как изменяется прочность связи в ряду СO2–SiO2–GeO2–SnO2? Указать причины этих изменений.
70. Дипольный момент молекулы HCN равен 0,97×10-29
71. Какой вид гибридизации электронных облаков имеет место в атоме кремния при образовании молекулы SiF4? Какова пространственная структура этой молекулы?
72. Опишите с помощью метода молекулярных орбиталей молекулу Н20.
Опишите с помощью метода молекулярных орбиталей молекулу Н20.
73. Определите тип гибридизации орбиталей центрального атома в частице Н3О+.Назовите и изобразите геометрическую форму этой частицы.
74. Определите тип гибридизации орбиталей центрального атома в частице NO2.Назовите и изобразите геометрическую форму этой частицы.
75. Укажите тип гибридизации орбиталей бора в молекуле BBr3.
76. Какие виды химической связи имеются в молекуле NH4I?
77. Сера образует химические связи с калием, водородом, бромом и углеродом. Какие из связей наиболее и наименее полярны? Укажите, в сторону какого атома происходит смещение электронного облака связи.
78. Описать с позиции метода МО молекулу ВеН2: определить кратность связи и магнитные свойства молекулы.
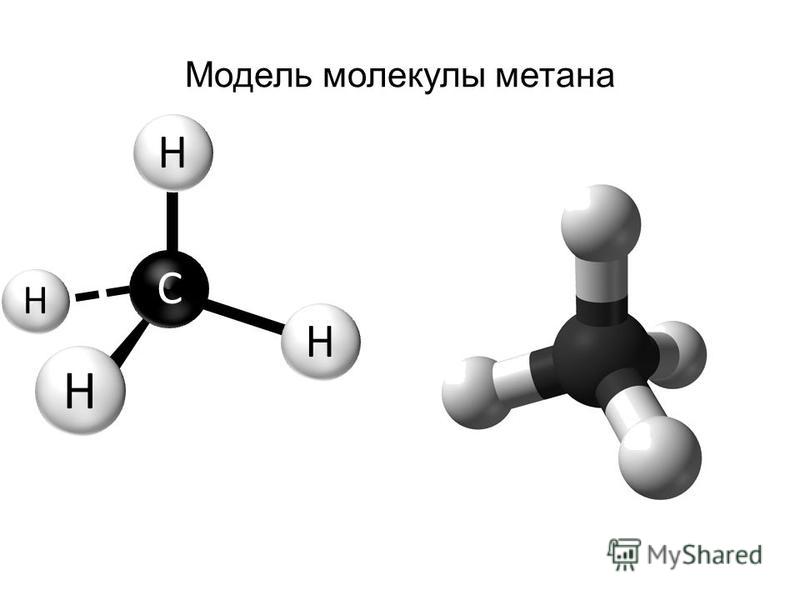
79. Описать с позиции метода МО молекулу СН4: определить кратность связи и магнитные свойства молекулы.
80. Определите тип гибридизации и геометрическую форму комплексного иона [MoCl4]2-
81. Определите тип гибридизации и геометрическую форму комплексного иона [ZnCl4]2-
Определите тип гибридизации и геометрическую форму комплексного иона [ZnCl4]2-
82. С помощью метода валентных связей (ВС) опишите пространственное строение молекулы CO2.
83. Определите тип гибридизации и геометрическую форму комплексного иона [Cd(H2O)4]2+
84. С помощью метода валентных связей (ВС) опишите пространственное строение молекулы (NН4)+.
85. Определите тип гибридизации и геометрическую форму комплексного иона [Ni(OH)4]2-
86. С помощью метода валентных связей (ВС) опишите пространственное строение молекулы PF3.
87. Определите тип гибридизации и геометрическую форму комплексного иона [Co(NH3)4]3+.
88. С помощью метода валентных связей (ВС) опишите пространственное строение молекулы SiF4.
89. Определите тип гибридизации и геометрическую форму комплексного иона [Cr(H2O)4]3+
90. Определите тип гибридизации и геометрическую форму комплексного иона [CuCl4]2-
Определите тип гибридизации и геометрическую форму комплексного иона [CuCl4]2-
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Режим работы и обучения
Студенту
Информация для студентов очной и заочной формы обученияЦентр дополнительного образования и профориентационной работы
Факультет последипломного образования
Информация о вузе
Информация о ПМФИВиртуальный кабинет психологической помощи
О приеме заявлений о зачислении в порядке перевода от граждан РФ, Украины, Донецкой и Луганской народных республик
Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВO ВолгГМУ Минздрава России осуществляет прием заявлений о зачислении в порядке перевода от граждан Российской Федерации, а также от граждан Украины, Донецкой и Луганской народных республик, вынужденно покинувших территорию республик и прибывших на территорию Российской Федерации, изъявивших желание перевестись для обучения в ПМФИ.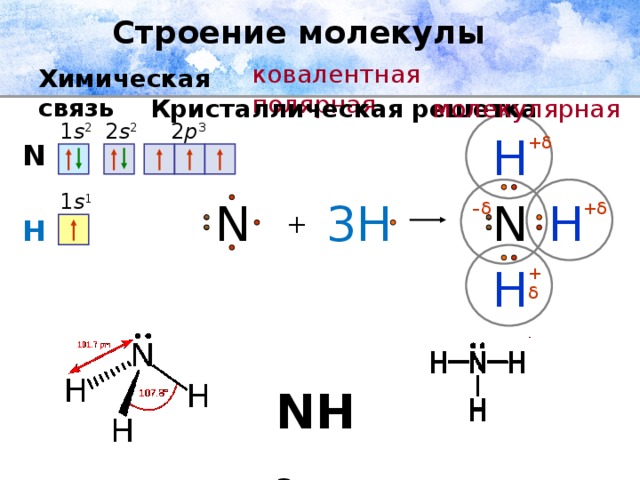
Перевод осуществляется на программы, реализуемые в ПМФИ, в соответствии с действующим законодательством, Положениями и Уставом ВолгГМУ.
Заявления о переводе принимаются ежедневно с 9:00 до 17:00 (выходные дни: суббота, воскресенье).
Ответственные сотрудники за прием заявлений о переводе:
ЧАХИРОВА Виктория Анатольевна, начальник учебного отдела
Тел. +7 (906) 460-09-80
e-mail: [email protected]
Дирекция ПМФИ
Центр дополнительного образования и профориентационной работы
Повышение квалификации
- Для педагогических работников
Профессиональная переподготовка
- Для педагогических работников
ПМФИ в: Youtube Instagram Вконтакте
Юбилей ПМФИ — 75
СЛОВО ДИРЕКТОРА
О ВУЗЕ
Пятигорский медико-фармацевтический институт, как правопреемник Пятигорской государственной фармацевтической академии, является признанным лидером фармацевтического образования России.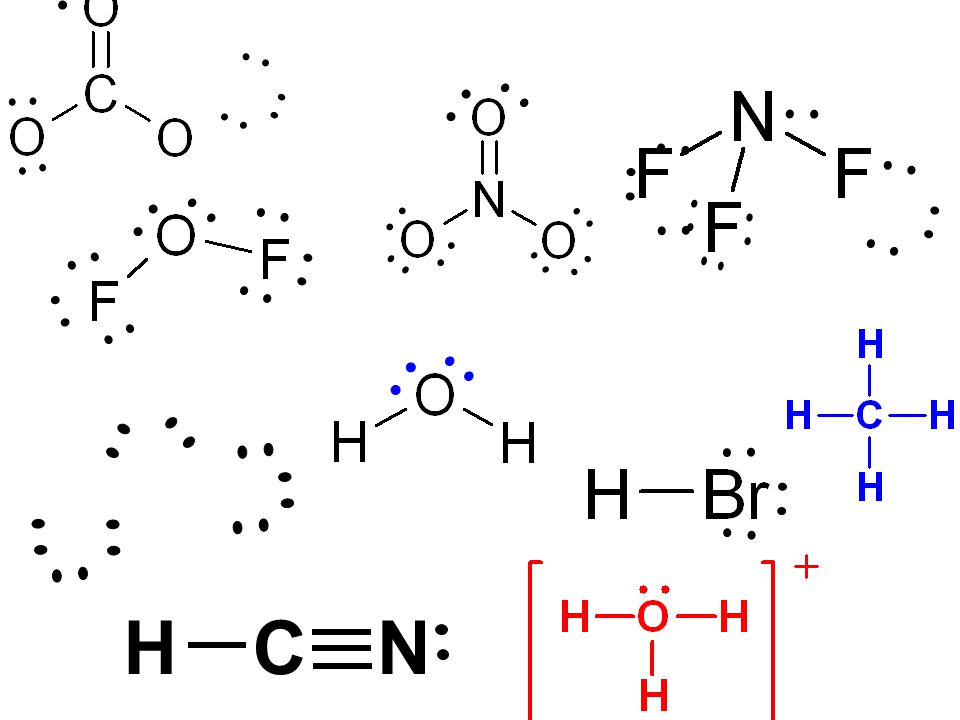 Авторитет вуза признан не только в России, но и за её пределами.
Авторитет вуза признан не только в России, но и за её пределами.
Ахвердова Ольга Альбертовна
Директор, доктор психологических наук, кандидат медицинских наук
Подробнее о вузе
Виртуальный кабинет психологической помощи
Очные психологические консультации (с использованием дистанционных технологий)
Время работы: пятница с 18:00 — 20:00 (платформа VooVMeeting)
Психолог invites you to a meeting on VooVMeeting
Meeting Topic: Психологическая служба
Meeting Time: 2022/3/18 17:00-19:00 (GMT+03:00) Moscow Standard Time — Moscow Recurrence:Every Fri
Click the link to join the meeting or to add it to your meeting list: https://voovmeeting.com/dm/9LrpICRwUcOT
#VooVMeeting: 818-0338-2767 Meeting Password: 12345
Attendees: Психолог
Заочные психологические консультации
e-mail: ovz@pmedpharm. ru
ru
Подробнее
Дополнительное профессиональное образование медицинских и фармацевтических специалистов
Все программы разработаны в соответствии с требованиями профессиональных стандартов, нормативной базой министерства здравоохранения и министерства образования Российской Федерации.
Для специалистов с высшим и средним профессиональным фармацевтическим и медицинским образованием:
- Провизоров;
- Фармацевтов;
- Врачей;
- Среднего медицинского персонала;
Больше информации
Новости
Читать все
Как связаны Кисловодск и 8 Марта?
7 марта 2023
В ПМФИ прошёл турнир по волейболу среди женских команд вузов Пятигорска
7 марта 2023
А ну-ка, девушки!
7 марта 2023
Директор ПМФИ Ольга Альбертовна Ахвердова поздравляет сотрудниц института с 8 Марта
7 марта 2023
«Мой праздник — единство народов республики, их дружба с другими народами» Р. Гамзатов
Гамзатов
6 марта 2023
Студенты ПМФИ продемонстрировали свои музыкальные навыки
6 марта 2023
Расписание он-лайн
Уточните курс и группу для просмотра актуального расписания.
Посмотреть расписание
Материалы
Доступ к методическим,
консультационным и справочным
материалам, лекциям, тестовым
заданиям.
Узнать больше
Галерея Посмотреть фотографии
Кафедры и подразделения
Учебный процесс в вузе осуществляется на 27 кафедрах
и в 41 подразделении.
Узнать больше
Сайт олимпиады ЖМИ здесь и участвуй!
ПМФИ — Соорганизатор направления «Фармация», материалы
Главный корпус ПМФИ —
Пятигорского филиала ФГБОУ ВО ВолгГМУ
Минздрава России
Объявления
Важно
Летняя онлайн языковая школа в Центре мировых языков и культур
26 мая 2022
Важно
Летняя профильная школа Юного провизора Пятигорского медико-фармацевтического института начнет свою работу в июне
23 мая 2022
Важно
Собеседование на восстановление по специальности «Фармация», «Стоматология», «Лечебное дело», «Медицинская биохимия», будет проходить 30 августа 2021 г.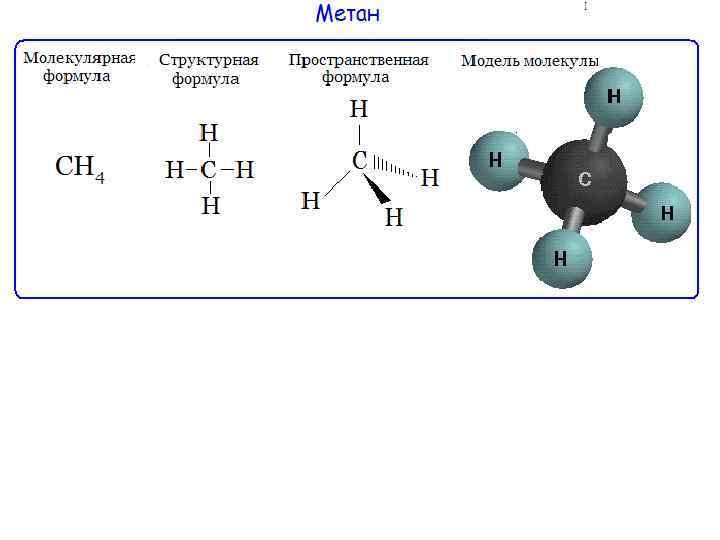 на кафедрах
на кафедрах
6 июля 2021
Читать все
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
№1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13. 07.2016.
07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
5.3C: \(HCN\) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 2611
HCN, цианистый водород, представляет собой летучее ядовитое соединение с выраженным горьким запахом. Это линейная молекула с тройной связью между атомами C и N и валентным углом 180 градусов. Его можно найти во фруктах с косточками из-за того, что они содержат небольшое количество циангидринов, которые медленно выделяют цианистый водород. Также его можно обнаружить в выхлопных газах автомобилей и горящих азотосодержащих пластмассах.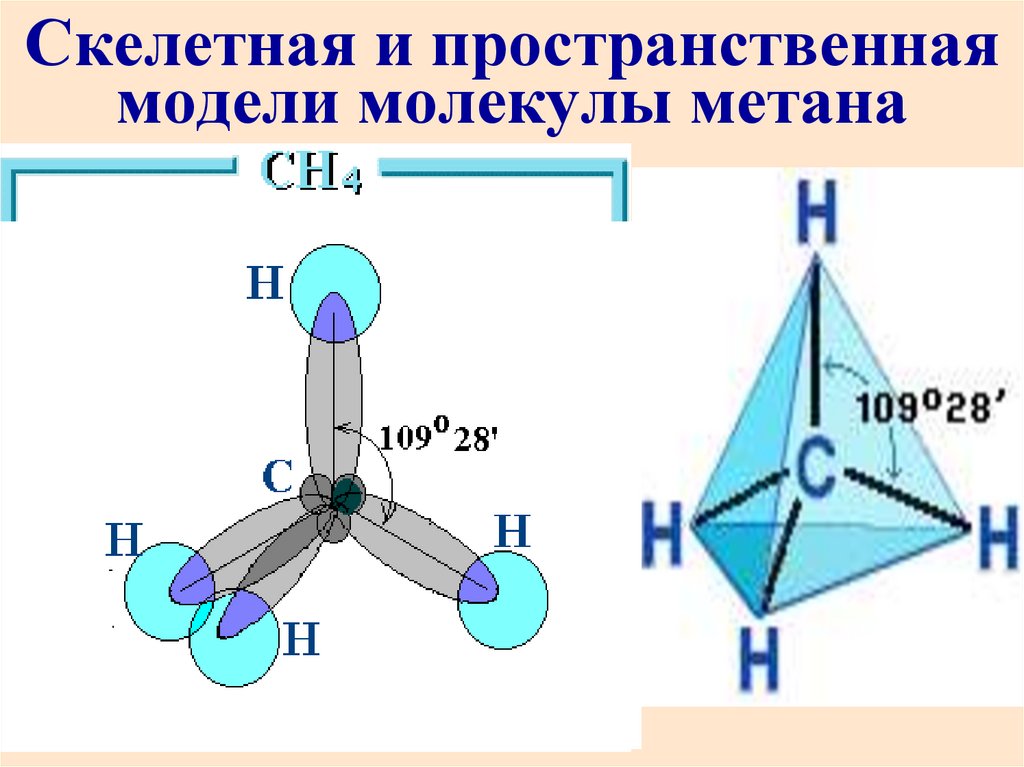
Введение
Теория валентной связи может быть объяснена перекрыванием атомных орбиталей, электроны которых локализованы в области образования химических связей. Однако, когда вы используете этот подход для объяснения химической структуры молекулы, вы должны знать, что существуют различные атомные орбитали для связывания, которые существенно влияют на структуру молекулы.
Определение теории валентных связей
Теория валентных связей просто объясняет образование связи, как точечная структура Льюиса, но вместо этого она объясняет связь с точки зрения ковалентной связи с помощью квантовой механики. Согласно этой теории, связь образуется, когда
1) Орбиталь одного атома занимает орбиталь другого атома, что называется перекрытием.
2) число электронов на обеих орбиталях в сумме не более двух.
Подобно образованию молекулы с точечной структурой Льюиса, связи между атомами завершаются, когда два электрона вместе находятся на одной орбитали.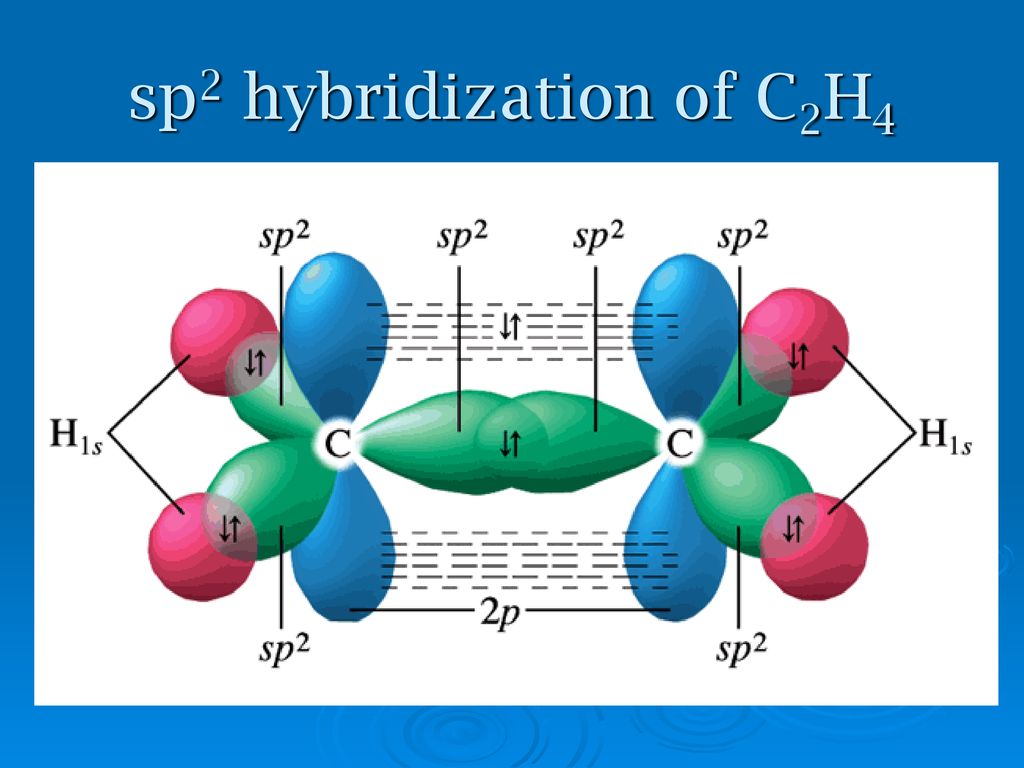
Сила связи зависит от степени перекрытия, так как электроны притягиваются к ядрам обоих атомов, больше электронов будет притягивать больше ядер, тем самым увеличивая прочность связи. Однако две орбитали не могут содержать более двух атомов из-за максимальной емкости, которую они могут удерживать.
Кроме того, поскольку известная атомная геометрия не может иметь эффективного перекрытия, атомные орбитали объединяются друг с другом и реконфигурируются в другую конфигурацию. Этот процесс называется гибридизацией.
Это образование новых гибридных орбиталей возможно путем объединения нескольких типов орбиталей (s,p,d и т.д.).
Опишите молекулярную связь HCN, используя теорию валентных связей
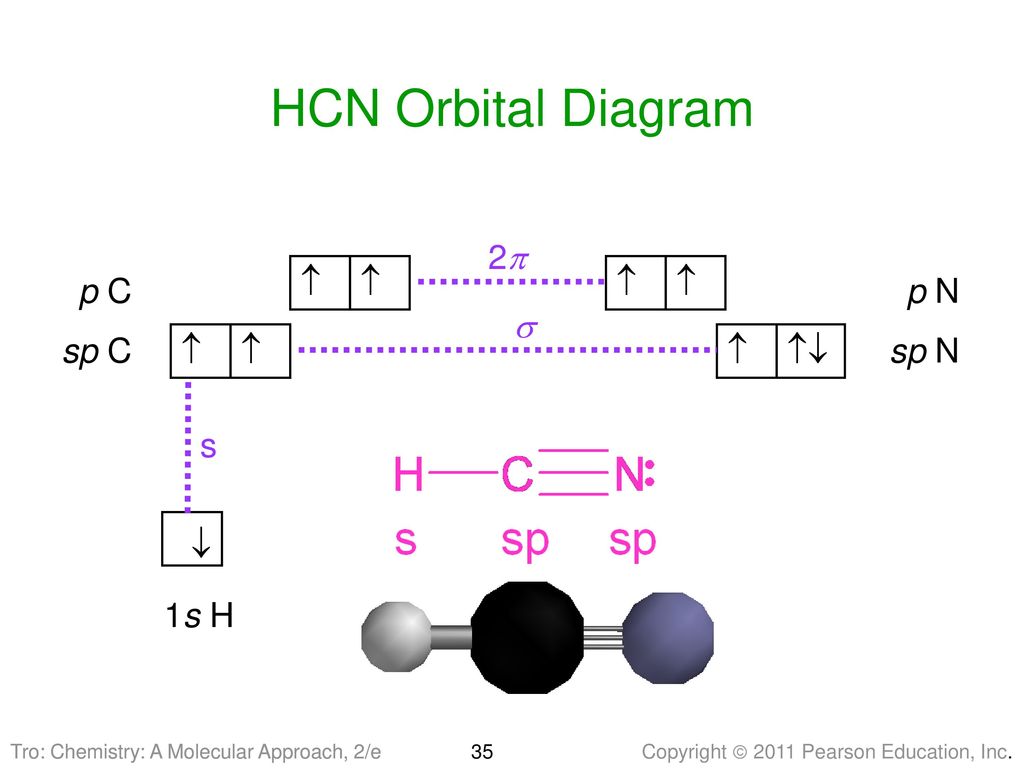
В молекуле HCN атом C включает sp -гибридизированную орбиталь, поскольку он будет соединяться только с двумя другими атомами с образованием HCN. Один из sp -гибридная орбиталь атома углерода перекрывается с 1 s орбиталью атома H, в то время как другая sp-гибридная орбиталь смешивается с одной из трех атомных p орбиталей атома азота, которые не были гибридизованы. Поскольку px-орбиталь C и N будет образовывать сигма-связь, это оставляет две атома N p -орбиталей, которые образуют две взаимно перпендикулярные пи-связи с двумя атомными p орбиталями на атоме C. Таким образом, HCN имеет одну одинарную и одну тройную связь. Последний состоит из сигма-связи от перекрывания C 9Гибридная орбиталь атома 0048 sp с орбиталью атома N p , а две взаимно перпендикулярные пи-связи образованы из параллельных атомных p орбиталей атомов углерода и азота.
Поскольку px-орбиталь C и N будет образовывать сигма-связь, это оставляет две атома N p -орбиталей, которые образуют две взаимно перпендикулярные пи-связи с двумя атомными p орбиталями на атоме C. Таким образом, HCN имеет одну одинарную и одну тройную связь. Последний состоит из сигма-связи от перекрывания C 9Гибридная орбиталь атома 0048 sp с орбиталью атома N p , а две взаимно перпендикулярные пи-связи образованы из параллельных атомных p орбиталей атомов углерода и азота.
Каталожные номера
- Winter, Mark J. Химическое соединение . Оксфорд: Oxford UP, 2005. Печать.
- Роджер Л. Декок и Гарри Б. Грей. Химическая структура и связывание . Университетские научные книги. 1989.
Внешние ссылки
1. Шайк, Сэсон С. и Филипп С. Хиберти. Руководство для химиков по теории валентных связей . Хобокен, Нью-Джерси: Wiley-Interscience, 2008. Печать.
2. «Склеивание и гибридизация». Кафедра химии и биохимии @ Государственный университет Бойсе . Веб. 05 ноября 2010 г.
«Склеивание и гибридизация». Кафедра химии и биохимии @ Государственный университет Бойсе . Веб. 05 ноября 2010 г.
Задачи
1. Какой тип связи присутствует на молекулярных орбиталях HCN?
2. Какая теория необходима для объяснения образования гибридных орбиталей?
3. Объясните, почему HCN является линейным.
Ответы
1. 1 сигма-связь между атомами Н и С. Между атомами C и N присутствует 1 сигма-связь и 2 пи-связи.
2. Теория валентной связи, а также гибридизация. Структуру точек Льюиса можно использовать, чтобы получить основное представление о структуре.
3. Из-за 2 пи-связей и 1 сигма-связи, образованных гибридизацией 2p x , 2p y и 2p z между атомами C и N, это перекрывание 2p делает связь более прочной и короткой, поэтому связь между C и N является линейной. Кроме того, исходя из свойства атомов находиться в положении с наименьшим возможным сдвигом, атом H будет находиться как можно дальше от атома C, что приведет к линейной структуре.
Кроме того, исходя из свойства атомов находиться в положении с наименьшим возможным сдвигом, атом H будет находиться как можно дальше от атома C, что приведет к линейной структуре.
Авторы и авторство
5.3C: \(HCN\) распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
HCN Структура Льюиса, Молекулярная геометрия, Валентный угол, Форма
Главная > Химия > HCN Структура Льюиса и ее молекулярная геометрия/форма
HCN — это химическая формула цианистого водорода, бесцветной и чрезвычайно ядовитой кислоты. Его также иногда называют синильной кислотой. Это химическое соединение пахнет горьким миндальным маслом и может оказывать разрушительное воздействие на глаза и дыхательные пути человека при вдыхании в больших количествах.
Если вы хотите узнать о химической природе и свойствах цианистого водорода (HCN), то ваша проблема решена. В этой статье мы обсудили все, что касается структуры Льюиса HCN, ее молекулярной геометрии или формы, электронной геометрии, валентных углов, гибридизации, формальных зарядов и т. д.
д.
Итак, без дальнейших промедлений, давайте начнем читать!
| Название молекулы | Цианистый водород |
| Chemical formula | HCN |
| Molecular geometry of HCN | Linear |
| Electron geometry of HCN | Linear |
| Hybridization | Sp |
| Природа | Полярная молекула |
| Валентный угол | 180° |
| Суммарный валентный электрон в HCN | 10 |
| Общий формальный заряд в HCN | Ноль |
Структура Льюиса HCN состоит из центрального атома углерода (C).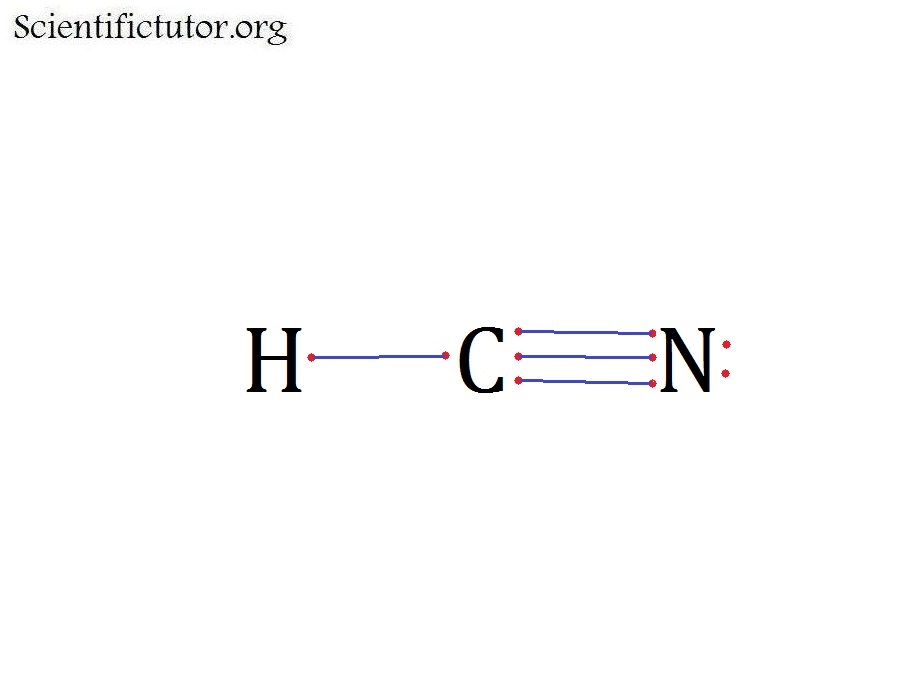 С этим атомом C атом водорода (H) связан с одной стороны одинарной ковалентной связью, а атом азота (N) связан с другой стороной центрального атома C тройной ковалентной связью. В структуре точек Льюиса HCN нет неподеленной пары на центральном атоме.
С этим атомом C атом водорода (H) связан с одной стороны одинарной ковалентной связью, а атом азота (N) связан с другой стороной центрального атома C тройной ковалентной связью. В структуре точек Льюиса HCN нет неподеленной пары на центральном атоме.
Давайте посмотрим, как мы можем нарисовать точечную структуру Льюиса HCN, используя простые шаги, указанные ниже.
Этапы рисования точечной структуры Льюиса HCN1. Подсчитайте общее количество валентных электронов в HCN
Точечная структура Льюиса молекулы называется упрощенным представлением всех присутствующих в ней валентных электронов. . Поэтому самый первый шаг при рисовании структуры Льюиса HCN – это подсчет общего количества валентных электронов, присутствующих в соответствующих атомах элементов.
Валентные электроны, присутствующие в атомах различных элементов молекулы, можно легко определить, идентифицируя эти атомы в периодической таблице. В молекуле HCN присутствуют три различных элементарных атома, то есть атом водорода (H), атом углерода (C) и атом азота (N).
Когда вы просмотрите Периодическую таблицу элементов, вы сразу обнаружите, что углерод присутствует в группе IV A, поэтому у него всего 4 валентных электрона. С другой стороны, азот присутствует в группе VA, поэтому он имеет всего 5 валентных электронов, в то время как водород находится в верхней части Периодической таблицы, имея только один валентный электрон.
- Общее количество валентных электронов в углероде = 4
- Общее количество валентных электронов в азоте = 5
- Общее количество валентных электронов в водороде = 1
∴ Молекула HCN состоит из 1 атома C, 1 Атом N и 1 атом H, поэтому общее количество валентных электронов, доступных для рисования точечной структуры Льюиса HCN = 4 + 5 + 1 = ·10 валентных электронов.
2. Найдите наименее электроотрицательный атом и поместите его в центр
Второй шаг при построении льюисовской структуры молекулы состоит в том, чтобы определить центральный атом, который, скорее всего, поделится своими электронами с разбросанными вокруг него атомами.
Электроотрицательность определяется как способность атома притягивать общую пару электронов из ковалентной химической связи. Следовательно, наименее электроотрицательный атом с большей вероятностью поделится своими электронами, чем привлечет электроны других.
Однако водород (H) никогда не считается центральным атомом ни в одной молекуле. Он всегда размещается как внешний атом в структуре молекулы Льюиса, потому что он может просто образовывать одинарную связь со своим соседним атомом, размещая максимум только 2 валентных электрона.
После того, как судьба атома H решена, оставшимися двумя атомами в структуре Льюиса HCN являются углерод (C) и азот (N). Углерод (EN = 2,55) менее электроотрицателен, чем азот (EN = 3,04), поэтому он более склонен делиться своими электронами с другими атомами. Следовательно, C расположен в центре структуры Льюиса HCN, а атомы H и N расположены вокруг него, как показано ниже.
3. Соединить внешние атомы с центральным атомом
Соединить внешние атомы с центральным атомом
Теперь все внешние атомы присоединены к центральному атому прямыми линиями.
Как мы уже определили, атомы H и N являются внешними атомами в HCN, а C является центральным атомом. Таким образом, атомы H и N соединены с центральным атомом C прямыми линиями.
Каждая прямая линия представляет одинарную ковалентную связь, т. е. пару связей, содержащую 2 электрона. В структуре, показанной выше, всего 2 одинарных связи, что означает, что всего 2 (2) = 4 валентных электрона используются до сих пор, из изначально доступных.
- Общее количество доступных валентных электронов – электроны использованы до , шаг 3 = 10-4 = 6 валентных электронов.
- Это показывает, что у нас все еще есть 6 валентных электронов, доступных для размещения в структуре Льюиса HCN.
4. Завершение октета внешних атомов
На этом этапе мы завершаем дуплет и/или октет внешних атомов, окружающих центральный атом C в структуре Льюиса HCN.
Атомы H и N являются внешними атомами в структуре Льюиса HCN. Атом водорода (H) требует в общей сложности 2 валентных электрона для достижения стабильной дуплетной электронной конфигурации.
Одинарная связь H-C означает, что 2 электрона уже доступны вокруг атома H, поэтому его дуплет завершен. Следовательно, на атоме Н не будет неподеленной пары. Но ситуация немного отличается для внешнего атома N.
Одинарная связь C-N представляет собой 2 валентных электрона вокруг атома азота. Ему все еще не хватает 6 электронов, чтобы достичь стабильной электронной конфигурации октета.
Таким образом, 6 электронов размещены в виде 3 неподеленных пар вокруг атома N в структуре Льюиса HCN, как показано ниже.
5. Завершите октет центрального атома, превратив неподеленные пары внешнего атома в ковалентные связи показано точками = 2(2) + 6 = 10 валентных электронов Все валентные электроны, доступные для рисования структуры Льюиса HCN, уже используются, поэтому на центральном атоме C нет неподеленной пары. Но остается вопрос: полный ли октет этого центрального атома? В приведенной выше структуре Льюиса вокруг центрального атома C имеется 2 одинарных связи, что означает в общей сложности 4 валентных электрона. Таким образом, углероду по-прежнему требуется еще 4 электрона для достижения стабильной конфигурации октета. Практическим решением этой проблемы является преобразование двух неподеленных пар, присутствующих на внешнем атоме азота, в ковалентные связи. Это приводит к тройной ковалентной связи между связанными атомами C и N, как показано на рисунке ниже. В приведенной выше структуре Льюиса центральный атом C и внешний атом N имеют полный октет, а атом H имеет полный дуплет. Таким образом, выгодное положение для всех вовлеченных атомов. В качестве последнего шага нам просто нужно проверить устойчивость структуры Льюиса, полученной в , шаг 5 , и мы можем сделать это, используя концепцию формального начисления. 6. Проверка устойчивости структуры Льюиса HCN с использованием концепции формального заряда Чем меньше формальный заряд атомов молекулы, тем выше стабильность ее структуры Льюиса. Официальный сбор можно рассчитать по приведенной ниже формуле. Теперь посчитаем формальный заряд атомов HCN, используя эту формулу и структуру Льюиса, нарисованную на шаге 5. Для атома углерода Для атома азота Для атома водорода Отсутствие формальных зарядов ни на одном из связанных атомов в молекуле HCN подтверждает устойчивость нарисованной нами структуры Льюиса. Также проверьте – 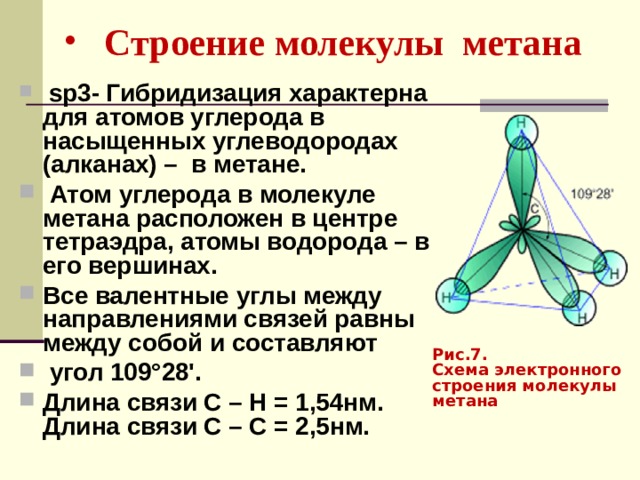
Какова электронная и молекулярная геометрия HCN?
Молекула цианистого водорода (HCN) имеет идентичную электронную и молекулярную геометрию или форму, то есть линейную. Все связанные атомы лежат симметрично в одной плоскости в линейном расположении.
Молекулярная геометрия HCNМолекулярная геометрия или форма молекулы HCN является линейной. Вокруг центрального атома углерода (С) в молекуле имеется одинарная связь и тройная связь, в то время как на этом центральном атоме нет неподеленной пары.
В молекуле нет отталкивания «одинокая пара — одинокая пара» или отталкивания «одинокая пара — пара связей». Это заставляет молекулу сохранять симметричную линейную форму.
Атомы H, C и N лежат на прямой линии, как показано на рисунке ниже, поэтому дано название «линейный».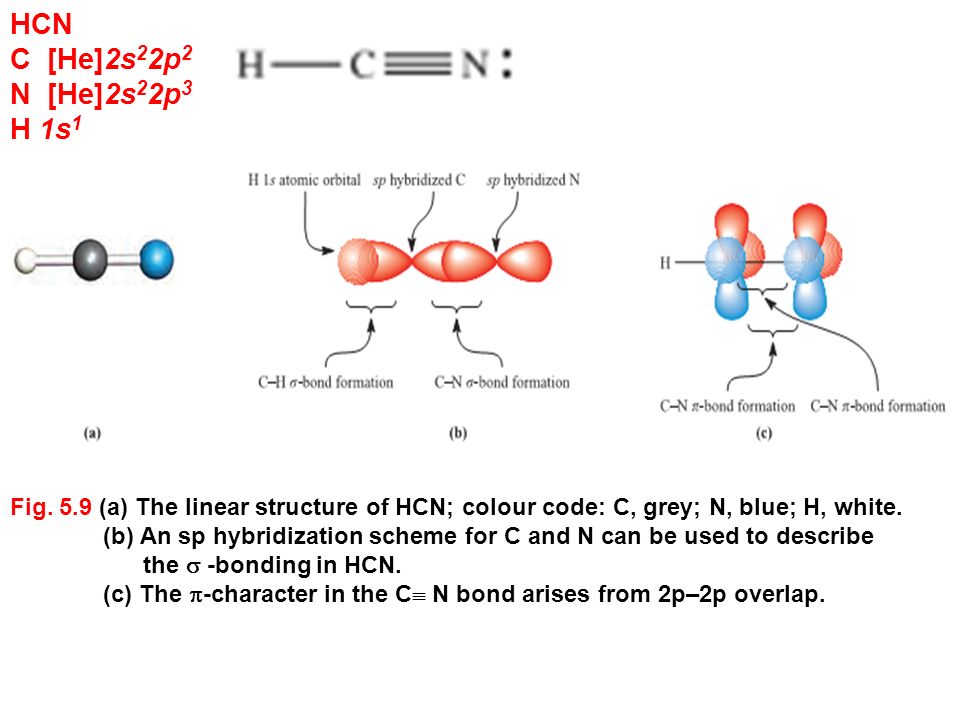 Это линейное расположение сводит к минимуму отталкивание пары связь-связь между связанными электронными парами.
Это линейное расположение сводит к минимуму отталкивание пары связь-связь между связанными электронными парами.
Молекулярная геометрия или форма молекулы зависит от различия между парами связей и неподеленными парами электронов, присутствующих в молекуле.
И наоборот, идеальная электронная геометрия молекулы определяется областями полной электронной плотности, окружающими центральный атом в молекуле.
Электронная геометрия HCNИдеальная электронная геометрия молекулы, имеющей две области электронной плотности вокруг центрального атома в молекуле, является линейной. В молекуле HCN тройная связь между связанными атомами C и N считается 1 областью электронной плотности.
Точно так же одинарная ковалентная связь между связанными атомами H и C представляет собой еще одну отдельную область электронной плотности.
Короче говоря, вокруг центрального атома C в молекуле HCN имеется всего 2 области электронной плотности.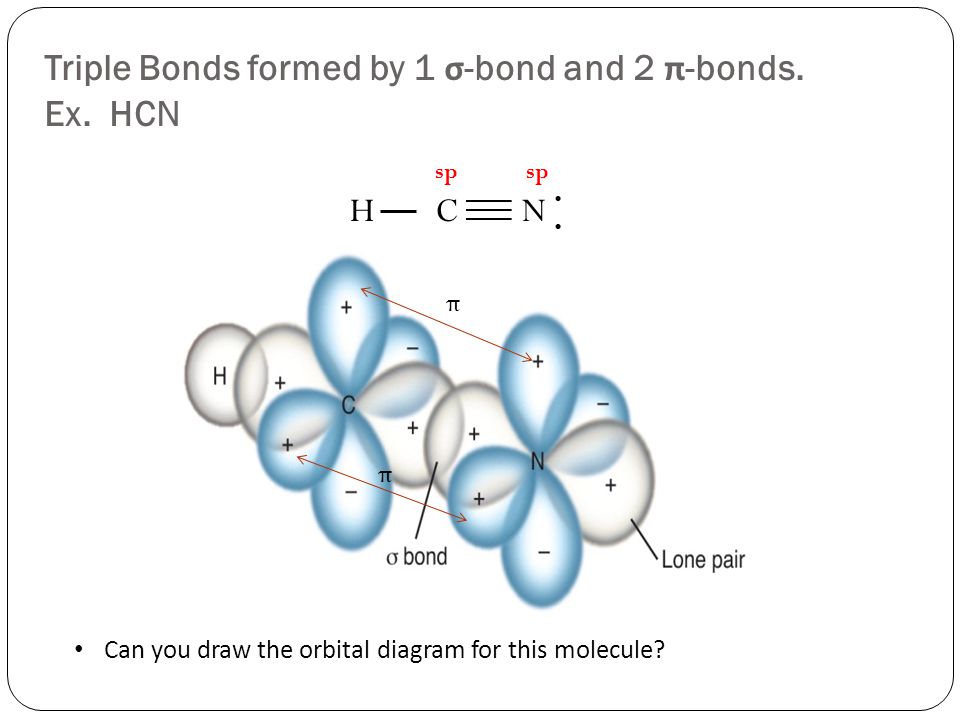 Таким образом, идеальная электронная геометрия HCN является линейной, что идентично его молекулярной геометрии или форме.
Таким образом, идеальная электронная геометрия HCN является линейной, что идентично его молекулярной геометрии или форме.
Быстрый и более простой способ определения электронной и молекулярной геометрии или формы молекулы, такой как HCN, — использование метода AXN.
AXN — это простая формула для представления атомов, связанных с центральным атомом молекулы, и количества неподеленных пар, присутствующих на этом центральном атоме.
Используется для предсказания геометрии или формы молекулы с использованием концепции VSEPR.
Обозначение AXN для молекулы HCN
- Символ A в формуле AXN представляет центральный атом, присутствующий в молекуле. В молекуле HCN углерод (C) действует как центральный атом, поэтому A=C.
- X обозначает атомы, связанные с центральным атомом. Так как 1 атом азота и 1 атом водорода связаны с центральным атомом углерода в молекуле HCN, то для HCN X=2.

- N обозначает количество неподеленных пар, присутствующих на центральном атоме в молекуле. Поскольку у центрального атома углерода в молекуле HCN нет неподеленной пары, то для HCN N=0.
Это показывает, что общая формула AXN для молекулы HCN имеет вид AX 2 .
Теперь взгляните на приведенную ниже диаграмму VSEPR и определите, какая электронная и молекулярная геометрия соответствует AX 9.0115 2 формула.
Диаграмма VSEPR подтверждает, что молекулы, имеющие общую формулу AX 2 , имеют идентичную электронную и молекулярную геометрию или форму, то есть линейную, как мы уже отметили для молекулы HCN.
Гибридизация HCNСвязанные атомы C и N в молекуле HCN находятся в состоянии sp-гибридизации.
Электронная конфигурация углерода (C) 1s 2 2s 2 2p 2 . Во время химической связи два 2s-электрона углерода становятся неспаренными.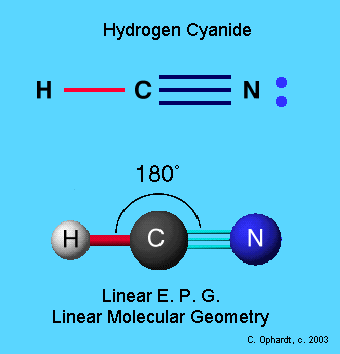 Один из двух 2s-электронов переходит на пустую 2p-орбиталь. Это приводит к электронной конфигурации возбужденного состояния 1s 2 2s 1 2p x 1 2p y 1 2p z 0 1.
Один из двух 2s-электронов переходит на пустую 2p-орбиталь. Это приводит к электронной конфигурации возбужденного состояния 1s 2 2s 1 2p x 1 2p y 1 2p z 0 1.
Следовательно, 2s-орбиталь смешивается с одной 2p-орбиталью, образуя две эквивалентные sp-гибридные орбитали, каждая из которых содержит только один электрон. Каждая sp-гибридная орбиталь имеет 50%-й характер s и 50%-ный характер p.
Электронная конфигурация азота (N): 1s 2 2s 2 2p 3 . Во время образования химической связи 2s-орбиталь азота гибридизуется с одной из трех атомных 2p-орбиталей с образованием двух sp-гибридных орбиталей.
Одна из двух sp-гибридных орбиталей содержит спаренные электроны, которые расположены неподеленной парой на атоме N в молекуле HCN. Другая sp-гибридная орбиталь содержит только один электрон, поэтому она используется для образования сигма-(σ)-связи с sp-гибридной орбиталью углерода за счет перекрытия sp-sp.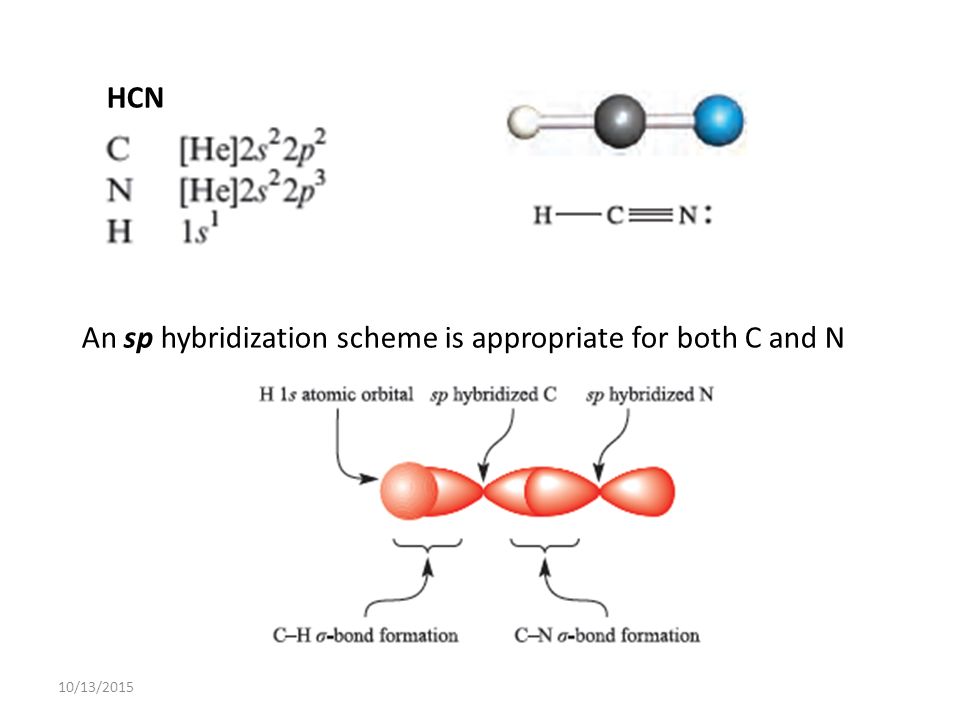
Вторая sp-гибридная орбиталь углерода образует еще одну сигма-связь (σ) с s-орбиталью H посредством sp-s-перекрытия. И наоборот, негибридизованные p-орбитали атомов углерода и азота образуют две связи pi (π). См. рисунок, приведенный ниже.
Короткий прием для нахождения гибридизации, присутствующей в молекуле, заключается в запоминании приведенной ниже таблицы. Стерическое число молекулы можно использовать по этой таблице, чтобы определить требуемую гибридизацию.
| Steric number | Hybridization |
| 2 | sp |
| 3 | sp 2 |
| 4 | sp 3 |
| 5 | SP 3 D |
| 6 | SP 3 D 2 |
9098. равно 2. Таким образом, он имеет sp-гибридизацию.
Линейный — идеальная форма и молекулярная геометрия. Нет интерференции неподеленных пар в форме и геометрии молекулы. Такие структуры неофициально называются нульмерными.
Три связанных атома расположены симметрично по прямой линии в молекуле HCN, образуя взаимный валентный угол 180°.
В молекуле HCN длина связи H-C составляет 109 пм, а длина связи C-N составляет 116 пм соответственно.
Является ли HCN полярным или неполярным?Также проверьте:- Как найти валентный угол?
Азот (N) более электроотрицателен, чем углерод (C). Между связанными атомами C (E.N = 2,55) и N (E.N = 3,04) в молекуле HCN существует разница в электроотрицательности 0,49 ед. Таким образом, связь CN является полярной с определенным значением дипольного момента (символ μ ).
Существует относительно небольшая разница в электроотрицательности между связанными атомами C (E.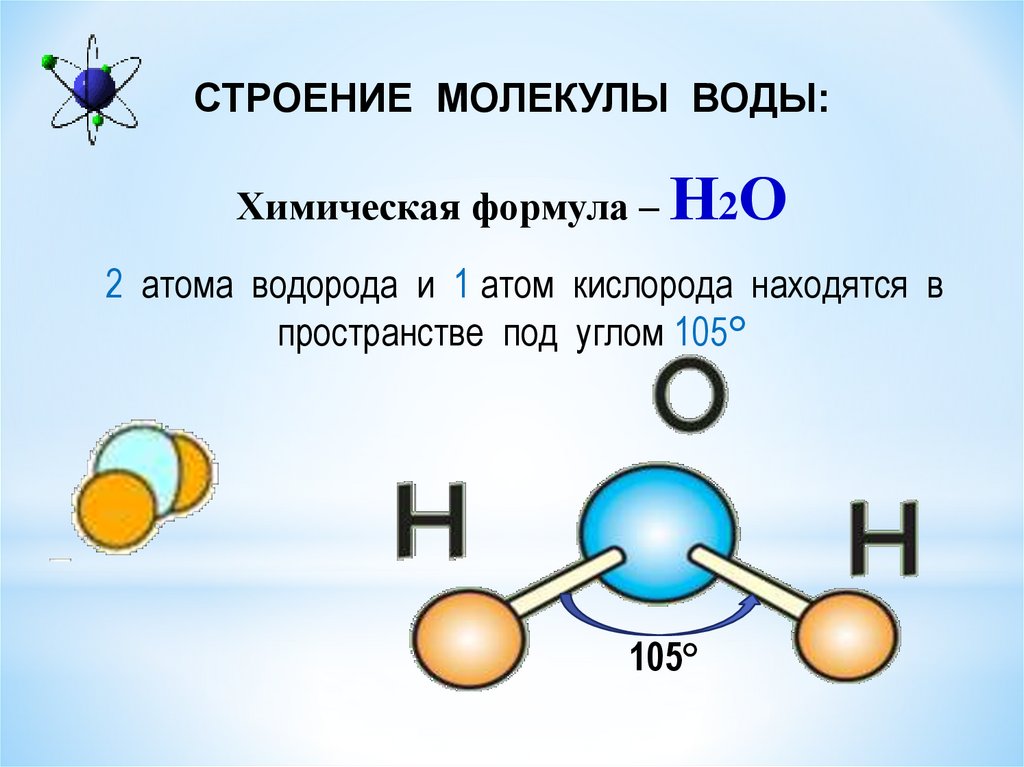 N = 2,55) и H (E.N = 2,20) в связи H-C. Таким образом, связь НС является слабополярной.
N = 2,55) и H (E.N = 2,20) в связи H-C. Таким образом, связь НС является слабополярной.
Азот, однако, из-за его высокой электроотрицательности притягивает общее электронное облако от связи CH в дополнение к притяжению электронного облака CN.
Следовательно, в молекуле образуются противоположно заряженные полюса, что означает, что молекула цианистого водорода (HCN) в целом полярна с результирующим дипольным моментом μ=2,98 Дебая (D).
Часто задаваемые вопросыПодробнее –
- Полярный или неполярный HCN?
- Как определить, является молекула полярной или неполярной?
| Какова структура Льюиса HCN? |
Структура Льюиса HCN состоит из трех различных атомов, то есть атомов C, H и N. Три атома лежат в одной плоскости в линейном порядке. Атом углерода (С) находится в центре структуры Льюиса. Он связан одинарной ковалентной связью с атомом водорода (H) с левой стороны. С правой стороны центральный атом C связан с атомом азота (N) тройной ковалентной связью. Неподеленная пара электронов также присутствует на внешнем атоме N, как показано ниже. |
| Сколько пар связей и неподеленных пар в структуре Льюиса HCN? |
Технически в структуре Льюиса HCN имеется 4 пары связей и 1 неподеленная пара. Три пары связей представляют собой 1 сигма- и 2 пи-связи между атомами C и N, связанными тройной связью, в то время как между атомами C и H, связанными одинарной связью, имеется пара общих связей. На центральном атоме С нет неподеленной пары, а на атоме N присутствует 1 неподеленная пара электронов. три пары связей между атомами C и N считаются одной областью электронной плотности при задании формы и геометрии молекуле HCN. |
| Какова форма молекулы и валентный угол HCN? |
| Согласно концепции VSEPR, HCN представляет собой молекулу типа AX 2 . Таким образом, он имеет идентичную электронную геометрию и молекулярную форму, то есть линейную. Атомы H-C-N лежат на прямой линии в линейном расположении и образуют взаимный валентный угол 180° |
| Почему форма HCN линейная, а H 2 O угловатая? |
Цианистый водород (HCN) представляет собой линейную молекулу, так как все связанные атомы лежат симметрично, в одной плоскости, а у центрального атома углерода нет неподеленной пары. Напротив, вода (H 2 O) представляет собой молекулу угловатой или изогнутой формы из-за 2 неподеленных пар, расположенных на центральном атоме O в молекуле. Отталкивание неподеленной пары и неподеленной пары и отталкивание пар неподеленная пара-связь нарушают симметрию трех связанных атомов. |
Читайте также:-
- CH 2 Cl 2 структура Льюиса и ее молекулярная геометрия
- CH 3 Структура Льюиса COOH и ее молекулярная геометрия
- С 2 Н 2 Cl 2 структура Льюиса и ее молекулярная геометрия
- CHCl 3 структура Льюиса и ее молекулярная геометрия
- CH 3 Структура Ф-льюиса и ее молекулярная геометрия
- CF 2 Cl 2 структура Льюиса и ее молекулярная геометрия
- CH 3 CN структура Льюиса и ее молекулярная геометрия
- CH 2 Структура Льюиса и ее молекулярная геометрия
- Общее количество валентных электронов, доступных для рисования структуры HCN Lewis , равно 10.



 Валентный угол уменьшается, и молекула принимает асимметричную угловатую форму.
Валентный угол уменьшается, и молекула принимает асимметричную угловатую форму.