Оксиды. Классификация, свойства, получение, применение.
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
 Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты
 Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:
Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства: Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов,
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей: Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:
 Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: 
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений: Термическое разложение солей, кислот и оснований :
Термическое разложение солей, кислот и оснований :
Применение оксидов
 Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Общая характеристика оксидов — урок. Химия, 8–9 класс.
Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
В оксидах химический элемент кислород находится в степени окисления \(–2\).
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
Примеры оксидов:
h3O — оксид водорода, или вода.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
CO2 — оксид углерода(\(IV\)), двуокись углерода или углекислый газ.


CO — оксид углерода(\(II\)), угарный газ.
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
 |  |
Fe2O3 — оксид железа(\(III\)).
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
 |
SiO2 — оксид кремния.
В природе встречается в виде кварцевого песка, кварца, горного хрусталя.
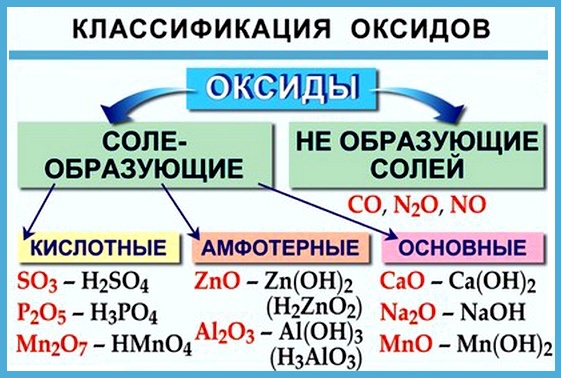
Классификация оксидов
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
- Основные оксиды.
Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основной оксид, является невысокой: \(+1\) или \(+2\).Примеры основных оксидов:
оксид натрия Na2O, оксид меди(\(II\)) CuO.
- Кислотные оксиды.
Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду.
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы(\(VI\)) SO3, оксид азота(\(IV\)) NO2.
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от \(+5\) до \(+8\). Например, оксид хрома(\(VI\)) CrO3 и оксид марганца(\(VII\)) Mn2O7.
- Амфотерные оксиды.
Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
Амфотерные свойства проявляет оксид цинка ZnO, оксид алюминия Al2O3, оксид бериллия BeO.
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
Например, хром может быть двухвалентен, трёхвалентен и шестивалентен.
Амфотерными свойствами обладает именно оксид хрома (\(III\)) Cr2O3.
- Несолеобразующие оксиды.
Несолеобразующими называют оксиды, которые при обычных условиях не взаимодействуют ни с кислотами, ни с основаниями.
Примеры несолеобразующих оксидов: оксид углерода(\(II\)), или угарный газ CO, оксид азота(\(I\)), или веселящий газ N2O, и оксид азота(\(II\)) NO.
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Например: Na2O — оксид натрия, Al2O3 — оксид алюминия.Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например: Cu2O — оксид меди(\(I\)), CuO — оксид меди(\(II\)), FeO — оксид железа(\(II\)), Fe2O3 — оксид железа(\(III\)), Cl2O7 — оксид хлора(\(VII\)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Например: монооксид углерода CO, диоксид углерода CO2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ CO, серный ангидрид SO3 и т. д.
Оксиды: классификация и химические свойства
Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
 Оксиды могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Оксиды могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
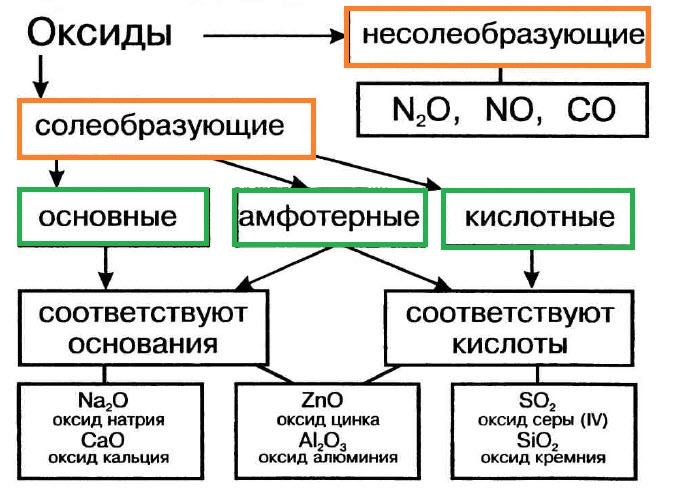
Они бывают солеобразующими и несолеобразующие.
Солеобразующие оксиды – это такие оксиды, которые в результате химических реакций образуют соли. Это оксиды металлов и неметаллов, которые при взаимодействии с водой образуют соответствующие кислоты, а при взаимодействии с основаниями – соответствующие кислые и нормальные соли. Например, оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl2 + H2O.
В результате химических реакций можно получать и другие соли:
CuO + SO3 → CuSO4.
Несолеобразующими оксидами называются такие оксиды, которые не образуют солей. Примером могут служить СО, N2O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова «основание»), кислотными и амфотерными.
Основными оксидами называются такие оксиды металлов, которым соответствуют гидроксиды, относящиеся к классу оснований. К основным оксидам относятся, например, Na2O, K2O, MgO, CaO и т.д.
 Химические свойства основных оксидов
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na2O + H2O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na2O + SO3 → Na2SO4.
3. Реагируют с кислотами, образуя соль и воду:
CuO + H2SO4 → CuSO4 + H2O.
4. Реагируют с амфотерными оксидами:
Li2O + Al2O3 → 2LiAlO2.
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO2, SO3, P2O5, N2O3, Cl2O5, Mn2O7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO3 + H2O → H2SO4.
Но не все кислотные оксиды непосредственно реагируют с водой (SiO2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO2 + CaO → CaCO3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO2 + Ba(OH)2 → BaCO3 + H2O.
В состав амфотерного оксида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH)2 и H2ZnO2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl2 + H2O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na2 ZnO2 + H2O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + H2O => Na2[Zn(OH)4].
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле. Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Остались вопросы? Хотите знать больше об оксидах?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Конспект «Оксиды (названия, классификация, получение)»
«Оксиды (названия, классификация, получение)»
Ключевые слова конспекта: оксиды, названия оксидов, классификация оксидов, получение оксидов, химические свойства.
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2.
К примеру, оксидом является соединение P2O5. А вот РН3 и H3PO4 — не являются оксидами, потому что в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов, а не двух.
Оксиды подразделяют на солеобразующие (основные, кислотные, амфотерные) и несолеобразующие (безразличные). Особое положение у оксида «вода».
Названия оксидов
Названия оксидов состоят из двух слов: 1-е – «оксид», 2-е – название элемента в родительном падеже. Например, СаО – оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Например: Fe2О3— оксид железа (III), FеО — оксид железа (II). Если у элемента постоянная валентность, то ее не обозначают в названии.
Некоторые оксиды имеют особые (тривиальные) названия: Н2О — вода, СО — угарный газ, СО2 — углекислый газ и др.

Если элемент образует оксиды в нескольких степенях окисления, то оксид с наименьшей валентностью – низший оксид, а с наибольшей – высший оксид. Так, оксид хрома (II) СгО – низший оксид, а оксид хрома (VI) СгO3 – высший оксид.
Классификация оксидов
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими (безразличными): H2O, CO, N2O, NO, F2O. Безразличные оксиды образуются только неметаллами.
Вот некоторые правила образования солеобразующих оксидов:
- неметаллы образуют только кислотные оксиды;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
Предсказать свойства оксида металла может помочь эта схема.

Основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Валентность металлов в амфотерных оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов.
Схема определения типа оксида:
- определить, не является ли данный оксид несолеобразующим;
- определить, какой элемент входит в состав оксида: металл или неметалл, для чего нужно знать из таблицы Менделеева символы элементов — неметаллов.
- если в состав оксида входит атом неметалла — то оксид кислотный;
- для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
Например:
- Сг2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- CrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
Получение оксидов
Oксиды образуются при взаимодействии простых и сложных веществ с кислородом:
4Аl + 3O2 = 2Аl2O3; Si + O2 = SiO2;
SiH4 + 2O2 = SiO2 + 2Н2O; 2Н2S + 3O2 = 2SO2 + 2Н2O.
В реакциях с простыми веществами из одних оксидов могут получаться другие оксиды:
Fe2O3 + С = 2FeO + СО; 2CuO + Н2 = Сu2O + Н2O.
Oксиды образуются при разложении некоторых сложных веществ, обычно при нагревании:
СаСO3 = СаО + СO2; 2Аl(ОН)3 = Аl2O3 + 3Н2O.
Химические свойства оксидов
1. При разложении (при нагревании) неустойчивых оксидов – оксида серебра Ag2O и оксида ртути (II) HgO – образуется соответствующий металл и кислород:
2Ag2O = 4Ag + O2 ↑, 2HgO = 2Hg + O2 ↑.
2. Некоторые oксиды при нагревании образуют другие оксиды. Так, из красного оксида хрома (VI) получается зеленый оксид хрома (III): 4СrO3 = 2Сr2O3 + 3O2 ↑.
3. Некоторые oксиды металлов и неметаллов реагируют с водой:
СаО + Н2O = Са(ОН)2, SO3 + Н2O = Н2SO4.
4. Oксиды металлов обычно реагируют с оксидами неметаллов:
СаО + SO2 = CaSO3, MgO + СO2 = MgCO3.
Реакции оксидов с основаниями, кислотами и солями будут рассмотрены позже.
Конспект урока «Оксиды (названия, классификация, получение, свойства)».
Следующая тема: «Свойства солеобразующих оксидов».
План-конспект урока по химии (8 класс): Оксиды. Состав. Классификация и номенклатура
8 класс Тема урока: «Оксиды. Состав, номенклатура, классификация.
Основные и кислотные оксиды».
Урок « Оксиды» относится к блочной теме « Соединения химических элементов» и является вторым по счету. Занятие носит проблемный характер, построен на применении знаний учащихся о бинарных соединениях и валентности элементов.
Тип урока: урок изучения нового материала
Цель урока: сформировать понятие об оксидах как об одном из классов химических соединений; рассмотреть состав, строение, номенклатуру.
Задачи (шаги, с помощью которых достигаются цели урока):
Образовательные задачи:
- дать понятие об оксидах
- продолжить формирование умения составлять формулы веществ, используя валентность элементов, названия веществ.
- закрепить знания химической номенклатуры для бинарных соединений
- показать значение оксидов в природе и жизни человека.
Развивающие задачи:
- Развивать речевые навыки, наблюдение и умение делать выводы
- развивать умение работать коллективно
- Развивать интерес к химической науке
Воспитательные задачи:
- Воспитывать умение работать в атмосфере поиска, творчества, прививать чувство ответственности за выполненную работу, самостоятельность, общительность, коммуникабельность.
Оборудование: ноутбук, проектор, экран, ПСХЭ Д.И. Менделеева, дидактический материал, учебник; на столах учащихся образцы природных минералов и руд, содержащих оксиды.
Ход урока:
- Организационный момент
Приветствие, проверка готовности к уроку
Цель: Включение детей в деятельность на личностно-значимом уровне.
Здравствуйте ребята, садитесь. Мы снова встретились с вами на уроке химии, где сами открываете новые знания, как вы это делаете? (Мы проходим два этапа: определяем, что мы еще не знаем, и самостоятельно открываем новые знания.)
- Актуализация знаний.
Мотивация учебной деятельности на успешную работу
Цель: Повторение изученного материала, необходимого для «открытия нового знания»
Вначале урока учитель проводит самостоятельную работу, где отрабатываются умения учащихся определять валентность химических элементов по формулам бинарных соединений и, наоборот, записывать формулы по валентности.
Самостоятельная работа «Валентность химических элементов»
№ п/п | Символ химического элемента | Валентность | Формула соединения | Символ химического элемента | Валентность |
1 | Na | ? | NaCl | Cl | I |
2 | Al | ? | Al2O3 | ? | ? |
3 | ? | ? | CaO | ? | ? |
4 | K | ? | ? | N | V |
5 | C | IV | ? | O | ? |
( учащиеся работают индивидуально, самоконтроль по шаблону)
Провожу «мозговой штурм» для самостоятельного определения темы урока.
Тема сегодняшнего урока …. А вот это вы узнаете, когда отгадаете кроссворд. На работу вам отводится 2 мин. Работая парами, впишите химические термины в бланк и найдите ключевое слово.
По горизонтали:
1. Название элемента, имеющего относительную атомную массу 35,5
2. Название этого элемента содержит в своем составе хвойное дерево, а атом этого элемента весит 58 а.е.м.
3. Он бесцветный, но тяжелый,
В нем огонь всегда веселый.
Он в крови у нас живет,
Ну, конечно …
4. Назовите науку о веществах и их превращениях
5. Он с погодной стужей дружит,
Иногда лекарством людям служит,
Знает млад и стар народ –
Коль ушиб, то срочно нужен …
6. Назовите элемент, в названии которого спрятались названия сразу двух животных и находится он между 32 и 34 химическим элементом.
Правильно — оксиды. Это тема сегодняшнего урока. Запишите, пожалуйста, ее в тетради (слайд №1).
III. Изучение нового материала
С кислородом ходит парой,
То металл, то неметалл он,
Дружбу связями скрепит
Всем известный класс… (ОКСИД). (слайд№2)
Вспомните, пожалуйста, определение класса ОКСИДОВ и запишите его в тетрадь (слайд
- Изучение нового материала.
(Цель: формирование системно-информационного анализа, развитие умений определять цели и задачи деятельности, выбирать средства реализации цели)
Класс веществ, который нам предстоит изучить, всегда содержит кислород, представители этого класса получаются при взаимодействии с кислородом, это бинарные соединения.
Выпишите формулы этих соединений. (см. формулы в с/р, один ученик -у доски, остальные в тетрадях)
Al2O3
CaO Какой класс сложных веществ нам предстоит изучить?
CO2 Назовите тему сегодняшнего урока? (учащиеся: оксиды)
— Верно. Вы правильно определили тему сегодняшнего урока
«Оксиды. Состав, классификация, номенклатура».
( Запись темы урока «Оксиды» в тетрадь)
Этап «открытия нового знания»
- Определение класса оксидов
Проанализируйте формулы. Что общего во всех этих веществах?
( Учащиеся выделяют общие признаки оксидов, работая в паре)
— Сформулируем определение оксидов, ответив на 3 вопроса.
В ходе анализа справа от формул учитель делает краткую запись на доске, а учащиеся в тетради:
а) какие вещества по составу?
б) сколько элементов в составе?
в) какой элемент обязательно входит в состав оксидов, его валентность?
Al2O3 1. Сложные вещества.
CaO 2. Состоят из 2 х.э.
CO2 3. О, II
(создание проблемной ситуации и ее решение)
— Дайте определение оксидам (Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород c валентностью -2).
(учащиеся записывают определение в тетрадь).
Первичная проверка усвоения нового материала.
Игра «Волшебный цветок»
Сорвать все лепестки с формулами оксидов.
(Учащиеся работают в группах, выбирают формулы оксидов, мотивируя свой выбор).
(создание проблемной ситуации и ее решение)
OF2 можно ли отнести к оксидам? ( учащиеся обращаются к алгоритму составления оксидов)
г) Алгоритм составления формул оксидов (учащиеся работают с учебником).
Учащиеся: OF2 – фторид кислорода.
Выведите общую формулу класса оксидов.
II
ЭxОy
Классификация оксидов (оксиды металлов, оксиды неметаллов).
Первичная проверка усвоения нового материала.
Составьте формулы оксидов: оксид бария, оксид алюминия, оксид калия, оксид углерода(IV), оксид серы(VI) , оксид железа(III)
Физминутка. Трудным оказался путь, надо бы передохнуть. (Зарядка для глаз)
2) Номенклатура (названия) оксидов.
Попробуйте правильно назвать оксиды, формулы которых записаны К2О, FeO, Fe2O3
Названия оксидов, в состав которых входят химические элементы с постоянной валентностью, даются без упоминания валентности.
Если же они образованны химическими элементами с переменной валентностью, то рядом с названием оксида ставится в скобках валентность
Алгоритм построения названий оксидов:
Оксид + название элемента в родительном падеже (валентность в случае ее переменности) Учащиеся записывают алгоритм в тетрадь.
Первичная проверка усвоения нового материала.
(работа в группах, самоконтроль по шаблону) У вас на столах лежат карточки.
Выпишите в столбик из перечня химических формул веществ формулы оксидов и
MgO, KOH, O3, SO3, SO2, Al2S3, CaCO3, Аl2O3, Mg(OH)2, CO2, Na3N, HCl, CaO, h3CO3, P2O5, FeCl3, Na2O, h3SO4, СuО, Cu2O, HNO3 ,Nh4
3) Многие оксиды встречаются в природе в виде полезных ископаемых, они находятся в окружающем нас воздухе, образуются в результате деятельности человека. Сейчас вы познакомитесь с образцами оксидов. (работа с коллекцией природных оксидов)
- Н2О — вода — оксид водорода
- Al2О3- оксид алюминия — глинозём
- SiO2 — кварц, кремнезём, речной песок, яшма – оксид кремния
- СаО — оксид кальция — негашеная известь
- MnO2 — оксид марганца (IV) — пиролюзит
- MgO — оксид магния — жженая магнезия
- Fe2O3 — оксид железа (III) — красный железняк (гематит)
Те оксиды, с которыми вы познакомились используются человеком в строительстве, для производства металлов, стекла, как поделочные материалы.
4) Составьте формулы названных в тексте оксидов (работа с текстом в группе, самоконтроль по шаблону)
В земной коре – литосфере – находится оксид алюминия ________ (глина), оксид кремния (IV) _____ (песок), оксид железа (III) ______ (содержится в красном железняке). Водная оболочка Земли – гидросфера – оксид водорода _____. В воздухе есть оксид углерода (IV) ______ (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) _____ (угарный газ), оксид серы (IV) ______ (сернистый газ), оксид азота (II) ____ и оксид азота (IV) ______.
Ответ: оксид алюминия — Al2O3, оксид кремния — SiO2, оксид железа (III) — Fe2O3, оксид водорода — Н2О, оксид углерода (IV) — СО2, оксид серы (IV) — SO2, оксид азота (II) – NO, оксид азота (IV) — NO2
5) Сообщения учащихся
- Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета, запаха и вкуса. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
- Натуральный рубин — самый дорогой драгоценный камень в мире. Всё потому, в природе очень редко встречаются совершенные рубины ещё и больших размеров. Рубин — разновидность корунда. Химическая формула Al2O3
- Углекислый газ (Оксид углерода(IV) ) — CO2, газ без цвета, обладает кислым запахом и вкусом (что используется в производстве газированной воды), растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации −78 °С. Углекислый газ образуется при гниении и горении органических веществ.
- Глина — широко распространенная горная порода. Состав глины. Во всех сортах природной глины всегда содержатся: а) глинозем, т. е. окcид алюминия Al2O3; б) кремнезем или оксид кремния(IV) SiO2; в) гидратная вода, Н2O, как вещество удаляемое после выслушивания при прокаливании. Из глиняного теста делают различные изделия — кувшины, кринки, горшки, миски и т. п., которые после обжига становятся совершенно твердыми и не пропускают воду. Кирпичные заводы вырабатывают из глины строительные кирпичи, также обладающие большой механической прочностью. Это указывает еще на одно важное свойство глины — ее способность твердеть после обжига, давая материал, не размокающий в воде и непроницаемый для нее.
6.Получение оксидов
IV. Контроль знаний, обратная связь
( самостоятельная работа учащихся, оценка своей работы по ключу)
Тест по теме: «Оксиды».
1.Общая формула оксидов.
А) ЭxОy Б) ЭхНу В) ЭхНуО
2. Ряд формул, в котором все вещества оксиды:
А) ZnO, ZnCl2, h3O Б) CaO, NaOH, Nh4 В)SO3, MgO, CuO
3. Оксид марганца (IV) имеет формулу
А)Mn2O7 Б) MnO2 В) MnF4
4. Установите соответствие между формулой оксида и названием
Формула оксида Название оксида
1.NO А) оксид азота (II)
2.N2O3 Б) оксид азота (IV)
3.NO2 В) оксид азота (III)
Г) оксид азота (V)
5. Запишите формулы: оксид натрия, оксид углерода (IV), оксид фосфора (V)
V.Подведение итогов. Рефлексия.
(Цель: формирование у учащихся способности подводить итоги урока, обобщать, делать выводы, характеризовать свои действия)
Молодцы, вы сегодня хорошо работали. Мы все вместе узнали что-то новое и всё же каждый для себя совершил какое- то открытие. Поделитесь этим открытием, закончите предложение:
А всё ли мы знаем об оксидах?
— Обратите внимание. Перед каждым из вас лежит листок, в котором даются характеристики оксидов. В течение минуты проставьте знаки «+» во 2-ой колонке (в колонке «Я знаю») напротив тех характеристик, с которыми вы познакомились и узнали:
№ п/п | Характеристики оксидов | Я узнал (а) |
1 | Состав оксидов | |
2 | Классификацию оксидов | |
3 | Названия оксидов | |
4 | Физические свойства оксидов | |
5 | Получение оксидов | |
6 | Взаимодействие оксидов с водой | |
7 | Распространение оксидов в природе | |
8 | Применение оксидов |
Сегодня на уроке
- Мне удалось…
- Я узнал(а) много нового …
- Я научился …
- Мне необходимо …
Запишите продолжение этого предложения в тетрадях. Итак, озвучьте свои записи.
(мы сегодня научились находить формулы оксидов среди других веществ, называть оксиды и составлять формулы по названиям, познакомились с отдельными представителями оксидов.)
Позвольте и мне продолжить эту фразу.
Сегодня на уроке мне удалось пообщаться с замечательными молодыми людьми, которые станут украшением нашего общества.
Так как, урок необычный, я разрешаю вам поставить каждому из вас себе оценку.
Оцените себя.
- Домашнее задание: § 18 упр. 4,5, 6
Используя дополнительную литературу подготовить сообщение на тему: «Применение оксидов».
№ п/п | Символ химического элемента | Валентность | Формула соединения | Символ химического элемента | Валентность |
1 | Na | ? | NaCl | Cl | I |
2 | Al | ? | Al2O3 | ? | ? |
3 | ? | ? | CaO | ? | ? |
4 | K | ? | ? | N | V |
5 | C | IV | ? | O | ? |
№ п/п | Символ химического элемента | Валентность | Формула соединения | Символ химического элемента | Валентность |
1 | Na | ? | NaCl | Cl | I |
2 | Al | ? | Al2O3 | ? | ? |
3 | ? | ? | CaO | ? | ? |
4 | K | ? | ? | N | V |
5 | C | IV | ? | O | ? |
№ п/п | Символ химического элемента | Валентность | Формула соединения | Символ химического элемента | Валентность |
1 | Na | ? | NaCl | Cl | I |
2 | Al | ? | Al2O3 | ? | ? |
3 | ? | ? | CaO | ? | ? |
4 | K | ? | ? | N | V |
5 | C | IV | ? | O | ? |
№ п/п | Символ химического элемента | Валентность | Формула соединения | Символ химического элемента | Валентность |
1 | Na | ? | NaCl | Cl | I |
2 | Al | ? | Al2O3 | ? | ? |
3 | ? | ? | CaO | ? | ? |
4 | K | ? | ? | N | V |
5 | C | IV | ? | O | ? |
Составьте формулы названных в тексте оксидов (работа с текстом в паре, самоконтроль по шаблону)
В земной коре – литосфере – находится оксид алюминия ________ (глина), оксид кремния (IV) _____ (песок), оксид железа (III) ______ (содержится в красном железняке). Водная оболочка Земли – гидросфера – оксид водорода _____. В воздухе есть оксид углерода (IV) ______ (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) _____ (угарный газ), оксид серы (IV) ______ (сернистый газ), оксид азота (II) ____ и оксид азота (IV) ______.
Составьте формулы названных в тексте оксидов (работа с текстом в паре, самоконтроль по шаблону)
В земной коре – литосфере – находится оксид алюминия ________ (глина), оксид кремния (IV) _____ (песок), оксид железа (III) ______ (содержится в красном железняке). Водная оболочка Земли – гидросфера – оксид водорода _____. В воздухе есть оксид углерода (IV) ______ (углекислый газ). В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода (II) _____ (угарный газ), оксид серы (IV) ______ (сернистый газ), оксид азота (II) ____ и оксид азота (IV) ______.
Ответ:
- оксид алюминия — Al2O3, 2. оксид кремния — SiO2, 3. оксид железа (III) — Fe2O3, 4. оксид водорода — Н2О, 5. оксид углерода (IV) — СО2, 6. оксид серы (IV) — SO2, 7. оксид азота (II) – NO, 8. оксид азота (IV) — NO2
Ответ:
- оксид алюминия — Al2O3, 2. оксид кремния — SiO2, 3. оксид железа (III) — Fe2O3, 4. оксид водорода — Н2О, 5. оксид углерода (IV) — СО2, 6. оксид серы (IV) — SO2, 7. оксид азота (II) – NO, 8. оксид азота (IV) — NO2
Ответ:
- оксид алюминия — Al2O3, 2. оксид кремния — SiO2, 3. оксид железа (III) — Fe2O3, 4. оксид водорода — Н2О, 5. оксид углерода (IV) — СО2, 6. оксид серы (IV) — SO2, 7. оксид азота (II) – NO, 8. оксид азота (IV) — NO2
Сегодня на уроке
- Мне удалось…
- Я узнал(а) много нового …
- Я научился …
- Мне необходимо …
Запишите продолжение этого предложения в тетрадях. Итак, озвучьте свои записи.
(мы сегодня научились находить формулы оксидов среди других веществ, называть оксиды и составлять формулы по названиям, познакомились с отдельными представителями оксидов.)
№ п/п | Характеристики оксидов | Я узнал (а) |
1 | Состав оксидов | |
2 | Классификацию оксидов | |
3 | Названия оксидов | |
4 | Физические свойства оксидов | |
5 | Получение оксидов | |
6 | Взаимодействие оксидов с водой | |
7 | Распространение оксидов в природе | |
8 | Применение оксидов |
Сегодня на уроке
- Мне удалось…
- Я узнал(а) много нового …
- Я научился …
- Мне необходимо …
Запишите продолжение этого предложения в тетрадях. Итак, озвучьте свои записи.
(мы сегодня научились находить формулы оксидов среди других веществ, называть оксиды и составлять формулы по названиям, познакомились с отдельными представителями оксидов.)
№ п/п | Характеристики оксидов | Я узнал (а) |
1 | Состав оксидов | |
2 | Классификацию оксидов | |
3 | Названия оксидов | |
4 | Физические свойства оксидов | |
5 | Получение оксидов | |
6 | Взаимодействие оксидов с водой | |
7 | Распространение оксидов в природе | |
8 | Применение оксидов |
Кальций окись (II)
порошкообразный
Медь окись (I)
порошкообразный
Хром окись (VI)
порошкообразный
Железо окись (III)
порошкообразный
5) Сообщения учащихся
- Вода́ (оксид водорода) — прозрачная жидкость, не имеющая цвета, запаха и вкуса. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, лёд на полюсах).
- Натуральный рубин — самый дорогой драгоценный камень в мире. Всё потому, в природе очень редко встречаются совершенные рубины ещё и больших размеров. Рубин — разновидность корунда. Химическая формула Al2O3
- Углекислый газ (Оксид углерода(IV) ) — CO2, газ без цвета, обладает кислым запахом и вкусом (что используется в производстве газированной воды), растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации −78 °С. Углекислый газ образуется при гниении и горении органических веществ.
- Глина — широко распространенная горная порода. Состав глины. Во всех сортах природной глины всегда содержатся: а) глинозем, т. е. окcид алюминия Al2O3; б) кремнезем или оксид кремния(IV) SiO2; в) гидратная вода, Н2O, как вещество удаляемое после выслушивания при прокаливании. Из глиняного теста делают различные изделия — кувшины, кринки, горшки, миски и т. п., которые после обжига становятся совершенно твердыми и не пропускают воду. Кирпичные заводы вырабатывают из глины строительные кирпичи, также обладающие большой механической прочностью. Это указывает еще на одно важное свойство глины — ее способность твердеть после обжига, давая материал, не размокающий в воде и непроницаемый для нее.
По горизонтали:
1. Название элемента, имеющего относительную атомную массу 35,5
2. Название этого элемента содержит в своем составе хвойное дерево, а атом этого элемента весит 58 а.е.м.
3. Он бесцветный, но тяжелый,
В нем огонь всегда веселый.
Он в крови у нас живет,
Ну, конечно …
4. Назовите науку о веществах и их превращениях
5. Он с погодной стужей дружит,
Иногда лекарством людям служит,
Знает млад и стар народ –
Коль ушиб, то срочно нужен …
6. Назовите элемент, в названии которого спрятались названия сразу двух животных и находится он между 32 и 34 химическим элементом.
Керамическая масса
Изобретение относится к электротехнической промышленности, а именно к производству электрокерамических изоляционных изделий. Техническим результатом предложенного изобретения является удешевление продукции при улучшении электромеханических свойств изоляторов и расширение сырьевой базы. Технический результат достигается дополнительным введением в состав керамической массы пыли электрофильтров вращающихся печей кальцинации глинозема. Масса содержит компоненты при следующем их соотношении, мас.%: глина 9,0 — 18,5, каолин 48,0 — 62,0, кварцевый песок 8,0 — 10,0, пегматит 17,0 — 24,0, отход производства глинозема 2,0 — 4,0. 2 табл.
Изобретение относится к электротехнической промышленности, а именно к производству электрокерамических изоляционных изделий.
Известна керамическая масса для изоляторов, включающая каолин, глину, кварцевый песок, полевой шпат, глинозем, фарфоровый черепок, доломит, мел, хромистый железняк и марганцевую руду [1]. Недостатком данной массы является использование дорогостоящих компонентов. Наиболее близким техническим решением, выбранным в качестве прототипа, является керамическая масса для изготовления электрических изоляторов, включающая каолин, глину, кварцевый песок, пегматит и малощелочное стекло [2]. Недостатком данной керамической массы является высокая температура обжига и использование привозного сырья. Техническим результатом изобретения является удешевление продукции при улучшении электромеханических свойств изоляторов и расширение сырьевой базы. Технический результат достигается тем, что керамическая масса для изготовления электрокерамических изоляторов, включающая глину, каолин, кварцевый песок и пегматит, дополнительно содержит оксидал, при следующем соотношении компонентов, мас.%: Глина — 9,0 — 18,5 Каолин — 48,0 — 62,0 Кварцевый песок — 8,0 — 10,0 Пегматит — 17,0 — 24,0 Оксидал — 2,0 — 4,0 Сопоставительный анализ с прототипом позволяет сделать вывод, что заявляемый состав керамической массы отличается от известного введением нового компонента — оксидала (отходы производства глинозема) и количественным содержанием компонентов. Оксидал (оксид алюминия) — это пыль электрофильтров вращающихся печей кальцинации глинозема, предварительно очищенная от примесей (R2O и SO3). Фазовый состав: содержание а-Al2O3, более 90%, гранулометрический состав: крупность порошка от 0 до 20 мкм, средний размер 5 — 7 мкм. Таким образом, заявляемое техническое решение соответствует критерию «новизна». Анализ известных составов керамических масс для изготовления электрокерамических изоляторов показал, что используемые вещества известны кроме оксидала, однако их применение в таком сочетании и в заявляемых количественных соотношениях обеспечивают изоляторам лучшие электромеханичекие свойства при значительном удешевлении продукции за счет расширения сырьевой базы. Таким образом, заявляемая керамическая масса соответствует критерию «изобретательский уровень». В таблице 1 приведены составы керамических масс для изготовления злектрокерамических изоляторов. Технология изготовления изделий из заявляемой массы состоит в следующем: все отощающие компоненты (кварцевый песок, пегматит и оксидал) измельчают мокрым способом и смешивают с глиносодержащим компонентом в шаровой мельнице до остатка на сите с сеткой 0063 не более 2%. Из шликера получают минеральный порошок путем добавления высушенных фильтр-пресных коржей, затем смешивают со связкой и прессуют изделия на гидравлических прессах. Шихта также пригодна для оформления методом пластического формования на вакуум-прессах с последующей обточкой на токарных станках. Образцы электрокерамических изоляторов, изготовленные из заявляемых керамических масс, имеют высокие электромеханические показатели (табл. 2.). Особенно следует подчеркнуть такой показатель как тангенс угла диэлектрических потерь, при частоте 1 кГц он равен 0,0001. А за счет расширения сырьевой базы (использование отходов производства глинозема) продукция имеет более низкую стоимость. ЛИТЕРАТУРА: 1. А.С. СССР N 339527, МКИ C 04 B 33/26, 1972 г. 2. А.с. СССР N 500203, МКИ C 04 B 33/26, 1976 г. (прототип)лФормула изобретения
Керамическая масса для изготовления электрокерамических изоляторов, включающая глину, каолин, кварцевый песок и пегматит, отличающаяся тем, что дополнительно содержит отход производства глинозема при следующем соотношении компонентов, мас.%: Глина — 9,0 — 18,5Каолин — 48,0 — 62,0
Кварцевый песок — 8,0 — 10,0
Пегматит — 17,0 — 24,0
Отход производства глинозема — 2,0 — 4,0н
РИСУНКИ
Рисунок 1, Рисунок 2Химические свойства оксидов — урок. Химия, 8–9 класс.
1. Основные оксиды, образованные щелочными и щелочноземельными металлами, взаимодействуют с водой, образуя растворимое в воде основание — щёлочи.
Основный оксид + вода → основание.
Например, при взаимодействии оксида кальция с водой образуется гидроксид кальция:
CaO+h3O→Ca(OH)2.
2. Основные оксиды взаимодействуют с кислотами, образуя соль и воду.
Основный оксид + кислота → соль + вода.
Например, при взаимодействии оксида меди с серной кислотой образуются сульфат меди и вода:CuO+h3SO4→CuSO4+h3O.
3. Основные оксиды могут взаимодействовать с оксидами, принадлежащими к другим классам, образуя соли.
Основный оксид + кислотный оксид → соль.
Например, при взаимодействии оксида магния с углекислым газом образуется карбонат магния:
MgO+CO2→MgCO3.
Химические свойства кислотных оксидов
1. Кислотные оксиды могут взаимодействовать с водой, образуя кислоты.
Кислотный оксид + вода → кислота.
Например, при взаимодействии оксида серы(\(VI\)) с водой образуется серная кислота:
SO3+h3O→h3SO4.
Обрати внимание!
Оксид кремния SiO2 с водой не реагирует.
2. Кислотные оксиды взаимодействуют со щелочами, образуя соль и воду.
Кислотный оксид + основание → соль + вода.
Например, при взаимодействии оксида серы(\(IV\)) с гидроксидом натрия образуются сульфит натрия и вода:
SO2+2NaOH→Na2SO3+h3O.
3. Кислотные оксиды могут реагировать с основными оксидами, образуя соли.
Кислотный оксид + основный оксид → соль.
Например, при взаимодействии оксида углерода(\(IV\)) с оксидом кальция образуется карбонат кальция:CO2+CaO→CaCO3.
Химические свойства амфотерных оксидов
1. Амфотерные оксиды при взаимодействии с кислотой или кислотным оксидом проявляют свойства, характерные для основных оксидов. Так же, как основные оксиды, они взаимодействуют с кислотами, образуя соль и воду.
Например, при взаимодействии оксида цинка с соляной кислотой образуется хлорид цинка и вода:
ZnO+2HCl→ZnCl2+h3O.
2. Амфотерные оксиды при взаимодействии со щёлочью или с оксидом щелочного или щелочноземельного металла проявляют кислотные свойства. При сплавлении их со щелочами протекает химическая реакция, в результате которой образуются соль и вода.
Например, при сплавлении оксида цинка с гидроксидом калия образуется цинкат калия и вода:
ZnO+2KOH→K2ZnO2+h3O.
Если же с гидроксидом калия сплавить оксид алюминия, кроме воды образуется алюминат калия: Al2O3+2KOH→2KAlO2+h3O.

