Электрический ток в электролитах — материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: носители свободных электрических зарядов в жидкостях.
Электролитом мы называем раствор (или расплав) вещества, через который может идти электрический ток; при этом исходное вещество проводником тока не является.
Например, кристаллы поваренной соли не проводят ток. Дистиллированная вода — тоже диэлектрик. Однако при растворении соли в воде получается среда, через которую ток отлично проходит! Следовательно, солёная вода будет электролитом (Вот почему запрещено купаться во время грозы — в водоёмах всегда растворено некоторое количество солей. При ударе молнии по воде пойдёт электрический ток).
Электролитами оказываются растворы солей, кислот и оснований. Прохождение тока через эти растворы означает, что в них имеются свободные заряды. Откуда же они там берутся, если ни в воде, ни в исходном веществе свободных зарядов не было?
Электролитическая диссоциация
Механизм, обеспечивающий появление свободных зарядов в электролите, называется электролитической диссоциацией. Мы ограничимся рассмотрением электролитической диссоциации в растворах.
Вообще, диссоциация — это распад молекулы на составные части под влиянием тех или иных факторов.В процессе электролитической диссоциации молекулы растворяемого вещества распадаются на положительные и отрицательные ионы в результате действия электрических сил со стороны молекул воды.
Многие свойства воды объясняются тем, что её молекулы являются полярными, то есть в электрическом отношении ведут себя как диполи (напомним, что диполь — это система двух одинаковых по модулю и противоположных по знаку зарядов, расположенных на небольшом расстоянии друг от друга). Полярность молекул обусловлена их геометрическим устройством (рис. 1 (изображение с сайта howyourbrainworks.net)).

Рис. 1. Молекулы воды
Угол, образованный линиями центров атома кислорода и двух атомов водорода, составляет примерно . Кроме того, электронные оболочки смещены в сторону кислорода. В результате центры положительных и отрицательных зарядов оказываются пространственно разделёнными: «минусы» преобладают в кислородной части молекулы воды, а «плюсы» — в водородной части.
Будучи диполями, молекулы воды создают вокруг себя электрическое поле и действуют электрическими силами как друг на друга, так и на молекулы примесей (притягиваясь друг к другу противоположно заряженными частями, молекулы воды создают весьма прочные связи. Вот почему столь велики удельная теплоёмкость и удельная теплота парообразования воды — на разрыв этих связей требуется значительная энергия).
Почему же соли, кислоты и основания распадаются в воде на ионы? Всё дело в том, что молекулы этих веществ также являются полярными. Давайте вернёмся к нашему примеру с растворением поваренной соли .
У атома натрия на внешнем электронном уровне находится один электрон. Он слабо связан с атомом и всегда готов покинуть место своего обитания. У атома хлора на внешнем электронном уровне семь электронов — одного как раз не хватает до полного комплекта. Атом хлора всегда готов захватить себе недостающий электрон.
Поэтому при образовании молекулы внешний электрон атома натрия уходит к атому хлора, и в результате молекула становится полярной — она состоит из положительного иона и отрицательного иона . Эта молекула схематически изображена на рис. 2 (атом хлора крупнее, чем атом натрия).

Рис. 2. Молекула
Иными словами, с электрической точки зрения молекула также оказывается диполем.
Взаимодействие двух сортов диполей — молекул и — как раз и вызывает процесс растворения.
На рис. 3 мы видим, как протекает этот процесс (изображение с сайта intro.chem.okstate.edu). Более крупные зелёные шарики изображают ионы хлора, более мелкие серые — ионы натрия.

Рис. 3. Электролитическая диссоциация: растворение в воде
Левая часть рисунка показывает ситуацию до начала растворения. Крупица соли в виде небольшого кубического кристаллика (Кристаллическая решётка поваренной соли имеет кубическую структуру. В вершинах куба в шахматном порядке, крест-накрест расположены атомы натрия и хлора) только что оказалась в воде.
Сразу же начинается «электрическая атака» со стороны молекул воды. Отрицательно заряженные (кислородные) части молекул обращаются к положительным ионам натрия, а положительные (водородные) части молекулы воды — к отрицательным ионам хлора. Молекулы начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
В конце концов эта связь становится настолько слабой, что удары соседних частиц, совершающих тепловое движение, разрушают молекулу . Она распадается на положительный ион и отрицательный ион .
В правой части рис. 3 мы видим результат такого распада: вырванные из кристаллической решётки ион хлора и ион натрия отправляются «в свободное плавание», окружённые прицепившимися к ним молекулами воды. Обратите внимание, что молекулы воды прилипли к отрицательному иону хлора своими положительными водородными частями, а к положительному иону натрия, наоборот, повернулись их отрицательные кислородные части.
Таким образом, при растворении соли в воде появляются свободные заряды: положительные ионы и отрицательные ионы (рис. 4). Это и является необходимым условием прохождения тока через раствор.

Рис. 4. Раствор в воде
Описанный выше процесс растворения совершенно аналогично протекает и в случае других примесей.Так, щёлочь распадается в водном растворе на положительные ионы калия и отрицательные ионы гидроксильной группы . Молекула серной кислоты при распаде даёт два положительных иона и отрицательно заряженный ион кислотного остатка В растворе медного купороса появляются положительные ионы меди и отрицательно заряженные ионы
Все ли молекулы растворяемого вещества распадутся на ионы? Это зависит от ряда условий.
Степенью диссоциации называется отношение числа распавшихся молекул к общему начальному числу молекул. При полном растворении вещества степень диссоциации равна .
Наряду с диссоциацией имеет место и обратный процесс: рекомбинация. А именно, две частицы противоположного знака могут встретиться и снова образовать нейтральную молекулу (рекомбинировать). С течением времени в растворе устанавливается состояние динамического равновесия: среднее число диссоциаций в единицу времени равно среднему числу рекомбинаций, в результате чего концентрация раствора остаётся неизменной (вспомните аналогичную ситуацию с насыщенным паром: при динамическом равновесии пара и жидкости среднее число вылетевших из жидкости молекул равно среднему числу молекул, вернувшихся обратно из пара в жидкость, так что концентрация насыщенного пара неизменна).
Процессы диссоциации-рекомбинации записываются в виде следующих уравнений, отражающих состояние динамического равновесия:
Изменение внешних условий может нарушить текущее динамическое равновесие и сместить его в ту или иную сторону. Например, при повышении температуры увеличивается скорость диссоциации, и концентрация положительных и отрицательных ионов в растворе возрастает.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
2. Отрицательные ионы — атомные или молекулярные кислотные остатки (например, или ), а также гидроксильная группа .
Второе отличие от металлов заключается в том, что носители свободных зарядов в электролите могут иметь заряд, равный по модулю как элементарному заряду , так и целому числу элементарных зарядов . Здесь — валентность атома или группы атомов; например, при растворении медного купороса имеем .
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом, а отрицательный — катодом (Имеется народная мудрость для запоминания знаков анода и катода: Андрей — парень положительный, Катька — девка отрицательная ;-)).

Рис. 5. Ионная проводимость электролита
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
Электролиз
Положительные и отрицательные ионы, будучи носителями свободных зарядов, в то же время являются частицами вещества. Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Явление переноса вещества при прохождении электрического тока через электролит называется электролизом
В процессе электролиза происходит разложение растворённого вещества на составные части и выделение этих частей на электродах. Так, в растворе медного купороса положительные ионы меди идут на катод, в результате чего катод покрывается медью. Кислотный остаток выделяется на аноде.
Естественным образом возникает вопрос о нахождении массы вещества, выделяющегося на электроде за определённое время . Эта масса, очевидно, совпадает с массой данного вещества, перенесённого током за время через электролит.
Пусть — масса одного иона этого вещества, — заряд иона ( — валентность вещества). Предположим, что за время через электролит прошёл заряд . Число ионов, пришедших на электрод, тогда равно . Масса выделившегося на электроде вещества равна суммарной массе пришедших ионов:
(1)
Величина является характеристикой вещества и называется его электрохимическим эквивалентом. Значения электрохимических эквивалентов различных веществ приводятся в таблицах.
При протекании через электролит постоянного тока за время проходит заряд . Подставляя это в формулу (1), получим первую формулу Фарадея:
(2)
Первый закон Фарадея. Масса выделяющегося на электроде вещества пропорциональна силе тока, протекающего через электролит, и времени прохождения тока.
Теперь преобразуем выражение для электрохимического эквивалента, введя молярную массу вещества:
Подставляя это выражение в (2), получим вторую формулу Фарадея:
(3)
Второй закон Фарадея. Масса выделяющегося на электроде вещества прямо пропорциональна молярной массе этого вещества и обратно пропорциональна его валентности.
В формуле (3) мы видим произведение двух констант и . Оно также является константой и называется постоянной Фарадея:
Кл/моль.
Формула (3) с постоянной Фарадея запишется так:
Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
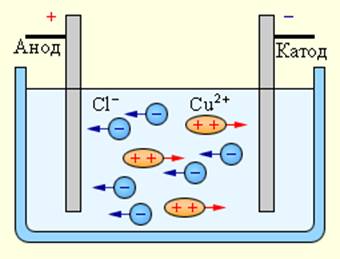
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
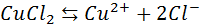
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1.15.1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
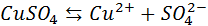
Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион 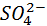 отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом:
отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом:
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
|
Рисунок 1.15.1. Электролиз водного раствора хлорида меди |
Закон электролиза был экспериментально установлен английским физиком Майклом Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
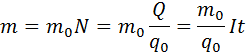
Здесь m0 и q0 – масса и заряд одного иона, 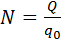 – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
– число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
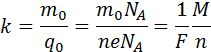
Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA – постоянная Фарадея.
F = eNA = 96485 Кл / моль. |
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
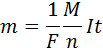
Явление электролиза широко применяется в современном промышленном производстве.
Какими носителями заряда создается электрический ток в растворах и расплавах электролитов?
Это пример самой большой исторической неудачи в физических обозначениях! И, к сожалению, это уже никак не исправить. Давайте посмотрим как же так получилось.
Наверно в любом учебнике по физике глава про электричество начинается с описания двух экспериментов: трения эбонитовой палочки о шерсть, и стеклянной палочки о бумагу или шелк. Это ровно то, как и началось изучение этого явления. Далее происходило следующее:
1) К середине XVIII века становится понятно, что существует два типа электричества: смоляное и стеклянное. Пока никакой речи о зарядах и знаках не идет.
2) Далее Бенжамин Франклин на основе своих многочисленных экспериментов строит первую (неправильную, как стало ясно позднее) теорию электричества, как жидкости. Но что самое важное, он вводит понятие положительного и отрицательного заряда, и определяет направление тока: от плюса к минусу. Все это происходит за век до появления идей об электроне.
3) В конце того же XVIII века появляется первый количественный закон — закон Кулона. В него уже входят заряды, хотя по прежнему и не известно, что именно является их переносчиком. Однако, ясно, что они могут быть положительными и отрицательными. Начинается эпоха активного изучения электричества.
4) Майкл Фарадей, изучая электролиз вводит понятие «ион» для обозначения заряда. А Джордж Стони рассчитывает заряд одного такого иона и предлагает термин «электрон» для минимального неделимого заряда. Электрон в переводе с греческого значит «янтарь», что отсылает нас к представлениям о «смоляном токе».
5) Спустя век после появления закона Кулона, Джозеф Томпсон, изучая катодные лучи, экспериментально обнаруживает частицы меньше чем атомы (Нобелевская премия 1906 года). А другой эксперимент (Жана Перрена) показывает, что катодные лучи состоят из отрицательно заряженных частиц.
Наконец картинка собралась воедино. Направление тока было выбрано очень давно: от плюса к минусу, то есть от анода к катоду. А в последствии оказалось, что существует минимальный (неделимый) дискретный заряд — электрон— который движется от катода к аноду, а значит является отрицательным.
Теперь, надеюсь видно, что такое несоответствие движения электрона и направления тока не более чем досадная случайность. Если бы Бенжамин Франклин в свое время выбрал другое направлен тока, то есть от минуса к плюсу (от катода к аноду), то электрон бы имел положительный заряд, и у нас не было множества проблем с этим несчастным минусом.
В каком-то смысле отрицательный заряд электрона — это самая неестественная вещь в физике.
Электрический ток в жидкостях. Видеоурок. Физика 10 Класс
Жидкости, как и твердые тела, могут быть проводниками, полупроводниками и диэлектриками. В этом уроке речь пойдет о жидкостях-проводниках. Причем не о жидкостях с электронной проводимостью (расплавленные металлы), а о жидкостях-проводниках второго рода (растворы и расплавы солей, кислот, оснований). Тип проводимости таких проводников – ионный.
Определение. Проводники второго рода – такие проводники, в которых при протекании тока происходят химические процессы.
Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: В ванну с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Но если в ванную поместить некоторое количество 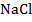

Рис. 1. Схема опыта
Проводимость электролитов
Откуда во втором случае берутся свободные заряды? Как было сказано в одном из предыдущих уроков, некоторые диэлектрики – полярные. Вода имеет как раз-таки полярные молекулы (рис. 2).
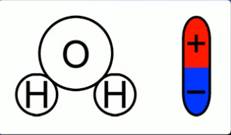
Рис. 2. Полярность молекулы воды
При внесении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные – возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора – отрицательный (рис. 3). Именно эти ионы и будут двигаться между электродами под действием электрического поля.
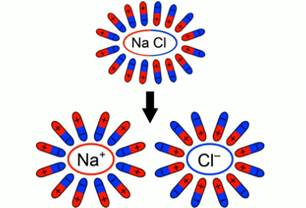
Рис. 3. Схема образования свободных ионов
При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои.
Электролиз
Так как протекание тока в жидкостях связано с переносом вещества, при таком токе имеет место процесс электролиза.
Определение. Электролиз – процесс, связанный с окислительно-восстановительными реакциями, при которых на электродах выделяется вещество.
Вещества, которые в результате подобных расщеплений обеспечивают ионную проводимость, называются электролитами. Такое название предложил английский физик Майкл Фарадей (рис. 4).
Электролиз позволяет получать из растворов вещества в достаточно чистом виде, поэтому его применяют для получения редких материалов, как натрий, кальций… в чистом виде. Этим занимается так называемая электролитическая металлургия.

Рис. 4. Майкл Фарадей (Источник)
Законы Фарадея
В первой работе по электролизу 1833 года Фарадей представил свои два закона электролиза. В первом речь шла о массе вещества, выделяющегося на электродах:
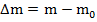
Первый закон Фарадея гласит, что эта масса пропорциональна заряду, прошедшему через электролит:
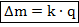
Здесь роль коэффициента пропорциональности играет величина 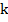 – электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:
– электрохимический эквивалент. Это табличная величина, которая уникальна для каждого электролита и является его главной характеристикой. Размерность электрохимического эквивалента:
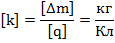
Физический смысл электрохимического эквивалента – масса, выделившаяся на электроде при прохождении через электролит количества электричества в 1 Кл.
Если вспомнить формулы из темы о постоянном токе:

То можно представить первый закон Фарадея в виде:
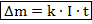
Второй закон Фарадея непосредственно касается измерения электрохимического эквивалента через другие константы для конкретно взятого электролита:

Здесь: 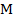 – молярная масса электролита;
– молярная масса электролита; 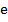 – элементарный заряд;
– элементарный заряд; 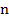 – валентность электролита;
– валентность электролита; 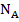 – число Авогадро.
– число Авогадро.
Величина  называется химическим эквивалентом электролита. То есть, для того чтобы знать электрохимический эквивалент, достаточно знать химический эквивалент, остальные составляющие формулы являются мировыми константами.
называется химическим эквивалентом электролита. То есть, для того чтобы знать электрохимический эквивалент, достаточно знать химический эквивалент, остальные составляющие формулы являются мировыми константами.
Исходя из второго закона Фарадея, первый закон можно представить в виде:
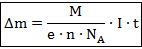
Фарадей предложил терминологию этих ионов по признаку того электрода, к которому они движутся. Положительные ионы называются катионами, потому что они движутся к отрицательно заряженному катоду, отрицательные заряды называются анионами как движущиеся к аноду.
Вышеописанное действие воды по разрыву молекулы на два иона называется электролитической диссоциацией.
Помимо растворов, проводниками второго рода могут быть и расплавы. В этом случае наличие свободных ионов достигается тем, что при высокой температуре начинаются очень активные молекулярные движения и колебания, в результате которых и происходит разрушение молекул на ионы.
Практическое применение электролиза
Первое практическое применение электролиза произошло в 1838 году русским ученым Якоби. С помощью электролиза он получил оттиск фигур для Исаакиевского собора. Такое применение электролиза получило название гальванопластика. Другой сферой применения является гальваностегия – покрытие одного металла другим (хромирование, никелирование, золочение и т.д., рис. 5)


Рис. 5. Примеры гальванопластики и гальваностегии соответственно (Источник), (Источник)
Также электролиз применяется в металлургии для выплавки редких металлов в чистом виде (алюминий, натрий, кальций, магний).
На следующем уроке мы разберем методику решения задач на тему «Электрический ток в жидкостях».
Список литературы
- Тихомирова С.А., Яворский Б.М. Физика (базовый уровень) – М.: Мнемозина, 2012.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. – М.: Илекса, 2005.
- Мякишев Г.Я., Синяков А.З., Слободсков Б.А. Физика. Электродинамика. – М.: 2010.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Fatyf.narod.ru (Источник).
- ХиМиК (Источник).
- Ens.tpu.ru (Источник).
Домашнее задание
- Что такое электролиты?
- Какие существуют два принципиально разных типа жидкостей, в которых может протекать электрический ток?
- Какие могут быть механизмы образования свободных носителей зарядов?
- *Почему масса, выделившаяся на электроде, пропорциональна заряду?
Открытая Физика. Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора: CuCl2←→Cu2++ 2Cl-. При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1.15.1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме CuSO4←→Cu2++ SO42-. Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион SO42- отдает аноду два электрона и превращается в нейтральный радикал SO4 вступает во вторичную реакцию с медным анодом: SO4 + Cu = CuSO4.
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит: m = kQ = kIt.
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду: m=m0N=m0Qq0=m0q0It.
Здесь m0 и q0 – масса и заряд одного иона, N=Qq0 – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде k=m0q0=m0NAneNA=1FMn.
Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA – постоянная Фарадея. F = eNA = 96485 Кл / моль.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид: m=1FMnIt.
Явление электролиза широко применяется в современном промышленном производстве.
Электрический ток в электролитах ℹ️ природа и механизм возникновения электротока в растворах и расплавах, законы, применение электролиза

Передача электротока

Электроток представляет собой упорядоченное движение свободных зарядов. Чтобы выяснить, как электрический ток проводится в растворах, следует понять, какие частицы являются его носителями. В твердых телах ток создается электронами. Носителями электрического тока в электролитах являются ионы. Эти частицы образуются в результате процесса распада (электрической диссоциации) молекул вещества под воздействием воды в растворах либо при нагревании и последующем появлении расплава.
Молекулы веществ распадаются благодаря разрыву ионных либо полярных ковалентных связей. Количество носителей заряда в электролите определяют концентрация и температура. Кроме того, степень распада молекул зависит от природы электролита. В результате они делятся на две группы:
- слабые — не подвержены распаду либо этот процесс протекает крайне медленно;
- сильные — в таких электролитах наблюдается быстрое расщепление молекул на ионы.
К первой группе принадлежит большая часть органических веществ — нерастворимые основания, слабые кислоты и плохо растворимые соли. Сильными электролитами являются щелочи, сильные кислоты и хорошо растворимые соли.
Электрическая диссоциация
Это основополагающий процесс для появления электротока в растворах, поэтому его необходимо рассмотреть более подробно. Все ионы, образующиеся при распаде молекул, можно разделить на 2 типа:

- Анионы. Имеют отрицательный заряд.
- Катионы. Обладают положительным зарядом.
Большинство свойств воды обусловлено полярностью молекул вещества. Говоря иначе, с точки зрения электротехники они являются диполями. Здесь следует вспомнить определение диполи — это система двух частиц, расположенных близко друг к другу. При этом их заряды противоположны по знаку, но одинаковы по модулю. Свойство полярности h3O объясняется геометрическим строением молекул вещества:
- угол между центральными линиями атомов равен примерно 104,5 градуса;
- электронны смещены в направлении кислорода.
Являясь диполями, молекулы воды способны создавать вокруг себя электрополе, которое воздействует не только на них, но и на частицы растворенного вещества.
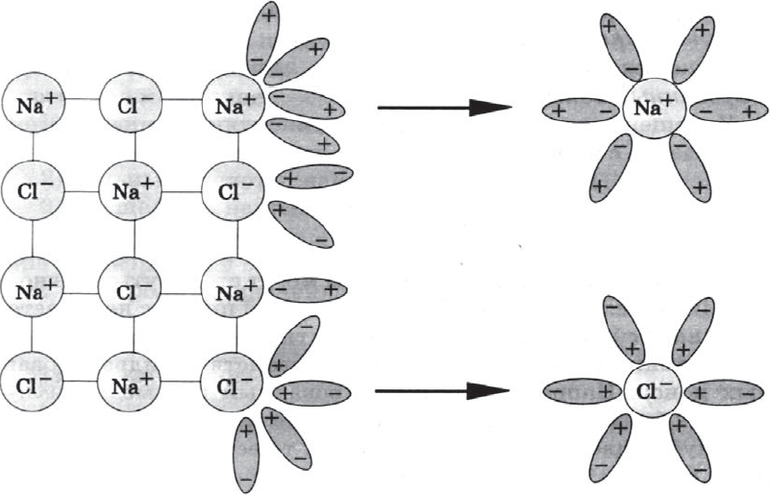
Чтобы установить, какова природа процесса распада молекул на ионы, следует рассмотреть раствор поваренной соли. На внешней орбите атома натрия расположен лишь 1 электрон. Его связь с атомом слаба, поэтому он способен быстро уйти со своего места. У атома хлора на внешней орбите находится уже 7 электронов и до комплекта не хватает одной частицы. Благодаря этому при образовании кристалла NaCl внешний электрон натрия присоединяется к атому хлора. В итоге образуется диполь.
Взаимодействие двух видов диполей и способствуют активизации процесса растворения. Если в раствор электролита поместить 2 электрода — катод (отрицательный) и анод (положительный), то свободные ионы устремятся к ним. При этом направление их движения протекает по конкретным правилам:
- катионы направятся к катоду;
- анионы начинают двигаться в направлении анода.
Как только переносчики электротока достигают электродов, они теряют свой заряд, превращаясь в нейтральные, и оседают на поверхности электродов.
Законы Фарадея
Процесс протекания электротока в электролитах называется электролизом. Среди ученых его наиболее активно изучал известных химик и физик Майкл Фарадей в 1833 году. В результате ему удалось сформулировать 2 закона, названных в его часть:

- Первый закон. Масса вещества (m), образованная на одном из электродов, прямо пропорциональна заряду (Δq), проходящему через раствор. Формула выглядит так: m = K*Δq = K*I*Δt, где I — сила тока в электролите, Δt — время прохождения электротока через раствор, K — химический эквивалент вещества.
- Второй закон. Электрохимический эквивалент вещества (K) прямо пропорционален его химическому эквиваленту. K = C * M / Z, где C — коэффициент пропорциональности (величина постоянная), M — молярная масса вещества, Z — валентность вещества.
Сегодня электролиз нашел широкое применение в технике и промышленности. Например, этот процесс используется в щелочных и кислотных аккумуляторах. Для успешной сдачи экзамена учащимся необходимо кратко пояснить механизм возникновения свободных зарядов в электролитах, сформулировать законы Фарадея, а также рассказать об электрической диссоциации.
Электролиты
Проводниками электрического тока являются не только металлы и полупроводники. Электрический ток проводят растворы многих веществ в воде. Чистая вода не проводит электрический ток, то есть, в ней нет свободных носителей электрических зарядов. Не проводят электрический ток и кристаллы поваренной соли (хлорида натрия). Но если растворить соль в воде, раствор будет хорошим проводником электрического тока. Растворы солей, кислот и оснований, которые способны проводить электрический ток называются электролитами.
 Прохождение электрического тока через электролиты обязательно сопровождается выделением вещества в твёрдом или газообразном состоянии на поверхности электродов. Выделение вещества на электродах показывает, что в электролитах электрические заряды переносят заряженные атомы вещества – ионы.
Прохождение электрического тока через электролиты обязательно сопровождается выделением вещества в твёрдом или газообразном состоянии на поверхности электродов. Выделение вещества на электродах показывает, что в электролитах электрические заряды переносят заряженные атомы вещества – ионы.
По степени диссоциации (способности распадаться на ионы) электролиты можно разделить на сильные и слабые. Степень диссоциации сильных электролитов в растворах равна единице: они полностью диссоциируют, не зависимо от концентрации раствора (щёлочи, соли, некоторые кислоты). Степень диссоциации слабых электролитов в растворах меньше единицы: они диссоциируют не полностью. И с ростом концентрации раствора степень диссоциации уменьшается (вода, ряд кислот и оснований).
Четкой границы между этими двумя группами нет: одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом – слабого.
Закон электролиза. Электрохимический эквивалент вещества
Электролизом называют физико-химический процесс, протекающий на электродах, погруженных в электролит, под действием электрического тока: на электродах выделяются составные части растворённых веществ или других веществ, которые являются результатом вторичных реакций.
В проводящих жидкостях упорядоченное движение ионов происходит в электрическом поле, созданном электродами – проводниками, которые соединены с полюсами источника электрической энергии. При электролизе положительный электрод называется анодом, а отрицательный – катодом. Отрицательные ионы – анионы – движутся к аноду, положительные ионы – катионы – к катоду. На аноде отрицательные ионы отдают лишние электроны (окислительная реакция). На катоде положительные ионы получают недостающие электроны (восстановительная реакция).
М. Фарадей на основе экспериментов с различными электролитами установил, что при электролизе масса m выделившегося вещества пропорциональна прошедшему через электролит заряду ∆q или силе тока I и времени ∆t прохождения тока:
m = k∆q = kI∆t
Данное уравнение называется законом электролиза, коэффициент k, зависящий от выделяющегося вещества, называется электрохимическим эквивалентом вещества.
Проводимость жидких электролитов объясняется тем, что при растворении в воде нейтральные молекулы солей, кислот и оснований распадаются на отрицательные и положительные ионы. В электрическом поле ионы приходят в движение и создают электрический ток.

Существуют не только жидкие, но и твёрдые электролиты. Примером твёрдого электролита может служить стекло. В составе стекла имеются положительные и отрицательные ионы. В твёрдом состоянии стекло не проводит электрический ток, так как ионы не могут двигаться в твёрдом теле. При нагревании стекла ионы получают возможность перемещаться под действием электрического поля и стекло становится проводником.
Явление электролиза применяется на практике для получения многих металлов из раствора солей. С помощью электролиза для защиты от окисления или для украшения производится покрытие различных предметов и деталей машин тонкими слоями таких металлов, как хром, никель, серебро, золото.
Остались вопросы? Не знаете, что такое электролиты?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.