Лёд. Описание, свойства, происхождение и применение минерала
Кубики льда
Лёд — минерал с хим. формулой H2O , представляет собой воду в кристаллическом состоянии.
Химический состав льда: Н – 11,2%, О – 88,8%. Иногда содержит газообразные и твердые механические примеси.
В природе лёд представлен, главным образом, одной из нескольких кристаллических модификаций, устойчивой в интервале температур от 0 до 80°C, имеющей точку плавления 0°С. Известны 10 кристаллических модификаций льда и аморфный лёд. Наиболее изученным является лёд 1-й модификации — единственная модификация, обнаруженная в природе. Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного и др.), а также в виде снега, инея и т.д.
- Структура
- Свойства
- Морфология
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
СТРУКТУРА
Кристаллическая структура льда
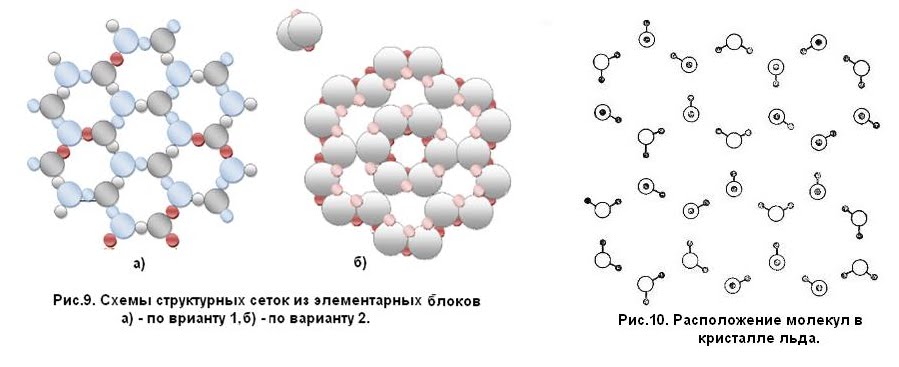
Кристаллическая структура льда похожа на структуру алмаза: каждая молекула Н20 окружена четырьмя ближайшими к ней молекулами, находящимися на одинаковых расстояниях от нее, равных 2,76Α и размещенных в вершинах правильного тетраэдра. В связи с низким координационным числом структура льда является ажурной, что влияет на его плотность (0,917). Лед имеет гексагональную пространственную решётку и образуется путём замерзания воды при 0°С и атмосферном давлении. Решётка всех кристаллических модификаций льда имеет тетраэдрическое строение. Параметры элементарной ячейки льда (при t 0°С): а=0,45446 нм, с=0,73670 нм (с — удвоенное расстояние между смежными основными плоскостями). При понижении температуры они меняются крайне незначительно. Молекулы Н20 в решётке льда связаны между собой водородными связями. Подвижность атомов водорода в решётке льда значительно выше подвижности атомов кислорода, благодаря чему молекулы меняют своих соседей. При наличии значительных колебательных и вращательных движений молекул в решётке льда возникают трансляционные соскоки молекул из узла пространственной их связи с нарушением дальнейшей упорядоченности и образованием дислокаций. Этим объясняется проявление у льда специфических реологических свойств, характеризующих зависимость между необратимыми деформациями (течением) льда и вызвавшими их напряжениями (пластичность, вязкость, предел текучести, ползучесть и др.
В связи с низким координационным числом структура льда является ажурной, что влияет на его плотность (0,917). Лед имеет гексагональную пространственную решётку и образуется путём замерзания воды при 0°С и атмосферном давлении. Решётка всех кристаллических модификаций льда имеет тетраэдрическое строение. Параметры элементарной ячейки льда (при t 0°С): а=0,45446 нм, с=0,73670 нм (с — удвоенное расстояние между смежными основными плоскостями). При понижении температуры они меняются крайне незначительно. Молекулы Н20 в решётке льда связаны между собой водородными связями. Подвижность атомов водорода в решётке льда значительно выше подвижности атомов кислорода, благодаря чему молекулы меняют своих соседей. При наличии значительных колебательных и вращательных движений молекул в решётке льда возникают трансляционные соскоки молекул из узла пространственной их связи с нарушением дальнейшей упорядоченности и образованием дислокаций. Этим объясняется проявление у льда специфических реологических свойств, характеризующих зависимость между необратимыми деформациями (течением) льда и вызвавшими их напряжениями (пластичность, вязкость, предел текучести, ползучесть и др. ). В силу этих обстоятельств ледники текут аналогично сильно вязким жидкостям, и, таким образом, природные льды активно участвуют в круговороте воды на Земле. Кристаллы льда имеют относительно крупные размеры (поперечный размер от долей миллиметра до нескольких десятков сантиметров). Они характеризуются анизотропией коэффициента вязкости, величина которого может меняться на несколько порядков. Кристаллы способны к переориентации под действием нагрузок, что влияет на их метаморфизацию и скорости течения ледников.
). В силу этих обстоятельств ледники текут аналогично сильно вязким жидкостям, и, таким образом, природные льды активно участвуют в круговороте воды на Земле. Кристаллы льда имеют относительно крупные размеры (поперечный размер от долей миллиметра до нескольких десятков сантиметров). Они характеризуются анизотропией коэффициента вязкости, величина которого может меняться на несколько порядков. Кристаллы способны к переориентации под действием нагрузок, что влияет на их метаморфизацию и скорости течения ледников.
СВОЙСТВА
Текстура льда
Лёд бесцветен. В больших скоплениях он приобретает синеватый оттенок. Блеск стеклянный. Прозрачный. Спайности не имеет. Твердость 1,5. Хрупкий. Оптически положительный, показатель преломления очень низкий (n = 1,310, nm = 1,309). В природе известны 14 модификаций льда. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии и обозначающегося как лёд I , образуются в условиях экзотических — при очень низких температурах (порядка -110150 0С) и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров — это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров — это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
МОРФОЛОГИЯ
Пласты арктического льда
В природе лёд – очень распространенный минерал. В земной коре существует несколько разновидностей льда: речной, озёрный, морской, грунтовый, фирновый и глетчерный. Чаще он образует агрегатные скопления мелкокристаллических зерен. Известны также кристаллические образования льда, возникающие сублимационным путем, т. е. непосредственно из парообразного состояния. В этих случаях лед имеет вид скелетных кристаллов (снежинки) и агрегатов скелетного и дендритного роста (пещерный лёд, изморозь, иней и узоры на стекле). Крупные хорошо огранённые кристаллы встречаются, но очень редко. Н. Н. Стуловым описаны кристаллы льда северо-восточной части России, встреченные на глубине 55—60 м. от поверхности, имеющие изометрический и столбчатый облик, причем длина наибольшего кристалла равнялась 60 см., а диаметр его основания — 15 см. Из простых форм на кристаллах льда выявлены только грани гексагональной призмы (1120), гексагональной бипирамиды (1121) и пинакоида (0001).
Н. Н. Стуловым описаны кристаллы льда северо-восточной части России, встреченные на глубине 55—60 м. от поверхности, имеющие изометрический и столбчатый облик, причем длина наибольшего кристалла равнялась 60 см., а диаметр его основания — 15 см. Из простых форм на кристаллах льда выявлены только грани гексагональной призмы (1120), гексагональной бипирамиды (1121) и пинакоида (0001).
Ледяные сталактиты, называемые в просторечии “сосульки”, знакомы каждому. При перепадах температур около 0° в осенне-зимние сезоны они растут повсеместно на поверхности Земли при медленном замерзании (кристаллизации) стекающей и капающей воды. Они обычны также в ледяных пещерах.
Ледяные забереги представляют собой полосы ледяного покрова из льда, кристаллизующегося на границе вода-воздух вдоль краёв водоёмов и окаймляющие края луж, берега рек, озёр, прудов, водохранилищ, и тп. при незамерзающей остальной части водного пространства. При их полном срастании на поверхности водоёма образуется сплошной ледяной покров.
Лёд образует также параллельно-шестоватые агрегаты в виде волокнистых прожилков в пористых грунтах, а на их поверхности – ледяные антолиты.
ПРОИСХОЖДЕНИЕ
Слои льда
Лёд образуется в основном в водных бассейнах при понижении температуры воздуха. На поверхности воды при этом появляется ледяная каша, сложенная из иголочек льда. Снизу на неё нарастают длинные кристаллики льда, у которых оси симметрии шестого порядка размещаются перпендикулярно к поверхности корочки. Соотношения между кристаллами льда при разных условиях образования показаны на рис. Лед распространен всюду, где имеется влага и где температура опускается ниже 0° С. В некоторых районах грунтовый лед оттаивает только на незначительную глубину, ниже которой начинается вечная мерзлота. Это так называемые районы вечной мерзлоты; в областях распространения многолетнемерзлых пород в верхних слоях земной коры встречаются так называемые подземные льды, среди которых различают современный и ископаемый подземный лёд. Не менее 10% всей площади суши Земли покрывают ледники, слагающая их монолитная ледяная порода носит название ледниковый лёд. Ледниковый лёд образуется в основном из скопления снега в результате его уплотнения и преобразования. Ледниковый покров занимает около 75% площади Гренландии и почти всю Антарктиду; самая большая мощность ледников (4330 м.) – установлена близ станции Бэрд (Антарктида). В центральной Гренландии толщина льда достигает 3200 м.
Не менее 10% всей площади суши Земли покрывают ледники, слагающая их монолитная ледяная порода носит название ледниковый лёд. Ледниковый лёд образуется в основном из скопления снега в результате его уплотнения и преобразования. Ледниковый покров занимает около 75% площади Гренландии и почти всю Антарктиду; самая большая мощность ледников (4330 м.) – установлена близ станции Бэрд (Антарктида). В центральной Гренландии толщина льда достигает 3200 м.
Месторождения льда общеизвестны. В местностях с холодной долгой зимой и коротким летом, а также в высокогорных районах образуются ледяные пещеры со сталактитами и сталагмитами, среди которых наиболее интересными являются Кунгурская в Пермской области Приуралья, а также пещера Добшине в Словакии.
В результате замерзания морской воды образуется морской лёд. Характерными свойствами морского льда являются солёность и пористость, которые определяют диапазон его плотности от 0,85 до 0,94 г/см3 . Из-за такой малой плотности льдины возвышаются над поверхностью воды на 1/7-1/10 своей толщины. Морской лёд начинает таять при температуре выше -2,3° С; он более эластичен и труднее поддается раздроблению на части, чем лёд пресноводный.
Морской лёд начинает таять при температуре выше -2,3° С; он более эластичен и труднее поддается раздроблению на части, чем лёд пресноводный.
ПРИМЕНЕНИЕ
Иглу из льда
В конце 1980-х годов лаборатория Аргонн разработала технологию изготовления ледяной гидросмеси (Ice Slurry), способной свободно течь по трубам различного диаметра, не собираясь в ледяные наросты, не слипаясь и не забивая системы охлаждения. Солёная водяная суспензия состояла из множества очень мелких ледяных кристалликов округлой формы. Благодаря этому сохраняется подвижность воды и, одновременно, с точки зрения теплотехники она представляет собой лёд, который в 5—7 раз эффективнее простой холодной воды в системах охлаждения зданий. Кроме того, такие смеси перспективны для медицины. Опыты на животных показали, что микрокристаллы смеси льда прекрасно проходят в довольно мелкие кровеносные сосуды и не повреждают клетки. «Ледяная кровь» удлиняет время, в течение которого можно спасти пострадавшего. Скажем, при остановке сердца это время удлиняется, по осторожным оценкам, с 10—15 до 30—45 минут.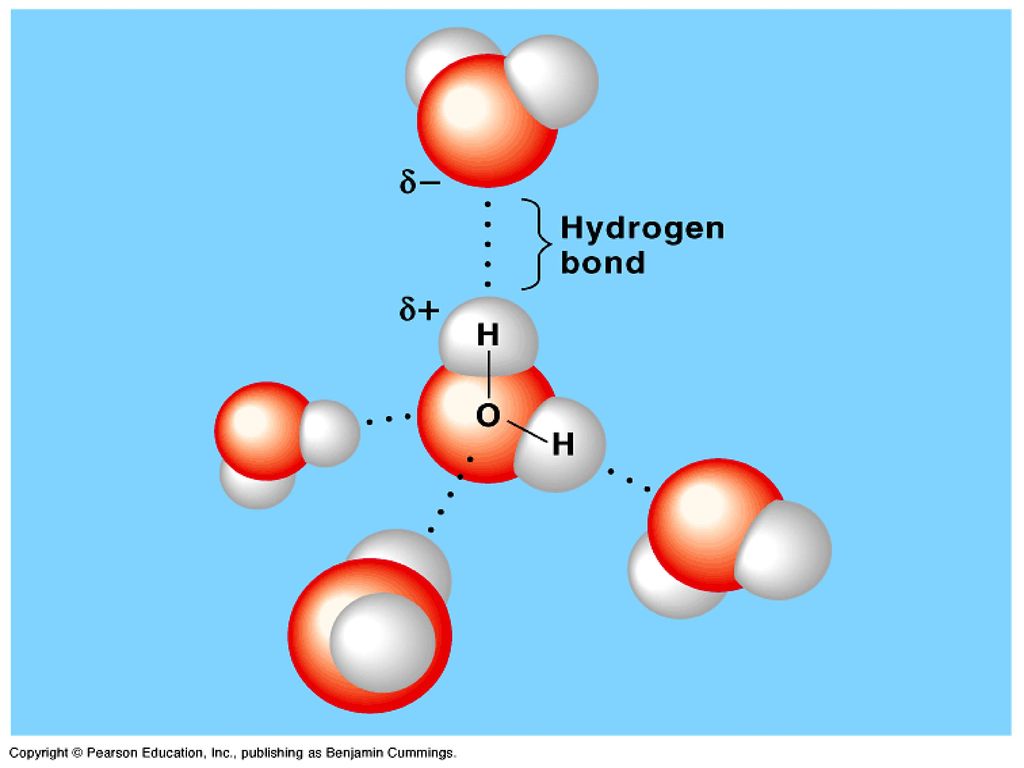
Использование льда в качестве конструкционного материала широко распространено в приполярных регионах для строительства жилищ — иглу. Лёд входит в состав предложенного Д. Пайком материала Пайкерит, из которого предлагалось сделать самый большой в мире авианосец.
Лед (англ. Ice) – H2O
КЛАССИФИКАЦИЯ
ФИЗИЧЕСКИЕ СВОЙСТВА
ОПТИЧЕСКИЕ СВОЙСТВА
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
Интересные статьи:
Молекулярный состав льда, воды и водяного пара, %
Молекула | Лед | Вода | Пар | |||
Температура, °С | ||||||
0 | 0 | 4 | 38 | 98 | 100 | |
Моногидроль [H2O] | 0 | 19 | 20 | 29 | 36 | >99,5 |
Дигидроль [(H2O)2] | 41 | 58 | 59 | 50 | 51 | <0,5 |
Тригидроль [(H2O)3] | 23 | 21 | 21 | 13 | 0 | |
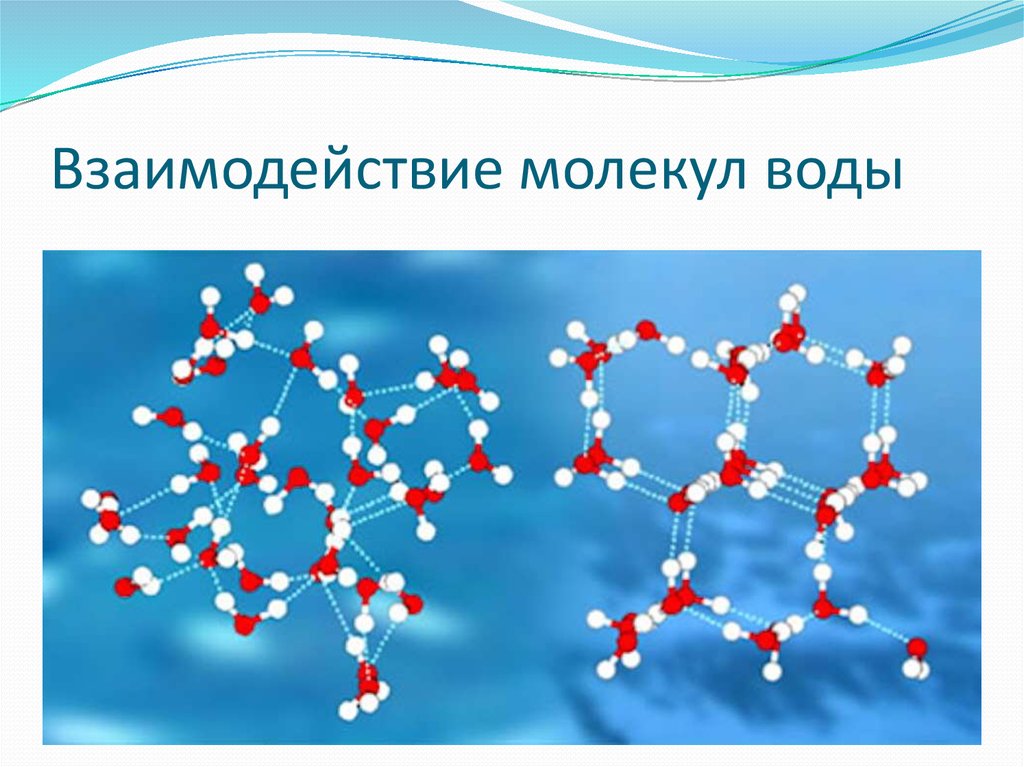
Таким образом, в результате взаимодействия
атомов водорода одной молекулы воды с
отрицательными зарядами кислорода
другой молекулы образуются четыре
водородные связи для каждой молекулы
воды.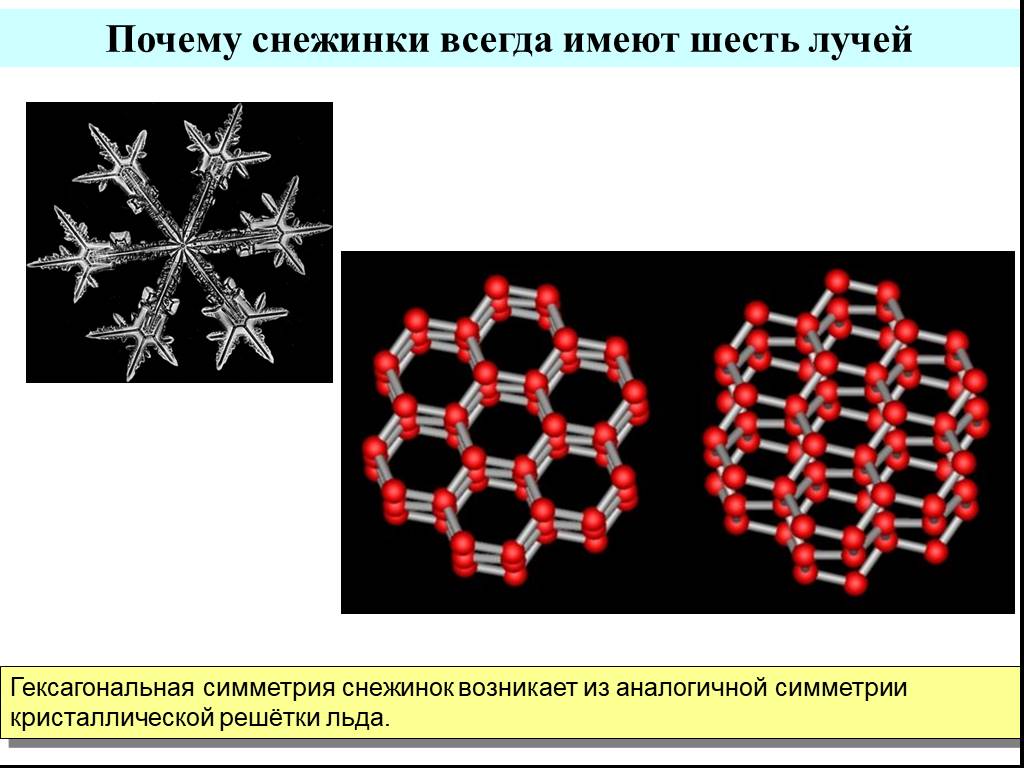 При этом молекулы, как правило,
объединяются в группы — ассоциаты:
каждая молекула оказывается окруженной
четырьмя другими (рис. 1.4). Такая плотная
упаковка молекул характерна для воды
в замерзшем состоянии (лед
При этом молекулы, как правило,
объединяются в группы — ассоциаты:
каждая молекула оказывается окруженной
четырьмя другими (рис. 1.4). Такая плотная
упаковка молекул характерна для воды
в замерзшем состоянии (лед
Рис. 1.4.Схема взаимодействия молекул воды
1 — кислород, 2 — водород. 3 — химическая связь, 4 — водородная связь.
Повышение температуры льда до его плавления и выше приводит к разрыву водородных связей. При жидком состоянии воды достаточно даже обычных тепловых движений молекул, чтобы эти связи разрушить.
Считается, что при повышении температуры
воды до 4°С упорядоченность расположения
молекул по кристаллическому типу с
характерной структурой для льда до
некоторой степени сохраняется. Имеющиеся
в этой структуре отмеченные выше пустоты
заполняются освободившимися молекулами
воды. Вследствие этого плотность жидкости
увеличивается до максимальной при
температуре 3,98°С. Дальнейший рост
температуры приводит к искажению и
разрыву водородных связей, а, следовательно,
и разрушению групп молекул, вплоть до
отдельных молекул, что характерно для
пара.
Имеющиеся
в этой структуре отмеченные выше пустоты
заполняются освободившимися молекулами
воды. Вследствие этого плотность жидкости
увеличивается до максимальной при
температуре 3,98°С. Дальнейший рост
температуры приводит к искажению и
разрыву водородных связей, а, следовательно,
и разрушению групп молекул, вплоть до
отдельных молекул, что характерно для
пара.
2. Физические свойства воды, водяного пара, льда и снега
2.1. Физические свойства воды
1. Плотность воды. В физике плотность неоднородной сплошной среды — предел отношения массы вещества этой среды m к объему V, в котором она заключена:
(2.1)
Плотность однородной сплошной среды определяется массой вещества этой среды в единице объема:
ρ = m/V. (2.2)
Плотность воды, как и всякого другого
вещества, является функцией температуры
и давления, т. е.
е.
ρ = f(t, P) (2.3)
Обычно функция (2.3) определяется экспериментально и выражается в виде таблицы или формулы.
Плотность воды изменяется с температурой сравнительно незначительно. Поэтому в большинстве случаев в практических расчетах ее значение может быть принято постоянным: ρ = 1000 кг/м3. Более точное значение плотности учитывается тогда, когда изучаемый процесс зависит от разности плотностей , например свободная конвекция, первопричина которой – разность плотностей по глубине воды.
Плотность соленой воды превышает плотность дистиллированной воды и зависит от состава растворенных солей и общей солености S. Общая соленость морской воды не превосходит 40‰, тогда как в соленых озерах она достигает 250 — 300‰
Сжимаемостью жидкости (воды)
называется свойство уменьшения объема
под влиянием повышения внешнего давления.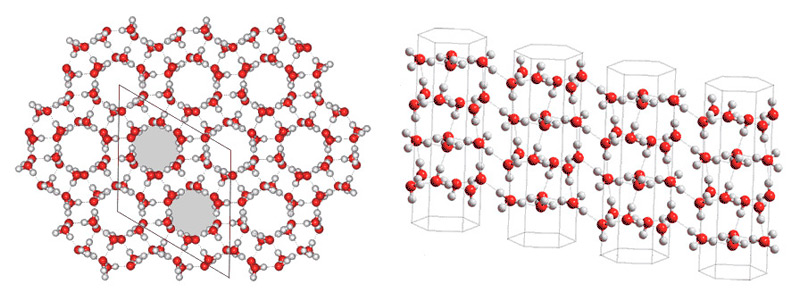 Величиной, обратной сжимаемости, является
объемная упругость.
Величиной, обратной сжимаемости, является
объемная упругость.
С жимаемость характеризуется коэффициентом сжимаемости β, который равен отношению относительного изменения объема жидкости V к изменению давления P и определяется по формуле
Знак минус показывает, что увеличению давления соответствует уменьшение объема.
Величину, обратную коэффициенту сжимаемости, называют модулем объемной упругости (модулем объемного сжатия):
k = 1/β. (2.5)
Приняв значение модуля объемной упругости для воды близким к его среднему значению и равным 2·109 Па, получим коэффициент сжимаемости β ≈ 5·10-10 1/Па.
Определим теперь уменьшение объема 1м3 воды, перенесенного на глубину 1000м (ΔP ≈ 107 Па) с поверхности. Из формулы (2.4) имеем
 6)
6)где V0 — единичный (удельный) объем воды на поверхности.
Подставив соответствующие значения в уравнения (2.6), получим ΔV = 5·10-10· ·1·107 = 5·10-3 м3 (или 0,5%). Эти расчеты показывают, что вода очень мало сжимаема.
Коэффициент β уменьшается при повышении температуры, солености и первоначального давления, под которым находилась вода до сжатия.
В ода, как и всякое вещество в природе, расширяется при повышении температуры и сжимается при ее понижении. Это расширение (сжатие) характеризуется
(2.7)
откуда
V2 = V1 (1 + βt Δt), (2.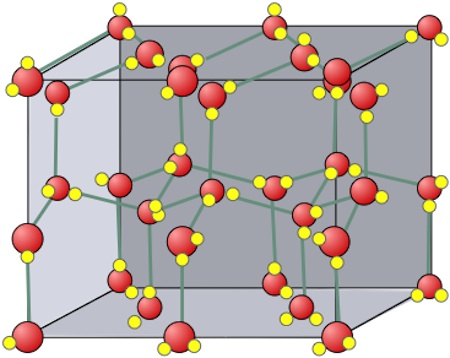 8)
8)
где ΔV = V2 — V1 — изменение объема жидкости; V1 и V2 — объемы жидкости соответственно при температуре
Так как плотность воды максимальна при
температуре t = 4°С (точнее 3,98°С), то при этой температуре
βt = 0, а при
температуре t
4°С βt
0, т.е. при нагревании объем не увеличивается,
а, напротив, уменьшается, что является
одной из физических аномалий воды. Таким
образом, в связи с плотностной аномалией
воды коэффициент ее объемного расширения
имеет отрицательные значения при
температуре от 0 до 4°С и положительные
при температуре выше 4°С, причем с
повышением температуры коэффициент β
По сравнению с другими жидкостями
коэффициент объемного расширения воды
сильно зависит от температуры.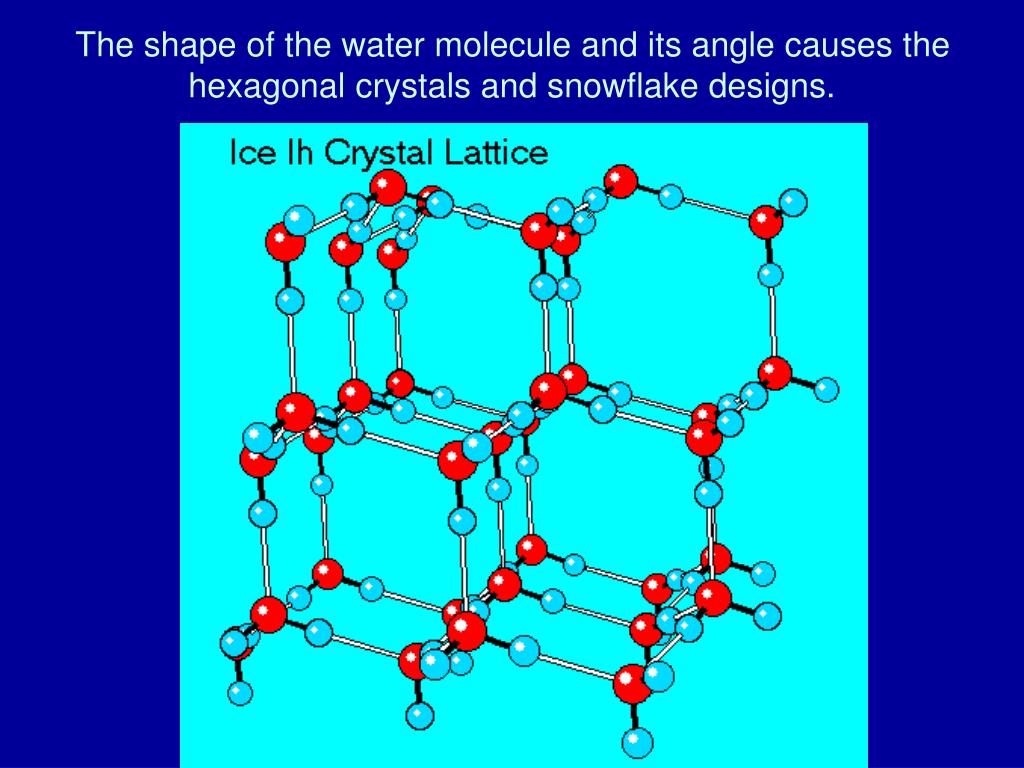
2. Характерные значения температуры воды. Температура наибольшей плотности дистиллированной воды при нормальном давлении 1,01·105 Па обычно принимается равной 4°С, хотя точное ее значение 3,98°С. Особый интерес имеет зависимость этой температуры от давления. Обычно ее принимают линейной и записывают в следующем виде:
(2.9)
г де — температура наибольшей плотности пресной воды при давлении Р; — температура наибольшей плотности пресной воды при давлении 1,01·105 Па; а—коэффициент пропорциональности.
Нужно также иметь в виду, что дистиллированной
воды в природе нет, а вода так называемых
пресных озер и рек всегда немного
минерализована. Например, концентрация
солей воды оз.Байкал составляет
0,0697кг/м3. Поэтому для природных
озер и искусственных водохранилищ
температура наибольшей плотности воды
всегда немного меньше 4°С.
Значение коэффициента a для дистиллированной воды, по лабораторным данным, равно 0,0079°С/Па.
Для температуры наибольшей плотности морской воды в зависимости от солености, может быть рекомендована формула Кнудсена — Крюммеля:
(2.10)
где S — соленость морской воды, ‰.
Температура кристаллизации (замерзания) дистиллированной воды при нормальном атмосферном давлении принимается равной 0°С и служит начальным значением температурной шкалы термометра Цельсия.
Процесс замерзания пресной и соленой воды происходит скачком с выделением теплоты кристаллизации. Обратный процесс, т. е. таяние льда, происходит с поглощением того же количества теплоты, но без скачка, постепенно.
Температура замерзания морской воды при нормальном давлении может быть определена, например, по эмпирической формуле Крюммеля:
tз = — (3·10-3 + 527·10-4S + 4·10-5S 2 + 40·10-6S 3). (2.11)
(2.11)
Формулой (2.11) можно пользоваться также для приближенного определения температуры замерзания минерализованных вод суши при малой их солености.
Переохлаждение воды в природе, т. е. понижение ее температуры замерзания по отношению к 0°С, наблюдается очень часто. В речных условиях переохлаждение поверхностного слоя воды составляет даже порядка — 1°С.
Переохлажденная на поверхности реки вода переносится в глубину турбулентным течением и в благоприятных условиях образует внутриводный (шуга) и донный лед. При этом степень переохлаждения глубинных вод значительно меньше, чем поверхностных. Переохлаждение наблюдается также в озерах и морях, где оно впервые и было обнаружено еще в XVIII в. в виде так называемого якорного льда на опущенных на дно якорях.
В лабораторных условиях в капиллярных трубках дистиллированную воду удалось переохладить до температуры — 33°С.
3. Тепловые характеристики воды. Теплоемкость — это количество
теплоты, поглощаемой телом при нагревании
его на 1 °С. Определяется она по формуле
Тепловые характеристики воды. Теплоемкость — это количество
теплоты, поглощаемой телом при нагревании
его на 1 °С. Определяется она по формуле
C = dQ/dt или C = Q/Δt, (2.12)
где dQ — бесконечно малое количество теплоты, вызвавшее бесконечно малое повышение температуры dt; Δt = t2 — t1 — изменение температуры тела, происходящее в результате подвода к нему количества теплоты Q; t1 и t2 — температура тела до и после подвода к нему теплоты.
Характеристикой теплоемкости вещества принята удельная теплоемкость — отношение теплоемкости тела к его массе:
c = C/m или c = Q/(m Δt). (2.13)
Удельная теплоемкость воды — это
количество теплоты, необходимое для
нагревания 1кг дистиллированной воды
на 1°С в пределах 14,5 — 15,5°С.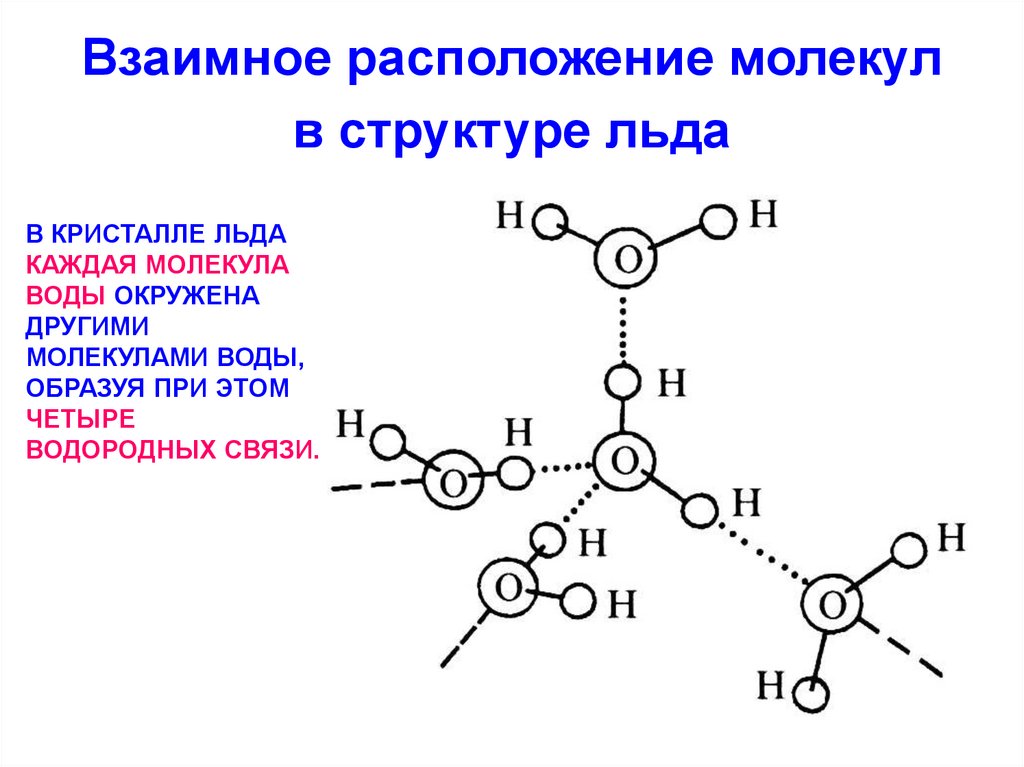 Удельная
теплоемкость воды слабо зависит от
температуры, поэтому в практических
расчетах ее значение может быть принято
постоянным, равным 4,2 кДж/(кг·°С).
Удельная
теплоемкость воды слабо зависит от
температуры, поэтому в практических
расчетах ее значение может быть принято
постоянным, равным 4,2 кДж/(кг·°С).
Удельная теплоемкость воды уменьшается с повышением температуры. Этим свойством, а также довольно большим значением удельной теплоемкости, вода отличается от всех других веществ, кроме ртути.
С увеличением минерализации воды теплоемкость ее уменьшается. Для морской воды при малой солености теплоемкость уменьшается примерно на 0,006кДж/(кг·°С) на 1‰.
Таблица 2.1
Теплофизические свойства воды
t, 0С | с, КДж . КгК | w, Вт . МК | а104, м2 с | 106, м2 с | , кгсек м2 | t106, 0С –1 | Рr |
0 | 4,12 | 0,554 | 0,0013 | 1,790 | 182,3 | -68,28 | 13,7 |
10 | 4,12 | 0,573 | 0,00136 | 1,300 | 133,1 | 88 | 9,56 |
20 | 4,12 | 0,597 | 0,00142 | 1,000 | 102,0 | 206,77 | 7,06 |
30 | 4,12 | 0,616 | 0,00153 | 0,805 | 81,7 | 303,26 | 5,5 |
Переход воды из жидкого состояния в
твердое (кристаллическое — лед)
сопровождается выделением теплоты
кристаллизации Qкр. ,
а обратный ему процесс — таяние льда —
поглощением теплоты плавления Qпл..
Эта способность вещества определяется удельной теплотой кристаллизации
(плавления):
,
а обратный ему процесс — таяние льда —
поглощением теплоты плавления Qпл..
Эта способность вещества определяется удельной теплотой кристаллизации
(плавления):
Lкр. = Qкр./m или Lпл. = Qпл./m, (2.14)
где m — масса затвердевающего (тающего) тела.
Удельная теплота кристаллизации воды Lкр. — это количество теплоты, которое выделяется при кристаллизации 1кг воды при постоянной температуре. Для дистиллированной воды она равна 33,3·104 Дж/кг.
Переход воды из жидкого состояния в
газообразное (пар) сопровождается
поглощением теплоты испарения Qи.
Источником ее обычно служит внутренняя
энергия самой жидкости, поэтому при
испарении она охлаждается. Обратный
испарению процесс — конденсация пара
— сопровождается выделением теплоты Qк, равной теплоте
испарения.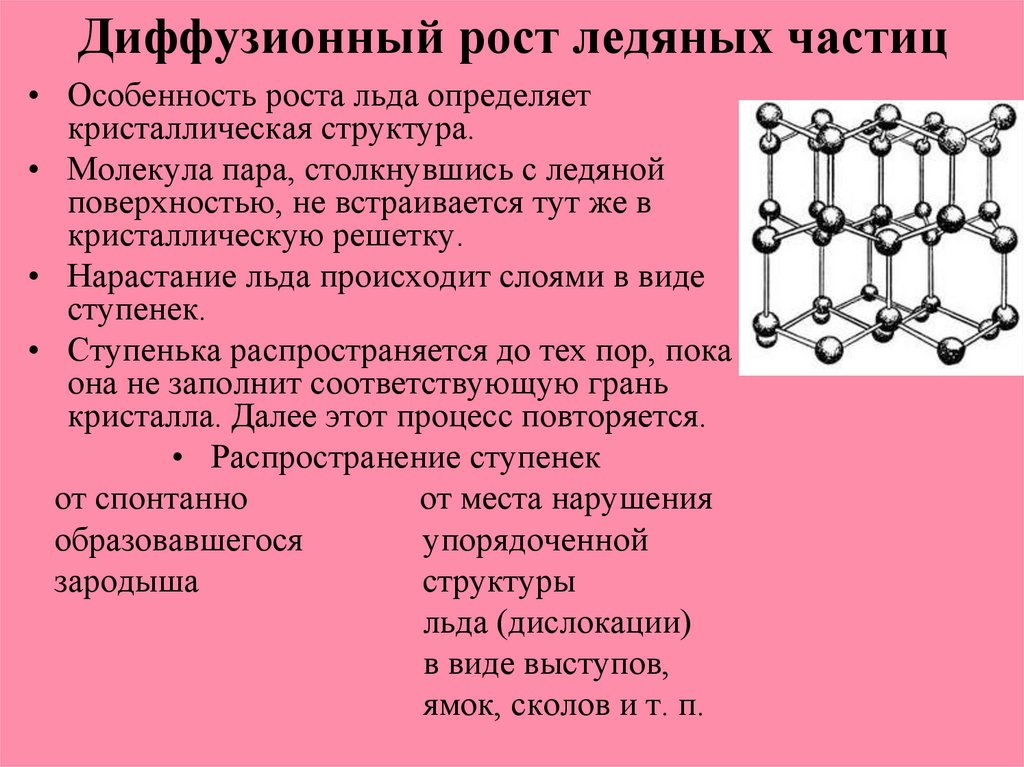 Эта способность вещества
определяется удельной теплотой
испарения (конденсации):
Эта способность вещества
определяется удельной теплотой
испарения (конденсации):
Lи = Qи/m или Lк = Qк/m. (2.15)
Итак, удельная теплота испарения воды — это количество теплоты, необходимое, чтобы перевести 1кг воды в парообразное состояние при постоянной температуре. Удельная теплота испарения воды зависит от температуры, при которой испаряется вода. Эта зависимость определяется следующей эмпирической формулой:
Lи = (25 – 0,024tп) 105, (2.16)
где 25·105 Дж/кг — удельная теплота испарения при температуре поверхности воды, равной 0°С; tп — температура поверхности испаряющейся воды.
Температуропроводность — физический параметр вещества и, в
частности, воды, способствующий передаче
теплоты таким образом, что температура
в каждой точке стремится к соответствующему
в данный момент установившемуся
состоянию.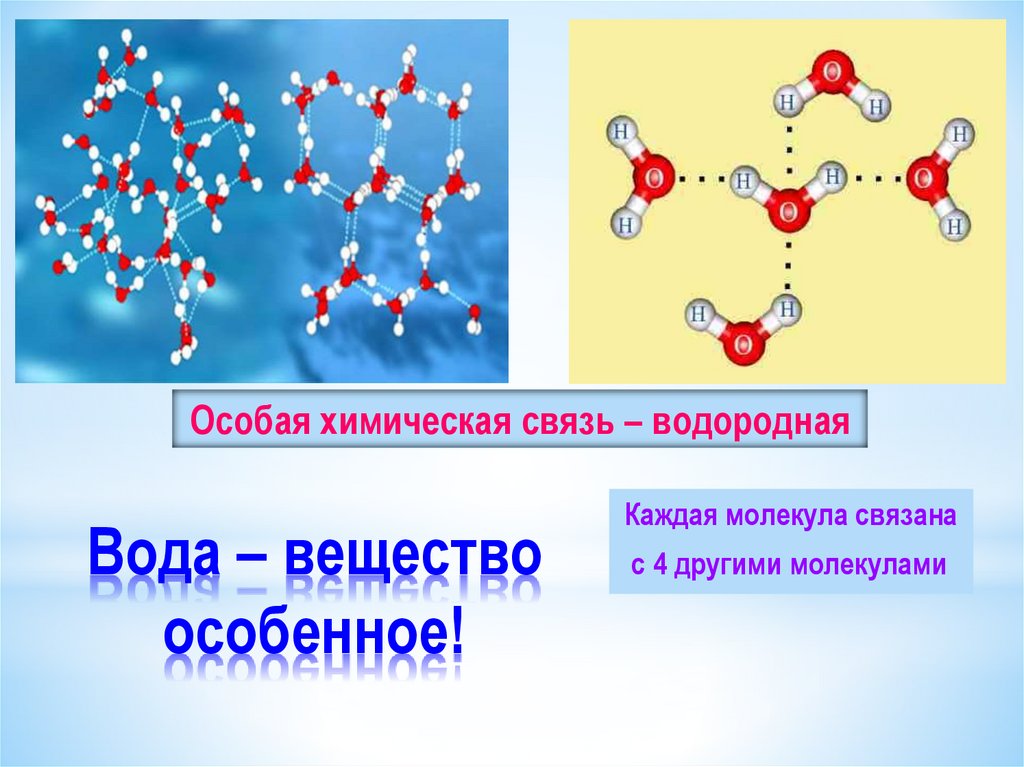 Характеристикой
температуропроводности является коэффициент температуропроводности a = λ/(cρ), где λ — коэффициент
теплопроводности. Коэффициент
температуропроводности воды слабо
зависит от температуры: при температуре,
равной 0 и 10°С, a соответственно равно 0,485·10-3 и
0,504·10-3 м2ч.
Характеристикой
температуропроводности является коэффициент температуропроводности a = λ/(cρ), где λ — коэффициент
теплопроводности. Коэффициент
температуропроводности воды слабо
зависит от температуры: при температуре,
равной 0 и 10°С, a соответственно равно 0,485·10-3 и
0,504·10-3 м2ч.
Отмеченные выше тепловые показатели воды аномальны по сравнению с аналогичными характеристиками других веществ. Это обстоятельство обязано ее структуре, обусловленной водородными связями между молекулами, характеризующимися большей прочностью, чем межмолекулярные взаимодействия. Например, большая теплоемкость воды может быть объяснена только распадом ассоциированных молекул при нагревании. Так как распад этих молекул сопровождается поглощением энергии, то при нагревании воды теплота расходуется не только на повышение температуры, но и на распад ассоциированных молекул.
4. Вязкость. Вязкость есть физическое
свойство вещества (жидкости, газа,
твердого тела) оказывать сопротивление
перемещению одной его части относительно
другой. Вязкость является одним из
главных свойств воды. Различают объемную и тангенциальную вязкость. Под
объемной вязкостью понимают способность
жидкости воспринимать растягивающие
усилия. Этот вид вязкости воды проявляется,
например, при распространении в ней
звуковых и особенно ультразвуковых
волн. Тангенциальная вязкость характеризует
способность жидкости оказывать
сопротивление сдвигающим усилиям.
Вязкость является одним из
главных свойств воды. Различают объемную и тангенциальную вязкость. Под
объемной вязкостью понимают способность
жидкости воспринимать растягивающие
усилия. Этот вид вязкости воды проявляется,
например, при распространении в ней
звуковых и особенно ультразвуковых
волн. Тангенциальная вязкость характеризует
способность жидкости оказывать
сопротивление сдвигающим усилиям.
Исследования показывают, что сопротивление жидкости растягивающим и сдвигающим усилиям проявляется лишь при различных скоростях движения одного слоя жидкости по другому, т. е. при возникновении угловых скоростей сдвига частиц. Со стороны слоя, движущегося быстрее, на слой, движущийся медленнее, действует ускоряющая сила. Наоборот, со стороны слоя, движущегося медленнее, на слой, движущийся быстрее, действует тормозящая, задерживающая сила. Эти силы, носящие название сил внутреннего трения, направлены по касательной к поверхности слоев.
По закону Ньютона, силы внутреннего
трения пропорциональны градиенту
скорости по нормали и площади, на которую
они действуют. Относя силу внутреннего
трения к площади, равной единице, получаем
касательное напряжение в жидкости. Оно
определяется по формуле
Относя силу внутреннего
трения к площади, равной единице, получаем
касательное напряжение в жидкости. Оно
определяется по формуле
τ = μ dυ/dn, (2.17)
где μ — динамический коэффициент вязкости (динамическая вязкость). Он определяет собой силу трения, приходящуюся на единицу поверхности при градиенте скорости, равном единице. Поэтому иногда его называют коэффициентом внутреннего трения. В реальной жидкости, в отличие от идеальной, μ 0.
Динамический коэффициент вязкости воды в сильной степени зависит от температуры, но почти не зависит от давления. Значение этого коэффициента для пресной воды, полученное опытным путем для t°С = 0°С, μ = 1,793·103 Па·с. При расчете динамического коэффициента вязкости применяют эмпирическую формулу Пуазейля:
μ = 0,000183/(1 + 0,0337t + 0,000221t2), (2.18)
где t — температура
воды.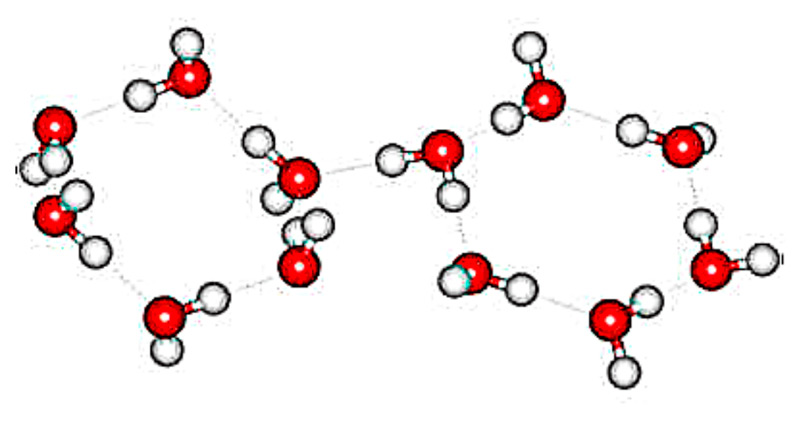
Следует отметить, что во многие расчетные формулы входит отношение динамического коэффициента вязкости μ к плотности жидкости ρ, носящее название кинематического коэффициента вязкости (кинематическая вязкость):
ν = μ/ρ. (2.19)
Значения коэффициентов вязкости существенно уменьшаются с повышением температуры.
Динамический коэффициент вязкости соленой воды незначительно отличается от коэффициента вязкости пресной воды. Например, при t = 20°С и S = 25‰ он равен 1,052·10-3 Па·с, а для пресной воды — 1,003·10-3 Па·с, т. е. больше примерно на 5%.
5. Поверхностное натяжение. Поверхностное натяжение воды возникает
на поверхности соприкасания ее с
воздухом, твердым телом или другой
жидкостью. Оно обусловлено силами
притяжения между молекулами. Внутри
воды силы притяжения между молекулами
взаимно компенсируются, а на молекулы,
находящиеся вблизи поверхности, действует
нескомпенсированная результирующая
сила, направленная внутрь от ее
поверхности.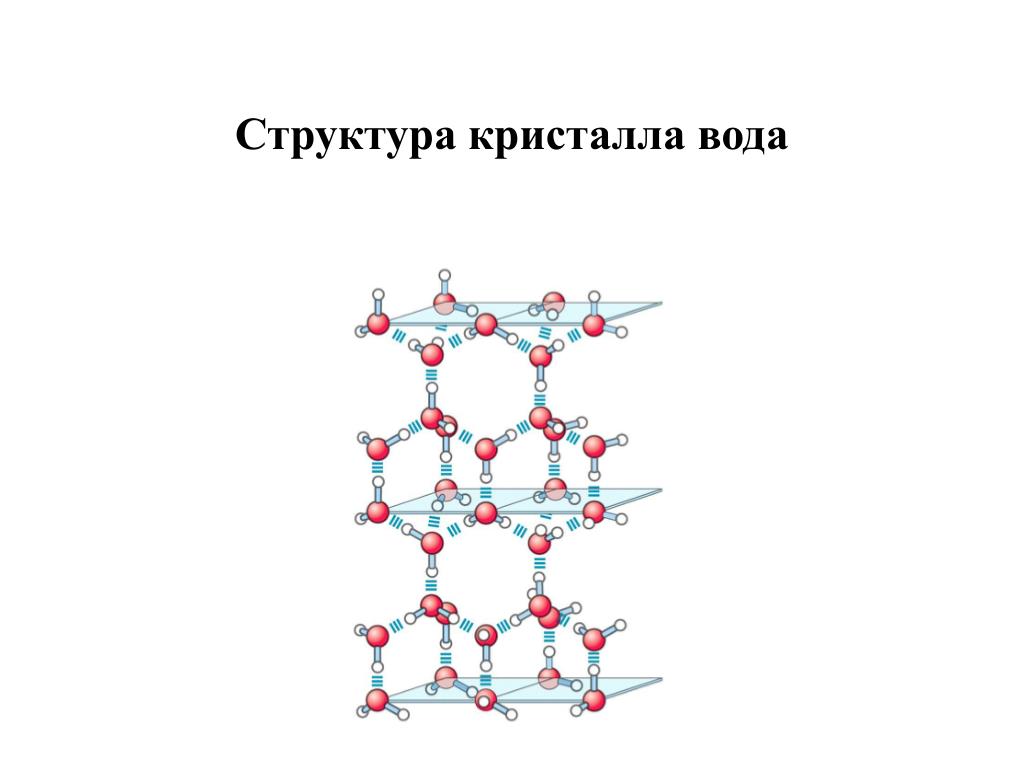 Поверхностное натяжение
стремится уменьшить поверхность жидкости
до минимума. Поэтому капли жидкости
имеют сферическую форму, а в невесомости
— форму шариков (поверхность сферы
является наименьшей из всех геометрических
фигур равного со сферой объема).
Поверхностное натяжение
стремится уменьшить поверхность жидкости
до минимума. Поэтому капли жидкости
имеют сферическую форму, а в невесомости
— форму шариков (поверхность сферы
является наименьшей из всех геометрических
фигур равного со сферой объема).
Сила поверхностного натяжения F действует на свободной поверхности жидкости, направлена по касательной к поверхности и нормально к границе свободной поверхности; она определяется по формуле
F = σl, (2.20)
где l — длина контура поверхности жидкости; σ — коэффициент поверхностного натяжения (поверхностное натяжение), H/м. Коэффициент поверхностного натяжения зависит не только от природы жидкости и ее температуры, но и от природы и состояния той среды, с которой соприкасается данная жидкость. В пределах от — 5 … 35°С он может быть вычислен по формуле (Н/м)
σ = (75,64 — 0,15t) 103. (2.21)
Коэффициент поверхностного натяжения
соленой воды отличается незначительно
от коэффициента поверхностного натяжения
пресной воды.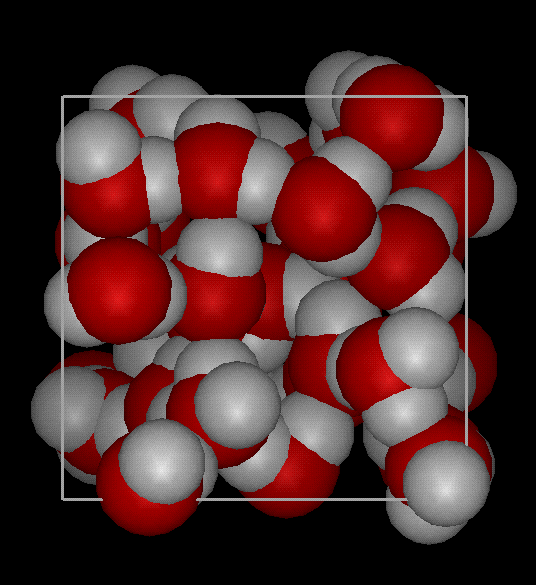
Поверхностное натяжение влияет на условия обмерзания сооружений, испарение, волнение, влажность снежного покрова и другие гидроледотермические явления.
6. Смачивание. При соприкосновении твердого тела с водой смачивание наблюдается в том случае, когда взаимодействие между их молекулами сильнее взаимодействия между молекулами самой воды. В этом случае вода будет стремиться увеличить поверхность соприкосновения и растечется по твердому телу. Когда же взаимодействие между молекулами твердого тела и молекулами соприкасающейся с ним воды более слабое, чем между молекулами самой воды, вода будет стремиться сократить поверхность соприкосновения с твердым телом. По отношению к твердым телам вода обладает свойством полного и частичного смачивания и полного несмачивания.
Явление смачивания имеет большое
значение при изучении передвижения
влаги по капиллярам в почвогрунтах и в
снеге. Поверхность смачивающей жидкости,
находящейся в узких капиллярах, принимает
вогнутую форму (рис.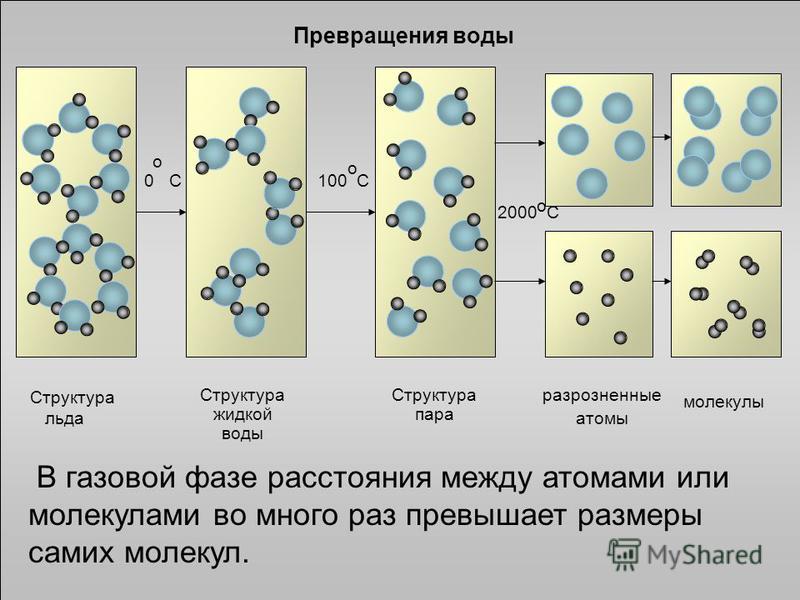 2.1). При вогнутом
мениске давление жидкости (воды) под
ним будет меньше атмосферного на уровне
горизонта подземных вод Pа на величину
2.1). При вогнутом
мениске давление жидкости (воды) под
ним будет меньше атмосферного на уровне
горизонта подземных вод Pа на величину
ΔP = 2σ/r, (2.22)
где r — радиус кривизны мениска (обычно принимается равным радиусу капилляра). Поэтому в капиллярах почвогрунтов вода поднимается на высоту h, при которой вес ее столба уравновешивает отрицательное дополнительное давление, обусловленное кривизной мениска:
ΔP = ρgh, (2.23)
где ρ — плотность воды, g — ускорение свободного падения.
15.2: Структура льда — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53838
Лед — интересный и полезный материал.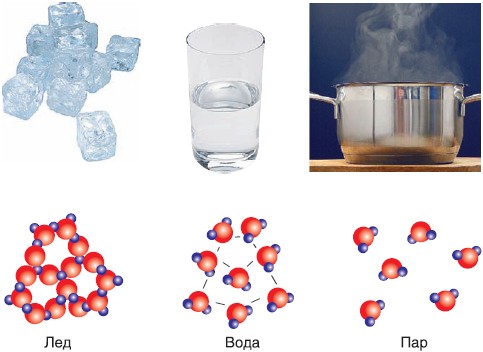 Его можно использовать для охлаждения продуктов и сохранения их свежести. Лед может обеспечить отдых, например, в случае катания на коньках. Когда он замерзает, он может причинить большой ущерб: дороги могут деформироваться, дома могут быть повреждены, водопроводные трубы могут лопнуть. Все это происходит из-за уникального свойства воды: при замерзании вода увеличивается в объеме по мере образования льда.
Его можно использовать для охлаждения продуктов и сохранения их свежести. Лед может обеспечить отдых, например, в случае катания на коньках. Когда он замерзает, он может причинить большой ущерб: дороги могут деформироваться, дома могут быть повреждены, водопроводные трубы могут лопнуть. Все это происходит из-за уникального свойства воды: при замерзании вода увеличивается в объеме по мере образования льда.
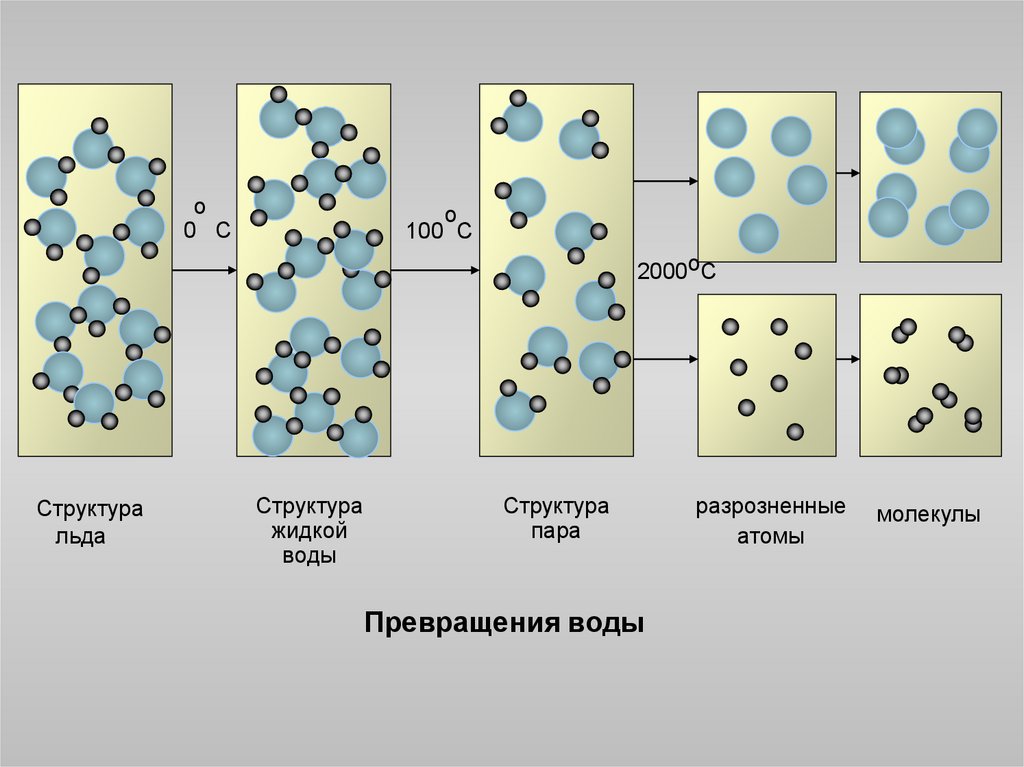
Структура льда
Жидкая вода — это жидкость. Водородные связи в жидкой воде постоянно рвутся и восстанавливаются, когда молекулы воды сталкиваются друг с другом. По мере охлаждения воды ее молекулярное движение замедляется, и молекулы постепенно приближаются друг к другу. Плотность любой жидкости увеличивается с понижением ее температуры. Для большинства жидкостей это продолжается по мере замерзания жидкости; твердое состояние более плотное, чем жидкое. Однако вода ведет себя иначе. На самом деле он достигает максимальной плотности примерно при \(4^\text{o} \text{C}\).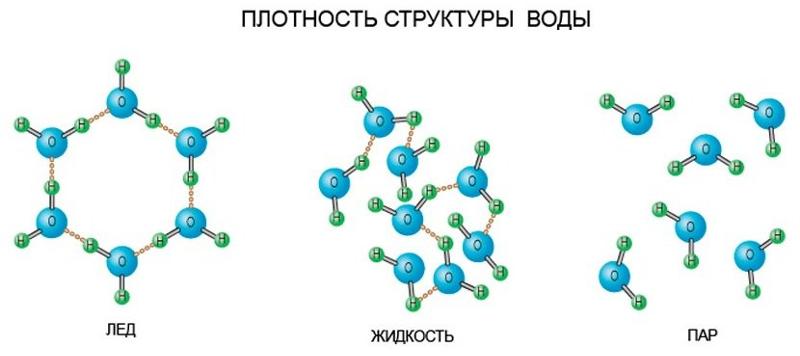 3 \right)\)»> 1.0000
3 \right)\)»> 1.0000
Лед менее плотный, чем жидкая вода, поэтому он плавает. Пруды или озера начинают замерзать у поверхности, ближе к холодному воздуху. Образуется слой льда, но он не тонет, как если бы вода не имела этой уникальной структуры, определяемой ее формой, полярностью и водородными связями. Если бы лед тонул, замерзая, целые озера замерзали бы. Поскольку лед не тонет, жидкая вода остается подо льдом всю зиму.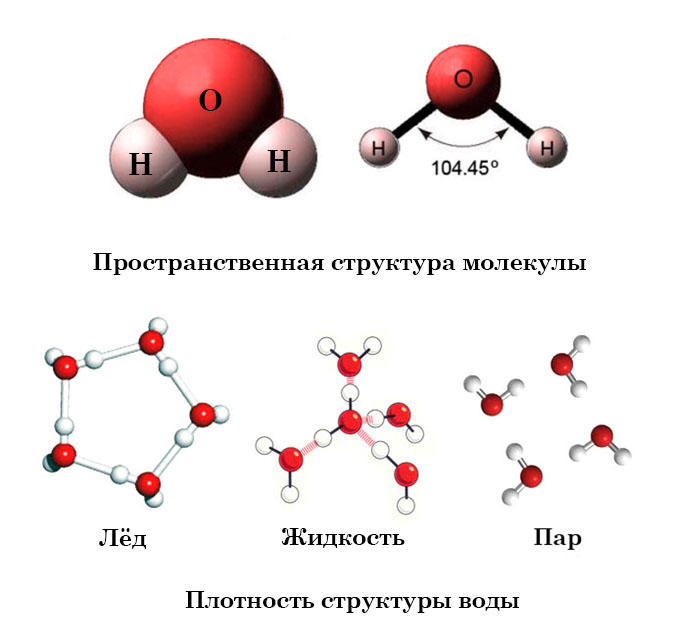 Это важно, так как рыбы и другие организмы способны пережить зиму. Лед — одно из немногих твердых тел, которое менее плотное, чем его жидкая форма.
Это важно, так как рыбы и другие организмы способны пережить зиму. Лед — одно из немногих твердых тел, которое менее плотное, чем его жидкая форма.
Резюме
- Плотность любой жидкости увеличивается при понижении ее температуры. В виде исключения лед имеет меньшую плотность, чем жидкая вода.
- В межмолекулярной структуре льда есть пространства, которых нет в жидкой воде.
Эта страница под названием 15.2: Структура льда распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
|



 )
) 
 )
)