Официальный сайт школы №1 города Коммунара.Школьные работы.Аномальные свойства воды при замерзани.
Цель: Изучение причин изменения плотности воды при снижении температуры.
Вода — одно из самых уникальных и загадочных веществ на Земле. Известно, что за незатейливой химической формулой Н2О скрывается вещество, обладающее уникальной структурой и не менее уникальными свойствами. Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Наличием водородных связей обусловлены уникальные свойства воды. Трехатомная молекула Н2О образует четыре водородные связи. В их образовании принимают участие оба атома водорода, а атом кислорода, имеющий две неподеленные электронные пары, образует две водородные связи с атомами водорода соседних молекул воды.
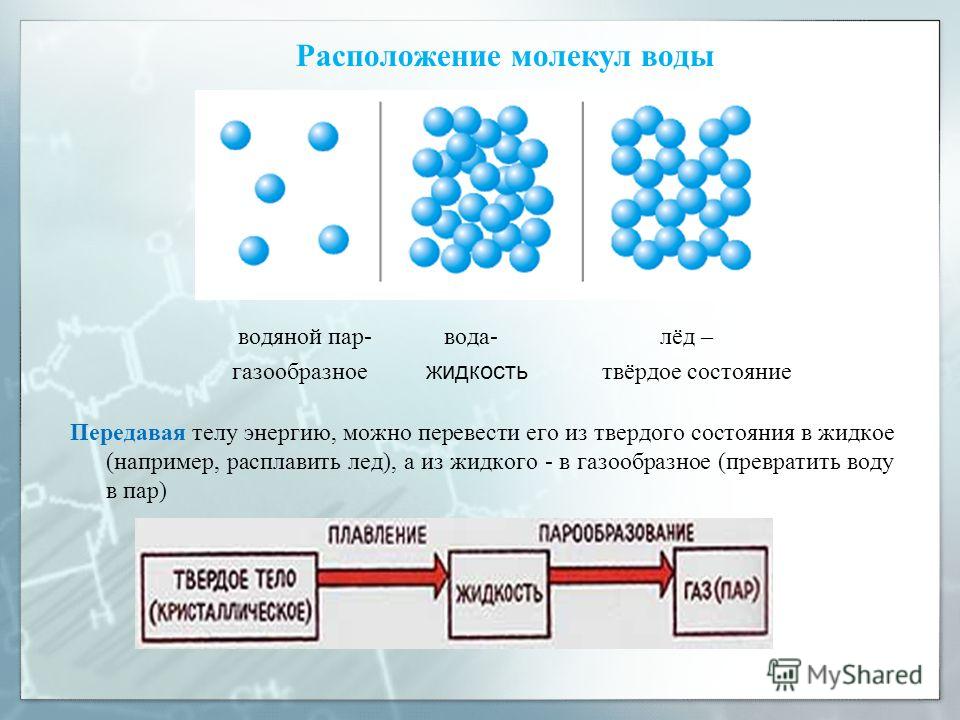
Хаотичное сообщество газообразных молекул воды при конденсации, формирует жидкое вещество удивительной сложности.
В кристалле льда между молекулами остаются пустоты. Объем этих пустот больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивает свою плотность.
Объект исследования: Дистиллированая вода.
Направления исследования:
1. Наблюдения за изменением плотности воды при снижении температуры через каждые 5 мин.
2. Расчет объема пустоты между молекулами воды в кристаллической решетке льда.
3. Вычисление среднего количества молекул жидкой воды в кластере при различных температурах.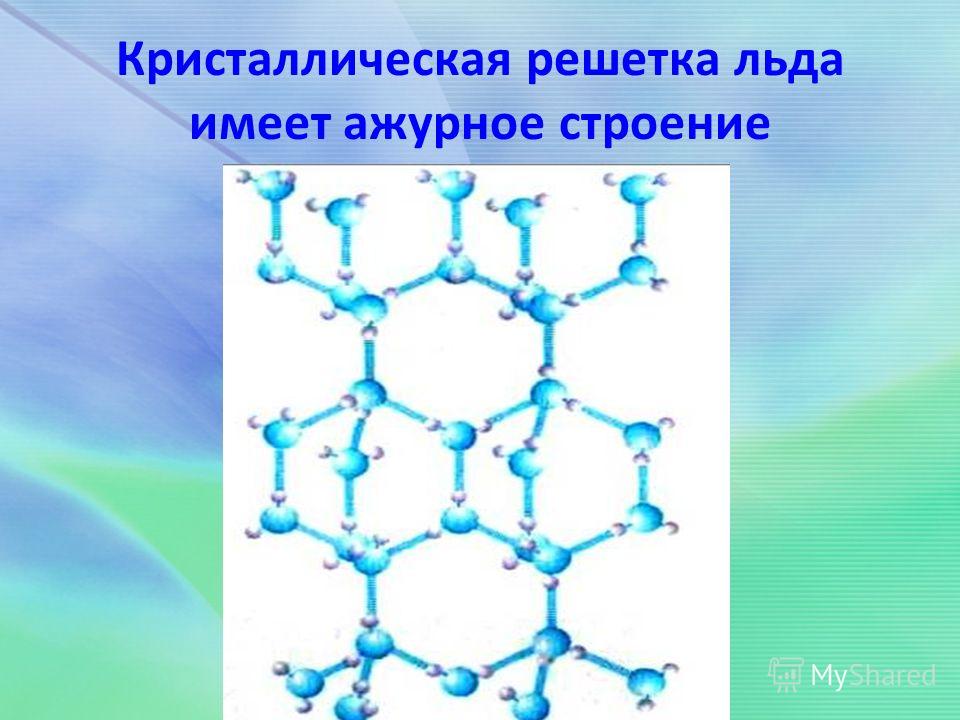
Результаты исследования:
1. От 100оС до 40оС плотность воды увеличивается. Скорость снижения плотности уменьшается с понижением температуры. От 40оС до 4 oС плотность меняется незначительно, нестабильно, скачкообразно. Наибольшее значение (1,00 г/мл) она имеет при температуре 4 oС. Замерзание воды сопровождается скачкообразным уменьшением плотности.
3.При температуре 4оС общая формула кластера Н14О7 , а при комнатной температуре среднее между Н8О4.
Выводы: Образование кластеров и пустот в них объясняет расширение воды при замерзании. Отсутствие в пустотах материальных частиц не отрицает сохранение в них полей и волн, т.е., кластер может быть хранителем информации.
Заключение: Результаты исследования могут быть полезны в расшифровке структуры воды. Особенности образования кластеров и кристаллической решетки льда, вытеснять все растворенные в ней вещества могут быть применимы в разработке установок по очистке воды путем неполного замораживания.
Особенности образования кластеров и кристаллической решетки льда, вытеснять все растворенные в ней вещества могут быть применимы в разработке установок по очистке воды путем неполного замораживания.
Автор: Захаренкова Наталья
Руководитель: Петролай Валентина Сафроновна
Более подробно узнать об аномальных свойствах воды при замерзании можно изучив исследовательскую работу Натальи и её презентацию. Тезисы её доклада размещены в сборнике «XXXIII Всероссийская научно-практическая конференция школьников по химии» — СПбГУ: 2009.
Минимальное число молекул Ученые рассчитали самый маленький кристалл льда: Наука и техника: Lenta.ru
Все мы много раз слышали об уникальных свойствах воды. Если бы «жидкость без цвета и запаха» не обладала особыми качествами, жизнь на Земле в ее нынешнем виде была бы невозможна. То же самое можно сказать о твердой форме воды — льде. Теперь ученые выяснили еще один его секрет: в только что опубликованном исследовании специалисты, наконец, определили, сколько именно молекул нужно для того, чтобы получить кристаллик льда.
Уникальная связь
Перечислять удивительные свойства воды можно очень долго. Она обладает самой высокой удельной теплоемкостью среди жидкостей и твердых тел, плотность ее кристаллической формы — то есть льда — меньше, чем плотность воды в жидком состоянии, способность к адгезии («прилипанию»), высокое поверхностное натяжение — все это и многое другое позволяет существовать на Земле жизни как таковой.
Своей уникальностью вода обязана водородным связям, точнее их количеству. С их помощью одна молекула H2O может «связаться» с четырьмя другими молекулами. Такие «контакты» ощутимо менее прочны, чем ковалентные связи (разновидность «обычных» связей, которые удерживают вместе, например, атомы водорода и кислорода в молекуле воды), и разорвать каждую водородную связь по отдельности достаточно просто. Но в воде таких взаимодействий очень много, и вместе они заметно ограничивают свободу молекул H2O, не давая им слишком уж легко отрываться от «товарищей», скажем, при нагревании.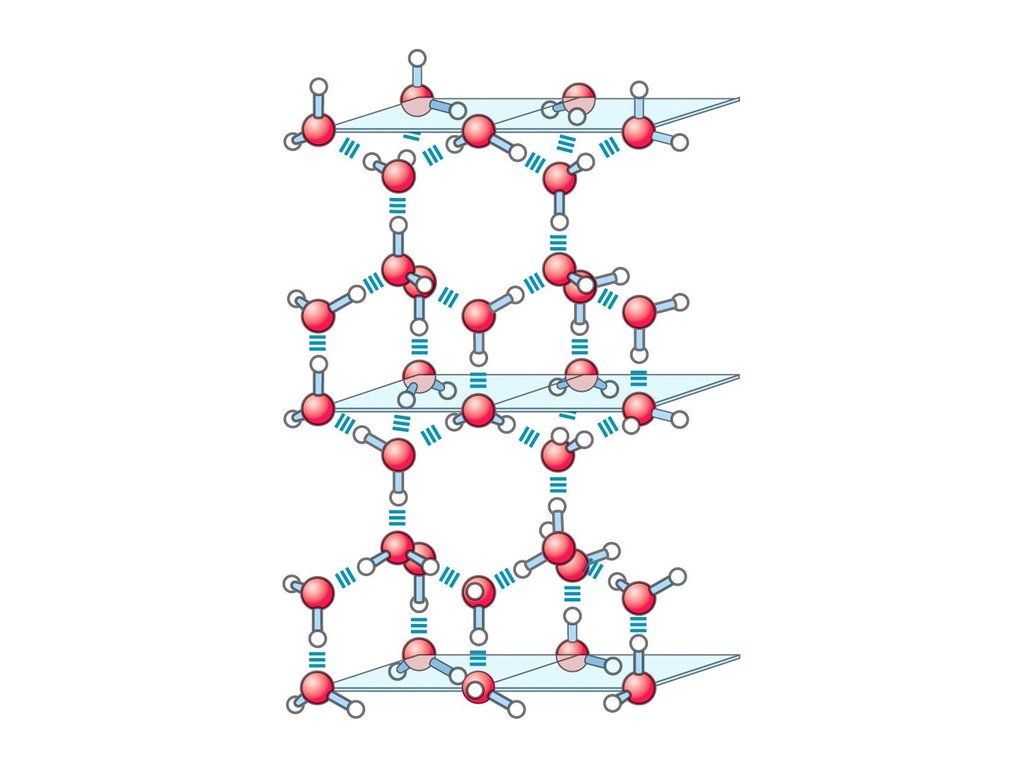 Каждая из водородных связей сама по себе существует ничтожную долю секунды — они постоянно разрушаются и возникают вновь. Но при этом в любой момент большая часть молекул воды оказывается вовлечена во взаимодействие с «соседями».
Каждая из водородных связей сама по себе существует ничтожную долю секунды — они постоянно разрушаются и возникают вновь. Но при этом в любой момент большая часть молекул воды оказывается вовлечена во взаимодействие с «соседями».
Айсберг в море Лазарева у берегов Антарктиды. Фото РИА Новости, Алексей Никольский
Lenta.ru
Водородные связи несут ответственность и за необычное поведение воды при кристаллизации, то есть при образовании льда. Плавающие по поверхности океана айсберги, корка льда в пресных водоемах — все эти явления нас не удивляют, потому что мы привыкли к ним с рождения. Но если бы основной на Земле была не вода, а какая-нибудь другая жидкость, то ни катков, ни подледной рыбалки не существовало бы вовсе. Плотность практически всех веществ при переходе из жидкого состояния в твердое увеличивается, потому что молекулы теснее «прижимаются» друг к другу, а значит, на единицу объема их становится больше.
Иначе обстоят дела с водой. До температуры в 4 градуса Цельсия плотность H2O дисциплинированно растет, но при переходе этой границы скачкообразно падает на 8 процентов. Объем замерзшей воды, соответственно, увеличивается. С этой особенностью хорошо знакомы жители домов с давно не ремонтировавшимися трубами или те, кто забывал в морозилке слабоалкогольные напитки.
Объем замерзшей воды, соответственно, увеличивается. С этой особенностью хорошо знакомы жители домов с давно не ремонтировавшимися трубами или те, кто забывал в морозилке слабоалкогольные напитки.
Причина аномального изменения плотности воды при переходе из жидкого состояния в твердое кроется все в тех же водородных связях. Кристаллическая решетка льда напоминает пчелиные соты, в шести углах которых располагаются молекулы воды. Они соединены между собой водородными связями, а их длина превышает длину «обычной» ковалентной связи. В итоге между молекулами затвердевшей H2O оказывается больше пустого пространства, чем было между ними в жидком состоянии, когда частицы свободно перемещались и могли подходить друг к другу совсем близко. Наглядное сопоставление укладок молекул жидкой и твердой фаз воды приведено, например, здесь.
Исключительные свойства и особая важность воды для обитателей Земли обеспечили ей постоянное внимание ученых. Не будет большим преувеличением сказать, что соединение двух атомов водорода и одного атома кислорода — наиболее тщательно исследованное вещество на планете.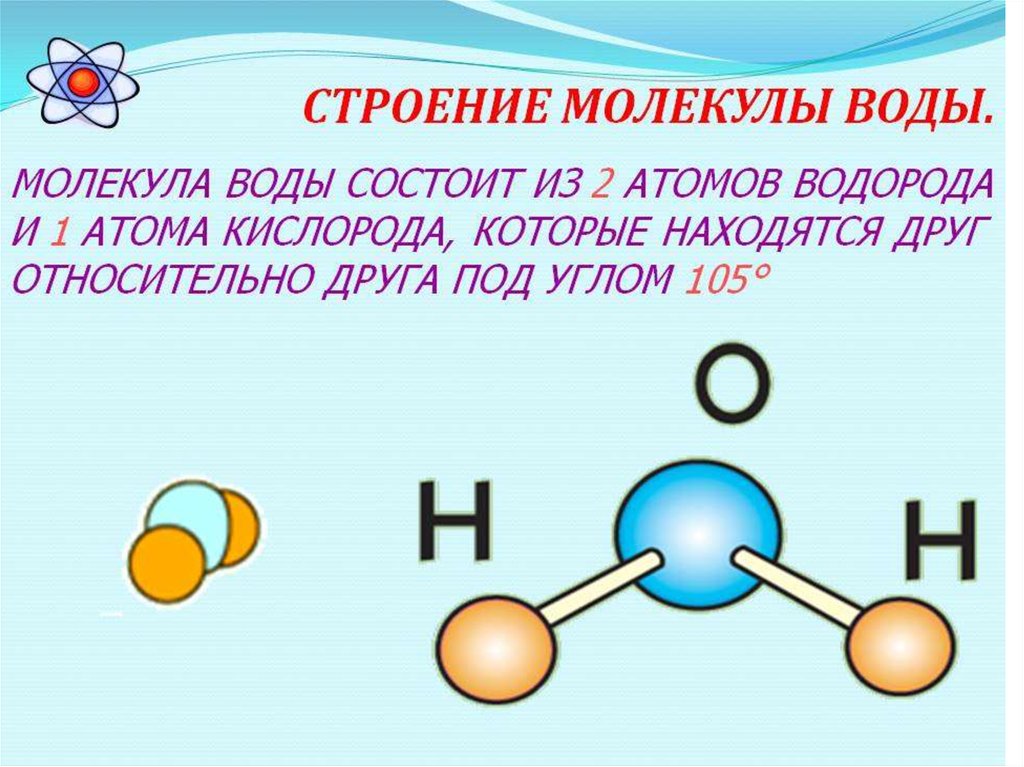 И тем не менее специалисты, выбравшие H2O предметом своего интереса, без работы не останутся. Например, они всегда могут заняться изучением того, как же, собственно, жидкая вода превращается в твердый лед. Процесс кристаллизации, приводящий к столь драматическим изменениям всех свойств, происходит очень быстро, и многие его детали до сих пор остаются неизвестными. После выхода последнего номера журнала Science одной загадкой стало меньше: теперь ученые точно знают, сколько молекул воды нужно положить в стакан, чтобы на холоде его содержимое превратилось в привычный лед.
И тем не менее специалисты, выбравшие H2O предметом своего интереса, без работы не останутся. Например, они всегда могут заняться изучением того, как же, собственно, жидкая вода превращается в твердый лед. Процесс кристаллизации, приводящий к столь драматическим изменениям всех свойств, происходит очень быстро, и многие его детали до сих пор остаются неизвестными. После выхода последнего номера журнала Science одной загадкой стало меньше: теперь ученые точно знают, сколько молекул воды нужно положить в стакан, чтобы на холоде его содержимое превратилось в привычный лед.
Разный лед
Слово «привычный» в предыдущем предложении употреблено не из стилистических соображений. Оно подчеркивает, что речь идет о кристаллическом льде — том самом, с похожей на соты гексагональной решеткой. Хотя привычным такой лед является разве что на Земле — в бесконечном межзвездном пространстве преобладает совсем другая форма льда, которую на третьей планете от Солнца получают в основном в лабораториях.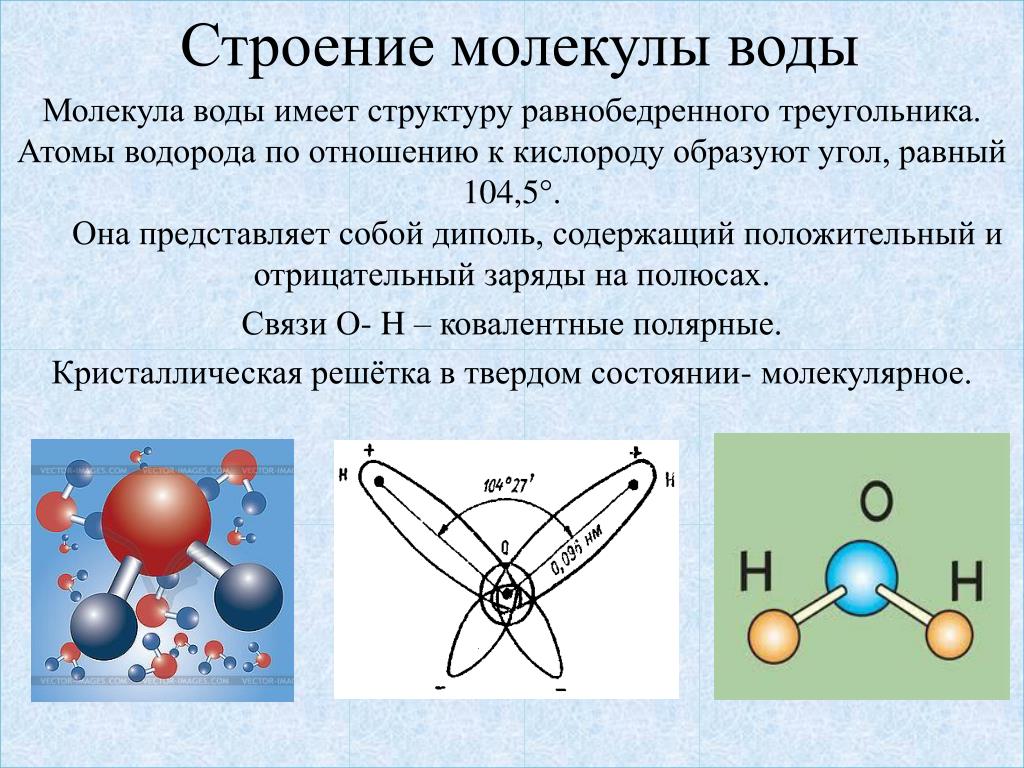 Этот лед называется аморфным, и никакой регулярной структуры у него нет.
Этот лед называется аморфным, и никакой регулярной структуры у него нет.
Аморфный лед можно получить, если очень быстро (в течение миллисекунд или даже быстрее) и очень сильно (ниже 120 кельвинов — минус 153,15 градуса Цельсия) охладить жидкую воду. В таких экстремальных условиях молекулы H2O не успевают сорганизоваться в упорядоченную структуру, и вода превращается в вязкую жидкость, плотность которой чуть больше плотности льда. Если температура остается низкой, то вода может пребывать в форме аморфного льда очень долго, но при потеплении она переходит в более привычное состояние кристаллического льда.
Аморфным и гексагональным кристаллическим льдом разновидности твердой формы воды не ограничиваются — всего на сегодня ученым известно более 15 ее видов. Самый распространенный на Земле лед носит название лед I h, но в верхних слоях атмосферы можно отыскать и лед I с, кристаллическая решетка которого напоминает решетку алмаза. Другие модификации льда могут быть тригональными, моноклинными, кубическими, ромбическими и псевдоромбическими.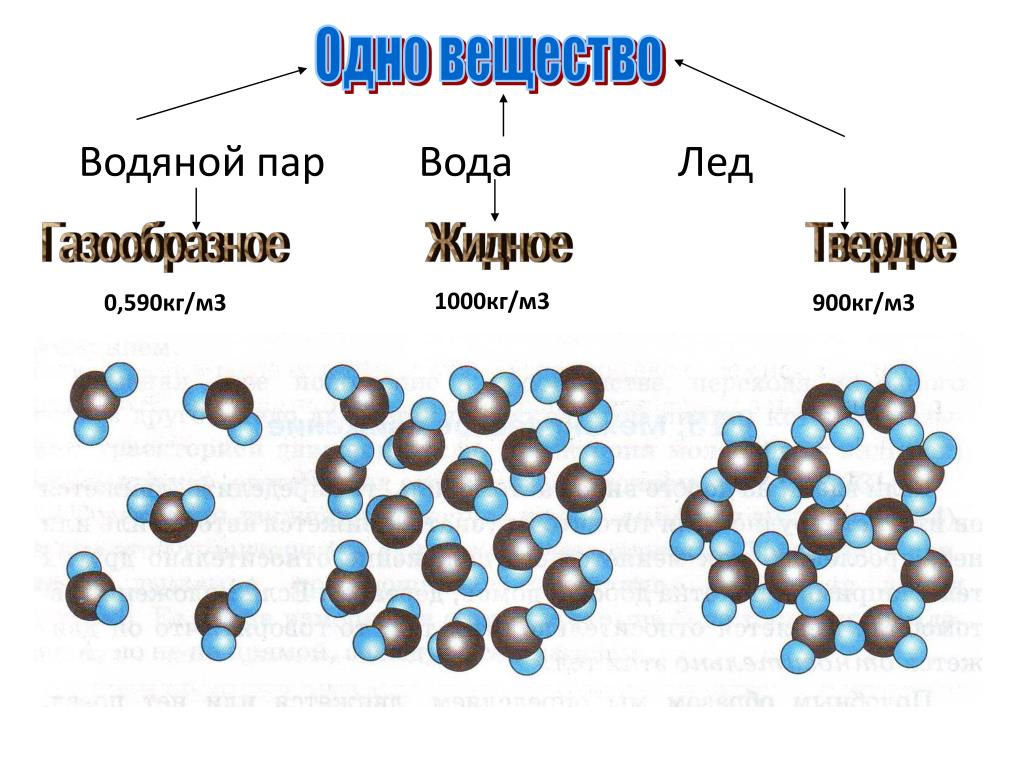
Но в некоторых случаях фазового перехода между этими двумя состояниями не произойдет: если молекул воды будет слишком мало, то вместо того, чтобы формировать строго организованную решетку, они «предпочтут» остаться в менее упорядоченном виде. «В любом молекулярном кластере взаимодействия на поверхности конкурируют со взаимодействиями внутри кластера, — объяснил «Ленте.ру» один из авторов новой работы, сотрудник института физической химии при Гёттингенском университете Томас Цойх (Thomas Zeuch). — Для кластеров меньшего размера энергетически более выгодным оказывается максимально оптимизировать структуру поверхности кластера, нежели формировать кристаллическую «сердцевину». Поэтому такие кластеры остаются аморфными».
Законы геометрии диктуют: по мере роста размеров кластера доля молекул, оказывающихся на поверхности, уменьшается. В какой-то момент энергетическая выгода от формирования кристаллической решетки перевешивает достоинства оптимального расположения молекул на поверхности кластера, и происходит фазовый переход. Но когда именно наступает этот самый момент, ученые не знали.
Но когда именно наступает этот самый момент, ученые не знали.
Группе исследователей, работавших под руководством профессора Удо Бака (Udo Buck) из института динамики и самоорганизации в Гёттингене, удалось дать ответ. Специалисты показали, что минимальное число молекул, которые могут образовать кристаллик льда, составляет 275 плюс-минус 25 штук.
В своем исследовании ученые использовали метод инфракрасной спектроскопии, модернизированный так, чтобы на выходе можно было отличать спектры, которые дают водяные кластеры, различающиеся по размеру всего на несколько молекул. Созданная авторами методика дает максимальное разрешение для кластеров, включающих от 100 до 1000 молекул — а именно в этом интервале, как считалось, и лежит «пороговое» число, после которого начинается кристаллизация.
Ученые получали аморфный лед, пропуская водяной пар, смешанный с гелием, сквозь очень тоненькое отверстие в вакуумную камеру. Пытаясь протиснуться в крошечную дырочку, молекулы воды и гелия непрерывно сталкивались друг с другом и в этой давке теряли значительную часть своей кинетической энергии.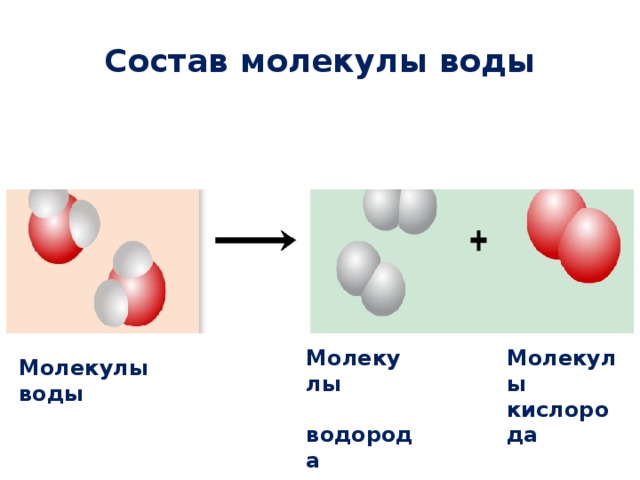 В итоге в вакуумную камеру попадали уже «успокоившиеся» молекулы, легко формирующие кластеры.
В итоге в вакуумную камеру попадали уже «успокоившиеся» молекулы, легко формирующие кластеры.
Возникновение кристаллической решетки при увеличеннии числа молекул воды в кластерах. Изображение Victoria Buch, Cristoph Pradzynski and Udo Buck. Нажмите на картинку, чтобы увеличить
Lenta.ru
Изменяя количество молекул воды и сравнивая итоговые спектры, исследователи смогли засечь момент перехода от аморфной к кристаллической форме льда (спектры этих двух форм имеют очень характерные отличия). Полученная учеными динамика хорошо согласовывалась с теоретическими моделями, которые предсказывают, что после прохождения «точки Х» формирование кристаллической решетки начинается в середине кластера и распространяется к его краям. Признаком того, что кристаллизация неизбежна (опять же, согласно теоретическим изысканиям), является формирование кольца из шести соединенных водородными связями молекул — именно это и происходит, когда общее число молекул в кластере становится равным 275-ти. Дальнейшее увеличение числа молекул ведет к постепенному разрастанию решетки, и на стадии 475 штук спектр ледяного кластера уже полностью неотличим от спектра, который дает обычный кристаллический лед.
Дальнейшее увеличение числа молекул ведет к постепенному разрастанию решетки, и на стадии 475 штук спектр ледяного кластера уже полностью неотличим от спектра, который дает обычный кристаллический лед.
«Механизм фазового перехода из аморфного состояния в кристаллическое на микроуровне в деталях до сих пор не изучен, — поясняет Цойх. — Мы можем сравнивать наши экспериментальные данные только с теоретическими предсказаниями — и в данном случае согласование оказалось замечательно хорошим. Теперь, отталкиваясь от нынешних результатов, мы вместе с химиками-теоретиками сможем продолжить изучение фазового перехода и, в частности, попытаемся выяснить, насколько быстро он происходит».
Работа Бака и коллег попадает в категорию «чисто фундаментальных», хотя кое-какие практические перспективы у нее тоже есть. Авторы не исключают, что в будущем созданная ими технология изучения водяных кластеров, позволяющая видеть различия при добавлении нескольких молекул, может оказаться востребованной и в прикладных областях. «В своей статье мы описали все ключевые компоненты технологии, так что в принципе ее вполне можно приспособить для изучения кластеров из других нейтральных молекул. Впрочем, основные принципы устройства лазера были понятны еще в 1917 году, а первый лазер был создан только в 1960-е», — предостерегает от излишнего оптимизма Цойх.
«В своей статье мы описали все ключевые компоненты технологии, так что в принципе ее вполне можно приспособить для изучения кластеров из других нейтральных молекул. Впрочем, основные принципы устройства лазера были понятны еще в 1917 году, а первый лазер был создан только в 1960-е», — предостерегает от излишнего оптимизма Цойх.
Лед, вода и молекулы. Наш зимний мир
Почему у снежинок шесть сторон?
В 1611 году люди не знали о молекулах, но когда философ Иоганн Кеплер увидел у себя на рукаве шестиконечную снежинку, он подумал, что ее симметрия обусловлена тем, что она состоит из мельчайших шестиугольных (шестигранных) частиц. Кеплер поднял несколько увлекательных вопросов о фундаментальной природе материи, и он был во многом прав. Изящные шестигранные формы, которые снова и снова можно увидеть в падающих с неба снежинках и в снежном покрове, обусловлены природой и формой молекулы воды.
Наблюдения философа Иоганна Кеплера за 6-сторонней симметрией, наблюдаемой в снежинках, намекнули на основную молекулярную структуру воды.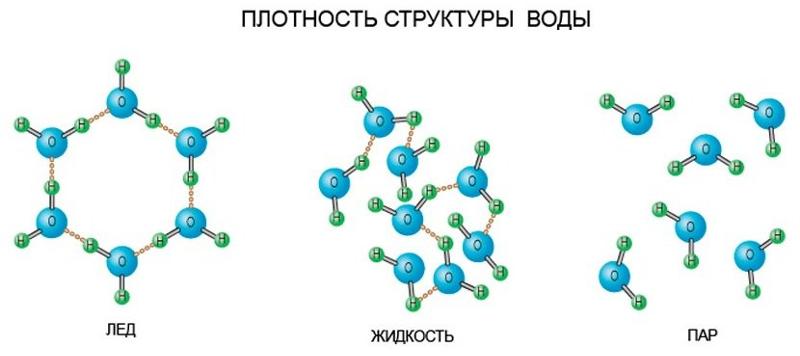 (Общественное достояние {{PD-old-100}})
(Общественное достояние {{PD-old-100}})
Первая удачная фотография снежинки была сделана в 1885 году Уилсоном А. «Снежинка» Бентли. Основываясь на более чем 5000 фотографий снежинок, Бентли пришел к выводу, что нет двух абсолютно одинаковых снежинок. Фото Уилсона А. Бентли (Public Domain {{PD-US-old}})
Снежные кристаллы могут расти горизонтально вдоль своей основной грани, образуя плоскую шестиугольную пластину или дендрит. Они также могут расти вертикально вдоль своих граней призмы, в результате чего образуются кристаллы в форме столбцов и игл. Большинство снежных кристаллов растут в обоих направлениях, что приводит к ошеломляющему множеству различных типов снежных кристаллов. Иллюстрация Мэтью Штурма
Лед против воды
Землю, «водную планету», можно легко назвать «полуледяной планетой», потому что температура зимой на большей части Земли достаточно низка, чтобы вода замерзала, поэтому существуют огромные ледяные шапки в полярных районах. И вода, и лед состоят из тетраэдрических молекул, состоящих из двух атомов водорода и одного атома кислорода (H 2 0), соединенных прочными связями. Лед имеет более жесткую и организованную структуру, чем вода, которая состоит из более рыхлых цепочек связанных молекул, которые могут скользить ближе друг к другу. Вещества, в которых молекулы более плотно упакованы, имеют более высокую плотность, чем те, в которых молекулы имеют большее расстояние между собой. Вот почему лед (менее плотный) плавает в воде (более плотный).
Лед имеет более жесткую и организованную структуру, чем вода, которая состоит из более рыхлых цепочек связанных молекул, которые могут скользить ближе друг к другу. Вещества, в которых молекулы более плотно упакованы, имеют более высокую плотность, чем те, в которых молекулы имеют большее расстояние между собой. Вот почему лед (менее плотный) плавает в воде (более плотный).
. Справа: жидкая вода (слева на изображении), молекулы h30 быстро перемещаются, потому что у них больше энергии, чем в твердой (ледяной) форме (на прямо на картинке). Когда h30 замерзает, молекулы замедляются, образуя организованную решетчатую структуру. Гексагональное расположение молекул h30 в твердом состоянии является причиной того, что снежные кристаллы имеют гексагональную симметрию. Изображение адаптировано из Британской энциклопедии Эндрю Старка на Quora (Условия предоставления услуг Quora)
Когда h30 замерзает, молекулы замедляются, образуя организованную решетчатую структуру. Гексагональное расположение молекул h30 в твердом состоянии является причиной того, что снежные кристаллы имеют гексагональную симметрию. Изображение адаптировано из Британской энциклопедии Эндрю Старка на Quora (Условия предоставления услуг Quora)
Молекула воды (H 2 0) состоит из одного атома кислорода (O) и двух атомов водорода (H). Атомы Н и О из разных молекул тоже притягиваются друг к другу. Связи между соседними молекулами H 2 0 называются водородными связями. Иллюстрация Мэтью Штурма
Что такого особенного в H
2 0? Некоторые важные характеристики водыЛюди на 60% состоят из воды, поэтому мы склонны считать свойства льда и воды само собой разумеющимися, но они экстремальны в том смысле, что влияют на всю жизнь и климат Земли.
Вода плотнее льда.
У большинства веществ твердое состояние более плотное, чем жидкое, но вода отличается! Лед менее плотный (917 кг на кубический метр), чем жидкая вода (1000 кг на кубический метр). Другой способ думать об этом состоит в том, что когда определенное количество жидкой воды замерзает в лед, он увеличивается в объеме. Вот почему:
Другой способ думать об этом состоит в том, что когда определенное количество жидкой воды замерзает в лед, он увеличивается в объеме. Вот почему:
Фото Lavivm на Pixabay (лицензия Pixabay)
Фото Доминикуса Йоханнеса Бергсма с Викисклада (CC-BY-SA-4.0)
Лед плавает, поэтому на дне океана нет ледников, и мы можем кататься на коньках по замерзшим прудам.
Когда трубы замерзают, они лопаются, а ледяная вода, замерзая в трещинах, раскалывает камни.
Вода обладает высокой теплоемкостью и скрытой теплотой
Из всех веществ на Земле вода обладает самой высокой теплоемкостью, которая представляет собой количество энергии (тепла), необходимое для повышения ее температуры. Он также имеет самую высокую скрытую теплоту, которая представляет собой количество энергии, необходимое для плавления твердого вещества в жидкость или жидкого вещества в газ. Вот почему:
Федеральное управление автомобильных дорог Фото / Martin Gyorgyfalvy (Public Domain) Фото Мэтью Штурма Снежные сугробы сохраняются в горах, где прохладнее, чем в долинах, в течение всего лета.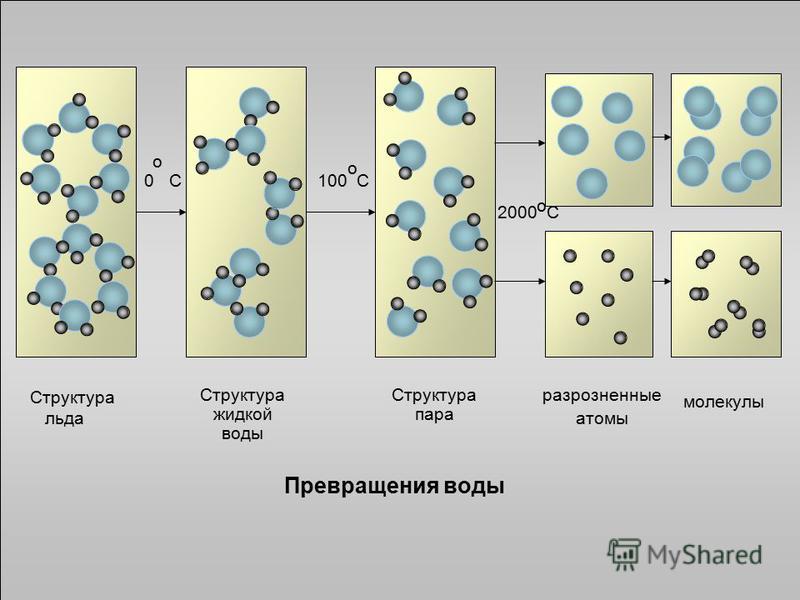
Снег в горах тает постепенно, стекая в ручьи и реки в течение всей весны и начала лета.
Вода и лед могут сосуществовать.
При низких температурах жидкая вода по-прежнему сосуществует со льдом в виде тонкого слоя. Вот почему:
Фото Гантаса Вайчуленаса из Pexels (лицензия Pexels)Снег и лед скользкие, что позволяет нам кататься на санках и коньках.
Снег отражает солнечный свет
Снег отражает видимый солнечный свет лучше, чем любое другое природное вещество на Земле, часто отбрасывая 85% света обратно в космос. Вот почему:
Фото Корди Вале на Pixabay (лицензия Pixabay)Снег помогает охлаждать планету, отражая, а не поглощая солнечную радиацию.
15.2: Структура льда — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53838
Лед — интересный и полезный материал.
Структура льда
Жидкая вода — это жидкость. Водородные связи в жидкой воде постоянно рвутся и восстанавливаются, когда молекулы воды сталкиваются друг с другом. По мере охлаждения воды ее молекулярное движение замедляется, и молекулы постепенно приближаются друг к другу. Плотность любой жидкости увеличивается с понижением ее температуры. Для большинства жидкостей это продолжается по мере замерзания жидкости; твердое состояние более плотное, чем жидкое. Однако вода ведет себя иначе. На самом деле он достигает максимальной плотности примерно при \(4^\text{o} \text{C}\).
Лед менее плотный, чем жидкая вода, поэтому он плавает. Пруды или озера начинают замерзать у поверхности, ближе к холодному воздуху. Образуется слой льда, но он не тонет, как если бы вода не имела этой уникальной структуры, определяемой ее формой, полярностью и водородными связями. Если бы лед тонул, замерзая, целые озера замерзали бы. Поскольку лед не тонет, жидкая вода остается подо льдом всю зиму.