Кислород: физические и химические свойства
История открытия кислородаПожалуй, среди всех известных химических элементов, именно кислород занимает ведущее значение, ведь без него попросту было бы невозможным возникновение жизни на нашей планете. Кислород – самый распространенный химический элемент на Земле, на его долю приходится 49% от общей массы земной коры. Также он входит в состав земной атмосферы, состав воды и состав более 1400 различных минералов, таких как базальт, мрамор, силикат, кремнезем и т. д. Примерно 50-80% общей массы тканей, как животных, так и растений состоит из кислорода. И, разумеется, общеизвестна его роль для дыхания всего живого.
История открытия кислорода
Люди далеко не сразу постигли природу кислорода, хотя первые догадки о том, что в основе воздуха лежит некий химический элемент, появились еще в VIII веке. Однако в то далекое время не было ни подходящих технических инструментов для его изучения, ни возможности доказать существования кислорода, как газа, отвечающего в том числе за процессы горения.
Открытие кислорода состоялось лишь спустя тысячелетие, в ХVIII веке, благодаря совместной работе нескольких ученых.
- В 1771 шведский химик Карл Шееле опытным путем исследовал состав воздуха, и определил, что воздух состоит из двух основных газов: одним из этих газов был азот, а вторым, собственно кислород, правда на то время само название «кислород» еще не появилось в науке.
- В 1775 году французский ученый А. Лувазье дал название открытому Шееле газу – кислород, он же оксиген в латыни, само слово «оксиген» означает «рождающий кислоты».
- За год до официальных «именин кислорода», в 1774 году английский химик Пристли путем разложение ртутного оксида впервые получает чистый кислород. Его опыты подкрепляют открытие Шееле. К слову сам Шееле также пытался получить кислород в чистом виде путем нагревания селитры, но у него не получилось.
- Более чем через столетия в 1898 году английский физик Джозеф Томпсон впервые заставил общественность задуматься, о том, что запасы кислорода могут закончиться вследствие интенсивных выбросов углекислого газа в атмосферу.
- В этом же году русский биолог Климент Тимирязев, исследователь фотосинтеза, открывает свойство растений выделять кислород.
Хотя растения и выделяют кислород в атмосферу, но проблема поставленная Томпсоном о возможной нехватки кислорода в будущем, остается актуальной и в наше время, особенно в связи с интенсивной вырубкой лесов (поставщиков кислорода), загрязнением окружающей среды, сжиганием отходов и прочая. Больше об этом мы писали в прошлой статье об экологических проблемах современности.
Значение кислорода в природе
Именно наличие кислорода, в сочетании с водой привело к тому, что на нашей планете стало возможным возникновение жизни. Как мы заметили выше, основными поставщиками этого уникального газа являются различные растения, в том числе наибольшее количество выделяемого кислорода приходится на подводные водоросли. Выделяют кислород и некоторые виды бактерий. Кислород в верхних слоях атмосферы образует озоновый шар, который защищает всех жителей Земли от вредного ультрафиолетового солнечного излучения.
Строение молекулы кислорода
Молекула кислорода состоит из двух атомов, химическая формула имеет вид О2. Как образуется молекула кислорода? Механизм ее образования ковалентный неполярный, другими словами за счет обобществления электроном каждого атома. Связь между молекулами кислорода также ковалентная и неполярная, при этом она двойная, ведь у каждого из атомов кислорода есть по два неспаренных электрона на внешнем уровне.

Так выглядит молекула кислорода, благодаря своим характеристикам она весьма устойчива. Для многих химических реакций с ее участием нужны специальные условия: нагревание, повышенное давление, применение катализаторов.
Физические свойства кислорода
- Прежде всего, кислород является газом, из которого состоит 21% воздуха.
- Кислород не имеет ни цвета, ни вкуса, ни запаха.
- Может растворяться в органических веществах, поглощаться углем и порошками металлов.
- Температура кипения кислорода составляет -183 С.
- Плотность кислорода равна 0,0014 г/см3
Химические свойства кислорода
Главным химическим свойством кислорода является, конечно же, его поддержка горения. То есть в вакууме, где нет кислорода, огонь не возможен. Если же в чистый кислород опустить тлеющую лучину, то она загорится с новой силой. Горение разных веществ это окислительно-восстановительный химический процесс, в котором роль окислителя принадлежит кислороду. Окислители же это вещества, «отбирающие» электроны у веществ восстановителей. Отличные окислительные свойства кислорода обусловлены его внешней электронной оболочкой.
Валентная оболочка у кислорода расположена близко к ядру и как следствие ядро притягивает к себе электроны. Также кислород занимает второе место после фтора по шкале электроотрицательности Полинга, по этой причине вступая в химические реакции со всеми другими элементами (за исключением фтора) кислорода выступает отрицательным окислителем. И лишь вступая в реакции со фтором кислород имеет положительное окислительное воздействие.
А так как кислород второй окислитель по силе среди всех химических элементов таблицы Менделеева, то это определяет и его химические свойства.
Получение кислорода
Для получения кислорода в лабораторных условиях применяют метод термической обработки либо пероксидов либо солей кислосодержащих кислот. Под действием высокой температуры они разлагаются с выделением чистого кислорода. Также кислород можно получить с помощью перекиси водорода, даже 3% раствор перекиси под действие катализатор мгновенно разлагается, выделяя кислород.
2KClO3 = 2KCl + 3O2↑ – вот так выглядит химическая реакция получения кислорода.
Также в промышленности в качестве еще одного способа получения кислорода применяют электролиз воды, во время которого молекулы воды раскладываются, и опять таки выделяется чистый кислород.
Использование кислорода в промышленности
В промышленности кислород активно применяется в таких сферах как:
- Металлургия (при сварке и вырезке металлов).
- Медицина.
- Сельское хозяйство.
- Как ракетное топливо.
- Для очищения и обеззараживания воды.
- Синтеза некоторых химических соединений, включая взрывчатые вещества.
Кислород, видео
И в завершение образовательное видео про кислород.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Oxygen.
Интересно о кислороде (23 фото)
Ответы на два вопроса: «что будет, если мир лишится кислорода на 5 секунд?» и «что будет, если кислорода станет в два раза больше?».
Познавательно.























Строение атома кислорода (O), схема и примеры
Общие сведения о строении атома кислорода
Порядковый номер равен 8. Заряд ядра равен +8. Атомный вес – 15,999а.е.м. В природе встречаются три изотопа кислорода: 16O,17O и 18O, из которых наиболее распространенным является 16O (99,762 %).
Электронное строение атома кислорода
Атом кислорода имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы –VI (халькогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 6 валентных электронов. Обладает высокой окислительной способностью (выше только у фтора).
Рис. 1. Схематичное изображение строения атома кислорода.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p4.
Кислород – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
У кислорода есть 2 пары спаренных электронов и два неспаренных электрона. Во всех своих соединениях кислород проявляет валентность II.
Рис. 2. Пространственное изображение строения атома кислорода.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Факты о кислороде, которые должен знать каждый (8 фото)
Кислород является важнейшим элементом на нашей планете для подержания жизни в той форме, к которой мы привыкли. Он является составной частью атмосферы нашей планеты и содержится не только в воздухе, но и в воде, благодаря чему на Земле существует жизнь не только на суше, но и в воде.
Как элемент кислород был впервые открыт в 1773 году Карлом Вильгельмом Шеле, но поскольку он не спешил публиковать свою работу, долгое время первооткрывателем кислорода значился Джозеф Пристли.
Кислород является не только необходимым, но и любопытным элементом, вот интересные факты о кислороде, которых вы, возможно, еще не знаете.
Он ядовит
Этот газ необходим для дыхания как животных, так и растений. Интересно, но несмотря на то, что без него не было бы жизни, слишком большое его количество может привести к отравлению и даже смерти. Симптомы отравления кислородом включают в себя потерю зрения, кашель, мышечные спазмы и судороги. При нормальном атмосферном давлении отравление кислородом наступает, если его содержание в воздухе превышает 50 % (обычное содержание кислорода в атмосфере — 21 %).
Чистый газ
Чистый кислород без примесей не имеет ни цвета, ни вкуса, ни запаха. Однако чистый кислород редко существует в природе без примесей.
Твердая и жидкая форма
В твердой и жидкой форме кислород отличается голубоватым цветом. Под влиянием пониженных температур и повышенного давления голубые кристаллы кислорода меняют цвет на оранжевый, красный, черный и серый.
Проводимость
Кислород — неметаллический элемент. У него низкая термальная и электрическая проводимость, однако высокая ионизация. Этот газ в чистом виде плохо проводит электричество, однако очень быстро формирует химические связи с другими элементами.
Валентность
В природе этот газ чаще всего встречается в двухвалентной молекуле O2 и трехвалентной молекуле O3 (озон). Синглетный кислород встречается в верхних слоях атмосферы, однако его атомы быстро формируют химические связи с другими элементами.
Горение
Процесс возгорания и горения невозможен без кислорода, однако этот газ не горит сам по себе.
Магнетизм
Кислород является парамагнетиком, то есть он отвечает на воздействие магнитного поля (притягивается магнитом только при наличии сильного магнитного поля), обладает положительной магнитной восприимчивостью, однако очень слабой.
Тело человека
Практически две трети массы человека составляет кислород. Это делает его самым изобильным элементом в организме. Большая часть кислорода в нашем организме является частью молекулы воды. Несмотря на то что молекул водорода в нашем теле почти в два раза больше, они значительно легче. Однако по массе во Вселенной водород значительно превышает кислород.
Северное сияние
Молекулы кислорода, находящиеся в движении, в ответе за яркие красные, желтые и зеленые цвета полярного сияния.
Молекулярная масса
До 1961 года масса атома кислорода являлась стандартом для атомной массы других элементов. После того как наука расширила свое понимание изотопов, в качестве стандарта атомной массы на место кислорода встал углерод.
Ученые объяснили появление молекулярного кислорода на кометах
Justin Cowart / Flickr
Инженеры из Калифорнийского технологического института объяснили механизм образования молекулярного кислорода (O2) на кометах. Примечательно, что открытие сделано отчасти случайно: исследователи занимались изучением и разработкой полупроводниковых материалов, и ради интереса решили изучить данные о химических реакциях на поверхности кометы Чурюмова-Герасименко. Исследование опубликовано в журнале Nature Communications.
В ходе своей более чем двухлетней миссии зонд «Розетта» собрал огромное количество данных о комете Чурюмова-Герасименко и составе выделяемых с нее газов. К примеру, выяснилось, что содержание тяжелой воды в выделяемом газе более чем в три раза выше, чем в земных океанах. Также, одним из важнейших открытий стало первое обнаружение молекулярного кислорода на кометах. Поскольку кислород является крайне активным элементом, то ранее в молекулярном виде в относительно больших количествах его обнаруживали в космосе лишь в двух туманностях, в остальных случаях находили лишь следовые концентрации. Как правило, он встречается в виде соединений, таких как вода или оксиды. Изначально, научное сообщество сошлось во мнении, что молекулярный кислород попал в комету скорее всего еще во времена ранней Солнечной системы несколько миллиардов лет назад. Понимание происхождения молекулярного кислорода в космосе важно в том числе и для понимания происхождения жизни на Земле и возможности ее нахождения на других космических телах.
Авторами новой работы стали специалисты в области полупроводниковых устройств, и в частности занимаются исследованием процессов при столкновении высокоэнергетических ионов с поверхностями полупроводников. Исследователи решили изучить данные о составе комы кометы Чурюмова-Герасименко с зонда «Розетта» и поняли, что на ней происходят процессы, похожие на те, которые они изучали в лаборатории. На основе данных о составе облака газов, окружающего комету и энергиях молекул в нем, ученые создали модель образования молекулярного кислорода.
Схема реакции, проходящей на поверхности кометы. Буквами S и O обозначено соединение, от которого ионизированная молекула воды «отрывает» атом кислорода
Yunxi Yao & Konstantinos P. Giapis / Nature Communications, 2017
Согласно предположению ученых, процесс происходит следующим образом. Из-за нагревания солнечными лучами вода испаряется с кометы. Затем молекулы воды ионизируются ультрафиолетовыми солнечными лучами и направляются солнечным ветром обратно к поверхности. При столкновении ионизированных молекул воды с содержащими атомы кислорода веществами на поверхности, молекулы захватывают один атом и вода распадается на молекулу O2 и два атома водорода. Реакции такого типа называются реакциями Эли-Риделя.Ученые отмечают, что на комете есть все необходимые условия для такого процесса. Они предполагают, что открытие такого абиотического механизма образования молекул кислорода может изменить взгляды ученых, занимающихся поиском признаков внеземной жизни.
Другие материалы, рассказывающие о ходе миссии «Розетта» и сделанных с ее помощью открытиях можно прочитать здесь.
Григорий Копиев
Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение » HimEge.ru
Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Для кислорода известны степени окисления -2, -1, +1, +2
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16О, 17О и 18О (преобладает 16О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути (+2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О2 и озона О3.
Строение молекулы озона
3О2 = 2О3 – 285 кДж
Озон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.
При хранении озон самопроизвольно превращается в кислород. Химически кислород О2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н2О → 2Н2 + О2
2. В лаборатории кислород получают:
1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4 и др.)
2. Термическим разложением перманганата калия KMnO4:
2KMnO4 = K2MnO4 + MnO2 + O2↑,
Бертолетовой соли KClO3:
2KClO3 = 2KCl + 3O2↑ (катализатор MnO2)
Оксида марганца (+4) MnO2:
4MnO2 = 2Mn2O3 + O2↑ (700 oC),
3MnO2 = 2Mn3O4 + O2↑ (1000 oC),
Пероксид бария BaO2 :
2BaO2 = 2BaO + O2↑
3. Разложением пероксида водорода:
2H2O2 = H2O + O2↑ (катализатор MnO2)
4. Разложение нитратов:
2KNO3 → 2KNO2 + O2
На космических кораблях и подводных лодках кислород получают из смеси K2O2 и K2O4:
2K2O4 + 2H2O = 4KOH +3O2↑
4KOH + 2CO2 = 2K2CO3 + 2H2O
Суммарно:
2K2O4 + 2CO2 = 2K2CO3 + 3О2 ↑
Когда используют K2O2, то суммарная реакция выглядит так:
2K2O2 + 2CO2 = 2K2CO3 + O2 ↑
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Химические свойства кислорода
Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s2 2p4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
Кислород легко реагирует с щелочными и щелочноземельными металлами:
4Li + O2 → 2Li2O,
2K + O2 → K2O2,
2Ca + O2 → 2CaO,
2Na + O2 → Na2O2,
2K + 2O2 → K2O4
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
3 Fe + 2O2 → Fe3O4
2Mg + O2 → 2MgO
2Cu + O2 → 2CuO
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
S + O2 → SO2,
C + O2 → CO2,
2H2 + O2 → H2O,
4P + 5O2 → 2P2O5,
Si + O2 → SiO2, и т.д
Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
N2 + O2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 oC или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2H2S + 3O2 → 2SO2 + 2H2O (избыток кислорода),
2H2S + O2 → 2S + 2H2O (недостаток кислорода),
4NH3 + 3O2 → 2N2 + 6H2O (без катализатора),
4NH3 + 5O2 → 4NO + 6H2O (в присутствии катализатора Pt ),
CH4 (метан) + 2O2 → CO2 + 2H2O,
4FeS2 (пирит) + 11O2 → 2Fe2O3 + 8SO2.
Известны соединения, содержащие катион диоксигенила O2+, например, O2+ [PtF6]— (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).
Озон химически более активен, чем кислород O2. Так, озон окисляет иодид — ионы I— в растворе Kl:
O3 + 2Kl + H2O = I2 + O2 + 2KOH
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Урок 16. Кислород и озон – HIMI4KA
В уроке 16 «Кислород и озон» из курса «Химия для чайников» мы рассмотрим кислород как химический элемент и как простое вещество; узнаем об истории его открытия; выясним, что такое озон и какими свойствами он обладает.


Исторически так сложилось, что химический элемент и одно из простых веществ, образованных атомами этого элемента, имеют общее название — кислород. Поскольку между этими понятиями существует принципиальная разница, следует четко различать, о чем идет речь — о кислороде как о химическом элементе или о простом веществе.
Кислород как химический элемент
Самым первым химическим элементом, к изучению которого мы приступаем, является кислород. Как вы уже знаете, химический знак кислорода — О. Относительная атомная масса кислорода равна 16:
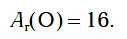
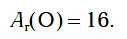
Позднее вы узнаете, какое строение имеет атом кислорода и чем он отличается от атомов других химических элементов.
Когда говорят о кислороде как о химическом элементе, то подразумевают атомы кислорода. Например: «В состав многих сложных веществ входит кислород», «Массовая доля кислорода в глюкозе равна 53,3 %». В этих примерах речь идет об атомах кислорода (О), которые наряду с атомами других химических элементов входят в состав сложных веществ, следовательно, в данном случае речь идет о кислороде как о химическом элементе.
Кислород как простое вещество
Простое вещество кислород существует в виде молекул. Молекула кислорода состоит из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O2.


Поскольку относительная атомная масса кислорода равна 16, то относительная молекулярная масса простого вещества кислорода равна:
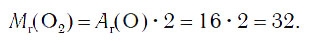
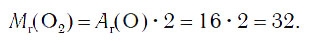
Следовательно, молярная масса кислорода равна:
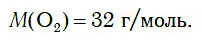
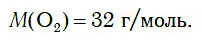
Как у всех газов, молярный объем кислорода при нормальных условиях равен:
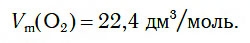
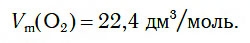
Когда говорят о кислороде как о простом веществе, то подразумевают вещество, имеющее формулу О2. Например: «Железные изделия быстро ржавеют в атмосфере влажного кислорода», «Для горения древесины необходим кислород». В этих примерах речь идет о веществе, имеющем формулу О2.
История открытия кислорода
История открытия самого важного для человека газа была долгой и запутанной. Впервые об открытии кислорода было сообщено в 1774 г. английским химиком Дж. Пристли. Он получил его при нагревании вещества HgO. Однако Дж. Пристли в то время не понял, что он получил новое газообразное вещество, и считал его разновидностью воздуха. Еще раньше в 1772 г. кислород был получен К. Шееле, но сообщение об этом он опубликовал только в 1777 г.
В 1774 г. Дж. Пристли сообщил о своих результатах великому французскому химику А. Лавуазье. Он тут же начал свои опыты и уже в 1775 г. сделал в Академии наук доклад «Мемуар о природе вещества, соединяющегося с металлами при прокаливании и увеличивающего их вес».
Происхождение названия «кислород» связано с образованием кислот в результате растворения в воде некоторых сложных веществ, содержащих атомы этого элемента. А. Лавуазье считал, что кислород — это обязательная составная часть всех кислот, что он «рождает» кислоты. Чтобы подчеркнуть это, А. Лавуазье в 1779 г. назвал этот газ «рождающим кислоты», или сокращенно — кислородом.
Озон
Кроме кислорода, существует еще одно простое вещество, молекулы которого состоят только из атомов кислорода. Это озон, молекула которого содержит три атома кислорода (рис. 74), его формула — О3.
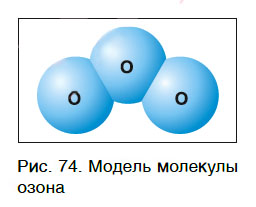

При нормальных условиях озон представляет собой газ с резким раздражающим запахом. Он очень токсичен для всех живых организмов и поэтому используется вместо хлора для обеззараживания воды.
Небольшие количества озона образуются в воздухе во время грозы, а также в результате взаимодействия смолы хвойных деревьев с кислородом. Озон оказывает губительное действие на бактерии, поэтому лесной воздух (особенно в хвойных лесах) обладает целебным действием.
В небольших количествах озон образуется также при работе копировальных аппаратов и лазерных принтеров. Использовать такие приборы следует только в хорошо проветриваемых помещениях.
В верхних слоях атмосферы Земли (на высоте примерно 30—40 км) существует озоновый слой. Содержащийся в нем озон образуется из кислорода под воздействием солнечного излучения. Некоторые компоненты этого излучения губительны для живых организмов и растений на нашей планете, а озоновый слой поглощает их. Если бы не было озонового слоя, то жизнь на Земле постепенно бы прекратилась.
Многие ученые считают, что вещества, образующиеся в процессе производственной деятельности человека, разрушают озоновый слой. Это прежде всего фреоны — соединения, использующиеся в холодильных установках и дезодорантах, выбросы реактивных самолетов и ракет. Попадая в озоновый слой, эти вещества приводят к уменьшению его толщины или даже разрыву этого слоя — образованию так называемых озоновых дыр. В результате образования и увеличения размеров озоновых дыр могут наступить серьезные экологические катастрофы.
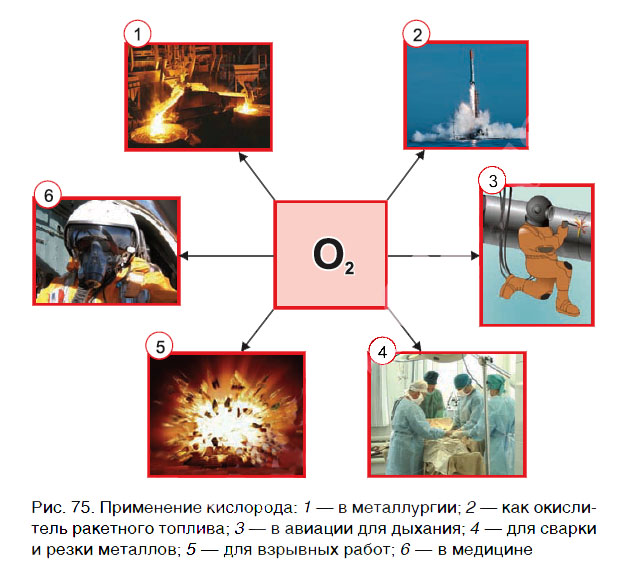
Применение кислорода
Кислород очень широко применяется в народном хозяйстве. На рисунке 75 приведены основные области применения кислорода. Главными потребителями кислорода являются металлургическая промышленность (выплавка стали), космическая техника (окислитель ракетного топлива), процессы обработки металлов (сварка и резка металлов).

Краткие выводы урока:
- Химический элемент кислород образует два простых вещества — кислород О2 и озон О3.
- Когда говорят о кислороде как о химическом элементе, подразумевают атомы кислорода О.
- Когда говорят о кислороде как о простом веществе, подразумевают вещество, состоящее из молекул и имеющее формулу О2.
Надеюсь урок 16 «Кислород и озон» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.

