Развитие в науке представлений о простом и сложном веществе. Химические элементы. Символы химических элементов. 8 класс
Результаты опытов по разложению вещества
Вам уже знакомо имя английского исследователя Р. Бойля. Именно он предложил опыты по определению состава веществ. Рассмотрим суть таких опытов.
Чтобы установить состав вещества (проанализировать вещество) часто используют реакцию разложения, в результате которой из одного исходного вещества получается несколько продуктов реакции.
ОПЫТ 1. Разложение сахара при нагревании.
Поместим в пробирку несколько крупинок сахара и нагреем ее в пламени спиртовки. В результате прокаливания на стенках пробирки появляются капельки прозрачной жидкости, а на месте крупинок сахара образуется вещество черного цвета (рис. 1). Если продолжать нагревание и дальше, то с черным веществом ничего не происходит. Это вещество – сажа (уголь). Его нельзя разложить ни при каких условиях.
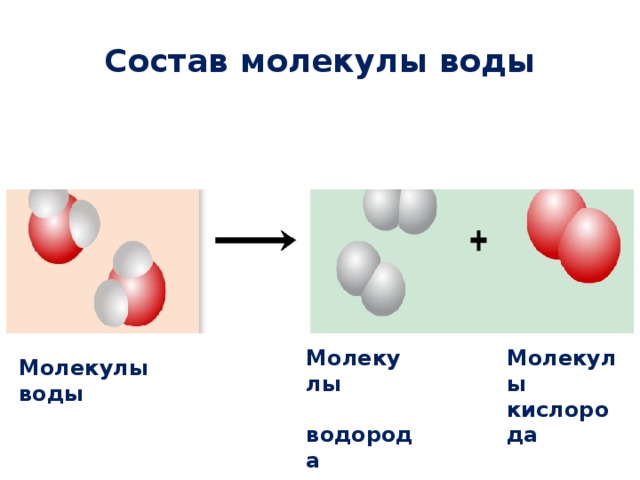
Прозрачная жидкость на стенках пробирки — это вода. Воду можно разложить на два вещества с помощью электрического тока.
Воду можно разложить на два вещества с помощью электрического тока.
Рис. 1. Разложение сахара при нагревании
Простые и сложные вещества
ОПЫТ 2. Разложение воды.
Заполним водой электролизер. На электроды надеваем пробирки, заполненные водой. При пропускании электрического тока через воду на электродах начнут выделяться газы, которые вытеснят воду из пробирок. Газы получатся чистыми, потому что воздуха в пробирках, заполненных водой, нет.
Рис. 2. Разложение воды под действием электрического тока
Итак, при разложении сахара образуется два вещества – вода и сажа (или уголь). Сажа не подвергается дальнейшему разложению. Вода же разлагается на водород и кислород. Водород и кислород дальше не разлагаются.
Рис. 3. Результаты опытов по разложению сахара и воды
За многие годы исследований ученые обнаружили немало веществ, которые не подвергаются разложению ни при каких условиях. Это сажа, железо, сера, медь, кислород, водород и другие. Вещества, которые не удавалось разложить, стали называть простыми веществами. Если вещество удавалось разложить, его считали сложным веществом.
Это сажа, железо, сера, медь, кислород, водород и другие. Вещества, которые не удавалось разложить, стали называть простыми веществами. Если вещество удавалось разложить, его считали сложным веществом.
Долгое время к простым веществам относили и воду, потому что не могли подобрать условия ее разложения. Ошибочно также простыми считали кварц и корунд. В состав минерала кварца входят атомы кремния и кислорода. А корунд, отличающийся большой твердостью, содержит атомы алюминия и кислорода.
По мнению Р. Бойля, простое вещество оттого нельзя разложить, что оно состоит из отличного от других элемента. Что же такое химический элемент?
Химический элемент
Химический элемент – это разновидность атомов.
Тогда сформулируем определения простого и сложного веществ.
Простое вещество состоит из одного химического элемента (из атомов одного вида).
Сложное вещество состоит из различных химических элементов (из атомов разных видов).
Важно отметить, что из одного простого вещества нельзя в ходе химической реакции получить вещество, образованное другим химическим элементом, т. к. в ходе химических реакций атомы не изменяются.
Проиллюстрируем данные определения. Молекула водорода состоит из двух атомов одного химического элемента, тоже называемого водородом. Молекула кислорода тоже состоит из двух атомов одного химического элемента, называемого кислородом. Сажа состоит только из атомов углерода. Молекула воды состоит из двух атомов водорода и одного атома кислорода, т. е. включает в себя два различных химических элемента.
Рис. 4. Модели строения некоторых веществ
Названия многих химических элементов не отличаются от названий простых веществ, образованных этими элементами. Например, простое вещество водород состоит из химического элемента водорода. Простое вещество кислород состоит из химического элемента кислорода. Простое вещество железо состоит из атомов железа. Поэтому очень важно научиться различать понятия «простое вещество» и «химический элемент».
Приведем примеры двух высказываний о кислороде, в одном из которых речь идет о химическом элементе, а в другом – о простом веществе.
Первое: «Рыбы дышат кислородом, растворенным в воде». Второе: «В состав молекулы воды входит кислород». Говоря о кислороде, который растворен в воде, мы имеем в виду вещество, для которого характерны определенные свойства – например, растворимость в воде. Кислород, входящий в состав молекулы воды, — это химический элемент. Т. е. мы можем сказать, что атом кислорода входит в состав молекулы воды.
Есть химические элементы, которые образуют несколько различных простых веществ. Например, химический элемент углерод образует графит (тоже, что и сажа, уголь) и алмаз. Графит – нетвердое вещество серого цвета с металлическим блеском. Из него делают стержни простых карандашей.
Алмаз — минерал, имеющий самую большую твердость. Ограненный алмаз называют бриллиантом. Несмотря на то, что эти простые вещества состоят только из атомов углерода, они очень различаются по свойствам.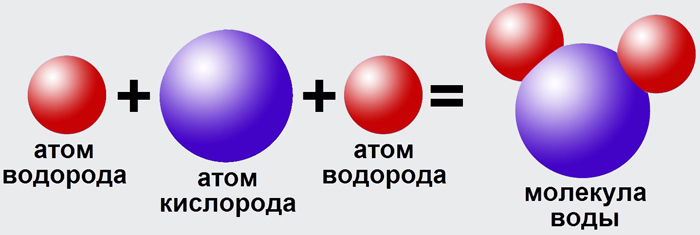
Аллотропия
Свойство химического элемента, образовывать несколько простых веществ, называют аллотропией. А простые вещества, образованные одним химическим элементом, называют аллотропическими модификациями.
Список рекомендованной литературы
- Сборник задач и упражнений по химии: 8-й класс: к учебнику П. А. Оржековского и др. «Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006.
- Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.17-19)
- Химия: 8-й класс: учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005. (§7)
- Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.

- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
- Единая коллекция цифровых образовательных ресурсов (Источник)
- Электронная версия журнала «Химия и жизнь» (Источник)
- Тесты по химии (онлайн) (Источник)
Домашнее задание
с. 17 №№ 4, 5 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Глава 1
Все вещества состоят из отдельных частиц, между которыми есть промежутки, — это предположение было доказано современной наукой. Частицы были названы молекулами (в переводе с латинского — «маленькая масса»).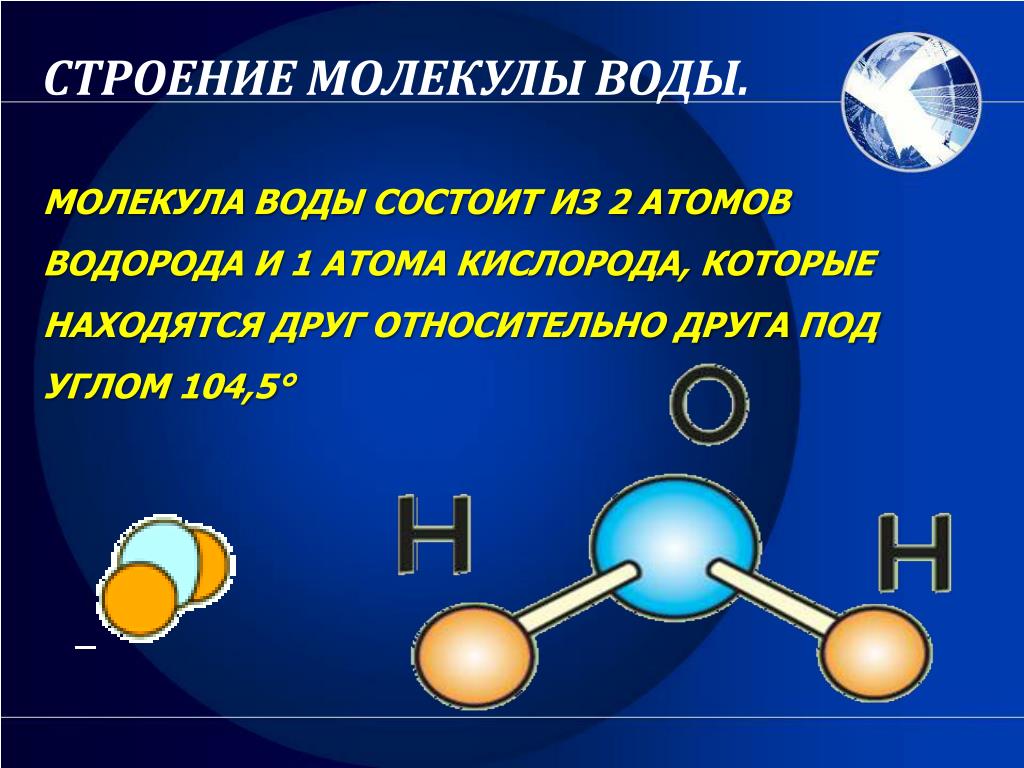
Молекула вещества — это мельчайшая частица данного вещества. |
Например, самая маленькая частица воды — молекула воды. Наименьшей частицей сахара является молекула сахара.
Попытаемся представить себе, каковы размеры молекул.
Электронный микроскоп позволяет получать изображения с увеличением |
Если бы можно было уложить в один ряд вплотную друг к другу 10 000 000 (или 107) молекул воды, то получилась бы ниточка длиной всего в 2 мм. Малый размер молекул позволяет получить тонкие плёнки различных веществ. Капля масла, например, может растекаться по воде слоем толщиной всего в 0,000002 м (или 2•10–6 м).
Даже небольшие тела состоят из огромного числа молекул. Так, в крупинке сахара содержится очень большое число молекул. Подсчитано, что в 1 см Через маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное количество молекул пройдёт через отверстие за 840 тыс. лет.
Через маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное количество молекул пройдёт через отверстие за 840 тыс. лет.
Из-за очень малых размеров молекулы невидимы невооружённым глазом или в обычные микроскопы. Но при помощи специального прибора — электронного микроскопа — удаётся сфотографировать наиболее крупные из них. На рисунке 21 показано расположение молекул белка, являющегося важной частью питания организма человека и животных.
Окружающие нас тела, даже похожие на первый взгляд, будут различны. В природе вы не встретите двух совершенно одинаковых снежинок или песчинок, людей, животных и пр.
Рис. 21. Молекула белка под микроскопом
Учёные с помощью опытов доказали, что молекулы разных веществ отличаются друг от друга, а молекулы одного и того же вещества одинаковы. Например, воду, полученную из сока или молока, нельзя отличить от воды, полученной путём перегонки из морской воды. Молекулы воды одинаковы. Из таких молекул не может состоять никакое другое вещество.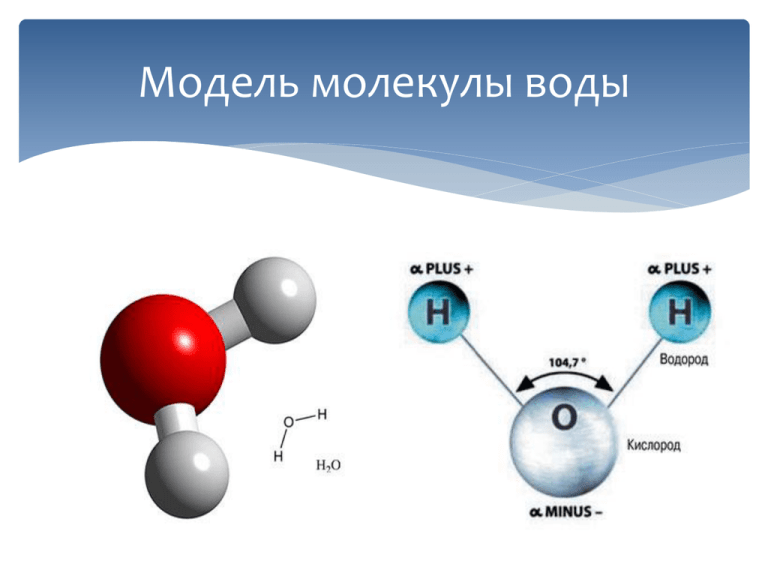
Молекулы, в свою очередь, состоят из ещё более мелких частиц — атомов (в переводе с греческого — «неделимый»).
Рис. 22. Схематическое изображение:
а — молекул воды;
б — молекул водорода и кислорода
Например, наименьшая частица воды — это молекула воды. Она состоит из трёх атомов: двух атомов водорода и одного атома кислорода. У некоторых веществ мельчайшей частицей вещества является атом. Из атомов состоят некоторые газы (аргон, гелий, неон и др.), а также отдельные твёрдые тела, например мышьяк, сера, кремний. А есть вещества, которые состоят из таких частиц, как ионы (в переводе с греческого — «странствующий»). Это поваренная соль, исландский шпат и др. Из курса химии вы узнаете, что любое вещество имеет своё обозначение, так, воду обозначают H2O, где H — атом водорода, O — атом кислорода.
Молекулы принято изображать схематически, т. е. с помощью моделей молекул. Две молекулы воды показаны на рисунке 22, а. Если разделить две молекулы воды, то образуется два атома кислорода и четыре атома водорода. На рисунке 22, б показано, что каждые два атома водорода могут соединиться в молекулу водорода, а атомы кислорода — в молекулу кислорода.
На рисунке 22, б показано, что каждые два атома водорода могут соединиться в молекулу водорода, а атомы кислорода — в молекулу кислорода.
1. Что такое молекула? 2. Что вы знаете о размерах молекул? 3. Из каких частиц состоит молекула воды? 4. Как изображается схематически молекула воды?
15.1: Структура воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53837
В своей известной поэме «Сказание о древнем мореплавателе» Сэмюэл Кольридж написал: «Вода, везде вода, ни капли для питья». Кольридж говорил о том, что он был в океане, но у него не было воды, потому что он убил альбатроса (очевидно, это принесло несчастье всем на корабле).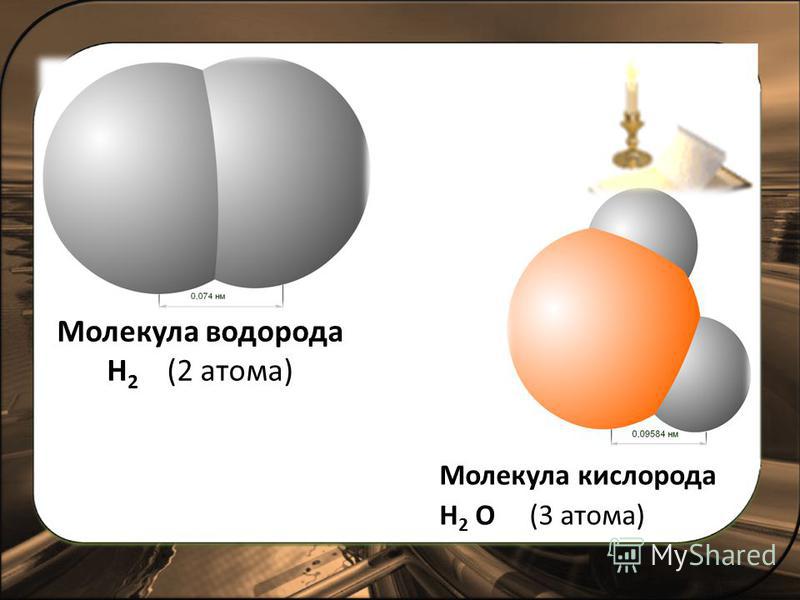 \text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
\text{o}\), что немного меньше идеального \(1093\) гибридная атомная орбиталь.
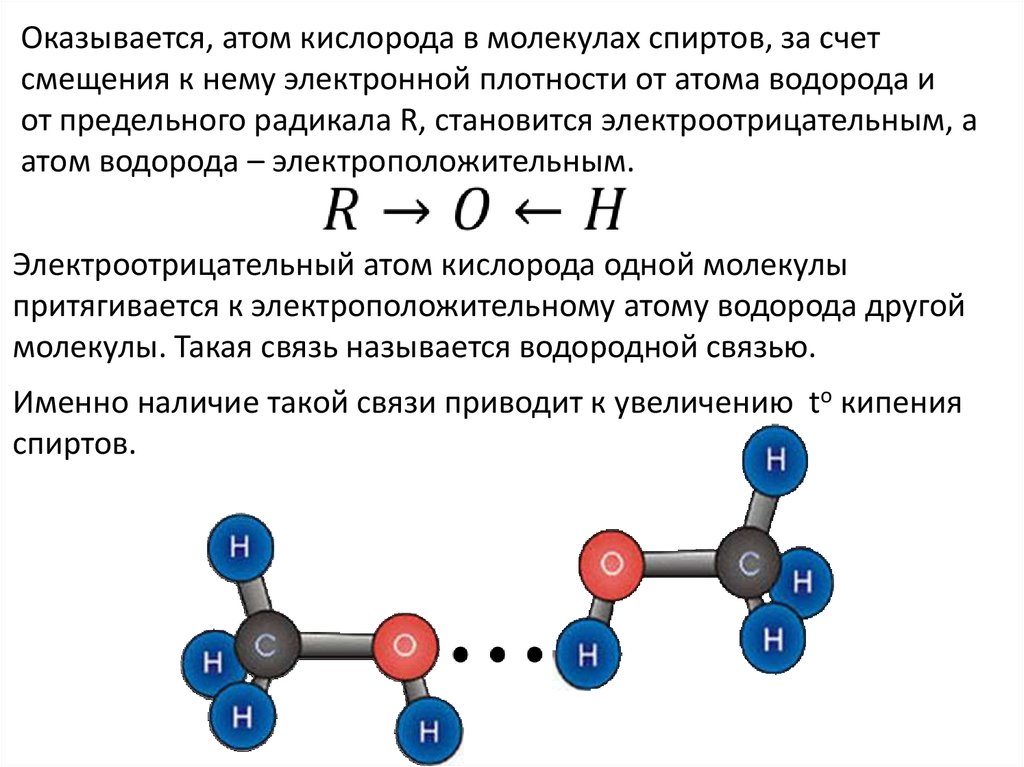
Изогнутая форма молекулы воды имеет решающее значение, поскольку полярные связи \(\ce{O-H}\) не компенсируют друг друга, а молекула в целом полярна. На рисунке ниже показана чистая полярность молекулы воды. Кислород — отрицательный конец молекулы, а область между атомами водорода — положительный конец молекулы.
Рисунок \(\PageIndex{2}\): Вода является полярной молекулой, так как большая электронная плотность находится вокруг более электроотрицательного атома кислорода. Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы. Рисунок \(\PageIndex{3}\): Водородная связь – это притяжение между неподеленной парой электронов на атоме кислорода одной молекулы и электронодефицитным атомом водорода соседней молекулы.
Каждый атом водорода сильно притягивается к неподеленной паре электронов соседнего атома кислорода. Они называются водородными связями и сильнее, чем обычные диполь-дипольные силы. Рисунок \(\PageIndex{3}\): Водородная связь – это притяжение между неподеленной парой электронов на атоме кислорода одной молекулы и электронодефицитным атомом водорода соседней молекулы.Резюме
- Вода представляет собой молекулярное соединение, состоящее из полярных молекул изогнутой формы.
- Атом кислорода приобретает частичный отрицательный заряд, а атом водорода приобретает частичный положительный заряд.

Эта страница под названием 15.1: Структура воды распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Химические реакции и молекулы | Биология для специальностей I
Результаты обучения
- Определение компонентов простых химических реакций
Все элементы наиболее стабильны, когда их внешняя оболочка заполнена электронами в соответствии с правилом октета. Это связано с тем, что атомам энергетически выгодно находиться в такой конфигурации, и это делает их стабильными. Однако, поскольку не у всех элементов достаточно электронов, чтобы заполнить их самые внешние оболочки, атомы образуют химических связей с другими атомами, таким образом получая электроны, необходимые им для достижения стабильной электронной конфигурации. Когда два или более атома химически связываются друг с другом, результирующая химическая структура представляет собой молекулу.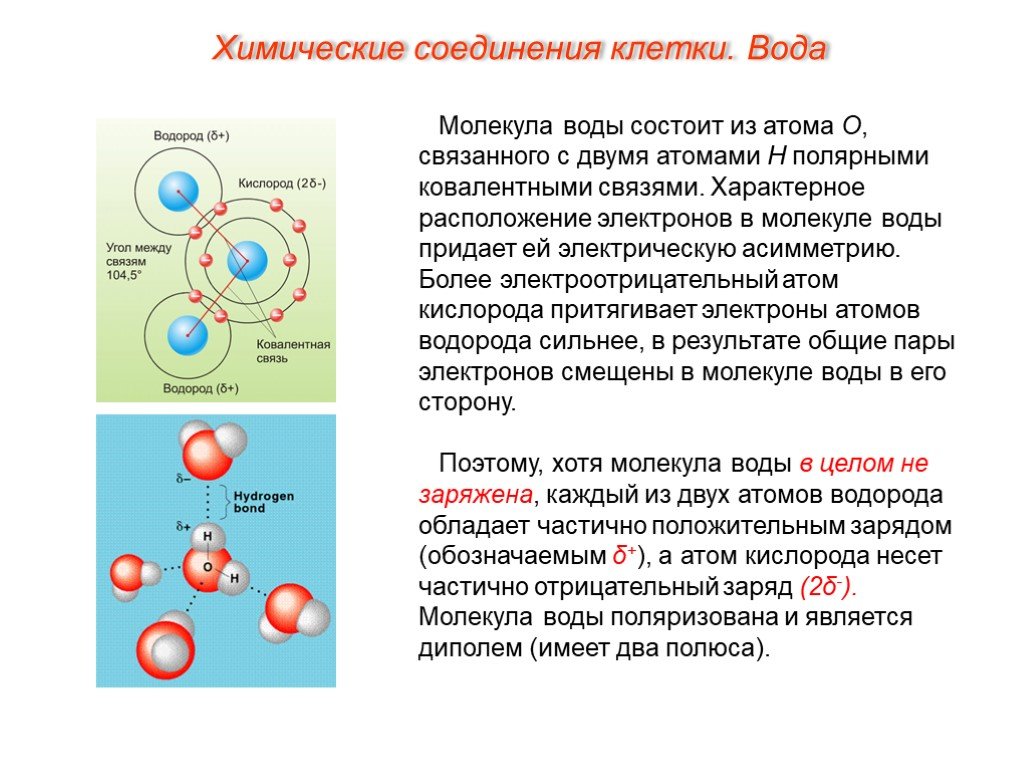 Знакомая молекула воды, H 2 O, состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе, образуя воду, как показано на рисунке 1. Атомы могут образовывать молекулы, отдавая, принимая или делясь электронами для заполнения своих внешних оболочек.
Знакомая молекула воды, H 2 O, состоит из двух атомов водорода и одного атома кислорода; они соединяются вместе, образуя воду, как показано на рисунке 1. Атомы могут образовывать молекулы, отдавая, принимая или делясь электронами для заполнения своих внешних оболочек.
Рис. 1. Два или более атома могут связываться друг с другом, образуя молекулу. Когда два атома водорода и кислород делят электроны через ковалентные связи, образуется молекула воды.
Химические реакции происходят, когда два или более атома соединяются вместе, образуя молекулы, или когда связанные атомы распадаются. Вещества, используемые в начале химической реакции, называются 9.0028 реагентов (обычно находятся в левой части химического уравнения), а вещества, обнаруживаемые в конце реакции, известны как продукты (обычно находятся в правой части химического уравнения). Между реагентами и продуктами обычно рисуется стрелка, указывающая направление химической реакции; это направление не всегда является «улицей с односторонним движением». Для создания молекулы воды, показанной выше, химическое уравнение будет таким:
Для создания молекулы воды, показанной выше, химическое уравнение будет таким:
2H + O → H 2 O
Примером простой химической реакции является расщепление молекул перекиси водорода, каждая из которых состоит из двух атомов водорода, связанных с двумя атомами кислорода (H 2 O 2 ). Реагент перекись водорода распадается на воду, содержащую один атом кислорода, связанный с двумя атомами водорода (H 2 O), и кислород, который состоит из двух связанных атомов кислорода (O 2 ). В приведенном ниже уравнении реакция включает две молекулы перекиси водорода и две молекулы воды. Это пример сбалансированное химическое уравнение , в котором число атомов каждого элемента одинаково в каждой части уравнения. Согласно закону сохранения материи, число атомов до и после химической реакции должно быть одинаковым, так что при нормальных условиях ни один атом не образуется и не разрушается.
2H 2 O 2 (перекись водорода) → 2H 2 O(вода) + O 2 (кислород)
Несмотря на то, что все реагенты и продукты этой реакции являются молекулами (каждый атом остается связаны по крайней мере с одним другим атомом), в этой реакции только перекись водорода и вода являются представителями подкласса молекул, известного как соединения : они содержат атомы более чем одного типа элемента. С другой стороны, молекулярный кислород, как показано на рисунке 2, состоит из двух атомов кислорода, связанных двойной связью, и классифицируется не как соединение, а как элемент.
С другой стороны, молекулярный кислород, как показано на рисунке 2, состоит из двух атомов кислорода, связанных двойной связью, и классифицируется не как соединение, а как элемент.
Рис. 2. Атомы кислорода в молекуле O 2 соединены двойной связью.
Некоторые химические реакции, такие как показанная выше, могут протекать в одном направлении, пока не будут израсходованы все реагенты. Уравнения, описывающие эти реакции, содержат однонаправленную стрелку и равны необратимый . Обратимые реакции — это реакции, которые могут идти в любом направлении. В обратимых реакциях реагенты превращаются в продукты, но когда концентрация продукта превышает определенный порог (характерный для данной реакции), часть этих продуктов снова превращается в реагенты; в этот момент обозначения продуктов и реагентов меняются местами. Это движение вперед и назад продолжается до тех пор, пока не установится определенный относительный баланс между реагентами и продуктами — состояние, называемое 9.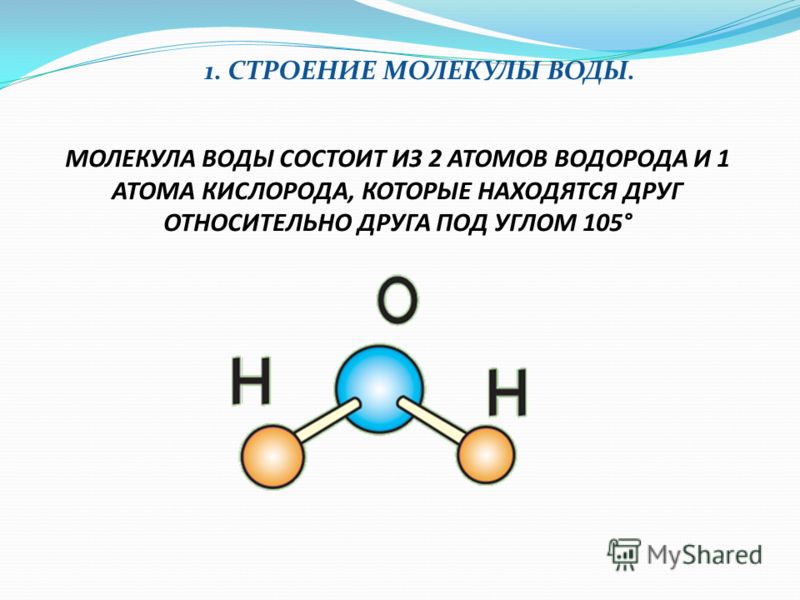 0028 равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двунаправленной стрелкой, указывающей как на реагенты, так и на продукты.
0028 равновесие . Эти ситуации обратимых реакций часто обозначаются химическим уравнением с двунаправленной стрелкой, указывающей как на реагенты, так и на продукты.
Например, в крови человека избыточные ионы водорода (H + ) связываются с ионами бикарбоната (HCO 3 – ), образуя равновесное состояние с угольной кислотой (H 2 CO 3 ). Если в эту систему добавить угольную кислоту, часть ее превратится в бикарбонат и ионы водорода.
HCO 3 – + H + ↔ H 2 CO 3
Однако в биологических реакциях равновесие достигается редко, поскольку концентрации обоих реагентов или продуктов постоянно меняются, часто или когда продукт одной реакции является реагентом для другой. Возвращаясь к примеру с избытком ионов водорода в крови, основным направлением реакции будет образование угольной кислоты. Однако угольная кислота также может покидать тело в виде углекислого газа (через выдох) вместо того, чтобы снова превращаться в ион бикарбоната, таким образом направляя реакцию вправо по химическому закону, известному как 9.