Почему вода является полярной Molecule
- Главная
- Pages
- гуманитарные науки
- география
- вопросы
- Изобразительное искусство
- Литература
- История и культура
- английский
- философия
- Языки
- испанский
- Немецкий
- мандарин
- русский
- английский как второй язык
- Французский
- японский язык
- Ресурсы
Элементы жизни. Вода — Рамблер/новости
Из чего состоят живые тела и при чем тут углерод? Что такое генетический код, кто такие вирусы, как устроено эволюционное древо и почему произошел кембрийский взрыв? Книга Сергея Ястребова «От атомов к древу: Введение в современную науку о жизни», вышедшая в издательстве «Альпина нон-фикшн» дает актуальные ответы на эти и многие другие вопросы. Публикуем главу из книги.Что такое вода?
Вода — одно из самых распространенных веществ на планете Земля. Она покрывает две трети земной поверхности, и ее очень много в живых организмах — гораздо больше, чем любого другого вещества. Подавляющее большинство биохимических реакций, то есть превращений жизненно важных молекул друг в друга, идет в растворах, где вода является растворителем. Воды много и в космосе — например, в кометах, в недрах Урана и Нептуна или в межзвездных туманностях. В целом можно сказать, что вода — это одно из самых распространенных веществ не только на Земле, но и вообще во Вселенной. Иное дело, что далеко не на всех планетах она встречается в жидком виде (Земля — единственная планета Солнечной системы, на поверхности которой есть постоянно существующие водоемы). Так или иначе, неудивительно, что именно вода послужила средой для всем нам знакомой жизни.
Что же такое вода с точки зрения химии? Это весьма простая молекула, состоящая всего лишь из двух атомов водорода (H) и одного атома кислорода (O). Соответственно, химическая формула воды — h3O. Каждый атом водорода соединен с атомом кислорода одной ковалентной связью, в полном соответствии с валентностью кислорода, которая (как мы помним) равна двум. Формулу воды можно записать и так: H–O–H. Это эквивалентно формуле 2 которую обычно приводят в книгах.
Многие свойства воды объясняются тем, что ее молекулы исключительно хорошо «слипаются» друг с другом. Например, на поверхности водоема они образуют пленку, по которой клопы-водомерки, отнюдь не микроскопические существа, бегают как посуху. Другие особенности воды как вещества — прекрасная теплопроводность и высокая температура кипения (на испарение литра воды надо потратить больше энергии, чем на испарение того же объема чуть ли не любой другой жидкости). Чтобы понять, почему вода именно такова, надо присмотреться к ее молекулам повнимательнее.
Водородная связь
Начнем вот с чего. В общей химии часто встречается понятие «электроотрицательность», введенное когда-то Лайнусом Полингом. Электроотрицательность — это сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Самый электроотрицательный элемент — фтор (F), а сразу за ним на шкале электроотрицательности следует кислород (O). Иначе говоря, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора, который в живой природе встречается очень редко. Запомним этот факт, он нам пригодится.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующая ее пара электронов никуда не смещается. Грубо говоря, эти электроны располагаются между атомами точно посредине. Такая ковалентная связь называется неполярной. Само собой разумеется, что любая ковалентная связь между одинаковыми атомами будет неполярна (например, связь в молекуле водорода H–H или углерод-углеродная связь C–C).
Если же ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого электроотрицательность выше. Такая связь называется полярной (см. рис. 1 и 2). При очень большой разнице в электроотрицательности связь может даже превратиться в ионную — это случится, если один атом полностью «отберет» общую пару электронов у другого. В молекулах, из которых состоят живые существа, ионные связи встречаются относительно редко, зато ковалентные полярные — очень часто. Например, это широко распространенные в органических веществах связи C–O и H–O.
Связь между водородом и кислородом в молекуле воды — это типичная ковалентная полярная связь. Электроотрицательность кислорода намного выше, поэтому общие лектроны смещены к нему. В результате на атоме кислорода образуется маленький отрицательный заряд, а на атомах одорода — маленькие положительные заряды. На графических формулах эти маленькие заряды, величина которых начительно меньше единицы, принято обозначать буквой «дельта» с добавлением соответствующего знака. Как мы еперь знаем, связи кислорода с водородом или углеродом ообще всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде.
А вот связь между углеродом и водородом (C–H) считается неполярной, хоть атомы и разные. И это тоже очень важно. Между атомами углерода и водорода разница в электроотрицательности настолько мала, что смещение электронов там незаметно. Например, молекулы углеводородов, состоящие только из атомов C и H, в силу этого полностью неполярны, никаких частичных зарядов, которые хоть на что-то влияли бы, в них нет.
Теперь вспомним, что положительные и отрицательные электрические заряды согласно закону Кулона притягиваются друг к другу. Например, частично отрицательный атом кислорода одной молекулы воды притягивается частично положительными атомами водорода других молекул воды. В результате между водородом и кислородом возникают нековалентные связи, основанные на электростатическом притяжении, — они называются водородными
Это очень слабые связи, в жидкой воде они легко образуются и так же легко рвутся при движениях молекул. Но, несмотря на то что водородные связи гораздо слабее ковалентных, они дают сильный эффект, если их много.
А в воде их очень много. Например, именно из-за колоссального количества водородных связей у воды исключительно высокая теплоемкость — ее трудно нагреть и трудно остудить. Большинство особенностей воды так или иначе связано с тем, что ее молекулы очень хорошо образуют водородные связи.
«Водородная связь чем-то напоминает любовь втроем», — писал в своем известном университетском учебнике американский биохимик Люберт Страйер. Он имел в виду, что в водородной связи атом водорода связан сразу с двумя атомами кислорода: с одним ковалентно (и прочно), а с другим электростатически (и слабо). Чтобы образовать водородную связь, атом водорода обязательно должен уже состоять в ковалентной связи с другим атомом, причем значительно отличающимся от него по электроотрицательности.
Водородные связи важны не только с точки зрения свойств воды. Они много где встречаются. Например, в главе 9 мы увидим, что без водородных связей невозможно представить себе структуру молекулы ДНК, от которой зависит хранение наследственной информации.
Любовь и ненависть воды
Любое вещество, растворенное в воде, так или иначе взаимодействует с ней, и способ этого взаимодействия зависит, прежде всего, от электрических свойств молекул. Например, если растворить в воде поваренную соль (NaCl), она распадется на положительно заряженные ионы натрия (Na+) и отрицательно заряженные ионы хлора (Cl–). При этом к ионам натрия молекулы воды «прилипнут» своими атомами кислорода (несущими маленький отрицательный заряд δ–), а к ионам хлора — атомами водорода (несущими маленький положительный заряд δ+). В результате и те и другие ионы получат оболочку, состоящую из молекул воды (см. рис. 3). Образование таких оболочек называется гидратацией. Ионы натрия и хлора находятся в воде в гидратированном состоянии. Гидратация — процесс, сопутствующий растворению в воде любого вещества (если оно вообще в ней растворимо, конечно).
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы (см. главу 1). Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кисло— рода обычно образуются водородные связи. Например, молекула глюкозы (C6h22O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины. В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно (см. главы 3, 5, 6). Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям, прежде всего, в виде углекислого газа, который мы выдыхаем. Но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы: например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых «суперземлях» — планетах с массой, в несколько раз превосходящей массу Земли. Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (Nh4). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода — ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт, или метанол (Ch4OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем: вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Зем— ля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
Наконец, еще один кандидат на роль подходящего для жизни гидрофильного растворителя — сероводород, соединение водорода и серы с формулой h3S (она же H–S–H). Молекула сероводорода очень похожа на молекулу воды. Правда, водородные связи она образует несколько хуже. В Солнечной системе сероводорода много на Ио — спутнике Юпитера, который отличается невероятной геологической активностью. Поверхность Ио покрыта вулканами, выбрасывающими фонтаны лавы, а состоит эта лава в основном из разнообразных соединений серы, которые текут и застывают, ибо в системе Юпитера очень холодно. Ио — это настоящий «мир льда и пламени».
Если бы на Ио была жизнь, она вполне могла бы быть основана на сероводороде, точно так же, как земная жизнь — на воде.
А может ли среда для жизни оказаться не гидрофильной, а гидрофобной? Исключить такое в принципе нельзя. Например, на крупнейшем спутнике Сатурна — Титане — есть угле— водородные озера и даже моря, состоящие из метана (Ch5), этана (C2H6) и пропана (C3H8). Это настоящий гидрофобный растворитель, в котором некоторые ученые допускают существование жизни, хотя прямых подтверждений этому пока что нет. Жидкой воды на поверхности Титана не бывает, там слишком холодно.
В целом, однако, сейчас кажется более вероятным, что главный растворитель для внеземной жизни окажется гидрофильным (но не обязательно водой). Во-первых, гидрофильных растворителей в природе просто больше. А во-вторых, все известные биохимические механизмы слишком уж сильно «заточены» под гидрофильную среду. Биохимию на гидрофобной основе вообразить гораздо труднее.
Из совсем уж экзотических альтернатив воде можно назвать, к примеру, фтороводород (HF, «аш-фтор»). Водный раствор фтороводорода — очень агрессивное вещество, которое называется плавиковой кислотой (в сериале «Во все тяжкие», главный герой которого — химик, ставший преступником, этой кислотой растворяют трупы). Однако многие органические молекулы, например углеводороды, в ней совершенно стабильны. К тому же фтороводород прекрасно образует водородные связи, а это, как мы уже знаем, очень важное для растворителя свойство. Возможность фтороводородной жизни допускали некоторые ученые, например астроном Карл Саган. А в фантастической повести Ивана Ефремова «Сердце Змеи» описана планета с фтороводородным океаном и дышащими фтором разумными жителями, с которыми земляне вступают в контакт. «Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…» Великий популяризатор науки Айзек Азимов — кстати говоря, биохимик по научной специальности — не раз задумывался над тем, из каких веществ могли бы образоваться океаны на других планетах. Он назвал такие вещества термином «талассогены», что буквально значит «производящие море». По определению Азимова, талассоген — это вещество, способное сформировать планетарный океан. В замечательной книге «Асимметрия жизни» Азимов подробно разбирает проблему океанов, приходя к выводу, что самые вероятные талассогены — это вода, аммиак и метан. При этом для планет, расположенных примерно на таком расстоянии от звезд, как Земля, вода имеет преимущество, потому что она остается жидкой при более высокой температуре. «Вы можете представить метановые океаны на такой планете, как Нептун, или аммиачные океаны на планете типа Юпитера, однако вода, и только вода может создать океан на внутренней планете вроде Земли». Это выглядит логичным, но тут есть по меньшей мере один важный нюанс. Азимов писал эту книгу больше 40 лет назад, когда о планетах других звездных систем не было известно совершенно ничего. Не было даже уверенности, что они вообще существуют. А сейчас астрономам известны тысячи экзопланет, и уже ясно, что, мягко говоря, далеко не все звездные системы похожи на Солнечную. Сочетания условий там могут быть совершенно другими. Поэтому от расширения списка возможных вариантов вреда, скорее всего, не будет.Возвращаясь к земной (а вернее, водной) биохимии, будем иметь в виду, что она — не единственная теоретически возможная. Изучая природу, всегда полезно помнить люби— мую мысль Станислава Лема: «Среди звезд нас ждет Неизвестное».
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс. Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
Полярная молекула — вода — Большая Энциклопедия Нефти и Газа, статья, страница 1
Полярная молекула — вода
Cтраница 1
Полярная молекула воды в известной степени подобна магнитику. Если встряхнуть в мешке кучу магнитиков и высыпать их из мешка на пол, магнитики не рассыплются, а вывалятся из мешка сплошным комом, так как притянутся друг к другу своими противоположными полюсами. Сходным образом объясняется и относительно слабая испаряемость воды. [1]
Полярные молекулы воды притягивают друг друга достаточно сильно, чтобы можно было говорить о существовании настоящей связи между отдельными молекулами воды, связи, которой дали специальное название — водородная связь, или Н — связь ( фиг. [2]
Полярные молекулы воды сольватируют ионы растворенного вещества. [3]
Полярные молекулы воды энергично сорбируются на кристаллической решетке цеолита вследствие ион-дипольного взаимодействия и группируются прежде всего вокруг катионов. По данным рентгеноструктурных исследований Тейлора [31, 32] ион натрия в кристаллической решетке цеолитов окружен двумя молекулами воды, окружение иона кальция менее определенно, в некоторых структурах это окружение составляет три молекулы воды. В элементарной ячейке слнтетического цеолита 5А при полном замещении ионов натрия на ионы кальция имеется шесть ионов кальция. И в том и другом случае, если исходить из соотношения числа молекул воды и катионов по Тейлору, в первом слое водяной оболочки, выстилающей поверхность сорбционной полости, содержится приблизительно 18 — 20 молекул воды, что составляет 19 — 20 % от веса элементарной ячейки. [5]
Полярные молекулы воды и спирта легко проникают в полости цеолитов, сорбируются всеми цеолитами вследствие существенного ион-дипольного взаимодействия. [7]
Полярные молекулы воды диаметром 2 6 А энергично адсорбируются синтетическими цеолитами, поэтому последние являются высокоэффективными осушителями. Равновесная адсорбционная емкость и динамическая активность по водяным парам цеолита значительно выше, чем у силикагеля и алю-могеля, особенно при низких концентрациях влаги в атмосферном воздухе. Свойства цеолитов позволяют производить многократные ( до 100 — 150) циклы адсорбция — дегенерация без, существенного снижения их адсорбционных параметров. [9]
Полярные молекулы воды с критическим диаметром молекулы, равным 2.6 А, свободно проникают через окна в полости изучаемых цеолитов. [11]
Полярные и неполярные молекулы
Полярные и неполярные молекулы в органической химии
Полярные и неполярные молекулы. Во всякой молекуле имеются как положительно заряженные частицы — ядра атомов, так и отрицательно заряженные — электроны. Для каждого рода частиц (или, вернее, зарядов) можно найти такую точку, которая будет являться как бы их «электрическим центром тяжести». Эти точки называются полюсами молекулы. Если в молекуле электрические центры тяжести положительных и отрицательных зарядов совпадут, то молекула будет неполярной. Таковы, например, молекулы Н2, N2, образованные одинаковыми атомами, у которых общие пары электронов в равной мере принадлежат обоим атомам, а также многие симметрично построенные молекулы с атомной связью, например метан СН4, четыреххлористый углерод ССl4. Но если молекула построена несимметрично, например состоит из двух разнородных атомов, то, как мы уже говорили, общая пара электронов может быть в большей или меньшей степени смещена в сторону одного из атомов. Очевидно, что в этом случае, вследствие неравномерного распределения положительных и отрицательных зарядов внутри молекулы, их электрические центры тяжести не совпадут и получится полярная молекула (рис. 32).
Полярные молекулы являются диполями. Этим термином обозначают вообще всякую электронейтральную систему, т. е. систему, состоящую из положительных и отрицательных зарядов, распределенных таким образом, что их электрические центры тяжести не совпадают.
Полярность молекул
Молекулы, которые образованы атомами одного и того же элемента, как правило, будут неполярными, как неполярны и сами связи в них. Так, молекулы Н2, F2, N2 неполярны.
Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы.
Если форма симметрична, то молекула неполярна (BeH2, BF3, CH4, CO2, SO3), если асимметрична (из-за наличия неподелённых пар или неспаренных электронов), то молекула полярна (NH3, H2O, SO2, NO2).
При замене одного из боковых атомов в симметричной молекуле на атом другого элемента также происходит искажение геометрической формы и появление полярности, например в хлорпроизводных метана CH3Cl, CH2Cl2 и CHCl3 (молекулы метанаCH4 неполярны).
Полярность несимметричной по форме молекулы вытекает из полярности ковалентных связей между атомами элементов с разной электроотрицательностью.
Как отмечалось выше, происходит частичный сдвиг электронной плотности вдоль оси связи к атому более электроотрицательного элемента, например:
Bδ+ →Fδ−
Cδ− ←Hδ+
Nδ− ←Hδ+
(здесь δ — частичный электрический заряд на атомах).
Чем больше разность электроотрицательностей элементов, тем выше абсолютное значение заряда δ и тем более полярной будет ковалентная связь.
Химическая полярность — Chemical polarity
«Полярная молекула» и «Неполярная» перенаправлять здесь. Для других видов использования термина «Polar», см Polar . Молекула воды , обычно используемый пример полярности. Два обвинения присутствуют с отрицательным зарядом в середине (красный оттенок), и положительный заряд на концах (синий оттенок).
Молекула воды , обычно используемый пример полярности. Два обвинения присутствуют с отрицательным зарядом в середине (красный оттенок), и положительный заряд на концах (синий оттенок).В химии , полярность является разделением электрического заряда , ведущего к молекуле или ее химическим группам , имеющим электрический дипольный момент , с отрицательно заряженным концом и положительно заряженным концом.
Полярные молекулы должны содержать полярные связи из — за разницы в электроотрицательности между связанными атомами. Полярная молекула с двумя или более полярными связями должна иметь геометрию , которая является асимметричной по меньшей мере в одном направлении, так что диполи облигаций не компенсируют друг друг.
Полярные молекулы взаимодействуют через диполь-дипольные межмолекулярные силы и водородные связи . Полярность лежит в основе ряда физических свойств , включая поверхностное натяжение , растворимость и плавления и кипения.
Полярность облигаций
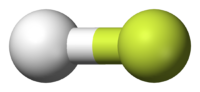
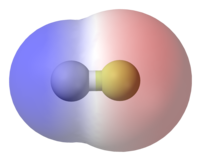 В молекуле фтористого водорода (HF), тем более электроотрицательный атом ( фтор ) показан в желтом цвете. Поскольку электроны тратить больше времени на атоме фтора в Н-F связи, красный представляет собой частично отрицательно заряженные области, в то время как синие представляет собой частично положительно заряженные области.
В молекуле фтористого водорода (HF), тем более электроотрицательный атом ( фтор ) показан в желтом цвете. Поскольку электроны тратить больше времени на атоме фтора в Н-F связи, красный представляет собой частично отрицательно заряженные области, в то время как синие представляет собой частично положительно заряженные области.Не все атомы притягивать электроны с той же силой. Количество «тянуть» атом оказывает на его электронов называется его электроотрицательность . Атомы с высокой электроотрицательности — таких , как фтор , кислород и азот — оказывать большее притяжение электронов , чем на атомах с более низким электроотрицательности , таких как щелочные металлы и щелочно — земельных металлов . В связи, это приводит к неравному распределению электронов между атомами, так как электроны будут нарисованы ближе к атому с более высокой электроотрицательностью.
Поскольку электроны имеют отрицательный заряд, неравное распределение электронов в связи приводит к образованию электрического диполя : разделение положительного и отрицательного электрического заряда. Поскольку количество заряда , отделенной в таких диполей, как правило , меньше , чем фундаментальный заряд , они называются частичные заряды , обозначенные как δ + ( дельта плюс) и дельта (пишется б минус). Эти символы были введены Кристофера Kelk Ингольдом и Эдит Hilda Ингольдом в 1926 году Связь дипольный момент вычисляется путем умножения количества заряда , разделенных и расстояние между зарядами.
Эти диполи внутри молекулы могут взаимодействовать с диполей в других молекулах, создавая диполь-дипольные межмолекулярные силы .
классификация
Облигации могут упасть между одной из двух крайностей — будучи полностью неполярными или полностью полярными. Полностью неполярная связь происходит , когда электроотрицательности являются идентичными и , следовательно , обладают разностью нуля. Полностью полярная связь более правильно называется ионной связи , и происходит , когда разница между электроотрицательностью является достаточно большой , что один атом на самом деле принимает электрон от других. Термины «полярные» и «неполярные», как правило , применяется к ковалентные связи , то есть, облигации , где полярность не является полным. Для того, чтобы определить полярность ковалентной связи с использованием численных средств, используется разница между электроотрицательностью атомов.
Полярность Бонд , как правило , разделена на три группы, которые свободно на основе разницы в электроотрицательности между двумя связанными атомами. Согласно шкале Полинга :
- Неполярные облигации , как правило , происходит , когда разница в электроотрицательности между двумя атомами составляет менее 0,5
- Полярные связи обычно возникают , когда разница в электроотрицательности между двумя атомами составляет примерно от 0,5 до 2,0
- Ионные связи обычно возникаюткогда разница в электроотрицательности между двумя атомами большечем 2,0
Полинга на основе этой схему классификации на частичной ионности облигации, которая является приближенной функцией разности в электроотрицательности между двумя связанными атомами. По его оценкам, разница в 1,7 соответствует 50% ионности, так что большая разница соответствует связям , которая является преимущественно ионной.
В качестве квантово-механического описания, Полинг предложил , что волновая функция для полярной молекулы АВ является линейной комбинацией волновых функций для ковалентных и ионных молекул: ψ = aψ (А: В) + bψ (A + B — ). Количество ковалентных и ионного характера , зависит от значений коэффициентов квадрат на 2 и б 2 .
Полярность молекул
Несмотря на то , что молекулы могут быть описаны как «полярной ковалентной», «неполярной ковалентной», или «ионно», часто это относительный термин, с одной молекулой просто быть более полярным или более неполярный , чем другой. Тем не менее, следующие свойства являются типичными для таких молекул.
Молекула состоит из одного или нескольких химических связей между молекулярными орбиталями различных атомов. Молекула может быть полярной либо в результате полярных связей из — за различия в электроотрицательности , как описано выше, или в результате асимметричного расположения неполярных ковалентных связей и не-связывающих пары электронов , известных как полные молекулярных орбитали .
Полярные молекулы
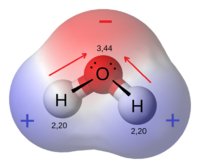 Молекула воды состоит из кислорода и водорода, с соответствующими электроотрицательность 3.44 и 2.20. Разность электроотрицательности поляризует каждый Н-О-связь, сдвигая свои электроны к кислороду (показано красными стрелками). Эти эффекты добавляют в качестве векторов, чтобы общая молекула полярных.
Молекула воды состоит из кислорода и водорода, с соответствующими электроотрицательность 3.44 и 2.20. Разность электроотрицательности поляризует каждый Н-О-связь, сдвигая свои электроны к кислороду (показано красными стрелками). Эти эффекты добавляют в качестве векторов, чтобы общая молекула полярных.Полярная молекула имеет чистый диполь в результате противоположные зарядов (то есть имеющие частичные положительные и отрицательные заряды частичных) из полярных связей , расположенные асимметрично. Вода (Н 2 О) представляет собой пример полярной молекулы , поскольку она имеет небольшой положительный заряд на одной стороне и небольшой отрицательный заряд на другом. Диполи не отменяют в результате чего чистый диполя. Из — за полярную природу самой молекулы воды, полярные молекулы , как правило , способны растворить в воде. Другие примеры включают сахара (такую как сахароза ), которые имеют много полярной кислород водород (-ОН) группы , и которые в целом весьма полярные.
Если связь дипольных моментов молекулы не отменяют, молекула полярная. Например, молекула воды (Н 2 О) содержит две полярные связи О-Н в виде изогнутой (нелинейной) геометрии. Облигация дипольных моменты не отменяют, так что молекула образует молекулярный диполь с отрицательным полюсом в кислороде и его положительный полюс на полпути между двумя атомами водорода. На рисунке каждая связь соединяет центральный атом O с отрицательным зарядом (красный) до атома Н с положительным зарядом (синий).
 Молекулы аммиака, NH 3 , является полярным в результате его молекулярной геометрии. Красный представляет собой частично отрицательно заряженные области.
Молекулы аммиака, NH 3 , является полярным в результате его молекулярной геометрии. Красный представляет собой частично отрицательно заряженные области.Фтористый водород , ВЧ, молекула полярная силу полярных ковалентных связей — в ковалентных связей электроны смещены в сторону более электроотрицательным атомом фтора. Аммиак , NH 3 , молекуле три NH облигации имеют лишь незначительную полярность ( по направлению к более электроотрицательным атомом азота). Молекула имеет два одиночки электронов в орбитальном, что указует на четвертую вершину тетраэдра, приближенного ( VSEPR ). Это орбитальное не участвует в ковалентной связи; это электронно-богатые, что приводит к мощному диполя через молекулу аммиака в целом.
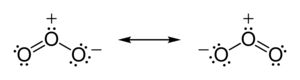
В озона (O 3 молекул), два О-O связей являются неполярными (нет никакой разницы электроотрицательности между атомами одного и того же элемента). Тем не менее, распределение других электронов происходит неравномерно — так как центральный атом должен делить электроны с двумя другими атомами, но каждый из внешних атомов должен делить электроны только с одним другим атомом, центральный атом более лишен электронов , чем другие (центральный атом имеет формальный заряд +1, тогда как внешние атомы каждый имеет формальный заряд — 1 / 2 ). Так как молекула имеет изогнутую геометрию, в результате диполь по всей молекуле озона.
При сравнении полярной и неполярной молекулы с подобными молярными массами, полярные молекулы в целом имеют более высокую температуру кипения, так как диполь-дипольное взаимодействие между полярными молекулами приводят к более сильным межмолекулярным достопримечательностям. Одной из распространенных форм полярного взаимодействия является водородной связью , который также известен как Н-связь. Например, вода образует Н-связь и имеет молекулярную массу M = 18 и температуру кипения 100 ° С, по сравнению с неполярным метаном с М = 16 и точкой кипения -161 ° C.
неполярные молекулы
Молекула может быть неполярной , либо когда существует равное распределение электронов между двумя атомами двухатомной молекулы или из-за симметричное расположение полярных связей в более сложной молекуле. Так , например, трифторид бора (BF 3 ) имеет плоскую треугольную расположение трех полярных связей на 120 °. Это приводит к отсутствию общего диполя в молекуле.
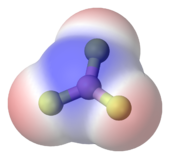 В молекуле трифторида бора , тригональное плоское расположение трех полярных связей не приводит к общему диполя.
В молекуле трифторида бора , тригональное плоское расположение трех полярных связей не приводит к общему диполя. 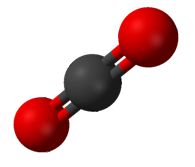 Двуокись углерода имеет два полярных CO связей в линейной геометрии.
Двуокись углерода имеет два полярных CO связей в линейной геометрии.Не каждая молекула с полярными связями является полярной молекулой. Диоксид углерода (СО 2 ) имеет два полярных C = O связей, но геометрия СО 2 является линейной , так что две дипольные моменты связей отменить и нет никакого чистого молекулярного дипольного момента; молекула неполярная.
 В метана , облигации располагаются симметрично (в тетраэдрическом устройстве) , так что нет общего дипольного.
В метана , облигации располагаются симметрично (в тетраэдрическом устройстве) , так что нет общего дипольного.Примеры бытовых неполярных соединений включают жиры, нефть и бензин / бензин. Таким образом, большинство неполярных молекул нерастворим в воде ( гидрофобный ) при комнатной температуре. Многие неполярные органические растворители , такие как скипидар , способны растворять неполярные вещества.
В метановых молекулах (CH 4 ) четыре CH связи расположены тетраэдрический вокруг атома углерода. Каждая облигация имеет полярность (хотя и не очень сильно). Тем не менее, облигации расположены симметрично таким образом , нет никакого полного дипольный в молекуле. Двухатомный кислород молекула (O 2 ) не имеет полярности в ковалентной связи из — за одинаковую электроотрицательность, следовательно , нет никакой полярности в молекуле.
амфифильных молекул
Большие молекулы , которые имеют один конец с полярными группами , присоединенными , а другой конец с неполярными группами описаны как амфифильных или амфифильных молекул. Они являются хорошими поверхностно -активными веществами и могут способствовать образованию стабильных эмульсий, или смеси, воды и жиров. Поверхностно снижают поверхностное натяжение между нефтью и водой путем адсорбции на границе раздела жидкость-жидкость.
-

Эта амфифильная молекула имеет несколько полярных групп ( гидрофильный , влаголюбивый ) на правой стороне и длинная неполярная цепь ( липофильный , жир любя ) на левой стороне. Это дает ему поверхностно -активные свойства
-

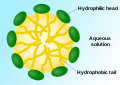
Мицеллы — то липофильные концы молекул поверхностно -активного вещества растворяются в масле, в то время как гидрофильные заряженные концы остаются вне в водной фазе, защищая остальную часть гидрофобного мицеллы. Таким образом, небольшие капли масла становится растворимым в воде.
-

Фосфолипиды являются эффективными природным поверхностно -активным, которые имеют важные биологические функции
Предсказание молекулы полярности
Определение группы точек является полезным способом предсказать полярность молекулы. В общем, молекула не будет обладать дипольным моментом, если отдельные связи дипольных моментов молекулы компенсируют друг друга. Это происходит потому , что дипольные моменты евклидовы векторные величины с величиной и направлением, а две равные векторы , которые выступают против друг друга сведет.
Любая молекула с центром инверсии ( «I») или горизонтальной плоскостью зеркала ( «σ ч ») не будет обладать дипольным моментом. Кроме того, молекула с более чем одним C п оси не будет обладать дипольным моментом , потому что дипольные моменты не могут лежать в более чем одном измерении . Как следствие этого ограничения, все молекулы с D симметрией ( символы шёнфлиса ) будут, следовательно, не имеют дипольный момент , так как , по определению, точечные группы D имеют два или несколько С н оси.
Так как C 1 , C s , С ∞h С п и С п V группы точек не имеют центра инверсии, горизонтальных плоскостей зеркальной или множественной С н оси, молекулы в одной из этих групп точек будут иметь дипольный момент.
Электрическое отклонение воды
Вопреки распространенному заблуждению, электрическое отклонение потока воды из заряженного объекта не основана на полярности. Отклонение происходит из-за электрически заряженных капель в потоке, который индуцирует заряженный объект. Поток воды также может быть отклонен в однородном электрическом поле, которое не может оказывать усилие на полярных молекул. Кроме того, после того, как поток воды заземлен, он больше не может быть отклонен. Слабое отклонение возможно даже для неполярных жидкостей.
Смотрите также
Рекомендации
внешняя ссылка
Полярность молекулы, влияние на растворимость в воде
Низкая растворимость неполярных газов (Не, Ne, Нг, СН ) в воде объясняется высокими критическими температурами этих газов. Высокая растворимость в воде сероводорода объясняется не только полярностью молекул растворителя и растворяемого газа, но и химическим взаимодействием H S + HjO = НЮ+ + HS». На растворимость газов в жидкостях оказывает влияние природа растворителя. Ниже приведены коэффициенты поглощения азота различными растворителями при 298 К. [c.382]Из-за полярности связи кислород — водород молекулы спиртов полярны. Низшие спирты хорошо растворимы в воде, однако по мере увеличения числа атомов углерода в углеводородном радикале влияние гидроксидной группы на свойства уменьшается и растворимость спиртов в воде понижается. Молекулы спиртов ассоциированы из-за образования водородных связей между ними, поэтому температуры их кипения выше температур кипения соответствующих углеводородов. [c.307]
На растворимость веществ в жидкости оказывают влияние природа растворителя и растворяемого вещества, температура, а для газов и давление. Природа растворяемого вещества определяется видом химической связи в его молекулах. Межмолекулярное взаимодействие полярных молекул воды с ионами или полярными молекулами растворяемого вещества сводится к взаимодействию диполей воды с ионами или диполями растворяемого вещества. Если молекулы растворяемого вещества неполярны, то растворимость его в воде будет ограниченной или. оно совсем не будет рас- [c.93]
Водородная связь играет большую роль в процессах растворения, так как растворимость зависит и от способности вещества давать водородные связи с растворителем. Например, сахар, молекулы которого имеют много ОН-групп, способных образовывать водородные связи, очень хорошо растворим в воде. Наоборот, отсутствием влияния водородной связи можно объяснить те случаи, когда полярные соединения не растворимы в воде. Так, полярный иодистый этил хорошо растворяет неполярный нафталин, а сам не растворяется в таком полярном растворителе, как вода. [c.134]
В ароматических соединениях сказывается сильное влияние V/ на полярность молекулы эффекта сопряжения, которое отражается на энергии диполь-дипольного взаимодействия молекул ароматического соединения с водой и на энергии водородной связи между водой и этими молекулами. Так, оттягивание электронной плотности из бензольного кольца молекулы фенола на введенную в кольцо нитрогруппу вызывает повышение эффективного положительного заряда на атоме кислорода и приводит вследствие этого к ослаблению водородной связи между фенольной группой и молекулами воды. В результате этого растворимость нитрофенола меньше растворимости фенола в 10 раз. [c.12]
Ввиду значительной полярности группы ОН, у молекул углеводородов, содержащих гидроксильную группу, наблюдается заметная полярность. В табл. 24.6 указана растворимость различных спиртов в воде при комнатной температуре. У спиртов с низкой молекулярной массой наличие группы ОН оказывает больщое влияние на их физические свойства. Однако по мере возрастания длины углеводородной цепочки группа ОН оказывает все меньшее влияние на свойства вещества (см. также разд. 12.3, [c.428]
Зависимость растворимости органических веществ от температуры определяется прежде всего влиянием молекул этих веществ на прочность структуры воды. При растворении ароматических углеводородов, а также производных бензола с гидрофобными полярными заместителями влияние их молекул на кластер- [c.12]
Характерным свойством ионизированных соединений является их растворимость в воде. Ковалентные соединения обычно растворяются в воде плохо, однако они хорошо растворимы в неполярных растворителях бензине, бензоле, четыреххлористом углероде. Растворимость в воде сильных кислот, щелочей и солей объясняется сольватацией их ионов полярными молекулами растворителя под. влиянием ионных зарядов. [c.34]
Принцип независимости поверхностного действия- [4]. Принцип состоит в том, что силовое поле вокруг полярной группы молекулы или неполярной углеводородной части не зависит от остальной ее части Это означает, что в дифильных молекулах действует какая-либо одна часть молекулы, оказывая решающее влияние на изменение поверхностных свойств. Так, смешивая уксусную кислоту с водой, мы можем говорить о парциальной растворимости в воде группы СООН. Группа СНз взаимодействовать не будет. Наоборот, при смешении более высокомолекулярно [c.32]
Образование мицелл НПАВ в водных растворах определяется, в основном, силами когезии углеводородных цепей молекул и сродством гидрофильных групп к молекулам воды в случае ионных ПАВ — когезией гидрофобных групп и балансом электрических сил ионизированных групп молекулы. В водных растворах молекулы ПАВ находятся в строго ориентированном состоянии таким образом, что гидрофобные части молекул располагаются центрально друг к другу, а гидрофильные — по отношению к полярному растворителю. В этом случае возникают возможности к образованию ассоциированных соединений. Как правило, мицеллы ПАВ и других ВВ имеют большие коллоидные размеры (40-500 А°), состоят из большого числа молекул (до 200) и обладают большой объемной емкостью, т.е. имеют пустоты. Кроме того, относительно небольшие промежуточные пространства могут возникать при набухании в воде плохо растворимых макромолекул ВВ. В эти пустоты мицелл или промежуточные пространства скоплений макромолекул под влиянием сил межмолекулярного притяжения могут проникать относительно небольшие молекулы ЛВ, образуя соединения, которые очень часто стабилизируются дополнительными побочными валентными силами. Количество включаемого ЛВ зависит от размеров полого пространства мицеллы и молекулы действующего вещества. [c.393]
Разделяющий агент изменяет условия фазового равновесия жидкость — пар в желаемом направлении. Прибавленная в раствор соль существенным образом изменяет сложный характер различных видов взаимодействия системы. Наиболее важными факторами, определяющими влияние соли на фазовое равновесие жидкость — пар, являются гидратация ионов и их электростатические характеристики. Заметную роль играют также растворимость веществ, свойства и состав разделяемой смеси. В результате действия прибавляемой соли происходит увеличение парциального дав
От чего зависит полярность молекулы » HimEge.ru
Когда молекула образована неполярными связями, она сама в целом тоже неполярна. Вообще, только одинаковые атомы образуют между собой совершенно неполярные ковалентные связи. В противном случае имеется хотя бы небольшое различие в электроотрицательностях, и ковалентная связь оказывается полярной. Таким образом, связи Н—Н и С—С — неполярные, а такие связи, как С=О, С—Сl и О—Н — полярные ковалентные связи.
Если же связи полярны, то полярность молекулы определяется ее формой (геометрией). Например, диоксид углерода СO2 представляет собой линейную молекулу (угол между связями 180°). Поэтому, хотя каждая связь из-за различия в электроотрицательностях полярна, молекула в целом неполярна:
Строение молекулы СO2
Концы молекулы заряжены отрицательно, а центр положительно. Полярности обеих связей компенсируют друг друга, поэтому молекула неполярна.
В отличие от молекулы СО2 молекула воды имеет изогнутую форму, представляя собой треугольник. Угол между связями Н —О составляет 105 . Атом кислорода несет частичный отрицательный заряд, а атомы водорода — частичный положительный,и в целом молекула воды полярна:
Полярность молекулы воды
Строение молекулы воды