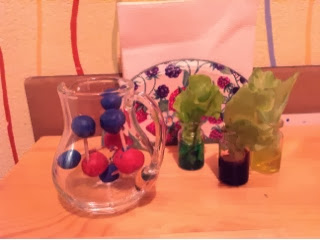Молекула воды из пластилина: фото — VilingStore
[h3]
Молекула воды[/h3]
С водой связана вся жизнь человека – от самого зарождения и до смерти. Вода – это одно из самых первых веществ, которое начинает изучать маленький исследователь – в ванне, луже и даже на кухонном столе. Ее уникальные свойства испаряться, замерзать, таять (плавиться) привлекает умы деток постарше.
Но о том, почему так происходит и из чего состоит хорошо известная вода – узнается только в старших классах школы. Однако мы склонны считать, что не стоит ждать пока познавательный интерес к этому уникальному по своим свойствам веществу начнет угасать. Ведь даже старшему дошкольнику доступны к пониманию понятия атом и молекула, тем более если их модели слепить своими собственными руками, опираясь на научные данные (с помощью взрослых).

Моделируем молекулу из пластилина
Для того чтобы смоделировать молекулу воды потребуется пластилин двух цветов и спички.
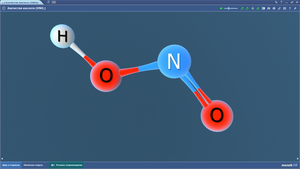
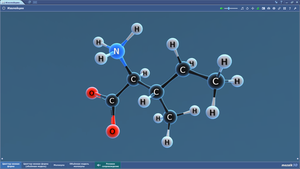
Молекула воды состоит из атомов двух элементов – водорода и кислорода
.
В Периодической системе Д.И. Менделеева эти элементы расположены под номером 1 и 8. Этот номер называется порядковым. Ниже в этой же клеточке есть еще одно число (с несколькими цифрами после запятой) – это относительная атомная масса элемента.
Для большей наглядности на кухонных электронных весах можно измерить массу пластилиновых шариков, демонстрирующих атомы этих элементов.
[h3]
Кислорода:[/h3]

и
водорода:

Заметим, что масса получившихся «атомов» по сравнению с настоящими увеличена в 1000 000 000 000 000 000 000 000 (10 в 24 степени) раз.
По размеру получилось примерно, что атом кислорода «похож» со сливу, а атом водорода – на горошину.
В молекуле воды два атома водорода и один атом кислорода располагаются достаточно близко друг к другу, но под определенным углом. Если обозначить «центр» атома кислорода точкой, приложить к нему центральную метку транспортира, то атомы водорода будут находиться по отношению друг к другу под углом 104 градуса.

В итоге у нас получилась вот такая модель молекулы воды:









Continue Reading
Как слепить молекулы из пластилина.
Многие школьники не любят химию и считают ее скучным предметом. Многим этот предмет дается с трудом. Но ее изучение может быть интересным и познавательным, если подойти к процессу творчески и показать все наглядно.
Предлагаем вам подробное руководство по лепке молекул из пластилина.
Перед изготовлением молекул нам нужно заранее определиться с тем, какие химические формулы будем использовать. В нашем случае это этан, этилен, метилен. Нам понадобятся: пластилин контрастных цветов (в нашем случае – красный и синий) и немного зеленого пластилина, спички (зубочистки).


1. Из красного пластилина скатываем 4 шарика диаметром около 2 см (атомы углерода). Затем из синего пластилина скатываем 8 шариков поменьше, диаметром около сантиметра (атомы водорода).


2. Берем 1 красный шарик и вставляем в него 4 спички (или зубочистки)так, как показано на рисунке.


3. Берем 4 синих шарика и надеваем их на свободные концы вставленных в красный шарик спичек. Получилась молекула природного газа.


4. Повторяем шаг №3 и получаем две молекулы для следующего химического вещества.


5. Сделанные молекулы нужно соединить между собой спичкой для того, чтобы получилась молекула этана.


6. Также можно создать молекулу с двойной связью — этилен. Для этого, из каждой молекулы, полученной при выполнении шага № 3 вынимаем по 1 спичке с надетым на нее синим шариком и соединяем детали между собой двумя спичками.




7. Берем красный шарик и 2 синих и соединяем их между собой двумя спичками так, чтобы получилась цепочка: синий – 2 спички – красный – 2 спички – синий. У нас получилась еще одна молекула с двойной связью – метилен.


8. Берем оставшиеся шарики: красный и 2 синих и соединяем их спичками между собой как показано на рисунке. Затем скатываем из зеленого пластилина 2 маленьких шарика и прикрепляем к нашей молекуле. У нас получилась молекула с двумя отрицательно заряженными электронами.


Изучение химии станет интереснее, а у вашего ребенка появится интерес к предмету.


Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Модель молекулы водорода из пластилина. Молекулы из пластилина
Кроме наблюдения и эксперимента, в познании естественного мира и химии большую роль играет моделирование.
Мы уже говорили о том, что одна из главных целей наблюдения — поиск закономерностей в результатах экспериментов.
Однако некоторые наблюдения неудобно или невозможно проводить непосредственно в природе. Естественную среду воссоздают в лабораторных условиях с помощью особых приборов, установок, предметов, т. е. моделей (от лат. modulus — мера, образец). В моделях копируются только самые важные признаки и свойства объекта.
Например, для того чтобы изучить природное явление молнию, ученым не нужно было дожидаться грозы. Молнию можно смоделировать на уроке физики и в школьной лаборатории. Двум металлическим шарикам нужно сообщить противоположные электрические заряды: положительный и отрицательный. При сближении шариков до определенного расстояния между ними проскакивает искра — это и есть молния в миниатюре. Чем больше заряд на шариках, тем раньше при сближении проскакивает искра, тем длиннее искусственная молния. Такую молнию получают с помощью специального прибора, который называется электрофорной машиной (рис. 33).
Рис. 33.
Электрофорная машина
Изучение модели позволило ученым определить, что природная молния — это гигантский электрический разряд между двумя грозовыми облаками или между облаками и землей. Однако настоящий ученый стремится найти практическое применение каждому изучаемому явлению. Чем мощнее электрическая молния, тем выше ее температура. А ведь превращение электрической энергии в теплоту можно использовать, например, для сварки и резки металлов. Так появился знакомый сегодня каждому учащемуся процесс электросварки (рис. 34).

Рис. 34.
Природное явление молнию можно смоделировать в лаборатории
Моделирование в физике используется особенно широко. На уроках по этому предмету вы будете знакомиться с самыми разными моделями, которые помогут вам изучить электрические и магнитные явления, закономерности движения тел, оптические явления.
Каждая естественная наука использует свои модели, которые помогают зримо представить себе реальное природное явление или объект.
Самая известная географическая модель — глобус (рис. 35, а) — миниатюрное объемное изображение нашей планеты, с помощью которого вы можете изучать расположение материков и океанов, стран и континентов, гор и морей. Если же изображение земной поверхности нанести на плоский лист бумаги, то такая модель называется географической картой (рис. 35, б).

Рис. 35.
Самые известные географические модели: а — глобус; б — карта
Широко используются модели при изучении биологии. Достаточно упомянуть, например, модели — муляжи органов человека и т. д. (рис. 36).

Рис. 36.
Биологические модели: а — гл
Молекула воды и ее состояния. Эксперименты. — молекула воды из пластилина — запись пользователя Алина (kAlinka2011) в сообществе Игры с детьми в категории Разное (если затрудняетесь с выбором)
твердое агрегатное состояние веществаВсем привет от нас с Сережей! Я реже появляюсь в блоге, но часто в инстаграме alinaland, заглядывайте!
В пятницу вечером мы с Сережиком решили заняться наукой, началось все с любимого эксперимента вулкан, который, я думаю, многие любят) но сейчас не о нем)
Мы продолжаем участвовать в проекте Марии Юнак ИГРАЕМ В ФИЗИКУ и осень началась с игр с водой.
Вода - уникальное вещество! Мы с вами гораздо больше, чем на половину состоим из воды, без воды не было бы жизни на Земле и т. д. Для начала мы поставили в окрашенную воду листики салата, что бы проследить, как пьют растения. Этот эксперимент остался на столе до утра.
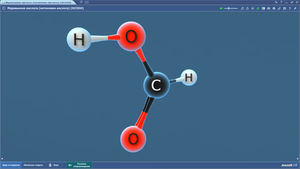
Дальше я нарисовала простенькую картинку из чего состоит вода и Сереже очень понравился кислородик с ручками, который держит 2 маленьких водородика. Молекулу воды просто сделать из пластилина и зубочисток.
Сережа очень старался, но не удержался и каждому кислороду добавил антенну.

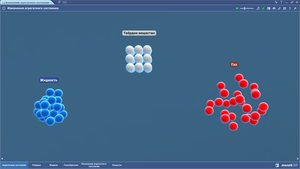
Молекулы готовы т мы перешли к агрегатным состояниям - жидкая, твердая и газообразная вода.
Во всех случаях молекула воды остается той же, но друг к другу они относятся уже по разному.
Структура льда четкая, молекулы крепко держатся за руки.
А вот паровички летят во все стороны! А еще пар умеет свистеть! Дада) нужен только чайник со свистком и ребенок удивлен и счастлив)
Ну а в жидком состоянии молекулы за руки тоже не держатся, но скучают друг по другу и просто тесняться поближе)
И еще мы провели увлекательный эксперимент с водой и свечкой! 2 таких любимых детьми вещи ОГОНЬ И ВОДА!
Здесь мы познакомились с теплоемкостью, любой горячий предмет, попадая в холодную воду, очень быстро охлаждается. Вода быстро забирает себе все тепло! Такое это уникальное вещество! Если капнуть парафин на твердую поверхность, например стола, то некоторое время парафин будет еще мягким и теплым, а в воде он моментально твердеет и остывает. И получаются очень красивые острова!
Во всех экспериментах принимают участие Древние люди и животные, потому что это Сережины любимчики сейчас) и для них мы показали эксперимент с вулканом
Запечатлеть мне его не получилось, так как я занималась уксусом, и нужен глаз да глаз!
Рецепт прост- сам вулкан - это обрезанная банка, облепленная пластилином, она крепится к одноразовой тарелке тоже пластилином. Ставим его на поднос с бортами, далее лава - уксус, сода, красная краска, капля фэйри. Все засыпаем в жерло и льем уксус! Супер быстрый, секундный, но очень впечатляющий эксперимент! Запаситесь содой и уксусом - ребенок потребует еще и еще! Можно вместо уксуса взять лимонную кислоту, но эффект будет слабее.
Выливаем лаву аккуратненько, ребенку плескаться не даем. Я это делаю в резиновых перчатках, показывая опасность) хорошо бы еще очками обзавестись для опытов.
Спасибо вам за внимание)
Мастер-класс Продолжение темы «имитация воды» Создаем волны. Макет молекулы воды своими руками фото
Молекула воды из пластилина фото — VilingStore.net
Молекула воды
С водой связана вся жизнь человека – от самого зарождения и до смерти. Вода – это одно из самых первых веществ, которое начинает изучать маленький исследователь – в ванне, луже и даже на кухонном столе. Ее уникальные свойства испаряться, замерзать, таять (плавиться) привлекает умы деток постарше.
Но о том, почему так происходит и из чего состоит хорошо известная вода – узнается только в старших классах школы. Однако мы склонны считать, что не стоит ждать пока познавательный интерес к этому уникальному по своим свойствам веществу начнет угасать. Ведь даже старшему дошкольнику доступны к пониманию понятия атом и молекула, тем более если их модели слепить своими собственными руками, опираясь на научные данные (с помощью взрослых).
Моделируем молекулу из пластилина
Для того чтобы смоделировать молекулу воды потребуется пластилин двух цветов и спички.
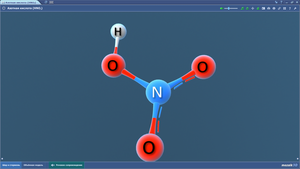
Молекула воды состоит из атомов двух элементов – водорода и кислорода
. В Периодической системе Д.И. Менделеева эти элементы расположены под номером 1 и 8. Этот номер называется порядковым. Ниже в этой же клеточке есть еще одно число (с несколькими цифрами после запятой) – это относительная атомная масса элемента. Для большей наглядности на кухонных электронных весах можно измерить массу пластилиновых шариков, демонстрирующих атомы этих элементов.Кислорода:
и
водорода:
Заметим, что масса получившихся «атомов» по сравнению с настоящими увеличена в 1000 000 000 000 000 000 000 000 (10 в 24 степени) раз.
По размеру получилось примерно, что атом кислорода «похож» со сливу, а атом водорода – на горошину.
В мо
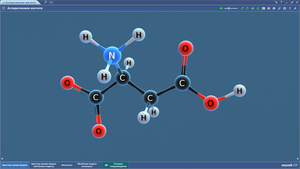
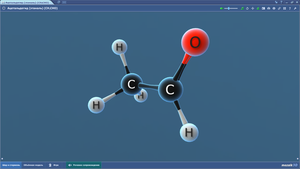
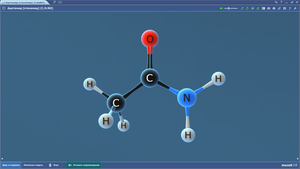
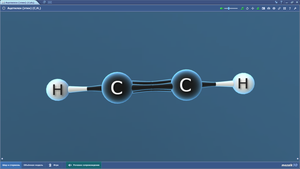
ПО «Mozaik». 3D-модели по химии
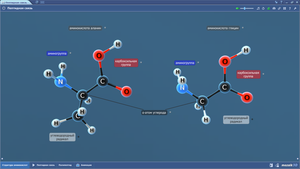
В составе программного обеспечения «Mozaik» имеются 3D-модели для изучения школьного курса химии. На 3D-моделях наглядно представлены различные химические объекты — атомы, молекулы, а также механизмы реакций.3D-модели по химии размещены в нескольких меню: неорганическая химия, общая химия, органическая химия.

Ниже представлен список. Сами 3D-модели по химии можно посмотреть на сайте mozaweb.com (в ознакомительном режиме имеются ограничения по количеству просматриваемых 3D-моделей в сутки).
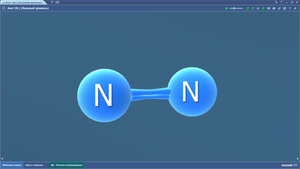
Азот
Азотистая кислота
Азотная кислота
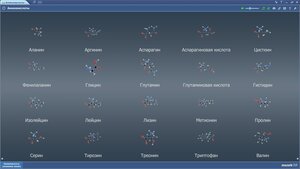
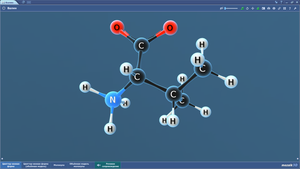
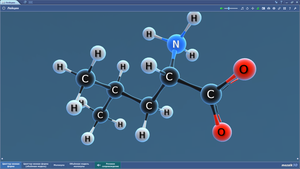
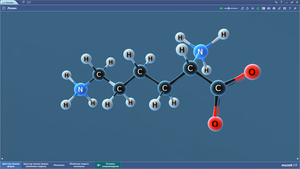
Аланин
Алканы
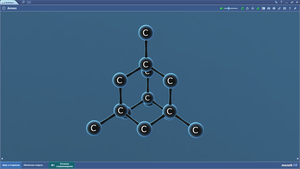
Алмаз
Альфа-D-глюкоза
Амилоза
Аминокислоты
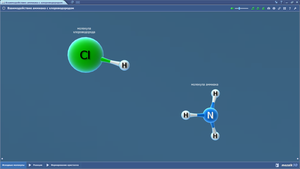
Аммиак
Анилин
Аргинин
Аспарагин
Аспарагиновая кислота
Атомные орбитали кальция

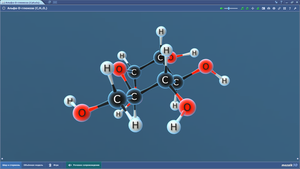
Ацетальдегид (этаналь)
Ацетамид
Ацетилен
Ацетон
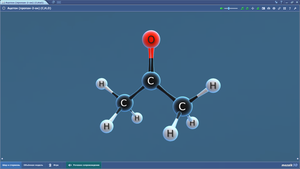
Белый фосфор

Бензойная кислота
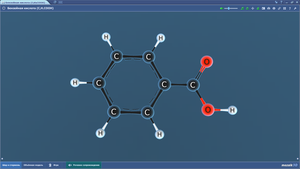
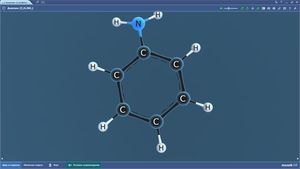
Бензол
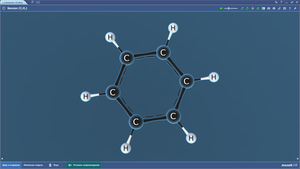
Бета-D-глюкоза
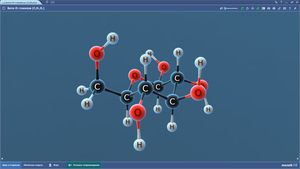
Бета-D-рибоза
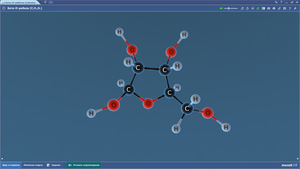
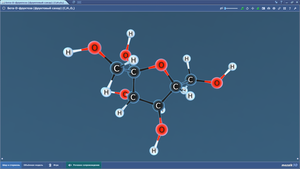
Бета-D-фруктоза
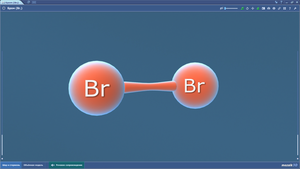
Бром
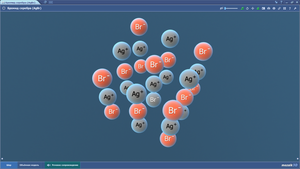
Бромид серебра
Бромоводород
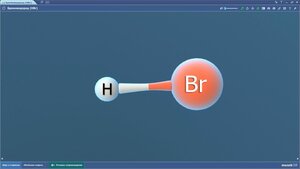
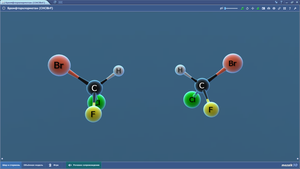
Бромфторхлорметан
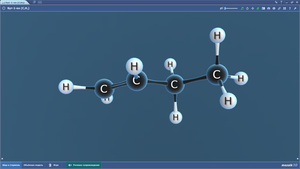
Бутан
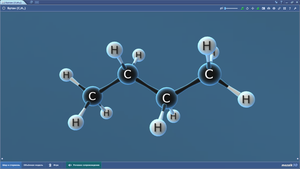
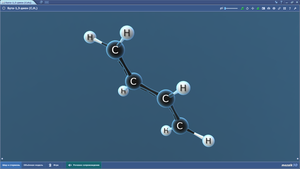
Бутадиен-1,3
Бутен-1
Валин
Взаимодействие аммиака с хлороводородом
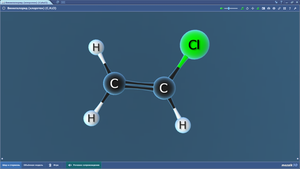
Винилхлорид
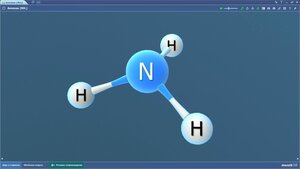
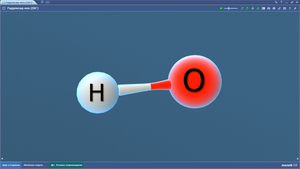
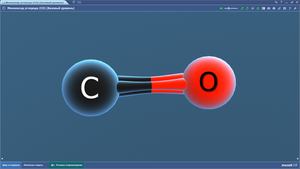
Вода
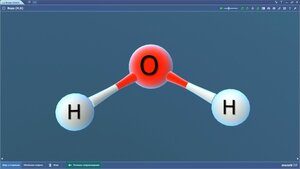
Водород

Вторичная структура белков
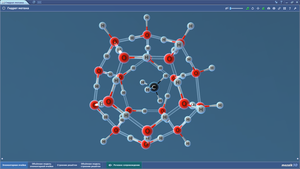
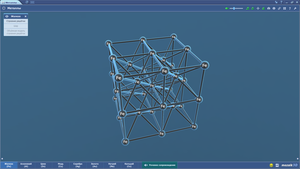
Гексагональная плотноупакованная решетка

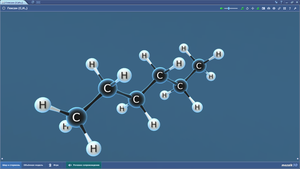
Гексан
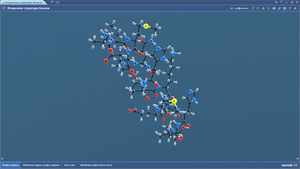
Гемоглобин

Гидрат метана
Гидрат-ион
Гипохлорит-ион
Гистидин
Глицеральдегид
Глицерин
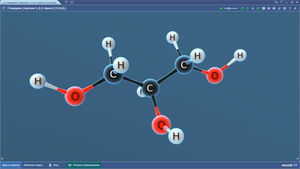
Глицилглицин
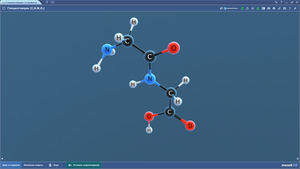
Глицин
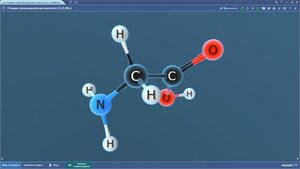
Глутамин
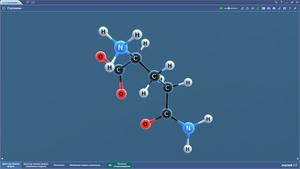
Глутаминовая кислота
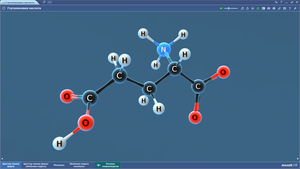
Гранецентрированная кубическая решетка

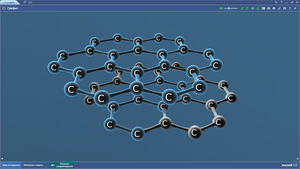
Графит
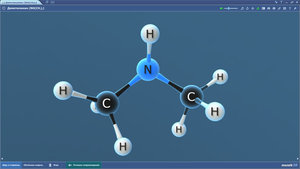
Диметиламин
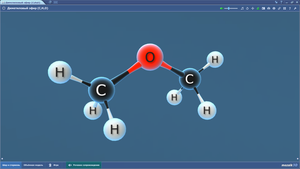
Диметиловый эфир
Диоксид азота
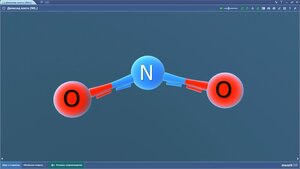
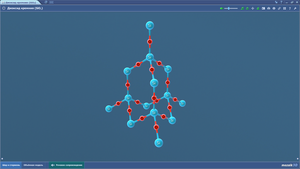
Диоксид кремния
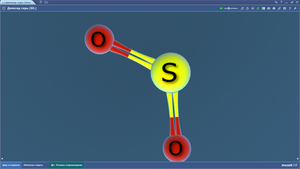
Диоксид серы
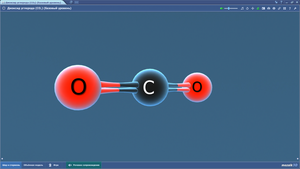
Диоксид углерода
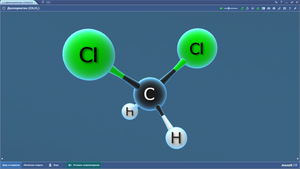
Дихлорметан
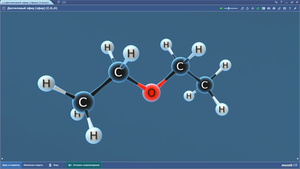
Диэтиловый эфир
ДНК

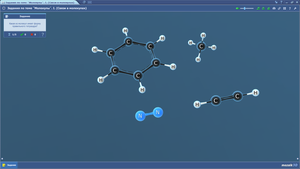
Задания по теме МОЛЕКУЛЫ. Полярность
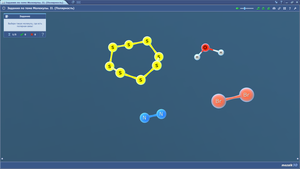
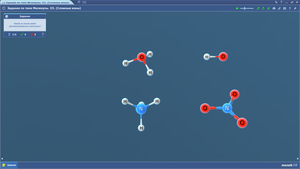
Задания по теме МОЛЕКУЛЫ. Сложные ионы
Задания по теме МОЛЕКУЛЫ. Углеводороды
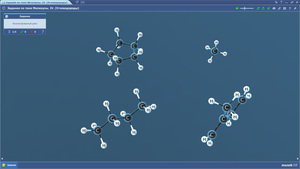
Задания по теме МОЛЕКУЛЫ. Кислородсодержащие органические соединения
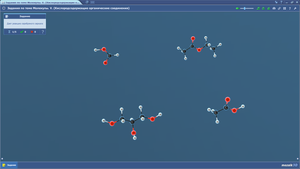
Задания по теме МОЛЕКУЛЫ. Углеводы
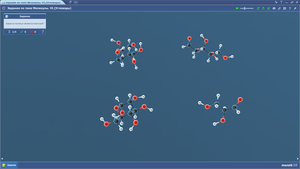
Задания по теме МОЛЕКУЛЫ. Азотсодержащие органические соединения
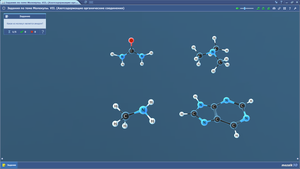
Задания по теме МОЛЕКУЛЫ. Связи в молекулах
Замыкание в цикл молекулы глюкозы
Изменения агрегатного состояния
Изобутан
Изолейцин
Изопентан
Изопрен
Имидазол
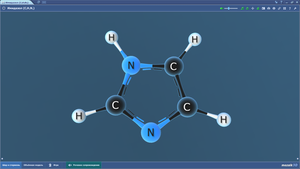
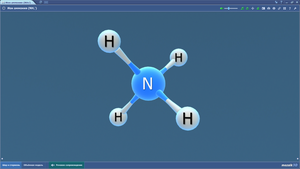
Ион аммония
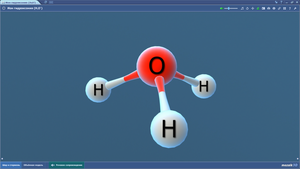
Ион гидроксония
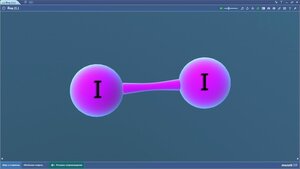
Йод
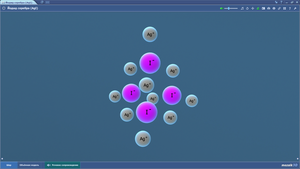
Йодид серебра
Йодоводород
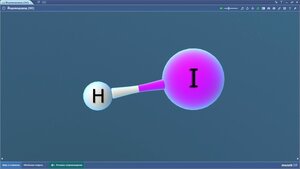
Карбамид
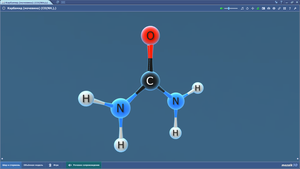
Карбонат кальция

Карбонат-ион
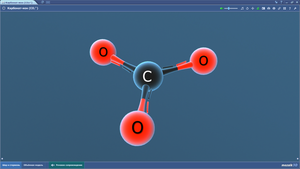
Кислород
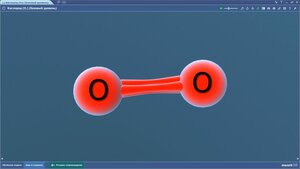
Конформации молекулы этана
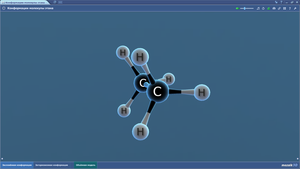
Кофермент А

Красный фосфор
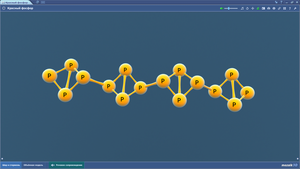
Кремний
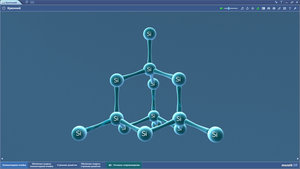
Кристалл йода

Кубическая объёмноцентрированная решетка

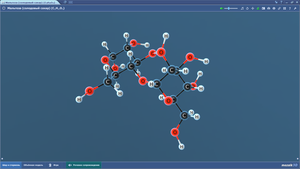
Лактоза
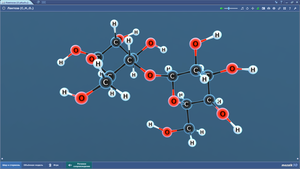
Лейцин
Лизин
Мальтоза
Металлы
Метан
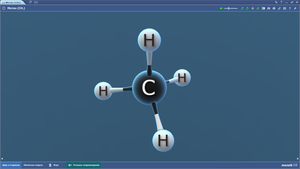
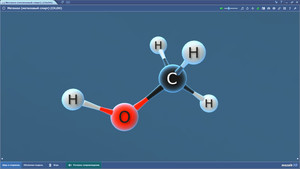
Метанол
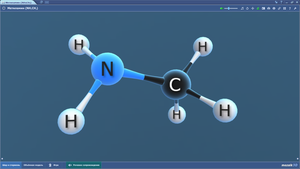
Метиламин
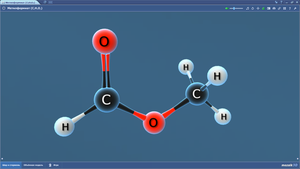
Метилформиат
Метионин
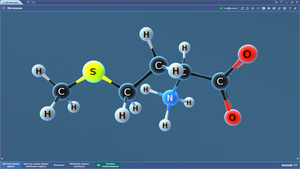
Молекула жира
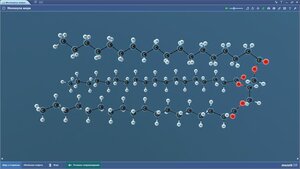
Молекула масла
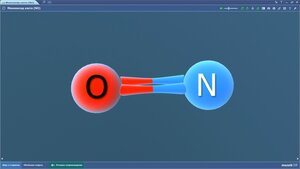
Монооксид азота
Монооксид углерода
Муравьиная кислота
Мыло
НАД, НАДФ И НАДФН
Нафталин
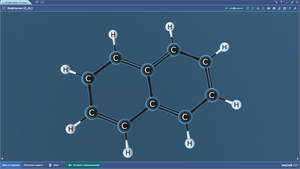
Нитрат серебра
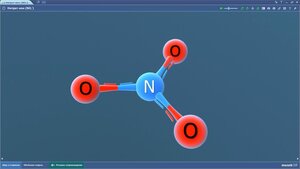
Нитрат-ион
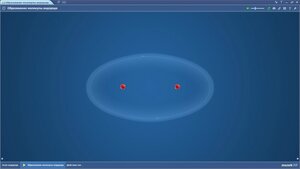
Образование молекулы водорода
Озон
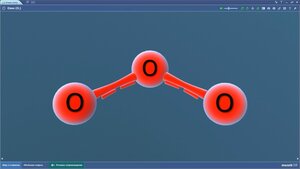
Олеиновая кислота
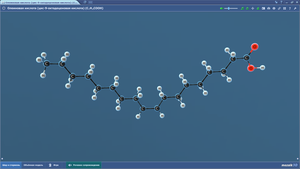
Оптическая изомерия
Пальмитиновая кислота
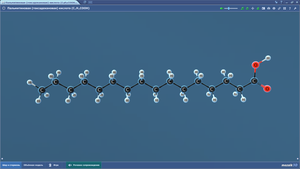
Пентан
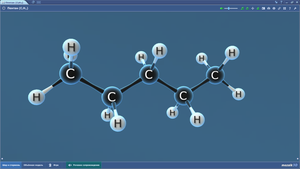
Пентаоксид фосфора
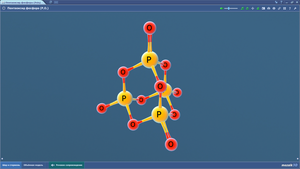
Пентен-1
Пептидная связь
Перманганат-ион
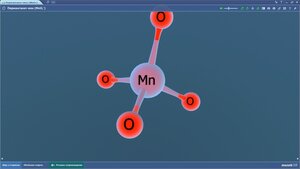
Пероксид водорода
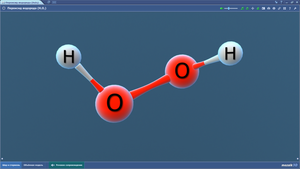
Пиридин
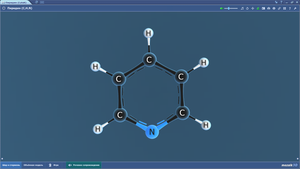
Пиримидин
Поурочный план лабораторной работы по теме: «Изготовление моделей молекул углеводородов»
Составить шаростержневую модель молекулы метана:
— сделать из черного пластилина один шарик, который будет символизировать атом углерода, и из белого пластилина сделать четыре шарика, которые будут символизировать атомы водорода. Причем диаметр черного шарика должен превышать диаметр белых шариков в 1,5 раза.
— на черном шарике (атом углерода) наметьте четыре равноудаленные друг от друга точки и вставьте в них палочки, к концам палочек присоедините четыре белых шарика (атомы водорода).
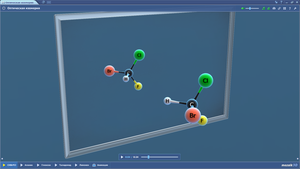
Составить шаростержневую модель молекулы трихлорметана:
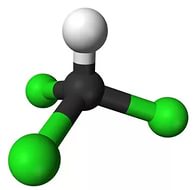
— исходя из модели молекулы метана, составьте модель молекулы трихлорметана.
— сделать из синего пластилина три шарика, которые будут символизировать атом хлора. Причем диаметр синих шариков должен превышать диаметр белых шариков в 2 раза.
— отнимите от модели молекулы метана три шарика белого цвета (символ атома водорода) и на освободившиеся места прикрепите синие шарики (символ атома хлора).
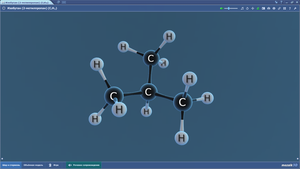
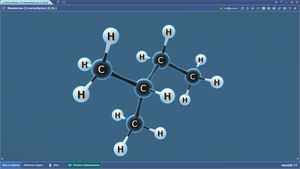
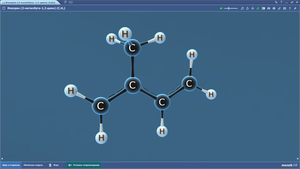
Составить шаростержневую модель молекулы этана:
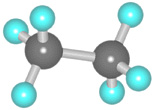
— сделать из черного пластилина два шарика, которые будут символизировать атом углерода, и из белого пластилина сделать шесть шариков, которые будут символизировать атомы водорода. Причем диаметр черных шариков должен превышать диаметр белых шариков в 1,5 раза.
— соедините между собой палочкой шарики черного цвета.
— на каждом черном шарике (атом углерода) наметьте три равноудаленные друг от друга точки и вставьте в них палочки, к концам палочек присоедините белый шарик (атомы водорода).
Составить шаростержневую модель молекулы хлорэтана:
— исходя из модели молекулы этана, составьте модель молекулы хлорэтана.
— сделать из синего пластилина шарик, которые будут символизировать атом хлора. Причем диаметр синего шарика должен превышать диаметр белых шариков в 2 раза.
— отнимите от модели молекулы этана один шарик белого цвета (символ атома водорода) и на освободившееся место прикрепите синий шарик (символ атома хлора).
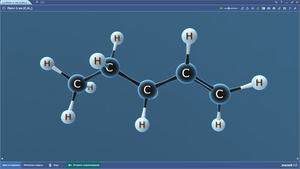
Составить шаростержневую модель молекулы бутана:

— сделать из черного пластилина четыре шарика, которые будут символизировать атом углерода, и из белого пластилина сделать десять шариков, которые будут символизировать атомы водорода. Причем диаметр черных шариков должен превышать диаметр белых шариков в 1,5 раза.
— соедините между собой палочками шарики черного цвета.
— на первый и четвертый черный шарик (атом углерода) наметьте три равноудаленные друг от друга точки и вставьте в них палочки, к концам палочек присоедините белый шарик (атомы водорода). Ко второму и третьему черному шарику вставить по две палочки, к концам палочек присоедините белый шарик (атомы водорода).
Выводы по лабораторной работе: _______________________________________________________.
Контрольные вопросы по защите лабораторной работе:
Какие существуют способы моделирования молекул органических соединений?
Какие положения теории химического строения органических соединений учитывались при составлении моделей молекул углеводородов?
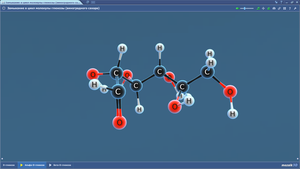
Записать название соединений их структурные формулы. С6Н14, С7Н16. Составить изомеры этих соединений, назвать их.