2.3. Полярность связи. Дипольный момент молекулы
l
µ = δ l
Рис. 2.23. Схема образования диполя в гетероядерной молекуле АВ
При образовании ковалентной химической связи между разными атомами (гетероядерные молекулы) электронная плотность распределяется не симметрично относительно ядер. В молекуле она сдвинута в сторону ато-
ма, имеющего большее значение электро- | Атом А | Атом В | |||
отрицательности. Вследствие | этого в | ||||
χА<χВ | |||||
двухатомной молекуле | центры | тяжести | |||
δ+ | δ− | ||||
положительных зарядов | ядер и | отрица- | |||
тельных зарядов электронов не совпадают. Возникает система разных по знаку, но одинаковых по величине электриче-
Возникает система разных по знаку, но одинаковых по величине электриче-
ских зарядов (δ+ и δ−) – электрический диполь (рис. 2.23).
Мерой полярности связи (характеристикой диполя) является диполь-
ный момент µ – произведение величины заряда δ на расстояние между центрами тяжести положительных и отрицательных зарядов (длина диполя l).
Единицей измерения дипольного момента в системе СИ [Кл м] чаще
используется внесистемная единица Дебай (D): 1 D = 3,33 10-30 Кл м.
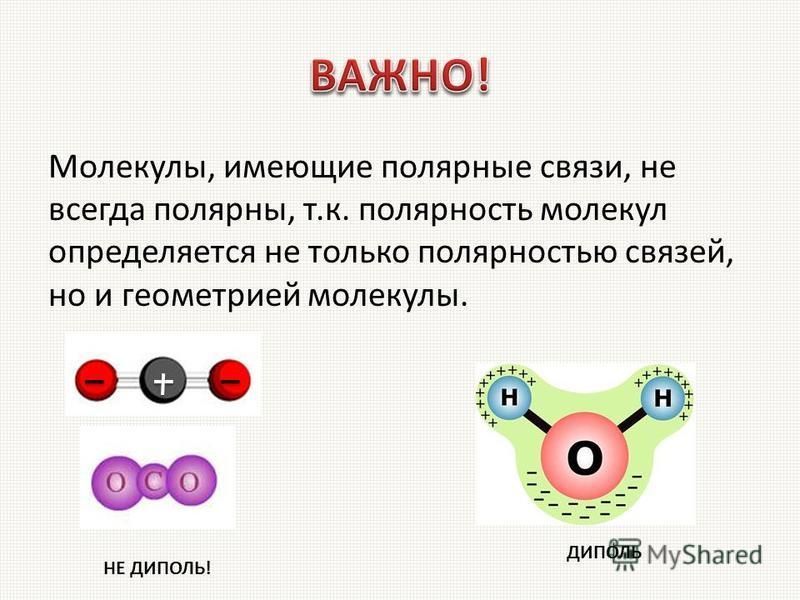
В гетероядерных молекулах связь всегда полярна, но если число атомов в молекуле три и более, то возникающая при этом система распределения зарядов может привести к тому, что молекула в целом не будет являться диполем – центры тяжести положительных и отрицательных зарядов совпадают. Как правило, это связано с симметричным строением молекулы.
Если молекулу, даже если она не является диполем, поместить в электрическое поле напряженностью Е, происходит разделение центров тяжести зарядов в результате смещения электронов относительно ядер, и смещения атомов относительно друг друга в молекуле.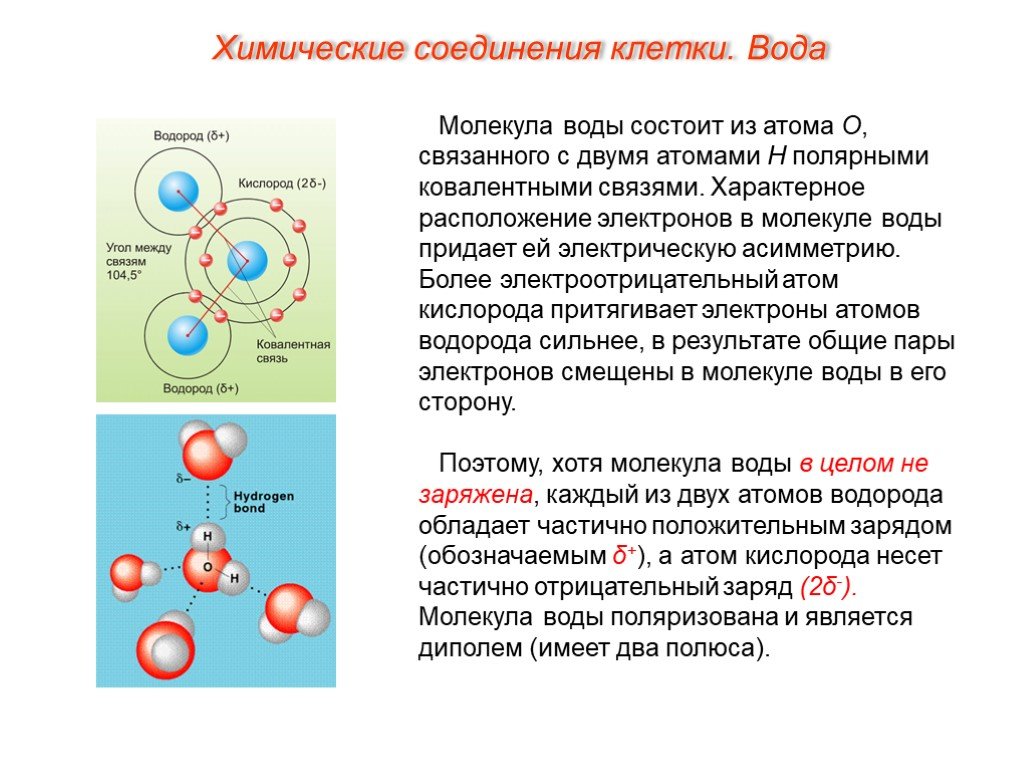 При этом молекула приобретает наведенный (индуцированный) дипольный момент. Способность молекул приобретать в электрическом поле дипольный момент на-
При этом молекула приобретает наведенный (индуцированный) дипольный момент. Способность молекул приобретать в электрическом поле дипольный момент на-
зывается поляризуемостью.
Дипольный момент наведенного диполя пропорционален напряженности электрического поля: µи = α ε0 E , где α – коэффициент поляризуе-
мости (поляризуемость) атома или молекулы, ε0 – электрическая постоянная.
73
Пример.
Молекула | Дипольный мо- | Дипольный момент | Строение | ||
| мент связи, D | молекулы, D | молекулы | ||
O3 | 0 | 0 | О |
| |
О | О | ||||
|
|
| |||
h3O | 1,5 | 1,84 | Н |
| |
О | Н | ||||
|
|
| |||
CO2 | 2,7 | 0 | С | O | |
| О | ||||
3 . ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
ИЖИДКОСТЯХ
Вещества в зависимости от внешних условий (температура и давление) и их химического состава могут существовать в трех основных агрегатных состояниях: газообразном, жидком и твердом. При достаточно низких температурах вещества находятся в твердом состоянии, а при относительно высоких – в жидком и газообразном.
При нагревании происходит, как правило, последовательный переход веществ из твердого в жидкое и газообразное состояние (плавление и испарение), а при охлаждении протекают обратные процессы (конденсация и кристаллизация). Эти переходы осуществляются при определенной температуре (температуре фазового перехода), при этом скачкообразно изменяется молярный объем вещества и энтропия (энергетическая характеристика степени разупорядоченности системы), поглощается или выделяется тепловая энергия (энтальпия фазового перехода). Температура перехода из одного состояния в другое зависит от химической природы вещества и давления.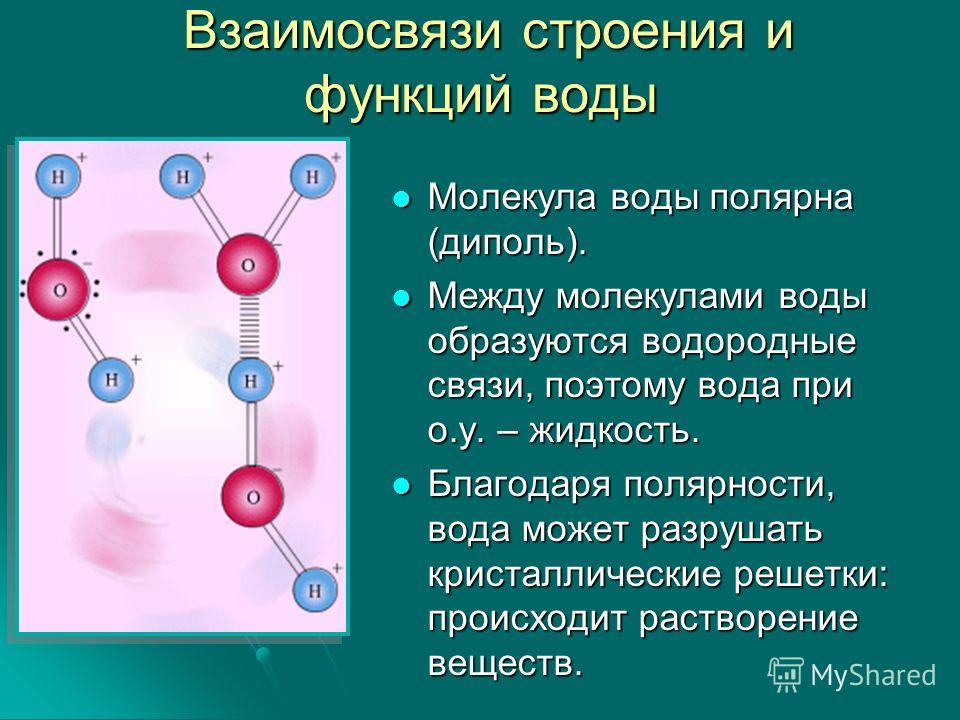
74
|
|
|
|
|
|
|
|
| Таблица 3 . 1 | ||
Температуры (°С), энтальпия (∆Н0, кДж/моль) и энтропии (∆S0, Дж/моль К) фазо- | |||||||||||
| вых переходов некоторых веществ при атмосферном давлении |
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Ве- | Тип кристалла |
|
|
|
| Фазовый переход |
|
|
|
| |
щест- |
|
| Плавление — |
|
|
| Кипение – |
| |||
во |
| кристаллизация |
| конденсация |
| ||||||
|
| tпл, °С |
| ∆Н0пл, |
| ∆S0 пл, | tкип, °С |
| ∆Н0исп, |
| ∆ S0исп, |
N2 | Молекулярный | -210 |
| 0,721 |
| 11,4 | -195,8 |
| 5,59 |
| 72,4 |
Ch5 | -//- | -182,5 |
| 0,938 |
| 10,4 | -164 |
| 8,18 |
| 75,0 |
h3O | -//- | 0 |
| 6,013 |
| 22,0 | 100 |
| 40,683 |
| 109,07 |
C6Н6 | -//- | 5,5 |
| 9,837 |
| 35,3 | 80,1 |
| 30,76 |
| 87,1 |
S(β) | -//- | 119,3 |
| 1,72 |
| 4,4 | 445 |
| 9,2 |
| 12,8 |
Si | Ковалентный | 1415 |
| 49,8 |
| 29,5 | 3300 |
| 356 |
| 99,6 |
AgCl | Ионный | 455 |
| 13,2 |
| 18,1 | 1557 |
| 184 |
| 100,5 |
NaCl | -//- | 801 |
| 28,2 |
| 26,3 | 1490 |
| 138 |
| 78,3 |
MgF2 | -//- | 1263 |
| 58 |
| 37,8 | 2270 |
| 274 |
| 107,7 |
Na | Металлический | 97,9 |
| 2,60 |
| 7,01 | 886 |
| 90. |
| 77,7 |
Ag | -//- | 960,5 |
| 11,3 |
| 9,2 | 2167 |
| 251 |
| 102,9 |
W | -//- | 3420 |
| 35,1 |
| 9,5 | 5680 |
| 770 |
| 129,3 |
Жидкое и твердое агрегатные состояния относят к конденсированному состоянию вещества. Оно отличается от газообразного тем, что энергия взаимодействия между частицами, образующими вещество, сравнима по величине или превышает энергию их теплового движения. Это приводит к тому, что среднее расстояние между частицами (между центрами частиц) в газе при нормальных условиях составляет величину ~ 10 их диаметров, тогда как в конденсированном состоянии оно сравнимо с их диаметром.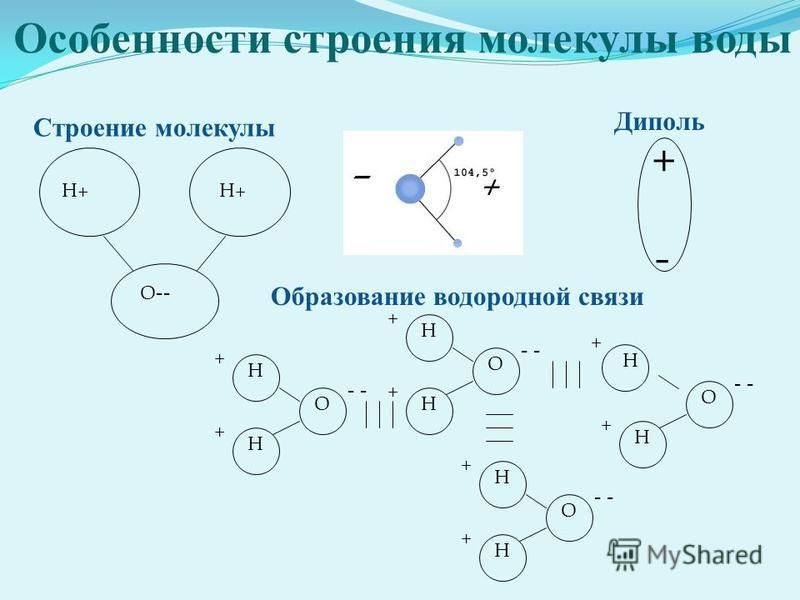 Молярный объем любого газа при нормальных условиях равен 22,4 л/моль, тогда как молярные объемы твердых веществ и жидкостей примерно в 103 раз меньше (0,01–0,05 л/моль).
Молярный объем любого газа при нормальных условиях равен 22,4 л/моль, тогда как молярные объемы твердых веществ и жидкостей примерно в 103 раз меньше (0,01–0,05 л/моль).
Пример. Расчет средних размеров пространства, занимаемого одной частицей при атмосферном давлении.
Газ Жидкость, кристалл
| d | d |
|
| |
a |
| a |
V = a3 – объем пространства a – ребро куба
d – средний диаметр частицы
75
Газ. | 1 | моль | газа при нормальных | условиях | занимает | объем | |||||
Vν = 22,4 л/моль и содержит 6,02 1023 молекул (число Авогадро). |
| ||||||||||
Средний размер пространства, занимаемого одной частицей: |
| ||||||||||
V = | 22,4 10 | -3 |
|
|
|
|
| 0 | |||
| = 3,7 10-26 м3 , a = 3 V = 3 3,7 10−26 = 3,3 10-9 м = 33А. | ||||||||||
|
| 6,02 1023 |
|
|
|
|
|
| |||
Размер молекулы азота (две длины связи) d N2 3 Ǻ. |
|
| |||||||||
Жидкость. |
| 1 | моль | жидкого брома | (Br2) | занимает | объем | ||||
V = | M | = | 160 | = 51,2 cм3 . | М=160 г/моль | – | молярная масса | брома, | |||
ν | ρ |
| 3,12 |
|
|
|
|
|
|
|
|
ρ=3,12 г/см3 – плотность жидкого брома, Vν – молярный объем жидкого брома.
Средний размер пространства, занимаемого одной частицей:
V = | 51,2 | 10 | -6 | = 8,5 10-29 м3 | , a = 3 V = 3 | 8,5 10−29 = 4,4 10-10 | 0 | |||
| м = 4,4 А . | |||||||||
| 1023 | |||||||||
6,02 |
|
|
|
|
|
|
| |||
Размер молекулы брома (две длины связи) d Br2 4,56 Ǻ. |
| |||||||||
Кристалл. 1 | моль металлического серебра занимает объем |
| ||||||||
|
|
|
| V = | M = |
| 108 | = | 10,3 cм3. |
|
|
|
|
| 10,50 |
| |||||
|
|
|
| ν | ρ |
|
|
| ||
М=108 г/моль – молярная масса серебра, ρ=10,50 г/см3 – плотность серебра, Vν – молярный объем серебра.
Средний размер пространства, занимаемого одной частицей:
V = | 10,3 | 10 | -6 | =1,7 10-29 м3 , a = 3 V = 3 1,7 10−29 | = 2,6 10-10 | 0 |
| м = 2,6 А. | |||||
| 6,02 | 1023 |
|
|
| |
Размер атома серебра (два металлических радиуса) d Ag 2,68 Ǻ.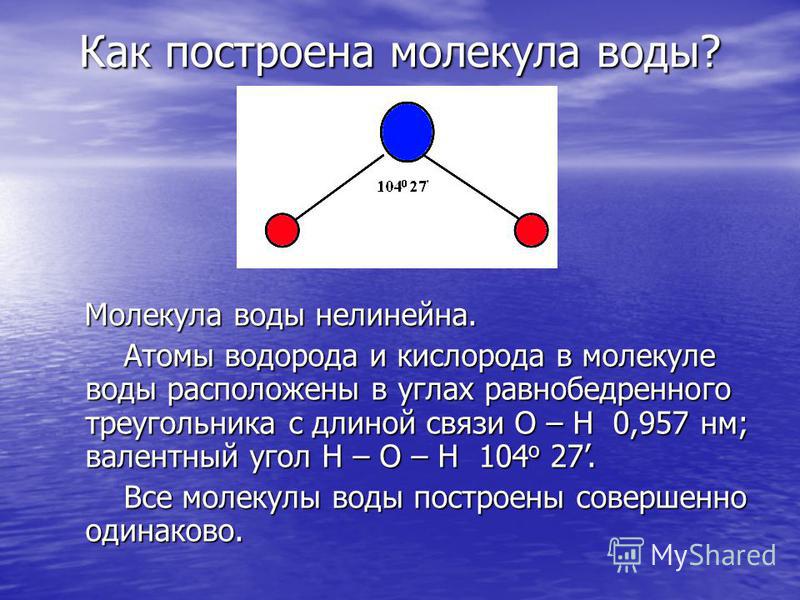
В газах частицы находятся в броуновском движении, при этом отсутствуют ближний и дальний порядок в положении частиц. Газ не имеет собственного объема и, соответственно, формы. В жидкостях броуновское движение осложнено наличием более или менее устойчивого ближнего порядка в положении частиц относительно друг друга за счет возникновения химических связей между отдельными частицами. Жидкость имеет собственный объем, но из-за слабого межмолекулярного взаимодействия под действием силы тяжести принимает форму сосуда, в котором она находится. В твердом состоянии вещества энергия взаимодействия между частицами намного превышает энергию теплового движения, что приводит к фиксированию положений частиц в пространстве, вокруг которых они совершают колебательные и вращательные движения. Это определяет наличие у твердых тел собственной формы и объема и большое сопротивление сдвигу.
76
Сравнение энергетических характеристик фазовых переходов свидетельствует о существенно меньшей перестройке вещества при плавлении, чем при испарении. Как видно из табл. 3.1, для всех кристаллов с различным типом химической связи теплота (энтальпия) плавления много меньше теплоты испарения. Энтропия фазового перехода, характеризующая изменение степени упорядоченности системы, также для плавления много меньше, чем для испарения.
Как видно из табл. 3.1, для всех кристаллов с различным типом химической связи теплота (энтальпия) плавления много меньше теплоты испарения. Энтропия фазового перехода, характеризующая изменение степени упорядоченности системы, также для плавления много меньше, чем для испарения.
В газообразном состоянии, где присутствуют слабо или совсем не взаимодействующие между собой молекулы вещества, химическая связь внутри них рассматривается с использованием моделей «классической» ковалентной связи.
При рассмотрении конденсированного состояния вещества химическая связь описывается с использованием моделей ковалентной, ионной и металлической связи. При этом необходимо принимать во внимание близкое расположение частиц, образующих систему. Это обстоятельство в ряде случаев (жидкости, молекулярные кристаллы) обусловливает необходимость учитывать существенный вклад межмолекулярного взаимодействия в энергию химических связей.
Необходимо отметить, что целый ряд веществ может не иметь одного из агрегатных состояний. Чаще всего это относится к жидкому и газообразному состояниям. Данное обстоятельство связано с соотношением между энергией, необходимой для перевода вещества из одного агрегатного состояния в другое, и энергией, достаточной для разрыва внутримолекулярных химических связей. Например, во многих нерастворимых в воде гидроксидах металлов при нагревании раньше протекает реакция дегидратации (Cu(OH)2→ CuO + h3O), а затем происходит плавление вещества.
Чаще всего это относится к жидкому и газообразному состояниям. Данное обстоятельство связано с соотношением между энергией, необходимой для перевода вещества из одного агрегатного состояния в другое, и энергией, достаточной для разрыва внутримолекулярных химических связей. Например, во многих нерастворимых в воде гидроксидах металлов при нагревании раньше протекает реакция дегидратации (Cu(OH)2→ CuO + h3O), а затем происходит плавление вещества.
3.2.Межмолекулярное взаимодействие
Как было отмечено выше, в конденсированном состоянии вещества на величину энергии химической связи существенно влияют межмолекулярные взаимодействия. Они связаны с электростатическим взаимодействием зарядов, возникающих в результате нарушения симметрии распределения электронной плотности в молекулах.
3.2.1.Межмолекулярные взаимодействия (силы Ван-дер-Ваальса)
В конденсированных фазах (жидкость, твердое тело) расстояние между молекулами соизмеримо с размерами самих молекул. На таких малых расстояниях проявляют себя силы электростатического взаимодействия диполей, как постоянных, так и наведенных. При этом энергия системы понижается.
При этом энергия системы понижается.
77
Межмолекулярные взаимодействия характеризуются отсутствием обмена электронами между частицами, отсутствием специфичности и насыщаемости. Энергия межмолекулярного взаимодействия сравнительно невелика, однако она вносит существенный вклад в энергетическое состояние системы, определяя в значительной степени физические и химические свойства вещества.
На сравнительно больших расстояниях r между молекулами, когда электронные оболочки не перекрываются, действуют только силы притяжения. При этом возможны три механизма возникновения сил притяжения.
1. Ориентационный эффект (диполь – дипольное взаимодействие). Если молекулы полярны, то проявляется электростатическое взаимодействие двух постоянных диполей. Полярные молекулы ориентируются относительно друг друга противоположно заряженными частями, энергия притяжения прямо пропорциональна дипольным моментам (µi2) и обратно пропорциональна расстоянию между ними (r6). Повышение температуры ослабляет это взаимодействие, так как тепловое взаимодействие стремится
нарушить взаимную ориентацию молекул.
2. Индукционный эффект (взаимодействие диполь – наведенный диполь).
Неполярные молекулы под действием поля полярной молекулы поляризуются, возникает индуцированный диполь. Индуцированный дипольный момент прямо пропорционален поляризуемости молекул (µи α µд). Энергия притяжения таких молекул прямо пропорциональна дипольным моментам (α µд2) и обратно пропорциональна расстоянию между ними (r6). Так как наведение диполей происходит при любом пространственном расположении молекул, индукционный эффект от температуры не зависит.
3. Дисперсионный эффект (взаимодействие мгновенных диполей).
В отличие от ориентационного и индукционного взаимодействия дисперсионный эффект имеет объяснение только в рамках квантовой механики. Его возникновение можно представить следующим образом: в процессе движения электронов распределение зарядов внутри атомов может стать несимметричным, что приводит к образованию «мгновенных диполей», которые притягиваются друг к другу. Более того, при сближении молекул движение электронов перестает быть независимым и возникает «самосогласованная» система взаимодействующих мгновенных диполей. Энергия притяжения прямо пропорциональна поляризуемостям молекул (αi) и обратно пропорциональна расстоянию между ними (r6).
Энергия притяжения прямо пропорциональна поляризуемостям молекул (αi) и обратно пропорциональна расстоянию между ними (r6).
Дисперсионный эффект, как наиболее универсальный, проявляется при взаимодействии как полярных, так и неполярных молекул. Причем для неполярных молекул и молекул с небольшим дипольным моментом он является основным.
78
Индукционный и ориентационный эффекты играют существенную роль при взаимодействии полярных молекул. Для молекул с большим значением дипольного момента основным является ориентационный эффект. Индукционный эффект обычно невелик и становится значительным лишь тогда, когда полярные молекулы сосуществуют с сильно поляризующимися молекулами (табл. 3.2).
На малых расстояниях между молекулами, когда их электронные оболочки сильно перекрываются, электростатическое отталкивание ядер и электронов становится больше их взаимного притяжения. Энергия отталкивания гораздо сильнее зависит от расстояния (r12), чем энергия притяжения. На больших расстояниях межмолекулярное взаимодействие определяется силами притяжения, а на малых силами отталкивания.
Таблица 3 . 2
Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
| Ориентацион- | Индукционное | Дисперсион- | µ, Кл м |
| α, м3 |
Молекула | ное |
| ное | Диполь- |
| Поляри- |
|
|
|
| |||
| % |
| ный |
| зуемость | |
|
|
| момент |
|
| |
|
|
|
|
| ×1030 | |
CO | < 0,01 | 0,1 | 99,9 | 0,33 |
| 1,926 |
HCl | 14,4 | 4,2 | 81,4 | 3,47 |
| 2,561 |
Nh4 | 44,9 | 5,3 | 49,7 | 4,94 |
| 2,145 |
h3O | 76,9 | 4,0 | 19,0 | 6,10 |
| 1,444 |
3. 2.2.Водородная связь
2.2.Водородная связь
Особым типом межмолекулярного взаимодействия является водородная связь. Она возникает между молекулами, которые содержат в своей структуре атом водорода и малый по размерам атом элемента с большим значением электроотрицательности (кислород, фтор, азот и др.). Поскольку разница в электроотрицательностях водорода и этих элементов велика, то связь сильно поляризована, на атомах возникают сравнительно большие отрицательные и положительные заряды. В то же время небольшой размер этих атомов позволяет им близко подходить друг к другу при ди- поль-дипольном взаимодействии. Поэтому энергия ориентационного взаимодействия значительно больше (примерно на порядок), чем в других случаях. Кроме того, энергия связи существенно увеличивается за счет частичного образования ковалентной составляющей связи между взаимодействующими атомами соседних молекул по донорно-акцепторному механизму. 1s-орбиталь водорода частично оголена благодаря сильной поляризации связи (это еще не Н+, но уже и не Н0), а на электроотрицательном атоме имеются неподеленные электронные пары.
79
Оба эти фактора приводят к увеличению энергии связи по сравнению с энергией межмолекулярного взаимодействия. Энергия водородной связи составляет величину порядка 100 кДж/моль, энергия межмолекулярного взаимодействия (силы Ван-дер-Ваальса) – 10-20 кДж/моль.
При конденсации молекул, способных к образованию водородных связей, их взаимное расположение будет определяться как направлением в пространстве атомов водорода внутри молекулы, так и направлением в пространстве электронных орбиталей электроотрицательного атома, связанного с атомом водорода соседней молекулы.
Водородная связь определяет многие физические и химические свойства веществ, в частности увеличивается температура плавления и кипения, изменяется плотность вещества. Особую роль водородная связь играет в биохимии, органические молекулы (в том числе и полимеры), содержащие H-O, H-N связи, образуют большое число водородных связей.
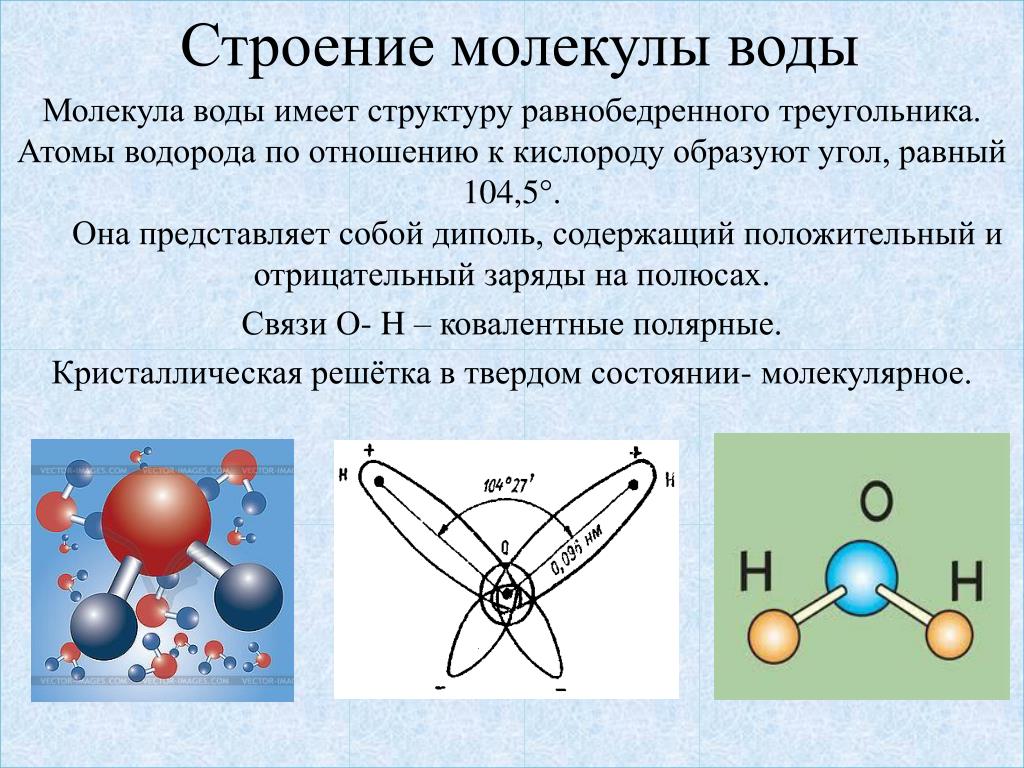
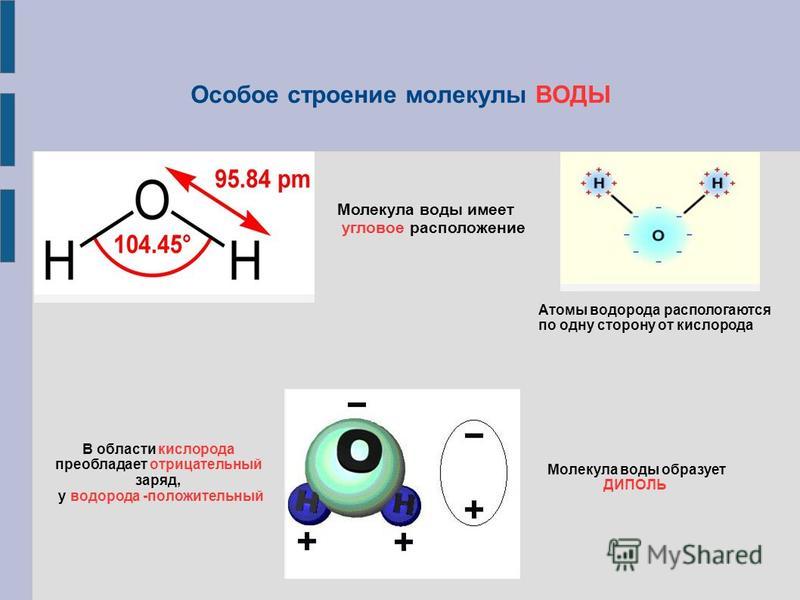
Примеры. Вода h3O.
В конденсированном состоянии каждая молекула воды может иметь четыре водородные связи: две между атомом кислорода (функции донора) и атомами водорода двух соседних молекул воды; еще две – за счет двух атомов водорода (функция акцептора). В кристаллическом состоянии образуется правильная алмазоподобная структура. В узлах располагаются большие атомы кислорода, которые связаны между собою через атом водорода. В жидком состоянии часть водородных связей разорвана (рис.3.1).
В кристаллическом состоянии образуется правильная алмазоподобная структура. В узлах располагаются большие атомы кислорода, которые связаны между собою через атом водорода. В жидком состоянии часть водородных связей разорвана (рис.3.1).
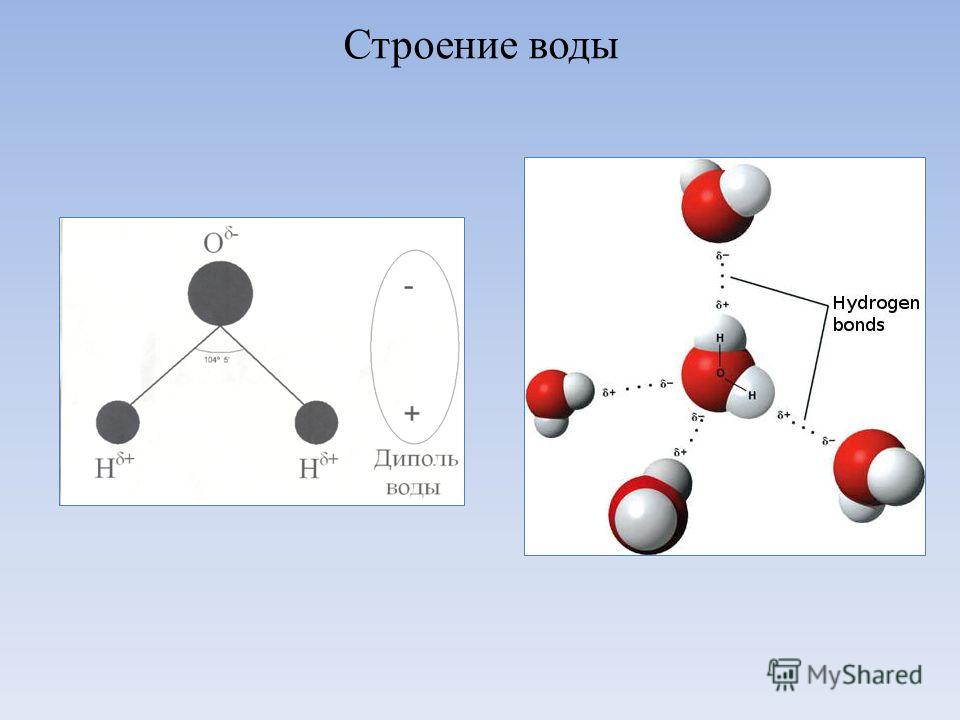
Нδ+ | Нδ+ Длина связи О | Н | 0,99 Ǻ |
| Длина связи О | Н | 1,77 Ǻ |
Оδ− | Угол связи 104,5о |
| |
Оδ− |
|
| |
Нδ+ | Нδ+ Нδ+ Нδ+ |
|
|
Оδ−
Рис. 3.1. Схема образования тетраэдрической пространственной структуры воды вкристаллическом и жидком состояниях: — ковалентная связь, — водородная связь
Фтористый водород HF.
В газообразном состоянии при невысоких температурах, за счет образования водородных связей, образуются ассоциаты (HF)2, (HF)6. . В конденсированном состоянии, в частности в твердом, HF образует зигзагообразные цепи (рис. 3.2).
. В конденсированном состоянии, в частности в твердом, HF образует зигзагообразные цепи (рис. 3.2).
80
взаимодействие, ван-дер-ваальсово
взаимодействие, ван-дер-ваальсово иначе ван-дер-ваальсовы силы (англ. van der Waals interaction или van der Waals force) — слабое, нековалентное межмолекулярное взаимодействие, возникающее за счет взаимодействия дипольных (мультипольных) моментов молекул и поляризации их электронных оболочек.
Описание
На больших расстояниях ван-дер-ваальсово взаимодействие имеет характер притяжения и возникает между любыми молекулами как полярными, так и неполярными. На малых расстояниях оно компенсируется отталкиванием электронных оболочек. Можно выделить следующие основные типы взаимодействий, называемых ван-дер-ваальсовыми.
1. Ориентационное (диполь–диполь) взаимодействие между полярными молекулами, т. е. молекулами с постоянными дипольными моментами. Потенциал взаимодействия () жестко ориентированных диполей является анизотропным, т.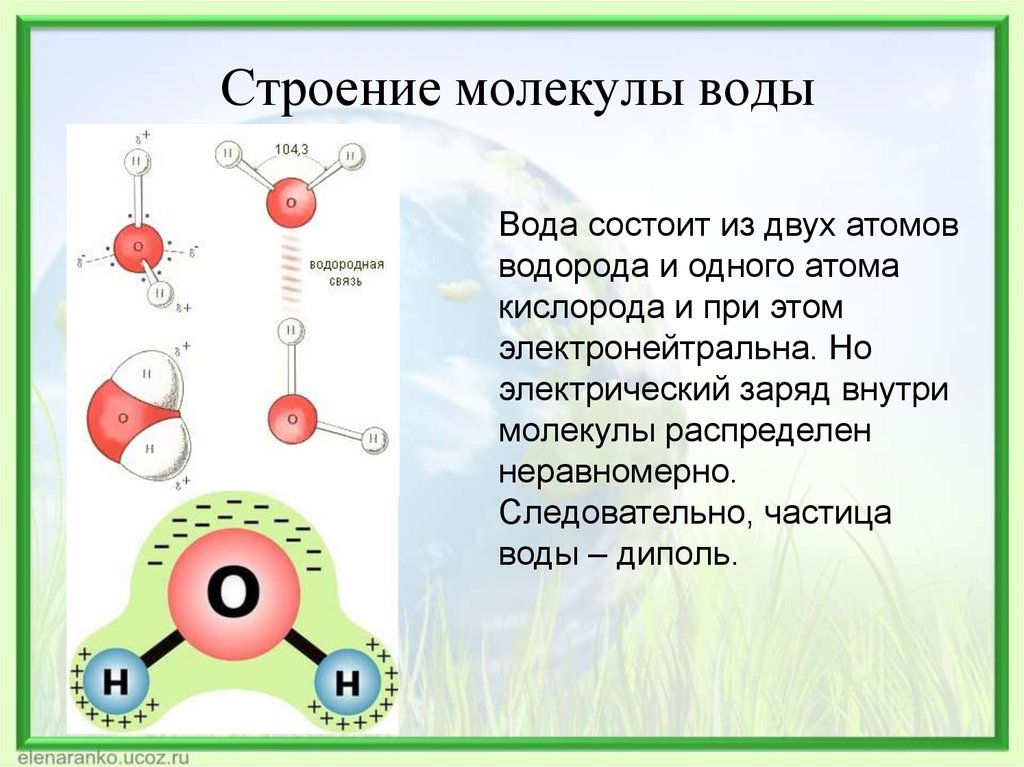 е. зависит от ориентации постоянного диполя. Он пропорционален квадратам дипольных моментов ( и ) и обратно пропорционален температуре () и шестой степени расстояния между диполями ():
е. зависит от ориентации постоянного диполя. Он пропорционален квадратам дипольных моментов ( и ) и обратно пропорционален температуре () и шестой степени расстояния между диполями ():
.
Кроме того, имеет место взаимодействие дипольных моментов с высшими мультипольными моментами (например, диполь-квадрупольное взаимодействие) и взаимодействие этих последних между собой, однако соответствующие вклады обычно заметно слабее.
2. Индукционное (постоянный диполь—наведенный диполь) взаимодействие между полярной и неполярной молекулами, при котором постоянный дипольный момент первой () взаимодействует с моментом, индуцированным его полем во второй. В этом случае потенциал обратно пропорционален шестой степени расстояния и прямо пропорционален поляризуемости неполярной молекулы () и квадрату постоянного дипольного момента:
.
Как и в предыдущих случаях, аналогичные эффекты, порожденные высшими мультипольными моментами, могут присутствовать, но гораздо менее существенны.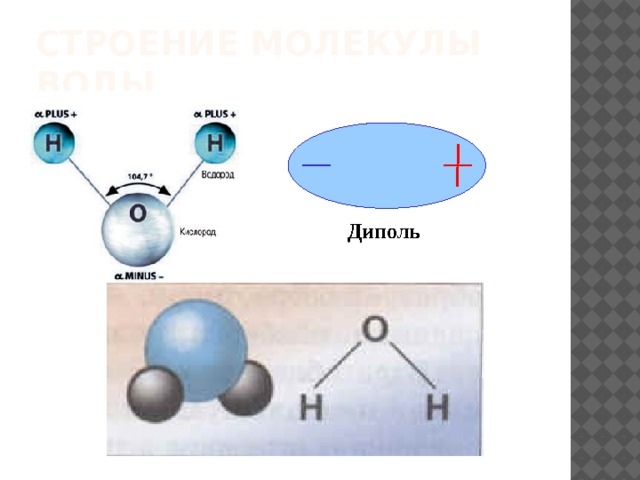
3. Дисперсионное (наведенный диполь—наведенный диполь) взаимодействие, представляющее собой взаимодействие моментов, возникающих, в классической модели, в результате мгновенных флуктуаций заряда (см. подробнее в статье взаимодействие, дисперсионное). Его потенциал также обратно пропорционален шестой степени расстояния и растет с ростом поляризуемости частиц:
.
Среди перечисленных наиболее сильными, как правило, являются дисперсионные взаимодействия. Для небольших молекул энергия ван-дер-ваальсовых взаимодействий может составлять порядка 1–30 кДж/моль. Ван-дер-ваальсово взаимодействие имеет место не только между молекулами, но и между нанообъектами, например углеродными нанотрубками. Несмотря на слабость этого взаимодействия, оно обеспечивает устойчивость молекулярных кристаллов, клатратов, супрамолекулярных комплексов, связь молекул с поверхностями (адсорбцию) и играет важную роль в процессах синтеза и самосборки молекулярных наноструктур.
Иллюстрации
Примеры ван-дер-ваальсовых взаимодействий. |
Автор
- Еремин Вадим Владимирович
Источники
- Стид Дж. В., Этвуд Дж.Л. Супрамолекулярная химия. Т. 1. — М.: Академкнига, 2007. — 480 с.
- Dai L. Intelligent Macromolecules for Smart Devices: from Materials Synthesis to Device Applications. — London: Springer-Verlag, 2004. — 496 p.
Напишите нам
- А
- Б
- В
- Г
- Д
- Ж
- З
- И
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Э
- Я
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Z
Молекулярный диполь — общая полярность молекулы
Структура и связь
Молекулярный диполь — общая полярность молекулы Дипольный момент молекулы и ее общая полярность зависят от величины 8 и
08 направления отдельных полярных связей и их дипольных моментов.
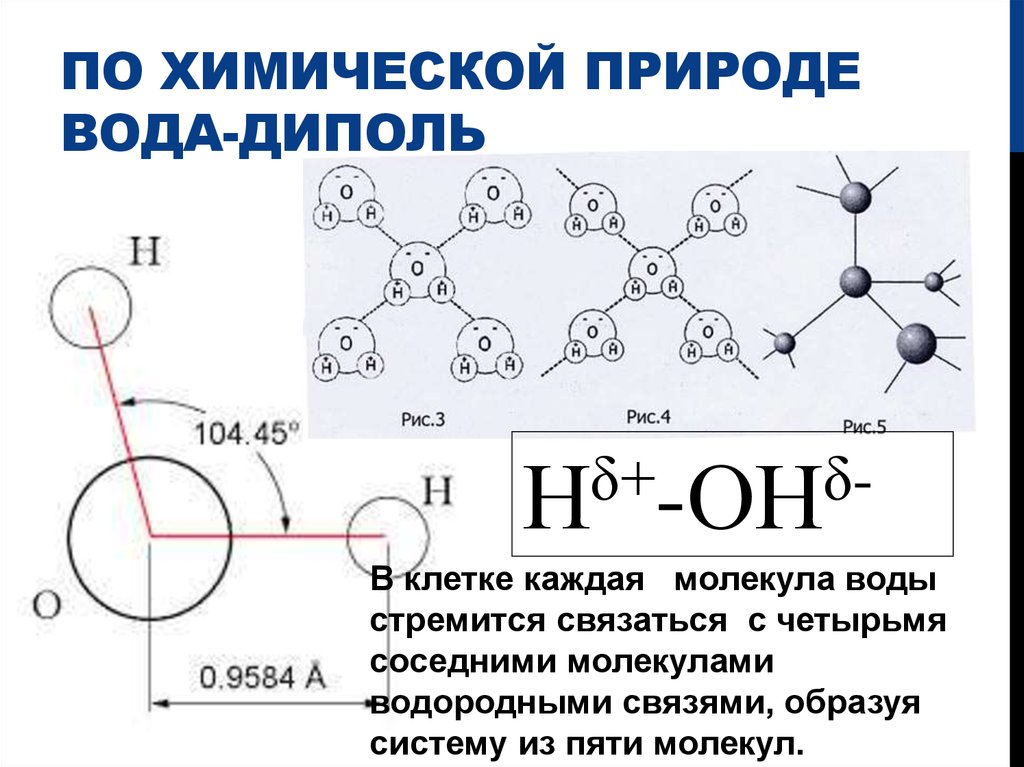
Помните, что для молекул с одной полярной связью молекулярный диполь определяется просто на основе дипольного момента этой связи:
Теперь, если имеется множественных полярных связей , молекулярный дипольный момент определяется векторной суммой этих дипольных моментов.
Например, если мы заменим еще один атом водорода в дихлорметане (CH 2 Cl 2 , показанный выше), нам нужно найти векторную сумму двух диполей C-Cl , чтобы определить общий диполь молекула:
Важно отметить, что неподеленных пар электронов также влияют на величину и направление молекулярного диполя .
Например, молекула воды имеет две полярные связи и одну неподеленную пару электронов. Кислород тянет связывающие электроны, общие с атомами водорода, поскольку он более электроотрицательный. С другой стороны, неподеленные пары направляют дипольный момент на них.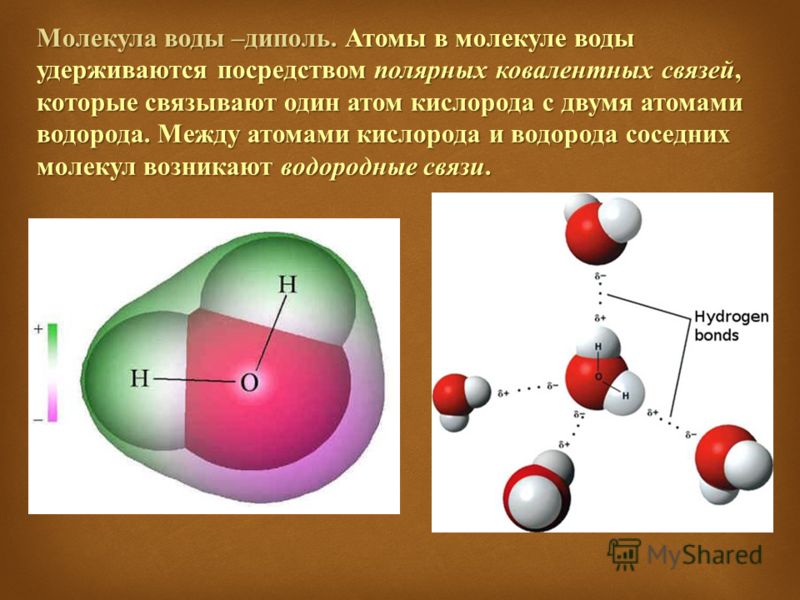 Хотя результирующие дипольные векторы не выровнены линейно по 0 o , все они указывают в одном направлении, и при их объединении мы видим, что все диполей усиливают друг друга. Об этом свидетельствует большее значение дипольного момента воды (1,85 Д) по сравнению с дипольным моментом отдельных связей ОН (1,5 Д).
Хотя результирующие дипольные векторы не выровнены линейно по 0 o , все они указывают в одном направлении, и при их объединении мы видим, что все диполей усиливают друг друга. Об этом свидетельствует большее значение дипольного момента воды (1,85 Д) по сравнению с дипольным моментом отдельных связей ОН (1,5 Д).
Очень полезно изучить теории гибридизации и VSEPR, которые предполагают, что атомы водорода и неподеленные пары кислорода находятся на sp 3 орбиталях на ~109,5 o .
Таким образом, 1,85 дптр является векторной суммой двух диполей 1,5 дптр на расстоянии 104,5 или плюс усиливающий эффект одиночных пар.
Точно так же аммиак имеет больший дипольный момент (1,47 Д), чем каждая связь NH (1,3 Д). Дипольный момент неподеленной пары усиливается векторной суммой трех связей N-H:
Мы только что обсудили примеры, когда дипольные моменты усиливались друг другом в соответствии с их векторной суммой. Так что насчет молекул, когда дипольных моментов направлены в противоположную сторону?
Так что насчет молекул, когда дипольных моментов направлены в противоположную сторону?
Здесь есть два сценария. Если дипольные моменты имеют одинаковую величину при 180 o , то молекула неполярна, так как дипольные моменты компенсируются.
Итак, чтобы обобщить, помните, что симметричных молекул не имеют дипольного момента независимо от того, насколько полярны ковалентные связи, потому что общий дипольный момент молекулы зависит от величины и направления отдельных диполей.
Например, двуокись углерода имеет две полярные связи C=O, однако их дипольные моменты , находящиеся при 180 o , сокращаются, и, следовательно, молекула не имеет чистого диполя и неполярна :
, то суммарный дипольный момент будет векторной суммой (вычитанием) этих дипольных моментов. См. практический вопрос ниже.
Во многих случаях молекула не нарисована или геометрия не задана , и вас просят определить, является ли данная молекула полярной или нет .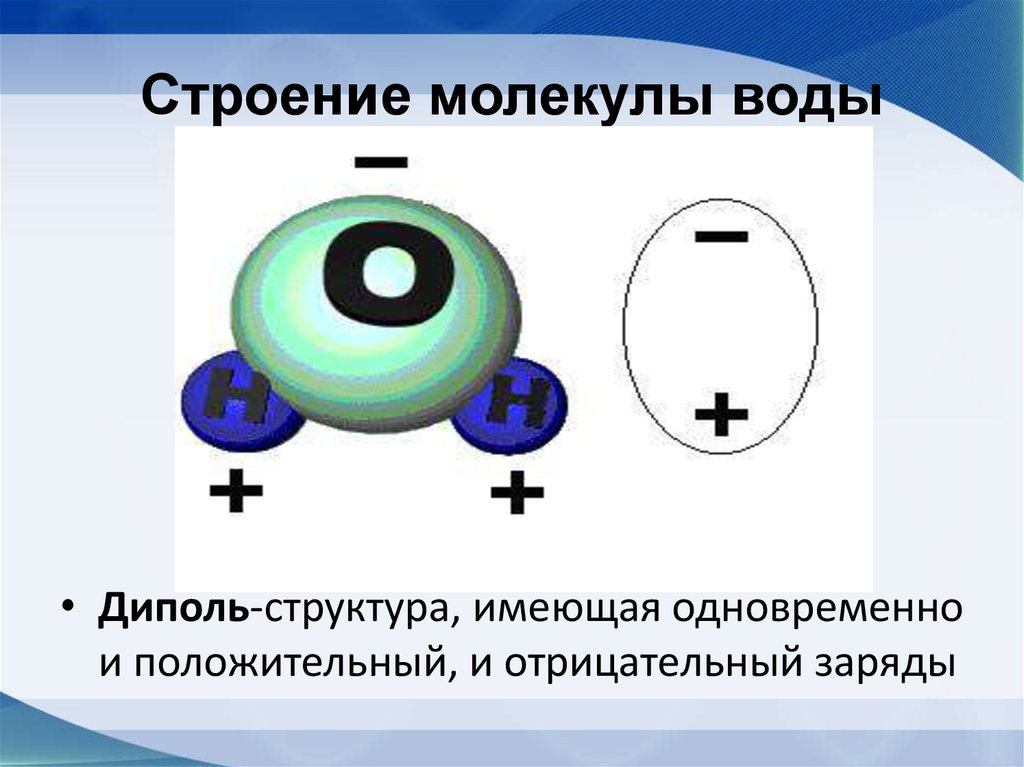
Чтобы ответить на этот вопрос, необходимо сначала определить геометрию молекулы по правилам теории ВСЕПР . Они сведены в следующую таблицу, но также подробно рассматриваются здесь, поэтому не стесняйтесь проверить их и структуры Льюиса, прежде чем мы перейдем к следующему примеру:0008 Пример:
Определите, является ли молекула полярной или нет, показав соответствующие дипольные моменты.
Эта молекула представляет собой формальдегид и имеет тригональную плоскую геометрию в соответствии с правилами VSEPR: связь С=О . Кислород, будучи более электроотрицательным, тянет электронную плотность связи С=О, определяя таким образом направление молекулярного диполя:
Для органических молекул, содержащих углеводородную цепь с небольшим количеством полярных связей, молекулярный диполь определяется суммой этих дипольных моментов.
Например, диэтиловый эфир обладает чистым дипольным моментом, который представляет собой векторную сумму двух полярных связей C-O :
дипольный момент из-за свободное вращение об этих одинарных связях.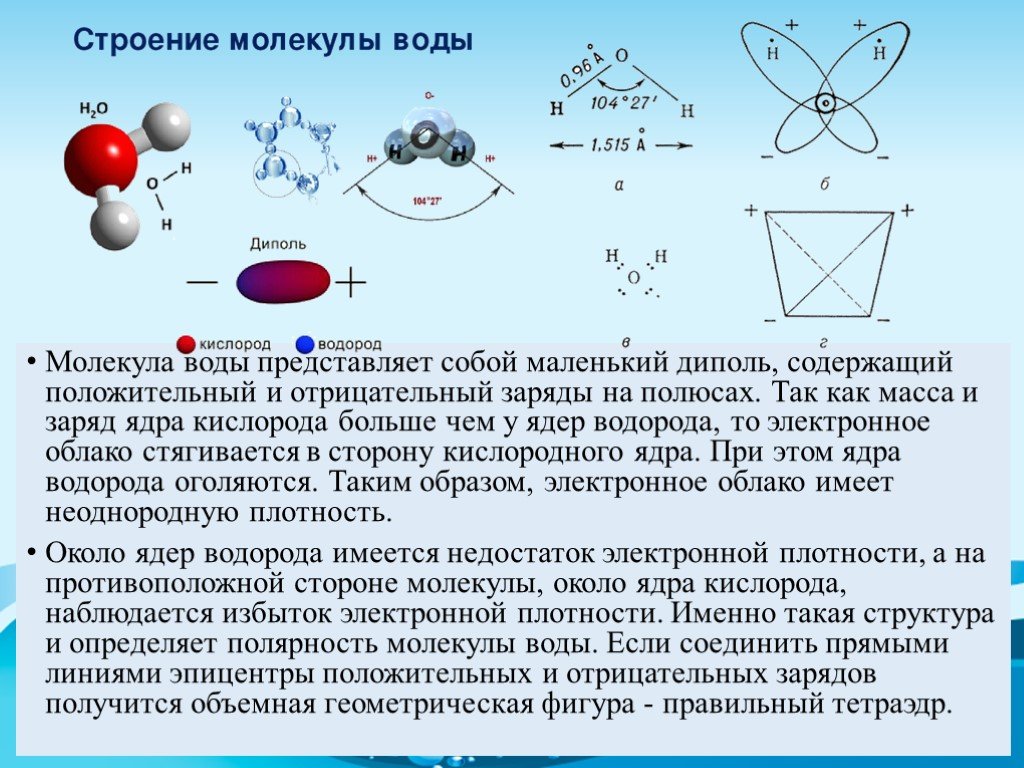 Однако наличие двойных связей , которые ограничивают постоянное изменение направления дипольного момента, позволяет определить молекулярный дипольный момент.
Однако наличие двойных связей , которые ограничивают постоянное изменение направления дипольного момента, позволяет определить молекулярный дипольный момент.
Это можно проиллюстрировать сравнением температур кипения цис – и транс -1,2-дихлорэтена :
057 цис
-1,2-дихлорэтен усиливается, и молекула демонстрирует чистый диполь . Напротив, изомер транс не имеет молекулярного диполя , поскольку связи C-Cl направлены в противоположном направлении и их дипольные эффекты компенсируются: неполярная молекула с более низкой температурой кипения (48 o против 60 o C), чем у цис -дихлорэтилена из-за межмолекулярных диполь-дипольных взаимодействий в последнем.Интересно, что изомер транс имеет температуру плавления на выше ! Почему так?
Ответим на этот вопрос в следующем посте про температуры кипения и плавления.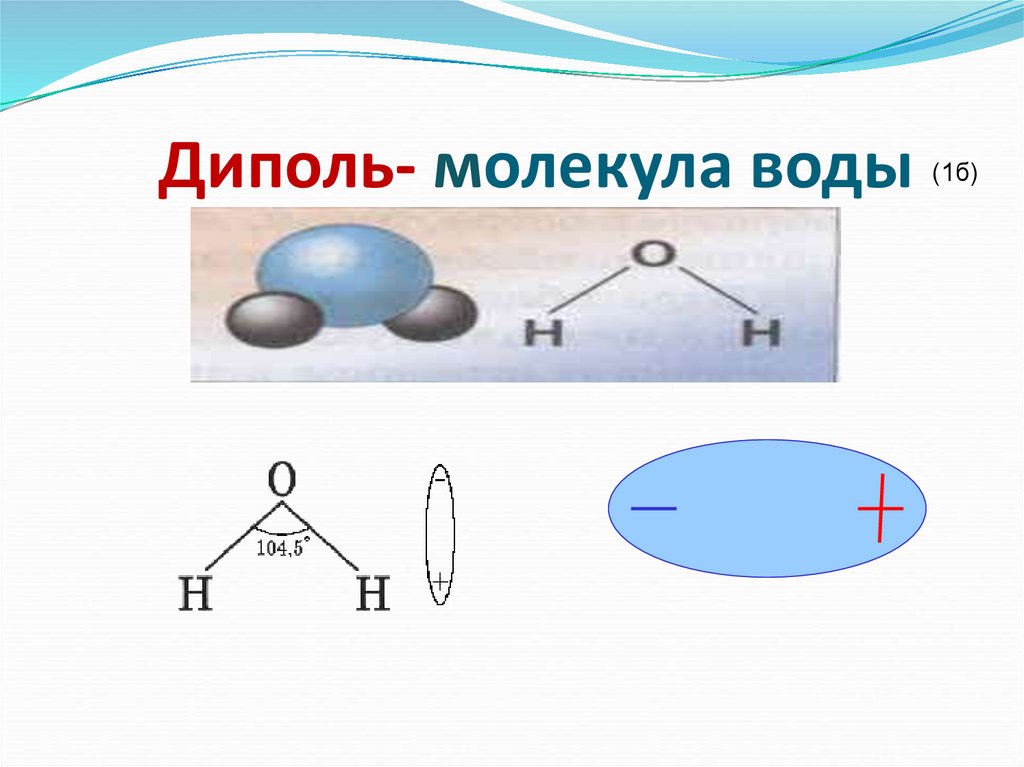
Подводя итог , молекулярный дипольный момент зависит от величины и направления всех дипольных моментов в молекуле. Чем больше молекулярный диполь, тем более полярна молекула. Симметричные молекулы с сопоставимой структурой менее полярны, чем , так как их индивидуальный диполь аннулирован и нет результирующего дипольного момента.
Как всегда, ниже приведены некоторые практические задачи на молекулярный дипольный момент.
1.
Определите полярные связи и укажите направление чистого молекулярного дипольного момента, если он есть.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
2.
Учитывая, что водород более электроотрицателен, чем дейтерий, какая из следующих молекул, по вашему мнению, будет иметь больший дипольный момент?
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видеороликов по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
3.
Как мы видели в статье, CO 2 не имеет молекулярного диполя , поскольку сумма двух связей C=O равна нулю. Однако SO 2 имеет молекулярный диполь , несмотря на аналогичную химическую формулу. Как бы вы объяснили это наблюдение?
Как бы вы объяснили это наблюдение?
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видеороликов по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 сводных учебных пособий .
Полярные и неполярные связи и молекулы
В этом учебнике по химии мы объясним разницу между полярными связями и неполярными связями . Затем мы расскажем вам определение полярной молекулы и что такое неполярная молекула есть. И последнее, но не менее важное: вы узнаете, что такое дипольный момент .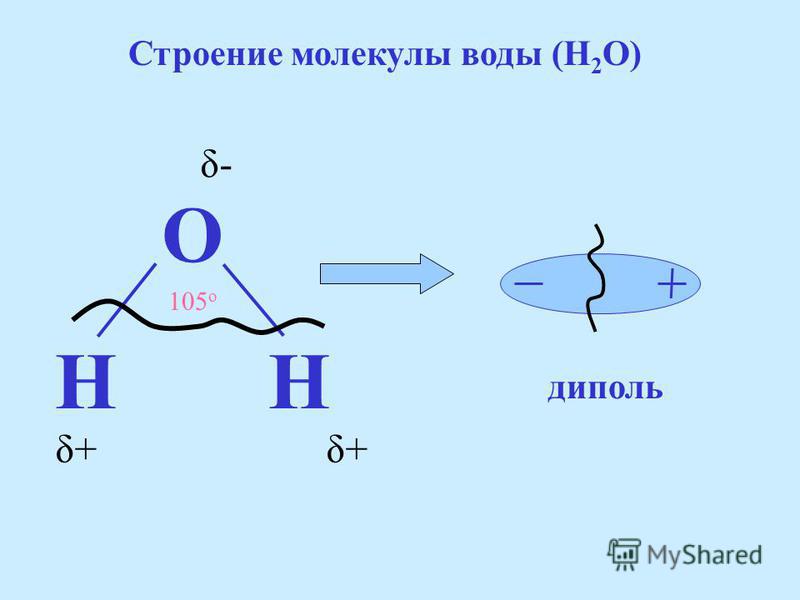
Проще говоря, полярный означает противоположно заряженный, а неполярный означает одинаково заряженный. Ковалентные связи могут быть полярными и неполярными. Чтобы понять разницу между полярными и неполярными связями, важно понять электроотрицательность.
Что такое электроотрицательность?Электроотрицательность — это мера того, насколько сильно атом хочет соединиться с другим атомом. Электроотрицательность увеличивается слева направо и вниз по каждому столбцу периодической таблицы. Шкала Полинга описывает электроотрицательность элемента со шкалой от 0,7 до 4. Фтор является наиболее электроотрицательным элементом с электроотрицательностью 4. Цезий является наименее электроотрицательным элементом с электроотрицательностью 0,7.
Что делает связь полярной? Полярная связь представляет собой тип ковалентной связи. Связь между двумя или более атомами является полярной, если атомы имеют значительно разные электроотрицательности (> 0,4).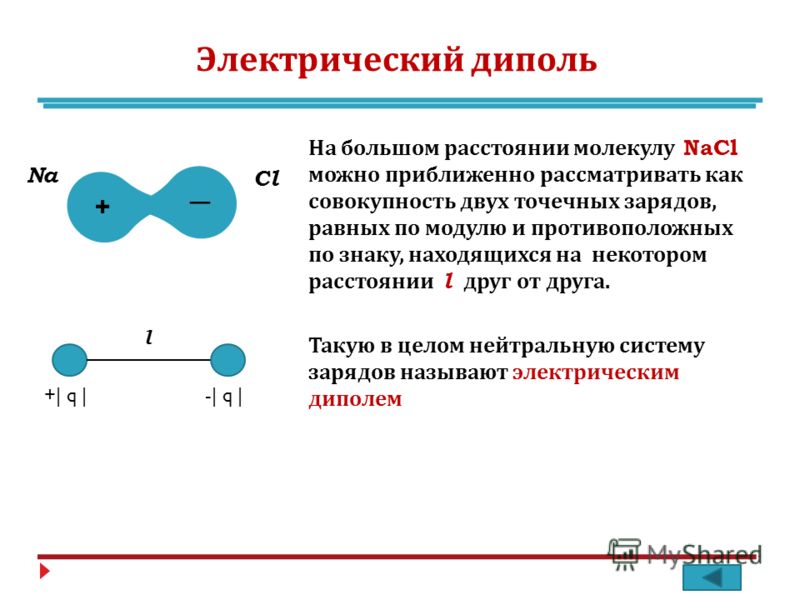 Полярные связи не разделяют электроны поровну, а это означает, что отрицательный заряд электронов неравномерно распределяется в молекуле. Это вызывает дипольный момент. Дипольный момент возникает, когда один конец связи положительный, а другой конец отрицательный. Классическим примером полярной связи является связь в воде между водородом и кислородом. Связь классифицируется как полярная связь, потому что она имеет большую разность электроотрицательностей 1,4. Электроны в водороде больше притягиваются к электронам в кислороде, потому что кислород более электроотрицательный.
Полярные связи не разделяют электроны поровну, а это означает, что отрицательный заряд электронов неравномерно распределяется в молекуле. Это вызывает дипольный момент. Дипольный момент возникает, когда один конец связи положительный, а другой конец отрицательный. Классическим примером полярной связи является связь в воде между водородом и кислородом. Связь классифицируется как полярная связь, потому что она имеет большую разность электроотрицательностей 1,4. Электроны в водороде больше притягиваются к электронам в кислороде, потому что кислород более электроотрицательный.
Неполярные связи также относятся к типу ковалентных связей. В отличие от полярных связей, неполярные связи делят электроны поровну. Связь между двумя или более атомами является неполярной, если атомы имеют одинаковую электроотрицательность или разность электроотрицательностей менее 0,4. Примером неполярной связи является связь в хлоре. Хлор содержит два атома хлора.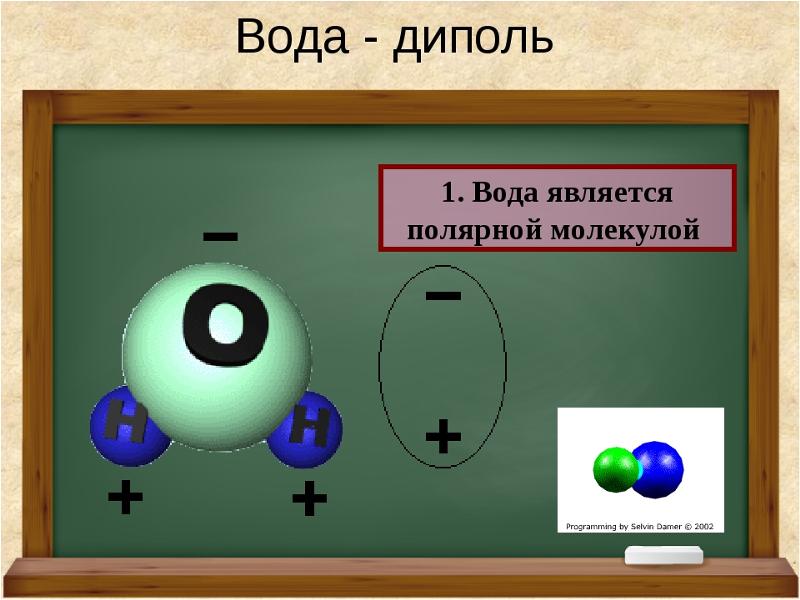 Электроны делятся поровну, потому что разница электроотрицательностей между двумя атомами равна нулю.
Электроны делятся поровну, потому что разница электроотрицательностей между двумя атомами равна нулю.
Что такое полярные молекулы?
В химии полярная молекула определяется как молекула, имеющая заряд на одной стороне молекулы, который не компенсируется. Он имеет область частичного заряда. Один конец слегка положительный, другой конец слегка отрицательный. Обычно они асимметричны, с неравномерным распределением электронов.
Полярные молекулы могут иметь ионные или полярные ковалентные связи. Молекула с двумя полюсами называется диполем . Когда вы измеряете величину полярности молекулы, результат называется 9.0007 дипольный момент .
Если молекула неполярна, то молекулы либо поровну делят электроны, т.е. они имеют неполярную связь или полярные связи симметричны в случае двуокиси углерода или четыреххлористого углерода. В этих молекулах есть диполи, но они компенсируются из-за симметрии.
Полярные молекулы имеют тенденцию слипаться и выстраиваться в группы, что влияет на свойства полярных соединений, таких как вода. Молекулы воды могут фактически выстраиваться под действием электростатической силы. Кроме того, полярные растворители склонны растворять полярные растворенные вещества, а неполярные растворители растворяют неполярные растворенные вещества.
Молекулы воды могут фактически выстраиваться под действием электростатической силы. Кроме того, полярные растворители склонны растворять полярные растворенные вещества, а неполярные растворители растворяют неполярные растворенные вещества.
Примеры полярных молекул
Является ли HF полярным?
Да, плавиковая кислота HF является полярной из-за большой разницы в электроотрицательности водорода и фтора. Молекула является полярно-ковалентной.
Является ли вода полярной молекулой?
Да, из-за изогнутой несимметричной формы молекулы. К атомам кислорода притягивается больше электронов, что приводит к суммарному заряду.
Является ли ацетон полярным или неполярным?
Из-за наличия карбонильной группы ацетон является несколько полярной молекулой. Существуют разные степени полярности, и ацетон менее полярен, чем вода, потому что только часть молекулы ацетона имеет полярную связь.
More examples of polar molecules
Sulfur dioxide SO 2 , ammonia NH 3 , carbon monoxide CO, ethanol C 2 H 5 OH, methanol CH 3 OH, hydrogen sulfide H 2 S, хлорметан CH 3 Cl, озон O3, трихлорид фосфора (поскольку он имеет тригонально-пирамидальную геометрию) PCl 3
Неполярные молекулы
В неполярной молекуле не образуются положительные или отрицательные полюса. Любые заряды распределяются равномерно по молекуле. Неполярные молекулы обычно симметричны, как тетраэдрическая молекула четыреххлористого углерода. Другим примером является трифторид бора, который является тригонально-плоским. В симметричных молекулах дипольные заряды компенсируются.
Любые заряды распределяются равномерно по молекуле. Неполярные молекулы обычно симметричны, как тетраэдрическая молекула четыреххлористого углерода. Другим примером является трифторид бора, который является тригонально-плоским. В симметричных молекулах дипольные заряды компенсируются.
Неполярные молекулы обычно хорошо растворяются в неполярных растворителях, но не растворяются в воде.
Примеры неполярных молекул
Является ли диоксид углерода полярным?
Нет, CO 2 не полярен, хотя связи полярны. Из-за линейной симметрии молекулы отрицательные заряды вокруг атомов кислорода компенсируются.
Является ли HCl полярной или неполярной?
Поскольку хлор более электроотрицателен, чем водород, соляная кислота HCl образует полярную связь и, следовательно, является полярной молекулой. Не существует симметрии, которая могла бы компенсировать дипольный заряд.
Другие примеры неполярных молекул
Бензол C 6 H 6 , Метан CH 4 , Четыреххлористый углерод CCl 4 , Трифторид бора (поскольку он имеет тригонально-плоскую геометрию) гексан C 6 H 14 , азот N 2
Наша новая интерактивная периодическая таблица
Лучший способ просмотреть свойства и тенденции элементов, включая электроотрицательность, — это наша новая супер-крутая интерактивная периодическая таблица.