МОДЕЛИ МОЛЕКУЛЯРНЫЕ • Большая российская энциклопедия
Авторы: Л. И. Беленький
МОДЕ́ЛИ МОЛЕКУЛЯ́РНЫЕ, наглядное изображение молекул органич. и неорганич. соединений, позволяющее судить о взаимном расположении атомов, входящих в молекулу. М. м. используют в тех случаях, когда по структурной формуле трудно или практически невозможно представить пространственное расположение атомов, в частности при изучении пространственной изомерии, в конформационном анализе, для оценки стерических препятствий.
Различают два осн. типа М. м.: 1) скелетные, приближённо отражающие ориентацию валентных связей, а иногда и орбиталей в пространстве, но не дающие представления об относит. размерах атомов; 2) объёмные, отображающие валентные углы, ковалентные радиусы атомов и их эффективные радиусы, близкие по значениям к ван-дер-ваальсовым.
К первому типу относятся известные с сер. 19 в. модели из шариков, соединённых отрезками проволоки (модели Кекуле – Вант-Гоффа). Более совершенны модели Дрейдинга (предложены в 1959 швейц. химиком А. Дрейдингом), состоящие из стальных стержней и трубок, соединённых в точке, изображающей ядро атома, под углами, равными валентным. Длины трубок и стержней пропорциональны длинам связей между атомами $\ce{H}$ и элемента (0,1 нм соответствует 2,5 см). Свободные концы трубок и стержней изображают ядра атомов Н, поэтому каждый фрагмент в отдельности является моделью молекулы простейшего водородного соединения к.-л. элемента ($\ce{CH_4, NH_3, H_2O, H_2S}$ и т. д.). Для сборки модели более сложного соединения стержень одного фрагмента вставляют в трубку другого; благодаря ограничит. устройству расстояние между центрами фрагментов пропорционально соответствующему межатомному расстоянию.
19 в. модели из шариков, соединённых отрезками проволоки (модели Кекуле – Вант-Гоффа). Более совершенны модели Дрейдинга (предложены в 1959 швейц. химиком А. Дрейдингом), состоящие из стальных стержней и трубок, соединённых в точке, изображающей ядро атома, под углами, равными валентным. Длины трубок и стержней пропорциональны длинам связей между атомами $\ce{H}$ и элемента (0,1 нм соответствует 2,5 см). Свободные концы трубок и стержней изображают ядра атомов Н, поэтому каждый фрагмент в отдельности является моделью молекулы простейшего водородного соединения к.-л. элемента ($\ce{CH_4, NH_3, H_2O, H_2S}$ и т. д.). Для сборки модели более сложного соединения стержень одного фрагмента вставляют в трубку другого; благодаря ограничит. устройству расстояние между центрами фрагментов пропорционально соответствующему межатомному расстоянию. Модели Дрейдинга верно отражают межатомные расстояния и валентные углы в молекулах. Они позволяют имитировать внутр. вращение, оценивать энергетич. выгодность разл. конформаций, измерять расстояния между непосредственно не связанными атомами. Модели Дрейдинга особенно широко применяют при изучении стереохимии полициклич. систем типа стероидов.
Модели Дрейдинга верно отражают межатомные расстояния и валентные углы в молекулах. Они позволяют имитировать внутр. вращение, оценивать энергетич. выгодность разл. конформаций, измерять расстояния между непосредственно не связанными атомами. Модели Дрейдинга особенно широко применяют при изучении стереохимии полициклич. систем типа стероидов.
Модели Стюарта – Бриглеба: а – метан; б – этилен; в – отдельный шаровой сегмент в разрезе.
Объёмные модели, правильно передающие размеры и форму молекул, были разработаны в 1934 нем. физиком Г. Стюартом и позднее усовершенствованы нем. физиком и химиком Г. Бриглебом (рис., а, б). Каждый фрагмент, изображающий атом определённого элемента, в моделях Стюарта представляет собой шаровой сегмент, причём радиус шара пропорционален эффективному радиусу атома ($r_{\text{эфф}}$), а расстояние от центра шара до плоскости среза – ковалентному радиусу ($r_{\text{ков}}$). В случае многовалентных атомов делают соответствующее число срезов, причём угол $α$ между перпендикулярами из центра шара на плоскости среза равен валентному (рис., в). По предложению Г. Бриглеба для атомов, соединённых кратными связями, сегменты изготовляют не из шаров, а из эллипсоидов, большая полуось которых соответствует эффективному радиусу, обусловленному наличием $π$-электронного, а малая – $σ$-электронного облака. Модели изготовляют обычно из пластмассы, окрашенной в цвета, установленные для каждого химич. элемента ($\ce{C}$ – чёрный, $\ce{H}$ – белый, $\ce{O}$ – красный, $\ce{N}$ – синий, $\ce{S}$ – жёлтый и т. д.). При сборке моделей сегменты соединяют между собой по плоскостям срезов, причём в случае простых связей сегменты могут вращаться один относительно другого. Модели Стюарта – Бриглеба верно передают валентные углы, межатомные расстояния и эффективные радиусы; они позволяют измерять расстояния между разл.
В случае многовалентных атомов делают соответствующее число срезов, причём угол $α$ между перпендикулярами из центра шара на плоскости среза равен валентному (рис., в). По предложению Г. Бриглеба для атомов, соединённых кратными связями, сегменты изготовляют не из шаров, а из эллипсоидов, большая полуось которых соответствует эффективному радиусу, обусловленному наличием $π$-электронного, а малая – $σ$-электронного облака. Модели изготовляют обычно из пластмассы, окрашенной в цвета, установленные для каждого химич. элемента ($\ce{C}$ – чёрный, $\ce{H}$ – белый, $\ce{O}$ – красный, $\ce{N}$ – синий, $\ce{S}$ – жёлтый и т. д.). При сборке моделей сегменты соединяют между собой по плоскостям срезов, причём в случае простых связей сегменты могут вращаться один относительно другого. Модели Стюарта – Бриглеба верно передают валентные углы, межатомные расстояния и эффективные радиусы; они позволяют измерять расстояния между разл.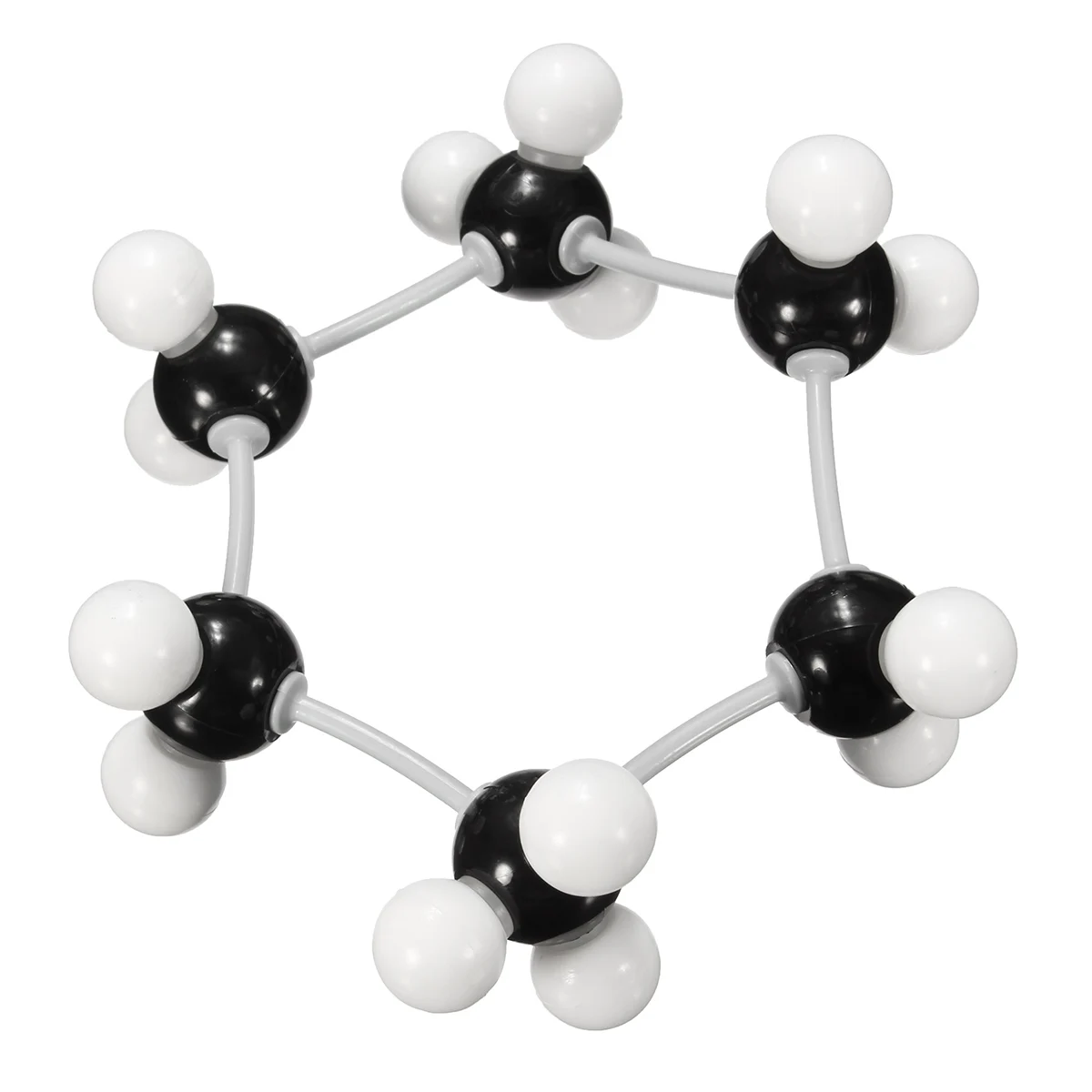 атомами и группами (0,1 нм соответствует 1,5 см). Эффективные радиусы, принятые в моделях Стюарта – Бриглеба, на 10–15% меньше ван-дер-ваальсовых радиусов, получаемых из кристаллографич. данных. Это связано с тем, что модели предназначены для рассмотрения стерических эффектов в молекуле, находящейся при обычных условиях, а не при темп-ре абсолютного нуля.
атомами и группами (0,1 нм соответствует 1,5 см). Эффективные радиусы, принятые в моделях Стюарта – Бриглеба, на 10–15% меньше ван-дер-ваальсовых радиусов, получаемых из кристаллографич. данных. Это связано с тем, что модели предназначены для рассмотрения стерических эффектов в молекуле, находящейся при обычных условиях, а не при темп-ре абсолютного нуля.
В связи с развитием компьютерной техники область использования классических М. м. заметно сузилась, поскольку во многих случаях они могут быть с успехом заменены виртуальными моделями, построенными на основании эксперим. структурных данных и результатов квантовохимич. расчётов, выполненных доступными для персональных компьютеров полуэмпирич. методами (см. Компьютерное моделирование в химии). Существующие программы позволяют видеть на экране и фиксировать на бумаге как скелетные, так и объёмные М. м. под разными углами и с разных сторон, как бы поворачивая молекулу; причём имеется возможность получения необходимых данных о межатомных расстояниях, валентных и диэдрических (двугранных) углах. Виртуальные модели могут быть использованы не только в процессе химич. исследований, но и для демонстрации в средней и высшей школе (при наличии необходимого оборудования).
м. под разными углами и с разных сторон, как бы поворачивая молекулу; причём имеется возможность получения необходимых данных о межатомных расстояниях, валентных и диэдрических (двугранных) углах. Виртуальные модели могут быть использованы не только в процессе химич. исследований, но и для демонстрации в средней и высшей школе (при наличии необходимого оборудования).
Модели молекул | Еврейская электронная библиотека
Полезно помнить, что слова выдуманы человеком.
Слова, которыми пользуются в жизни, имеют часто расплывчатый характер. Не все понимают одинаково слова сила и красота, энергия и напряжение. Да и «хорошая» погода разная для разных людей.
В науке такое положение дел не имеет места, во всяком случае не должно иметь. В особенности нетерпимо относятся к неточному использованию слов в физике.
Простейшие физические понятия придумывались для описания свойств и поведения предметов и тел, среди которых идет наша жизнь, короче говоря, для «больших» тел или, как еще мы говорим, для тел макроскопических.
Какие понятия, заимствованные из макромира, можно применять к молекулам? Все или некоторые? Истина лежит посредине.
А как обстоит дело с геометрическими и механическими понятиями? Можно ли говорить о форме молекулы, о ее упругости, о модуле изгиба и кручения, наконец, о пластичности молекул? Имеют ли смысл, и какой, понятия внутримолекулярных и межмолекулярных сил?
Цель этой статьи – показать, что с известными оговорками перенос на молекулу геометрических и механических понятий не только возможен, но и целесообразен.
Эта фраза означает следующее. В ряде случаев о молекуле можно говорить как о большом теле.
Тело, которому данную молекулу можно уподобить, назовем механической моделью молекулы.
Наша задача – рассказать, как эта модель строится и как используется для решения различных физических проблем.
Механическая модель молекулы получила в последнее время широкое распространение в связи с интересом к громадным (по сравнению с атомом) молекулам, из которых построены синтетические полимеры – капрон, найлон, полиэтилен (эти названия известны теперь каждому), а также важнейшие для жизнедеятельности животных и растений вещества – белки, нуклеиновые кислоты и так далее.
Всякое «изображение» молекулы должно состоять из описания взаимного расположения атомных ядер и характеристики движущихся около этих ядер электронов.
Химический опыт позволяет установить атомное строение молекулы (построить ее атомную модель), то есть указать, из каких атомов и как связанных друг с другом состоит молекула. Часть электронов тесно связана с определенными атомами, другая часть «обобществлена». Про эти электроны химики говорят – «они осуществляют химическую связь».
Конечно, атомная модель молекулы значительно проще электронно-ядерной. Но эта простота достигается за счет существенной потери. Теряется знание закона взаимодействия «строительных» частиц.
В электронно-ядерной модели взаимодействие между частицами, обеспечивающее структуру и свойства молекулы, – это электрическое взаимодействие между электронами и ядрами. Оно описывается законом Кулона: энергия взаимодействия электрона и ядра (или двух электронов, или двух ядер) равна e1e2/r (r – мгновенное расстояние между частичками.
Что же касается закона взаимодействия атомов, то он более сложен.
Может быть, испугаться этой трудности и предпочесть ясную электронно-ядерную картину молекулы? Нет, это было бы неверно. Правдивость самой картины отнюдь не является ее главным достоинством. Важно, чтобы наша модель молекулы хорошо «работала». А «хорошо работать» – это значит быстро и надежно предсказывать. Как бы точна ни была модель, но если «работать» с ней трудно, то мы задумаемся о другой, пусть более грубой, но зато более «работоспособной» модели.
Именно поэтому при изучении геометрии и механики молекулы мы отдаем предпочтение атомной модели. Сделать расчеты с помощью электронно-ядерной модели молекулы оказывается в этом случае нереалистичным, когда речь идет об интересующих нас проблемах: слишком много взаимодействующих частиц.
В то же время атомная модель молекулы позволяет истолковать и предсказать большую совокупность явлений.
В механической модели молекулы мы «забываем» про электроны и рассматриваем атом как кирпич мироздания. В механической модели за структуру и свойства молекулы отвечают взаимодействия атомов.
В механической модели за структуру и свойства молекулы отвечают взаимодействия атомов.
Модель молекулы можно нарисовать на бумаге, изготовить из проволоки, из шариков на пружинках… Существует множество типов моделей. Подходящим масштабом является сто миллионов. Размеры молекул указывают обычно в ангстремах. Один ангстрем – это стомилионная доля сантиметра. Расстояния между центрами атомов лежат в границах 1–2 ангстрема. Поэтому и удобен стомилионный масштаб: расположив центры «атомов» на расстояниях один-два сантиметра, мы легко разглядим детали строения, да и изготовлять шарики и срезы шариков (зачем нужны срезы, мы скажем ниже) такого размера вполне удобно.
В зависимости от целей и от личных вкусов используют те или иные модели. Пока что остановимся на скелетных моделях, то есть таких, в которых показаны (стерженьками) силы, соединяющие атомы в молекулу. Эти силы называют химическими, или валентными. О том, какие атомы с какими связаны, химики научились судить по химическим реакциям еще задолго до того, как физики научились устанавливать структуру молекулы своими методами.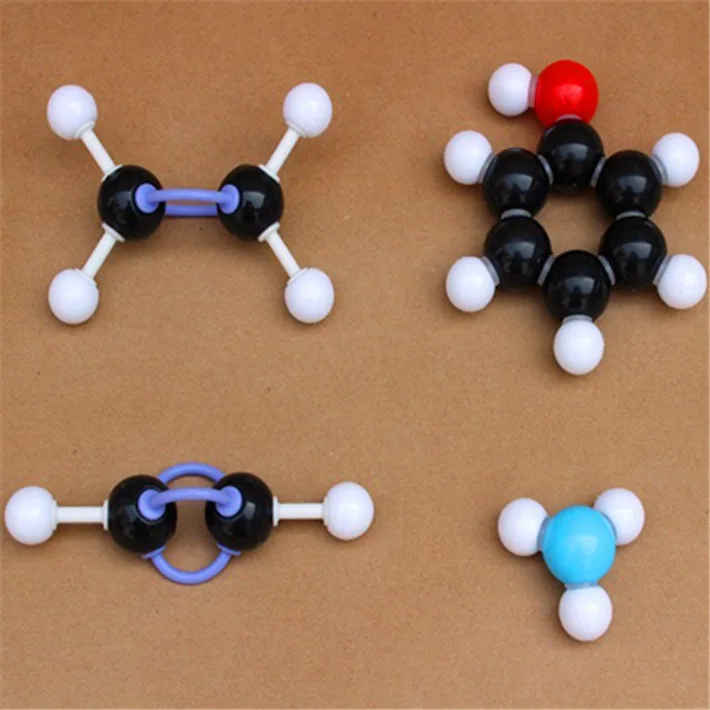
Итак, обратившись за указанием к химику, мы получаем от него сведения о том, как атомы присоединены друг к другу. Скажем, формула молекулы этилового спирта C2H5OH еще ничего не говорит о том, как соединены атомы между собой. Эта формула – так называемая брутто формула сообщает лишь сведения о составе. Разъясняя строение молекулы химик укажет нам: три атома водорода (рис. 1) соедините черточками с атомом углерода. (Эта группа атомов называется метильной.) Теперь, пожалуйста, соедините валентной черточкой атом углерода этой группы со вторым атомом углерода. Этот второй атом, кроме того, надо связать с парой атомов водорода, а четвертую черточку (раз четыре черточки от одного атома, значит, он четырехвалентный) приведите к атому кислорода. Оставшийся атом водорода следует присоединить к атому кислорода.
Физик сразу же задаст вопрос. А на каком расстоянии атомы, под какими углами друг к другу идут валентные черточки? На подобные вопросы ответы могут быть получены физическими исследованиями.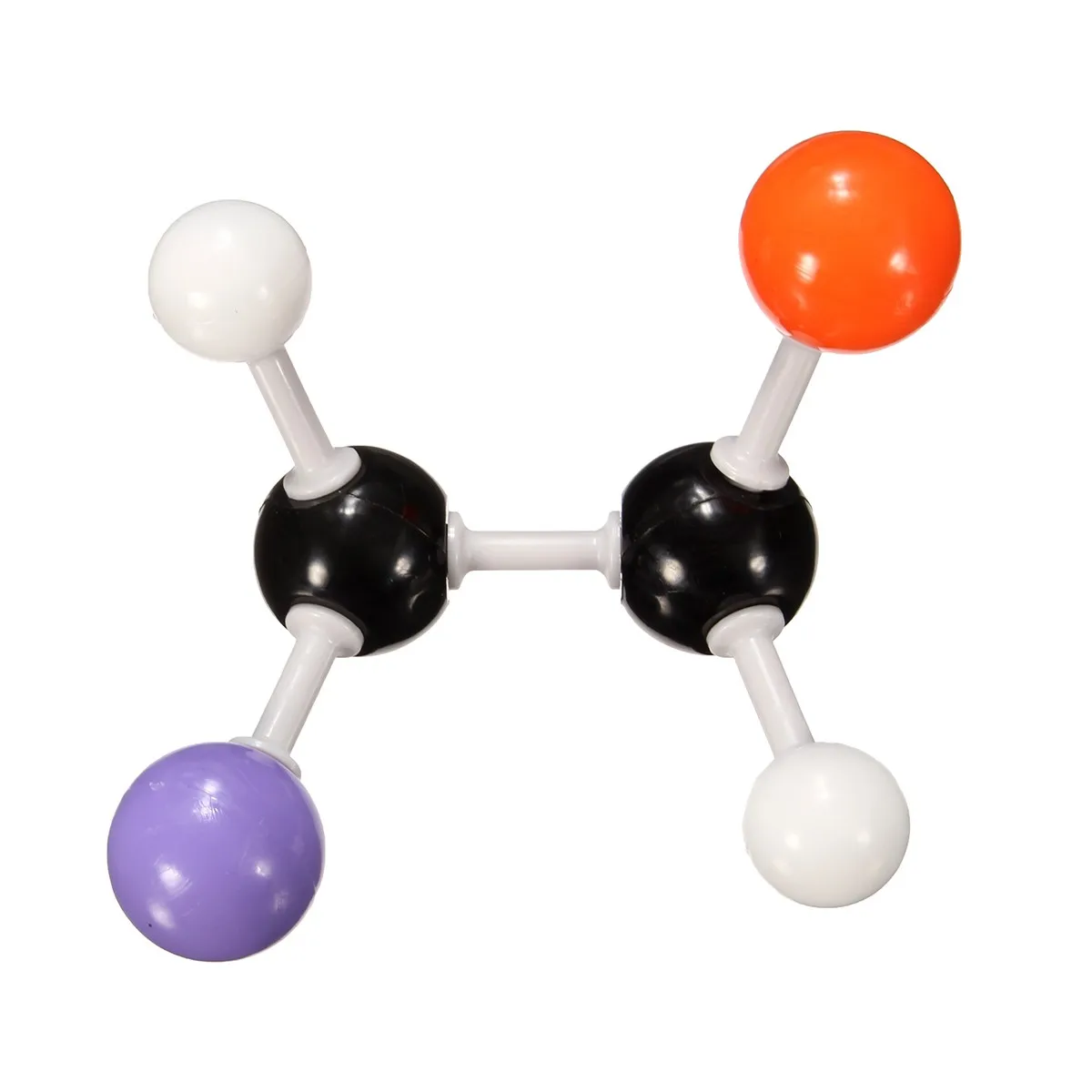
Теперь мы можем обратиться к проблеме межмолекулярных сил.
[1] [2]
Наборы молекулярных моделей, наборы, детали = Решения для молекулярного моделирования Indigo
Берете органическую химию или органическую и неорганическую химию? Наш базовый органический студенческий набор стоит $15,95 и включает в себя молекулярных орбиталей! Он поддерживается нашим конструктором 3D-молекулярных моделей. Компьютерная программа, специально разработанная для выбора лучших моделей органической химии для вас.
Компьютерная программа, специально разработанная для выбора лучших моделей органической химии для вас.
Нужно настроить или оживить любой набор или комплект? У нас есть полный ассортимент подлинного высококачественного
Преподавание криминалистики ДНК? Купите базовую мини-ДНК всего за 69,95 долларов США. Или поднимитесь на ступеньку выше, проведя практические эксперименты, используя нашу лучшую учебную модель ДНК с 262144 возможными уникальными последовательностями. Недостаточно? Как насчет 18 квадриллионов?
Нужны БОЛЬШИЕ пластиковые модели для демонстрации в классе ? Студенты-химики оценят нашу гигантскую модель кристаллической структуры циклогексана и 1000 атомов алмаза. Превратите базовый набор моделей фуллеренов в хиральные, зигзагообразные и «кресельные» бакитрубки или графеновые листы.
Получите полную информацию о нашем опыте в области молекулярных моделей в этом блестящем отзыве!
Молекулярные модели упорядочены по торговым маркам: Molymod, Orbit, Unit и Minit (компактные скелетные модели), которые отличаются стилем и размером атома . Бренды далее делятся на наборы, комплекты и детали.
Наборы для построения различных химических структур в общей и органической химии, моделей кристаллических решеток (
Наш конструктор 3D-молекулярных моделей может помочь создать любой органический набор для учащихся или учителей с одной или несколькими дополнительными моделями. Исследователи-фармакологи могут использовать его при разработке лекарств, чтобы помочь визуализировать молекулярную механику. Все для личного пользования. Может обозначать исследовательскую банку или класс 9.0005
Исследователи-фармакологи могут использовать его при разработке лекарств, чтобы помочь визуализировать молекулярную механику. Все для личного пользования. Может обозначать исследовательскую банку или класс 9.0005
Модели Indigo® дополнительно сгруппированы по функциям в ДНК, теорию VSEPR (молекулярная геометрия) и точечные группы (молекулярная симметрия) с некоторым совпадением с группами брендов. Кроме того, мы предлагаем модели органических молекул Unit (большие атомы), Minit (маленькие атомы) и AtoMag (магнитные).
Молекулярные модели для всех потребностей и всех уровней, независимо от того, преподаете ли вы химию в классе или онлайн. Молекулярные модели индиго являются идеальным дополнением для изучения основных концепций или сложных процессов в механизмах реакции горения. Это может варьироваться от простых химических концепций, таких как валентные углы (теория VSEPR), до молекулярных свойств различных молекул. Американское химическое общество заявляет, что построение и управление физическими моделями в трех измерениях развивает визуальное обучение и пространственные навыки, важные для понимания учащимися молекулярной структуры стереохимии.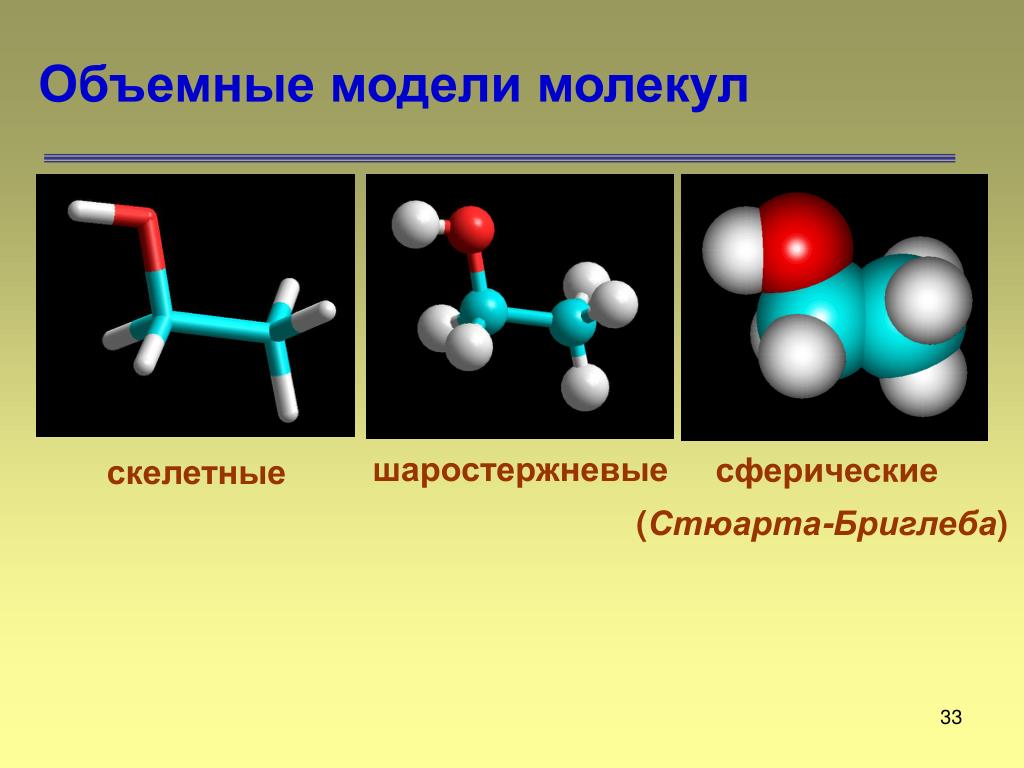
Зачем возиться с каркасными моделями вроде Darling Models Molecular Visions? Химические структуры выделяются шарико-стержневыми моделями (скелетными) с характерными переменными длинами химических связей для одинарных, двойных и тройных связей. Мы предлагаем модели, которые покрывают потребности бюджета от более низкой цены до высокой цены. Зачем покупать плохие китайские подделки Molymod, такие как NOBBY Organic chem или набор химических молекулярных моделей Linktor, чтобы изучать науку о макромолекулах? Особенно, когда наша обычная цена за количество превышает их цену продажи!
Описание Дополнительная информация Технический Часто задаваемые вопросы
Молекулярное моделирование — Последние исследования и новости
- Атом
- RSS-канал
Молекулярное моделирование охватывает все теоретические методы и вычислительные техники, используемые для имитации и изучения структуры и поведения молекул, начиная от небольших химических систем и заканчивая крупными биологическими молекулами и сборками материалов.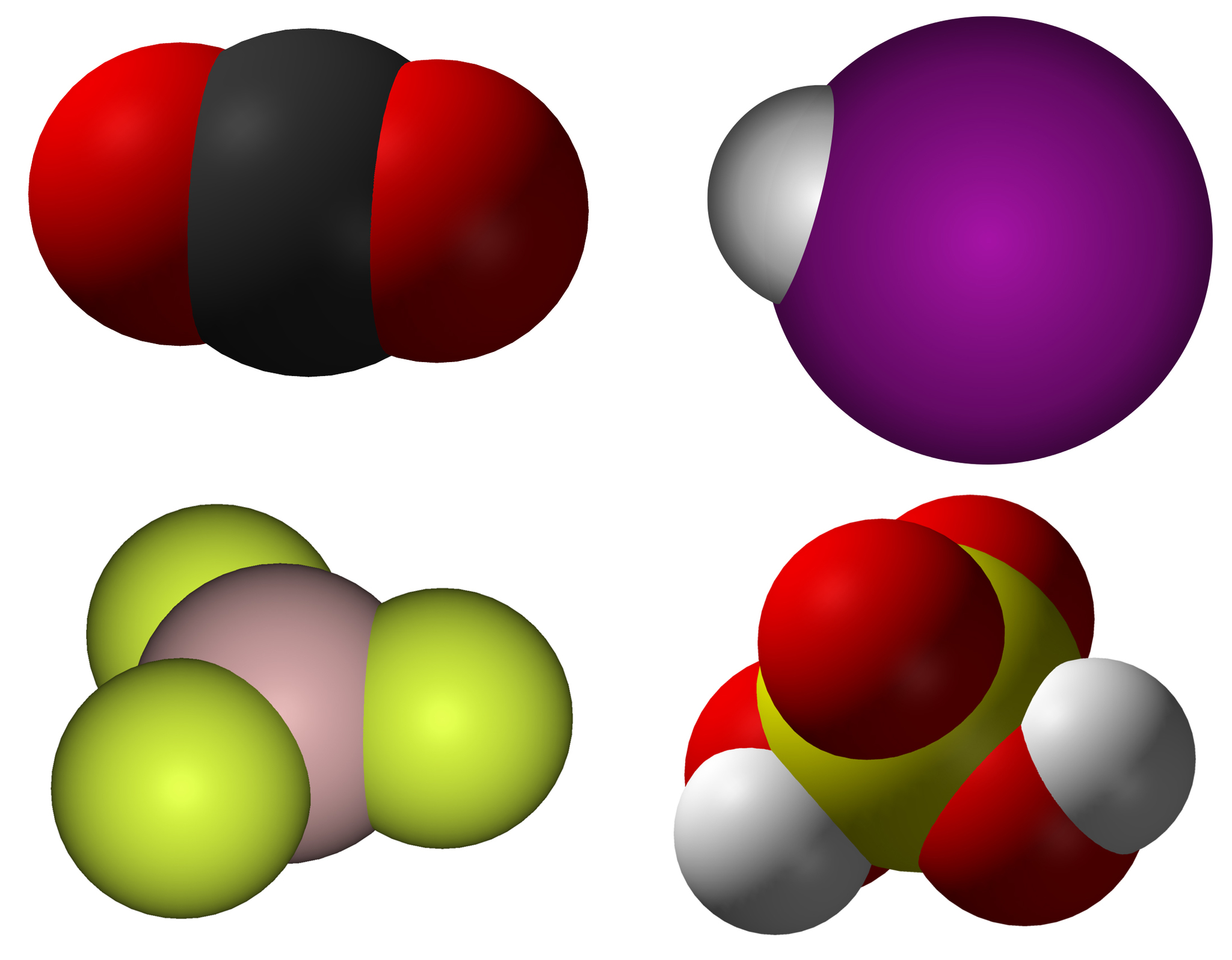
Последние исследования и обзоры
Исследовать |
- Пейюй Сюй
- , Сицзе Хуан
- и Х. Эрик Сюй
Клеточные исследования, 1-13
Исследовать
| Открытый доступРазработка белковых биосенсоров, которые реагируют на биомолекулы, вызывая клеточные реакции, в значительной степени зависит от связывания жестких молекул. Здесь авторы разрабатывают вычислительную стратегию для создания сигнальных комплексов между конформационно-динамическими белками и пептидами.
- Роберт Э. Джефферсон
- , Орельен Огье
- и Патрик Барт
Nature Communications 14, 2875
Исследовать
| Открытый доступ- Приянка Джайн
- , Джитендра Сатиджа
- и К. Суданадирадос
Научные отчеты 13, 8147
Исследовать
| Открытый доступИспользуя моделирование альфа-складки и крио-ЭМ реконструкцию, авторы раскрывают структурные и архитектурные принципы бактериальных функциональных амилоидных завитков, охватывающих непрерывную укладку β-соленоидных псевдоповторов внутри и между субъединицами.

- Майк Слейтел
- , Браджабандху Прадхан
- и Хан Ремаут
Nature Communications 14, 2822
Исследовать
| Открытый доступЦинк является важным металлом для многих белков. Здесь авторы предлагают модель, основанную на трехмерных сверточных сетях, для прогнозирования местоположения цинка в экспериментальных и расчетно предсказанных структурах в рамках, легко расширяемых для других металлов.

- Саймон Л. Дюрр
- , Андреа Леви
- и Урсула Ротлисбергер
Nature Communications 14, 2713
Исследовать |
Интегративная структурная биология, сочетающая количественную живую визуализацию, криокорреляционную микроскопию, усреднение субтомограмм и молекулярное моделирование, позволяет определить in situ структуру комплекса эндоплазматического ретикулума и митохондрий у дрожжей.

- Майкл Р. Возны
- , Андреа Ди Лука
- и Ванда Кукульски
Природа, 1-5
Все исследования и обзоры
Новости и комментарии
Основные результаты исследований |
- org/Person»> Лисинь Чжэн
- , Икун Яо
- и Майкл Дж. Ленардо
Клеточные исследования 33, 199-200
Основные результаты исследований |
- Каролина Сильва
- и Зеев А. Ронай
Клеточные исследования 33, 195-196
Комментарии и мнения |
Комментарий Кэтрин Тунясувунакоол из DeepMind — компании, стоящей за AlphaFold, о влиянии улучшенного предсказания структуры белка.
- Кэтрин Туньясувунакол
Nature Reviews Молекулярно-клеточная биология 23, 445-446
Новости и просмотры |




