Лабораторные работы 10-11 класс ЕМН | Опыты и эксперименты по химии:
Лабораторная работа №1
Изучение влияния строения веществ на их свойства
- Изготовление моделей молекул.
Задание. Постройте шаростержневые и масштабные модели молекул.
Выполнение опыта. Для построения молекул используйте пластилин или палочки. Для изготовления моделей, состоящих из различных атомов, используйте пластилин разных цветов.
Соберите шаростержневые и масштабные модели молекул фтороводорода, хлороводорода, йодоводорода, воды и сероводорода. Сделайте выводы.
- Свойства веществ, имеющих разные кристаллические решетки.
Задание. Исследуйте отношение к нагреванию веществ с ионной, атомной и молекулярной кристаллическими решетками.
Выполнение опыта. В четыре пробирки поместите около 0,5 г каждого вещества: кристаллической поваренной соли, чистого речного песка (SiO2), сахара и кристаллического йода. Пробирки с сахаром и йодом закройте кусочками ваты. Нагревайте пробирки в пламени горелки 2-3 мин. Какие изменения произошли в каждой пробирке? Сделайте выводы о физических свойствах каждого вещества, о строении их кристаллических решеток. Схематично изобразите строение кристаллов этих веществ.
Нагревайте пробирки в пламени горелки 2-3 мин. Какие изменения произошли в каждой пробирке? Сделайте выводы о физических свойствах каждого вещества, о строении их кристаллических решеток. Схематично изобразите строение кристаллов этих веществ.
Лабораторная работа №2
Получение гидроксидов и изучение их свойств.
Гидролиз солей.
Задание 1. На опытах исследуйте химические свойства щелочей, нерастворимых оснований, амфотерных гидроксидов и кислот.
Выполнение опыта. 1. В пробирку поместите 0,5 г оксида кальция и налейте 3-4мл воды. Полученный раствор разделите на три части и в каждую добавьте по одной капле различных индикаторов.
Растворы в двух пробирках нейтрализуйте растворами различных кислот.
Через раствор, находящийся в третьей пробирке, с помощью стеклянной трубочки продуйте воздух (осторожно, чтобы не разбрызгать раствор!). Что происходит в каждой трубке? Объясните наблюдаемые изменения и запишите уравнения протекающих реакций.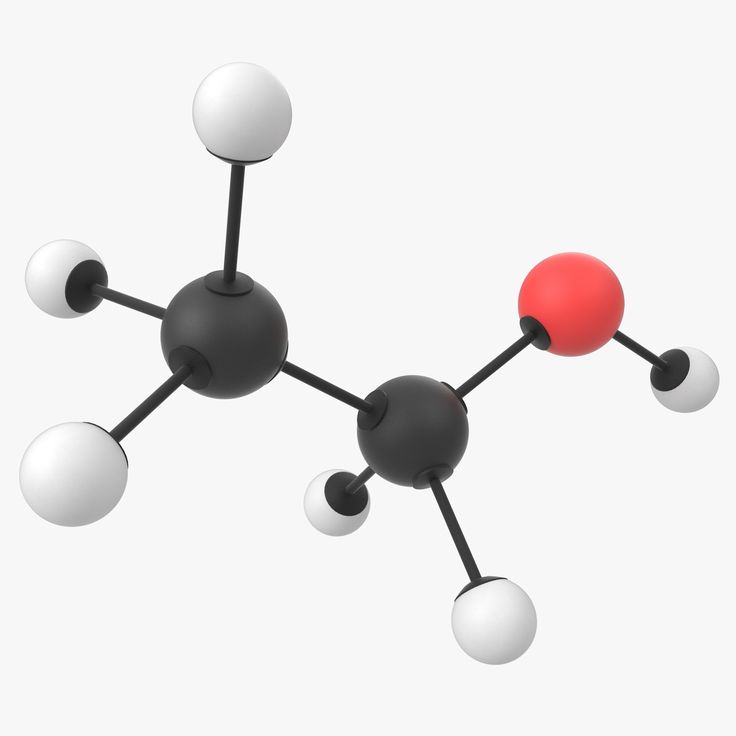
2. В чистую пробирку налейте 1-2 мл гидроксида натрия и добавьте несколько капель сульфата меди до образования осадка.
Полученное основание разделите на две части. Проверьте, как ведут себя не растворимые в воде основания при добавлении раствора кислоты и при нагревании. Запишите уравнения реакций. Сравните химические свойства щелочей и нерастворимых в воде оснований.
3. Налейте в пробирку 1 мл хлорида цинка и по каплям добавляйте раствор гидроксида натрия до образования студенистого осадка. Разделите осадок на две части. К одной добавьте раствор кислоты, а ко второй – раствор щелочи. Объясните наблюдаемые явления. Запишите уравнения протекающих реакций. Сделайте вывод о свойствах гидроксидов: щелочей, нерастворимых оснований, амфотерных гидроксидов и кислот.
Задание 2.Гидролиз солей. С помощью индикаторов определите среды растворов различных солей.
Выполнение опыта. 1. В пробирки налейте по 1 мл растворов хлорида натрия, карбоната натрия и сульфата алюминия.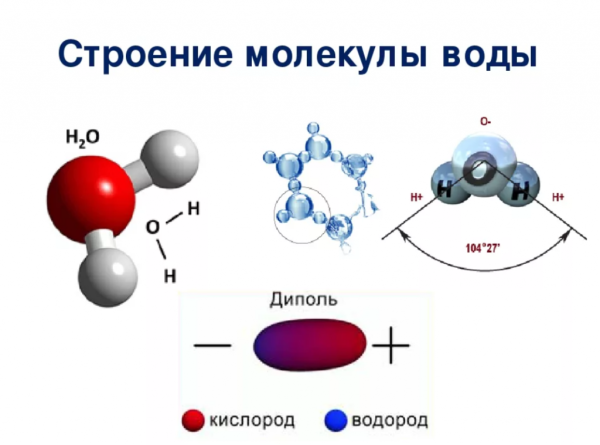 Проверьте, как изменится цвет красного и синего лакмуса при погружении в различные растворы.
Проверьте, как изменится цвет красного и синего лакмуса при погружении в различные растворы.
2. Добавьте в пробирки по одной капле фенолфталеина. Что наблюдаете? Результаты наблюдений оформите в виде таблицы.
3. Составьте уравнения реакций протекания гидролиза. Сделайте выводы.
Раствор соли | Фенолфталеин | Лакмус |
NaCl | ||
Na2CO3 | ||
Al2(SO4)3 |
Лабораторная работа №3
Химические свойства типичных металлов, неметаллов и амфотерных элементов.
Задание. Исследуйте химические свойства металлов, неметаллов и амфотерных элементов.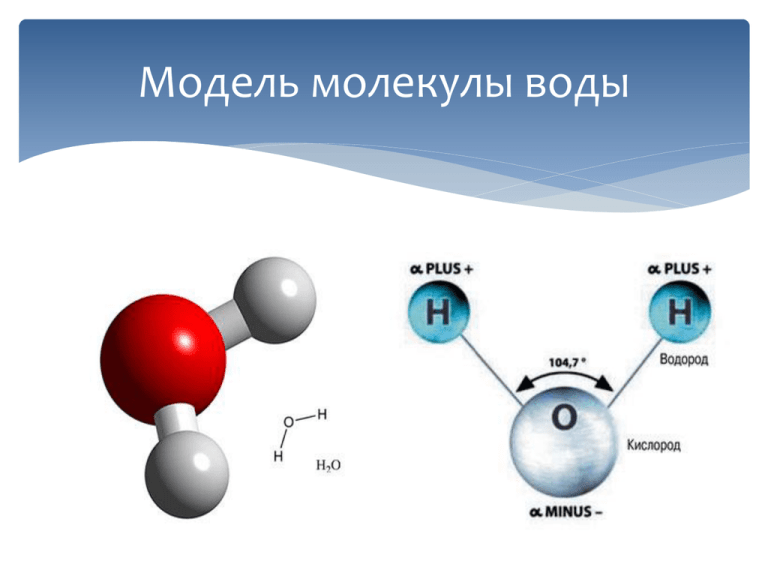
Опыт 1. Взаимодействие магния с кислотами и щелочами.
Выполнение опыта.
Поместите в две пробирки стружки магния.
В одну пробирку добавьте 10капель 1 М раствора серной кислоты, а в другую – 10 капель 1 М раствора гидроксида натрия.
Запись наблюдений и результатов опыта.
1. Запись наблюдения.
2. Напишите уравнения протекающих реакций
3. Запишите уравнения реакций взаимодействия магния с разбавленным и концентрированным растворами азотной кислоты, с концентрированным раствором серной кислоты. Расставьте коэффициенты методом электронного баланса.
Опыт 2. Взаимодействие алюминия с кислотами и щелочами.
Выполнение опыта.
Налейте в одну пробирку 10 капель 1 М раствора серной кислоты, а во вторую – 10 капель 1 М раствора гидроксида натрия. Опустите в них по грануле алюминия (или по кусочку алюминиевой фольги одинакового размера).
Запись наблюдений и результатов опыта.
1. Запись наблюдения.
2. Напишите уравнения протекающих реакций
3. Запишите уравнения реакций взаимодействия алюминия с разбавленной азотной кислотой. Расставьте коэффициенты методом электронного баланса.
Запишите уравнения реакций взаимодействия алюминия с разбавленной азотной кислотой. Расставьте коэффициенты методом электронного баланса.
Лабораторная работа №4.
6.1 Ознакомление с образцами важнейших солей натрия, калия, кальция и магния, сравнение химической активности металлов.
Задание. Ознакомьтесь с выданными образцами важнейших солей натрия, калия, кальция и магния и заполните таблицу.
Название | Формула | Внешний вид | Находится в природе или получают химическим путем | Применение |
6.2 Окрашивание пламени солями щелочных и щелочноземельных металлов.
Задание. Научитесь химическими методами определять наличие (или отсутствие) ионов калия, натрия, кальция. (Эти ионы можно идентифицировать по окраске пламени.)
(Эти ионы можно идентифицировать по окраске пламени.)
Выполнение опыта. 1. В пробирку налейте 1 мл соляной кислоты и опустите в нее на несколько секунд проволоку. Затем внесите проволоку в пламя и прокаливайте до тех пор, пока пламя не перестанет окрашиваться в неестественный для него цвет.
2. Остудите проволоку и возьмите ею крупинку сухой соли. Внесите проволоку в соляную кислоту и прокаливайте в пламени.
Чтобы лучше рассмотреть окрашивание пламени ионами калия, возьмите синее стекло. Результаты исследования оформите в тетради в виде таблицы.
Ионы | Соли | Окраска пламени |
Li+ | ||
Na+ | ||
K+ | ||
Ca+ |
6. 3 Получение известковой воды и ее взаимодействие с оксидом углерода (VI).
3 Получение известковой воды и ее взаимодействие с оксидом углерода (VI).
Задание. Изучите на опыте свойства соединения кальция.
Выполнение опыта. 1. В пробирку поместите немного оксида кальция и прилейте 3-4 мл воды. Полученный раствор испытайте раствором индикатора.
2. Часть жидкости отфильтруйте от осадка. Полученный прозрачный фильтрат разделите на две части.
3. Оставшуюся жидкость (с осадком) и фильтрат в одной из пробирок нейтрализуйте раствором соляной кислоты.
4. Через фильтрат, находящийся в третьей пробирке, с помощью стеклянной трубки продуйте воздух (осторожно, чтобы не разбрызгать раствор!). Объясните все явления, которые вы наблюдали. Запишите уравнения происходивших реакций.
Лабораторная работа №5
Качественные реакции на распознование ионов
Cu2+, Fe2+, Fe3+, Zn2+.
Задание. Проведите качественные реакции на ионы меди, железа, цинка.
Выполнение опыта.
1. Налейте в пробирку 1 мл раствора гидроксида натрия и добавьте несколько капель раствроа соли меди до выпадения осадка. Напишите ионное уравнение реакции. Отметьте признак протекания этой реакции.
Напишите ионное уравнение реакции. Отметьте признак протекания этой реакции.
2. К 4-5 каплям раствора хлорида или сульфата железа (III) добавьте 1-2 капли раствора тиоцианата калия. Как изменилась окраска раствора? Напишите ионное уравнение реакции, учитывая, что образовавшаяся соль – тиоцианат железа Fe(CNS)3 – малодиссоциирующее соединение.
3. К нескольким каплям раствора хлорида железа (II) добавьте 1-2 капли раствора красной кровяной соли. Какого цвета выпавший осадок? Напишите ионное уравнение реакции, учитывая, что осадок (турнбулева синь) имеет состав Fe3[Fe(CN)6]2.
4. Налейте в пробирку 1 мл раствора соли цинка и по каплям добавляйте раствор щелочи до выпадения студенистого бесцветного осадка. Напишите уравнение этой реакции в ионном виде.
Лабораторная работа №6
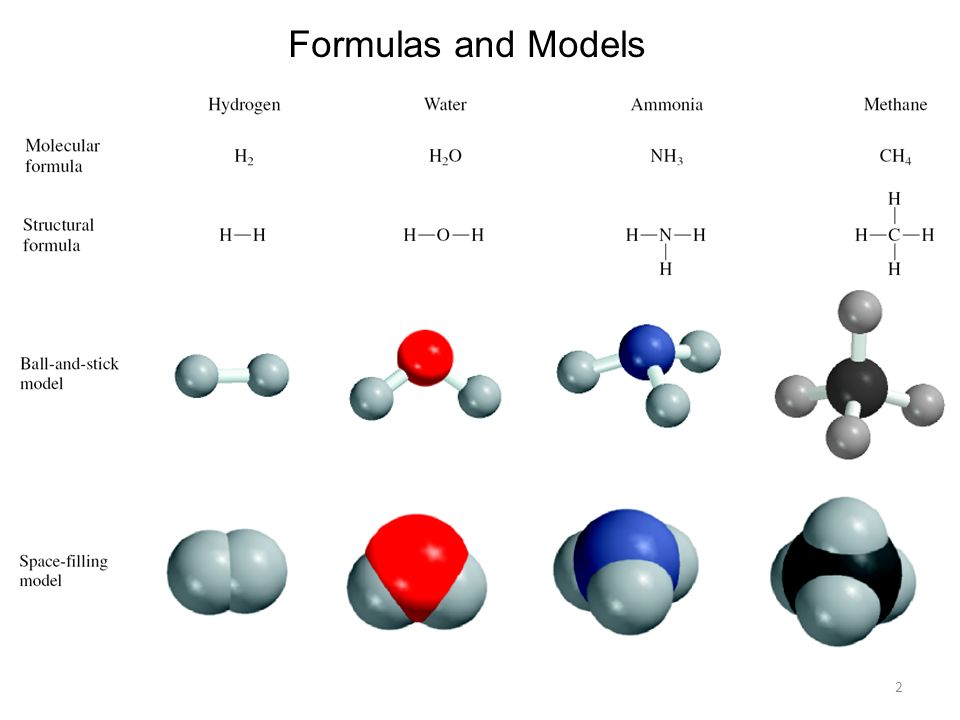
Составление шаростержневых моделей молекул метана, пропана, этилена, ацетилена, аммиака, воды, уксусной кислоты.
Необходимые материалы и приспособления: пластилин светлого и темного цвета (или пластмассовые шары), палочки и спички.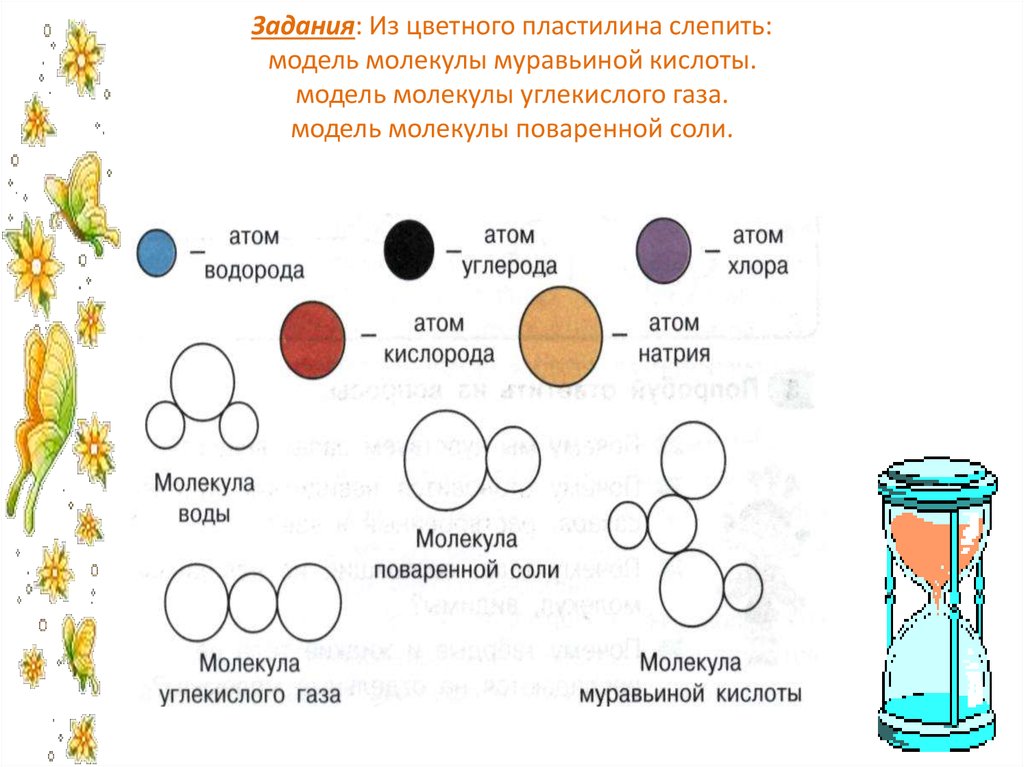
Модель молекуля метана Ch5
Из белого или светло-голубого пластилина (или из другого материала) изготовьте четыре небольших шарика одинакового размера, из пластилина темного цвета – один шарик, диаметр которого в 1,5раза больше предыдущих, что приблизительно правильно передает соотношение размеров атомов углерода и водорода. Наметьте на поверхности темного шарика, изображающего углерод, четыре равноудаленные друг от друга токи, вставьте в этих местах палочки (спички) и с помощью них присоедините светлые шарики, изображающие водород.
Модель молекулы пропана C3H8
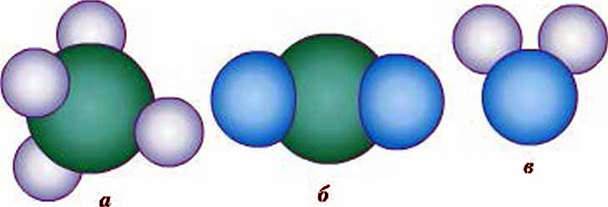
Из белого или светло-голубого пластилина изготовьте 8 шариков одинакового размера (атомы водорода) и из темного пластилина – три шарика (атомы углерода). Как и в предыдущем случае, темные шарики должны бать больше светлых в 1,5 раза. Три темных шарика (атомы углерода) соедините между собой с помощью палочек или спичек таким образом, чтобы угол между ними составлял 109°. Теперь к каждому «атому углерода» присоедините, как и в предыдущем случае, «атомы водорода».
Модели молекул этана, этилена и ацетилена.
Аналогичным способом (как и в случаях изготовления моделей молекул (Ch5 и C3H8) постройте модели молекул этана (C2H6), этилена (C2h5) и ацетилена (C2h3).
Модель молекулы уксусной кислоты СН3СООН.
Изготовив из пластилина красного цвета атомы кислорода, постройте модель молекулы уксусной кислоты.
Модель молекулы аммиака Nh4.
Из пластилина зеленого цвета изготовьте шарик (атом азота), который должен быть в 2 раза больше, чем «атомы водорода». Поместив «атом азота» в вершину, постройте треугольную пирамиду, основание пирамиды образуют «атомы водорода» соединенные между собой с помощью палочек или спичек.
Модель молекулы воды Н2О.
Соедините два светлых шарика – «атомы водорода» с «атомом кислорода» (красный шарик) так, чтобы между «атомами водорода» образовался угол, равный 104°.
Лабораторная работа № 7
Получение этилена и изучение его свойств
Реактивы и оборудование: металлический штатив с лапкой, спиртовка (горелка), пробирка с газоотводной трубкой, две пробирки (поменьше), осколки фарфоровой посуды, этиловый спирт, серная кислота, бромная (йодная) вода (2-3 капли брома или йода в 50 мл воды), раствор перманганата калия, подкисленный серной кислотой, спички.
Собрав установку для получения газа, проверьте ее герметичность.
Выполнение работы.
Получение этилена дегидратацией этилового спирта. В сухую пробирку налейте 3-4 мл готовой смеси этилового спирта и концентрированной серной кислоты и поместите в нее несколько осколков фарфоровой чашки (для равномерного кипения).
Закройте пробирку пробкой с газоотводной трубкой и укрепите в лапке штатива. Смесь нагревайте осторожно, соблюдая правила техники безопасности.
Взаимодействие этилена с бромной (йодной) водой. Конец газоотводной трубки погрузите в пробирку, где находится 1,5 мл бромной (йодной) воды, пропускайте этилен до тех пор, пока раствор на обесцветится.
Взаимодействие этилена с раствором перманганата калия. Не прекращая нагревания смеси, опустите конец газоотводной трубки в пробирку с подкисленным раствором перманганата калия. Пропускайте этилен до обесцвечивания раствора.
Горение этилена. Не прекращая нагревания смеси, поверните газоотводную трубку отверстием вверх и подожгите выделяющийся газ, обратите внимание на горение этилена. Прекратите нагревание, уберите рабочее место.
Прекратите нагревание, уберите рабочее место.
Ответьте на следующие вопросы:
А) Какой газ выделяется при нагревании смеси этилового спирта и серной кислоты?
Б) Что вы заметили при пропускании этилена через бромную (йодную) воду и раствор перманганата калия?
В) Почему этилен горит более светящимся пламенем, чем метан?
Г) Чем отличаются свойства этилена от свойств насыщенных углеводородов?
Написав уравнения соответствующих реакций, объясните замеченные вами изменения.
Лабораторная работа №8
Растворение глицерина в воде и его реакция
с гидроксидом меди(II)
Реактивы и оборудование: глицерин, дистиллированная вода, 2 %-ный раствор сульфата меди (II), 10 %-ный раствор гидроксида натрия, пробирки.
Выполнение работы
1. В пробирку налейте 2-3 мл дистиллированной воды и добавьте 0,5-1 мл глицерина, тщательно перемешайте смесь. Обратите внимание, глицерин, как более тяжелая жидкость, образует нижний слой.
2. В пробирку налейте 3-4 мл раствора сульфата меди (II) и добавьте раствор гидроксида натрия до выпадения осадка. Чтобы опыт удался, нужно взять избыток щелочи. Полученную смесь разделите в две пробирки, в одну внесите несколько капель глицерина и сравните с содержимым второй пробирки. Смесь с глицерином хорошенько взболтайте и снова сравните с содержимым второй пробирки. Осадок в пробирке с глицерином растворяется и образуется раствор синего цвета.
Чтобы опыт удался, нужно взять избыток щелочи. Полученную смесь разделите в две пробирки, в одну внесите несколько капель глицерина и сравните с содержимым второй пробирки. Смесь с глицерином хорошенько взболтайте и снова сравните с содержимым второй пробирки. Осадок в пробирке с глицерином растворяется и образуется раствор синего цвета.
Объяснив наблюдаемые явления, напишите уравнения реакции.
Лабораторная работа №9
Цветные реакции белков.
Реактивы и оборудование: штатив, пробирка, пипетка, фильтровальная бумага, воронка, колба, нагревательный прибор, белок яйца, 10 %-ный раствор гидроксида натрия, 5 %-ный раствор сульфата меди (II), 10 %-ный раствор гидроксида аммония, ацетат свинца, концентрированная азотная кислота, формалин, этанол.
Выполнение работы
1. Биуретовая реакция. В пробирку налейте 2 мл раствора белка и 2 мл раствора гидроксида натрия, добавьте 2-3 капли раствора сульфата меди (II). При встряхивании смеси образуется красно-фиолетовое окрашивание, что свидетельствует о наличии в смеси белка. Такая качественная реакция называется биуретовой.
Такая качественная реакция называется биуретовой.
2. Ксантопротеиновая реакция. В пробирку налейте 4 мл раствора белка и 1 мл концентрированной азотной кислоты, осторожно нагрейте смесь. При этом выпадет осадок. Какой он имеет цвет?
Если в обезжиренное молоко добавить несколько капель азотной кислоты, то начинается свертывание белка. Какая реакция при этом происходит?
3. Выпадение белка в осадок в присутствии солей тяжелых металлов.
Возьмите две пробирки, в каждую налейте по 2 мл раствора белка, затем внесите несколько капель в первую пробирку раствора сульфата меди (II), во вторую – раствора ацетата свинца (II). В пробирках образуются творожистые осадки, так как в растворах солей белки плохо растворяются. Объясните происходящие в пробирках изменения.
4. Действие формалина и спирта на белки. Возьмите две пробирки, налейте в одну этиловый спирт, во вторую — формалин. Добавьте в пробирки по 1 мл раствора белка. В обеих пробирках выпадает осадок. Почему осадки не растворяется в воде?
5. Свертывание (денатурация) белков при нагревании. Налейте в пробирку раствор яичного белка и нагревайте до кипения. Растворяется ли полученный осадок при добавлении воды? Объясните, почему осадок не растворяется.
Свертывание (денатурация) белков при нагревании. Налейте в пробирку раствор яичного белка и нагревайте до кипения. Растворяется ли полученный осадок при добавлении воды? Объясните, почему осадок не растворяется.
Лабораторная работа №10
Распознавание пластмасс и волокон
Оборудование и реактивы: образцы пластмасс и волокон под номерами, спиртовка, спички, стеклянные палочки, тигельные щипцы, асбестовые сетки.
В разных пакетах под номерами имеются образцы пластмасс. Пользуясь приведенными ниже данными, определите, под каким номером какая пластмасса находится.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пламенем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до черного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
Распознавание волокон.
В разных пакетах под номерами содержатся образцы волокон. Пользуясь приведенными ниже данными, определите, под каким номером какое волокно находится.
Хлопок. Горит быстро, распространяя запах жженной бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженных перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Модели молекул метана, этана, пропана, бутана, изобутана — КиберПедия
Ход работы:
Задание 1.Напишите структурные формулы следующих соединений:
А) нонан Б) декан В) гексан Г) октан
А____________________________________________________________________________
Б____________________________________________________________________________
В____________________________________________________________________________
Г____________________________________________________________________________
Задание 2.Соберите модель молекулы метана. Для этого из пластилина светлых тонов изготовьте четыре небольших шарика, а из пластилина темных тонов — один шарик, который приблизительно в два раза больше предыдущих. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями
Для этого из пластилина светлых тонов изготовьте четыре небольших шарика, а из пластилина темных тонов — один шарик, который приблизительно в два раза больше предыдущих. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями
С-Н составляет 109°, т.е. молекула имеет тетраэдрическое строение. Нарисуйте шаростержневую модель молекулы метана.
Задание 3.Соберите модель молекулы н-бутана, используя пластилин. Аналогично соберите модель молекулы изобутана. Учтите, что в молекуле бутана атомы углерода расположены по соотношению друг к другу под углом 109°, т.е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов. Нарисуйте шаростержневые модели молекул бутана и изобутана.
Задание 4.Напишите структурные формулы всех возможных изомеров гексана. Назовите их по международной номенклатуре.
Задание 5.Напишите структурные формулы следующих углеводородов:
А) 2-метилгексан:
Б) 2,2-диметилпентан;
В) н-пентан;
Г) 2,2-диметил-4этилгексан;
Д) 2,3,4-триметилпентан;
Е) 2-этилпентан
| А | Г |
| Б | Д |
| В | Е |
Вопросы для закрепления материала:
1.Запишите определения.
Органические соединения — _____________________________________________________
_____________________________________________________________________________
Органическая химия — __________________________________________________________
_____________________________________________________________________________
Углеводороды — _______________________________________________________________
_____________________________________________________________________________
Гомологический ряд — _________________________________________________________
_____________________________________________________________________________
Гомологи — ___________________________________________________________________
_____________________________________________________________________________
Изомеры — ____________________________________________________________________
_____________________________________________________________________________
Изомерия — ___________________________________________________________________
_____________________________________________________________________________
2. Укажите валентность элементов в органических соединениях:
Укажите валентность элементов в органических соединениях:
А) углерода ______; Б) водорода ______; В) кислорода _______; Г) азота ______.
3. Подчеркните формулы органических соединений. ВаСО3, СН4, СО2, СН3ОН, Н2СО3, НСl,С4Н10, СО, С6Н6,Na2СО3,С2Н5СООН,С2Н2, NН3, КНСО3,СН3NН2
Выпишите формулы углеводородов_______________________________________________
_____________________________________________________________________________
4.Определите степень окисления элементов в соединениях: СН4; С2Н2; С2Н4
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: 90 мин.
Максимальное время выполнения задания: 90 мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:Выполнение работы более 90% –оценка «5»,
70-90% — оценка «4»,
50 -70% — оценка «3»,
Менее 50% — оценка «2».
Лабораторная работа №6
Тема работы:Кислородсодержащие органические соединения.
Цель:изучить химические свойства этилового спирта, глицерина,уксусной кислоты, глюкозы, сахарозы и крахмала.
Техника безопасности
1. Работа с нагревательными приборами.
2. Работа с химической посудой.
3. Работа с химическими реактивами.
Оборудование и реактивы: штатив с пробирками, спиртовка, медная проволока, гранулы цинка, оксид меди (II), кристаллический карбонат натрия,крахмал, растворы глицерина, гидроксида натрия, сульфата меди (II), глюкозы, сахарозы, этилового спирта,спиртового раствора йода, вода.
Задание:Выполните опыты и оформите отчет, заполнив таблицу.
Теоретическая часть
К кислородсодержащим органическим соединениям, которые состоят из атомов углерода, водорода и кислорода, относятся спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры, углеводы. Их химические свойства определяются наличием в молекулах различных функциональных групп.
Этиловый спирт С2Н5ОН-бесцветная жидкость со своеобразным запахом, легче воды, хорошо растворим в воде и сам является растворителем многих неорганических и органических веществ. Этанол – ядовитое наркотическое вещество. Спирт легко воспламеняется и горит синеватым почти не светящимся пламенем. Этиловый спирт реагирует со щелочными металлами с образованием алкоголятов.
2С2H5OH + 2Na = 2C2H5ONa +H2
Этанол вступает в реакцию дегидратации:
С2Н5ОН→С2Н4↑ + Н2О
Межмолекулярная дегидратация:
С2Н5ОН + НОС2Н5 = С2Н5-О-С2Н5 + Н2О
Оксид меди (II) окисляет спирт в альдегид:
С2Н5ОН + СuО = СН3-СНО + Н2О + Сu
С карбоновыми кислотами спирт образует сложные эфиры:
СН3-СООН + С2Н5ОН = СН3-СОО-С2Н5+ Н2О
Глицерин-это представитель трехатомных спиртов. Он неограниченно растворим в воде, очень гигроскопичен, не ядовит. Если оставить глицерин в открытом сосуде, его масса увеличивается до 40% за счёт поглощения влаги из воздуха. Это свойство широко используется в парфюмерной промышленности. Глицерин используют как пищевую добавку при изготовлении кондитерских изделий и напитков, при производстве пластмасс, в кожевенном производстве и текстильной промышленности, а также для изготовления взрывчатых веществ. Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди (II), который растворяется с образованием ярко-синего раствора.
Он неограниченно растворим в воде, очень гигроскопичен, не ядовит. Если оставить глицерин в открытом сосуде, его масса увеличивается до 40% за счёт поглощения влаги из воздуха. Это свойство широко используется в парфюмерной промышленности. Глицерин используют как пищевую добавку при изготовлении кондитерских изделий и напитков, при производстве пластмасс, в кожевенном производстве и текстильной промышленности, а также для изготовления взрывчатых веществ. Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди (II), который растворяется с образованием ярко-синего раствора.
Карбоновые кислоты – это органические вещества в состав которых входит карбоксильная группа – СООН, связанная с углеводородным радикалом.
Класс карбоновых кислот очень разнообразен. Начинает гомологический ряд муравьиная кислота или метановая (НСООН).Муравьиная кислота – это жидкость с резким запахом, хорошо растворимая в воде, ядовита, при попадании на кожу вызывает ожоги.
Уксусная кислота часто встречается в растениях, в выделениях животных, образуется при окислении органических веществ. Из всех карбоновых кислот она имеет самое широкое применение. Всем известно использование водного раствора уксусной кислоты – уксуса в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей). Путем различных реакций солеобразования получают соли уксусной кислоты – ацетаты. Уксусная кислота используется для получения искусственных волокон, пластмасс на основе целлюлозы, производства красителей (индиго), медикаментов (аспирин), ядохимикатов, органического стекла. Сама кислота и её эфиры являются хорошими растворителями.
При диссоциации уксусной кислоты образуются ионы водорода:
СН3COOH → СН3COO— + H+
Карбоновые кислоты реагируют с активными металлами и их оксидами, со щелочами:
2СН3СООН + 2К = 2СН3СООК + Н2
ацетат калия
СН3СООН + КОН = СН3СООК + Н2О
Взаимодействуют со спиртами с образованием сложных эфиров:
СН3CОOН + НOС2Н5 → СН3COОС2Н5 + Н2О
этиловый эфир уксусной кислоты
Углеводы представляют собой конечные продукты фотосинтеза и являются исходными веществами для биосинтеза других органических соединений. Одним из наиболее распространенных моносахаридов является глюкоза, которая имеет молекулярную формулу С6Н12О6.Глюкоза – белое кристаллическое вещество сладкого вкуса, хорошо растворимое в воде. По химическому строению глюкоза многоатомный спирт и альдегид, содержит пять гидроксильных групп –ОН и одну карбонильную группу. Как альдегид она вступает в реакции гидрирования, дает реакцию «серебряного зеркала». Как многоатомный спирт, вступает в реакцию этерификации. Специфическим свойством глюкозы является процесс брожения. Существует несколько типов брожения: спиртовое, молочнокислое и маслянокислое. В живом организме глюкоза окисляется кислородом воздуха до углекислого газа и воды, с выделением большого количества энергии.
Одним из наиболее распространенных моносахаридов является глюкоза, которая имеет молекулярную формулу С6Н12О6.Глюкоза – белое кристаллическое вещество сладкого вкуса, хорошо растворимое в воде. По химическому строению глюкоза многоатомный спирт и альдегид, содержит пять гидроксильных групп –ОН и одну карбонильную группу. Как альдегид она вступает в реакции гидрирования, дает реакцию «серебряного зеркала». Как многоатомный спирт, вступает в реакцию этерификации. Специфическим свойством глюкозы является процесс брожения. Существует несколько типов брожения: спиртовое, молочнокислое и маслянокислое. В живом организме глюкоза окисляется кислородом воздуха до углекислого газа и воды, с выделением большого количества энергии.
Глюкоза – основной источник энергии в клетке. Именно она используется в лечебных целях (применяют внутрь или вводят внутривенно ослабленным больным). Кроме того глюкозу используют для получения различных соединений: этилового спирта, молочной кислоты и др. В пищевой промышленности ее применяют в качестве заменителя сахарозы. В молекуле глюкозы объединяются свойства альдегида и многоатомного спирта, поэтому глюкозу называютальдегидоспиртом. Подобно многоатомным спиртам глюкоза с гидроксидом меди (II) образуется ярко-синий раствор.
В пищевой промышленности ее применяют в качестве заменителя сахарозы. В молекуле глюкозы объединяются свойства альдегида и многоатомного спирта, поэтому глюкозу называютальдегидоспиртом. Подобно многоатомным спиртам глюкоза с гидроксидом меди (II) образуется ярко-синий раствор.
При нагревании глюкозы с Cu(OH)2 получается характерная реакция на альдегиды – «медное зеркало».
СН2ОН ─ (СНОН)4 ─ C ═ O + 2Cu(OH)2 = CH2OH ─ (CHOH)4 ─ C ═ O + Cu2O↓ + 2H2O
│ │
H OH
При нагревании глюкозы с аммиачным раствором оксида серебра получается характерная реакция на альдегиды – «серебряное зеркало».
СН2ОН ─(СНОН)4 ─C ═ O + Ag2O → CH2OH ─(CHOH)4 ─ C ═ O + 2Ag↓
│ │
H OH
Под действием биологических катализаторов – ферментов – глюкоза способна превращаться в спирт – это так называемое спиртовое брожение.
С6Н12О6 → 2С2Н5ОН + 2СО2
Крахмал представляет собой белый аморфный порошок, нерастворимый в холодной воде. В горячей воде крахмал сначала набухает, а затем дает вязкий раствор, который называется клейстером. Крахмал является смесью полисахаридов, поэтому не дает реакций, свойственных моносахаридам. Он не обладает восстановительными свойствами – не образует красного осадка оксида меди (I). При действии минеральных кислот крахмал гидролизуется до глюкозы.
В горячей воде крахмал сначала набухает, а затем дает вязкий раствор, который называется клейстером. Крахмал является смесью полисахаридов, поэтому не дает реакций, свойственных моносахаридам. Он не обладает восстановительными свойствами – не образует красного осадка оксида меди (I). При действии минеральных кислот крахмал гидролизуется до глюкозы.
(С6Н10О5)n + nH2O → nC6H12O6
Характерной реакцией на крахмал является реакция его с раствором иода — раствор окрашивается в интенсивный синий цвет.
Ход работы
| Опыт | Результаты | |
| Опыт №1 Окисление этилового спирта оксидом меди (II). | В пробирку поместите 4 капли этилового спирта и погрузите в нее прокаленную медную спираль, покрытую черным налетом оксида меди (II). | Что наблюдаете? ___________________________________ ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ |
| Опыт №2 Получение глицерата меди | В пробирку налейте 1 мл 10%-го раствора сульфата меди (II) и добавьте немного 10%-го раствора гидроксида натрия. К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. К полученному осадку добавьте по каплям глицерин. Взболтайте смесь.
| Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ ___________________________________ |
| Опыт №3 Свойства уксусной кислоты. | В три пробирки налейте по 2 мл уксусной кислоты. В первую пробирку добавьте гранулу цинка, во вторую – несколько крупинок оксид меди (II), в третью – кристаллический карбонат натрия. | Что наблюдаете? 1 пробирка__________________________ 2 пробирка__________________________ 3 пробирка__________________________ Напишите уравнения реакций 1 __________________________________ ___________________________________ 2 __________________________________ ___________________________________ 3 _________________________________ ___________________________________ |
Опыт №4 Действие гидроксида меди (II) на глюкозу.
| а) В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). б) К полученному раствору добавьте 1 мл воды и нагрейте на пламени спиртовки только верхнюю часть раствора. | Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ____________________________________ |
| Опыт №5 Действие гидроксида меди (II) на сахарозу. | В пробирку прилейте 0,5 мл раствора сахарозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Полученный раствор осторожно нагрейте. | Что наблюдаете? ___________________________________ ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ |
Опыт №6
Действие йода на крахмал.
| В стакан с 20 мл воды, нагретой до кипения, добавьте 2 г крахмала, хорошо размешайте образовавшуюся суспензию до образования прозрачного коллоидного раствора – крахмального клейстера. Налейте в пробирку 2-3 мл охлажденного клейстера и добавьте несколько капель спиртового раствора йода. Нагрейте смесь в пробирке. | Что наблюдаете? ___________________________________ __________________________________ __________________________________ __________________________________ ___________________________________ ___________________________________ |
Общий вывод:_________________________________________________________________
__________________________________________________________________
_______________________________________________________________
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
Вопросы для закрепления материала:
1. Почему глюкоза проявляет свойства альдегидов и спиртов?
Почему глюкоза проявляет свойства альдегидов и спиртов?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
2. Почему сахароза не дает реакцию «серебряного зеркала»?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
3. Как можно обнаружить крахмал в продуктах питания?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
4. В трех пробирках находятся растворы: уксусной кислоты, глюкозы и глицерина. Определите характерными реакциями, в какой из пробирок находится какое вещество, и напишите уравнения реакций.
Определите характерными реакциями, в какой из пробирок находится какое вещество, и напишите уравнения реакций.
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Осуществите превращение: CO2 → C6H12O6 → C2H5OH → CO2
Осуществите превращение: CO2 → C6H12O6 → C2H5OH → CO2
______________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: 90 мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:Выполнение работы более 90% –оценка «5»,
70-90% — оценка «4»,
50 -70% — оценка «3»,
Менее 50% — оценка «2»
Литература
Основная:
1. Ерохин Ю.М. Химия для профессий и специальностей технического и естественно-научного профиля: учебник для студ. учреждений сред.проф. образования. — М., 2016.
учреждений сред.проф. образования. — М., 2016.
2. Габриелян, О.С. Химия для профессий и специальностей технического профиля. — М., 2014.
3. Егоров А.С. Химия для колледжей. – Ростов н/Д , 2013.
Дополнительная:
1. Габриелян, О.С. Химия: тесты, задачи и упражнения: учеб.пособие для студ. учреждений сред. проф. образования. — М., 2014.
2. Ерохин Ю.М. Сборник задач и упражнений по химии (с дидактическим материалом). — М., 2005.
3. Маршанова, Г.Л. Техника безопасности в школьной химической лаборатории: Сборник инструкций и рекомендаций. – М., 2002.
Интернет – ресурсы:
www. pvg. mk. ru (олимпиада «Покори Воробьевы горы»).
www. hemi. wallst. ru (Образовательный сайт для школьников «Химия»).
www. alhimikov. net (Образовательный сайт для школьников).
www. chem. msu. su (Электронная библиотека по химии).
www. enauki. ru (интернет-издание для учителей «Естественные науки»).
www. 1september. ru (методическая газета «Первое сентября»).
www. hvsh. ru (журнал «Химия в школе»).
www. hij. ru (журнал «Химия и жизнь»).
www. chemistry-chemists. com (электронный журнал «Химики и химия»).
Раскрытие секретов воды: пошаговое руководство по созданию 3D-модели молекулы воды
Создание 3D-модели молекулы воды — увлекательный и познавательный способ узнать о свойствах воды и ее структуре. Вода является уникальной молекулой благодаря своей способности образовывать водородных связи , которые позволяют ей оставаться жидкой при относительно низких температурах. Создавая 3D-модель молекулы воды, учащиеся могут лучше понять химические и физические свойства воды. В этой статье приведены пошаговые инструкции о том, как сделать 3D-модель молекулы воды с помощью простых материалов, таких как воздушные шары, проволока и глина. Кроме того, в этой статье мы обсудим важность изучения молекул воды и рассмотрим некоторые области применения 3D-моделей молекул воды.
Как выглядела бы вода в трехмерном изображении?
Источник изображения: cloudinary. com
com Вода может принимать различные трехмерные формы в зависимости от объема и формы сосуда, в котором она находится. Если вы нальете воду в чашу, она примет форму чаши. . Если вы нальете его в банку, он примет форму банки. Если налить его в воздушный шар, он примет сферическую форму. Если вы нальете его в цилиндр, он примет форму цилиндра. Даже если вы заморозите воду, она примет форму того сосуда, в котором она находится. Неважно, в какой сосуд формы вы нальете воду, вода примет эту форму.
Как сделать модель молекулы
Источник изображения: ingridscience.ca Создание модели молекулы — отличный способ визуализировать структуру и свойства соединения. Для начала вам нужно будет собрать материалы для вашей модели. Вам понадобятся пенопластовые шарики или другие мелкие предметы для представления атомов, зубочистки или другие предметы для обозначения связей между атомами, а также ножницы или канцелярский нож, чтобы сделать необходимые надрезы. После того, как у вас есть запасы, вам нужно будет исследовать молекулу, которую вы моделируете, чтобы определить количество атомов и тип связей, соединяющих их. Теперь, когда у вас есть эта информация, вы можете начать строить свою модель. Поместите шарики из пенопласта или другие предметы, изображающие атомы, а затем обрежьте зубочистки или другие предметы до нужной длины, чтобы изобразить связи. Наконец, соберите части, чтобы закончить модель. Немного потренировавшись, вы сможете создать визуально приятную и точную модель любой молекулы.
После того, как у вас есть запасы, вам нужно будет исследовать молекулу, которую вы моделируете, чтобы определить количество атомов и тип связей, соединяющих их. Теперь, когда у вас есть эта информация, вы можете начать строить свою модель. Поместите шарики из пенопласта или другие предметы, изображающие атомы, а затем обрежьте зубочистки или другие предметы до нужной длины, чтобы изобразить связи. Наконец, соберите части, чтобы закончить модель. Немного потренировавшись, вы сможете создать визуально приятную и точную модель любой молекулы.
Низкомолекулярные сложные эфиры, представляющие собой органические соединения с формулой RCO2R, имеют приятный фруктовый запах, например, запах яблока, банана и клубники. Существует множество различных типов фруктовых эфиров, но примером является пропилэтанолат, бесцветная жидкость со сладким запахом. Его можно легко получить в лаборатории путем взаимодействия спирта с карбоновой кислотой в реакции этерификации. Это соединение изготовлено из диоксида пропилового эфира и представляет собой сложный эфир ароматического пропилэтаноата.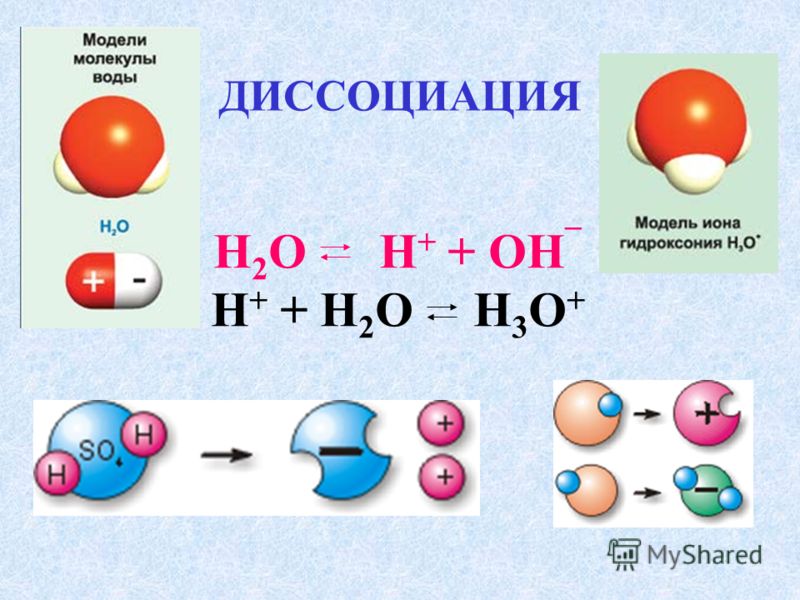 Вы можете создать свою собственную модель этой молекулы, используя жевательные конфеты, мини-зефир и палочки для коктейлей. Именно здесь вы сможете максимально экспериментировать с выбранными вами материалами для атомов и молекул. В любой момент эксперимента не рекомендуется потреблять какую-либо часть 9Молекулярная модель 0003 , которую вы построили. Образцы следует выбросить в мусорный бак. Убедитесь, что вы не навредите себе, используя палочки для коктейлей, острые предметы или другие подобные предметы.
Вы можете создать свою собственную модель этой молекулы, используя жевательные конфеты, мини-зефир и палочки для коктейлей. Именно здесь вы сможете максимально экспериментировать с выбранными вами материалами для атомов и молекул. В любой момент эксперимента не рекомендуется потреблять какую-либо часть 9Молекулярная модель 0003 , которую вы построили. Образцы следует выбросить в мусорный бак. Убедитесь, что вы не навредите себе, используя палочки для коктейлей, острые предметы или другие подобные предметы.
Структура молекулы воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода и имеет форму буквы V. Молекулы воды являются полярными молекулами, что означает, что положительные и отрицательные заряды распределены неравномерно. Кислородная сторона молекулы слегка отрицательна, а два атома водорода слегка положительны. Это позволяет молекулам воды образовывать водородные связи с другими молекулами воды и даже с другими молекулами, что и придает воде ее уникальные свойства. Молекулы воды также способны образовывать множество различных структур, в том числе кластеры и листы, из-за образующихся между ними водородных связей.
Молекулы воды также способны образовывать множество различных структур, в том числе кластеры и листы, из-за образующихся между ними водородных связей.
Какой формы молекула воды?
Согласно формализму Льюиса, вода имеет угловатую или изогнутую форму с валентным углом H-O-H, равным 104,5. Четыре электронных домена, включая две связывающие пары и две несвязывающие пары, имеют примерно тетраэдрическую форму.
Как сделать молекулярную модель из глины
Изготовление молекулярной модели из глины — увлекательный и творческий способ изучения молекул. Для создания модели вам понадобится противень, пластилин разных цветов, зубочистки и линейка. Начните с измерения длины каждой связи между атомами молекулы с помощью линейки. Затем используйте глину, чтобы создать шарики, размер и количество которых соответствуют типу атома. Поместите шарики на противень и используйте зубочистки, чтобы соединить атомы, убедившись, что длина зубочисток соответствует длине измеренных вами связей. Когда ваша модель будет готова, обожгите глину в соответствии с инструкциями производителя. Приложив немного терпения и усилий, вы получите удовольствие и красочная молекулярная модель , чтобы помочь вам узнать о молекулах.
Когда ваша модель будет готова, обожгите глину в соответствии с инструкциями производителя. Приложив немного терпения и усилий, вы получите удовольствие и красочная молекулярная модель , чтобы помочь вам узнать о молекулах.
Месяц назад я начал дискуссию о молекулярном моделировании на форуме Qoto Discourse. BluTack в то время был единственной глиной, поэтому я сделал из него грубую модель. В Poundland было около пластилина для лепки , которое я смог купить некоторое время назад. В этом обучающем видео мы рассмотрим первый из двух шагов.
Как создать молекулу
Создание молекулы начинается с понимания типов атомов, из которых состоит молекула. В зависимости от типа образующейся молекулы используемые атомы могут различаться. Например, молекулы воды состоят из двух атомов водорода и одного атома кислорода. После определения атомов, которые будут включены в молекулу, атомы должны быть расположены в правильном порядке, чтобы создать единую молекулу. Это можно сделать, используя концепцию ковалентных связей, которая представляет собой притяжение между двумя атомами, заставляющее их образовывать химическую связь. Как только атомы расположены правильно, молекула готова.
Это можно сделать, используя концепцию ковалентных связей, которая представляет собой притяжение между двумя атомами, заставляющее их образовывать химическую связь. Как только атомы расположены правильно, молекула готова.
Как создать молекулу?
Молекулы образуются при взаимодействии атомов с электронами, и их описывает полезное сокращение, известное как Структуры Льюиса . Из-за этих визуальных представлений теория отталкивания пар электронов валентной оболочки («VSEPR») может использоваться для предсказания формы молекул в трех измерениях.
Можно ли создать молекулу?
Несмотря на то, что мы можем создать подавляющее большинство молекул, которые только можем себе представить, это правда, что сложные молекулы часто производятся по более низкой цене и в более медленном графике.
Что такое молекула и как она создается?
Молекулы состоят из одного или нескольких атомов. Существует вероятность того, что атомы в молекулах будут одинаковыми или разными ( молекула кислорода имеет два атома кислорода, а молекула воды имеет только один атом кислорода). Несколько тысяч атомов могут составить биологическую молекулу, такую как ДНК или белки.
Несколько тысяч атомов могут составить биологическую молекулу, такую как ДНК или белки.
Сколько атомов нам нужно, чтобы сделать молекулу?
Молекулы образуются при взаимодействии атомов. молекулы образуются при соединении двух или более атомов. Молекулы могут состоять всего из двух атомов или из 2000 атомов.
Причины для создания собственных молекулярных моделей | Идеи
Многое из того, что мы знаем о химии, невозможно увидеть. Вместо этого ученые разработали модели для описания ключевых понятий на основе имеющихся данных и математических принципов. Модели можно считать инструментами мышления, помогающими формировать объяснения. Они также являются полезными упрощениями для облегчения понимания.
Источник: © Royal Society of Chemistry
Будьте изобретательны: легкодоступные материалы и планирование могут сделать процесс обучения эффективным , структура и связь, атомная структура и теория столкновений. Хотя теория «стилей обучения» в преподавании и обучении была широко дискредитирована, кинестетические подходы — учебные действия, включающие выполнение определенных действий — действительно вносят разнообразие в уроки для учителей и учеников. Физические модели также могут стимулировать обсуждение между учащимися или способствовать обсуждению между учащимся и учителем.
Физические модели также могут стимулировать обсуждение между учащимися или способствовать обсуждению между учащимся и учителем.
Наборы молекулярных моделей часто используются для физического моделирования на уроках химии. Атомы и соединения в наборах молекулярных моделей были специально разработаны для воспроизведения наблюдаемых углов и валентностей атомов в ковалентных молекулах. Однако наборы могут быть дорогими и ограничивать занятия по моделированию школьной средой. Неформальное моделирование с использованием доступных материалов обеспечивает доступную альтернативу. Одно исследование, посвященное неформальному моделированию молекулярной геометрии, показало, что наборы моделей «сделай сам» с использованием ершиков для труб оказались «более значимыми для лучших учеников и более приятными для всех».
Наборы молекулярных моделей часто используются для физического моделирования на уроках химии. Атомы и соединения в наборах молекулярных моделей были специально разработаны для воспроизведения наблюдаемых углов и валентностей атомов в ковалентных молекулах. Однако наборы могут быть дорогими и ограничивать занятия по моделированию школьной средой. Неформальное моделирование с использованием доступных материалов обеспечивает доступную альтернативу. Одно исследование, посвященное неформальному моделированию молекулярной геометрии, показало, что наборы моделей «сделай сам» с использованием ершиков для труб оказались «более значимыми для лучших учеников и более приятными для всех». 1
Однако наборы могут быть дорогими и ограничивать занятия по моделированию школьной средой. Неформальное моделирование с использованием доступных материалов обеспечивает доступную альтернативу. Одно исследование, посвященное неформальному моделированию молекулярной геометрии, показало, что наборы моделей «сделай сам» с использованием ершиков для труб оказались «более значимыми для лучших учеников и более приятными для всех». 1
Выбор материалов для моделирования
Вы можете найти примеры химических концепций, смоделированных с использованием любого вообразимого материала, в академической литературе и других источниках. Сферы, изображающие атомы, можно смоделировать с помощью подручных материалов, таких как шарики из полистирола, пластилин или липкая липкая бумага. Связи атомов можно моделировать с помощью ершиков для труб, ватных палочек или зубочисток. В совокупности они похожи на модели, сделанные с помощью наборов молекулярных моделей. Студенты должны решить, сколько связей установить и где их разместить, что создает трудности для более успевающих. Леса могут поддержать студентов, нуждающихся в дополнительной помощи.
Леса могут поддержать студентов, нуждающихся в дополнительной помощи.
В вашем классе
Загрузите рабочий лист для создания модели связи в аммиаке в формате MS Powerpoint или pdf.
Модели для склеивания могут быть изготовлены из аналогичных материалов. Картонные пазлы или перфокарты могут представлять собой ионы. Чистящие средства для труб в виде валентных оболочек и шарики в виде внешних электронов могут проиллюстрировать модель ковалентной связи Льюиса. Веревка, картонные круги или проволока создают электронные оболочки для модельных атомов, а липкие точки, выпученные глазки, бусинки для украшений и даже сладости могут отображать электроны.
Модели для склеивания могут быть изготовлены из аналогичных материалов. Картонные пазлы или перфокарты могут представлять собой ионы. Чистящие средства для труб в виде валентных оболочек и шарики в виде внешних электронов могут проиллюстрировать модель ковалентной связи Льюиса. 2 Веревка, картонные круги или проволока создают электронные оболочки для модельных атомов, а липкие точки, выпученные глазки, бусинки для украшений и даже сладости могут отображать электроны.
Получение максимальной отдачи от физических моделей
Учителям сложно использовать модели, поскольку могут возникать неверные представления. Например, распространенное заблуждение состоит в том, что научная модель является точной копией реальной вещи, точно так же, как отлитая под давлением игрушечная машинка является моделью автомобиля стандартного размера. Немногие студенты понимают, почему ученые используют несколько моделей для объяснения концепций. Кроме того, слово «модель» имеет несколько значений в зависимости от контекста. Когда мы используем слово «модель» в обучении, то, что приходит в голову нашим ученикам, может отличаться от того, что у нас в голове.
Учителям сложно использовать модели, потому что могут возникать неверные представления. Например, распространенное заблуждение состоит в том, что научная модель является точной копией реальной вещи, точно так же, как отлитая под давлением игрушечная машинка является моделью автомобиля стандартного размера. Немногие студенты понимают, почему ученые используют несколько моделей для объяснения концепций. 3 Кроме того, слово «модель» имеет несколько значений в зависимости от контекста. Когда мы используем слово «модель» в обучении, то, что приходит в голову нашим ученикам, может отличаться от того, что у нас в голове.
Немногие студенты понимают, почему ученые используют несколько моделей для объяснения концепций. 3 Кроме того, слово «модель» имеет несколько значений в зависимости от контекста. Когда мы используем слово «модель» в обучении, то, что приходит в голову нашим ученикам, может отличаться от того, что у нас в голове.
Как и при любом занятии в классе, вы должны оценить цели обучения, сопровождающие занятие по моделированию, и спланировать другие аспекты урока, чтобы учащиеся добились прогресса. Уроки произвольного моделирования редко бывают успешными. Поэкспериментируйте с материалами перед уроками, чтобы предвидеть, где могут возникнуть неправильные представления или даже плохое поведение. Подумайте, какие вопросы будут проверять понимание учащимися и как вопросы и мышление будут работать в больших классах. Например, наборы карточек с вопросами между парами студентов дают подсказки для обсуждения. Они позволяют учителю в конце урока задавать прямые вопросы, как только учащиеся имеют возможность подумать.
Помимо уроков, неформальные модели служат хорошим украшением классной комнаты, обеспечивая прочную память. Поскольку они недороги, студенты могут взять их домой или использовать домашние материалы для изготовления моделей и их критики.
Мы хотели бы увидеть неформальные занятия по моделированию, которые вы проводите на своих занятиях. Напишите нам в Твиттере @RSC_EiC.
Источник: © Королевское химическое общество
Основные советы для неформального моделирования
1. Продумайте логистику распределения материалов и уборки.
2. Предупредите, какие проблемы могут возникнуть при использовании выбранных вами материалов, например, проблемы с гигиеной для сладостей в лабораториях и проблемы с безопасностью при использовании острых ершиков для труб.
3. Запланируйте вопросы для более глубокого анализа теории или для проверки полезности модели.
Дополнительная литература
Королевское химическое общество Разработка и использование моделей Курс повышения квалификации помогает справиться с трудностями, связанными с использованием моделей.

