Квантово-химические модели атомов и молекул
АННОТАЦИЯ
В статье рассматриваются квантово-химические модели атомов, молекул, позволяющие понять сущность химических превращений вещества на атомном и молекулярном уровне его организации.
ABSTRACT
The article is devoted to a detailed consideration of graphic quantum-chemical models of atoms, molecules and chemical bonds. This approach allows understanding the nature of the chemical processes and the laws of their proceeding.
Современные представления о строении атомов и молекул, понимание химических превращений вещества на атомном и молекулярном уровне его организации раскрывает квантовая химия.
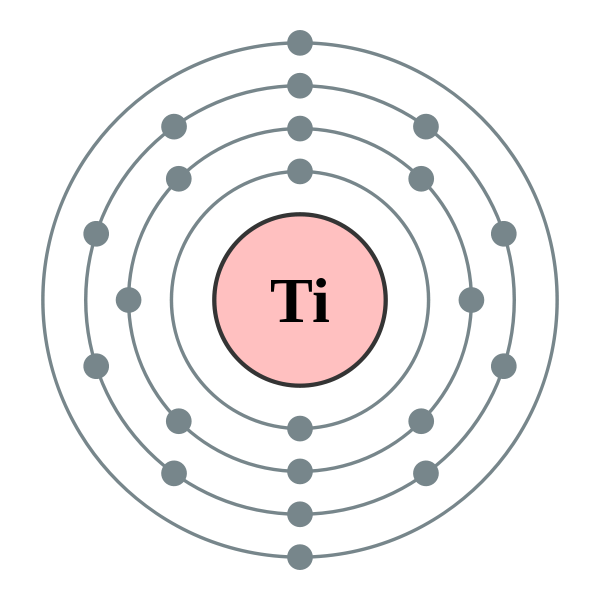
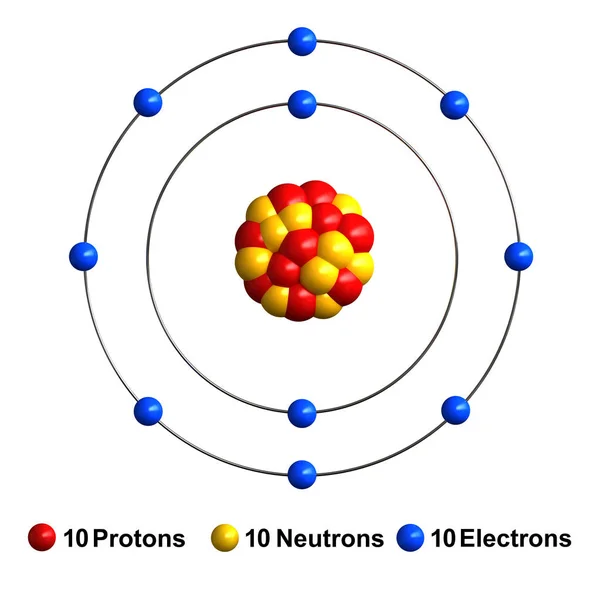
С позиции квантовой химии атом – это микросистема, состоящая из ядра и электронов, движущихся в электромагнитном поле ядра. На рис. 1 представлены орбитальные, электронные и электронографические модели атомов первого и второго периодов, построенные с использованием квантовых принципов и правил заполнения электронами энергетических уровней в атомах. Четыре квантовых числа n, l, ml, ms полностью характеризуют движение электронов в поле ядра. Главное квантовое число n характеризует энергию электрона, его удалённость от ядра и соответствует номеру энергетического уровня, на котором находится электрон. Орбитальное квантовое число l определяет форму орбитали и энергию подуровней одного и того же энергетического уровня. Понятие «орбиталь» означает наиболее вероятную область движения электрона в атоме. Магнитное квантовое число ml определяет число орбиталей и их пространственную ориентацию. Главное, орбитальное и магнитное квантовые числа взаимосвязаны. Орбитальное квантовое число l принимает значения на единицу меньше, чем главное квантовое число n. Если n = 1, то l = 0, и по форме это сферическая 1s-орбиталь. Если n = 2, то орбитальное квантовое число принимает два значения: l = 0, 1, указывающие на наличие двух подуровней.
Четыре квантовых числа n, l, ml, ms полностью характеризуют движение электронов в поле ядра. Главное квантовое число n характеризует энергию электрона, его удалённость от ядра и соответствует номеру энергетического уровня, на котором находится электрон. Орбитальное квантовое число l определяет форму орбитали и энергию подуровней одного и того же энергетического уровня. Понятие «орбиталь» означает наиболее вероятную область движения электрона в атоме. Магнитное квантовое число ml определяет число орбиталей и их пространственную ориентацию. Главное, орбитальное и магнитное квантовые числа взаимосвязаны. Орбитальное квантовое число l принимает значения на единицу меньше, чем главное квантовое число n. Если n = 1, то l = 0, и по форме это сферическая 1s-орбиталь. Если n = 2, то орбитальное квантовое число принимает два значения: l = 0, 1, указывающие на наличие двух подуровней. Это сферическая 2s— орбиталь (l = 0) и три 2p-орбитали, напоминающие по форме гимнастические гантели, расположенные под углом 90о по осям декартовой системы координат.
Это сферическая 2s— орбиталь (l = 0) и три 2p-орбитали, напоминающие по форме гимнастические гантели, расположенные под углом 90о по осям декартовой системы координат.
Рисунок 1. Квантово-химические, электронные и электронографические модели атомов первого и второго периодов
Число и пространственное расположение 2p-орбиталей определяет магнитное квантовое число ml, которое принимает значения в пределах изменения орбитального квантового числа от –l до +l. Если l = 0, то ml = 0 (одна s—орбиталь). Если l = 1, то ml принимает три значения –1, 0, +1 (три р-орбитали).
Орбитальные модели атомов показывают пространственное расположение и форму орбиталей, а на электронографических моделях в виде символических квантовых ячеек дано изображение орбиталей и положение уровней и подуровней на энергетической диаграмме. Следует обратить внимание на размеры атомов. В периодах повторяется одна и та же закономерность – по мере увеличения заряда ядра происходит возрастающая деформация (сжатие) орбиталей под действием электромагнитного притяжения электронов ядром (рис. 1).
Следует обратить внимание на размеры атомов. В периодах повторяется одна и та же закономерность – по мере увеличения заряда ядра происходит возрастающая деформация (сжатие) орбиталей под действием электромагнитного притяжения электронов ядром (рис. 1).
Размещение электронов на орбиталях подчиняется одному из важнейших принципов квантовой механики (принцип Паули): на одной орбитали может находиться не больше двух электронов, причем они должны различаться собственным моментом количества движения – спином (англ. spin вращение). Электроны, различающиеся спинами, условно изображают стрелками и ¯. Когда на одной орбитали находятся два электрона, они имеют антипараллельные спины и не мешают друг другу двигаться в поле ядра.
Это свойство напоминает вращение в зацеплении двух шестеренок. Находясь в зацеплении, одна шестеренка вращается по часовой стрелке, другая – против часовой стрелки. Третья шестеренка в зацеплении с двумя другими останавливает вращение. Она лишняя. Так и на одной орбитали может находиться лишь 2 электрона, третий – лишний.
Она лишняя. Так и на одной орбитали может находиться лишь 2 электрона, третий – лишний.
При заполнении электронами энергетических уровней и подуровней в действие вступает квантовый принцип минимума энергии (правило Клечковского). Электроны заполняют орбитали от низшего к высшему энергетическому уровню. Принцип минимума энергии напоминает заполнение этажей многоэтажного дома в период наводнения. Вода поднимается и заполняет все этажи снизу вверх, не пропуская ни одного.
В соответствии с правилом Хунда все р-орбитали заполняются сначала одним электроном и только затем вторым с антипараллельным спином.
Квантовохимические модели атомов позволяют объяснить свойства атомов обмениваться энергией, отдавать и присоединять электроны, изменять геометрическую конфигурацию, образовывать химические связи.
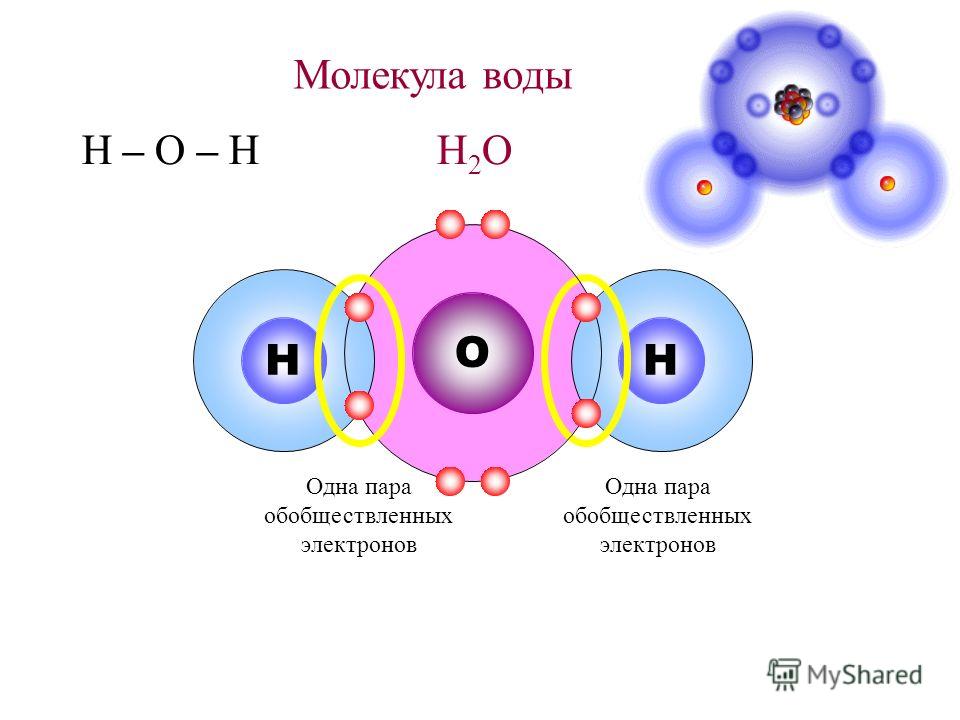
Ковалентная химическая связь образуется при перекрывании валентных электронных облаков. Например, такая связь представлена в орбитальной модели молекулы водорода (рис. 2).
2).
Рисунок 2. Модель ковалентной связи в молекуле водорода
Использование квантовохимического метода валентных связей основано на представлении, о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких электронных пар с антпараллельными спинами. С позиции метода валентных связей молекула – это микросистема, состоящая из двух или большего числа ковалентно связанных атомов. Положительно заряженные ядра атомов удерживаются отрицательным зарядом, сосредоточенным в области перекрывания атомных орбиталей. Притяжение ядер атомов к повышенной электронной плотности между ними уравновешивается силой отталкивания ядер между собой. Образуется устойчивая микросистема, в которой длина ковалентной связи равна расстоянию между ядрами.
В молекуле фтора так же, как и в молекуле водорода, имеется неполярная ковалентная связь. При перекрывании 2р1-орбиталей электронная пара создает между ядрами атомов повышенную электронную плотность и удерживает молекулу в устойчивом состоянии (рис. 3).
3).
F–F
Рисунок 3. Модель ковалентной связи в молекуле фтора
Под неполярной ковалентной связью подразумевается такое перекрывание валентных орбиталей, в результате которого совпадают центры тяжести положительных и отрицательных зарядов.
Возможно образование полярной ковалентной связи при перекрывании 1s1— и 2р1-орбиталей. На рис. 4 представлена модель фтороводорода с полярной ковалентной связью. Электронная плотность между ковалентно связанными атомами смещается к атому фтора, заряд ядра которого (+9) оказывает большее электромагнитное притяжение по сравнению с ядром атома водорода с зарядом (+1).
H–F
Рисунок 4. Модель полярной ковалентной связи в молекуле фтороводорода
Ионная связь обусловлена притяжением электрически заряженных частиц – ионов.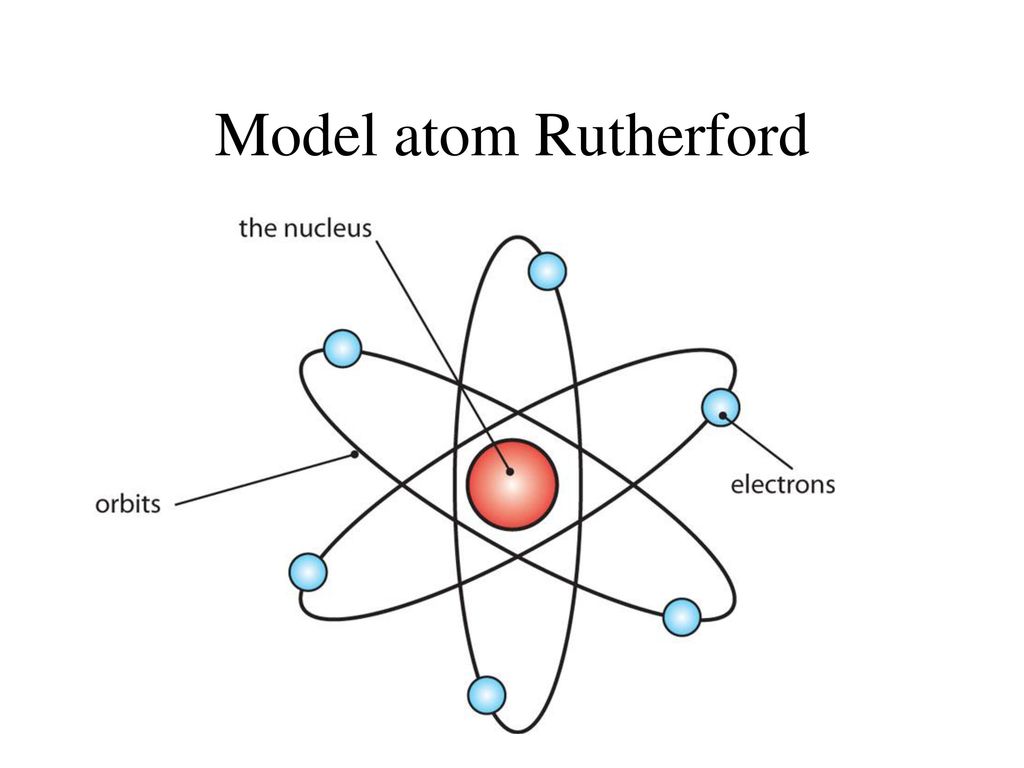 На рис. 5 представлена модель образования ионной связи во фториде лития. Сильное электромагнитное поле, создаваемое ядром атома фтора, захватывает и удерживает на р-орбитали электрон, принадлежавший атому лития. Атом лития, лишенный электрона, изменяет геометрическую конфигурацию (исчезла 2s-орбиталь), становится положительно заряженным ионом и притягивается к отрицательно заряженному иону фтора, который приобрел лишний электрон на р-орбиталь.
На рис. 5 представлена модель образования ионной связи во фториде лития. Сильное электромагнитное поле, создаваемое ядром атома фтора, захватывает и удерживает на р-орбитали электрон, принадлежавший атому лития. Атом лития, лишенный электрона, изменяет геометрическую конфигурацию (исчезла 2s-орбиталь), становится положительно заряженным ионом и притягивается к отрицательно заряженному иону фтора, который приобрел лишний электрон на р-орбиталь.
Рисунок 5. Модель ионной пары Li+F— фторида лития
Силы электростатического притяжения противоположно заряженных ионов и отталкивания электронных оболочек ионов лития и фтора уравновешены и удерживают ионы на расстоянии, соответствующем длине ионной связи. Перекрывание орбиталей в соединениях с ионной связью практически отсутствует.
Особый вид химической связи проявляется в атомах металлов. Кристалл металла (рис. 6) состоит из положительно заряженных ионов, в поле которых свободно движутся валентные электроны («электронное облако»).
Кристалл металла (рис. 6) состоит из положительно заряженных ионов, в поле которых свободно движутся валентные электроны («электронное облако»).
Рисунок 6. Модель кристалла металлического лития
Ионы и «электронное облако» взаимно удерживают друг друга в устойчивом состоянии. Благодаря высокой подвижности электронов металлы обладают электронной проводимостью.
В молекулах атомы, связанные несколькими ковалентными связями, изменяют геометрическую конфигурацию. Рассмотрим проявление этого свойства на примере атома углерода (1s2-орбиталь в моделях атома углерода не изображена, т.к. не участвует в образовании химической связи).
Экспериментально установлено, что в молекуле СН4 атом углерода образует с атомами водорода четыре одинаковые ковалентные связи, эквивалентные по своим энергетическим и пространственным характеристикам. Трудно представить четыре одинаковые ковалентные связи, если иметь в виду, что в углероде валентные электроны располагаются на двух энергетических 2s и 2p подуровнях:
В основном (невозбужденном) состоянии углерод образует лишь две ковалентные связи. В возбужденном состоянии один электрон с подуровня 2s переходит на более высокий энергетический подуровень 2p. В результате такого перескока электрона увеличивается суммарная энергия 2s— и 2p-орбиталей и валентность атома углерода изменяется до четырех:
В возбужденном состоянии один электрон с подуровня 2s переходит на более высокий энергетический подуровень 2p. В результате такого перескока электрона увеличивается суммарная энергия 2s— и 2p-орбиталей и валентность атома углерода изменяется до четырех:
И все же этого недостаточно, чтобы объяснить четыре равноценные ковалентные связи в молекуле СН4, т.к. 2s— и 2p-орбитали имеют разную форму и пространственное расположение. Проблема была решена введением гипотезы о гибридизации – смешении валентных электронов в подуровнях одного и того же энергетического уровня. В молекуле метана одна 2s— и три 2р-орбитали атома углерода в результате гибридизации превращаются в четыре равноценные sp3-гибридные орбитали:
В отличие от невозбужденного (основного) состояния атома углерода, в котором три 2р-орбитали атома расположены под углом 90о (рис. 7,а), в молекуле метана (рис. 7,b) равноценные по форме и размерам sp3 -гибридные атома углерода расположены под углом 109о28‘.
7,b) равноценные по форме и размерам sp3 -гибридные атома углерода расположены под углом 109о28‘.
Рисунок 7. Модель молекулы метана
В молекуле этилена С2Н4 (рис. 8,а) атомы углерода находятся в sр2-гибридном состоянии. В гибридизации участвует 2s-орбиталь и две 2р-орбитали. В результате гибридизации атомы углерода образуют три равноценные sp2-гибридные орбитали, расположенные под углом 120о на плоскости; 2pz-орбиталь не участвует в гибридизации.
Рисунок 8. Модель молекулы этилена
В молекуле этилена атомы углерода связаны не только s-связью, но и p-связью. Она образуется в результате перекрывания рz-орбиталей с образованием двух областей перекрывания над и под осью, соединяющей ядра, по обе стороны от оси s-связи (рис. 8).
8).
Модель тройной связи представлена в молекуле ацетилена (рис. 9). При смешении одной 2s— и одной 2рх—орбитали атома углерода образуются две sp-гибридные орбитали, которые располагаются на линии, соединяющей ядра атомов (угол 180о). Негибридные 2ру—и 2рz-орбитали разных атомов углерода перекрываются, образуя две p-связи во взаимно перпендикулярных плоскостях (рис. 9).
Рисунок 9. Модель молекулы ацетилена
Молекулы, подобно атомам, проявляют свойство разрывать и образовывать химические связи, изменять геометрическую конфигурацию, переходить из электронейтрального в ионное состояние. Указанные свойства представлены в реакции между молекулами аммиака NН3 и фтороводорода HF (рис. 10). Разрывается ковалентная связь в молекуле фтороводорода, и образуется ковалентная донорно-акцепторная связь между азотом и водородом в молекуле аммиака. Донором выступает неподелённая пара электронов атома азота, акцептором – вакантная орбиталь атома водорода (рис. 10). Геометрическая конфигурация молекулы NН3 (тригональная пирамида, валентный угол 107о18′) изменяется на тетраэдрическую конфигурацию иона NН4+ (109о28′). Завершающим процессом является образование ионной связи в кристаллической структуре фторида аммония. Орбитальные модели молекул позволяют показать все перечисленные выше свойства в одной реакции: разрывать и образовывать химические связи, изменять геометрическую конфигурацию, переходить из электронейтрального в ионное состояние.
Донором выступает неподелённая пара электронов атома азота, акцептором – вакантная орбиталь атома водорода (рис. 10). Геометрическая конфигурация молекулы NН3 (тригональная пирамида, валентный угол 107о18′) изменяется на тетраэдрическую конфигурацию иона NН4+ (109о28′). Завершающим процессом является образование ионной связи в кристаллической структуре фторида аммония. Орбитальные модели молекул позволяют показать все перечисленные выше свойства в одной реакции: разрывать и образовывать химические связи, изменять геометрическую конфигурацию, переходить из электронейтрального в ионное состояние.
Рис. 10. Модель образования ионной пары кристаллического NH4+F—
Химическая реакция с использованием символов химических элементов:
NН3 + HF → NН4F,
дает обобщенное выражение того, что раскрыто в орбитальных моделях молекул. Химические реакции, представленные орбитальными моделями и символами химических элементов, взаимно дополняют друг друга. В этом их достоинство. Овладение элементарными знаниями квантово-химического выражения структуры и состава атомов и молекул ведет к пониманию ключевых химических понятий: ковалентная полярная и неполярная связь, донорно-акцепторная связь, ионная связь, геометрическая конфигурация атомов и молекул, химическая реакция. И на фундаменте этих знаний можно уверенно использовать символику химических элементов и соединений для краткого описания химических состояний и превращений вещества.
Химические реакции, представленные орбитальными моделями и символами химических элементов, взаимно дополняют друг друга. В этом их достоинство. Овладение элементарными знаниями квантово-химического выражения структуры и состава атомов и молекул ведет к пониманию ключевых химических понятий: ковалентная полярная и неполярная связь, донорно-акцепторная связь, ионная связь, геометрическая конфигурация атомов и молекул, химическая реакция. И на фундаменте этих знаний можно уверенно использовать символику химических элементов и соединений для краткого описания химических состояний и превращений вещества.
Приведем ещё пример реакции, рассматриваемой с позиций квантовой химии. Вода проявляет свойства слабого электролита. Электролитическую диссоциацию обычно представляют уравнением:
Н2О ⇄Н+ + ОН—
или
Н2О + Н2О ⇄Н3О+ + ОН—.
Деление молекул воды на положительно и отрицательно заряженные ионы раскрывает квантовохимическая модель реакции электролитической диссоциации (рис. 11).
11).
Рисунок 11. Модель электролитической диссоциации воды
Молекула воды представляет собой искаженную пирамиду (валентный угол 104о30′). Две sр3-гибридные орбитали атома кислорода образуют s-связи с атомами водорода. Две другие sр3-гибридные орбитали располагают свободными парами электронов с антипараллельными спинами. Разрыв ковалентной Н−О связи в одной из молекул приводит к образованию на соседней молекуле ковалентной химической связи по донорно-акцепторному механизму. Ион водорода, располагающий вакантной орбиталью, выступает в роли акцептора электронной пары атома кислорода соседней молекулы воды. В этом примере, как и в предыдущем, квантово-химический подход позволяет понять физико-химический смысл процесса электролитической диссоциации воды.
***
Мышление – это процесс, с помощью которого мы опосредствованно можем судить о том, что скрыто от нашего чувственного восприятия. Квантовая химия дает зрительный образ химических процессов и состояний вещества, раскрывает то, что скрыто от нашего чувственного восприятия, побуждает учиться и размышлять.
Квантовая химия дает зрительный образ химических процессов и состояний вещества, раскрывает то, что скрыто от нашего чувственного восприятия, побуждает учиться и размышлять.
Список литературы:
1. Выготский Л.С. Мышление и речь. – М.: Лабиринт, 1999. – 352 с.
2. Загашев И.О., Заир-Бек С.И. Критическое мышление: технология раз-вития. – СПб: Альянс «Дельта, 2003. – 284 с.
3. Краснов К.С. Молекулы и химическая связь. – М.: Высшая школа, 1984. – 295 с.
4. Леонтьев А.Н. Лекции по общей психологии. – М.: Смысл, 2000. – 512 с.
5. Перегудов Ф.И., Тарасенко Ф.П. Введение в системный анализ. – М.: Высшая школа, 1989. – 367 с.
6. Прокофьев В.Ф. Человек – управляемый биокомпьютер? // Вестник международной академии наук (русская секция). – 2008. – №1. – С. 1-21.
7. Яблоков В.А., Захарова О.М. Системная организация содержания обу-чения химии // Universum: Психология и образование: электрон. научн. журн. 2016. №5(23) / [Электронный ресурс]. – Режим доступа:
– Режим доступа:
URL://7universum.com/ru/psy/archiv/item/2505 (дата обращения 2.04.2017)
Строение вещества. Атомы и Молекулы. 7-й класс
1 урок в теме «Строение вещества»
Цель урока:
- Развитие креативных способностей личности в процессе выявления особенностей строения вещества на основе данных, полученных в ходе эксперимента.
- Обучающая: сформировать представление о строении вещества;
- Воспитывающая: вызвать у учащегося интерес к экспериментальному методу познания;
- Развивающая: развить креативные способности личности, такие как: выдвижение гипотез
Задачи, направленные на:
1. предметные результаты:
- Выявление особенностей строения вещества на основе данных, полученных в результате эксперимента, введение понятий: «молекула», «атом».
2. метапредметные результаты:
- Освоение способов проведения исследования (эксперимента), установление причинно-следственных связей
3.
- Получение целостного представления о мире, развитие креативных свойств личности
Планируемые результаты учащихся:
- интерпретировать данные эксперимента;
- самостоятельно сформулировать понятия «атом и молекула»
- выявить связь между атомами и молекулами. Планируемые результаты учителя:
- создать условия для проведения эксперимента.
Тип урока: урок освоения новых понятий
Оборудование: компьютер, мультимедийный проектор, презентация «Строение вещества. Молекулы и атомы». Учебник Физика. 7 класс — Белага В.В., Ломаченков И.А., Панебратцев Ю.А
Лабораторное оборудование для демонстрации опытов: лист бумаги, модель молекулы воды и углекислого газа, мензурка с водой, стакан с водой, лабораторный термометр, резиновый жгут, мел, осенний лист, резиновый мяч.
Лабораторное оборудование для проведения опытов на парте учащихся: мел, осенний лист, вода, машинное масло, пипетка, три мензурки, спирт, воздушный шарик, игрушка тянучка, модели атомов и молекул.
Межпредметные связи:
Формы работы: фронтальная, групповая.
Методы: метод эвристической беседы, наблюдения.
Ход урока
I. Организационный этап (приветствие, проверка готовности к уроку, эмоционального настроя)— Доброе утро, ребята! Меня зовут Юлия Игоревна Гильфанова. И я рада приветствовать вас на уроке, на котором мы будем открывать страницы в познании окружающего нас мира. Впереди нас ждут интересные открытия.
II. Вводно-мотивационный этап
— Мама, а почему вода жидкая?
— Ну что ты, Андрюша! Ты опять задаешь глупые вопросы. Вода жидкая, потому что она вода.
Вода жидкая, потому что она вода.
— Мама, но почему вода жидкая, а лед твердый?
— Ах, Андрюша, сколько раз я тебе говорила, что лед твердый, потому что лед
— Это замерзшая вода.
Мальчик ничего не понял. Что-то неуловимое в его походке и всей фигуре говорило о том, что «глупые вопросы» продолжали его интересовать.
И впрямь, так ли уж глупы вопросы, занимавшие мальчика? В самом деле, почему одни тела жидкие, другие твердые, а третьи газообразные? С чем это может быть связано? Как вы думаете, ребята? (ответы учащихся).
Итак, давайте сформулируем тему урока? О чем сегодня будем вести речь?
Ребята высказывают мнения
Записываем тему урока в тетрадь: Строение вещества. (Презентация, Слайд 1)
Слайд 1
Ребята, данные вопросы волновали ученых ещё с древних времён. Давайте вспомним, как представлял материю древнегреческий учёный Аристотель?
(Аристотель полагал, что материя — это простая система из четырёх первоначал — огня, воды, воздуха и земли.
Прогрессивнее мыслил Левкипп и его знаменитый ученик Демокрит. Давайте вспомним, что предположили знаменитые учёные? (Они предположили, что материю нельзя делить бесконечно Слайд 4: мельчайшей частицей всего является атом (неделимый). АТОМ — где частица А — означает «не», а греческое слово «томос» — «делить», «делимый». Таким образом, атом с греч. означает «неделимый». Слайд 5
Слайд 5
По мнению Демокрита, всё (и воздух, и земля, и вода, и огонь) состоит из неделимых мельчайших шарообразных частиц.
Ребята, даайте попробуем объяснить аромат цветов с точки зрения теории строения вещества Демокрита? Слайд 5
(Аромат цветов, по мнению Демокрита, мы чувствуем потому, что вылетяющие из чашечки цветка атомы попадают в нос человека и вызывают ощуще ние запаха.)
Продолжая учения Демокрита, французский философ Пьер Гассенди говорил: «Атомы, как правило, объединяются в более крупные частички, наподобие того, как отдельные буквы объединяются в слова». Как вы понимаете данное выражение? (букв в алфавите — 33, а слов, образованных из данных букв, великое множество.
Как вы понимаете данное выражение? (букв в алфавите — 33, а слов, образованных из данных букв, великое множество.
Химических элементов, атомов на сегодняшний день известно 118, а сколько веществ есть в мире вокруг нас).
Эти более крупные частички Гассенди назвал молекулами, от латинского слова «молес», что означает — масса. (Слайд 6)
Слайд 6
Трудно представить, что за несколько столетий до нашей эры, без микроскопов и другой техники, философы смогли достоверно предсказать строение материи.
Если древнегреческие учёные объясняли строение материи, вещества, то великий русский ученый Михаил Васильевич Ломоносов, попытался ответить на вопрос: интересно, а каковы размеры атома? Как вы думаете, ребята? (формулируют предположения и гипотезы), как в науке можно проверить
Вот и, Михаил Васильевич экспериментальным путём измерил атом. Для этого учёный раскатывал лист золота до толщины 1/15552 линии (одна линия равна 2,5 мм). По мнению Ломоносова, эта величина как раз и равнялась размеру одного атома. Так, одна песчинка золота диаметром 0,1 линии (0,25 мм) должна содержать 3 761 479 876 атомов. Конечно, расчёт был крайне неточен: количество атомов оказалось занижено как минимум на восемь порядков (108)!
Для этого учёный раскатывал лист золота до толщины 1/15552 линии (одна линия равна 2,5 мм). По мнению Ломоносова, эта величина как раз и равнялась размеру одного атома. Так, одна песчинка золота диаметром 0,1 линии (0,25 мм) должна содержать 3 761 479 876 атомов. Конечно, расчёт был крайне неточен: количество атомов оказалось занижено как минимум на восемь порядков (108)!
(Слайд №7)
Многие учёные в 18-20 веках занималась изучением темы строения вещества. (Жан Батист Перрен, Д.И.Менделеев, А.Эйнштейн и др)
Историю материи, вещества и атома нельзя назвать законченной, пока не найдены все существующие мельчайшие частицы, пока не синтезированы все возможные элементы.
III. Этап изучения нового материала Ребята, зачем нам задумываться над тем, из чего состоят все вещества? Где вы в жизни сталкивались с тем, что все вещества состоят из частиц? (ответы учащихся: кусок сахара растворяется в воде, кровь бежит и. т.д) .
т.д) .
Одним из методов познания в физике является эксперимент. И вам сейчас, работая в группах, предлагается провести простейшие опыты и попробовать установить факты.
Ребята, какие физические тела и вещества у вас есть на парте? Перечислите, пожалуйста, (термометр, мензурка, мел, осенний лист, вода, модель молекулы воды.). Молодцы! Не забываем о правилах техники безопасности при работе с данными приборами.
Вы работаете по парам, порядка 5-10 минут, ваша задача поэкспериментировать, сделать различные действия и чётко записать, нарисовать, представить в любой удобной для вас форме, какой факт вы установили.
Работа в группах
Инструкция
На выполнение заданий вам даётся время 7-10 минут.
Ребята, у вас на парте лежит осенний лист. Разорвите его на мелкие части и разотрите пальцами. Что мы наблюдаем? |
Задание №2
Проведите пальцем руки по поверхности мела. Какой вывод вы сможете сделать? |
Задание №3
Возьмите колбу с водой комнатной температуры и опустите в неё лабораторный термометр. Добавьте в колбу горячей воды, не вынимая термометр. Что вы наблюдаете в ходе эксперимента? Почему поднимается уровень спирта в жидкостном термометре при повышении температуры? Объясните данный опыт с точки зрения теории строения вещества. |
Задание №4
Растяните резиновый жгут. Возьмите резиновый мяч и попробуйте его сжать. Объясните данный опыт с точки зрения теории строения вещества. |
Задание №5
Внимательно посмотрите на иллюстрацию. Какие выводы вы можете сделать? |
Задание №6
1. Оцените размеры атома, посмотрев на иллюстрацию.
По окончанию работы в парах, ребята предоставляют свои результаты. Перечисляют или демонстрируют факты, которые они установили. На основании представленных фактов, делаем вывод и заполняем опорный конспект урока, который у ребят лежит на парте на столе (слайд №8, 9)
Слайд №8
Записываем в пустые прямоугольники
Слайд №9
Продемонстрировать модели молекул воды, углекислого газа, витамина С.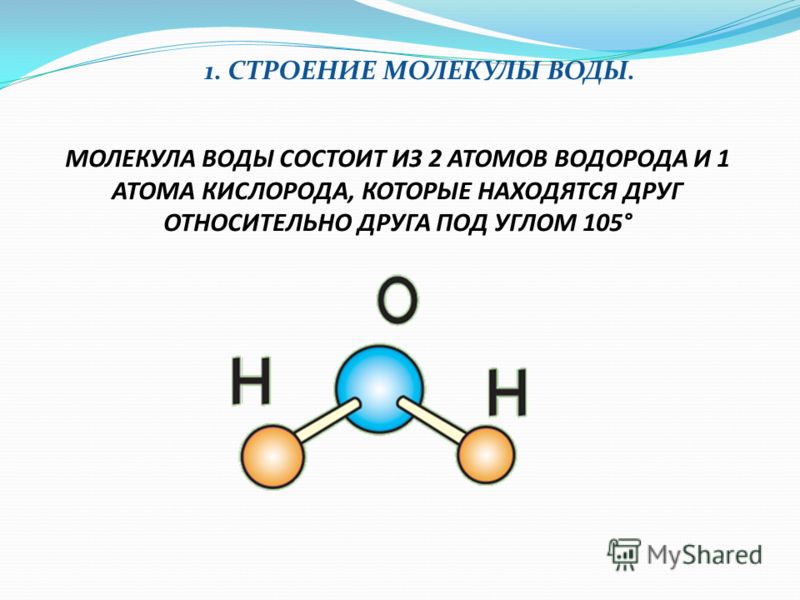
Мы с вами говорили, что атом — неделимый, на самом деле это не так. На сегодняшний день схема строения вещества выглядит следующим образом
Слайд №10
IV. Этап закрепления полученных знаний
Сейчас мы с вами отправимся в небольшое путешествие по вашему родному городу (виртуальная экскурсия) Скажите пожалуйста, как называется данный памятник? (В 2006 году был открыт памятник купцу-коробейнику. Памятник установлен на главной улице (Большая Садовая) города Ростов-на-Дону, недалеко от входа в парк имени Горького). Обратите внимание, как блестит сапог купца и мордочка кота рядом с ним. Как вы думаете, почему? (Горожане приходят покупать у коробейника исполнение желаний. Для это необходимо потереть сапог, или кафтан купца, положить монетку на короб, погладить кота и загадать желание держась за большой палец). Каждый желающий, кто погладил кота, потер сапог, уносил после этого частичку памятника, потому что памятник состоит из молекул сплава бронзы. Как при максимальном увеличении выглядят молекулы твёрдого вещества? (при нажатии на кнопку запускается видео).
Как при максимальном увеличении выглядят молекулы твёрдого вещества? (при нажатии на кнопку запускается видео).
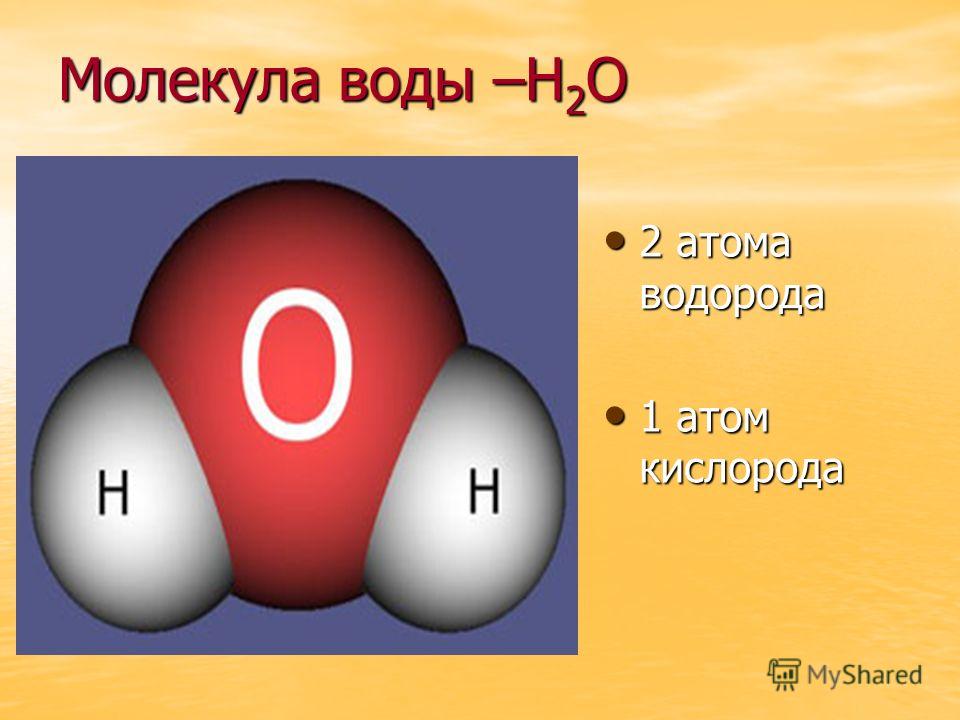
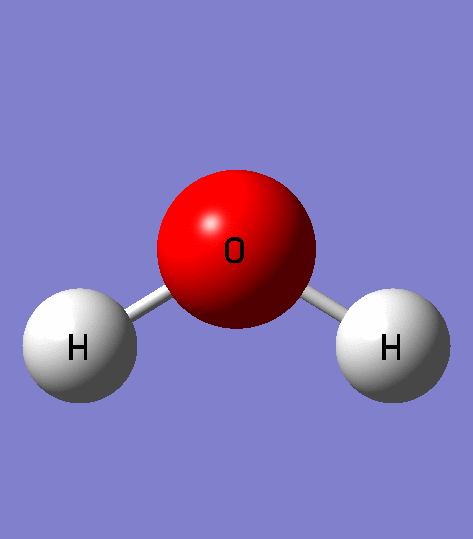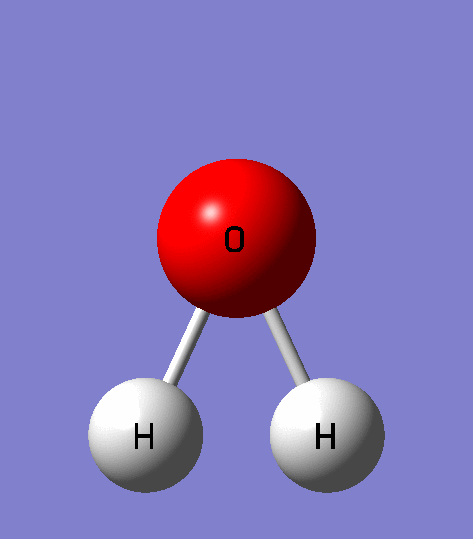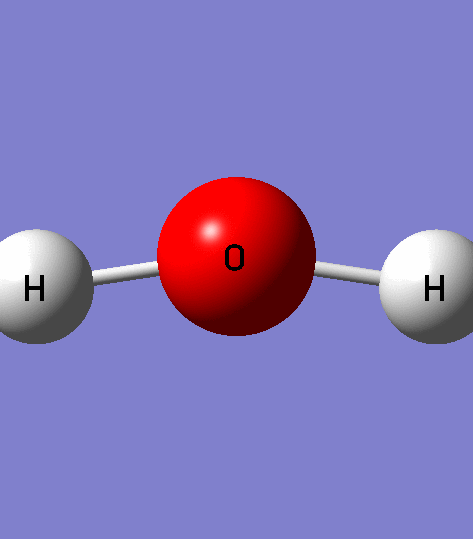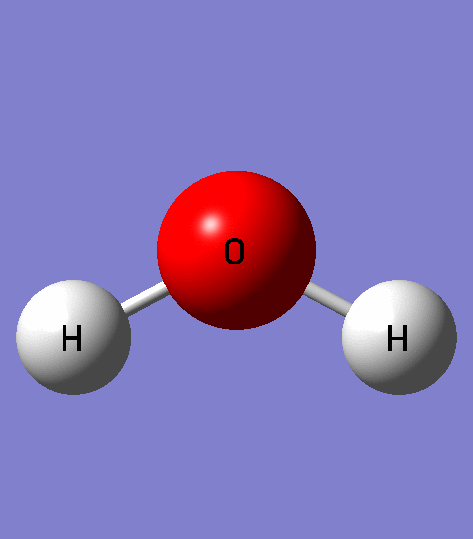
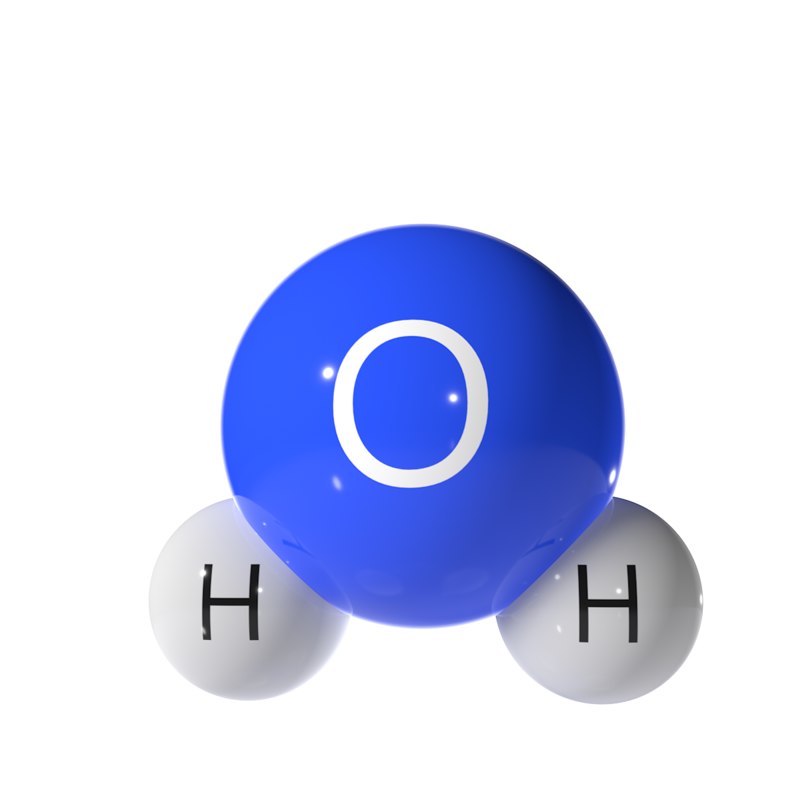
Прогуляемся по Петровской улице, перейдём к знаменитому фонтану вашего города. Как он называется? (Ростовчанка). Из каких атомов состоит молекула воды? (два атома водорода и один атом кислорода). Водород самый простой и легкий их всех химических элементов, можно считать идеальным топливом.
Он там, где есть вода. При сжигании водорода образуется вода, которую можно снова разложить на водород и кислород, нет никакого загрязнения окружающей среде.
Водород синтетическое топливо, его можно получать из угля, нефти, газа, путем разложения воды.
Производство водорода пока неэкономичный для энергетики процесс, как только водород станет доступным топливом, как сегодня природный газ, он сможет его полностью заменить. Как вы думаете, а человек состоит из молекул? Может ли человек уменьшится до размеров атома? (фрагмент фильма Человек Муравей).
Конечно нет, пока это только фантастика. Но если подойти со стороны физики твердого тела, то есть возможность интересной метаморфозы. Помните, как выглядели раньше компьютеры IBM S/370 или БЭСМ-6 в 70-е годы? Они не помещались даже в одну комнату. А сегодня в наших телефонах помещается тысяча таких компьютеров. С точки зрения микроэлектроники, изменение линейных размеров логического элемента произошло от сантиметров — к нанометрам, в миллионы раз. При этом функциональность не утеряна. То вполне можно себе представить уменьшенного до размера Человека-муравья робота в форме человека. Правда с автономностью здесь не все так просто, аккумуляторы за это время не стали в миллионы раз меньше и мощнее.
Существует область науки и техники, работающая с объектами нанометровых размеров — нанотехнология. То есть объекты нанотехнологий сравнимы по своим размерам с крупными молекулами!
Пока еще мифические нано роботы могут занять центральное место в медицине (например, для точной доставки лекарств, очистки кровеносных сосудов) или стать основой для технологии автоматического строительства и создания любых по сложности объектов. Но до полноценных нано роботов еще очень далеко. Хотя еще сто лет назад считалось, что и полеты в космос — это пустая фантазия.
Но до полноценных нано роботов еще очень далеко. Хотя еще сто лет назад считалось, что и полеты в космос — это пустая фантазия.
Социальная рефлексия
Эмоциональная рефлексия
Ответьте на вопросы: итак, что я узнал(а) сегодня на уроке? А зачем это вообще нужно знать? (ответы учащихся). Какое открытие я сделал для себя?
При нагревании промежутки между молекулами увеличиваются, так и отношения между людьми, когда в семье ссоры, накал страстей, ухудшаются. Люди, как молекулы, отдаляются друг от друга. А когда, остынут, страсти улягутся, то люди сближаются обратно. И как бы вам не приходилось тяжело в жизни, всегда сохраняйте спокойствие и душевное равновесие.
В память о нашей встрече я хочу подарить вам вот такую символическую лампочку И пусть эти лампочки освещают ваш правильный путь в жизни! Пусть она будет вашим генератором идей в дальнейшем изучении науки о природе — физики.
Спасибо за урок!
ROCO Глава 2: Модели для заполнения пространства
Объемные модели
радиуса Ван-дер-Ваальса используются для построения специальной вид молекулярной модели, называемый моделью заполнения пространства . Эти модели строятся путем рисования каждого атома в виде сферы Ван-дер-Ваальса. с ядром атома в центре сферы.
Модели, заполняющие пространство, полезны, потому что они показывают сколько места занимает атом (или молекула). Вы можете видеть это легко, сравнивая заполняющие пространство модели с традиционными шарико-палочными модели, подобные показанным на следующем рисунке. Последние не обеспечивают что-то вроде реалистичного ощущения размера молекулы.
Шариковые (вверху) и заполняющие пространство модели (нижний)
|
С другой стороны, вы также можете видеть, что это намного
труднее установить паттерны связи в заполняющей пространство модели. Облигации
можно найти, если вспомнить, что расстояния связи намного меньше
чем несвязанные расстояния. Связь должна существовать между любыми двумя атомами
которые создают сильно перекрывающиеся сферы.
Облигации
можно найти, если вспомнить, что расстояния связи намного меньше
чем несвязанные расстояния. Связь должна существовать между любыми двумя атомами
которые создают сильно перекрывающиеся сферы.
Выше я упоминал, что радиусы Ван-дер-Ваальса также используется для оценки несвязанных взаимодействий. Такая же оценка может быть достигнуто с помощью моделей заполнения пространства. Визуальный аналог расстояния «промежуток предсказания» — это модель, которая содержит два перекрывающихся несвязанных атома.
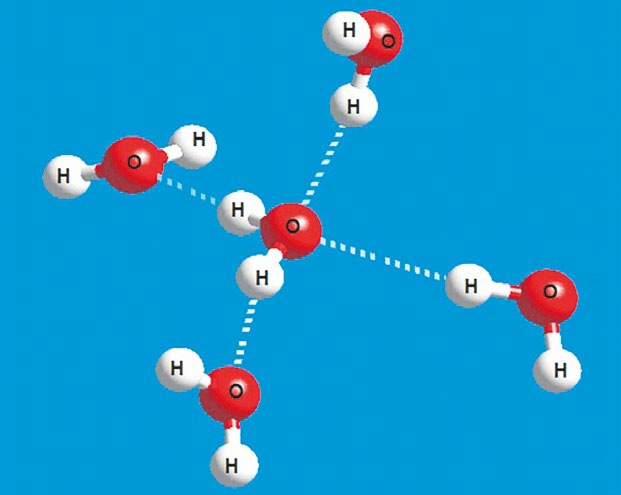
На следующем рисунке сравниваются шарико-стержневые и заполняющие пространство модели трех молекул воды. Молекулы были расположены чтобы они занимали примерно те же позиции, что и могли бы занимать в кристалле льда.
Три молекулы воды (из лед) | ||
Шарико-стержневая модель мало что раскрывает, но
модель заполнения пространства ясно показывает, что центральный атом кислорода
существенно перекрывается с атомом водорода в другой молекуле воды.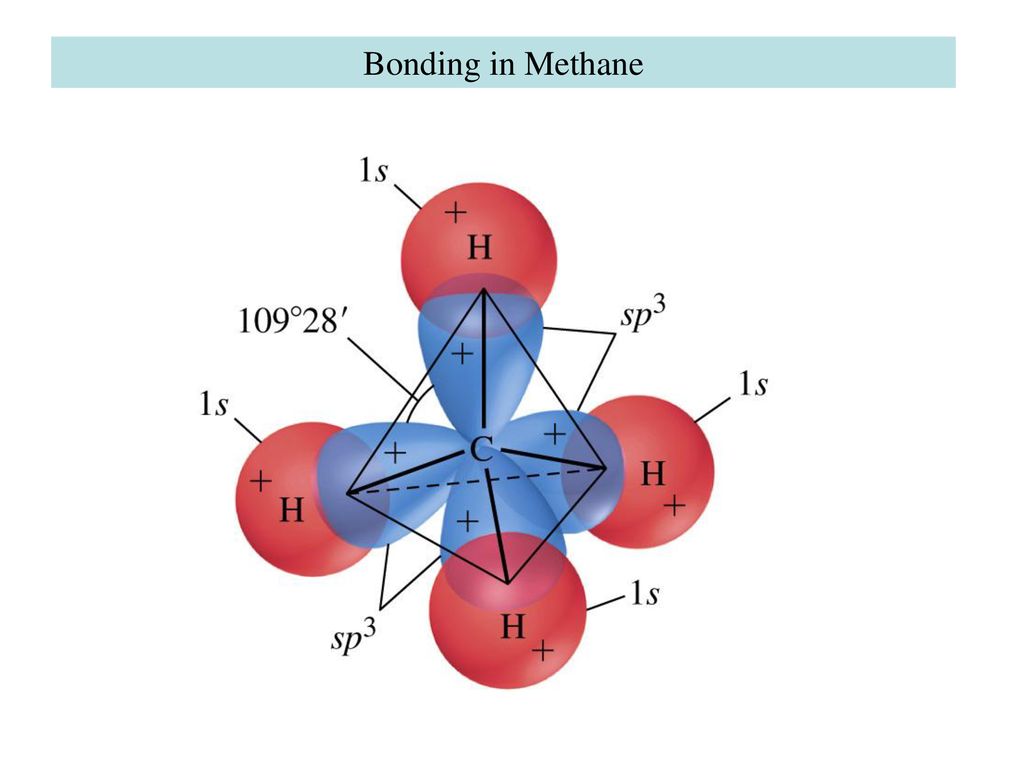 Измерения расстояний подтверждают, что несвязанное расстояние ОН (1,8
Å) намного меньше суммы ван-дер-ваальсовых радиусов
(1,2 + 1,4 = 2,6 Å).
Измерения расстояний подтверждают, что несвязанное расстояние ОН (1,8
Å) намного меньше суммы ван-дер-ваальсовых радиусов
(1,2 + 1,4 = 2,6 Å).
Эти наблюдения предполагают, что молекулы воды сильно притягивать друг друга. Этот вывод подтверждается некоторыми другие странные свойства, и химики решили, что это привлекательное Сила заслуживает особого названия. Они называют это водородная связь . Некоторые ученые утверждают, что водородные связи воды ответственны за для самой жизни.
КОНЕЦ ГРУППЫ |
Chemists Crack Complete Quantum Nature of Water
Химики создали первую полную квантово-механическую модель воды — одного из ключевых компонентов жизни. Журнал Journal of Physical Chemistry Letters опубликовал прорыв, в котором использовалось машинное обучение для разработки модели, которая дает подробное и точное описание того, как большие группы молекул воды взаимодействуют друг с другом.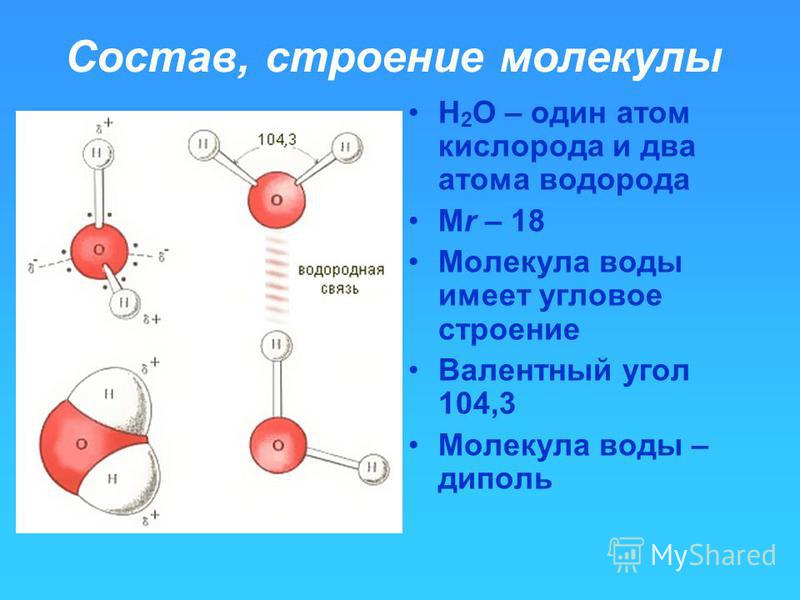
«Мы считаем, что нашли недостающую часть полного микроскопического понимания воды», — говорит Джоэл Боуман, профессор теоретической химии в Университете Эмори и старший автор исследования. «Похоже, что теперь у нас есть все, что нам нужно знать, чтобы описать молекулы воды в любых условиях, включая лед, жидкость или пар, в диапазоне температур и давлений».
Исследователи разработали бесплатное программное обеспечение с открытым исходным кодом для модели, которую они назвали «q-AQUA».
Программное обеспечение q-AQUA представляет собой универсальный инструмент для изучения воды. «Мы ожидаем, что исследователи будут использовать его для всего: от предсказания того, может ли экзопланета иметь воду, до углубления нашего понимания роли воды в клеточных функциях», — говорит Боуман.
Боумен — один из основателей теоретической динамики реакций и лидер в изучении загадок, лежащих в основе таких вопросов, как, например, почему нам нужна вода, чтобы жить.
Первым автором исследования является Ци Ю, бывший соискатель докторской степени Эмори в лаборатории Боумена, которая с тех пор закончила учебу и в настоящее время является научным сотрудником Йельского университета. Среди соавторов аспирант Эмори Апурба Нанди, кандидат наук в лаборатории Боумена; Риккардо Коне, бывший научный сотрудник Эмори в лаборатории Боумена, который сейчас работает в Миланском университете; и Пол Хьюстон, бывший декан по естественным наукам Технологического института Джорджии, а ныне почетный профессор Корнельского университета.
Среди соавторов аспирант Эмори Апурба Нанди, кандидат наук в лаборатории Боумена; Риккардо Коне, бывший научный сотрудник Эмори в лаборатории Боумена, который сейчас работает в Миланском университете; и Пол Хьюстон, бывший декан по естественным наукам Технологического института Джорджии, а ныне почетный профессор Корнельского университета.
Открытие попало на обложку Journal of Physical Chemistry Letters.
Открытие попало на обложку Journal of Physical Chemistry Letters.
Вода покрывает большую часть поверхности Земли и жизненно важна для всех живых организмов. Он состоит из простых молекул, каждая из которых состоит из двух атомов водорода и одного атома кислорода, связанных водородом.
Несмотря на простоту и повсеместность воды, описание взаимодействий кластеров молекул H 2 O в любых условиях представляет большие трудности.
Закон Ньютона управляет поведением тяжелых объектов в так называемом классическом мире, включая движение планет. Однако чрезвычайно легкие объекты на уровне атомов и электронов являются частью квантового мира, который подчиняется уравнению Шрёдингера для квантово-механических систем.
Каждая молекула воды состоит из одного атома кислорода и двух атомов водорода. «По весу мы состоим примерно на 70% из воды, — говорит Боумен, — и все же с химической точки зрения мы не совсем понимаем, как молекулы воды взаимодействуют с биологическими системами». Каждая молекула воды состоит из одного атома кислорода и двух атомов водорода. «По весу мы примерно на 70% состоим из воды, — говорит Боуман, — и все же с химической точки зрения мы не совсем понимаем, как молекулы воды взаимодействуют с биологическими системами».0123 «Атом водорода — самый легкий атом из всех, что делает его наиболее квантово-механическим», — объясняет Боумен. Хотя большие сложные проблемы в классическом мире можно разделить на части для решения, объекты в квантовом мире слишком «нечетки», чтобы их можно было разбить на отдельные части. Исследователи попытались создать квантовую модель воды, разбив ее на взаимодействия кластеров молекул воды. Боумен сравнивает это с людьми на вечеринке, сгруппированными в разговорные группы по два, три или четыре человека. «Представьте, что вы пытаетесь придумать модель для описания разговоров в каждой из этих групп людей, которую можно распространить на всю вечеринку», — говорит он. «Сначала вы собираете данные о двух говорящих людях и определяете, что они говорят, кто что говорит и что означает разговор. Становится сложнее, когда вы пытаетесь смоделировать разговор между тремя людьми. А когда вы получаете до четырех человек, это становится почти невозможным, потому что на вас поступает так много данных». Боумен является одним из основателей теоретической специальности динамики теоретических реакций и посвятил большую часть своей карьеры поиску более глубокого понимания воды во всех ее формах. Боумен является одним из основателей теоретической специальности динамики теоретических реакций и посвятил большую часть своей карьеры поиску более глубокого понимания воды во всех ее формах. В текущей статье исследователи использовали мощные методы машинного обучения, которые позволили компьютерам фиксировать взаимодействия групп из двух, трех и четырех молекул. «Довести это до уровня четырех тел было очень сложно, и никто раньше этого не делал и не публиковал», — говорит Боуман. «Мы знали, что если нам удастся этого добиться, мы будем далеко продвинуться к почти полному решению. В некотором смысле это был краеугольный камень всего процесса». Вместо слов, исходящих из уст людей, в анализе использовались тысячи чисел, исходящих из компьютеров. «Взаимодействие молекул воды в четырех телах, по-видимому, является последним, которое определяет все взаимодействия молекул воды», — говорит Боуман. Чтобы проверить свою модель, исследователи провели компьютерное моделирование в диапазоне температур для 256 молекул воды, взаимодействующих группами по две, три и четыре молекулы одновременно. Результаты показали, что модель была очень точной даже в таком масштабе. «Мы думаем, что можем довести нашу модель до 3000 или 4000 взаимодействующих молекул воды», — говорит Боуман. «Компьютерные усилия значительно возрастут, но это симуляции, которые мы планируем запустить в следующий раз, когда мы установили доказательство концепции для нашей модели». Модель может также служить трамплином для разработки аналогичных, более упрощенных моделей, которые требуют меньше вычислительной мощности, но при этом достаточно точны, чтобы делать полезные прогнозы относительно квантовой механики воды, говорит Боуман. «У него есть квантовая странность, состоящая в том, что он является и частицей, и волной одновременно».
«У него есть квантовая странность, состоящая в том, что он является и частицей, и волной одновременно».
 Однако, в отличие от людей, отдельные молекулы воды идентичны. Эта симметрия позволила исследователям построить модель взаимодействия между наборами из двух, трех и четырех молекул воды, чтобы она применялась к еще большим группам молекул.
Однако, в отличие от людей, отдельные молекулы воды идентичны. Эта симметрия позволила исследователям построить модель взаимодействия между наборами из двух, трех и четырех молекул воды, чтобы она применялась к еще большим группам молекул.




 This approach allows understanding the nature of the chemical processes and the laws of their proceeding.
This approach allows understanding the nature of the chemical processes and the laws of their proceeding. Понятие «орбиталь» означает наиболее вероятную область движения электрона в атоме. Магнитное квантовое число ml определяет число орбиталей и их пространственную ориентацию. Главное, орбитальное и магнитное квантовые числа взаимосвязаны. Орбитальное квантовое число l принимает значения на единицу меньше, чем главное квантовое число n. Если n = 1, то l = 0, и по форме это сферическая 1s-орбиталь. Если n = 2, то орбитальное квантовое число принимает два значения: l = 0, 1, указывающие на наличие двух подуровней. Это сферическая 2s— орбиталь (l = 0) и три 2p-орбитали, напоминающие по форме гимнастические гантели, расположенные под углом 90о по осям декартовой системы координат.
Понятие «орбиталь» означает наиболее вероятную область движения электрона в атоме. Магнитное квантовое число ml определяет число орбиталей и их пространственную ориентацию. Главное, орбитальное и магнитное квантовые числа взаимосвязаны. Орбитальное квантовое число l принимает значения на единицу меньше, чем главное квантовое число n. Если n = 1, то l = 0, и по форме это сферическая 1s-орбиталь. Если n = 2, то орбитальное квантовое число принимает два значения: l = 0, 1, указывающие на наличие двух подуровней. Это сферическая 2s— орбиталь (l = 0) и три 2p-орбитали, напоминающие по форме гимнастические гантели, расположенные под углом 90о по осям декартовой системы координат. Если l = 0, то ml = 0 (одна s—орбиталь). Если l = 1, то ml принимает три значения –1, 0, +1 (три р-орбитали).
Если l = 0, то ml = 0 (одна s—орбиталь). Если l = 1, то ml принимает три значения –1, 0, +1 (три р-орбитали). Когда на одной орбитали находятся два электрона, они имеют антипараллельные спины и не мешают друг другу двигаться в поле ядра.
Когда на одной орбитали находятся два электрона, они имеют антипараллельные спины и не мешают друг другу двигаться в поле ядра. 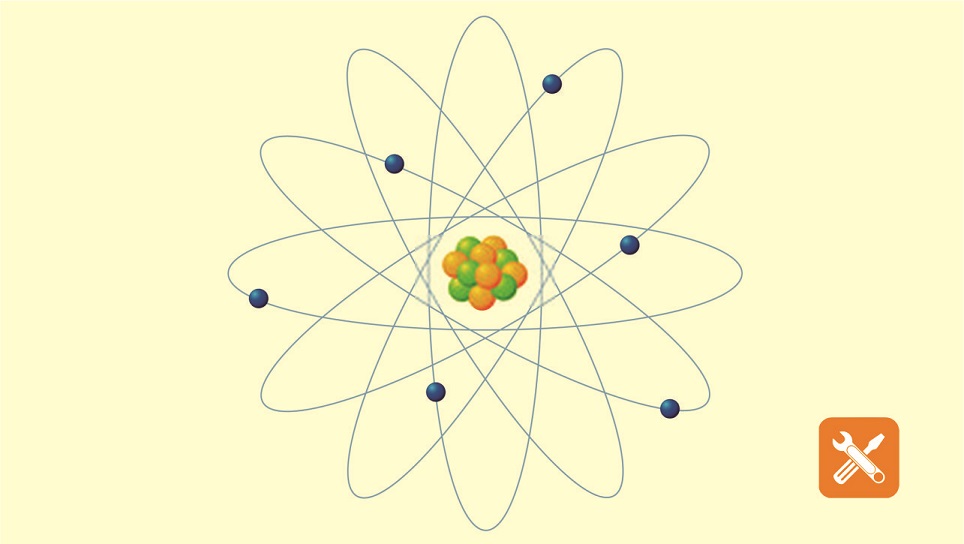
 Притяжение ядер атомов к повышенной электронной плотности между ними уравновешивается силой отталкивания ядер между собой. Образуется устойчивая микросистема, в которой длина ковалентной связи равна расстоянию между ядрами.
Притяжение ядер атомов к повышенной электронной плотности между ними уравновешивается силой отталкивания ядер между собой. Образуется устойчивая микросистема, в которой длина ковалентной связи равна расстоянию между ядрами. На рис. 4 представлена модель фтороводорода с полярной ковалентной связью. Электронная плотность между ковалентно связанными атомами смещается к атому фтора, заряд ядра которого (+9) оказывает большее электромагнитное притяжение по сравнению с ядром атома водорода с зарядом (+1).
На рис. 4 представлена модель фтороводорода с полярной ковалентной связью. Электронная плотность между ковалентно связанными атомами смещается к атому фтора, заряд ядра которого (+9) оказывает большее электромагнитное притяжение по сравнению с ядром атома водорода с зарядом (+1).

 к. 2s— и 2p-орбитали имеют разную форму и пространственное расположение. Проблема была решена введением гипотезы о гибридизации – смешении валентных электронов в подуровнях одного и того же энергетического уровня. В молекуле метана одна 2s— и три 2р-орбитали атома углерода в результате гибридизации превращаются в четыре равноценные sp3-гибридные орбитали:
к. 2s— и 2p-орбитали имеют разную форму и пространственное расположение. Проблема была решена введением гипотезы о гибридизации – смешении валентных электронов в подуровнях одного и того же энергетического уровня. В молекуле метана одна 2s— и три 2р-орбитали атома углерода в результате гибридизации превращаются в четыре равноценные sp3-гибридные орбитали: В гибридизации участвует 2s-орбиталь и две 2р-орбитали. В результате гибридизации атомы углерода образуют три равноценные sp2-гибридные орбитали, расположенные под углом 120о на плоскости; 2pz-орбиталь не участвует в гибридизации.
В гибридизации участвует 2s-орбиталь и две 2р-орбитали. В результате гибридизации атомы углерода образуют три равноценные sp2-гибридные орбитали, расположенные под углом 120о на плоскости; 2pz-орбиталь не участвует в гибридизации. Негибридные 2ру—и 2рz-орбитали разных атомов углерода перекрываются, образуя две p-связи во взаимно перпендикулярных плоскостях (рис. 9).
Негибридные 2ру—и 2рz-орбитали разных атомов углерода перекрываются, образуя две p-связи во взаимно перпендикулярных плоскостях (рис. 9). Завершающим процессом является образование ионной связи в кристаллической структуре фторида аммония. Орбитальные модели молекул позволяют показать все перечисленные выше свойства в одной реакции: разрывать и образовывать химические связи, изменять геометрическую конфигурацию, переходить из электронейтрального в ионное состояние.
Завершающим процессом является образование ионной связи в кристаллической структуре фторида аммония. Орбитальные модели молекул позволяют показать все перечисленные выше свойства в одной реакции: разрывать и образовывать химические связи, изменять геометрическую конфигурацию, переходить из электронейтрального в ионное состояние. И на фундаменте этих знаний можно уверенно использовать символику химических элементов и соединений для краткого описания химических состояний и превращений вещества.
И на фундаменте этих знаний можно уверенно использовать символику химических элементов и соединений для краткого описания химических состояний и превращений вещества. Две другие sр3-гибридные орбитали располагают свободными парами электронов с антипараллельными спинами. Разрыв ковалентной Н−О связи в одной из молекул приводит к образованию на соседней молекуле ковалентной химической связи по донорно-акцепторному механизму. Ион водорода, располагающий вакантной орбиталью, выступает в роли акцептора электронной пары атома кислорода соседней молекулы воды. В этом примере, как и в предыдущем, квантово-химический подход позволяет понять физико-химический смысл процесса электролитической диссоциации воды.
Две другие sр3-гибридные орбитали располагают свободными парами электронов с антипараллельными спинами. Разрыв ковалентной Н−О связи в одной из молекул приводит к образованию на соседней молекуле ковалентной химической связи по донорно-акцепторному механизму. Ион водорода, располагающий вакантной орбиталью, выступает в роли акцептора электронной пары атома кислорода соседней молекулы воды. В этом примере, как и в предыдущем, квантово-химический подход позволяет понять физико-химический смысл процесса электролитической диссоциации воды. – М.: Лабиринт, 1999. – 352 с.
– М.: Лабиринт, 1999. – 352 с. 
 В Blender’е есть два основных режима –
Режим правки (Edit Mode) и
Режим объекта (Object Mode).
Режим правки предназначен для изменения формы объекта путем выделения вершин на объекте.
Режим объекта влияет на объект в целом.
Клавиша Tab переключает между этими двумя режимами.
В Blender’е есть два основных режима –
Режим правки (Edit Mode) и
Режим объекта (Object Mode).
Режим правки предназначен для изменения формы объекта путем выделения вершин на объекте.
Режим объекта влияет на объект в целом.
Клавиша Tab переключает между этими двумя режимами.
 Вид спереди. Клавиша 1 на цифровом поле.
6. Увеличить цилиндр по оси Z в 7.5 раза. Нажать S, затем Z, и, зажав Ctrl, двигать мышью пока значения в левом нижнем углу 3D-окна не станет равно 7.5. Закрепить, щелкнув левой клавишей мыши.
7. Повернуть цилиндр на 90 градусов по оси Y. Нажать R, затем Y, и, удерживая Ctrl, двигать мышью пока значения в левом нижнем углу 3D-окна не станет равно 90. Закрепить, щелкнув левой клавишей мыши.
Ход работы
Вид спереди. Клавиша 1 на цифровом поле.
6. Увеличить цилиндр по оси Z в 7.5 раза. Нажать S, затем Z, и, зажав Ctrl, двигать мышью пока значения в левом нижнем углу 3D-окна не станет равно 7.5. Закрепить, щелкнув левой клавишей мыши.
7. Повернуть цилиндр на 90 градусов по оси Y. Нажать R, затем Y, и, удерживая Ctrl, двигать мышью пока значения в левом нижнем углу 3D-окна не станет равно 90. Закрепить, щелкнув левой клавишей мыши.
Ход работы Совместить концы цилиндров. Перемещать с помощью мыши за красную и синюю стрелки-оси.
11. Разместить 3D-курсор в точке соединения двух цилиндров Щелчок левой клавишей мыши
Ход работы
Совместить концы цилиндров. Перемещать с помощью мыши за красную и синюю стрелки-оси.
11. Разместить 3D-курсор в точке соединения двух цилиндров Щелчок левой клавишей мыши
Ход работы Oder starten Sie eine neuesuche, um noch mehr Stock-Photografie und Bilder zu entdecken. 3D химическая форма Вассера. h3o-wassermolekül auf blauem, sauberemhintergrund. naturwissenschaften, chemie, biologie, bildungskonzept. — модель молекулы воды стоковые фото и изображения
Oder starten Sie eine neuesuche, um noch mehr Stock-Photografie und Bilder zu entdecken. 3D химическая форма Вассера. h3o-wassermolekül auf blauem, sauberemhintergrund. naturwissenschaften, chemie, biologie, bildungskonzept. — модель молекулы воды стоковые фото и изображения — модель молекулы воды стоковые фотографии и изображения
— модель молекулы воды стоковые фотографии и изображения — модель молекулы воды стоковые фото и изображения
— модель молекулы воды стоковые фото и изображения Molekülzeichen im flachen Stil. EPS 10
Molekülzeichen im flachen Stil. EPS 10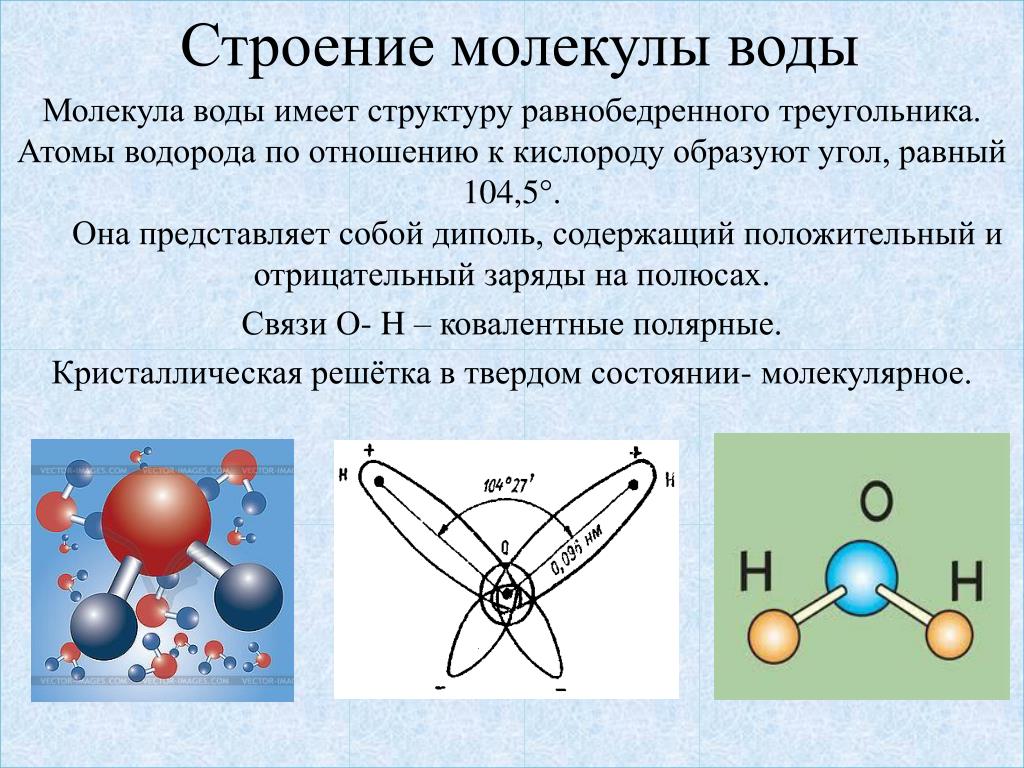 Вектор науки о данных. Многоугольник Векторхинтергрунд.
Вектор науки о данных. Многоугольник Векторхинтергрунд.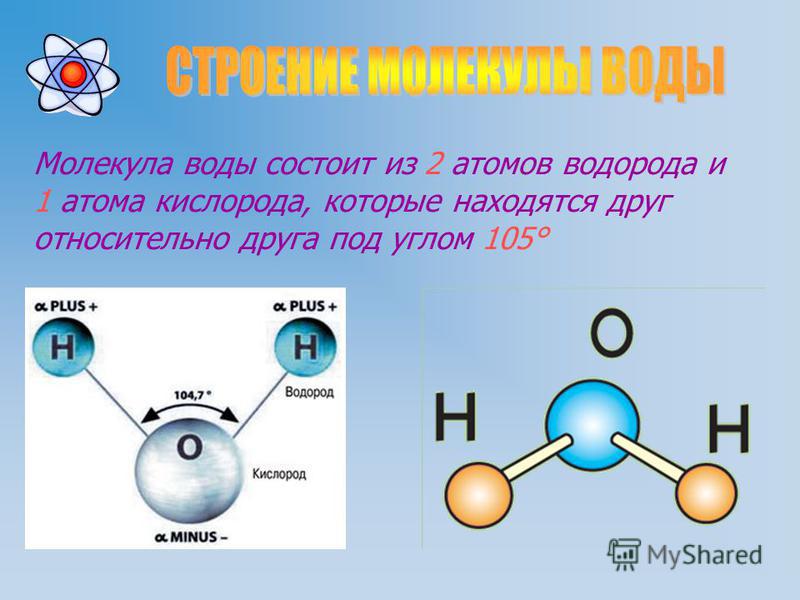 Многоугольник Векторхинтергрунд. Molekül- und Kommunikationshintergrund.
Многоугольник Векторхинтергрунд. Molekül- und Kommunikationshintergrund. Вектор науки о данных. Многоугольник Векторхинтергрунд.
Вектор науки о данных. Многоугольник Векторхинтергрунд.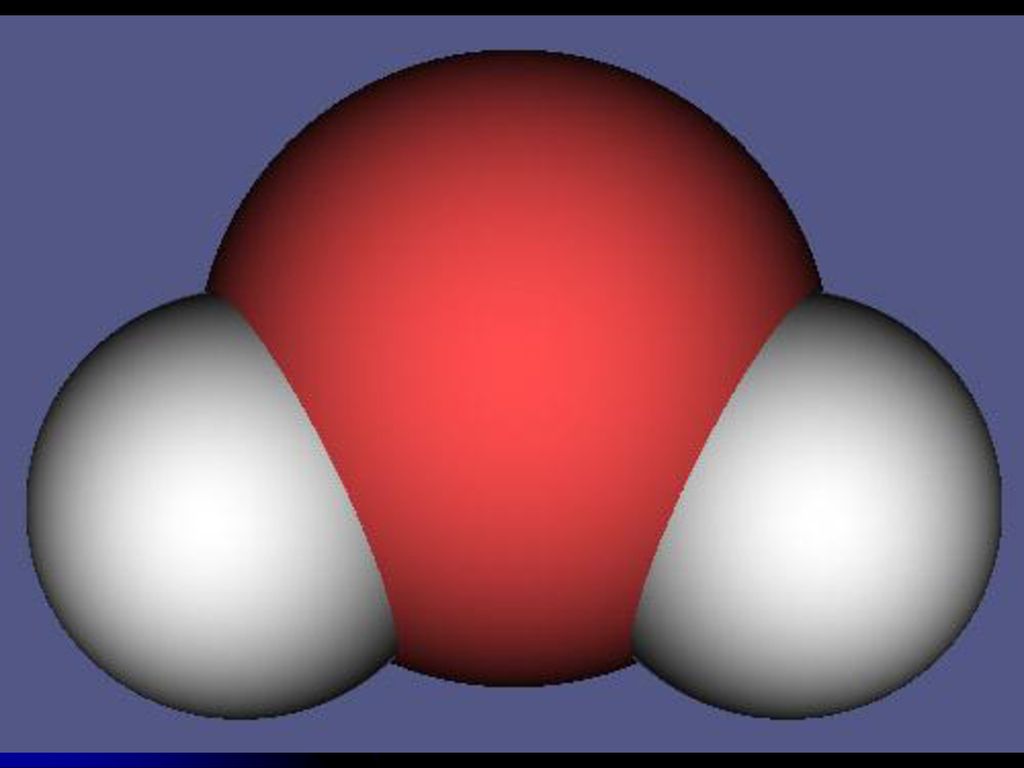 Das Konzept der Symbiose…
Das Konzept der Symbiose…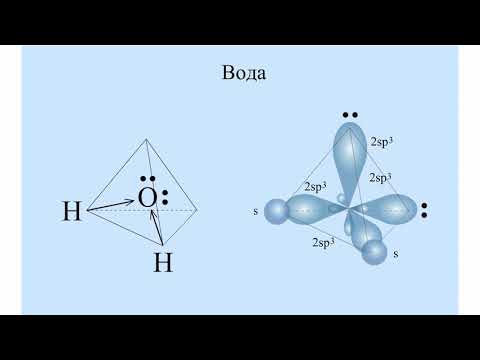 Металлические и прозрачные современные графические объекты. Wissenschaftliche Kulisse für kybernetisches, digitales, Web- und Technologydesign.
Металлические и прозрачные современные графические объекты. Wissenschaftliche Kulisse für kybernetisches, digitales, Web- und Technologydesign. бунт велленлиниен. флаер, обложка, брошюра. abbildung — модель молекулы воды стоковая графика, клипарт, мультфильмы и символы
бунт велленлиниен. флаер, обложка, брошюра. abbildung — модель молекулы воды стоковая графика, клипарт, мультфильмы и символы крем feuchtigkeitsspendende. — модель молекулы воды сток-график, -клипарт, -мультфильмы и -символ
крем feuchtigkeitsspendende. — модель молекулы воды сток-график, -клипарт, -мультфильмы и -символ ген реферирует netzwerk. eps 10 — модель молекулы воды сток-график, -клипарт, -мультфильмы и -символ
ген реферирует netzwerk. eps 10 — модель молекулы воды сток-график, -клипарт, -мультфильмы и -символ Gene…
Gene… Джин…
Джин…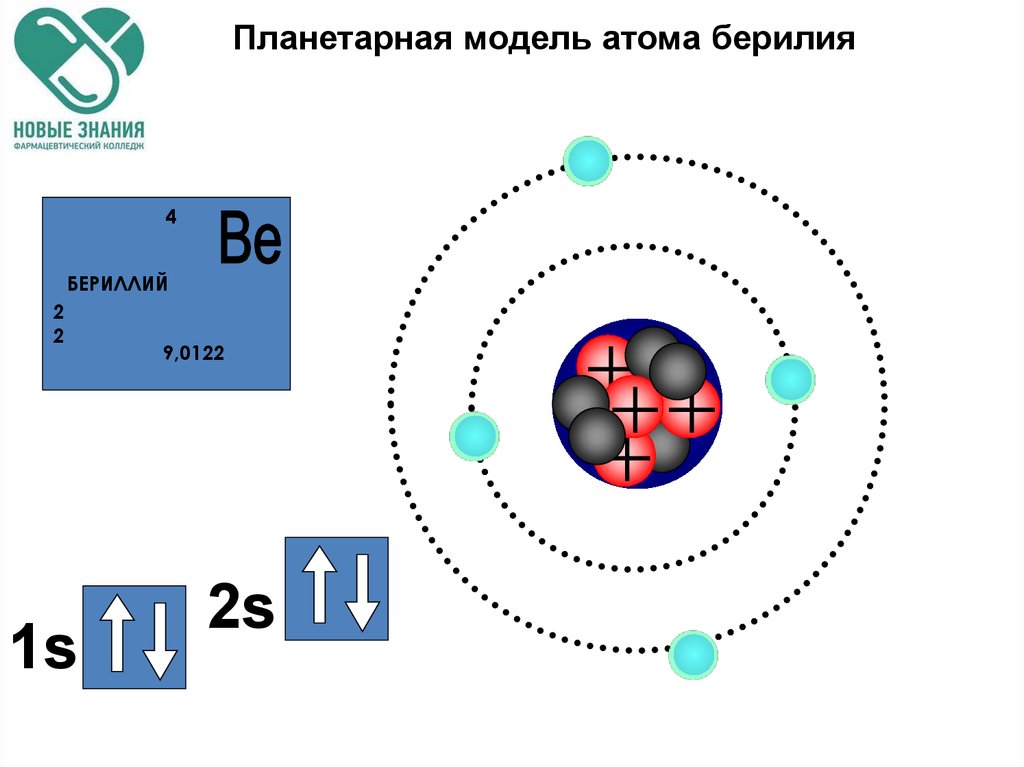 Большие количества водорода используются для гидрогенизации масел с образованием жиров, например, для производства маргарина.
Большие количества водорода используются для гидрогенизации масел с образованием жиров, например, для производства маргарина.
 В 1766 году он собрал пузырьки и показал, что они отличаются от других газов. Позже он показал, что когда водород горит, он образует воду, тем самым положив конец вере в то, что вода была элементом. Газ получил свое название водород , что означает образующий воду, Антуан Лавуазье.
В 1766 году он собрал пузырьки и показал, что они отличаются от других газов. Позже он показал, что когда водород горит, он образует воду, тем самым положив конец вере в то, что вода была элементом. Газ получил свое название водород , что означает образующий воду, Антуан Лавуазье. 20
20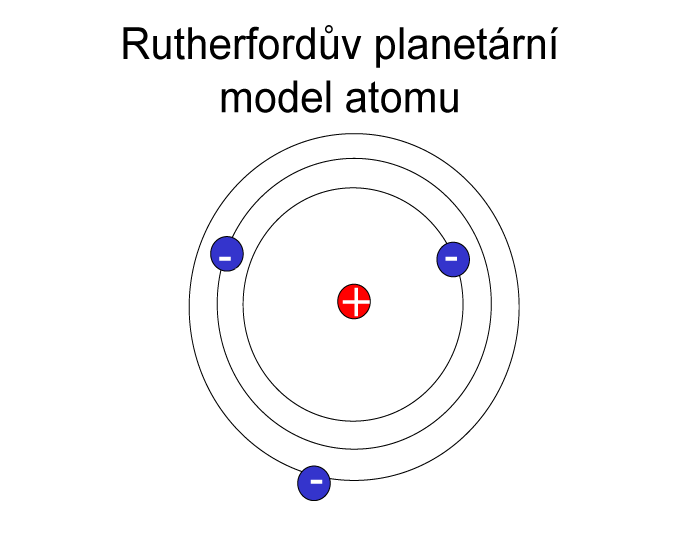 016
016

 Ни один воздушный шар не парит так хорошо, как водородный.
Ни один воздушный шар не парит так хорошо, как водородный. Водородный дирижабль был обречен.
Водородный дирижабль был обречен.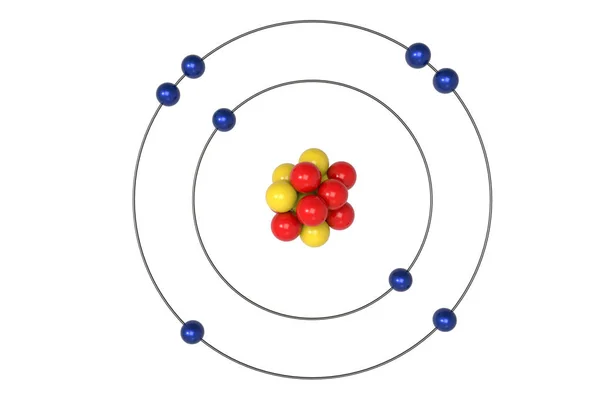 Другой проблемой является получение водорода. Это происходит либо из углеводородов, потенциально оставляющих осадок парниковых газов, либо из электролиза воды с использованием электричества, которое не может быть получено экологически чистым способом.
Другой проблемой является получение водорода. Это происходит либо из углеводородов, потенциально оставляющих осадок парниковых газов, либо из электролиза воды с использованием электричества, которое не может быть получено экологически чистым способом.
 org/elements.
org/elements. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.  Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Элементы 113, 115, 117 и 118 © Королевское общество химии 2017. 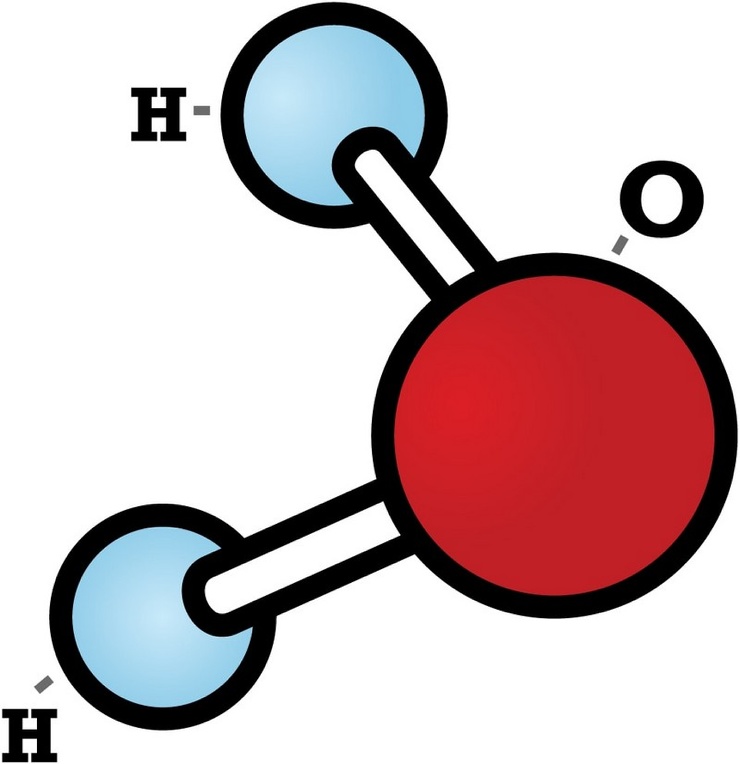 На этом рисунке показаны ключевые модели, предложенные для атома, и то, как они менялись с течением времени.
На этом рисунке показаны ключевые модели, предложенные для атома, и то, как они менялись с течением времени.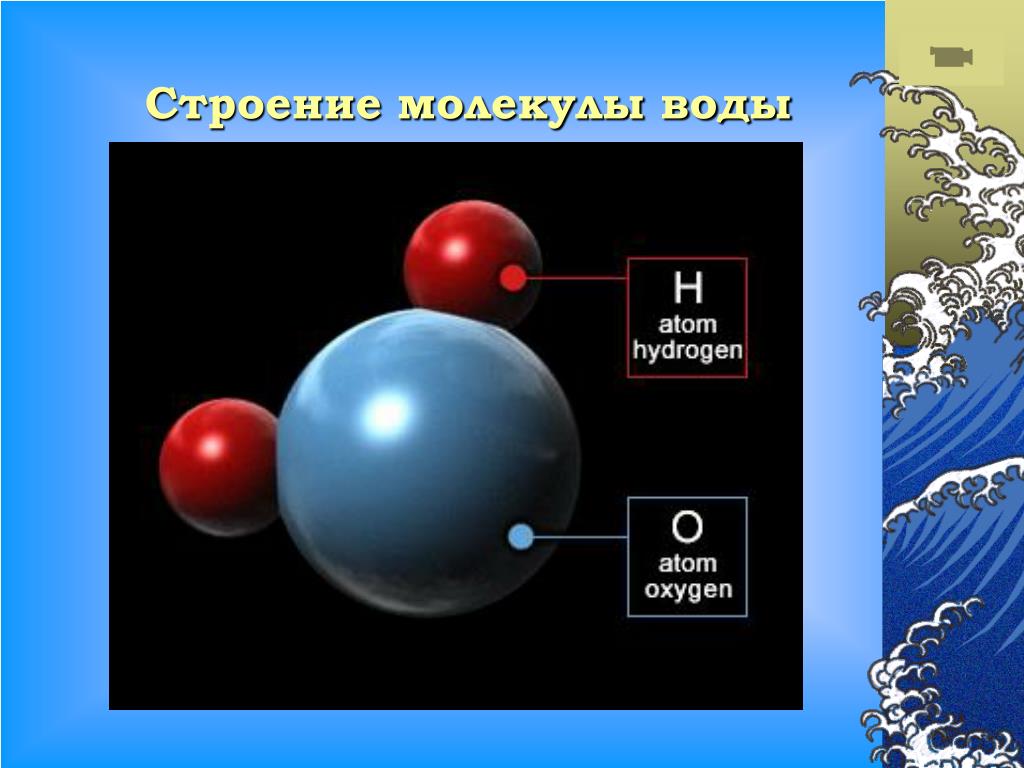 Хотя теперь мы знаем, что это не так, их идеи заложили основу для будущих моделей атома.
Хотя теперь мы знаем, что это не так, их идеи заложили основу для будущих моделей атома. Были некоторые попытки определить, как могут выглядеть атомы, например, предположение лорда Кельвина о том, что они могут иметь вихреподобную структуру, но только на рубеже 20-го века прогресс в выяснении атомной структуры действительно начался. подбирать.
Были некоторые попытки определить, как могут выглядеть атомы, например, предположение лорда Кельвина о том, что они могут иметь вихреподобную структуру, но только на рубеже 20-го века прогресс в выяснении атомной структуры действительно начался. подбирать. Это открытие принесло ему Нобелевскую премию в 1906.
Это открытие принесло ему Нобелевскую премию в 1906.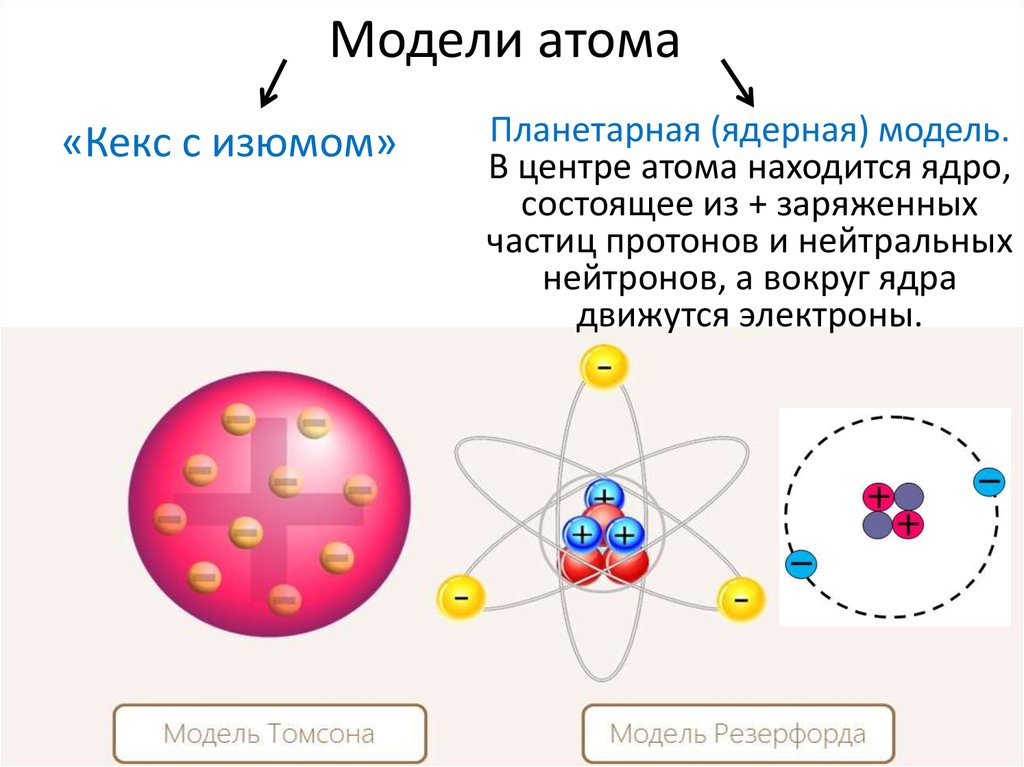 Альфа-частицы были настолько малы, что могли проходить сквозь золотую фольгу, и, согласно модели Томсона, которая показывала, что положительный заряд рассеивается по всему атому, они должны были проходить с небольшим отклонением или вообще без него. Проведя этот эксперимент, он надеялся подтвердить модель Томсона, но в итоге сделал прямо противоположное.
Альфа-частицы были настолько малы, что могли проходить сквозь золотую фольгу, и, согласно модели Томсона, которая показывала, что положительный заряд рассеивается по всему атому, они должны были проходить с небольшим отклонением или вообще без него. Проведя этот эксперимент, он надеялся подтвердить модель Томсона, но в итоге сделал прямо противоположное.

 У него все еще есть свое применение; это очень удобно для объяснения химической связи и реакционной способности некоторых групп элементов на простом уровне.
У него все еще есть свое применение; это очень удобно для объяснения химической связи и реакционной способности некоторых групп элементов на простом уровне. Эти области пространства называются электронными орбиталями. Возможно, понятно, почему уроки химии в средней школе не приводят прямо к этой модели, хотя сегодня она является принятой моделью, потому что требуется немного больше времени, чтобы собраться с мыслями!
Эти области пространства называются электронными орбиталями. Возможно, понятно, почему уроки химии в средней школе не приводят прямо к этой модели, хотя сегодня она является принятой моделью, потому что требуется немного больше времени, чтобы собраться с мыслями!