№3 Литий
История открытия:
В 1817 г. шведский химик и минералог Август Арфведсон, анализируя природный минерал петалит, установил, что в нем содержится «огнепостоянная щелочь до сих пор неизвестной природы». Позднее он нашел аналогичные соединения в составе других минералов. Арфведсон предположил, что это соединения нового элемента и дал ему название литий (от греческого liqoz – камень).
Металлический литий был выделен в 1818 году английский химиком Гемфри Дэви электролизом расплава гидроксида лития.
Нахождение в природе и получение:
Природный литий состоит из двух стабильных изотопов — 6Li (7,42%) и 7Li (92,58%).
Литий — сравнительно мало распространенный элемент (массовая доля в земной коре 1,8*10-3%, 18 г/тонну). Кроме петалита LiAl[Si4O10], основными минералами лития являются слюда, лепидолит — KLi1,5Al1,5[Si3AlO10](F,OH)2 и пироксен сподумен — LiAl[Si2O
В настоящее время для получения металлического лития его природные минералы или обрабатывают серной кислотой, или спекают с CaO или CaCO3, а затем выщелачивают водой. Получают растворы сульфата или гидроксида лития, из которых осаждают плохо растворимый карбонат Li2CO3, который затем переводят в хлорид LiCl. Электролизом расплава хлорида лития в смеси с хлоридом калия или бария получают металлический литий.
Физические свойства:
Простое вещество литий — мягкий щелочной металл серебристо-белого цвета. Из всех щелочных металлов он самый твердый, высокоплавкий (Ткип=180,5 и Тпл=1340° С). Это самый легкий металл (плотность 0,533 г/см3), он плавает не только в воде, но и в керосине. Литий и его соли окрашивают пламя в карминно-красный цвет.
Химические свойства:
Литий проявляет типичные свойства щелочных металлов, взаимодействуя с водой, кислородом, другими неметаллами. Хранить его приходится под слоем под слоем минерального масла, придавливая сверху, чтобы не всплывал.
В соответствии с положением в ПСХЭ, литий наименее активный щелочной металл. Так в реакции с кислородом он образует в основном оксид лития, а не пероксиды как другие металлы. Подобно натрию литий растворяется в жидком аммиаке, образуя синий раствор с металлической проводимостью. Растворенный литий постепенно реагирует с аммиаком: 2Li + 2NH3 = 2LiNH2 + H2.
Литий отличается повышенной активностью при взаимодействии с азотом, образуя с ним уже при обычной температуре нитрид Li
По некоторым свойствам литий и его соединения напоминают соединения магния (диагональное сходство в таблице Менделеева).
Важнейшие соединения:
Оксид лития, Li2O — белое кристаллическое вещество, основный оксид, с водой образует гидроксид
Гидроксид лития — LiOH — белый порошок, обычно моногидрат, LiOH*H2O, сильное основание
Соли лития — бесцветные кристаллические вещества, гигроскопичны, образуют кристаллогидраты состава LiX*3H2O. Карбонат и фторид лития подобно аналогичным солям магния малорастворимы.
Карбонат и нитрат лития при нагревании разлагаются, образуя оксид лития:
Пероксид лития — Li2O2 — белое кристаллическое вещество, получают реакцией гидроксида лития с пероксидом водорода:
2LiOH + H2O2 = Li2O2 + 2H2O
Используют в космических аппаратах и подводных лодках для получения кислорода:
2Li2O2 + 2CO2 = 2Li2CO3 +O2
Гидрид лития LiH получают взаимодействием расплавленного лития с водородом. Бесцветные кристаллы, реагирует с водой и кислотами с выделением водорода. Источник водорода в полевых условиях.
Применение:
Металлический литий — высокопрочные и сверхлегкие сплавы с магнием и алюминием для авиационной и космической техники. Легирующая добавка в металлургии (связывает азот, кремний, углерод). Теплоноситель (расплав) в ядерных реакторах.
Из лития изготовляют аноды химических источников тока и гальванических элементов с твёрдым электролитом.
Соединения: специальные стекла, глазури, эмали, керамика. Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров
LiOH как добавка в электролит щелочных аккумуляторов. Карбонат лития – добавка в расплав при производстве алюминия: снижает температуру плавления электролита, увеличивает силу тока, уменьшает нежелательное выделение фтора.
Металлоорганические соединения лития (например бутиллитий LiС4Н9) — широко применяются в промышленном и лабораторном органическом синтезе и как катализаторы полимеризации.
Дейтерид лития-6: как источник дейтерия и трития в термоядерном оружии (водородная бомба). См. Ядерные реакции дейтерида лития. (анимированные модели).
Содержание лития в организме человека составляет около 70 мг. В течение суток в организм взрослого человека поступает около 100 мкг лития. Литий способствует высвобождению магния из клеточных «депо» и тормозит передачу нервного импульса, ингибируя проводимость нервной системы. Соли лития применяются психотропные лекарственные средства, оказывая успокаивающий эффект при лечении шизофрении и депрессии. Однако передозировка может привести к тяжелым осложнениям и летальному исходу.
Нурмаганбетов Т.
ТюмГУ, 582 группа, 2011 г.
Источники:
Литий // Википедия. URL: http://ru.wikipedia.org/wiki/Литий (дата обращения: 23.05.2013).
Литий // Онлайн Энциклопедия Кругосвет. URL: http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/LITI.html (дата обращения: 23.05.2013).
Оксид лития — Википедия
Материал из Википедии — свободной энциклопедии
Окси́д ли́тия (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития —
- 4 Li+ O2⟶2 Li2O{\displaystyle {\mathsf {4\ Li+\ O_{2}\longrightarrow 2\ Li_{2}O}}}
- 2 Li2O2→195∘C 2 Li2O+ O2↑{\displaystyle {\mathsf {2\ Li_{2}O_{2}{\xrightarrow {195^{\circ }C}}\ 2\ Li_{2}O+\ O_{2}\uparrow }}}
- Взаимодействует с водой, образуя щёлочь:
- Li2O+h3O→ 2 LiOH{\displaystyle {\mathsf {\ Li_{2}O+H_{2}O{\xrightarrow {\ }}\ 2\ LiOH}}}
- Li2O+2 HCl→ 2 LiCl+h3O{\displaystyle {\mathsf {\ Li_{2}O+2\ HCl{\xrightarrow {\ }}\ 2\ LiCl+H_{2}O}}}
- литий из оксида вытесняется некоторыми металлами и неметаллами:
- Li2O+Mg→800∘C 2 Li+MgO{\displaystyle {\mathsf {\ Li_{2}O+Mg{\xrightarrow {800^{\circ }C}}\ 2\ Li+MgO}}}
- 2 Li2O+Si→1000∘C 4 Li+SiO2{\displaystyle {\mathsf {2\ Li_{2}O+Si{\xrightarrow {1000^{\circ }C}}\ 4\ Li+SiO_{2}}}}
- с кислотообразующими оксидами образует соли:
- Li2O+CO2→500∘C Li2CO3{\displaystyle {\mathsf {Li_{2}O+CO_{2}{\xrightarrow {500^{\circ }C}}\ Li_{2}CO_{3}}}}
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
Гидроксид лития — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 февраля 2019; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 февраля 2019; проверки требуют 2 правки.Гидроксид лития — неорганическое основание щелочного металла лития, имеющее формулу LiOH. Является сильным основанием, но наиболее слабым основанием среди щелочных металлов.
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы с тетрагональной решёткой.[2] При работе с ним необходимо проявлять осторожность, избегать попадания на кожу и слизистые оболочки.
Растворяется в воде, 12,24 г/100 см3 при 25 °C, растворимость с температурой практически не повышается. В этаноле, в отличие от гидроксида натрия, почти не растворяется.[3]
- 2 Li+2 h3O⟶2 LiOH+ h3↑{\displaystyle {\mathsf {2\ Li+2\ H_{2}O\longrightarrow 2\ LiOH+\ H_{2}\uparrow }}}
- Li2O+ h3O⟶2 LiOH{\displaystyle {\mathsf {Li_{2}O+\ H_{2}O\longrightarrow 2\ LiOH}}}
- Li2CO3+ Ca(OH)2⟶2 LiOH+ CaCO3↓{\displaystyle {\mathsf {Li_{2}CO_{3}+\ Ca(OH)_{2}\longrightarrow 2\ LiOH+\ CaCO_{3}\downarrow }}}
- Обменными реакциями:
- Li2SO4+ Ba(OH)2⟶2 LiOH+ BaSO4↓{\displaystyle {\mathsf {Li_{2}SO_{4}+\ Ba(OH)_{2}\longrightarrow 2\ LiOH+\ BaSO_{4}\downarrow }}}
- LiOH+ HCl⟶ LiCl+ h3O{\displaystyle {\mathsf {LiOH+\ HCl\longrightarrow \ LiCl+\ H_{2}O}}}
- 2 LiOH+ h3SO4⟶ Li2SO4+2 h3O{\displaystyle {\mathsf {2\ LiOH+\ H_{2}SO_{4}\longrightarrow \ Li_{2}SO_{4}+2\ H_{2}O}}}
- 2 LiOH+ CO2⟶ Li2CO3+ h3O{\displaystyle {\mathsf {2\ LiOH+\ CO_{2}\longrightarrow \ Li_{2}CO_{3}+\ H_{2}O}}}
- 2 LiOH+ SO3⟶ Li2SO4+ h3O{\displaystyle {\mathsf {2\ LiOH+\ SO_{3}\longrightarrow \ Li_{2}SO_{4}+\ H_{2}O}}}
- При нагревании в инертной атмосфере (Ar) разлагается:
- 2 LiOH→800oC,Ar Li2O+ h3O{\displaystyle {\mathsf {2\ LiOH{\xrightarrow {800^{o}C,Ar}}\ Li_{2}O+\ H_{2}O}}}
Гидроксид лития используют для получения солей лития; как компонент электролитов в щелочных аккумуляторах и поглотитель углекислого газа в противогазах, подводных лодках и космических кораблях. Он также используется как катализатор полимеризации. Применяется в стекольной и керамической промышленности. При производстве водоупорных смазочных материалов, обладающих механической стабильностью в широком диапазоне температур.
Нам нужен свой литий
ЭкспертБизнес
Россия импортирует литий, несмотря на то что обладает собственными запасами этого стратегического металла. Растущий спрос на него и геополитическая ситуация подталкивают к тому, чтобы начать добывать литий на своей территории
Вера Колерова
Добывать литий в солончаках Чили не так уж сложно. Затраты на обогащение металла невелики — большую часть работы сделает солнце. Фото: предоставлено компаниейЛитий стал известен широкой публике после того, как появились мобильные телефоны, в каждом из которых есть аккумулятор. Это не мешает ему оставаться в статусе секретного металла, сведения о котором отчасти составляют государственную тайну. Дело в том, что этот металл используется при изготовлении водородной бомбы.
Несколько лет назад прогнозы бурного развития электротранспорта спровоцировали «литиевую лихорадку». Литий (точнее, его соединения) используется в производстве литий-ионных аккумуляторов. Мировое производство лития не успевало за спросом, и в результате цены на этот металл с 5500 долларов за тонну в 2014 году выросли к 2018 году до 14 тысяч.
Россия на мировом рынке лития является потребителем. Карбонат лития мы импортируем. По данным рейтингового агентства АКРА, в прошлом году в страну ввезли 5,23 тыс. тонн карбоната лития преимущественно из Чили (60%) и Аргентины (38%), а также 223 тонны гидроксида лития (80% — из Китая, 20% — из США). В пересчете на металл это полторы тысячи тонн лития. То есть около трех процентов мирового потребления.
Уже по итогам этого года ожидается, что предложение лития на рынке будет больше, чем спрос
Минпромторг оценивает перспективную потребность российских предприятий в литиевых продуктах примерно в три тысячи тонн в год и считает необходимым начать создавать полный технологический цикл по добыче и переработке этого металла.
Сегодня его в России нет. «Крупных промышленных предприятий, потребляющих соединения лития для производства продукции верхних переделов — аккумуляторных батарей, керамической промышленности, смазочных материалов, — не существовало и в Советском Союзе, — говорит Руслан Димухамедов, директор по развитию бизнесов АО “Атомредметзолото” (горнорудный дивизион “Росатома”). — Поэтому потребление лития у нас связано в основном с переработкой импортируемого сырья из дешевых соединений в чуть более дорогие объемом примерно десять тысяч тонн в год».
Производство Лития в России
Производств, выпускающих соединения лития (промышленную литиевую продукцию), в России очень мало. Новосибирский завод химконцентратов (НЗХК), входящий в структуру «Росатома», производит металлический литий и изотопы лития. Гидроксид лития и металлический литий выпускает Химико-металлургический завод (Красноярск), соединения лития выпускает Сибирский химический комбинат в Северске. 90% их продукции идет в Западную Европу, Японию и США. Именно экспорт помог заводам пройти 1990-е годы и не разориться. Но в России делается все-таки лишь полуфабрикат, из которого за рубежом выпускают высокотехнологичную продукцию. Выходит, что необходимо создавать производственный цикл в «обе стороны»: идти и в сырье, и в продукцию высокого передела.
Казалось бы, зачем свой литий, если хватает привозного? Но зависимость от импорта принято считать опасной: ситуацию с литиевым сырьем часто сравнивают с рынком редкоземов, где монополистом является Китай, который поднял цены до такого уровня, что многие страны, в том числе Россия, задумались о развитии своей редкоземельной промышленности. «Все вспомнили, что в Подмосковье лежат мегатонны редких земель в виде отходов химического производства, и начали их перерабатывать», — говорит Вадим Тарасов, профессор, заведующий кафедрой цветных металлов и золота НИТУ МИСиС.
На рынке лития нет монополии, но присутствует нечто похожее на олигополию. Самые большие объемы литийсодержащего сырья добывает Чили, далее следует Китай, который не только разрабатывает собственные месторождения, но и закупает сырье.
Чтобы не зависеть так сильно от мировых цен, необходимо развивать свою добычу. Тем более что экономически это целесообразно. По оценкам Руслана Димухамедова, предварительная оценка показывает, что себестоимость добычи лития в России может быть на среднем мировом уровне. Мировые цены на литий, по его мнению, обеспечат безубыточность проектов по его добыче. Главное, как скоро в России удастся их реализовать и выйти на рынок с готовой продукцией.
Производство лития по странам мира
В «Атомредмедзолоте» ждут роста отечественного литиевого рынка — будет развиваться добыча этого металла, а параллельно начнут создаваться производства глубокой переработки лития. В перспективе пяти–десяти лет рынок лития вырастет кратно.
Аналитики оценивают перспективы российского литиевого рынка более сдержанно. Внутренний рынок сбыта ограничен. По мнению Максима Худалова, директора группы корпоративных рейтингов АКРА, в России потребность в литии несущественна и значимого роста производства в перспективе пяти лет ждать не стоит. Этот металл применяется только для технологических целей машиностроения и предприятиями атомной промышленности, ведь российские проекты по производству литий-ионных батарей не реализовались (или не в полной мере). «А с учетом ухудшения доступа к зарубежным технологиям отставание России в этом сегменте может усилиться», — считает г-н Худалов. Как полагает эксперт, внутренний рынок способен развиваться за счет роста спроса со стороны атомной промышленности, но пока существенного роста собственного производства не будет.
Россия при недостатке внутреннего спроса могла бы наращивать экспорт лития, учитывая долгосрочный тренд на электрификацию транспорта. «Российским проектам в добыче лития необходимо как можно быстрее воспользоваться окном возможностей и успеть встроиться в мировые торговые цепочки», — утверждает Руслан Димухамедов.
Впрочем, экспортные перспективы портит высокая конкуренция со стороны Чили и Аргентины. Да и рассчитывать на долгий и устойчивый рост цен не стоит. В АКРА ждут снижения цен на литий в связи со значительным увеличением производства этого металла в мире. «Последний рост цен на литий носил преимущественно спекулятивный характер. В обозримом будущем, с потерей мирового интереса к электромобилям, ожидается, скорее, плавное снижение мировых цен на литий», — считает Анастасия Соснова, аналитик ИК «Фридом Финанс».
Однако никто не прогнозирует и обрушения цен на литий ниже уровня 2015 года.
Генеральный директор управляющей компании ПАО «Химико-металлургический завод» (Красноярск) Лев Третьяков предупреждает, что если государство не станет поддерживать проекты добычи литийсодержащих руд, есть риск снижения объемов переработки импортного сырья вплоть до полной остановки производства — из-за санкционной политики либо в связи с возможным дефицитом сырья на мировом рынке и ростом цен.
Запасы лития по странам мира
Забытое изобилие
«Парадоксальная ситуация: у нас обилие месторождений с подтвержденными запасами и полное отсутствие государственного интереса к их освоению», — говорит кандидат геолого-минералогических наук Гелий Мелентьев, эксперт специализированного журнала «Редкие земли».
Основные сырьевые запасы лития в стране сосредоточены в месторождениях редкометалльных гранитных пегматитов (пегматит — разновидность горной породы). Руда обогащается, из нее выделяются литиевые минералы, а далее литиевый концентрат направляется на химико-металлургический передел с получением соединений лития.
Содержание оксида лития в российских пегматитах и гранитах сопоставимо с содержаниями, характерными для большинства зарубежных месторождений, утверждает Дмитрий Ключарев, заведующий отделом Института минералогии, геохимии и кристаллохимии редких элементов (ИМГРЭ).
Основные российские месторождения — Колмозерское, Тастыгское, Вишняковское, Гольцовое и проч. — разведаны еще в середине прошлого века.
Использование лития в производстве
По словам Вадима Тарасова, в России проблемы не только с освоением, но и с разведанностью месторождений: «Фактически мы пользуемся данными конца прошлого века. Новых разведочных работ на эту тему не заказывают. Это определяется потребностями: тех месторождений, которые вскрыты, достаточно для того, чтобы развернуть широкомасштабное производство лития». Дмитрий Ключарев утверждает, что если сейчас начать отрабатывать месторождения, то через три–пять лет потребности России будут частично закрыты, а лет через десять возможен экспорт литиевой продукции.
Однако России всегда было проще и дешевле закупать карбонат лития в Латинской Америке. В Чили себестоимость добычи лития невысока, его добывают из солончаковых озер с минимальными затратами — основную энергию для обогащения металла дает солнце. Рассол просто выпаривается в бассейнах. Образно говоря, чилийцы ждут, пока соль осядет в условиях жаркого климата и останется только собрать ее лопатой в грузовик и отвезти на производство.
В России тоже есть солончаковые озера в южных регионах, но эти потенциальные ресурсы лития только изучаются. То же касается добычи лития вообще. Как сообщили в «Атомредметзолоте», компания прорабатывает вопрос строительства завода по добыче лития из руд Завитинского месторождения (Забайкальский край). Кроме того, ТВЭЛ рассматривает организацию новых производств — как перерабатывающих соли лития, так и продукции более глубоких переделов (катодных материалов и аккумуляторов).
Завитинское месторождение, которое разрабатывал Забайкальский ГОК, — единственный освоенный источник лития в России. В 1997 году оно было законсервировано из-за истощения рентабельных запасов. «Там вполне можно восстановить технологии, и это уже делается, — говорит Вадим Тарасов. — Получается довольно богатый литием концентрат, который можно перерабатывать на хлорид либо на карбонат лития».
Источники сырья для лития
Начать разрабатывать новые месторождения гораздо сложнее. Это потребует колоссальных инвестиций и времени. По словам Дмитрия Ключарева, с момента принятия решения о начале разработки подготовленного разведанного месторождения и до выхода первого продукта пройдет в лучшем случае три-четыре года, а скорее пять-семь лет. Фактически речь идет о строительстве сложного горно-обогатительного и химико-металлургического производства, которое может выдавать как концентрат для переработки, так и готовые соединения лития.
Но не обязательно браться за добычу лития из месторождений, считает Вадим Тарасов, предлагая внимательнее смотреть в сторону отвалов и хвостов производств на ГОКах: «Такой проект уже несколько лет вынашивает “Русал”, планируя создать опытное производство на Ярославском ГОКе в Приморском крае, чтобы перерабатывать литийсодержащий концентрат. Я бы не стал драматизировать ситуацию с литием. Металл нужный, и его можно производить значительно больше, чем сейчас, взяв то, что лежит на наших горно-обогатительных комбинатах».
Правда, извлекать литий из отвалов и хвостов обогатительных предприятий — задача не из простых, считает Дмитрий Ключарев. «Например, хвосты обогащения руд Вознесенского и Пограничного месторождений состоят преимущественно из слюд, а это своего рода химическая помойка. Помимо лития эти слюды содержат множество других элементов. Чтобы извлечь из этой каши именно литий, нужны сложные технологии и большие затраты энергии».
В МИСиС совместно с «Русалом» разработали такую установку для извлечения лития из отвалов. Кроме того, у специалистов кафедры цветных металлов МИСиС есть технологии металлотермического получения лития из отходов алюминиевого производства, синтетического каучука и использованных литиевых источников энергии. «О техногенном сырье тоже не нужно забывать», — отмечает Вадим Тарасов. Однако пока эти технологии не очень востребованы рынком.
Наибольший спрос на литий прогнозируется со стороны производителей аккумуляторов
Литий в подарок
Не реализована у нас в стране в промышленных масштабах и активно обсуждаемая сейчас технология добычи лития из гидротермального сырья. Литий можно извлекать как попутный компонент из подземных рассолов, открывающихся при добыче нефти, газа и алмазов. В этом случае рассолы с литием становятся отдельным «бонусом» для добытчиков. В мире из рассолов добывается 60–65% общего объема лития. Есть мнение, что такая добыча лития будет обходиться дешевле. К крупнейшим источникам подобного сырья — попутных нефтяных рассолов — в России относят Верхнечонское и Ярактинское нефтегазовые месторождения.
Как объясняет Дмитрий Ключарев, плюсы добычи лития из пегматитового сырья — более высокое содержание его в породе, а также то, что уже на первом переделе можно получить готовый продукт — для керамики, алюминиевой промышленности и т. д.
В противовес пегматитам литий, получаемый из рассолов, проходит больше стадий передела. Зато рассолы более выдержаны по содержаниям. Хотя в них в целом меньше лития, но и расходы на первичное обогащение ниже. Основные затраты приходятся на химико-металлургическое производство. Тем не менее литий, получаемый из пегматитового и из гидротермального сырья, примерно равноценен с точки зрения затрат на производственный процесс и себестоимости конечной продукции, считает ученый.
Но если технологии для добычи лития из пегматитов давно известны и отработаны, то с гидротермальным сырьем все не так просто. Как рассказывает Екатерина Михеева, ведущий специалист Центра ОМСН ФГБУ «Гидроспецгеология», еще в 1990-е годы в новосибирской компании «Экостар-Наутех» были разработаны и опробованы технологии получения лития и брома на базе иркутских рассолов. Однако опытов промышленного применения не было. «К сожалению, китайцы быстро освоили эти технологии, им хватило пяти лет, чтобы начать получать литий из своих соленых озер», — говорит Екатерина Михеева.
Сегодня российская сорбционная технология извлечения соединений лития из рассолов на ионообменных смолах широко применяется за рубежом, утверждает Дмитрий Ключарев.
В принципе, достать литий из рассола несложно, считает Вадим Тарасов. «Это земельный металл, у которого очень высокое содержание в земной коре, он есть везде, в том числе в Подмосковье, — говорит Тарасов. — Можно и в Подмосковье найти рассолы и извлечь оттуда литий».
Будет ли такая добыча лития выгодна и интересна нефтяникам, нужно еще считать. Но, по мнению Гелия Мелентьева, при несопоставимо более низких концентрациях лития в подземных рассолах (по сравнению, например, с солончаками в Чили), возникают сомнения в этом. «Не говоря уже о том, что появится много экологических проблем, которые обойдутся очень дорого, — продолжает он. — Будут оставаться гигантские объемы воды, содержащей бром, йод, минеральные соли и так далее. При том что ценность извлекаемого лития значительно ниже, чем суммарная ценность всех этих попутных компонентов».
По мнению Вадима Тарасова, проблема может возникнуть с организацией добычи лития из подземных рассолов и его переработкой в российском климате, далеком от чилийского. Нефтяные скважины расположены на большом расстоянии друг от друга, а растворы нужно перекачивать в места, где будет проходить их концентрирование. На месте перерабатывать их в концентрат будет достаточно сложно. В условиях Севера бывает нелегко добраться до нефти и газа, тут не до выкачивания рапы (насыщенного солевого раствора). В Читинской области этим занимаются при добыче других ценных металлов, но при этом трубы, по которым перекачивается рапа, специально обогревают для доставки рассолов в места их концентрирования.
Тем не менее нефтяники пробуют заниматься литием. «Татнефть» в сентябре сообщила, что испытала технологию извлечения металлов (в том числе лития) из попутно добываемых пластовых вод, разработанную в институте ТатНИПИнефть.
Правительство Иркутской области готово через год начать производство лития из рассолов — здесь планируют добывать литий, перерабатывать и обогащать его на Ангарском электролизном химическом комбинате (входит в структуру «Росатома»). Технологии переработки лития предоставит иркутская компания «Брайнсиб». Как говорит Евгений Балашов, зампредседателя правительства Иркутской области, в регионе самая высокая концентрация лития в рапе. «Иркутская нефтяная компания уже получила первый килограмм лития», — говорит Евгений Балашов. По его словам, иркутским продуктом можно покрыть потребности «Росатома» в сульфате лития (это около пяти тысяч тонн), а также российского рынка в батарейном литии (около двух тысяч тонн). Иркутская область планирует выходить и на внешние рынки.
По мнению Льва Третьякова, на освоение технологии добычи лития из подземных вод уйдет не менее четырех-пяти лет. «Потребность в инвестициях и сроки реализации подобных проектов в разы больше, чем для добычи рудных минералов, содержащих литий. Однако при сохранении текущего уровня цен и росте рынка литиевой продукции такие проекты могут быть окупаемы», — утверждает эксперт.
Кроме необкатанности такой технологии в промышленном масштабе в этой области есть и юридические сложности. Отсутствует ясный юридический механизм регулирования добычи рассолов из газонефтяных месторождений. Этой проблемой озаботился Минпромторг, и на сентябрьском совещании говорилось о том, что нужно упростить нормативно-правовую базу, чтобы пользователи недр могли добывать полезные компоненты из подземных вод без дополнительного лицензирования.
Нужны изменения и в системе налогообложения. «Посмотрев статью 342 Налогового кодекса, мы увидим, что добыча таких вод должна подвергаться НДПИ по ставке 5,5 процента. Поэтому было бы целесообразно обнулить ставку НДПИ», — считает промышленный эксперт Леонид Хазанов.
И наконец, пора уже снять завесу тайны с лития. По мнению Руслана Димухамедова, пересмотр режима гостайны для месторождений лития повысит инвестиционную привлекательность литиевых проектов, облегчит использование дополнительных инструментов их финансирования и сотрудничество с зарубежными контрагентами.
Изменения в законодательстве, направленные на продвижение литиевых проектов в добыче и переработке, явно назрели, хотя и совпадает это намерение государства с периодом «охлаждения» мировых цен на литий. Но учитывая, что в России электротранспорт все громче заявляет о себе и ведущие автозаводы один за другим включают электромобили в свои производственные линейки, внутреннее потребление лития все-таки имеет шансы на рост.
Иодид лития — Википедия
| Иодид лития | |
|---|---|
 ( ({{{картинка малая}}}) | |
| Общие | |
| Систематическое наименование | иодид лития |
| Хим. формула | LiI |
| Физические свойства | |
| Состояние | белое кристаллическое твердое |
| Молярная масса | 133,85 г/моль |
| Плотность | безводный — 4,076 г/см3 тригидрат — 3,494 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 459 °C |
| • кипения | 1171 °C |
| Энтальпия | |
| • образования | 270,377 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 151[1] |
| • в воде (при 100 °C) | 433[1] |
| • в метаноле | 343 г/100 мл |
| • в ацетоне | 42,6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10377-51-2 17023-24-4 (моногидрат) 17023-25-5 (дигидрат) 7790-22-9 (тригидрат) |
| PubChem | 66321 |
| Рег. номер EINECS | 233-822-5 |
| SMILES | [Li+].[I-] |
| InChI | 1S/HI.Li/h2H;/q;+1/p-1HSZCZNFXUDYRKD-UHFFFAOYSA-M |
| ChemSpider | 59699 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Иодид лития или LiI — это химическое соединение лития и иода. На воздухе оно желтеет, так как иодид окисляется до иода.[2]
Содержание
- 1 Получение
- 2 Применение
- 3 Примечания
- 4 Ссылки
Иодид лития можно получить путём взаимодействия лития с иодом:
2Li + I2 → 2LiI
Взаимодействием лития с йодоводородом
2Li + 2HI → 2LiI + H2↑
а также в результате реакции гидроксида лития с йодоводородом:
LiOH + HI → LiI + H2O
Эта соль используется как электролит в высокотемпературных батареях, а также в долгоживущих батареях, к примеру, в электрокардиостимуляторах. Ещё используется как люминофор для обнаружения нейтронов.[3].
Монокристаллы, активированные европием или оловом применяют в качестве сцинтилляторов в ядерной физике.
- ↑ 1 2 Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ A PDF file from ESPICorp Inc., a supplier of lithium iodide (неопр.) (PDF) (недоступная ссылка). Дата обращения 16 сентября 2005. Архивировано 11 ноября 2006 года.
- ↑ Some lithium iodide phosphors for slow neutron detection, K. P. Nicholson et al. Br. J. Appl. Phys. 6 104-106 (1955) DOI:10.1088/0508-3443/6/3/311
- Webelements – Lithium Iodide (неопр.).
- Composition of LITHIUM IODIDE — NIST (неопр.). Архивировано 10 апреля 2012 года.
 | Это заготовка статьи по химии. Вы можете помочь проекту, дополнив её. |
Литий-серный аккумулятор — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 февраля 2019; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 февраля 2019; проверки требуют 3 правки.| Литий-серный аккумулятор | |
|---|---|
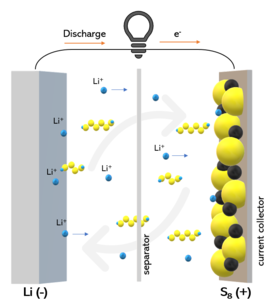 Схематический рисунок ЛСА в ходе разряда | |
| Удельная энергоёмкость | 250-500 Вт/ч/кг |
| Долговечность (циклы) | >1000 |
| Электродвижущая сила | 1,7-2,5 В |
Литий-серный аккумулятор (сокращённо — Li-S, ЛСА) — вторичный химический источник тока, в котором катод жидкий с содержанием серы отделён от электролита специальной мембраной.
- Теоретическая удельная энергоёмкость: до 2600[1]Вт·ч/кг (до 9360 кДж/кг)
- Удельная энергоёмкость: 250–500 Вт·ч/кг (900-1800 кДж/кг)
- Удельная энергоплотность: 218[2] Вт·ч/дм3 (785 кДж/дм3)
- Удельная плотность конструкции: н/д кг/дм3
- Количество циклов заряд-разряд до потери 20% ёмкости: 1000[3] (1500 без потерь ёмкости, при токах 0,05-1 С[4])
- Срок хранения: н/д лет
- Саморазряд при комнатной температуре: н/д % в месяц
- Напряжение: 2.1[2][5]В; 1,7-2,5[4] В
- Удельная мощность: н/д Вт/кг (при разряде током н/д С)
- Диапазон рабочих температур: от -40°C[1]
- КПД: н/д %
- Стоимость: достижима менее $100/кВт·ч[4] (10 Вт⋅ч/$)
Аккумулятор сделан многослойным, между анодом и катодом расположены анодные и катодные мембраны и слой электролита. Конструкция такого аккумулятора схожа с литий-ионными аккумуляторами, однако, в отличие от него, литий-серный аккумулятор использует вместе с литиевым анодом серосодержащий катод, за счёт чего увеличивается его удельная зарядовая ёмкость. Другая особенность Li-S — возможность использовать жидкий катод, увеличивая таким образом плотность тока через него[5].
Электро-химическая реакция[править | править код]
Реакция литий-серного аккумулятора совпадает с реакцией натрий-серного аккумулятора, только в данном случае роль натрия выполняет литий[6]:
- Разряд
- S8 → Li2S8 → Li2S6 → Li2S4 → Li2S3
- Заряд
- Li2S → Li2S2 → Li2S3 → Li2S4 → Li2S6 → Li2S8 → S8
Примечательна удельная энергоёмкость литий-серных аккумуляторов, составляющая уже у первых образцов до 300 Вт·ч/кг[5]. К другим достоинствам литий-серного аккумулятора можно отнести отсутствие необходимости использовать компоненты защиты, низкая себестоимость, широкий диапазон рабочих температур и общую экологическую безопасность[1].
К недостаткам литий-серного аккумулятора следует отнести очень короткое время жизни (всего 50-60 циклов заряд-разряд)[2]. Однако, последние образцы имеют долговечность 1000 и более циклов[7][8][3][4].
Разработка[править | править код]
Первые образцы подобных аккумуляторов были разработаны в 2004 году компанией Sion Power из США.
В 2006 эта компания представила опытный образец аккумулятора размером 11×35×55 мм и ёмкостью 2,2 А⋅ч при напряжении 2,1 В
В результате исследований, команде ученых из Стэнфорда удалось стабилизировать время жизни на уровне 100 циклов заряд-разряда, при падении ёмкости на 10-20% от изначальной. Однако примененный учеными способ (добавление полиэтиленгликоля, полуокисленного графена и микрочастиц сажи) приводит к очень высокому разбросу показателей катодов — лучшие из них теряют 10% ёмкости, худшие — 25%[10].
В 2013-м году учёными из Лаборатории Беркли(США) достигнута энергоёмкость 500 Вт·ч/кг и около 250 Вт·ч/кг при заряде/разряде токами 0,05 и 1 C соответственно; долговечность при этом составила не менее 1500 циклов заряда-разряда без потери ёмкости
Использование[править | править код]
Именно такой тип аккумуляторов использовался в августе 2008 года при рекордно высоком и продолжительном полёте на самолёте на солнечных батареях[11].
- ↑ 1 2 3 Перспективные источники тока.
- ↑ 1 2 3 4 Построен новый тип сверхъёмкого литиевого аккумулятора. 20.03.2006
- ↑ 1 2 Li-S battery company OXIS Energy reports 300 Wh/kg and 25 Ah cell, predicting 33 Ah by mid-2015, 500 Wh/kg by end of 2018. 12.11.2014
- ↑ 1 2 3 4 5 New lithium/sulfur battery doubles energy density of lithium-ion. 01.12.2013
- ↑ 1 2 3 Литий-серные аккумуляторы для портативных устройств (неопр.) (недоступная ссылка). Дата обращения 2 августа 2010. Архивировано 24 мая 2012 года.
- ↑ Tudron, F.B., Akridge, J.R., and Puglisi, V.J. (2004): Lithium-Sulfur Rechargeable Batteries: Characteristics, State of Development, and Applicability to Powering Portable Electronics Архивная копия от 14 июля 2011 на Wayback Machine
- ↑ World-Record Battery Performance Achieved With Egg-Like Nanostructures. 08.01.2013
- ↑ Sulphur-TiO2 yolk-shell nanoarchitecture with internal void space for long-cycle lithium-sulphur batteries. Январь 2013
- ↑ Разработан самый емкий на сегодня аккумулятор
- ↑ Графен повысил живучесть ультраёмких батарей. 14.07.2011
- ↑ BBS News: «Solar plane makes record flight» (англ.)
Фторид лития — Википедия
Материал из Википедии — свободной энциклопедии
| Фторид лития | |
|---|---|
 ( ({{{картинка3D}}}) | |
| Систематическое наименование | Фторид лития |
| Традиционные названия | Фтористый литий |
| Хим. формула | LiF |
| Молярная масса | 25,94 г/моль |
| Плотность | 2,640[1] |
| Температура | |
| • плавления | 848,2[1] |
| • кипения | 1673[1] °C |
| Уд. теплоёмк. | 1562 Дж/(кг·К) |
| Теплопроводность | 4,01 Вт/(м·K) |
| Энтальпия | |
| • образования | −616,0[1] кДж/моль |
| Удельная теплота испарения | 5,67⋅106 Дж/кг |
| Удельная теплота плавления | 1,044⋅106 Дж/кг |
| Коэфф. тепл. расширения | 37×10−6 |
| Растворимость | |
| • в воде | 0,13425[1] |
| Диапазон прозрачности | 120—6000 нм |
| Показатель преломления | 1,77 (112,7 нм), 1,3978 (420 нм), 1,3915 (620 нм) 1,2912 (6200 нм)[1] |
| Дипольный момент | 6,3274(2)[1] |
| Рег. номер CAS | 7789-24-4 |
| PubChem | 224478 |
| Рег. номер EINECS | 232-152-0 |
| SMILES | |
| InChI | |
| RTECS | OJ6125000 |
| ChemSpider | 23007 |
| Пиктограммы ECB |  |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Фтори́д ли́тия, фто́ристый ли́тий — бинарное химическое соединение лития и фтора с формулой LiF, литиевая соль плавиковой кислоты. При нормальных условиях — белый порошок или прозрачный бесцветный кристалл, негигроскопичный, почти не растворим в воде. Растворяется в азотной и плавиковой кислоте.
- Используя плохую растворимость фторида лития, его легко получить обменными реакциями:
- LiCl+Nh5F → LiF↓+Nh5Cl{\displaystyle {\mathsf {LiCl+NH_{4}F\ {\xrightarrow {\ }}\ LiF\downarrow +NH_{4}Cl}}}
- LiOH+HF → LiF↓+h3O{\displaystyle {\mathsf {LiOH+HF\ {\xrightarrow {\ }}\ LiF\downarrow +H_{2}O}}}
Фторид лития встречается в природе в виде крайне редкого минерала грайсита[2].
Фторид лития при нормальных условиях представляет собой белый порошок или прозрачные бесцветные кристаллы кубической сингонии, пространственная группа F m3m, параметры ячейки a = 0,40279 нм, Z = 4.
Плохо растворяется в воде (0,120 г/100 мл при 0 °C[1]), при повышении температуры растворимость несколько повышается (0,134 г/100 мл при 25 °C[1]; 0,1357 г/100 мл при 35 °C). Произведение растворимости Ksp = 1,84⋅10−3 (при 25 °С)[1].
Плавится при 848,2 °C[1]; плотность расплава 1,81 г/см3[1], коэффициент объёмного расширения жидкого LiF составляет 4,90⋅10−4 К−1·г/см3[1].
Теплопроводность при стандартных условиях 4,01 Вт/(м·K), при гелиевой температуре (4,2 К) 620 Вт/(м·K), при 20 К 1800 Вт/(м·K), при повышении температуры до азотной (77 К) теплопроводность снижается до 150 Вт/(м·K)[1].
Фторид лития диамагнитен, его молярная магнитная восприимчивость равна −10,1⋅10−6 см3/моль[1]. Относительная диэлектрическая проницаемость составляет 9,00 (при комнатной температуре, в диапазоне 102—107 Гц)[1].
Межъядерное расстояние в молекуле LiF составляет 1,5639 нм (в газовой фазе)[1], коэффициент упругости связи 2,50 Н/см[1]. Электрическая поляризуемость молекулы равна 10,8⋅10−24 см3[1].
- LiF+HF → LiHF2{\displaystyle {\mathsf {LiF+HF\ {\xrightarrow {\ }}\ LiHF_{2}}}}
- Растворяется в концентрированных сильных кислотах:
- LiF+h3SO4 → LiHSO4+HF↑{\displaystyle {\mathsf {LiF+H_{2}SO_{4}\ {\xrightarrow {\ }}\ LiHSO_{4}+HF\uparrow }}}
- LiF+HNO3 → LiNO3+HF↑{\displaystyle {\mathsf {LiF+HNO_{3}\ {\xrightarrow {\ }}\ LiNO_{3}+HF\uparrow }}}
- Реагирует с оксидами и гидроксидами щелочноземельных металлов:
- 2 LiF+CaO →600oC Li2O+CaF2{\displaystyle {\mathsf {2\ LiF+CaO\ {\xrightarrow {600^{o}C}}\ Li_{2}O+CaF_{2}}}}
- 2 LiF+Ca(OH)2 → 2 LiOH+CaF2↓{\displaystyle {\mathsf {2\ LiF+Ca(OH)_{2}\ {\xrightarrow {\ }}\ 2\ LiOH+CaF_{2}\downarrow }}}
Фторид лития обладает очень высокой прозрачностью от ультрафиолетовой до инфракрасной области спектра (0,12…6 мкм)[3], поэтому он используется в ультрафиолетовой (в том числе в области вакуумного ультрафиолета, где его прозрачность превосходит все прочие оптические материалы) и инфракрасной оптике. Кроме того, он используется для измерения доз облучения методом термолюминесцентной дозиметрии. Монокристаллы фторида лития используются для рентгеновских монохроматоров и для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски. Лазер F−
2:LiF даёт инфракрасное излучение с длиной волны 1120 нм.
Проявляет слабые сцинтилляционные свойства. Диэлектрик; характеризуется высоким удельным электрическим сопротивлением вследствие большой ширины запрещённой зоны.
Монокристалл фторида лития в стакане водыВысокая теплота плавления (1044 кДж/кг) позволяет использовать фторид лития как материал для хранения тепловой энергии[4]. При плавлении увеличивает свой объём на 22 %. Жидкий фторид лития вызывает быструю коррозию металлов.
Фторид лития-7 применяют для растворения соединений урана и тория в ядерных жидкосолевых реакторах.
- Фторид лития токсичен. Среднесуточная ПДК в воздухе 1 мг/м³. Пероральная летальная доза для морских свинок 200 мг/кг, для крыс 143 мг/кг[5].
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.

