Литиевый элемент питания — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 марта 2018; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 марта 2018; проверки требуют 7 правок. Литиевый (Li/FeS2) гальванический элемент формфактора АА, 1,5 В[1] Литиевые гальванические элементы формфактора CR123A, 3 В
Миниатюрный литиевый гальванический элемент ДМЛ-120 (МЛ2325, аналог CR2325)
Литиевый (Li/FeS2) гальванический элемент формфактора АА, 1,5 В[1] Литиевые гальванические элементы формфактора CR123A, 3 В
Миниатюрный литиевый гальванический элемент ДМЛ-120 (МЛ2325, аналог CR2325)  Устройство миниатюрного литиевого элемента CR2032
Устройство миниатюрного литиевого элемента CR2032Литиевый элемент — одиночный неперезаряжаемый гальванический элемент, в котором в качестве анода используется литий или его соединения. Катод и электролит литиевого элемента может иметь много видов, поэтому термин «литиевый элемент» объединяет группу элементов с одинаковым материалом анода. Отличается от других элементов питания высокой продолжительностью работы и высокой стоимостью. В зависимости от выбранного типоразмера и используемых химических материалов, литиевый элемент питания может производить напряжение от 1,5 В (совместим с щелочными элементами) до 3,7 В. Литиевые элементы питания широко распространены в современной портативной электронной технике.
К достоинствам литиевых элементов можно отнести[2]:
- меньшую, чем у серебра и ртути, дефицитность;
- возможность выполнения особо плоских элементов (толщиной 1-1,5 мм), позволяющих производить особо плоские устройства, такие как наручные часы;
- возможность получения различных рабочих напряжений (1,5: 2,8; 3 и 3,5 В), что невозможно реализовать в других видах гальванических элементов;
- исключительно малые токи саморазряда и высокая степень герметичности, что позволяет хранить литиевые элементы до начала эксплуатации 5-7 лет без нарушения герметичности;
- возможность хранения и работы в широком диапазоне отрицательных и положительных температур.
В качестве катода в литиевом элементе могут использоваться:
и другие
Литиевые элементы нашли применение в устройствах, предъявляющих высокие требования к элементам питания на протяжении длительного срока службы, таким как электрокардиостимулятор и другие имплантируемые медицинские устройства. Такие устройства могут работать автономно до 15 лет. Применение литиевых элементов в устройствах с небольшим сроком службы не всегда оправдано. Так, литиевый элемент может прослужить дольше, чем детская игрушка, для которой он был приобретен. Диапазон применения литиевых элементов практически аналогичен применению щелочных элементов — это большое количество различных устройств, таких как часы или фотокамера.
Типоразмеры[править | править код]
Небольшие («таблеточные») литиевые элементы часто используются в портативных электронных устройствах с малым энергопотреблением (часы, калькуляторы), а также в компьютерах для питания энергозависимой памяти CMOS и часов.
Литиевые батарейки


Литиевые батарейки используются во многих современных устройствах. Это компьютерная и фототехника, материнские платы и т. п. На сегодняшний день можно встретить несколько видов и типоразмеров литиевых АКБ. Как и другие типы аккумуляторов, литиевые имеют свои плюсы и минусы. Подробно о них будет сказано в статье ниже. Сейчас достаточно сказать, что их преимущества позволили широко распространиться этим батареям в различной потребительской электронике. Они заняли некоторые ниши на рынке, которые раньше занимали никель─кадмиевые и никель─металлогидридные аккумуляторы. В этом материале предлагаем поговорить о батарейках литиевого типа, их особенностях, характеристиках, разновидностях, маркировке и т. п.
Содержание статьи
Основные особенности
В своё время для создания электрохимических источников тока с большой энергетической плотностью учёным пришлось отказаться от использования в них водного электролита. Исследования велись в разных направлениях, но самыми успешными стали литиевые батарейки с твёрдым и органическим электролитом. Разработки начались ещё в начале XX столетия, а в активную фазу они перешли в 60-е годы прошлого века. Специалисты предлагали в качестве катодных материалов MnO

Литиевые аккумуляторные элементы в некоторых нишах составляют конкуренцию АКБ, использующими водный электролит. Производители различной электроники используют литиевые АКБ в тех случаях, когда необходимо постоянное рабочее напряжение и стабильная работа в течение долгого времени. Среди Li батареек можно встретить модели, которые способны отдавать высокий разрядный ток. Но это, скорее, исключение. В основном литиевые аккумуляторы применяются там, где требуются низкие и средние разрядные токи.
Одно из основных требований безопасности к литиевому типу батареек – это надёжная герметизация. Нужно полностью исключить вероятность утечки электролита и попадания в аккумулятор элементов из окружающей среды. Разгерметизация может привести к возгоранию из-за высокой активности лития. Даже если этого не произойдёт, разгерметизированная батарейка непригодна для дальнейшего использования. Производство таких АКБ ведётся в помещения с контролем влажности и в герметичных боксах с аргоновой атмосферой.
Форма литиевых аккумуляторных элементов может быть дисковой, цилиндрической, призматической. Размеры в большинстве случаев соответствуют габаритам прочих электрохимических источников тока. В связи с этим нужно обращать внимание на рабочее напряжение, которое у литиевых батареек, как правило, выше остальных типов АКБ. Чтобы исключить путаницу, некоторые производители оснащают литиевые элементы нестандартными выводами для подключения.
В таблице ниже можно посмотреть параметры различных литиевых аккумуляторных элементов.
| Характеристики аккумуляторных батарей | Li/MnO2 | Li/SO2 | Li/SOCl2 | Li/CFx | Li/CuO | Li/I2 |
|---|---|---|---|---|---|---|
| Характеристики аккумуляторных батарей | Li/MnO2 | Li/SO2 | Li/SOCl2 | Li/CFx | Li/CuO | Li/I2 |
| Рабочее напряжение, В | 3,0 | 2,6-2,9 | 3,3-3,5 | — | 1,2-1,5 | — |
| Конечное напряжение, В | 2,0 | 2,2 | 2,2 | 2,0 | 0,9-1,0 | 2,2 |
| Напряжение разомкнутой цепи, В | 3,5 | 3,0 | 3,67 | 3,3 | 1,6 | 2,8 |
| Весовая удельная энергия, Втч/кг | до 250 | до 600 | 250 | 300 | — | |
| Объёмная удельная энергия, Втч/кг | 500 | 500-560 | до 1100 | 600 | 600 | до 1000 |
| Диапазон рабочих температур, С | от -20 до +55 | от -60 до +70 | от -50 до +70(до +130) | от -20 до +60 | от -10 до +70 | от -10 до +60 |
| Саморазряд, процентов в год | 2-2,5 | 1-2 | 1,5-2 | 1-2 | 1-2 | 1 |
В следующем разделе они рассматриваются подробнее.
Вернуться к содержанию
Электрохимические системы литиевых АКБ
Батареи на основе Li/MnO2 (литий/диоксид марганца)
Этот тип элементов с литием был разработан одним из первых. При обозначении литиевых батарей в маркировке используются символы «CR».

Литиевая батарейка Li/MnO2
Внутри этой электрохимической системы протекает следующая реакция:
Li + Mn + 4O2 → Mn + 3O2 (Li+)
Согласно реакции, диоксид марганца при взаимодействии с литием восстанавливается до трехвалентного состояния из четырёхвалентного. При этом ионы лития внедряются в кристаллическую решётку оксида. В качестве электролита в этих системах используется перхлорат лития, который находится в органическом растворителе. Напряжение разомкнутой цепи аккумуляторной батарейки литий/диоксид марганца составляет 3,5, а номинал 3 вольта. Конечное напряжение равно 2 вольта.
Этот тип батареек часто можно встретить в материнских платах и часах в дисковом форм-факторе («таблетка»).
Дополнительно можете прочитать подробную статью про литий-ионные аккумуляторы.
Вернуться к содержанию
Аккумуляторы на базе Li/CuO (литий/оксид меди)
Li/CuO батареи имеют рабочее напряжение, которое сопоставимо с марганцево-цинковыми элементами щелочного типа. При этом энергетическая плотность у литиевых в три раза больше.
2Li + CuO → Li2O + Cu
CuO → Cu2O → Cu
Интервал рабочего напряжения составляет от 1,2 до 1,5 вольта и зависит разрядного тока. На разомкнутой АКБ напряжение равно 2,5 вольта. Аккумуляторные элементы литий/оксид меди сохраняют работоспособность при температурах от -10 до +70 градусов Цельсия. Батареи хранятся до 10 лет (при 20 градусах по Цельсию). Источники тока на основе Li/CuO мало распространены на рынке.
АКБ на основе Li/SO2 (литий/диоксид серы)
Разновидность батарей на основе литий/диоксид серы имеет жидкофазный материал катода. Эти АКБ достаточно хорошо изучены и широко применяются в народном хозяйстве. Роль катода в их случае выполняет графит с сажей плюс пластификатор. Смесь этих элементов наносится на металл. В качестве электролита использует диоксид серы SO2 с некоторыми добавками. Объёмная доля самого оксида серы составляет 70─75 процентов. Дополнительные добавки в электролите обеспечивают требуемую электропроводность.

Литиевая батарейка Li/SO2
В аккумуляторном элементе литий/диоксид серы при разряде протекает следующая электрохимическая реакция:
2Li + 2SO2 → Li2S2O4
Напряжение при разомкнутой цепи составляет 3 вольта, рабочее от 2,6 до 2,9. Рабочая температура составляет от -60 до +70 градусов Цельсия. К плюсам Li/SO2 стоит отнести высокую удельную мощность. Среди недостатков батареек литий/диоксид серы специалисты отмечают серьёзное внутреннее давление, а также сильный разогрев в случае короткого замыкания. По этой причине, конструкция таких аккумуляторов включает предохранитель для сброса избыточного давления. Он срабатывает при нагреве батарейки до 100 градусов по Цельсию.
Аккумуляторные элементы этого типа выпускаются цилиндрической конструкции. Она подразумевает наличие литиевого анода по периферии и угольного катода в центре. Такая сборка обеспечивает высокие электрические характеристики АКБ. Храниться аккумуляторы Li/SO2 могут до десяти лет при саморазряде 1─2 процента в год (данные при 20 Цельсия).
Вернуться к содержанию
Батарейки на базе Li/I2 (литий/йод)
В этих аккумуляторных элементах жидкий электролит отсутствует, как и сепаратор.
Внутри батареек Li/I2 идёт следующая реакция:
2Li + I2 → 2LiI
Катод с содержанием йода взаимодействует с литием, в результате чего образуется йодид лития LiI. Это твёрдое вещество, которое одновременно выступает в роли электролита и сепаратора, разделяя активные вещества.
Напряжение разомкнутой цепи Li/I2 батарейки равно 2,8 вольта. Его величина зависит от сопротивления слоя LiI. Это вещество накапливается в пространстве между электродами. Этот процесс сопровождается линейным снижением напряжения до 2,2 вольта. Причём оно резко падает, когда запас I подходит к концу.
Аккумуляторы этого типа могут храниться от 10 до 15 лет при величине саморазряде 10 процентов за всё это время. Процесс саморазряд в этом случае обусловлен взаимодействием йода и лития. Это происходит в результате диффузия I через слой LiI. Величина саморазряда во многом определяется толщиной этого слоя. Этим объясняется активное прохождение саморазряда в самом начале хранения.
Литиевые батарейки литий/йод не выделяют газ в процессе работы. Поэтому объём АКБ сохраняется постоянным в процесс эксплуатации. Кроме того, они довольно устойчивы к нарушениям правил использования. Эти батарейки нашли применение в тех областях, где требуется высокая надёжность работы. В частности, это аккумуляторы для питания кардиостимуляторов в медицине. Работоспособность АКБ литий/йод сохраняется при температурах от -10 до +60 по Цельсию.
Вернуться к содержанию
Аккумуляторные батарейки Li/FeS2 (литий/дисульфид железа)
Эти элементы стоят довольно дорого, но благодаря некоторым преимуществам, они востребованы на рынке.

Литиевая батарейка Li/FeS2
При разряде в аккумуляторах Li/FeS2 протекает следующая реакция:
4Li + FeS2 → 2Li2S + Fe
Интересной особенностью является сохранение работоспособности системы Li/FeS2 при -40 по Цельсию. Это по силам только батареям с катодами в жидком виде. Батарейки Li/FeS2 имеют стабильные характеристики при работе с потребителями, требующими большой мощности.
Аккумуляторы литий/дисульфид железа имеют в своей конструкции защиту по току. При непрерывном потреблении она составляет 2 ампер (форм-фактор АА). Кроме того, есть предохранитель, отключающий нагрузку при температуре элемента 85─95 градусов Цельсия. Если батарейка разогревается до 130─160 градусов, то открывается клапан для сброса давления.
Вернуться к содержанию
Аккумуляторные элементы литий/полифторуглерод
Стоимость этих батареек выше Li/MnO2. Но они имеют более широкий диапазон рабочих температур. По этой причине они применяются в различных устройствах, испытывающих нагрев в процессе работы.
Реакция внутри этих аккумуляторов описывается следующим уравнением:
nLi + (CFx)n → nLiFx + nC
Напряжение элемента без нагрузки равно 3,2─3,3 вольта. Конечное напряжение около 2 вольт. Интервал рабочих температур от -40 до +85 градусов. При хранении в течение 10 лет эти батарейки теряют примерно 1/5 от номинальной ёмкости.
Первые коммерческие образцы батареек литий/полифторуглерод были выпущены 25─30 лет назад. Главное применение они находят в различной портативной электронике. При отрицательных температурах и высоком разрядном токе они проигрывают по показателям аккумуляторам типа Li/MnO2. По сравнению с Li/I2 аккумуляторные элементы Li/CFx имеют более высокую мощность. Поэтому их также используют в медицинских кардиостимуляторах и дефибрилляторах.
Вернуться к содержанию
Аккумуляторные батарейки Li/SOCl2 (литий/тионилхлорид)
Эти аккумуляторные системы имеют жидкофазный катод и самые высокие удельные электрические параметры среди литиевых батареек.

Литиевая батарейка Li/SOCl2
В них протекает следующая реакция:
4Li + 2SOCl2 → 4LiCl + SO2 + S
Существенная доля SO2 растворяется в электролите без изменения давления в корпусе батарейки. Напряжение без нагрузки равно 3,67, при работе 3,3─3,5 вольта. На величину напряжения сильно влияет разрядный ток.
Рабочая температура составляет от -60 до +85─130 градусов Цельсия. По конструкции аккумуляторные батарейки Li/SOCl2 близки к Li/SO2. Электролит тионилхлорид – это агрессивное вещество. Поэтому конструкция батарей разрабатывалась с учётом повышенных требований к пожарной и взрывобезопасности. Аккумуляторы литий/тионилхлорид хранятся до десяти лет. Саморазряд при этом составляет до 2 процентов в год (данные при 20 градусах Цельсия). При понижении температуры до -50 сильно падает ёмкость батарейки (в несколько раз).
Если элемент из холода перенести в тёплое место, то внутри будет продолжаться процесс разряда. За счёт того, что разлагаются промежуточные продукты реакции, может быть сильный разогрев и даже взрыв. Поэтому для обеспечения безопасности Li/SOCl2 имеют аварийный клапан для сброса давления, плавкие предохранители, термовыключатели.
Вернуться к содержанию
Размеры батареек
Как уже говорилось выше, литиевые батарейки выпускаются в соответствии с распространёнными типоразмерами. Есть, к примеру, литиевые пальчиковые батарейки. Форма элементов может быть цилиндрической, призматической и дисковой. Ниже приведена таблица с элементами питания по классификации, принятой в США.
| Название | Напряжение, В | Высота, мм | Диаметр, мм |
|---|---|---|---|
| Название | Напряжение, В | Высота, мм | Диаметр, мм |
| AAA | 1,5 | 44,5 | 10,5 |
| AA | 1,5 | 50,5 | 14,5 |
| C | 1,5 | 50,0 | 26,2 |
| D | 1,5 | 61,5 | 34,2 |
| PP3 | 9,0 | 48,5 | 26,5 |
Помимо обозначений, приведённых в таблице, есть ещё сленговые названия этих батареек:
- AAA – «мизинчиковые»;
- AA – «пальчиковые»;
- C – «дюймовочка»;
- D – «бочка»;
- PP3 – «крона».
На изображениях ниже вы можете посмотреть фотографии этих батареек.

AAA

AA

C
Кроме того, ещё существует большое количество дисковых литиевых батареек разных форм-факторов.

D

PP3
Вернуться к содержанию
Область применения
Литиевые батарейки имеют достаточно длительный срок эксплуатации в сравнении с другими видами. Чаще всего они используются в различных устройствах, которые имеют существенное потребление энергии. Ниже перечислены некоторые из них:
- Фототехника;
- Компьютеры;
- Медицинское оборудование;
- Игрушки;
- Военная промышленность;
- Авиация;
- Космическая отрасль.
Вернуться к содержанию
Маркировка
Правила маркировки батареек разрабатывает, устанавливает и контролирует организация IEC. Это международная электротехническая комиссия. Согласно их требованиям, на корпусе элемента должны быть указаны:
- Состав;
- Энергоёмкость;
- Размер;
- Класс;
- Напряжение.
На изображении ниже приведена маркировка батарейки.

Для расшифровки вам пригодятся следующие две таблицы:
Таблица буквенных обозначений различных элементов.
| Маркировка | Тип батарейки |
|---|---|
| Маркировка | Тип батарейки |
| R | Солевая |
| LR | Щелочная |
| SR | Серебряная |
| CR | Литиевая |
| PR | Воздушно-цинковая |
Маркировка типоразмера батареек.
| Типоразмер | Маркировка |
|---|---|
| Типоразмер | Маркировка |
| D | 20 |
| C | 14 |
| AA | 6 |
| AAA | 03 |
| PP3 | 6/22 |
Используя эти данные можно расшифровать маркировку батарейки на изображении. LR6 – означает, что это щелочная батарейка типоразмера AA. Номинальное напряжение составляет 1,5 вольта.
Вернуться к содержанию
Преимущества и недостатки литиевых батареек
Преимущества
- Высокая энергоёмкость;
- Стабильность характеристик при разной величине разрядного тока;
- Длительный срок эксплуатации;
- Постоянное напряжение;
- Небольшие габариты и вес;
- Достаточно широкий диапазон рабочих температур.
Вернуться к содержанию
Недостатки
- Стоимость выше, чем у остальных видов элементов;
- При нарушении правил эксплуатации и целостности могут воспламеняться.
В заключение стоит сказать пару слов о безопасности. Нужно чётко понимать, что литиевые батарейки и аккумуляторы, представляют собой разные источники тока. Если аккумулятор работает определённое количество циклов, то батарейки являются первичными источниками тока. Они предназначены для однократного использования. Не пытайтесь вскрывать литиевые батарейки и проводить какие-то мероприятия по их восстановлению. Это не АКБ и восстановлению они не подлежат. При этом на рынке есть и аккумуляторы указанных выше типоразмеров. Например, AA. Так, что будете внимательны при покупке, изучайте маркировку.
Если материал был для вас полезен, делайте репост в социальных сетях. Голосуйте в опросе ниже и оценивайте статью! Исправления и дополнения к статье оставляйте в комментариях.
Вернуться к содержанию
Литиевые батарейки — размеры, виды и другие характеристики
Мир наполнен приборами, игрушками, которые мертвы, если отсутствует источник энергии – батарейка. Гальванический элемент, преобразующий химическую энергию в электрическую, знают все. Одноразовое устройство – батарейка, с возможностью цикличной зарядки – аккумуляторная батарейка. Литиевые источники энергии имеют высокую плотность заряда, работают дольше, выполняют те же задачи, что солевые, алкалиновые.

Устройство и состав литиевой батарейки
Здесь описываются гальванические элементы, работающие на необратимой реакции окисления. Отданный заряд не восстанавливается, батарейка называется одноразовой. Элемент состоит из анода, выполненного из металлического лития, катода из твердых MnO2, Fes2, Cuo, CFx, жидких SO2, SOCl2. Продолжается поиск других солей с высоким сродством к восстановлению. Окислителем выступает активный литий, отдающий электроны. Корпус аккумулятора герметичный, с выводами клемм и их маркировкой. Надпись «do not recharge»- повторно не заряжать, предупредит, что литиевая батарейка одноразовая.
Существует 2 типа батареек по конструкции:
- бобинные;
- спиральные.

Бобинные литиевые батарейки служат до 20 лет, применяются потребителями, не превышающими запрос в 150 мА. Срок службы элементов до 20 лет.
Спиральные конструкции имеют большую поверхность лития, импульсно дают до 4 А, при постоянном токе — 0,1-1,8 А. Но саморазряд этих устройств достигает 10 % в год от первоначальной емкости. Элементы с любым составом катода выпускают в двух типах. Литиевые батарейки могут быть круглыми, призматическими или в форме таблеток.

Крупными и признанными производителями литиевых батареек считают EVE, Minamoto, SAFT, Robiton, Varta, Tekcell. Небольшие производства есть в Китае.
Свойства литиевых батареек с разными анодными парами
В зависимости от химического состава катода в связке с металлическим литием, меняется емкость и напряжение на клеммах элемента, их саморазряд и способность работать в диапазоне температур.
- Li/MnO2 — батарейка литиевая маркируется как «CR». Электролитом является перхлорат лития. Номинальное напряжение 3 В, саморазряд 2,5 % за год, срок годности до 10 лет. Температура рабочей среды -20 +55 0 С. Форма – преобладает таблетка.
- Li/CuO, по рабочему напряжению 1,2-1,5 В идентичны щелочным, но заряд она вмещает в 3 раза больше. Рабочий температурный интервал -10 +70. Срок службы 10 лет.
- Li/SO2 — одни из самых распространенных видов литиевых батареек. Катод представляет пластификатор с графитом и сажей. Электролитом служит диоксид жидкий с компонентами для электропроводности. Рабочее напряжение 2,6-2,9 В. В конструкции не смогли избежать повышения давления в корпусе и сильный разогрев при КЗ, пришлось ставить предохранитель давления. Литиевые батарейки хорошо работают на морозе до -60 0 и в жару +70 0, сохраняют заряд до 10 лет.
- Li/I2 — тип батарейки без электролита. Химическая реакция 2Li+I2 >2LiI происходит в твердом составе, диффузией. Полученная соль тоже твердая, выступает в роли сепаратора. Работает батарейка до 15 лет, надежны, используются в кардиостимуляторах.
- Li/FeS2 – лучшие литиевые батарейки, востребованы, несмотря на высокую цену. Такие элементы работают с устройствами большой мощности, имеют защиту по току, предохранитель, срабатывающий на 85-90 0 и клапан сброса давления. Чаще используются в форм-факторе АА.
- Li/CFx – разновидность литиевых батареек, работающих при высокой температуре, до +85 0. За 10 лет на саморазряд уходит 20 % емкости. Используются в дефибрилляторах, кардиостимуляторах и портативной электронике.
- Li/SOCl2 – самая энергоемкая литиевые батарейки. Напряжение без нагрузки больше, чем 3,6 В. При работе поддерживается 3,3- 3,5 В. В качестве электролита применен тионилхлорид, агрессивный компонент. Верхний предел работоспособности +(85-130) 0 С. Нижний – минус 60, но при сильно упавшей емкости элемента. Предусмотрена защита от взрыва в виде термовыключателя, плавких предохранителей и клапана избыточного давления.

Размеры литиевых батареек
Чтобы правильно подобрать нужный источник энергии, необходимо знать его геометрические размеры и форму. Показатели стандартизированы, разберемся в типоразмерах литиевых одноразовых батареек. Используется классификация США.
| Знак | V (В) | H (мм) | D (мм) | Народное название | Маркировка типоразмера
|
| ААА | 1,5 | 44,5 | 10,5 | мизинчиковая | 03 |
| АА | 1,5 | 50,5 | 14,5 | пальчиковая | 6 |
| С | 1,5 | 50,0 | 26,2 | дюймовочка | 14 |
| D | 1,5 | 61,5 | 34,2 | бочка | 20 |
| РРЗ | 9,0 | 48,5 | 26,5 | крона | 6/22 |
Отдельные типы литиевых батареек можно посмотреть на фото.
-

- крона
-

- дюймовочка
-

- пальчиковая
При выборе литиевой батарейки важна маркировка, по ней можно определить тип элемента. Для литиевой батарейки на корпусе большими буквами будет напечатано CR, на щелочной LR, на солевой R.
Всегда ли литиевые батарейки предпочтительнее щелочных? Изделия отлично работают в любых условиях. Но всегда ли экономически выгодно покупать батарейку литиевую в 5 раз дороже, если на малом токе они превосходит алкалиновые в 1,5-2 раза? Какие лучше, решается в каждом случае, применительно к решаемым задачам.
Необходимо учесть, что запас энергии на всех типах литиевых батареек больше в несколько раз. Чтобы не перепутать устройства, производители делают Li АКБ с особыми выводами.
Литиевые батарейки ААА
Мы рассмотрим одноразовую батарейку с литиевым анодом типа ААА. Компактное устройство имеет пассивный слой на аноде, предупреждающий реакцию. Даже кратковременная подача тока разрушит слой и приведет в негодность батарейку. В отличие от солевых мизинчиковых батареек, литиевые разогреются настолько, что могут взорваться. Зарядка литиевых одноразовых батареек запрещена!

Если замкнуть плюс и минус у литиевой батарейки, она тоже может загореться. Поэтому, необходимо соблюдать следующие правила:
- провода к контактам не крепят паяльником;
- батарейку не носят в кармане, где случайно могут быть металлические мелкие предметы;
- перевозить элементы нужно в специальном чехле или футляре;
- не оставлять батарейку под прямыми лучами солнца.
Стоит ли покупать литиевую батарейку ААА, которая стоит дороже алкалиновой в 5 раз. Учитывая, что работает она в 7 раз дольше, и легче на 35 %, стоит.
Срок годности литиевых батареек
При правильном хранении, литиевые батарейки АА будут безотказно работать, если их подключить в течение 10 лет. Зачастую, тог саморазряда составляет 2 % в год при хранении в комнатных условиях, t = 20 0 С.
Дату выпуска и срок годности можно найти на корпусе в виде буквенно-цифрового кода. Зашифровано по разному, только в цифрах, 5 знаков означает число, месяц и год (40615), а код 9А14 следует читать 9 января 2014 года. Срок годности вынесен отдельно. Срок годности действителен, если батарейка находится в упаковке и ею никогда не пользовались.

Литиевые или алкалиновые батарейки, какие лучше
Алкалиновые и щелочные батарейки одно и то же. Воспользуемся тестированием специалистами Росконтроля, пальчиковых ААА батареек и сравним их с литиевыми. Так как идеальных элементов на случаи импульсной и постоянной умеренной и слабой нагрузки нет, предлагается определить, где предпочтительнее использовать щелочные, а где литиевые батарейки и какие лучше.
Результаты исследований показали, что для импульсных токовых нагрузок с высокой мощностью лучше купить литиевую батарейку – прослужит столько же, что 3 щелочных, но весит она намного меньше, чем аварийный запас из нескольких другого вида.
В пультах и часах, в детских игрушках оптимально использовать алкалиновые аккумуляторы, по стоимости выгоднее. Малые токи быстро истощают заряд литиевой батарейки, и проработает она почти столько же, что и щелочная.
Можно ли заряжать литиевые батарейки

Одноразовые литиевые батарейки заряжать нельзя! аккумуляторные батарейки используют со специальным зарядным устройством. Они могут выдержать до 1000 перезарядов, существенно сэкономив бюджет на покупку одноразовых элементов.
Как определить, что перед вами, аккумулятор или одноразовая батарейка? Сведения перед глазами. На аккумуляторе указывается емкость в mAh, на литиевой батарейке такой информации нет. Намекнет на аккумулятор цена, она высокая. На изделии обязательно найдется маркировка «rechargeable» — перезаряжаемая.
Если вы профессионально работаете с фотовспышкой и другой мощной аппаратурой, купите плоскую полимерную или цилиндрическую заряжаемую литиевую батарейку. Это выгоднее, чем приобретать в большом количестве одноразовые элементы.
Зарядное устройство для литиевых батареек

Не всяким устройством можно заряжать литиевые батарейки. Лучше купить специальное, которое само ведет 2 этапа зарядки, выводит на дисплей текущие показатели и во время отключит аккумулятор от питания. Как заряжать литиевую батарейку, если она полимерная? Различий нет, принцип действия у них один. Стоит такой зарядник недорого, около 20$, хорошо, если функция измерения емкости в наличии.
Любой зарядник должен преобразовать, стабилизировать сетевое напряжение, воздавая на выходе 5 В. Сила тока регулируемая 0,5 -1,0* С. С – емкость батареи в А-ч, МА-ч, в цифровом выражении. Зарядка предусмотрена по ускоренной схеме, до 80 % от емкости и по полной схеме, в 2 этапа, примерно около 3 часов. После полного набора энергии зарядник отключается.

Видео
Все разнообразие литиевых современных источников энергии и о том, как заряжать литиевую батарейку представлено на видео.
особенности этого типа элементов питания

 Современный мир насыщен разнообразными гаджетами, игрушками и приборами, которые требуют для работы элементы питания в виде гальванических батареек либо аккумуляторов. Различные брендовые компании предлагают широкий ассортимент питающих элементов. Наиболее эффективными считаются литиевые батарейки и аккумуляторы. Они отличаются повышенной стоимостью, но это с лихвой компенсируется положительными свойствами.
Современный мир насыщен разнообразными гаджетами, игрушками и приборами, которые требуют для работы элементы питания в виде гальванических батареек либо аккумуляторов. Различные брендовые компании предлагают широкий ассортимент питающих элементов. Наиболее эффективными считаются литиевые батарейки и аккумуляторы. Они отличаются повышенной стоимостью, но это с лихвой компенсируется положительными свойствами.Принцип работы литиевых элементов основан на реакции окисления, являющейся необратимой. Отрицательный вывод в элементах выполняют из оксида лития, а положительный из оксидов различных металлов. Для катода применяют оксиды железа, марганца, меди. Иногда вместо металла применяют жидкие соединения серы и хлора.
Стоит знать! В процессе реакции оксид лития отдает отрицательные частицы, тем самым протекает ток, и заряд накапливается.
Данные батареи изготавливаются с восстановлением заряда, а также одноразовые у которых в ходе реакции накопленный заряд не восстанавливается. По конструкции исполнения различают два вида гальванических элементов на основе лития- бобинные и спиральные.
Бобинные батарейки
Бобинные элементы питания на основе реакции оксида лития изготавливают призматической формы. В качестве катода применяется жидкий оксид хлора, он находится в центре и соединен со стеклянно-металлическим герметичным выводом. По кругу расположен литиевый анод, от катода разделяется угольным катализатором.
Сроком службы таких элементов производители объявляют до 20 лет. Номинальный ток батареек не превышает 150 мА.
Спиральные батарейки
Спиральные литиевые элементы питания изготавливают в виде призмы и цилиндра, а также в форме таблеток. В конструкции применяется анод из лития, отделенный от электролита угольным катализатором.
Важно! Производители для защиты от вздутия литиевой батарейки устанавливают предохранительный клапан.
Такое исполнение питающих элементов подразумевает большую активную площадь лития, тем самым заряд быстрее отдается при гальванической реакции. Самостоятельный разряд достигает 10% в год, постоянный номинальный ток имеет значение от 0,1 А до 1,8 А. При импульсе ток может достигать значение 4 А.
Свойства литиевых батареек при разных анодных парах
В зависимости от материала используемого при изготовлении катода технические характеристики литиевых батареек могут изменяться по основным параметрам. Выделяют 7 основных анодных пар:
- Li/MnO2— электролитом является соединение хлора с литием. Постоянное напряжение до 3 В, потеря заряда в течение года составляет 2,5%. Сроком годности устанавливается значение до 10 лет. Выполняется в виде таблетки и имеет маркировку «CR». Диапазон рабочих температур от -20°С до +55°С.
- Li/CuO- соединение меди позволяет сохранять больше заряда в течение срока службы. Номинальное напряжение имеет значение 1,2-1,5 В. Диапазон рабочих температур от -10°С до +70°С. Элемент питания с данной анодной парой может имеет срок годности до 10 лет.
- Li/SO2— в качестве электролита применяется диоксид серы, в котором содержатся элементы для повышения проводимости. Катод выполняется из прессованного графита с сажей. Данное исполнение является наиболее распространенным. Номинальное напряжение, вырабатываемое при реакции, составляет 2,6 В- 2,8 В. При эксплуатации возможно возникновение короткого замыкания для этого в конструкции установлен предохранитель давления. Батарейка способна работать при диапазоне температур от -60°С до +70°С, способна сохранять работоспособность в течение 10 лет.
- Li/I2— в данных элементах не применяется электролит, химическая реакция происходит при смешивании твердых материалов. Считаются самыми надежными, используются для питания в медицинских аппаратах, где необходим постоянное значение напряжения на длительный срок. Рассчитана на 15 лет работы.
- Li/FeS2— имеют завышенную стоимость, что не делает их менее распространенными. Среди потребителей считаются лучшими. Применяются в устройствах с повышенной мощностью, в конструкции есть предохранитель давления и клапан сброса, а также защита при резком увеличении значения тока. Срабатывает предохранитель при температуре от 80 °С. Изготавливаются цилиндрической формы, имеют срок службы до 10 лет.
- Li/CFx— элемент питания работает при повышенных значениях температуры до +85°С. Применяется в медицинской технике, имеет саморазряд до 20% в течение 10 лет.
- Li/SOCl2— отличается от остальных повышенной емкостью. Номинальное рабочее напряжение составляет значение без подачи нагрузки до 3,8 В, а при нагрузке 3,5В. Электролитом является химическое соединение на основе хлора, считается агрессивным. При падении рабочей температуры ниже нуля емкость начинает падать, и наоборот при повышении значение незначительно увеличивается. Максимальная температуры работоспособности +130°С. В конструкции имеется защита в виде плавкой вставки, а также клапан увеличенного давления.
Габариты и маркировки
Для работы различных приборов необходимо правильно подобрать элемент питания. Для этого следует знать такие параметры как диаметр, длину, значение напряжения и конструкцию исполнения. На элементах питания используется специальная маркировка, зная расшифровку можно легко найти нужную батарейку. Различают несколько видов маркировки:
- Литиевые батарейки ААА- значение напряжения составляет 1,5 В, длина 44,5 мм, диаметр 10,5 мм. Имеет народное название мизинчиковая.
- АА- номинальное рабочее напряжение составляет 1,5 В, имеет длину 50,5 мм и диаметр исполнения 14,5 мм. В быту называют пальчиковой.
- С- имеет рабочее значение напряжения 1,5 В, длину и диаметр 50 мм и 26,2 мм соответственно. Народное название дюймовочка.
- D- рабочее напряжение 1,5 В. Длина батарейки составляет 61,5 мм, а диаметр 34,2 мм. В народе называют бочка.
- РР3- имеет повышенное значение напряжения 9 В. Диаметр составляет 26,5 мм, а длина 48,5 мм. В быту называют крона.
Подбирая элемент питания необходимо учитывать требования к применению. Литиевые отличаются от алкалиновых батареек повышенной стоимостью.
Сроки службы литиевых элементов питания
При соблюдении всех требований по хранению батарейки способны прослужить более 10 лет. Часто бывает, что забытый элемент через несколько лет может отлично справляться с питанием различных приборов. Дата изготовления указывается на корпусе в виде шифра, состоящего из букв и цифр. Срок хранения литиевых батареек указан на упаковке, даже, если она не применялась. Маркировку контролирует всемирная электротехническая комиссия.
Области применения
Данные батарейки имеют длительный срок службы, что делает их распространенными для применения в аппаратах и приборах с увеличенной мощностью потребления. Основными устройствами, где применяются батарейки считают:
- компьютерная техника;
- оптическая и фототехника;
- оборудование, используемое в медицине;
- авиастроение;
- военная промышленность;
- космическая отрасль.
Достоинства и недостатки литиевых батарей
Как и любое электрическое оборудование батарейки на основе лития имеют плюсы и минусы в процессе применения. К достоинствам относятся:
- низкий уровень самостоятельного разряда;
- высокая емкость заряда;
- повышенное значение рабочего напряжения аккумуляторных батарей;
- можно ли зарядить литиевую батарею – да;
- высокая надежность;
- просты в применении.
К недостаткам причисляют:
- Повышенную стоимость. Сложная конструкция аккумуляторов, состоящих из батарей. Невозможность использования без контроля за показателями напряжения и тока. В качестве защиты устанавливают контроллер.
- Наступление срока службы с первого дня изготовления. С течением времени элемент теряет свои полезные свойства.
- Пагубное влияние широкого диапазона перепада температур применения.
Разница между щелочными и литиевыми элементами питания
При выборе между алкалиновыми и литиевыми батарейками следует учитывать условия, при которых они будут использоваться.
Важно помнить, что для приборов и аппаратов в которых необходимо питание повышенной мощности, а также если присутствует вероятность возникновения импульсных токов следует использовать элемент питания либо аккумуляторы на основе реакций лития. Нет необходимости приобретать взамен несколько алкалиновых.
Напротив, оборудование, где нет импульсных потреблений повышенной мощности обычно применяют щелочные элементы.
Внимание! Малые токи пагубно влияют на емкость литиевых батареек, тем самым понижая срок службы.
Заряжать или не заряжать литиевые батарейки
При покупке необходимо обратить внимание на маркировку указывающую возможность многократного перезаряда. Обычно на элементе указывается надпись «rechargeable», что значит перезаряжаемая.
Отсутствие соответствующих указаний на корпусе говорит об одноразовости батарейки. Приобретение заряжаемых элементов может значительно сэкономить затраты на покупку запаса из одноразовых.
Совет! Само восполнение заряда следует производить при помощи специальных приборов, предназначенных для этого.
В их конструкции зарядных устройств используются средства контроля и защиты. Заряд протекает в два этапа и занимает время от 3 до 8 часов.
Появление литиевых элементов значительно упростило использование переносных приборов и аппаратов с отдельным питанием. Соблюдение правил эксплуатации, хранения и перезарядки таких батареек надолго сохранит их работоспособность и срок службы.
Литий-ионный аккумулятор — Википедия
 Литий-ионный аккумулятор цилиндрический, типоразмера 18650
Литий-ионный аккумулятор сотового телефона Siemens, призматический[1]
Литий-ионный аккумулятор цилиндрический, типоразмера 18650
Литий-ионный аккумулятор сотового телефона Siemens, призматический[1]Литий-ионный аккумулятор (Li-ion) — тип электрического аккумулятора, который широко распространён в современной бытовой электронной технике и находит своё применение в качестве источника энергии в электромобилях и накопителях энергии в энергетических системах. Это самый популярный тип аккумуляторов в таких устройствах как сотовые телефоны, ноутбуки, цифровые фотоаппараты, видеокамеры и электромобили.
Основной источник: [2]Впервые принципиальная возможность создания литиевых аккумуляторов на основе способности дисульфид титана или дисульфид молибдена включать в себя ионы лития при разряде аккумулятора и экстрагировать их при зарядке была показана в 1970 году Майклом Стэнли Уиттингемом. Существенным недостатком таких аккумуляторов являлось низкое напряжение — 2,3 В и высокая пожароопасность вследствие образования дендритов металлического лития, замыкающих электроды.
Позднее Дж. Гуденафом были синтезированы другие материалы для катода литиевого аккумулятора — кобальтит лития LixCoO2(1980 год), феррофосфат лития LiFePO4 (1996 год). Преимуществом таких аккумуляторов является более высокое напряжение — около 4 В.
Современный вариант литий-ионного аккумулятора с анодом из графита и катодом из кобальтита лития изобрёл в 1991 году Акира Ёсино. Первый литий-ионный аккумулятор по его патенту выпустила корпорация Sony в 1991 году.
В настоящее время ведутся исследования по поиску материалов на основе кремния и фосфора, обеспечивающих повышенную емкость интеркалирования ионов лития и по замене ионов лития на ионы натрия.
Нобелевская премия по химии 2019 года была вручена троим перечисленным выше учёным «За создание литий-ионных батарей».
 При использовании литий-ионных аккумуляторов в составе батарей без балансирующего устройства, часть из них окажется переразряженной (B) при работе батареи или перезаряженной (C) либо не дозаряженной (D) до номинальной ёмкости во время зарядки батареи
При использовании литий-ионных аккумуляторов в составе батарей без балансирующего устройства, часть из них окажется переразряженной (B) при работе батареи или перезаряженной (C) либо не дозаряженной (D) до номинальной ёмкости во время зарядки батареиХарактеристики литий-ионных аккумуляторов зависят от химического состава составляющих компонентов и варьируются в следующих пределах:
Контроллер заряда/разряда (плата защиты) цилиндрического литий-ионного аккумулятора, конструкционно припаянный к отрицательному контакту аккумулятора и обратной фольгированной стороной выполняющий его функции. На снимке частично демонтирован и отсоединён от проводника, идущего к положительному контакту аккумулятораЧасто в корпус аккумулятора встраивают контроллер защиты (или PCM-плата (англ. Protection Circuit Module)), который отключает аккумулятор, предотвращая превышение напряжения заряда, чрезмерный разряд и превышение температуры, приводящие его к преждевременной деградации или разрушению. Также этот контроллер может опционально ограничивать ток потребления. Тем не менее, надо учитывать, что не все аккумуляторы снабжаются защитой. В целях снижения стоимости производители могут не устанавливать её. Кроме того, в устройствах в которых встроен контроллер защиты, а также в аккумуляторных батареях (к примеру ноутбуков) используются только аккумуляторы без встроенной платы защиты[6].
Литиевые аккумуляторы имеют специальные требования при подключении нескольких ячеек последовательно. Зарядные устройства для таких многосоставных аккумуляторов с ячейками или сами аккумуляторные батареи снабжаются схемой балансировки ячеек. Смысл балансировки в том, что электрические свойства ячеек могут немного отличаться, и какая-то ячейка достигнет полного заряда/разряда раньше других. При этом необходимо прекратить заряд этой ячейки, продолжая заряжать остальные, так как переразряд или перезаряд литий-ионных аккумуляторов выводит их из строя. Эту функцию выполняет специальный узел — балансир[en] (или BMS-плата (англ. Battery Management System)[7]). Он шунтирует заряженную ячейку так, чтобы ток заряда шёл мимо неё. Балансиры одновременно выполняют функцию платы защиты в отношении каждого из аккумуляторов, так и батареи в целом[8][9].
Зарядные устройства могут поддерживать конечное напряжение заряда в диапазоне 4,15—4,25В.
Кроме контроллера защиты, литий-ионные, а также литий-полимерные аккумуляторы выпускаемые в формфакторах АА и ААА с напряжением 1,5 В (не следует путать с аналогичного размера формфакторами 14500 и 10440 напряжением 3,7 В, а также с незаряжаемыми одноразовыми литиевыми элементами питания напряжением тоже 1,5 В) оборудуются встроенными электронными преобразователями напряжения. Отличие таких аккумуляторов — стабилизированное напряжение на выходе на контактах в 1,5 В независимо от рабочего напряжения самой ячейки аккумулятора и его моментальное обнуление, когда напряжение самой литиевой ячейки становится ниже допустимого (срабатывает плата защиты).
Литий-ионный аккумулятор. Схема работыЛитий-ионный аккумулятор состоит из электродов (катодного материала на алюминиевой фольге и анодного материала на медной фольге), разделённых пористым сепаратором, пропитанным электролитом. Пакет электродов помещён в герметичный корпус, катоды и аноды подсоединены к клеммам-токосъёмникам. Корпус иногда оснащают предохранительным клапаном, сбрасывающим внутреннее давление при аварийных ситуациях или нарушениях условий эксплуатации. Литий-ионные аккумуляторы различаются по типу используемого катодного материала. Переносчиком заряда в литий-ионном аккумуляторе является положительно заряженный ион лития, который имеет способность внедряться (интеркалироваться) в кристаллическую решётку других материалов (например, в графит, оксиды и соли металлов) с образованием химической связи, например: в графит с образованием LiC6, оксиды (LiMnO2) и соли (LiMnRON) металлов.
Первоначально в качестве отрицательных пластин применялся металлический литий, затем — каменноугольный кокс. В дальнейшем стал применяться графит. Применение оксидов кобальта позволяет аккумуляторам работать при значительно более низких температурах, повышает количество циклов разряда/заряда одного аккумулятора. Распространение литий-железо-фосфатных аккумуляторов обусловлено их относительно низкой стоимостью. Литий-ионные аккумуляторы применяются в комплекте с системой контроля и управления — СКУ или BMS (battery management system), — и специальным устройством заряда/разряда.
В настоящее время в массовом производстве литий-ионных аккумуляторов используются три класса катодных материалов:
- кобальтат лития LiCoO2 и твёрдые растворы на основе изоструктурного ему никелата лития
- литий-марганцевая шпинель LiMn2O4
- литий-феррофосфат LiFePO4.
Электрохимические схемы литий-ионных аккумуляторов:
- литий-кобальтовые LiCoO2 + 6C → Li1-xCoO2 + LiC6
- литий-ферро-фосфатные LiFePO4 + 6C → Li1-xFePO4 + LiC6
Благодаря низкому саморазряду и большому количеству циклов заряда/разряда, Li-ion-аккумуляторы наиболее предпочтительны для применения в альтернативной энергетике. При этом, помимо системы СКУ они укомплектовываются инверторами (преобразователи напряжения).
- Высокая энергетическая плотность (ёмкость).[источник не указан 680 дней]
- Низкий саморазряд.
- Высокий ток работы
- Не требуют обслуживания.
Широко применяемые литий-ионные аккумуляторы при перезаряде, несоблюдении условий заряда или при механическом повреждении часто бывают чрезвычайно огнеопасными.
- Огнеопасны
- Теряют работоспособность при переразряде
- Теряют ёмкость на холоде
- От 200 до 500 циклов зарядки
Взрывоопасность[править | править код]
 | Статья или раздел содержит противоречия и не может быть понята однозначно. Следует разрешить эти противоречия, используя более точные авторитетные источники или корректнее их цитируя. На странице обсуждения должны быть подробности. |

Аккумуляторы Li-ion первого поколения были подвержены взрывному эффекту. Это объяснялось тем, что в них использовался анод из металлического лития, на котором в процессе многократных циклов зарядки/разрядки возникали пространственные образования (дендриты), приводящие к замыканию электродов и, как следствие, возгоранию или взрыву. Этот недостаток удалось окончательно устранить заменой материала анода на графит. Подобные процессы происходили и на катодах литий-ионных аккумуляторов на основе оксида кобальта при нарушении условий эксплуатации (перезарядке). Литий-ферро-фосфатные аккумуляторы полностью лишены этих недостатков. Кроме того, все современные зарядные устройства для литий-ионных аккумуляторов предотвращают перезаряд и перегрев вследствие слишком интенсивного заряда.[источник не указан 559 дней]
Литиевые аккумуляторы изредка проявляют склонность к взрывному самовозгоранию.[17][18][19] Интенсивность горения даже от миниатюрных аккумуляторов такова, что может приводить к тяжким последствиям.[20] Авиакомпании и международные организации принимают меры к ограничению перевозок литиевых аккумуляторов и устройств с ними на авиатранспорте.[21][22]
Самовозгорание литиевого аккумулятора очень плохо поддается тушению традиционными средствами. В процессе термического разгона неисправного или поврежденного аккумулятора происходит не только выделение запасенной электрической энергии, но и ряд химических реакций, выделяющих вещества для поддержания горения, горючие газы от электролита[23], а также в случае не LiFePO4 электродов[24], выделяется кислород. Потому вспыхнувший аккумулятор способен гореть без доступа воздуха и для его тушения непригодны средства изоляции от атмосферного кислорода. Более того, металлический литий активно реагирует с водой с образованием горючего газа водорода, потому тушение литиевых аккумуляторов водой эффективно только для тех видов аккумуляторов, где масса литиевого электрода невелика. В целом тушение загоревшегося литиевого аккумулятора неэффективно. Целью тушения может быть лишь снижение температуры аккумулятора и предотвращение распространения пламени[25][26][27].
Эффект памяти[править | править код]
Традиционно считается, что, в отличие от Ni-Cd и Ni-MH аккумуляторов, Li-Ion аккумуляторы полностью избавлены от эффекта памяти. По результатам исследований учёных Института Пауля Шерера (Швейцария) в 2013 году этот эффект был таки обнаружен, но оказался ничтожен.[28]
Причиной его является то, что основой работы батареи являются процессы высвобождения и обратного захвата ионов лития, динамика которых ухудшается в случае неполной зарядки.[29] Во время зарядки ионы лития один за другим покидают частицы литий-феррофосфата, размер которых составляет десятки микрометров. Катодный материал начинает разделяться на частицы с разным содержанием лития. Заряжание батареи происходит на фоне возрастания электрохимического потенциала. В определённый момент он достигает предельного значения. Это приводит к ускорению высвобождения оставшихся ионов лития из катодного материала, но они уже не меняют суммарного напряжения батареи. Если батарея не будет полностью заряжена, то на катоде останется некоторое число частиц, близких к пограничному состоянию. Они практически достигли барьера высвобождения ионов лития, но не успели его преодолеть. При разряде свободные ионы лития стремятся вернуться на место и рекомбинировать с ионами феррофосфата. Однако на поверхности катода их также встречают частицы в пограничном состоянии, уже содержащие литий. Обратный захват затрудняется, и нарушается микроструктура электрода.
В настоящее время просматриваются два пути решения проблемы: внесение изменений в алгоритмы работы системы управления батареями и разработка катодов с увеличенной площадью поверхности.
Требования к режимам заряда/разряда[править | править код]
Глубокий разряд полностью выводит из строя литий-ионный аккумулятор. Также на жизненный цикл аккумуляторов влияет глубина его разряда перед очередной зарядкой и зарядка токами выше установленных производителем. Крайне чувствительны они и к напряжению зарядки. Если его повысить всего на 4 %, то аккумуляторы будут вдвое быстрее терять ёмкость от цикла к циклу. Ток зарядки зависит от разницы напряжений между аккумулятором и зарядным устройством и от сопротивления как самого аккумулятора, так и подводимых к нему проводов. Поэтому увеличение напряжения зарядки на 4 % может приводить к увеличению тока зарядки в 10 раз. Это отрицательно сказывается на аккумуляторе. Он может перегреваться и деградировать[30].
Старение[править | править код]
Литиевые аккумуляторы стареют, даже если не используются. Соответственно, нет смысла покупать аккумулятор «про запас» или чрезмерно увлекаться «экономией» его ресурса.
Оптимальные условия хранения Li-ion-аккумуляторов достигаются при 40-процентном заряде от ёмкости аккумулятора и температуре 0…10 °C:[31]
| Температура, ⁰C | С 40%-м зарядом, % за год | Со 100%-м зарядом, % за год |
|---|---|---|
| 0 | 2 | 6 |
| 25 | 4 | 20 |
| 40 | 15 | 35 |
| 60 | 25 | 40 % за три месяца |
Снижение ёмкости при низких температурах[править | править код]
Как и в других типах аккумуляторов, разрядка в условиях низких температур приводит к снижению отдаваемой энергии, в особенности при температурах ниже 0 ⁰C. Так, снижение запаса отдаваемой энергии при понижении температуры от +20 ⁰C до +4 ⁰C приводит к уменьшению отдаваемой энергии на ~5-7 %, дальнейшее понижение температуры разрядки ниже 0 ⁰C приводит к потере отдаваемой энергии на десятки процентов. Разряд аккумулятора при температуре не ниже, указанной производителем аккумуляторов, не приводит к их деградации (преждевременному исчерпанию ресурса). Химия литий-ионных аккумуляторов более чувствительна к температурам при зарядке АКБ, и оно оптимально при температурах ~ +20 ⁰C, а при температурах ниже +5 ⁰C не рекомендовано.[32]
Как и для других типов аккумуляторов, одним из вариантов решения проблемы являются аккумуляторы с внутренним подогревом.[33]
- ↑ А.М. Скундин, О.А. Брылев. Наноматериалы в современных химических источниках тока (неопр.). МГУ (2011).
- ↑ Татьяна Кулова. Аккумуляторы, изменившие жизнь // Наука и жизнь. — 2019. — № 12. — С. 2-7.
- ↑ Li-ion 4.35V vs 4.20V сколько теряем? Тест SANYO UR18650ZTA. / Зарядки, пауэрбанки, провода и переходники / iXBT Live (рус.). iXBT Live (26 августа 2018). Дата обращения 18 октября 2019.
- ↑ Топовые аккумуляторы 21700: LG M50 5000мАч vs Samsung 48G 4800мАч / Зарядки, пауэрбанки, провода и переходники / iXBT Live (рус.). iXBT Live (30 июня 2018). Дата обращения 18 октября 2019.
- ↑ Sony VTC6A и VTC6 с одинаковыми Matrix-кодами — результаты тестов (неопр.). www.ecigtalk.ru. Дата обращения 18 октября 2019.
- ↑ Н. Бровка, О. Янченков Применение специализированных микропроцессоров для построения схем контроля и защиты литий-ионных и литий-полимерных аккумуляторных батарей // Журнал «Компоненты и Технологии». — № 3, 2007 г. С. 132—135. ISSN 2079-6811.
- ↑ Обзор BMS контроллера заряда литий-ионных аккумуляторов 18650 3.7В на YouTube
- ↑ Сердечный Д. В., Томашевский Ю. Б. Управление процессом заряда многоэлементных литий-ионных аккумуляторных батарей / Научная статья // Журнал «Измерение. Мониторинг. Управление. Контроль». — № 3 (21), 2017 г. С. 115—123. УДК 621.314. DOI 10.21685/2307-5538-2017-3-16. ISSN 1999-5458.
- ↑ Сазонов И. Е., Лукьяненко М. В. Выравнивание заряда в литий-ионных аккумуляторных батареях / Научная статья // Сборник материалов IX Междунарародной научно-практической конференции, посвящённой Дню космонавтики]]. «Актуальные проблемы авиации и космонавтики» [Электронныйресурс]. Красноярск: СибГУ им. М. Ф. Решетнева — № 9, т. 1, 2013 г. С. 204. УДК 537.22. ISSN 1999-5458.
- ↑ [1].
- ↑ [2].
- ↑ [3].
- ↑ [4]
- ↑ [5]
- ↑ [6].
- ↑ [7].
- ↑ Возгорания на Dreamliner связаны с аккумуляторами
- ↑ Samsung отзывает Galaxy Note 7 из-за возможности возгорания
- ↑ Находившийся за рулем Tesla бывший агент ФБР погиб в ДТП
- ↑ Should You Be Worried About Your E-Cigarette Exploding?
- ↑ Лайнер экстренно сел из-за загоревшегося планшета Samsung
- ↑ Lithium Batteries as Cargo in 2016 Update III
- ↑ Bandhauer Todd M., Garimella Srinivas, Fuller Thomas F. A Critical Review of Thermal Issues in Lithium-Ion Batteries (англ.) // Journal of The Electrochemical Society. — 2011. — Vol. 158, no. 3. — P. R1. — ISSN 0013-4651. — DOI:10.1149/1.3515880. [исправить]
- ↑ Zaghib K., Dubé J., Dallaire A., Galoustov K., Guerfi A., Ramanathan M., Benmayza A., Prakash J., Mauger A., Julien C.M. Enhanced thermal safety and high power performance of carbon-coated LiFePO4 olivine cathode for Li-ion batteries (англ.) // Journal of Power Sources. — 2012. — December (vol. 219). — P. 36—44. — ISSN 0378-7753. — DOI:10.1016/j.jpowsour.2012.05.018. [исправить]
- ↑ http://www.powerinfo.ru/accumulator-liion.php
- ↑ Гореть, а не тлеть! Что на самом деле случилось с электроседаном Tesla Motors?
- ↑ Аспекты безопасности литий-ионных аккумуляторов
- ↑ Paul Scherrer Institut (PSI) :: Memory effect now also found in lithium-ion batteries (неопр.). Дата обращения 2 мая 2013. Архивировано 11 мая 2013 года.
- ↑ Экономия батареи на Андроид: советы и мифы | AndroidLime (неопр.). androidlime.ru. Дата обращения 29 февраля 2016.
- ↑ Мельничук О. В., Фетисов В. С. Особенности заряда и разряда литиевых аккумуляторных батарей и современные технические средства управления этими процессами / Научная статья // Журнал «Электротехнические и информационные комплексы и системы». — № 2, т. 12, 2016 г. С. 41-48. УДК 621.355.9. ISSN 1999-5458.
- ↑ 5 практических советов по эксплуатации литий-ионных аккумуляторов (рус.)
- ↑ Эксплуатация и хранение литий-ионных аккумуляторов (рус.)
- ↑ Независимая интернет-газета «Новый взгляд». 22.01.2016.Созданы литий-ионные аккумуляторы с подогревом
Литиевая батарейка — Lithium battery

 Литий 9 вольт , АА и ААА размеров. Верхнего блока имеет три литий-марганец клетки двуокиси внутри, в нижней части две дисульфидные литий-железо отдельные клетки физически и электрически совместимы с 1,5 вольт углерода-цинковых или щелочных батарей.
Литий 9 вольт , АА и ААА размеров. Верхнего блока имеет три литий-марганец клетки двуокиси внутри, в нижней части две дисульфидные литий-железо отдельные клетки физически и электрически совместимы с 1,5 вольт углерода-цинковых или щелочных батарей.Литиевые батареи являются первичными батареями , которые имеют литий в качестве анода . Эти типы батарей, также упоминается как литий-металлических батарей.
Они стоят особняком от других батарей в их высокой плотности заряда (длительный срок службы) и высокой стоимости на единицу. В зависимости от конструктивных соединений и химических используемых, литиевые элементы могут производить напряжение от 7000150000000000000 ♠1,5 В (сравнимых с цинк-углеродом или щелочной батареей ) до приблизительно 7000370000000000000 ♠3,7 В .
Одноразовые первичные литиевые батареи следует отличать от вторичной литий-ионных , литий фосфат железа и литий-полимер , которые являются аккумуляторные батареи питания. Литий особенно полезно, потому что его ионы могут быть выполнены с возможностью перемещения между анодом и катодом , с использованием интеркалированного литием соединения в качестве катодного материала , но без использования металлического лития в качестве материала анода. Чистый лития будет мгновенно реагировать с водой, или даже влаги в воздухе; лития в литий — ионных батарей находится в менее реактивным соединением.
Литиевые батареи широко используются в портативных электронных устройствах, а также в электрических транспортных средствах, начиная от полноразмерных автомобилей до радиоуправляемых игрушек.
история
Описание
Термин «литиевая батарея» относится к семейству различных литий-металлической химическим, включающая многим типов катодов и электролитов , но все с металлическим литием в качестве анода. Батареи требует от 0,15 до 0,3 кг лития за киловатт — час.
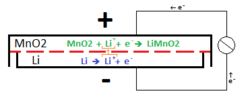 Схема батареи лития клетки кнопки с MnO 2 (двуокись марганца) , на катоде
Схема батареи лития клетки кнопки с MnO 2 (двуокись марганца) , на катодеНаиболее распространенный тип литиевого элемента , используемого в производстве потребительских товаров использует металлический литий в качестве анода и диоксида марганца в качестве катода, с солью лития , растворенного в органическом растворителе .
 Разобранном батарея CR2032 Слева — отрицательная чашки с внутренней стороны слоем лития (окисляется на воздухе), сепаратор (пористый материал), катод (диоксид марганца), металлическая сетка — ток коллектора, металлический корпус (+) (повреждение при открытии ячейки ), на дне пластиковой изоляции кольцо
Разобранном батарея CR2032 Слева — отрицательная чашки с внутренней стороны слоем лития (окисляется на воздухе), сепаратор (пористый материал), катод (диоксид марганца), металлическая сетка — ток коллектора, металлический корпус (+) (повреждение при открытии ячейки ), на дне пластиковой изоляции кольцоДругой тип литиевого элемента , имеющего большую плотность энергии является клетка хлорид лития-тионил . Изобретенный Адам Геллер в 1973 году, литий-тионилхлоридом батареи , как правило , не продаются на потребительском рынке, а также найти более широкое использование в коммерческих / промышленных: автоматическое считывание показаний счетчиков (AMR) и медицинские: автоматические внешние дефибрилляторы приложения (AEDs). Химия электролита ниже, не является перезаряжаемой. Ячейка содержит жидкую смесь хлористого тионила (SOCl 2 ), тетрахлоралюминат литии ( LiAlCl
4 ) ипентахлорида ниоби(NbCl
5 )которые действуюткачествекатолита,электролита, электронной раковины и дендриты профилактических во время обратного состояния напряжения,электролит, соответственно. Пористый углеродный материал служиткачествекатода коллектора токакоторый принимает электроны из внешней цепи. Батареи хлористого лития-тионил хорошо подходит для чрезвычайно низкого тока или умеренных приложениями импульсакогда срок службы до 40 лет необходим.
Химии
| Химия | катодный | электролит | Номинальное напряжение | Холостое напряжение | Wh / кг | Вт · ч / л |
|---|---|---|---|---|---|---|
| Li-MnO 2 (МЭК Код: C) , «CR» | Термическая обработка диоксида марганца | Перхлорат лития в органическом растворителе ( пропиленкарбонат и диметоксиэтане во многих общих , но не всех продуктах) | 3 В | 3,3 В | 280 | 580 |
| «Li-Mn». Наиболее распространенными потребительского класса литиевая батарея, около 80% рынка литиевой батареи. Использование недорогих материалов. Подхожу для применения в условиях низкого стока, с длительным сроком службы, низкой стоимостью. Высокая плотность энергии на обоих массы и объема. Диапазоны рабочих температур от -30 ° C до 60 ° C. Может поставить большие токи импульсов. С разрядом, внутренними подъемами импеданса и уменьшается напряжение на клеммы. Высокий саморазряд при высоких температурах. 1,2 диметоксиэтан является REACH кандидат вещество очень высокого беспокойства . | ||||||
| Li- (CF) х (МЭК код: В) , «БР» | Углерод монофторид | Тетрафторборат лития в пропиленкарбонат , диметоксиэтан , или гамма-бутиролактоне | 3 В | 3,1 В | 360-500 | 1000 |
| Катодный материал , образованный путем высокотемпературной интеркаляцией из фтора газа в графитовый порошок. По сравнению с диоксидом марганца (CR), который имеет то же номинальное напряжение, оно обеспечивает большую надежность. Используется для низкого до умеренного текущих приложений в памяти и резервного копирования часов батареи. Используемые в аэрокосмической промышленности, квалифицированное для пространства с 1976 года, военные приложения , как наземные и морские, в ракетах, а также в искусственных кардиостимуляторов . Работает примерно до 80 ° C. Очень низкий саморазряд (<0,5% / год при 60 ° C, <1% / год при 85 ° C). Разработанный в 1970 — х годах Matsushita . | ||||||
| Li-FeS 2 (IEC Код: F) , «FR» | дисульфид Железо | Пропиленкарбонат , диоксоланы , диметоксиэтан | 1,4-1,6 В | 1,8 В | 297 | |
| «Литий-железо», «Ли / Fe». Названный «напряжение-совместимый» лития, так как он может работать в качестве замены для щелочных батарей с его номинальным напряжением 1,5 В. Как таковые, Энерджайзер лития клетки АА и ААА размера использует эту химии. В 2,5 раза выше , срок службы для высокого тока режима разряда , чем щелочных батарей, лучше срок хранения за счет снижения саморазряда, 10-20 лет срок хранения. FeS 2 дешево. Катод часто выполнен в виде пасты порошка сульфида железа , смешанного с порошком графита. Вариант литий-CuFeS 2 . | ||||||
| Li-SOCl 2 (IEC код: E) | тионилхлорид | Литий тетрахлоралюминат в тионилхлорида | 3.5 В | 3,65 В | 500-700 | 1200 |
| Жидкий катод. Для применения в условиях низких температур. Может работать до -55 ° С, где она сохраняет более 50% своей номинальной мощности. Незначительное количество газа генерируется в номинальном использовании, ограниченное количество при злоупотреблении. Имеет относительно высокое внутреннее сопротивление и ограниченный ток короткого замыкания. Высокая плотность энергии, около 500 Вт · ч / кг. Toxic. Электролит реагирует с водой. Слаботочные клетки , используемые для портативной электроники и резервного копирования памяти. Сильноточные клетки , используемые в военных целях. В длительном хранении, образует пассивирующий слой на аноде, что может привести к временной задержке напряжения , когда введено в эксплуатацию. Высокая стоимость и проблемы безопасности ограничивают использование в гражданских целях. Может взорваться , когда короткое замыкание. Underwriters Laboratories требуют квалифицированного специалиста для замены этих батарей. Опасные отходы, класс 9 Hazmat отгрузки. Не используется для потребления или общего назначения батарей. | ||||||
| Li-SOCl 2 , BrCl, Li-BCX (IEC код: E) | Тионилхлорид с хлоридом брома | Литий тетрахлоралюминат в тионилхлорида | 3,7-3,8 В | 3,9 В | 350 | 770 |
| Жидкий катод. Вариант батареи хлорида тионила, с 300 мВ высокого напряжения. Более высокое напряжение падает до 3,5 V только хлорид брома получает потребляется в течение первых 10-20% разряда. Клетки с добавлением хлорида брома, как полагают, будет безопаснее, когда нарушаются. | ||||||
| Li-SO 2 Cl 2 | Сульфурилхлорид | 3,7 В | 3,95 В | 330 | 720 | |
| Жидкий катод. По аналогии с тионилхлоридом. Сброс не приводит к накоплению элементарной серы, которая , как полагает, участвуют в некоторых опасных реакциях, поэтому сульфурилхлорид батарея может быть более безопасной. Коммерческое развертывание препятствует тенденции электролита к коррозии анодов литии, уменьшая срок годности при хранении. Хлор добавляется в некоторые клетки , чтобы сделать их более устойчивыми к злоупотреблению. Хлоридные клетки сульфурилом дают меньше , чем максимальный ток тионилгалогенидами хлоридных из них, за счет поляризации углеродного катода. Сульфурилхлорид бурно реагирует с водой, выделяя хлористый водород и серную кислоту. | ||||||
| Li-SO 2 | Диоксид серы на тефлоновой -bonded углерода | Литий бромид в диоксиде серы с небольшим количеством ацетонитрила | 2,85 В | 3,0 В | 250 | 400 |
| Жидкий катод. Может работать до -55 ° С и до + 70 ° С. Содержит жидкий SO 2 при высоком давлении. Требует безопасность отверстие, может взорваться в некоторых условиях. Высокая плотность энергии. Высокая цена. При низких температурах и высоких токов, работает лучше , чем Li-MnO 2 . Toxic. Ацетонитрил образует цианид лития , и может образовывать цианистого водорода при высоких температурах. Используется в военных целях. Добавление брома монохлорида может увеличить напряжение до 3,9 V и увеличить плотность энергии. | ||||||
| Li-I 2 | Йод , который был смешивают и нагревают с поли-2-винилпиридина (П2ВП) с образованием твердого органического комплекса с переносом заряда. | Твердый монослой кристаллического иодида лития , который проводит ионы лития от анода к катоду , но не ведет йод. | 2,8 В | 3,1 В | ||
| Твердый электролит. Очень высокая надежность и низкий уровень саморазряда. Используется в медицинских приложениях, требующих длительный срок, например , кардиостимуляторы. Не генерирует газ даже при коротком замыкании. Твердотельный химический, ограниченный ток короткого замыкания, подходит только для слаботочных приложений. Терминал напряжение уменьшается со степенью разряда вследствие осаждения иодида лития . | ||||||
| Li-Ag 2 CrO 4 | Серебряный хромат | Литий перхлората раствор | 3,1 / 2,6 В | 3,45 В | ||
| Очень высокая надежность. Имеет плато 2,6 V после достижения определенного процента от разряда, обеспечивает раннее предупреждение о надвигающемся разряде. Разработан специально для медицинских применений, например, имплантированных кардиостимуляторов. | ||||||
| Li-Ag 2 В 4 O 11 , Ли-СВО, Ли-CSVO | Оксид серебра + пентаоксид ванадия (СВО) | гексафторфосфата лития или гексафторарсената лития в пропиленкарбоната с диметоксиэтаном | ||||
| Используется в медицинских приложениях, таких как имплантируемые дефибрилляторы, нейростимуляторов и инфузионных систем по наркотикам. Также проектируется для использования в другой электронике, например, аварийных радиобуев . Высокая плотность энергии. Длительный срок хранения. Возможность непрерывной работы при номинальной температуре 37 ° С. Двухступенчатый разряд с плато. Выходное напряжение снижается пропорционально степени разряда. Устойчив к злоупотреблению. | ||||||
| Li-CuO (IEC код: G) , «GR» | Оксид меди (II), | Перхлорат лития, растворенный в диоксолане | 1,5 В | 2,4 В | ||
| Может работать до 150 ° C. Разработанный в качестве замены цинка углерода и щелочных батарей. «Напряжение до» Проблемы, высокая разница между открытым контуром и номинальным напряжением. Производится не до середины 1990-х годов, заменены сульфида лития-железа. Текущее использование ограничено. | ||||||
| Li-Cu 4 O (PO 4 ) 2 | Медь oxyphosphate | |||||
| См Li-CuO | ||||||
| Li-CuS | сульфид меди | литий-металл | 1,5 В | соли лития или соли , такой как хлорид тетралкиламмония , растворенного в LiClO 4 в органическом растворителе , который представляет собой смесь 1,2-диметоксиэтан, 1,3-диоксолан и 2,5-диметилоксазола в качестве стабилизатора | ||
| Li-PbCuS | Сульфид свинца и сульфид меди | 1,5 В | 2,2 В | |||
| Li-FeS | сульфид железа | Пропиленкарбонат , диоксоланы , диметоксиэтан | 1.5-1.2 В | |||
| «Литий-железо», «Ли / Fe». используется в качестве замены для щелочных батарей . См дисульфид лития-железа. | ||||||
| Li-Bi 2 Pb 2 O 5 | Ведущий висмутат | 1,5 В | 1,8 В | |||
| Замена серебра-оксид батарей , с более высокой плотностью энергии, более низкой тенденцией к утечке, и более высокой производительностью при более высоких температурах. | ||||||
| Литий-Би 2 O 3 | Висмут триоксида | 1,5 В | 2,04 В | |||
| Литий-V 2 O 5 | пятиокиси ванадия | 3,3 / 2,4 В | 3,4 В | 120/260 | 300/660 | |
| Два разряда плато. Низкое давление. Перезаряжаемый. Используется в резервных батареях . | ||||||
| Li-CuCl 2 | хлорид меди | LiAlCl 4 или LiGaCl 4 в SO 2 , жидкость, неорганический, неводный электролит. | ||||
| Перезаряжаемый. Эта клетка имеет три плато напряжения , поскольку он разряжает (3,3 В, 2,9 В и 2,5 В). Разрядка ниже первого плато уменьшает жизнь клетки. Комплексная соль растворяют в SO 2 имеет более низкое давление паров при комнатной температуре , чем чистый диоксид серы, что делает строительство проще и безопаснее , чем литий-SO 2 батарей. | ||||||
| Li / Al-MnO 2 , «ML» | диоксид марганца | 3 В | ||||
| Перезаряжаемый. Анод представляет собой литий-алюминиевый сплав. В основном продается компанией Maxell . | ||||||
| Li / Al-V 2 O 5 , «VL» | пятиокиси ванадия | 3 В | ||||
| Перезаряжаемый. Анод является Li-Al сплава. | ||||||
| Li-Se | Селен | неводные электролиты карбонатные | 1,9 В. | |||
| Li-воздух ( литий-воздушная батарея ) | пористый углеродный | Органические, водный, стеклокерамические (полимер-керамические композиционные материалы) | 1800-660 | 1600-600 | ||
| Перезаряжаемый. Нет коммерческую реализация не доступна, начиная с 2012 года из — за трудности в достижении нескольких циклов разряда без потери мощности. Есть несколько возможных реализаций, каждая из которых имеет различные энергетические мощности, преимущества и недостатки. В ноябре 2015 года группа из Университета Кембриджа исследователей продвинул работу на литий-воздушных батарей, разработав процесс зарядки , способный продлить срок службы батареи и батареи эффективности. Их работа привела к батарее , которая доставила высокие плотности энергии, более 90% эффективности, и может быть пополнены до 2000 раз. Литий-воздушные батареи описаны как «конечной» батарей , поскольку они предлагают высокую теоретическую плотность энергии до десяти раз больше энергии , предлагаемых регулярных литий-ионных батарей. Они были впервые разработаны в научно — исследовательской среде Авраамом и Цзяна в 1996 году технология, однако, по состоянию на ноябрь 2015 года, не будет сразу доступен в любой отрасли , и это может занять до 10 лет для литий-воздушные батареи для оснащения устройств. Непосредственная задача , стоящая перед учеными , участвующих в его изобретения состоит в том , что батарея нуждается в специальном пористого графена электрода, помимо других химических компонентов, и узкий зазор между напряжением заряда и разряда , чтобы значительно повысить эффективность работы . | ||||||
Жидкости органический электролит представляет собой раствор ионов , образующих неорганического соединения лития в смеси с высокой диэлектрической проницаемостью растворителя ( пропиленкарбоната ) и низкой вязкости растворителя ( диметоксиэтан ).
Инженеры из Калифорнийского университета в Сан-Диего разработали прорыв в области химии электролита, что позволяет литиевые батареи работать при низких температурах до -60 ° C с отличной производительностью. Новые электролиты позволяют также электрохимические конденсаторы, чтобы работать как низко как -80 ° C — их предел тока при низкой температуре -40 ° C. В то время как технология позволяет крайнюю работу при низких температурах, высокая производительность при комнатной температуре еще поддерживается. Новая химия электролита может также увеличить плотность энергии и улучшить безопасность литиевых батарей и электрохимических конденсаторов.
Приложения
Литиевые батареи находят применение во многих долговечных, важных устройствах, таких как кардиостимуляторы и другие имплантируемых электронных медицинских устройства. Эти устройства используют специализированные литий-йодид аккумуляторы рассчитаны на 15 или более лет. Но для других, менее важных приложений , таких как в игрушках , литиевая батарея может фактически переживет устройство. В таких случаях, дорогой литиевая батарея не может быть экономически выгодным.
Литиевые батареи могут быть использованы вместо обычных щелочных элементов во многих устройствах, таких как часы и фотоаппараты . Несмотря на то, что они являются более дорогостоящими, литиевые обеспечит более длительный срок службы, тем самым сводя к минимуму замены батареи. Однако, внимание должно быть уделено повышенное напряжение , разработанного литиевых элементов перед их использованием в качестве заменой в устройствах , которые обычно используют обычные цинковые клетки.

Литиевые батареи также оказаться полезными в океанографии приложений . В то время как литиевые аккумуляторы значительно дороже , чем стандартные океанографических пакеты, они занимают в три раза емкости щелочных упаковок. Высокая стоимость обслуживания удаленных океанографические приборов ( как правило , на судах) часто оправдывает эту высокую стоимость.
Размеры и форматы
Небольшие литиевые батареи очень часто используется в небольших, портативных электронных устройствах, такие как карманные компьютеры , часы, видеокамеры, цифровые камеры, термометры, калькуляторы, персональный компьютер BIOS (прошивки), оборудование связи и удаленные замки автомобиля. Они доступны во многих форм и размеров, с общим разнообразие быть разнообразие в 3 вольта «монета» типа марганца, обычно от 20 мм в диаметре и толщиной 1.6-4 мм.
Тяжелые электрические требования многих из этих устройств делают литиевые батареи особенно привлекательным вариантом. В частности, литиевые батареи могут легко поддерживать короткие, тяжелые текущие потребности устройств , таких как цифровые камеры , и они поддерживают более высокое напряжение в течение более длительного периода , чем щелочные элементы.
популярность
Литиевые батареи первичных составляют 28% от всех продаж первичных батарей в Японии, но только 1% от всех продаж батарей в Швейцарии. В ЕС лишь 0,5% от всех продаж батарей включая вторичные типов являются литиевые первичные.
Вопросы безопасности и регулирования
диск компьютерной индустрии, чтобы увеличить емкость батареи может испытать пределы чувствительных компонентов, таких как мембранный сепаратор, полиэтиленовой или полипропиленовой пленки, которая имеет толщину всего 20-25 мкм. Плотность энергии литиевых батарей имеет более чем в два раза, так как они были введены в 1991 году Когда аккумулятор сделан, чтобы содержать больше материала, сепаратор может подвергаться стрессу.
Проблемы быстрого разряда
Литиевые батареи могут обеспечить очень высокие токи и может выполнять очень быстро, когда короткое замыкание. Несмотря на то, что это полезно в тех случаях, когда требуются высокие токи, слишком-быстрый сброс литиевой батареи может привести к перегреву батареи, разрыва и даже к взрыву. Литий-тионилхлорид батареи особенно чувствительны к этому типу разряда. Потребительские батареи обычно включают перегрузки по току или тепловой защиты или вентиляционные отверстия, чтобы предотвратить взрыв.
Авиаперелеты
С 1 января 2013 года , гораздо более строгие правила были введены ИАТА о перевозке литиевых батарей по воздуху. Они были приняты Международным почтовым союзом; Однако, в некоторых странах, например в Великобритании, решили , что они не будут принимать литиевые батареи , если они не входят в комплект оборудования они питания.
Из-за указанными выше риски, судоходство и перевозки литиевых батарей ограничены в некоторых ситуациях, в частности, транспортировка литиевых батарей по воздуху.
США Администрация транспортной безопасности объявила ограничение эффективного 1 января 2008 на литиевых батареях в зарегистрированном и ручной клади. Правила запрещают литиевые батареи не установлен в устройстве от зарегистрированного багажа и ограничивать их в ручной клади по общему содержанию лития.
Австралия Сообщение запрещены перевозки литиевых батарей в воздушной почте в течение 2010 года.
Великобритания правило перевозки литиевых батарей были внесены изменения в национальном химическом центре МЧС в 2009 году.
В конце 2009 года , по крайней мере , некоторые почтовые администрации ограничить перевозку груз воздушной почты (включая Express Mail Service ) литиевые батареи, литий-ионные батареи и продукты , содержащие эти (такие как ноутбуки и мобильные телефоны). Среди этих стран Гонконг , США и Япония.
метамфетамина лаборатории
Неиспользованные литиевые батареи обеспечивают удобный источник металлического лития для использования в качестве восстановителя в метамфетамин лаборатории. В некоторых странах были приняты законы, ограничивающие литиевые батареи продаж или попросили бизнеса вносить добровольные ограничения в попытке помочь обуздать создание незаконных лабораторий мет . В 2004 году Wal-Mart магазинов были зарегистрированы , чтобы ограничить продажу одноразовых литиевых батарей до трех пакетов в Миссури и четыре пакета в других государствах.
Вопросы здоровья проглатывания
Кнопочные батареи привлекательны для маленьких детей и часто попадает. За последние 20 лет, несмотря на то , что не было увеличение общего количества батарей таблеточного типа поглощенных в течение года, исследователи отметили 6,7-кратное увеличение риска , что прием пищи приведет к умеренной или основным осложнением и 12.5 кратно увеличение со смертельным исходом по сравнению последнее десятилетие предыдущего.
Первичный механизм травмы с проглатыванием кнопки батареи является генерация гидроксида ионов , которые вызывают серьезные химические ожоги, на аноде. Это электрохимический эффект неповрежденной батареи, и не требует корпусов , чтобы быть нарушены или содержимого освобождено. Осложнения включают стриктуры пищевода , трахеи-пищеводный свищ , паралич голосовых связок, аорто-пищеводный свищ , и смерть. Большинство проглатывания не видело; презентации неспецифические; напряжение батареи увеличилась; 20 до 25 мм размера кнопки батареи, более вероятно , чтобы стать подано на крикофарингеальной перекрестке; и серьезное повреждение ткани может произойти в течение 2 -х часов. 3 В, 20 мм литиевой батарею CR2032 участвует во многих осложнениях от проглатывания кнопки аккумулятора детей менее 4 -х лет. В то время как единственное лекарство от пищеводного сдавление является эндоскопическое удаление, +2018 исследование из Детской больницы Филадельфии Рейчел Р. ANFANG и его коллеги обнаружили , что раннее и частое проглатывание меда или сукральфат суспензии перед удалением батареи может уменьшить тяжесть травмы в значительная степень. В результате Отравления США Центр на базе National Capital (Яд Control) рекомендует использовать мед и сукральфат после известного или подозреваемого проглатывания , чтобы уменьшить риск и тяжесть повреждения пищевода, и , следовательно , его близлежащие структуры. Кнопка батареи может также привести к значительным некротические повреждения , когда застрял в носу или ушах. Профилактические меры в США по национальной кнопке целевой батареи силы в сотрудничестве с лидерами отрасли , привели к изменениям в упаковке и отсек батареи дизайне в электронных устройствах , чтобы ограничить доступ ребенка к этой батарее. Тем не менее, по- прежнему является отсутствие осведомленности по всему населению в целом и медицинского сообщества к его опасности. Центральный Манчестер University Hospital Trust предупреждает , что «многие врачи не знают , что это может причинить вред».
выбытие
Правила утилизации и переработки батарей отличаются друг от друга; местные органы власти могут иметь дополнительные требования по сравнению с теми , национальными правилами. В Соединенных Штатах, один производитель лития железа дисульфид первичных батарей сообщает , что потребительские количества используемых клеток могут быть отброшены в бытовых отходов, так как батарея не содержит каких — либо веществ , контролируемых США федеральных правил. Другой производитель заявляет , что «кнопка» литиевые батареи размера содержат перхлорат , который регулируется как опасные отходы в Калифорнии; регулируемые величины не будут найдены в типичном использовании потребителей этих клеток.
В качестве лития в используемых, но не рабочем (т.е. длительного хранения) клетки кнопок все еще может быть в чашке катода, можно извлечь коммерчески полезные количества металла из таких клеток, а также двуокись марганца и специальных пластмасс. Из эксперимента режим обычного отказа является то, что они будут читать 3.2 В или выше, но быть не в состоянии генерировать полезный ток (<5 мА по сравнению с> 40 мА для хорошей новой ячейки) Некоторые из них также сплава лития с магнием (Mg), чтобы сократить расходы и они особенно склонны к режиму упомянутого отказа.
Смотрите также
Рекомендации
внешняя ссылка
Литиевые батарейки
СОДЕРЖАНИЕ
Свойства, обусловленные литием.
Типы батареек с положительными электродами из различных материалов.
-Железодисульфидные.
-Диоксид марганца.
-Тионилхлорид.
-Диоксид серы.
-Полимонофторуглерод.
Депассивация
Правила обращения и меры предосторожности.СВОЙСТВА, ОБУСЛОВЛЕННЫЕ ЛИТИЕМ

Батарейки с литиевым отрицательным электродом выпускаются в цилиндрическом, дисковом и призматическом корпусах.
Производство литиевых батареек началось в семидесятых годах в нескольких странах. Наилучшие результаты удалось получить при использовании лития в сочетаниях с твердыми и органическими электролитами. Улучшить эксплуатационные и энергетические параметры позволил отказ от водного электролита.

Литий в слитках в виде секторной формы. При обычных условиях литий реагирует с кислородом и азотом воздуха, покрываясь пленкой темного цвета.
Литий – мягкий, пластичный металл, расположен первым в ряду электродных потенциалов. Его электродный потенциал составляет – 3,045 вольта. Подробнее об электродных потенциалах рассказано в статье “Разность электродных потенциалов – возможность работы батарейки”. Это позволяет создавать батарейки напряжением около трех вольт, что упрощает реализацию питания многих приборов. Одна литиевая батарейка может заменить две щелочных или солевых. Напряжение 3 вольта литиевой батарейки, вместо привычных 1,5 вольт кроме преимуществ имеет недостатки в виде некоторых особенностей применения. Литиевые батарейки производятся в стандартных корпусах, поэтому с их появлением требуется внимательно проверять напряжение устанавливаемых батареек. Литий самый легкий металл. Батарейки, имеющие литиевые электроды на одну треть легче щелочных батареек. Химически литий очень активен. Эти свойства лития позволяют создавать химические источники тока минимальных размеров и массы. Главное преимущество литиевых источников тока – очень высокая плотность энергии, гарантирующая большой заряд. Это позволяет литиевым батарейкам обеспечивать наибольшую продолжительность работы по сравнению с другими химическими элементами. Также среди преимуществ этого типа батареек работа в условиях экстремальных температур.
Литиевые электроды во всех электролитах покрываются пассивной пленкой толщиной несколько нанометров. Пленка обладает свойствами твердого электролита, проводящего ионы лития. Образование пленки предотвращает самопроизвольную реакцию литиевого электрода с электролитом, поэтому литиевые элементы имеют низкий саморазряд. Снижения заряда составляет 1-2 % в год. Срок хранения литиевых батареек составляет 10 лет, а некоторых типов до пятнадцати лет. При различных токах разряда емкость батареек почти не изменяется. В начале работы батарейки желательно провести депассивацию, разрушающую пленку на литиевом электроде.
Недостатком батареек является высокая цена из-за используемого лития, но с течением времени потребление этого типа батареек будет возрастать, а с увеличением добычи и переработки лития цена будет снижаться. Большая часть лития добывается в восьми странах.

Добыча лития.
Объем запасов лития на территории России приблизительно оценивается как 1 миллион тонн. Более половины сосредоточенно в месторождениях Мурманской области. Производителями лития и его солей в Росси являются Новосибирский завод химконцентратов и Красноярский химико-металлургический завод.
Литий способен вызвать ожоги из-за постоянно присутствующей на коже влаги. Работать с литием можно только в защитной одежде и очках. Высокая активность лития усложняет технологию производства батареек. Хранить литий можно только под слоем минерального масла. Для уничтожения отходов лития их обрабатывают этиловым спиртом.
В литиевых батарейках цилиндрической формы используются электроды ленточного типа. Преимущества рулонной конструкции электродов: низкое сопротивление и сниженный нагрев. Такая конструкция позволяет увеличить ток разряда батарейки.

Рулонные электроды цилиндрической литиевой батарейки. Для отрицательного электрода используется литиевая фольга.
Батарейки обладают высокой степенью герметичности, для повышения безопасности эксплуатации в конструкцию входят клапаны, предотвращающие критическое повышение давления. Производство происходит в герметичных объемах в сухой атмосфере инертных газов. В этих батарейках нет вредных веществ, содержащихся в других типах. Исключено содержание ртути, кадмия, свинца.
Применяются в компьютерах, промышленной автоматике, медицинских приборах, различных переносных и карманных устройствах, электронных часах и играх, измерительных приборах, счетчиках расхода газа, фото и видеотехнике и во многих других областях, где востребована герметичность батареек и эксплуатация в течении многих лет.
ТИПЫ БАТАРЕЕК С ПОЛОЖИТЕЛЬНЫМИ ЭЛЕКТРОДАМИ ИЗ РАЗЛИЧНЫХ МАТЕРИАЛОВ
ЖЕЛЕЗОДИСУЛЬФИДНЫЕ
В последние годы усиливается интерес к литиевым батарейкам, имеющим твердый положительный электрод, изготовленный из дисульфида железа FeS2 (пирит). Благодаря химическому составу этот тип батареек имеет напряжение 1,5 вольта, в отличии от других литиевых источников питания, что позволяет их использовать вместо устаревших типов батареек с водным электролитом. При разряде литий отрицательного электрода превращается в сульфид лития. Цилиндрическая батарейка содержит электроды рулонной конструкции. При изготовлении положительного электрода натуральный пирит, размельченный и смешенный с графитом размещается на пленочном токоотводе. После установки в корпус батарейки ленточных электродов производят заполнение электролитом и герметизируют корпус. В состав батарейки входит терморезистор, ограничивающий ток через батарейку при ее нагреве. Сохранность батареек 15 лет и более. Работоспособность сохраняется при понижении температуры до – 40 °С.


Железосульфидная батарейка Energizer L91 и ее разряд током 1 ампер при температуре 21 °C.


Железосульфидная батарейка Duracell LF1500 и ее разряд током 1 ампер при температуре 21 °C.
Литий-железодисульфидные батарейки предназначены для использования в режиме токов разряда 0,5 ампер, выпускаются в цилиндрическом и дисковом корпусе. О дисковом исполнении литиевых батареек рассказано в статье “Конструкция батареек”.
ДИОКСИД МАРГАНЦА
Наиболее распространен и изучен из литиевых батареек тип, имеющий твердый положительный электрод, изготовленный из термообработанного диоксида марганца MnO2. В результате реакции разряда образуется оксид лития. Этот тип батареек в наименовании имеет буквы СR. Напряжение составляет 3 вольта. Батарейки сохраняют работоспособность до десяти лет, могут отдавать большой ток и имеют значительную емкость. К этому типу принадлежит батарейка «Корунд» напряжением 9В, состоящая из трех элементов.
Корпус батарейки выполнен из нержавеющей стали. Мембрана, разделяющая электроды, выполнена из полипропилена.


Конструкция диоксид марганцевой Конструкция катушечной диоксид
батарейки со спиральными электродами, марганцевой батарейки, герметизация герметизация крышки закатыванием . крышки лазерной сваркой
Батарейки со спиральными электродами имеют закатанную крышку или приваренную лазером, батарейки катушечной конструкции имеют крышку, приваренную лазером.


Закатанная крышка батарейки. Крышка батарейки приварена лазером.
Диапазон температуры Батарейки работают в интервале
эксплуатации от – 20 до 60 °C. температуры от – 40 до 85 °C.
Для защиты от перегрева и короткого замыкания в конструкции закатанной батарейки присутствует терморезистор с положительной температурной характеристикой. При нагревании его сопротивление увеличивается незначительно, но при достижении температурой значения 85 °C сопротивление резко возрастает, что приводит к снижению тока через батарейку до минимального значения.

Расположение терморезистора в конструкции положительного полюса батарейки.
Батарейки катушечного типа в цилиндрическом корпусе рекомендуются для применения в устройствах с низким потреблением мощности: 5 миллиампер при непрерывном потреблении и 20 миллиампер в импульсном режиме. Это могут быть резервные запоминающие устройства, часы, календари, счетчики воды, счетчики газа, автомобильная электроника. Батарейки со спиральными электродами предназначены для токов непрерывного потребления 1,5 ампера, а в импульсном режиме 4 ампера.


Диоксид марганцевая батарейка Varta CR AA катушечной конструкции и разряд нагрузками различного сопротивления при температуре 21 °C.
ТИОНИЛХЛОРИД
Батарейки Li/SOCl2 обладают наилучшими удельными характеристики. Тионилхлорид – химически высокоактивная жидкость. При разряде батарейки образуется хлорид лития, диоксид серы и сера. Электролитом является раствор тетрахлоралюмината в тионилхлориде. Диоксид серы большей частью растворяется в электролите, поэтому давление в батарейке не повышается. Основным компонентом пассивной пленки, образующейся на литиевом электроде, является хлорид лития. Материал положительного электрода это пористый углерод, пропитанный тионилхлоридом, таким образом, батарейки этого типа имеют жидкий положительный электрод. Батарейки выпускаются с различными типами выводов аксиальными, ножевыми, гибкими проводами. Благодаря такому положительному электроду батарейки на основе тионилхлорида имеют наибольшее значение удельной энергии среди литиевых батареек. Например, весовая удельная энергия цилиндрической батарейки в корпусе AA катушечной конструкции может достигать 1000 ватт-часов на литр. Напряжение батарейки находится в пределах от 3,3 до 3,6 вольт, хранение до 10 лет при саморазряде 1,5…2 % в год при температуре 20 °С. Батарейки катушечной конструкции предназначены для работы в режиме малых токов и ориентированы на резервное питание запоминающих устройств. Температура работы от – 55 до 85 °C, с применением особого электролита от – 50 до 150 °C. При температуре около – 50 °С емкость снижается в несколько раз ниже номинальной.
Отрицательный электрод изготавливается осаждением лития на внутренней поверхности корпуса. Большую часть объема корпуса батарейки занимает пористый катод. Батарейки предназначены для питания приборов небольшим током в течение длительного времени.


Тионилхлоридная батарейка EEMB ER14250 катушечной конструкции и разряд различными токами при температуре 21 °C.


Тионилхлоридная батарейка Saft LS14500 катушечной конструкции и разряд различными токами при температуре 21 °C.
Применение ленточных электродов, упакованных в виде спирали, дает возможность использовать батарейки в режиме повышенных токов. В батарейку введен аварийный клапан давления и плавкий предохранитель для защиты от перегрузки.
Тионилхлоридная батарейка Saft LSH 14, содержащая внутреннюю спиральную конструкцию и характеристики разряда различными токами при температуре 21 °C.
Высокопроизводительные батарейки содержат трихлоралюминий, который растворяет пассивную пленку хлорида лития на отрицательном электроде, но при этом ускоряется коррозия лития.
Батарейки находят применение в запоминающих устройствах, сигнализации, освещении, автомобильной электронике, в бурильном оборудовании, в геотермальных измерениях, радиосвязи и во многих других.
После хранения может потребоваться депассивация. Если после работы в условиях экстремально низкой температуры батарейка попадает в прогретое помещение и разряд продолжается, то возможен разогрев за счет разложения продуктов реакции, который может привести к взрыву.
Батарейки на основе SO2 наиболее универсальны благодаря соответствию различным техническим требованиям, хорошей изученности, накопленному опыту производства и высокой механизации технологических процессов. Обладают стабильным напряжением почти до окончания разряда. Они имеют высокую удельную емкость и способны работать в широком температурном диапазоне от – 60 до 70 °С. Некоторые модели этих батареек могут работать при понижении температуры до – 70 °C. Положительный электрод представляет собой соединение политетрафторэтилена и ацетиленовой сажи. Электролитом батарейки служит диоксид серы с добавками. В результате реакции разряда образуется Li2S2O4. Батарейки выполняются в корпусах с высокой герметичностью. Жидкое состояние диоксида серы обеспечено давлением внутри батарейки в две атмосферы. В конструкции присутствует защитный клапан, снижающий давление, при повышении температуры до значения около 105 °С. Батарейки выпускаются в цилиндрическом корпусе, содержащем катушечное или спиральное исполнение электродов. Напряжение батареек составляет от 2,5 до 2,8 вольта, срок хранения может достигать десяти лет при температуре 20 °С или 1 год при температуре 70 °C. Низкое внутреннее сопротивление даже при низких температурах позволяет использовать этот тип при условиях, исключающих применение других типов батареек: космос, океанология, холодные районы. Батарейки на основе диоксида серы широко применяются в гражданских и военных областях.


Диоксид серная батарейка EEMB LSS26500 и разряд различными токами при температуре 21 °C.
ПОЛИМОНОФТОРУГЛЕРОД
Главным преимуществом этого типа литиевых батареек Li/(CFx)n является высокий энергетический потенциал при температурах 85 °C и даже 125 °C. Батарейки применяются в первую очередь в устройствах, нагревающихся во время работы. Емкость едва заметно снижается после года хранения при температуре 21 °C, а при температуре хранения 90 °C потеря емкости составляет около 2 % в год. При хранении в течение 10 лет батарейки теряют не более одной пятой части емкости. Эти батарейки одни из первых с твердым положительным электродом, появившиеся на промышленном рынке. Удельная энергия полимонофторуглеродной литиевой батарейки достигает 600 ватт-часов на литр. Напряжение работы этих батареек составляет от 2,5 до 2,8 вольта. В процессе реакции фторированный углерод превращается в обычный углерод, происходит рост электропроводности, улучшая условия разряда. Применяются при малых и умеренных токах потребления.
Положительный электрод состоит полимонофторуглерода. Его изготовление происходит при температуре от 300 до 600 °C в атмосфере фтора.
Электролит – раствор гексафторарсената лития в диметилсульфоксиде. В батарейках, выполненных в дисковом корпусе, литиевая фольга расположена на медной решетке, а положительный электрод из политетрафторэтилена и ацетиленовой сажи, находится на решетке из никеля. Батарейки рассчитаны на низкую мощность, выпускаются в корпусах различной формы, успешно используются в запоминающих устройствах, в кардиостимуляторах и в имплантируемых дефибрилляторах. Высокотемпературные дисковые батарейки применяются в автомобильной электронике, в автоматике шлагбаумов и других областях электротехники.
Если предполагается работа в условиях температуры ниже нуля, потребление средних токов, то по цене этот тип батареек не выдерживает конкуренции с более дешевыми литиевыми батарейками, имеющими положительный электрод из диоксида марганца.


Полимонофторуглеродный первичный химический источник питания Panasonic BR1220 и его разряд при различной температуре.
Многочисленные преимущества литиевых батареек омрачает образование пассивной пленки на литиевом электроде. Если для питания часов или пульта телевизора применить литиевые батарейки напряжением 1,5 вольта с расчетным током эксплуатации 0,5 ампер, то возможно прибор будет неуверенно работать после установки весьма дорогих источников питания. Для таких устройств нужно применять литиевые батарейки, предназначенные для работы в режиме малых токов, но на 1,5 вольт маломощные литиевые батарейки для бытовой техники найти сложно. Выход видится в проведении депассивации при установке элементов или каждый раз при включении прибора, если прибор долго не эксплуатировался. Для депассивации нужно подвергнуть батарейки кратковременному импульсу разрядного тока в 10-20 миллиампер. Это мероприятие должно разрушить или ослабить пассивную пленку на литиевом электроде. Если специально предназначенные батарейки устанавливаются в отсек питания прибора с током в десятки миллиампер, то пассивная пленка будет разрушена во время начального периода работы батареек. Для обеспечения депассивации существуют рекомендации производителей литиевых батареек в виде цепей, содержащих конденсаторы. Параллельно батарейке включается конденсатор. При заряде конденсатора происходит кратковременная импульсная нагрузка батарейки. Для универсальности применения различных химических систем батареек, приборы, имеющие батарейное питание можно оснастить конденсаторами, емкостью 0,22…0,68 мкФ, подключенные параллельно батарейкам. Если депассивацию не проводить, то в первое время работы будет наблюдаться провал напряжения. Это приходится наблюдать при установке новой литиевой батарейки в материнскую плату персонального компьютера. Батарейка начинает поддерживать память часов реального времени спустя 2-3 дня после установки. Это время необходимо для разрушения пассивной пленки.
Батарейки запрещается вскрывать, нагревать, сжигать. Следует избегать замыкания полюсов батарейки. Ни в коем случае нельзя пытаться зарядить литиевую батарейку. Устанавливать в прибор, имеющий отсек для нескольких батареек можно батарейки только одного типа и марки. Если обнаружено нарушение корпуса, то батарейки заменить и в дальнейшем не использовать. При установке проверять полярность, ориентируясь на маркировку. Литиевые химические элементы могут иметь конструкцию полюсов, отличающуюся от традиционной конструкции.




