Строение линейное — Справочник химика 21
Макромолекулы многих полимеров построены из одинаковых многократно повторяющихся групп атомов, называемых звеньями. Если звено обозначить буквой А, то в простейшем случае строение линейной макромолекулы можно представить в виде [c.270]
Представления о строении полимерных тел прошли сложную эволюцию от мицеллярных теорий к современным концепциям структурной физики полимеров (см. Структура, Надмолекулярная структура. Кристаллическое состояние, Аморфное состояние. Коллоидные полимерные системы). Несостоятельность мицеллярных теорий строения линейных гомополимеров с однородными по строению цепями макромолекул (напр,, целлюлозы, натурального каучука) заключается в отсутствии физич. причин существования устойчивых фазовых частиц коллоидных размеров. Развитие представлений о макромолекулах, не отличающихся от малых молекул природой сил межмолекулярного взаимодействия, исключило возможность научного обоснования мицеллярных представлений о строении полимеров и их р-ров. Здесь следует еще раз подчеркнуть, что имеются в виду макромолекулы, лишенные дифильности в упомянутом выше смысле. Гибкие макромолекулы, содержащие разнородные по полярности участки, в определенных условиях могут давать микро-гетерогенные системы типа лиофильных золей. При этом лиофобные группы макромолекул объединяются в ядре коллоидной частицы (напр., белковой глобулы), а лиофильные образуют ее поверхностный слой.
Линейными называются такие полимеры, макромолекулы которых существуют в виде длинных неразветвленных цепей. Строение линейной макромолекулы можно схематически представить так [c.327]
Строение линейных органических полимеров обычно указывают, описывая минимальное повторяющееся звено. Эта система в настоящее время применяется в СА [8], а также допускается ШРАС [6], однако в последнем случае упомянутые звенья называют структурно повторяющимися единицами . Такая единица может быть простой двухвалентной группой (типа приведенных на с. 95) или комбинацией их. В этих случаях название группировки, взятое в квадратные скобки, ставится за префиксом поли . В случае несимметричного повторяющегося звена, поскольку возможно его написание и наименование в двух направлениях, необходимо, чтобы правила определяли начало и направление перечисления. Такое требование делает правила сложными, и мы не имеем возможности их здесь подробно об-
Строение Линейное Плоскостно-тригональное [c.209]
Полимерные молекулы кремниевых кислот могут быть как циклическими, так и цепными, но всегда каждый атом Si в них имеет тетраэдрическое окружение из четырех атомов О и два соседних тетраэдра имеют одну общую вершину (атом О). Строение линейного метасиликат-иона SiO на плоскости можно представить так [c.379]
На рис. 1 схематически изображено строение линейных (а), разветвленных (б), сетчатых лестничных (в), паркетных, или пластинчатых (г), и трехмерных (д, е) полимеров.
Полисилоксаны, или кремнийорганические полимеры содержат силоксановую связь —Si—О—Si—. В общем виде строение линейного полисилоксана можно представить следующим образом [c.217]
Свойства поверхностно-активных веществ (ПАВ) находятся в тесной зависимости от их специфического строения. Линейные молекулы ПАВ, имеющие большую длину, состоят из двух частей—гидрофильной, придающей ПАВ способность растворяться в воде, и гидрофобной (отталкивающейся от воды). [c.328]
На рис. 108 схематически изображено строение линейного, разветвленного и пространственного полимеров. [c.370]
Фрагмент цепи целлюлозы Цепь, построенная из тысяч остатков О-глюкозы, имеет линейное строение. Линейные цепи закрепляются водородными связями между моносахаридными звеньями внутри одной цепи. Между параллельно уложенными цепями полисахарида также возникают водородные связи, придающие жесткость всей структуре. Этой особенностью строения обусловлена высокая механическая прочность целлюлозы.
И о СТРОЕНИИ ЛИНЕЙНЫХ ПОЛИМЕРОВ [c.108]
Ранее были рассмотрены сочетания [т ] и О, [т]] и 9, поз
Молекула линейная — Справочник химика 21
Обычные конденсации, например образование сложных эфиров-при взаимодействии спиртов с кислотами, гликолей с одноосновными кислотами, одноатомных спиртов с двухосновными кислотами, к образованию высокомолекулярных соединений не приводят. Для поликонденсаций необходимо, чтобы каждая из реагирующих молекул была по меньшей мере бифункциональна, т. е. содержала бы или две группы —ОН, или две группы —СООН, или —ОН и —СООН. Так, например, гликоль при поликонденсации превращается в полигликоли, оксикислоты—в эстолиды, на что уже указывалось выше. Бифункциональные соединения могут давать лишь длинные линейные молекулы (линейные полимеры). Длину цепейАтом -)- линейная молекула, линейный комплекс [c.46]
Две линейные молекулы Линейный 10- [c.32]
Как вращающееся тело молекула в общем случае обладает тремя степенями свободы вращательного движения и характеризуется тремя главными моментами инерции 1а> I в > с относительно трех декартовых осей координат, проходящих через центр тяжести молекулы. В качестве одной из них выбирается ось симметрии молекулы. (Линейные молекулы имеют только две степени свободы вращательного движения. Для них /с =0, 1а =1в ) Момент инерции выражается соотношением
В общем случае молекул линейных и типа симметричного и асимметричного волчков определение структуры требует привлечения дополнительной информации (об изотопозамещенных молекулах, о вращательном, колебательном взаимодействии и др.). [c.170]
Полярность проявляется, как уже говорилось, при образовании ковалентной связи между атомами с разной электроотрицательностью. При этом следует различать полярность связи и полярность молекул. Не всякая полярная связь приводит к образованию полярной молекулы. Двухатомные молекулы сложных веществ НС1, НВг, СО и т. п. всегда полярны. Иногда для появления полярности необходимо, чтобы центры распределения положительных и отрицательных зарядов не совпадали. В молекуле СО2 связи углерод — кислород. полярны, причем на атоме углерода находится некоторый положительный заряд, а на каждом из атомов кислорода — такой же отрицательный заряд. Следовательно, на атоме углерода сосредоточен центр положительного заряда. Поскольку атомы кислорода расположены на одной прямой по обе стороны от атома углерода (молекула линейная) на равных расстояниях, положительный заряд нейтрализуется. Таким образом, несмотря на полярность каждой связи в СО , вся молекула в целом является неполярной и причиной этого является ее линейное строение, Наоборот, молекула Н—С = N полярна, так как связи углерод — водород и углерод — азот имеют различную длину и различную полярность.
Эффективность применения метода моделирования к решению проблемы строения молекул асфальтенов будет тем выше, чем точнее искусственная модель по составу и строению будет воспроизводить молекулу или фрагменты молекулы асфальтенов нефти. Вряд ли можно признать удачной искусственную модель асфальтенов — спрессованную под давлением смесь сажи и синтетического линейного полиэтилена [26]. Сажа представляет собой почти чистый углерод с графитоподобной упаковкой атомов, а в молекулах линейного полимера тысячи атомов углерода соединены в длинную, слегка разветвленную цепь. Ни один из образующих искусственную модель компонентов даже отдаленно не воспроизводит строение молекул асфальтенов, основную часть которых составляет конденсированное полициклическое (преимущественно ароматическое) ядро. Часть периферических атомов водорода в ядре замещена алифатическими или циклическими структурными звеньями.
Если молекула линейна, то при Т 0др
Укажем, что в общем случае многоатомная молекула имеет 3 степени свободы поступательного движения, 3 или 2 (если молекула линейная) степени свободы вращательного движения и Зл—6 (или для линейной молекулы Зл—5) степеней свободы колебательного движения, где л — число атомов в молекуле. [c.66]
Геометрия молекулы линейная [c.78]
Такие реакции называются реакциями гетерополиконденсации. При поликонденсации бифункциональных мономеров образуются полимерные молекулы линейной структуры. В табл. 37 представлены наиболее распространенные полимеры, получаемые по реакции поликонденсации.
Рассмотрим для примера несколько типов молекул. Линейные трехатомные молекулы типа УХУ (например, СО2, рис. 70) имеют центр [c.174]
Если при образовании химйческих связей возникают две sp-гибридные орбитали, расположенные друг к другу под углом 180° (см. рис. 11,9), то молекула будет иметь линейную форму. Примерами таких молекул являются молекулы галидов бериллия. Возбужденный атом бериллия имеет два неспаренных электрона (2s и 2р ), при гибридизации атомных орбиталей образуются две sp-орбитали. При взаимодействии бериллия с галогенами происходит перекрывание sp-орбиталей бериллия с р-орбиталями галогенов, в результате чего образуются молекулы линейной формы, например Вг—Ве—Вг.
Нормальные колебания молекул. Молекула, состоящая из N атомов, обладает ЗЫ степенями свободы движения. Из них 3 степени свободы приходятся на поступательное движение молекулы, а остальные ЗЛ — 3—на ее вращение и колебание. Число вращательных и колебательных степеней свободы определяется геометрией молекулы. Линейная молекула имеет ЗЫ — 5 колебательных степеней свободы, нелинейная ЗЫ — 6. [c.221]
XV-31. Сделайте серию эскизов, представляющих все возможные колебания молекулы двуокиси углерода (молекула линейная), и укажите, какие из этих колебаний будут активны в инфракрасной области. [c.162]
Если молекула линейная, то доводы очень просты. В трех измерениях отличие значительно, потому что когда молекула линейная, одна вращательная степень свободы переходит в колебательную. Однако в данном случае эта степень свободы будет соответствовать движению из плоскости и, следовательно, будет отсутствовать. [c.416]
В молекулах Ь1Н, НР у атомов щелочного металла и атомов галогена только по одной орбитали, участвующей в образовании химической
Химическая связь и строение молекул | Задания 61
Механизм образования ковалентной связи
Ковалентная связь. Строение молекулы воды
Задание 61.
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
Решение:
Связь, осуществляемая за счёт образования электронных пар, в одинаковой мере принадлежащей обоим атомам, называется ковалентной неполярной. Ковалентные связи определённым образом ориентированы в пространстве, т. е. имеют направленность. Причина того, что молекулы могут иметь линейное плоское или какое-либо другое строение, заключается в использовании атомами для образования связей разные орбитали и разное их количество. Молекулы, которые имеют дипольный момент, не являются линейными, а молекулы, у которых нет дипольного момента – линейные.
Молекула воды Н2О имеет дипольный момент, значит, она имеет нелинейное строение. В образовании связей между атомами кислорода и водорода участвуют один атом кислорода и два атома водорода. Кислород – цейтральный атом в молекуле воды, и он имеет четыре электронные пары, две пары неподелённые и две – поделённые, которые образованы одним s-электроном и одним р-электроном кислорода. Такая молекула имеет тетраэдрическое строение в центре тетраэдра находится атом кислорода, а по углам тетраэдра два атома водорода и две неподелённые электронные пары кислорода. В такой молекуле угол между связями должен быть равен 109,50. Если бы молекула воды была плоская, то угол НОН должен быть 900. Но рентгеноструктурный анализ молекул воды показывает, что угол НОН равен 104,50. Это объясняет, что молекула воды имеет не линейное форму, а имеет форму искажённого тетраэдра. Объясняется это тем, что атом кислорода претерпевает sp3— гибридизацию, когда одна s-орбиталь и три р-орбитали атома кислорода гибридизируются, образуя четыре равноценные sp3-гибридные орбитали. Из четырёх sp3-гибридных орбиталей две заняты s-орбиталями атома водорода. Разница между значениями валентного угла и тетраэдрическим углом объясняется тем, что отталкивание между неподелёнными электронными парами больше, чем между связывающими.
Полярная ковалентная связь
Задание 62.
Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов определите, какая из связей: HCl, IСl, ВгF наиболее полярна.
Решение:
Ковалентная связь, которая образована разными атомами, называется полярной. Например, H — Cl; центр тяжести отрицательного заряда (связанного с электронами) не совпадает с центром тяжести положительного заряда (связанного с зарядом ядра атома). Электронная плотность общих электронов смещена к одному из атомов, имеющего большее значение электроотрицательности, в большей степени. В H : Cl общая электронная пара смещена в сторону наиболее электроотрицательного атома хлора. Полярность связи количественно оценивается дипольным моментом (), который является произведением длины диполя (l) – расстояния между двумя равными по величине и противоположными по знаку зарядами +g и –g на абсолютную величину заряда: = lg. Дипольные моменты НСI, НВг, НI равны, соответственно 1,04; 0,79; 0,38 D. Дипольные моменты молекул обычно измеряют в дебаях (D)* : 1D = 3,33 . 10-30 Кл .м.
Дипольный момент — величина векторная и направлен по оси диполя от отрицательного заряда к положительному. Дипольный момент связи даёт ценную информацию о поведении молекулы в целом. Наряду с дипольным моментом , для оценки степени полярности связи используют характеристику, называемую электроотрицательностью элемента (ЭО). ЭО – это способность атома притягивать к себе валентные электроны других атомов. Значения ЭО элементов приведены в специальных шкалах (таблицах).
Значения ЭО водорода, хлора, брома, йода, фтора соответственно равны: 2,1; 3,0; 2,8; 2,5; 4,0. Исходя из значений ЭО элементов в соединениях
наиболее полярная связь в молекуле ВгF, так как разница электроотрицательностей между фтором и бромом наибольшая – 1,2 (4,0 – 2,8 = 1,2), чем у HCl и IСl.
Донорно-акцепторная связь
Задание 63.
Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и BF4-? Укажите донор и акцептор.
Решение:
Донорно-акцепторная связь – это ковалентная связь, в которой обобществлённую пару электронов предоставляет только один из участвующих в связи атомов. При этом один из атомов является донором – поставщиком электронной пары, а другой – акцептором – поставщиком свободной квантовой орбитали.
Катион аммония NH4+ образуется по донорно-акцепторному механизму:
Он имеет форму правильного тетраэдра:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи H — N, образованные по различным механизмам, никаких различий не имеют, т. е. все они равноценны. Донором является атом азота, а акцептором – атом водорода.
Ион BF4- образуется из BF3 и иона F-. Этот ион образуется за счёт того, что неподелённая электронная пара иона F- «встраивается» в валентную оболочку атома бора ковалентносвязанной молекулы BF3:
В ионе BF4- донором является ион фтора, а акцептором атом бора молекулы BF3.
Донорно-акцепторная связь в структурных формулах изображается стрелкой которая направлена от донора к акцептору.
Метод валентных связей (ВС)
Задание 64.
Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеCl2 и тетраэдрическое СН4?
Решение
а) Представления метода валентных связей позволяют объяснить геометрию многих молекул. Так молекула BeCl2 состоит из одного атома бериллия и двух атомов хлора. Атом бериллия в возбуждённом состоянии имеет один s-электрон и один р-электрон. При образовании BeCl2 возникают две ковалентные связи. Одна из них должна быть s — p связью, образованная за счёт перекрывания s-облака атома бериллия и р-облака атома хлора, другая (р — р связь) за счёт перекрывания р-облака атома бериллия и р-облака атома хлора.
р — р связь и s — p могут располагаться друг относительно друга под углом, т. е. молекула BeCl2 должна быть угловой, но точно установлено, что молекула BeCl2 имеет линейное строение, причём обе — связи равны по энергии и по длине. Для объяснения геометрии молекулы BeCl2 привлекается концепция гибридизации атомных орбиталей. Суть концепции атомных орбиталей заключается в том, что атомные орбитали могут геометрически видоизменяться и смешиваться друг с другом таким образом, чтобы обеспечить наибольшее перекрывание с орбиталями других атомов и, следовательно, наибольший выигрыш в энергии. Это достигается в том случае, если вместо орбиталей, имеющих разные форму и энергию, появляются одинаковые по форме и энергии гибридные орбитали, представляющие собой линейные комбинации исходных атомных орбиталей. Так в атоме Ве s-орбиталь и р-орбиталь вступают во взаимодействие, их энергии выравниваются и образуются две одинаковые по форме sp-гибридные орбитали. Два образовавшихся sp-гибридных электронных облака имеют одинаковую энергию и ассиметричную форму, которая обеспечивает большее перекрывание р-электронными облаками атома хлора, чем перекрывание с участием чистых негибридизированных s- и р-облаков. Два гибридных sp-облака располагаются относительно друг друга и ядра атома под углом 1800:
Рис. 1. Трёхатомная молекула BeCl2
В результате такого расположения гибридных облаков молекула BeCl2 имеет линейное строение.
б) Молекула СН4 состоит из одного атома углерода и четырёх атомов водорода, между которыми возникают четыре ковалентные связи. Атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, один из них на s-орбитали и три на р-орбиталях:
Заполнение внешнего энергетического уровня атома углерода в основном состоянии:
Заполнение внешнего энергетического уровня атома углерода в возбуждённом состоянии:
Из четырёх связей в молекуле СН4 должны быть одна s — s и три s — p связи, образованные за счёт перекрывания орбиталей атома углерода с s-орбиталью атомов водорода. В результате этого перекрывания должна образоваться связь s — s, отличная от трёх s — p связей длиной и энергией и, расположенная к любой из них под углом около 1250. Однако точно установлено, что молекула СН4 имеет форму тетраэдра с углом между связями 109,50, причём все связи равноценны по длине и энергии. Объяснить тетраэдрическое строение молекулы СН4 можно sp3-гибридизацией. Атом углерода содержит четыре sp3-гибридные орбитали, образующиеся в результате линейной комбинации s-орбитали и трёх p-орбиталей. Четыре sp3-гибридные орбитали располагаются друг относительно друга под углом 109,50. Они направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода (рис. 2.).
Рис. 2. Схема строения молекулы СН4;
Метан, несвязывающих электронных пар нет.
Таким образом, в молекуле СН4 образуются четыре равноценные химические -связи за счёт перекрывания sp3-гибридных орбиталей атома углерода с s-орбиталями атомов углерода.
Образование сигма-связи и пи-связи
Задание 65.
Какую ковалентную связь называют -связью и какую -связью? Разберите на примере строения молекулы азота.
Решение:
Связь, образующаяся за счёт перекрывания вдоль линии, соединяющей два атома, называют -связью (любая простая связь) или «Если перекрывание атомных орбиталей происходит на межъядерной оси, то образуется сигма-связь ( -связь). Сигма-связь образуется за счёт перекрывания двух s-орбиталей (s — s связь), одной s- и одной р-орбиталью (s — p связь), двумя р-орбиталями (р — р связь), одной s- и одной d-орбиталью (s — d связь), одной p- и одной d-орбиталью (p — d связь).
Варианты перекрывания атомных орбиталей, приводящие к образованию -связи (рис.1.):
Рис. 1.Схемы образования -связей
Связь, образованная за счёт перекрывания атомных орбиталей по обе стороны от межъядерной оси, называется -связью. Вариантов образования -связи немного (рис. 2.):
Рис. 1.Схемы образования -связей
Она не так прочна как сигма-связь, поскольку перекрывание в -связи намного слабее. -связи никогда не образуются , если нет -связи. Иными словами, -связи могут быть лишь в молекулах с двойными и тройными связями. Например, в молекуле N2 тройная связь включает одну -связь и две -связи: . Атом азота на внешнем энергетическом уровне содержит пять электронов: два на s-орбитали и три неспаренных электрона на р-орбиталях. За счёт перекрывания р-электрона одного атома и р-электрона другого атома азота образуется
-связь. Две другие связи являются -связями, которые образовались за счёт перекрывания двух р-электронов одного атома и двух р-электронов другого ниже и выше и перпендикулярно друг другу по отношению плоскости -связи.
1.3 Углы между связями и форма молекул
В молекулах на валентных уровнях атомов электроны располагаются парами. Расположение соседних атомов вокруг каждого атома в молекуле обусловливается количеством электронных пар на его внешнем уровне. Во внимание принимаются пары лишь одинарных связей и свободные электронные пары.
Пары электронов отталкиваются друг от друга и поэтому они располагаются так, чтобы уменьшить это отталкивание, что достигается максимально возможным удалением их друг от друга.
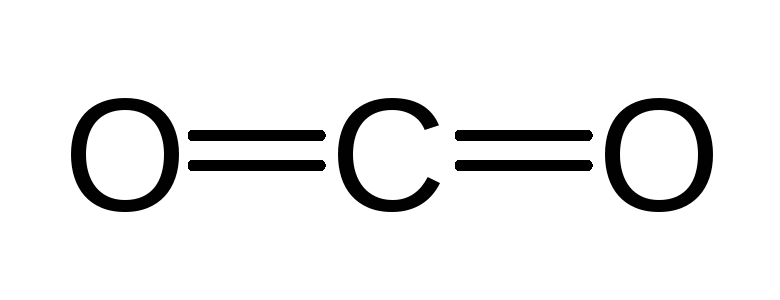
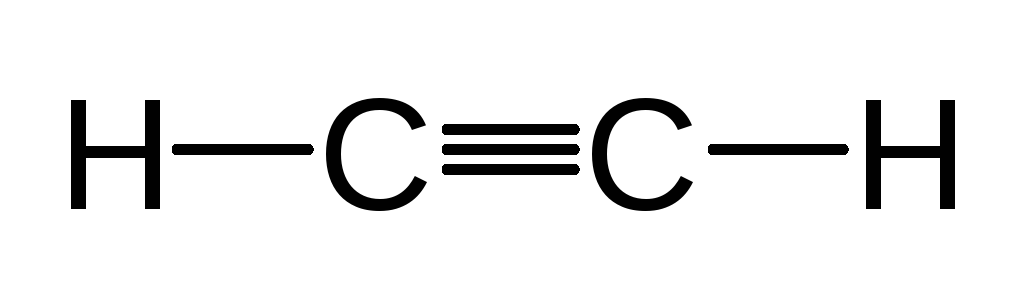
Чтобы находиться как можно дальше друг от друга две электронные пары должны располагаться под углом 180о, т.е. находятся на одной прямой по разные стороны от ядра. Линейное строение имеют молекулы диоксида углерода и ацетилена
Три пары электронов должны располагаться вокруг центрального атома под углом 120о. Плоское треугольное строение с углом между связями около 120о имеют молекулы этена (этилена) и метаналя (формальдегида) и изоэлектронные им молекулы.
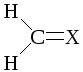
Системы с одинаковым количеством электронных пар у атомов называют изоэлектронными. Изоэлектронные системы имеют сходную геометрию и сходные химические свойства.
Четыре пары электронов должны образовывать между собой угол 109,5 о. Наиболее характерными примерами тетраэдрических структур являются молекулы метана, аммиака и воды.
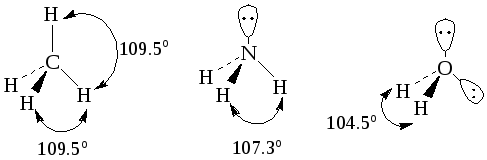
Электронные пары в аммиаке и воде не равноценны, т. к. свободные электронные пары ближе к ядрам, чем связывающие. Следствием этого является уменьшение валентных углов. В аммиаке он составляет 107,3o, а в воде — 104,5о.
Пять электронных пар располагаются вокруг центрального атома по углам тригональной бипирамиды с двумя типами валентных углов: 90 и 120о. В тригональной бипирамиде аксиальные связи длиннее экваториальных связей. Наиболее характерным примером является пентахлорид фосфора.

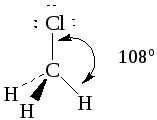
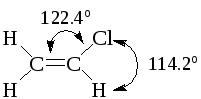
Упр. 10. Предскажите валентные углы всех связей в (a) CH3Cl, (б) H2C=CHCl,
(в) CH3-N=C=O, (г) CH3OH, (д) CH3OCH3, (е) CH3NH2, (ж) CH3NH3+, (з) CH3+,
(и) CH3.
Ответ (а) В структуре Льюиса хлорметана (метилхлорида) CH3Cl атом углерода окружен четырьмя регионами электронной плотности. Поэтому мы предсказываем для нее тетрагональное расположение атомов вокруг атома углерода и тетраэдрическую форму молекулы.
(б) В структуре Льюиса винилхлорида H2C=CHCl каждый атом углерода окружен тремя регионами электронной плотности. Поэтому мы предсказываем треугольное расположение атомов вокруг каждого атома углерода и плоскую форму молекулы.
1.4 Резонанс
Имеются молекулы и ионы, для которых можно изобразить не одну, а несколько структур Льюиса. Например, структуру этаноат-иона (ацетат-иона) нельзя описать с помощью только одной классической формулы. Атомы кислорода в ацетат-анионе эквивалентны. Иначе говоря, связи углерода с кислородом этаноат-иона не являются ни простыми, ни двойными. Их кратность представляет собой нечто среднее между простой и двойной связью (на 1/2 простой и на 1/2 двойной). Для описания строения этого аниона следует воспользоваться резонансными структурами.
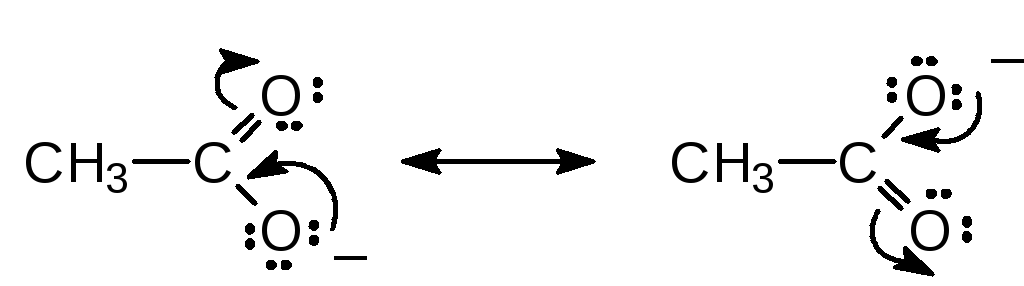
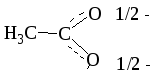
этаноат-ион (ацетат-ион) резонансный гибрид
(эквивалентный вклад каждой структуры)
В отличие от ацетат-иона вклад резонансных структур метаналя (формальдегида) не эквивалентен, т.к. они имеют разный характер.
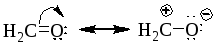
Согласно теории резонанса, в тех случаях, когда строение молекулы невозможно с достаточной степенью точности описать одной классической структурой, берут другие возможные для данной молекулы классические структуры, набор которых называется каноническим или резонансным. Наложение друг на друга (суперпозиция) резонансных структур приводит к «резонансному гибриду», который и отражает истинное электронное строение молекулы.
Иначе говоря, если ион или молекула могут быть изображены двумя или более структурами Льюиса, тогда ни одна из этих структур, не является корректным изображением молекулы и ни одна из них не соответствует ни физическим, ни химическим свойствам данной молекулы или иона. Истинное их строение может быть представлено гибридом этих структур.
Обоюдоострая стрелка между резонансными структурами означает не равновесие между ними, а только тот факт, что истинное электронное строение этой молекулы является средним между крайними структурами. Структуры не идентичны, но эквивалентны. Их отличие друг от друга состоит только в расположении электронов. Для того чтобы показать, как оно меняется, используются кривые стрелки.
Резонанс структур ведет к стабилизации основного состояния молекулы, иона или радикала. Мерой этой стабилизации служит энергия резонанса, которая тем больше, чем больше число возможных резонансных структур.
Упр. 11. Изобразите резонансные структуры для следующих молекул и ионов:
(а)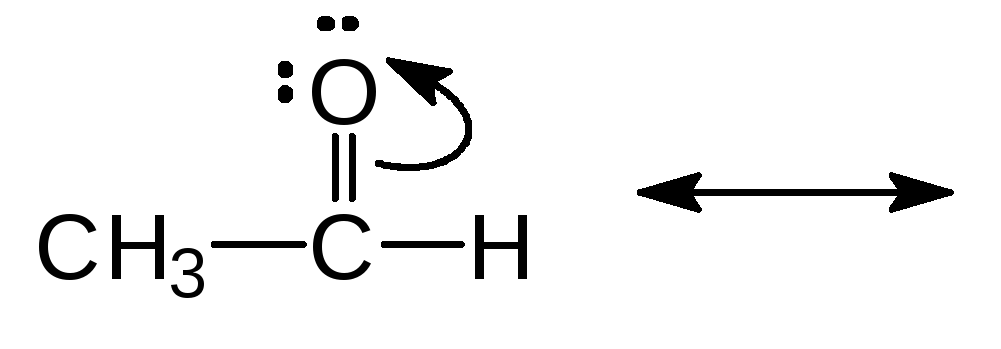 (б)
(б)  (в)
(в) 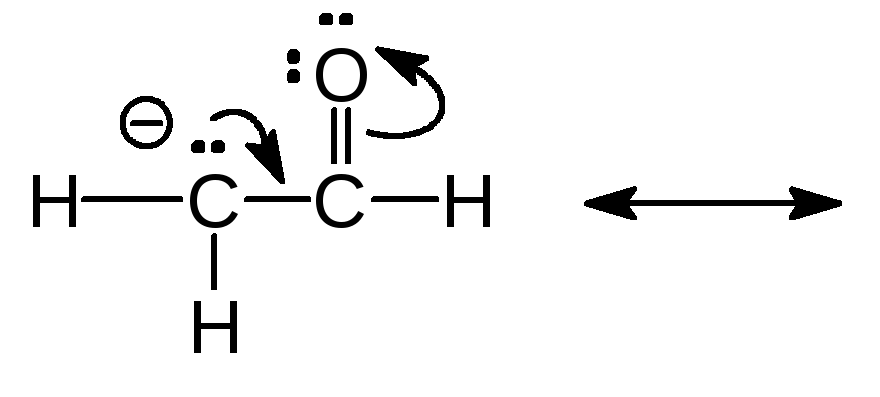
(г)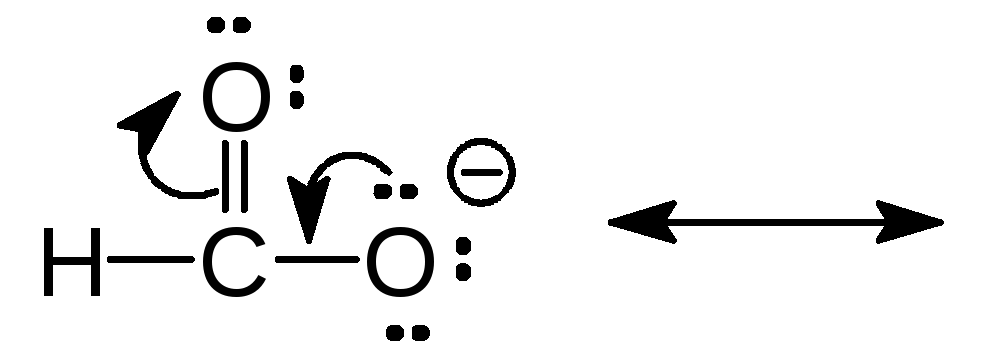 (д)
(д) 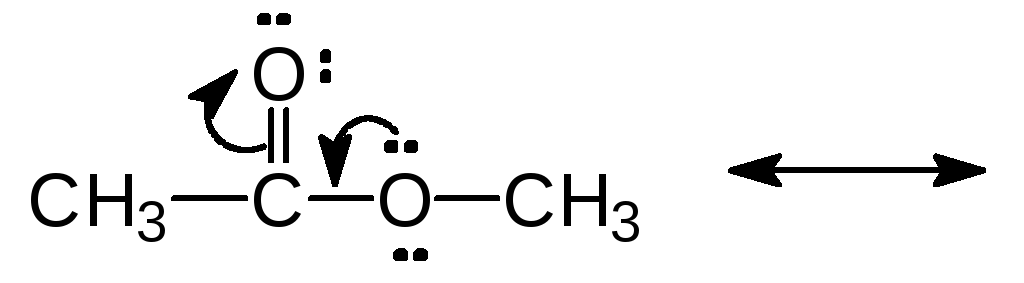 (е)
(е) 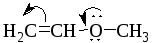
(ж) 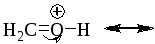 (з)
(з) (и)
(и) 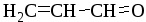
Ответ (а) 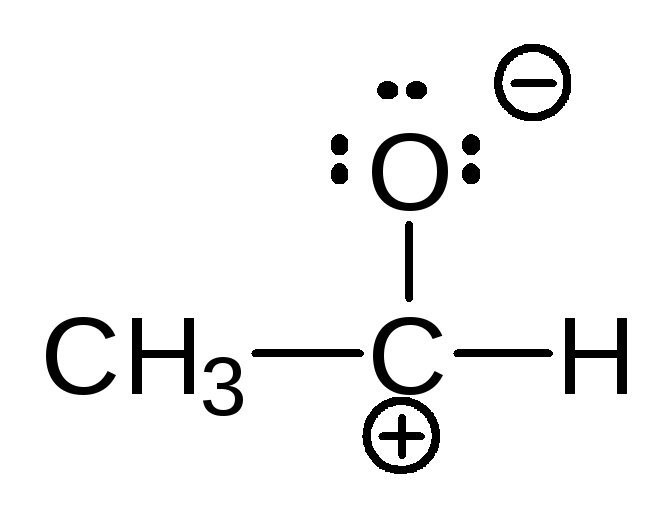 (б)
(б) 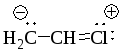 (в)
(в)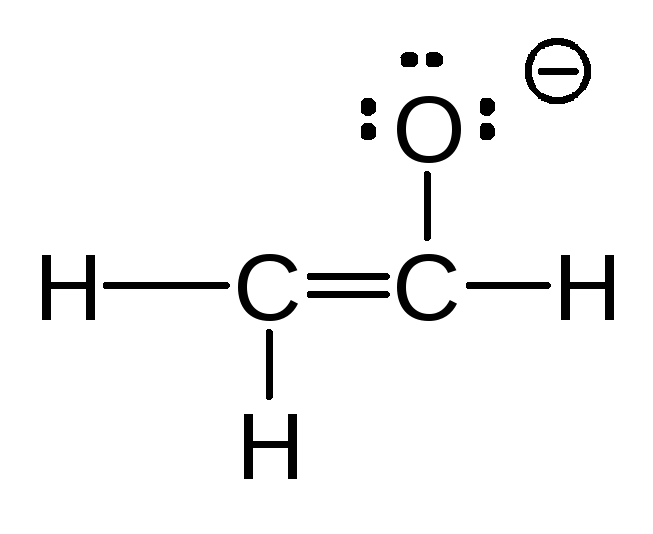 (г) ……
(г) ……
Резонансные структуры могут вносить не одинаковый вклад в гибрид.
Оценить вклад каждой структуры в гибрид можно путем учета ниже следующих факторов.
Структуры, в которых валентные уровни всех атомов насыщены, более предпочтительны, чем те, в которых у одного или двух атомов валентные уровни не насыщены.
Структуры с большим числом ковалентных связей вносят больший вклад, чем структуры с меньшим числом ковалентных связей.
Структуры с разделенными противоположными зарядами вносят меньший
вклад, чем структуры, в которых таких зарядов нет.
Структуры с отрицательным зарядом на более электроотрицательном атоме вносят больший вклад, чем структуры с отрицательным зарядом на менее электроотрицательном атоме.
Упр. 12. Оцените вклад каждой из структур:
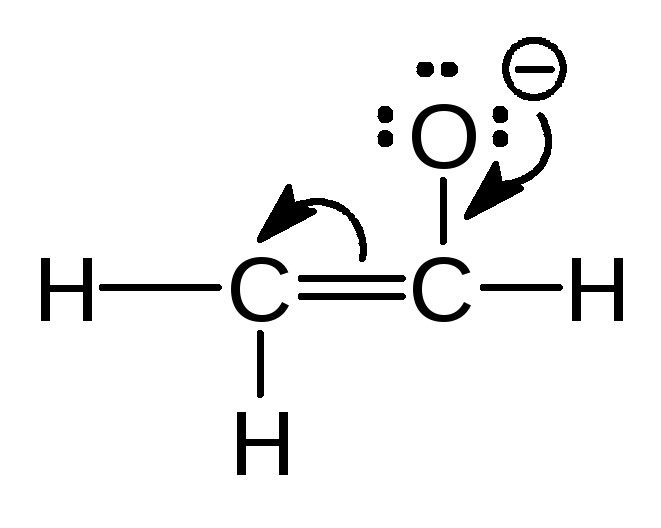
(а)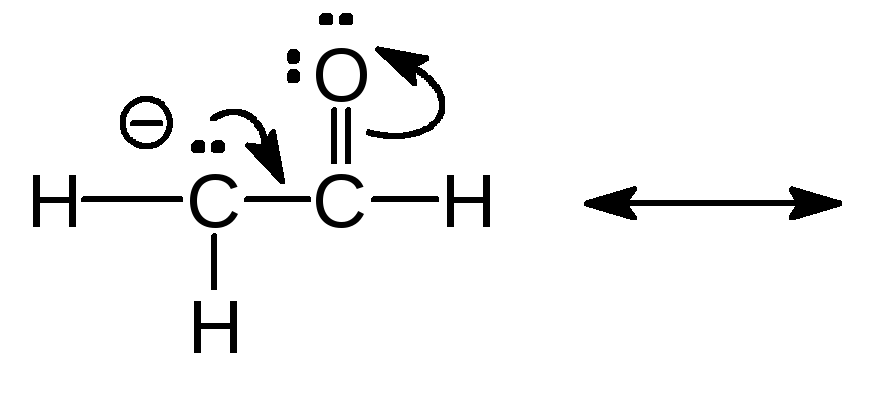
 (б)
(б)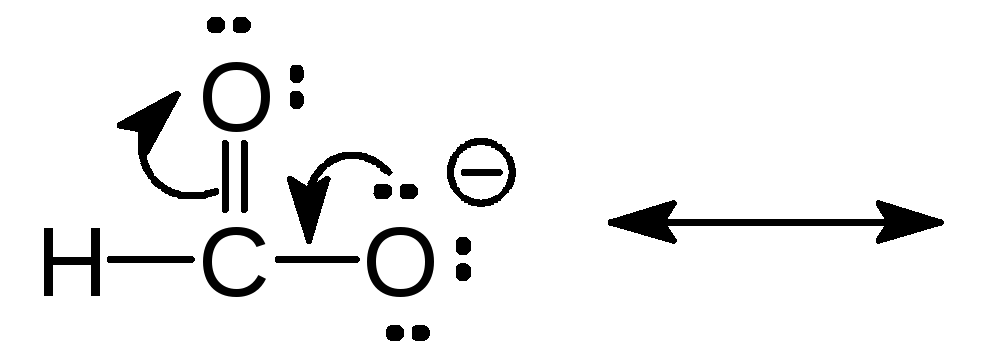
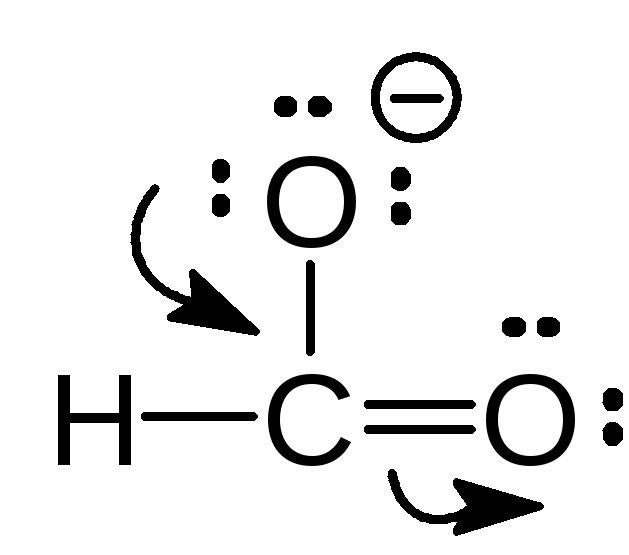
(в)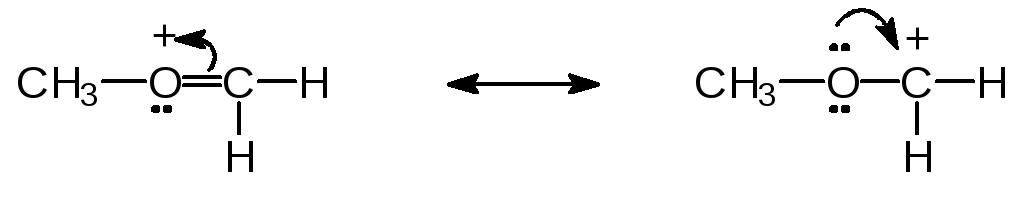
Ответ (а) Правая структура вносит больший вклад в гибрид потому, что в ней отрицательный заряд находится на более электроотрицательном атоме кислорода. (б) Структуры эквивалентны и вносят одинаковый вклад в гибрид. (в) …
Атомные и молекулярные орбитали
Отрицательно заряженные электроны располагаются вокруг положительно заряженных ядер атомов на орбиталях. Орбиталь s имеет форму шара, а p — гантели. Одна из ветвей гантели имеет положительное значение фазы, а другая — отрицательное.

S орбиталь p орбиталь
Связь между атомами возникает за счет перекрывания атомных орбиталей (АО). Чем больше это перекрывание, тем прочнее связь. Перекрываясь, АО образуют молекулярные орбитали (МО), и вся молекула рассматривается как многоядерная многоэлектронная система, в которой, как в атоме, общие для всей молекулы электроны расселяются по различным МО.
При образовании молекулы водорода из атомов по мере их сближения 1s орбитали начинают перекрываться и АО превращаются в МО молекулы водорода, по которым начинают двигаться оба электрона. На каждой молекулярной орбитали может находиться не более двух электронов и то с разными спинами (принцип Паули). В случае образования молекулы водорода комбинация двух АО дает две МО: связующую, на которой и будут располагаться оба электрона, и разрыхляющую.
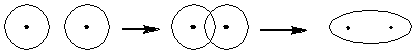
Рис. 1Перекрывание двух АО 1s с образованием связующей МО.

Рис. 2 Перекрывание двух АО 1s с образованием разрыхляющей МО.
Относительная энергия электрона на связующей МО молекулы водорода значительно меньше энергии на АО атома водорода, в то время как относительная энергия электрона на разрыхляющей МО молекулы водорода значительно больше энергии на АО атома водорода. Энергетическая диаграмма МО молекулы водорода показана на рис..3.
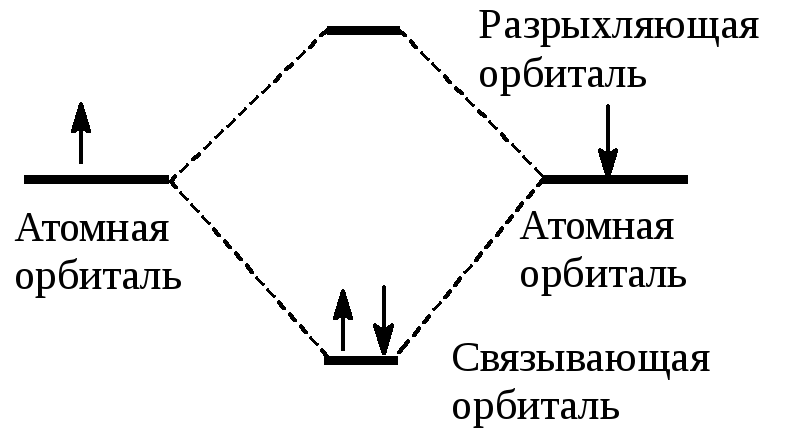
Рис. 3 Энергетическая диаграмма молекулы водорода.
Комбинация двух АО дает две МО.
p-Орбитали могут перекрываться двумя путями. Первый способ перекрывания (рис. 1.4а) осуществляется в том случае, когда оси перекрывающихся орбиталей лежат на одной прямой. При этом перекрывающиеся доли p-орбиталей должны иметь одинаковый знак. Образующаяся в этом случае связь имеет форму эллипса и называется -связью. При втором типе перекрывания (рис. 1.4б) оси p-орбиталей параллельны и образующаяся при этом МО будет состоять из двух частей — над и под плоскостью касания орбиталей. Такая МО по форме напоминает p-орбиталь, ее называют -орбиталью, а соответствующую ей связь – -связью.
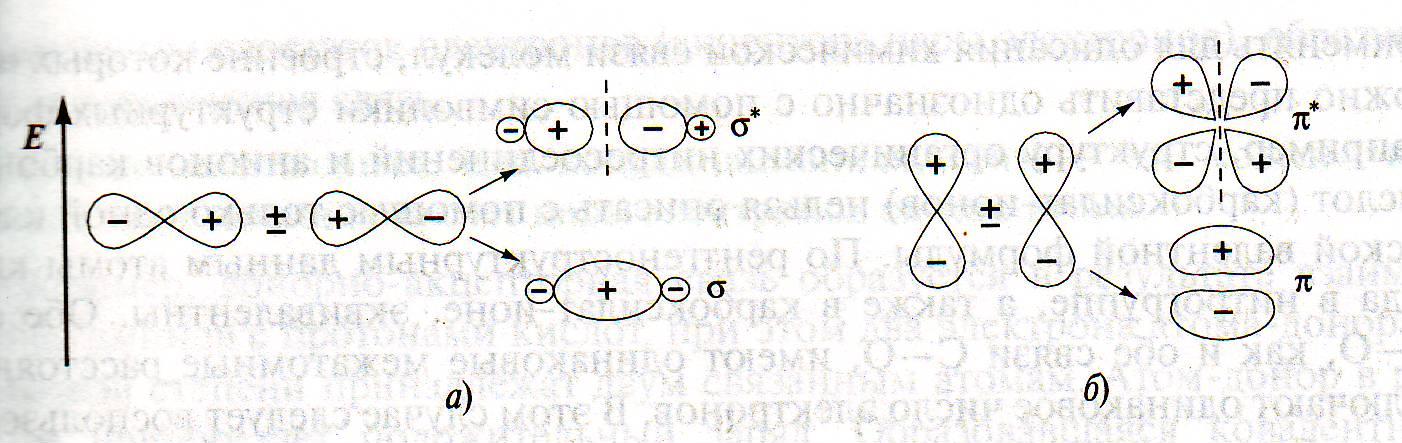
Рис. 4. Перекрывание двух АО 2p с образованием связующих а) -МО и б) -МО.
А. Гибридизация атомных орбиталей
Электронная конфигурация валентного слоя атома углерода предполагает его двухвалентность, как, например, в оксиде углерода, однако, в метане, как и в других соединениях, атом углерода образует с другими атомами четыре связи.
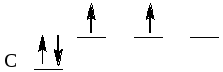
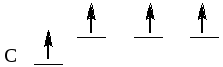
Строение молекулы ацетилена (C2h3), схема и примеры
Общие сведения о строении молекулы ацетилена
Формула C2H2. Структурная формула HC ≡ CH. Молярная масса равна 26 г/моль.
В свободном виде представляет собой газ без цвета и запаха, обладающий слабым наркотическим действием. Температура кипения равна (-84oС).
Ацетилен мало растворим в воде и очень хорошо растворим в ацетоне. В виде ацетонового раствора его хранят в стальных баллонах, заполненных каким-нибудь инертным пористым материалом. Смеси ацетилена с воздухом взрывоопасны.
Электронное строение молекулы ацетилена
Структурная формула ацетилена имеет вид HC ≡ CH. Два атома углерода, связанные тройной связью, находятся в состоянии sp-гибридизации. Каждый такой атом имеет две sp-гибридные орбитали, расположенные под углом 180o. За счет осевого перекрывания одной из этих орбиталей атом углерода образует σ-связь с другим атомом углерода, а за счет второй sp-гибридной орбитали — σ-связь с атомом водорода. σ-Скелет молекулы имеет линейное строение (рис. 1).
Рис. 1. Строение молекулы ацетилена.
Оставшиеся негибридизованными две p-орбиталикаждого атома углерода расположены под углом 90o одна к другой. При боковом перекрывании этих орбиталей с соответствующими p-орбиталями другого sp-гибридизованного атома углерода образуются две π-связи, расположенные в двух взаимно перпендикулярных плоскостях.
Таким образом, тройная связь образуется из трех пар обобществленных электронов, т.е. это шестиэлектронная связь. Она представляет собой сочетание одной σ- и двух π-связей. π-Электронное облако тройной связи имеет вид цилиндра, охватывающего оба атома углерода.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Химическая связь и строение молекул | Задания 61
Механизм образования ковалентной связи
Ковалентная связь. Строение молекулы воды
Задание 61.
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
Решение:
Связь, осуществляемая за счёт образования электронных пар, в одинаковой мере принадлежащей обоим атомам, называется ковалентной неполярной. Ковалентные связи определённым образом ориентированы в пространстве, т. е. имеют направленность. Причина того, что молекулы могут иметь линейное плоское или какое-либо другое строение, заключается в использовании атомами для образования связей разные орбитали и разное их количество. Молекулы, которые имеют дипольный момент, не являются линейными, а молекулы, у которых нет дипольного момента – линейные.
Молекула воды Н2О имеет дипольный момент, значит, она имеет нелинейное строение. В образовании связей между атомами кислорода и водорода участвуют один атом кислорода и два атома водорода. Кислород – цейтральный атом в молекуле воды, и он имеет четыре электронные пары, две пары неподелённые и две – поделённые, которые образованы одним s-электроном и одним р-электроном кислорода. Такая молекула имеет тетраэдрическое строение в центре тетраэдра находится атом кислорода, а по углам тетраэдра два атома водорода и две неподелённые электронные пары кислорода. В такой молекуле угол между связями должен быть равен 109,50. Если бы молекула воды была плоская, то угол НОН должен быть 900. Но рентгеноструктурный анализ молекул воды показывает, что угол НОН равен 104,50. Это объясняет, что молекула воды имеет не линейное форму, а имеет форму искажённого тетраэдра. Объясняется это тем, что атом кислорода претерпевает sp3— гибридизацию, когда одна s-орбиталь и три р-орбитали атома кислорода гибридизируются, образуя четыре равноценные sp3-гибридные орбитали. Из четырёх sp3-гибридных орбиталей две заняты s-орбиталями атома водорода. Разница между значениями валентного угла и тетраэдрическим углом объясняется тем, что отталкивание между неподелёнными электронными парами больше, чем между связывающими.
Полярная ковалентная связь
Задание 62.
Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов определите, какая из связей: HCl, IСl, ВгF наиболее полярна.
Решение:
Ковалентная связь, которая образована разными атомами, называется полярной. Например, H — Cl; центр тяжести отрицательного заряда (связанного с электронами) не совпадает с центром тяжести положительного заряда (связанного с зарядом ядра атома). Электронная плотность общих электронов смещена к одному из атомов, имеющего большее значение электроотрицательности, в большей степени. В H : Cl общая электронная пара смещена в сторону наиболее электроотрицательного атома хлора. Полярность связи количественно оценивается дипольным моментом (), который является произведением длины диполя (l) – расстояния между двумя равными по величине и противоположными по знаку зарядами +g и –g на абсолютную величину заряда: = lg. Дипольные моменты НСI, НВг, НI равны, соответственно 1,04; 0,79; 0,38 D. Дипольные моменты молекул обычно измеряют в дебаях (D)* : 1D = 3,33 . 10-30 Кл .м.
Дипольный момент — величина векторная и направлен по оси диполя от отрицательного заряда к положительному. Дипольный момент связи даёт ценную информацию о поведении молекулы в целом. Наряду с дипольным моментом , для оценки степени полярности связи используют характеристику, называемую электроотрицательностью элемента (ЭО). ЭО – это способность атома притягивать к себе валентные электроны других атомов. Значения ЭО элементов приведены в специальных шкалах (таблицах).
Значения ЭО водорода, хлора, брома, йода, фтора соответственно равны: 2,1; 3,0; 2,8; 2,5; 4,0. Исходя из значений ЭО элементов в соединениях
наиболее полярная связь в молекуле ВгF, так как разница электроотрицательностей между фтором и бромом наибольшая – 1,2 (4,0 – 2,8 = 1,2), чем у HCl и IСl.
Донорно-акцепторная связь
Задание 63.
Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и BF4-? Укажите донор и акцептор.
Решение:
Донорно-акцепторная связь – это ковалентная связь, в которой обобществлённую пару электронов предоставляет только один из участвующих в связи атомов. При этом один из атомов является донором – поставщиком электронной пары, а другой – акцептором – поставщиком свободной квантовой орбитали.
Катион аммония NH4+ образуется по донорно-акцепторному механизму:
Он имеет форму правильного тетраэдра:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи H — N, образованные по различным механизмам, никаких различий не имеют, т. е. все они равноценны. Донором является атом азота, а акцептором – атом водорода.
Ион BF4- образуется из BF3 и иона F-. Этот ион образуется за счёт того, что неподелённая электронная пара иона F- «встраивается» в валентную оболочку атома бора ковалентносвязанной молекулы BF3:
В ионе BF4- донором является ион фтора, а акцептором атом бора молекулы BF3.
Донорно-акцепторная связь в структурных формулах изображается стрелкой которая направлена от донора к акцептору.
Метод валентных связей (ВС)
Задание 64.
Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеCl2 и тетраэдрическое СН4?
Решение
а) Представления метода валентных связей позволяют объяснить геометрию многих молекул. Так молекула BeCl2 состоит из одного атома бериллия и двух атомов хлора. Атом бериллия в возбуждённом состоянии имеет один s-электрон и один р-электрон. При образовании BeCl2 возникают две ковалентные связи. Одна из них должна быть s — p связью, образованная за счёт перекрывания s-облака атома бериллия и р-облака атома хлора, другая (р — р связь) за счёт перекрывания р-облака атома бериллия и р-облака атома хлора.
р — р связь и s — p могут располагаться друг относительно друга под углом, т. е. молекула BeCl2 должна быть угловой, но точно установлено, что молекула BeCl2 имеет линейное строение, причём обе — связи равны по энергии и по длине. Для объяснения геометрии молекулы BeCl2 привлекается концепция гибридизации атомных орбиталей. Суть концепции атомных орбиталей заключается в том, что атомные орбитали могут геометрически видоизменяться и смешиваться друг с другом таким образом, чтобы обеспечить наибольшее перекрывание с орбиталями других атомов и, следовательно, наибольший выигрыш в энергии. Это достигается в том случае, если вместо орбиталей, имеющих разные форму и энергию, появляются одинаковые по форме и энергии гибридные орбитали, представляющие собой линейные комбинации исходных атомных орбиталей. Так в атоме Ве s-орбиталь и р-орбиталь вступают во взаимодействие, их энергии выравниваются и образуются две одинаковые по форме sp-гибридные орбитали. Два образовавшихся sp-гибридных электронных облака имеют одинаковую энергию и ассиметричную форму, которая обеспечивает большее перекрывание р-электронными облаками атома хлора, чем перекрывание с участием чистых негибридизированных s- и р-облаков. Два гибридных sp-облака располагаются относительно друг друга и ядра атома под углом 1800:
Рис. 1. Трёхатомная молекула BeCl2
В результате такого расположения гибридных облаков молекула BeCl2 имеет линейное строение.
б) Молекула СН4 состоит из одного атома углерода и четырёх атомов водорода, между которыми возникают четыре ковалентные связи. Атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, один из них на s-орбитали и три на р-орбиталях:
Заполнение внешнего энергетического уровня атома углерода в основном состоянии:
Заполнение внешнего энергетического уровня атома углерода в возбуждённом состоянии:
Из четырёх связей в молекуле СН4 должны быть одна s — s и три s — p связи, образованные за счёт перекрывания орбиталей атома углерода с s-орбиталью атомов водорода. В результате этого перекрывания должна образоваться связь s — s, отличная от трёх s — p связей длиной и энергией и, расположенная к любой из них под углом около 1250. Однако точно установлено, что молекула СН4 имеет форму тетраэдра с углом между связями 109,50, причём все связи равноценны по длине и энергии. Объяснить тетраэдрическое строение молекулы СН4 можно sp3-гибридизацией. Атом углерода содержит четыре sp3-гибридные орбитали, образующиеся в результате линейной комбинации s-орбитали и трёх p-орбиталей. Четыре sp3-гибридные орбитали располагаются друг относительно друга под углом 109,50. Они направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода (рис. 2.).
Рис. 2. Схема строения молекулы СН4;
Метан, несвязывающих электронных пар нет.
Таким образом, в молекуле СН4 образуются четыре равноценные химические -связи за счёт перекрывания sp3-гибридных орбиталей атома углерода с s-орбиталями атомов углерода.
Образование сигма-связи и пи-связи
Задание 65.
Какую ковалентную связь называют -связью и какую -связью? Разберите на примере строения молекулы азота.
Решение:
Связь, образующаяся за счёт перекрывания вдоль линии, соединяющей два атома, называют -связью (любая простая связь) или «Если перекрывание атомных орбиталей происходит на межъядерной оси, то образуется сигма-связь ( -связь). Сигма-связь образуется за счёт перекрывания двух s-орбиталей (s — s связь), одной s- и одной р-орбиталью (s — p связь), двумя р-орбиталями (р — р связь), одной s- и одной d-орбиталью (s — d связь), одной p- и одной d-орбиталью (p — d связь).
Варианты перекрывания атомных орбиталей, приводящие к образованию -связи (рис.1.):
Рис. 1.Схемы образования -связей
Связь, образованная за счёт перекрывания атомных орбиталей по обе стороны от межъядерной оси, называется -связью. Вариантов образования -связи немного (рис. 2.):
Рис. 1.Схемы образования -связей
Она не так прочна как сигма-связь, поскольку перекрывание в -связи намного слабее. -связи никогда не образуются , если нет -связи. Иными словами, -связи могут быть лишь в молекулах с двойными и тройными связями. Например, в молекуле N2 тройная связь включает одну -связь и две -связи: . Атом азота на внешнем энергетическом уровне содержит пять электронов: два на s-орбитали и три неспаренных электрона на р-орбиталях. За счёт перекрывания р-электрона одного атома и р-электрона другого атома азота образуется
-связь. Две другие связи являются -связями, которые образовались за счёт перекрывания двух р-электронов одного атома и двух р-электронов другого ниже и выше и перпендикулярно друг другу по отношению плоскости -связи.
Как метод валентных связей (ВС) объясняет угловое строение молекулы h3S и линейное молекулы СО2.
Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S и линейное молекулы СО2.
Решение: Ковалентная, как и донорно-акцепторная химическая связь образуется между атомами, расположенными в пространстве друг относительно друга определенным образом – направленно. Это вызвано необходимостью наибольшего перекрывания волновых функций (атомных орбиталей) электронов, образующих связь, что должно приводить к минимальной энергии системы. По методу ВС атомная орбиталь принимает форму, позволяющую ей более полно перекрываться с орбиталью соседнего атома. Изменить свою форму атомная орбиталь может, лишь комбинируясь с другими атомными орбиталями иной симметрии этого же атома. В результате комбинации различных орбиталей (s, p, d, f и т.д.) возникают новые атомные орбитали промежуточной формы, которые называются гибридными. Получающиеся гибридные орбитали центрального атома имеют определенную направленность в пространстве. Этим и объясняется строение молекул.
16S – 1s22s22p63s23p4 p-элемент
s p d
n=3 | ↑↓ | ↑↓ | ↑ | ↑ |
|
|
|
|
|
n=2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
|
|
|
|
|
n=1 | ↑↓ |
|
|
|
|
|
|
|
|
Изменить свою «форму» атомная орбиталь может лишь комбинируясь с другими атомными орбиталями иной симметрии этого же атома. Гибридизация осуществляется при возбуждении атома, т.е. требует затрат энергии.
Возбуждения атома не происходит, поэтому в участии образования молекулы Н2S не участвуют гибридные орбитали, участвуют просто две р- орбитали; направление от ядра атома.
Угол между атомными орбиталями 900.
6С- 1s22s22р2
s p
В возбужденном состоянии:
s p
А результате:
одна s + одна p- орбиталь → две sp- гибридные орбитали,
так как центральный атом С образует две связи с кислородом. Две sp- гибридные орбитали имеют следующее направление от ядра атома:
Угол между атомными орбиталями 1800. 

