Катод — Википедия
Материал из Википедии — свободной энциклопедии
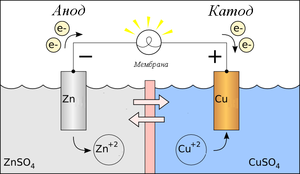 Схема гальванического элемента Даниэля-Якоби
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος — ход вниз; нисхождение) — электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии и цветной металлургии

В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют
Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «-» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления[2][3]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента, на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
См. также
Литература
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Катод — Википедия
Материал из Википедии — свободной энциклопедии

Катод (от греч. κάθοδος — ход вниз; нисхождение) — электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии и цветной металлургии

В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.

Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «-» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
См. также
Литература
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Катод какой заряд. Знаем ли мы, что такое анод
Например, при электролитическом рафинировании металлов (меди , никеля и пр.) на катоде осаждается очищенный металл.
Катод в вакуумных электронных приборах
Катод у полупроводниковых приборов
Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления , а анод — тот, где протекает процесс окисления . При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В электротехнике катод — отрицательный электрод, ток течет от анода к катоду, электроны , соответственно, наоборот.
См. также
Литература
Ссылки
- Рекомендации ИЮПАК по выбору знака для величин анодного и катодного токов
Wikimedia Foundation . 2010 .
Синонимы :Смотреть что такое «Катод» в других словарях:
— (греч. kathodos спуск). Полюс гальванической пары, противоположный аноду. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. КАТОД в гальванических элементах и вольтовом столбе отрицательный полюс, т. е. конец… … Словарь иностранных слов русского языка
катод — а, м. cathode f. <англ. cathode < гр. kathodos путь вниз, спуск. Электрод, соединенный с отрицательным полюсом источника тока (в противоположность аноду). БАС 1. В действии таких приборов, как гальваническая баттарея, полярности нет и быть… … Исторический словарь галлицизмов русского языка
катод — катод Плоская заготовка, получаемая методом электролиза, предназначенная для переплава. [ГОСТ 25501 82] катод Отрицательный электрод рентгеновской трубки [Система неразрушающего контроля. Виды (методы) и технология… … Справочник технического переводчика
— (от греч. kathodes ход вниз, возвращение; термин предложен англ. физиком М. Фарадеем в 1834), 1) отрицательный электрод электровакуумного или газоразрядного прибора, служащий источником эл нов, к рые обеспечивают проводимость межэлектродного пр… … Физическая энциклопедия
Эмиттер Словарь русских синонимов. катод сущ., кол во синонимов: 4 термокатод (1) … Словарь синонимов
КАТОД — КАТОД, электрод, соединенный с отрицательным полюсом батареи. Если в жидкость погрузить две металлические пластины, соединенные с полюсами батареи, то различие между катодом и анодом скажется в следующем: если пластины, из к рых сделаны электроды … Большая медицинская энциклопедия
катод — электровакуумного прибора; катод Электрод, основным назначением которого обычно является испускание электронов при электрическом разряде … Политехнический терминологический толковый словарь
— (от греческого kathodos ход вниз, возвращение), электрод электронного либо электротехнического прибора или устройства (например, электровакуумного прибора, гальванического элемента, электролитической ванны), характеризующийся тем, что движение… … Современная энциклопедия
— (от греч. kathodos ход вниз возвращение), в широком смысле электрод различных радио и электротехнических устройств или приборов (электронных ламп, гальванических элементов, электролитических ванн и т. д.), характеризующийся тем, что движение… … Большой Энциклопедический словарь
КАТОД, отрицательно заряженный ЭЛЕКТРОД в электролитическом элементе или ЭЛЕКТРОННОЙ ТРУБКЕ. В процессе ЭЛЕКТРОЛИЗА (где электрическая энергия используется для осуществления химических изменений) к нему притягиваются положительно заряженные ионы… … Научно-технический энциклопедический словарь
КАТОД, катода, муж. (греч. kathodos возвращение) (физ.). Отрицательный электрод; ант. анод. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
Книги
- Методы экспериментальной физики в избранных технологиях защиты природы и человека: Монография , Коржавый Алексей Павлович. В книге изложены избранные методы экспериментальной физики, созданные на основе вакуумных СВЧ-, газоразрядных лазеров и приборов отпаянного типа для защиты окружающей природной среды и…
Анод в электрохимии
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде . Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в ча
Катод — Википедия. Что такое Катод
 Схема гальванического элемента Даниэля-Якоби
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος — ход вниз; нисхождение) — электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии и цветной металлургии

В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.

Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «-» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления[2][3]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента, на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.[3][4][5].
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
См. также
Литература
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Что такое анод и катод, в чем их практическое применение
Анод и катод известны многим людям, даже тем, которые не связаны с электрикой или электроникой. Катод это электрод, имеющий отрицательный заряд, а анод заряжен положительно. Чтобы это легко и быстро запомнить, есть одно правило. В слове «катод» пять букв, также как и в слове «минус», а «анод» – четыре буквы, аналогично слову «плюс». Катоды и аноды используются для электролиза, в том числе для получения многих металлов, например алюминия. Они нашли широкое применения в современной промышленности, электроники и других сферах.
В статье будет подробно рассказано о том, что такое Анод и катод, а также для чего именно они нужны и какие физические законы за ними стоят. В качестве дополнения, настоящая статья имеет два ролика и статью, которую можно скачать по ссылке.

Анод и катод
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал.
В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность. Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы.

Химия электролиза.
Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду. У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху.
Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду. При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию). Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.

Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора.
Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс). Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. В табл. 1 даны нормальные электродные потенциалы некоторых водных растворов веществ при +25° С.
Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.

Два разнополярных электрода
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе. С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Это интересно! Все о полупроводниковых диодах.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
- Масса вещества mэ, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ: mэ = α/τ,здесь а – электрохимический эквивалент вещества, г/Кл.
- Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n: mэ= А / 96480n, здесь 96480 – число Фарадея, Кл х моль-1.
Таким образом, электрохимический эквивалент вещества α= А / 96480n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества – кулоном (ампер-секундой).
Для меди А = 63,54, n =2, α =63,54/96480-2= 0,000329 г/Кл, для никеля α =0,000304 г/Кл, для цинка α=0,00034 г/Кл. В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами. Отношение массы фактически выделившегося вещества к массе его, которая должна была бы выделиться по закону Фарадея, носит название выхода вещества по току η1.
Следовательно, для реального процесса mэ = η1 х (А / 96480n) х It. Естественно, всегда η1<1. Выход по току существенно зависит от плотности тока на электроде. С увеличением плотности тока на электроде выход по току растет и повышается эффективность процесса.
Напряжение Uэл, которое необходимо подвести к электролизеру, состоит из: напряжения разложения Ер (разность потенциалов анодной и катодной реакций), суммы анодного и катодного перенапряжений падения напряжения в электролите Еп, падения напряжения в электролите Uэ = IRэп (Rэп – сопротивление электролита), падения напряжения в шинах, контактах, электродах Uс = I(Rш+Rк+Rэ). Получаем: Uэл = Ер + Еп + Uэ + Uс.

Устройство гальванической цепи.
Мощность, потребляемая при электролизе, равна: Рэл = IUэл = I(Ер + Еп + Uэ + Uс). Из этой мощности только первая составляющая расходуется на проведение реакций, остальные являются тепловыми потерями процесса. Лишь при электролизе расплавленных солей часть теплоты, выделяющейся в электролите IUэ, используется полезно, так как расходуется на расплавление загружаемых в электролизер солей.
Эффективность работы электролизной ванны, может быть оценена массой вещества в граммах, выделяемого на 1 Дж затраченной электроэнергии. Эта величина носит название выхода вещества по энергии.Ее можно найти по выражению qэ = (αη1)/Uэл100, здесь α – электрохимический эквивалент вещества, г/Кл, η1 – выход по току, Uэл – напряжение на электролизере, В.
Определение анода и катода
Для начала возьмем очень серьезный документ, который является ЗАКОНОМ для науки, техники и, конечно, школы. Это «ГОСТ 15596-82. ИСТОЧНИКИ ТОКА ХИМИЧЕСКИЕ. Термины и определения». Там на странице 3 можно прочесть следующее: «Отрицательный электрод химического источника тока это электрод, который при разряде источника является анодом». То же самое, «Положительный электрод химического источника тока это электрод, который при разряде источника является катодом». (Термины выделены мной. БХ). Но тексты правила и ГОСТа противоречат друг-другу. В чем же дело?
Материал по теме: Как подключить конденсатор
А всё дело в том, что, например, деталь, опущенная в электролит для никелирования или для электрохимического полирования, может быть и анодом и катодом в зависимости от того наносится на нее другой слой металла или, наоборот, снимается. Электрический аккумулятор является классическим примером возобновляемого химического источника электрического тока. Он может быть в двух режимах – зарядки и разрядки. Направление электрического тока в этих разных случаях будет в самом аккумуляторе прямо противоположным, хотя полярность электродов не меняется.

В зависимости от этого назначение электродов будет разным. При зарядке положительный электрод будет принимать электрический ток, а отрицательный отпускать. При разрядке – наоборот. При отсутствии движения электрического тока разговоры об аноде и катоде бессмысленны.
«Поэтому, во избежание неясности и неопределенности, а также ради большей точности, – записал в своих исследованиях М.Фарадей в январе 1834г., – я в дальнейшем предполагаю применять термины, определение которых сейчас дам».
Каковы же причины введения новых терминов в науку Фарадеем? А вот они: «Поверхности, у которых, согласно обычной терминологии, электрический ток входит в вещество и из него выходит, являются весьма важными местами действия и их необходимо отличать от полюсов». В те времена после открытия Т. Зеебеком явления термоэлектричества имела хождение гипотеза о том, что магнетизм Земли обусловлен разностью температур полюсов и экватора, вследствие чего возникают токи вдоль экватора. Она не подтвердилась, но послужила Фарадею в качестве «естественного указателя» при создании новых терминов. Магнетизм Земли имеет такую полярность, как если бы электрический ток шел вдоль экватора по направлению кажущегося движения солнца.

Обозначение анода и катода
Фарадей записывает: «На основании этого представления мы предлагаем назвать ту поверхность, которая направлена на восток – анодом, а ту, которая направлена на запад – катодом». В основе новых терминов лежал древнегреческий язык и в переводе они значили: анод – путь (солнца) вверх, катод – путь (солнца) вниз.
В русском языке есть прекрасные термины ВОСХОД и ЗАХОД, которые легко применить для данного случая, но почему-то переводчики Фарадея этого не сделали. Мы же рекомендуем пользоваться ими, ибо в них корнем слова является ХОД и, во всяком случае, это напомнит пользователю термина, что без движения тока термин не применим. Для желающего проверить рассуждения создателя термина с помощью других правил, например правила пробочника, сообщаем, что северный магнитный полюс Земли лежит в Антарктиде, возле Южного географического полюса.
Ошибкам в применениях терминов АНОД и КАТОД нет числа. В том числе и в зарубежных справочниках и энциклопедиях. Поэтому в электрохимии пользуются другими определениями, более понятными читателю. У них анод – это электрод, где протекают окислительные процессы, а катод – это электрод, где протекают восстановительные процессы. В этой терминологии нет места электронным приборам, но при электротехнической терминологии указать анод радиолампы, например, легко. В него входит электрический ток. (Не путать с направлением электронов).

Как работает батарейка.
Основные свойства катодов
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал. Катод должен отдавать с единицы поверхности большой ток эмиссии при возможно низкой температуре нагрева и обладать большим сроком службы. Нагрев катода в электровакуумном приборе производится протекающим по нему током.
Такие термоэлектронные катоды разделяются на две основные группы:
- катоды прямого накала,
- катоды косвенного накала (подогревные).
Катоды прямого накала представляют собой металлическую нить, которая непосредственно разогревается током накала и служит для излучения электронов.Поверхность излучения катодов прямого накала невелика, поэтому от них нельзя получить большой ток эмиссии. Малая теплоемкость нити не позволяет использовать для нагрева переменный ток. Кроме того, при нагреве переменным током температура катода не постоянна во времени, а следовательно, меняется во времени и ток эмиссии.
Положительным свойством катода прямого накала является его экономичность, которая достигается благодаря малому количеству тепла, излучаемого в окружающую среду вследствие малой поверхности катода. Катоды прямого накала изготовляются из вольфрамовой и никелевой проволоки. Однако большая работа выхода (W = 4,2÷4,5 в) определяет высокую рабочую температуру катода, вследствие чего катод становится неэкономичным. Для повышения экономичности катода вольфрамовую или никелевую проволоку (керн) «активируют» — покрывают пленкой другого элемента. Такие катоды называются активированными.

Если на поверхность керна нанесена электроположительная пленка (пленка из цезия, тория или бария, имеющих меньшую работу выхода, чем материал керна), то происходит поляризация пленки: валентные электроны переходят в керн, и между положительно заряженной пленкой и керном возникает разность потенциалов, ускоряющая движение электрона при выходе его из керна.
Работа выхода катода с такой мономолекулярной электроположительной пленкой оказывается меньше работы выхода электрона как из основного металла, так и из металла пленки. При покрытии керна электроотрицательной пленкой, например кислородом, работа выхода катода увеличивается. Подогревные катоды выполняются в виде никелевых гильз, поверхность которых покрывается активным слоем металла, имеющим малую работу выхода. Внутри катода помещается подогреватель— вольфрамовая нить или спираль, подогрев которой может осуществляться как постоянным, так и переменным

Как работает гальванизация.
током.
Для изоляции подогревателя от гильзы внутренность последней покрывается алундом (Аl2O3). Подогревные катоды, благодаря их большой тепловой инерции, обычно питают переменным током, значительная поверхность гильзы обеспечивает большой эмиссионный ток. Подогревные катоды, однако, менее экономичны и разогреваются значительно дольше, чем катоды прямого накала.
Заключение
Рейтинг автора
Автор статьи
Инженер по специальности «Программное обеспечение вычислительной техники и автоматизированных систем», МИФИ, 2005–2010 гг.
Написано статей
Принцип работы анода и катода можно более подробно изучить из статьи Анод и катод в диодах. Если у вас остались вопросы, можно задать их в комментариях на сайте.
Также в нашей группе ВК можно задавать вопросы и получать на них подробные ответы от профессионалов. Для этого приглашаем читателей подписаться и вступить в группу. В завершение статьи хочу выразить благодарность источникам, откуда мы черпали информацию во время подготовки материала:
www.electricalschool.infol
www.meanders.ru
www.electrik.info
www.elel.ru
www.kristallikov.net
www.obrazovaka.ru
ПредыдущаяТеорияЧто такое индуктивность
СледующаяТеорияЗаконы Кирхгофа простыми словами: определение для электрической цепи
Катод — Википедия. Что такое Катод
 Схема гальванического элемента Даниэля-Якоби
Схема гальванического элемента Даниэля-ЯкобиКатод (от греч. κάθοδος — ход вниз; нисхождение) — электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии и цветной металлургии

В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл. Получаемый металл также именуется катодом (катод медный[1], катод никелевый, катод цинковый и т.п.) и используется для последующего изготовления металлической продукции (проволоки, фольги, порошка, изделий и пр.). Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины.
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки. Для облегчения электронной эмиссии как правило, делается с нанесением металлов с малой работой выхода электрона и дополнительно подогревается. Различают катоды прямого накала, где нить накала непосредственно является источником электронов, и косвенного, где катод подогревается через керамический изолятор.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключенный к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.

Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «-» катод — электрод, на котором происходит процесс восстановления, а «+» анод — тот, где протекает процесс окисления[2][3]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента, на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.[3][4][5].
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (Zn) — катод, положительный «+» (Cu) — анод, ток течёт от анода к катоду, электроны, соответственно, наоборот, от «−» (Zn) к «+» (Cu).
См. также
Литература
- ↑ ГОСТ 546-2001 Катоды медные. Технические условия
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ 1 2 Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Как определить катод и анод + описание
 Как определить катод и анод + описание
Как определить катод и анод + описание
Среди терминологии в сфере электрики встречаются такие понятие, как катод и анод. Это может касательно источников питания, химии, физики и гальваники. Термин может встречаться еще и в вакуумной и полупроводниковой электронике. Им можно обозначать выводы или даже контакты устройства, а еще, каким электрическим знаком они будут обладать.
В данной статье вы узнаете о том, что это такое, а еще как определить катод и анод в диоде, электролизере, у батарейки, где в них плюс, а где минус.
Гальваника и электрохимия
В сфере электрохимии есть пару основных разделов:
- Элементы гальваники – производство электрической энергии благодаря счету химической реакции. К подобным элементам можно отнести аккумуляторы и батарейки. Их также часто называют химическим токовым источником.
- Электролиз – воздействие на реакцию химического типа электрической энергией, иными словами – посредством источника питания запускается определенная реакция.
Предлагаем рассмотреть окислительно-восстановительные реакции в элементах гальванического типа, и тогда такие процессы происходят на его электродах?
 Анод – электрод, и на нем есть окислительная реакция, а именно он будет отдавать электроны. А вот электрод, на котором будет происходить окислительная реакция называется восстановлением.
Анод – электрод, и на нем есть окислительная реакция, а именно он будет отдавать электроны. А вот электрод, на котором будет происходить окислительная реакция называется восстановлением.- Катод – электрод, на котором будет протекать реакция восстановления, а именно он будет принимать электроны. Электрод, на котором будет реакция восстановления – называется окислителем.
Отсюда возникнет вопрос – где минус, а где плюс у батарейки? Исходя из определения, у гальванических элементов анод будет отдавать электроды.
Обратите внимание, что в ГОСТе 15596-82 дано официальная формулировка наименований вывод источников тока химического типа, если кратко, то плюс будет только на катоде, а минус на аноде.
В таком случае будет рассматриваться протекание электричества по проводнику внешних цепей от окислителя (то есть катода) к аноду, а именно к восстановителю. Так как электроны в цепи будут течь от минуса до плюса, а электричество наоборот, и в таком случае катод будет являться плюсом, а анод минусом. Кстати, ток всегда будет втекать в анод.
Подробности
Процесс электролиза или заряда аккумулятора
Такие процессы походи и обратные гальваническим элементам, так как тут не энергия попадает за счет реакции химического характера, а даже наоборот – химическая реакция будет происходить благодаря внешнему источнику электричества. В таком случае плюсом источника питания все еще будут называть катодом, а минус анодом. А вот контакты заряжаемого элемента гальваники или электроды электролизера уже способны носить противоположные наименования, и следует разобраться, почему.
Важно! При разряде элемента гальваники элемента анод является минусом, а катод плюсом, при зарядке все будет наоборот.
Так как ток от положительного вывода источника питания будет поступать на положительный вывод аккумулятора – последний кстати уже не сможет быть катодом. Ссылаясь на сказанное выше, можно сделать выводы, что в таком случае аккумуляторные электроды при зарядке символически меняют местами. В таком случае через электрод заряжаемого элемента гальваники, в который втекает ток электричества, называют анодом. Итак, при зарядке плюс аккумулятора станет анодом, а минус будет катодом.
Гальванотехника
 Процессы металлического осаждения в результате реакции химического типа под действием электрического тока (при процессе электролиза) называют гальванотехникой. Получается, что мир начал получать золоченные, посеребренные, хромированные или даже покрытые иными металлами украшения, а еще детали. Такой процесс применяют в роли декоративных, а еще в прикладных целях – для того, чтобы улучшать устойчивость к коррозии разных узлов и механизмов агрегатов. Метод работы действия установок для нанесения покрытия гальванического типа будет лежать в применении растворов солей элементов, которыми станут покрывать деталь, в роли электролита.
Процессы металлического осаждения в результате реакции химического типа под действием электрического тока (при процессе электролиза) называют гальванотехникой. Получается, что мир начал получать золоченные, посеребренные, хромированные или даже покрытые иными металлами украшения, а еще детали. Такой процесс применяют в роли декоративных, а еще в прикладных целях – для того, чтобы улучшать устойчивость к коррозии разных узлов и механизмов агрегатов. Метод работы действия установок для нанесения покрытия гальванического типа будет лежать в применении растворов солей элементов, которыми станут покрывать деталь, в роли электролита.
Определить, где анод, а где катод в гальванике тоже важно. Именно в этом случае анод будет являться электродом, к которому подключаются положительный вывод источника питания, а получается, катод в таком случае станет минусом. При этом металл будет осаждаться (восстанавливаться) на минусовом электроде (речь идет про реакцию восстановления). Получается, что есть вы желаете изготовить позолоченное кольцо собственноручно – подключите к нему отрицательный вывод блочка питания и поместите в емкость с требуемым растворителем.
В электронике
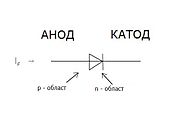
Ножки или электроды полупроводниковых, а еще вакуумных электронных устройств крайне часто называют катодом и анодом. Предлагаем рассмотреть условное обозначение графического типа полупроводникового диода по схеме. Как видите, анод у диода подключают до плюса батареи. Он так называется по той причине – в такой вывод у диода в любом случае будет втекать ток. На настоящем элементе на катоде будет маркировка в воде точки или полоски. Со светодиодом все аналогично, и на 0.5 см светодиодах внутренности видны через колбу. Та половина, что больше является катодом. Аналогичным образом будет обстоять ситуация даже с тиристором, назначение вывод и однополярное использование таких трехногих компонентов делает его управляемым диодом.
У диода вакуумного типа анод тоже обычно подключается до плюса, а катод к минусу, как изображена на схеме. Хотя при приложении напряжения обратного типа – названия элементов не поменяются, несмотря на протекание электрического тока в обратном направлении, пускай даже и незначительного. С пассивными элементами, а именно конденсаторы и резисторы, дела будут обстоять иначе. У резистора не будет выделять отдельно аноды и катоды, ток в нем может начать протекать в любом направлении. Вы сможете давать любые название для его выводов, и все зависит от ситуации, а также рассмотренной схемы. У простых неполярных конденсаторов все точно также. Реже подобное разделение по наименованиям контактов будет наблюдаться в электролитических конденсаторах.
Заключение
Итак, важно подвести итоги, отвечая на вопрос – как запомнить, где плюс, а где же минус у анода и катода? Есть удобное мнемоническое правило для электролиза, аккумуляторного заряда, гальваники и приборов полупроводникового типа. У таких слов с аналогичными наименованиями одинаковое количество букв, что показано ниже. Во всех случаях, которые перечислены выше, ток будет вытекать из катода, а втекать будет в анод. Пусть вас не сбивает с толку постоянная путаница «Почему, когда у аккумулятора при заряде катод становится отрицательным, а при обычных обстоятельствах он положительный?». Следует помнить о том, что у всех элементов электроники, а еще гальванике и электрозиров – в общем у вас энергетических потребителей анодом можно называть вывод, который подключают к плюсу. На этом отличия закончатся, и теперь вам будет проще разбираться что минус, что плюс между выводами устройств и элементов. Напоследок следует посмотреть полезные видеоролике по теме статьи. Теперь вы точно знаете, что такое катод и анод, а еще запомнить их весьма быстро. Надеемся, эта информация была для вас интересной, а еще полезной.
Что такое катод батареи?
Катод — это вывод, через который электрический ток выходит из поляризованного электрического устройства, причем направление электрического тока противоположно направлению потока электронов. Таким образом, электроны текут вокруг катодного вывода, в то время как ток течет далеко от него.
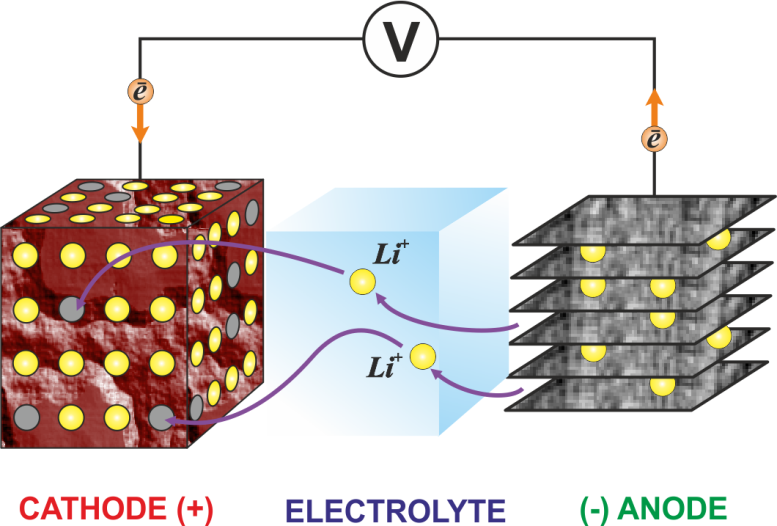
Помните, что полярность катода не всегда отрицательная и зависит от типа используемого устройства и даже может отличаться в зависимости от режима работы устройства.Например: устройство, которое потребляет энергию, имеет отрицательно заряженный катод, а устройство, которое вырабатывает энергию, имеет положительный катод. Следуя той же концепции, разряжающаяся батарея удерживает катод, который является положительным электродом, клеммой, на которой происходит электрохимическое восстановление. Электрохимическое восстановление — это химическая реакция, которая вызывает перенос электронов между молекулами. Из-за этого уменьшения, которое вызывает протекание тока, катионы (положительно заряженные ионы) из раствора электролита и электроны из цепи движутся к катоду.
Давайте обсудим эту концепцию с помощью литий-ионных аккумуляторов. Литий-ионные аккумуляторы включают в себя систему двойной интеркаляции, то есть и анод, и катод имеют структуры, которые позволяют извлекать и обратимо вводить катионы лития. На базовом уровне существуют различные материалы, которые подвергаются обратимой интеркаляции и могут служить идеальными материалами для катода батареи. Некоторые из примеров катодного материала, используемого в современных литий-ионных батареях, включают: LiCoO2, LiNi1 / 3Co1 / 3Mn1 / 3O2 (NMC), LiNi0.8Co0,15Al0,05O2 (NCA), LiFePO4 (LFP) и LiMn2O4 и их варианты (LMO), каждый из которых имеет свой набор достоинств. Выбор материала катода существенно влияет на стоимость и производительность литий-ионной батареи.
Три критерия выбора материала включают:
a) Простота и удобство обращения.
b) Материал должен быть устойчивым на воздухе при комнатной температуре.
c) Материал должен соответствовать требованиям по охране окружающей среды и токсичности.
Статьи по теме:
Клеммы аккумулятора
Анод батареи
Электролит батареи
Металлы, используемые в батарее
,Battery Building Blocks — Battery University
(Батарейный университет )Узнайте о составе трех наиболее распространенных аккумуляторов и о том, как они служат нашему обществу.
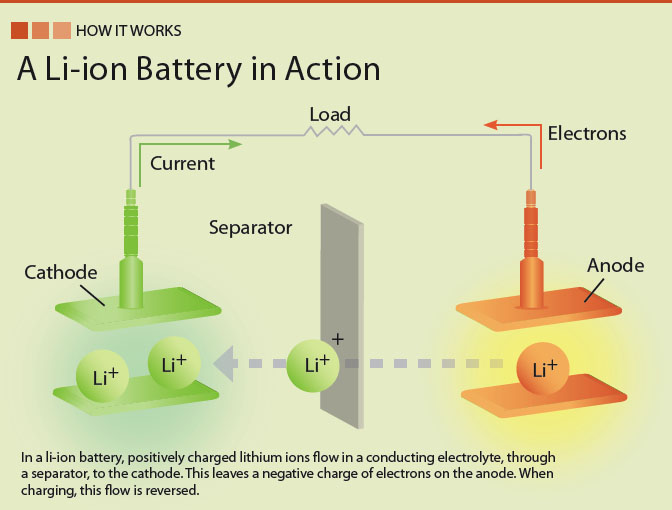
Электрохимическая батарея состоит из катода, анода и электролита, которые действуют как катализатор. При зарядке на поверхности раздела катод / электролит образуется скопление положительных ионов. Это приводит к движению электронов к катоду, создавая потенциал напряжения между катодом и анодом. Освобождение происходит путем прохождения тока от положительного катода через внешнюю нагрузку и обратно к отрицательному аноду.При зарядке ток течет в другом направлении.
Батарея имеет два отдельных пути; один представляет собой электрическую цепь, по которой протекают электроны, питая нагрузку, а другой — путь, по которому ионы перемещаются между электродами через разделитель, который действует как изолятор для электронов. Ионы — это атомы, которые потеряли или приобрели электроны и стали электрически заряженными. Сепаратор электрически изолирует электроды, но допускает движение ионов.
Анод и катод
Электрод батареи, который выделяет электроны во время разряда, называется анодом , ; Электродом, поглощающим электроны, является катод , .
Анод батареи всегда отрицательный, а катод положительный. Это, по-видимому, нарушает соглашение, поскольку анод является клеммой, на которую протекает ток. Электронная лампа, диод или аккумулятор на зарядке следуют этому порядку; однако отключение питания от батареи при разряде поворачивает анод отрицательным. Поскольку аккумулятор представляет собой электрическое накопительное устройство, обеспечивающее энергию, анод аккумулятора всегда отрицательный.
Литий-ионный анод — угольный (см. BU-204: Как работают литиевые батареи?), Но для литий-металлических батарей порядок обратный.Здесь катод — углерод, а анод — металлический литий (см. BU-212: Батареи будущего). За некоторыми исключениями, литий-металлические батареи не подлежат перезарядке.
| Символ батареи Катод батареи положительный; анод отрицательный. |
Таблицы 1a, b, c и d суммируют состав вторичных батарей на основе свинца, никеля и лития, включая первичные щелочные.
| Свинцово-кислотный | Катод (положительный) | Анод (отрицательный) | Электролит |
|---|---|---|---|
| Материал | Диоксид свинца (шоколадно-коричневый) | Серый свинец (при образовании губчатый) | Серная кислота |
| Полная зарядка | Оксид свинца (PbO 2 ), электроны добавлены к положительной пластине | Свинец (Pb), электроны удалены с пластины | Сильная серная кислота |
| Выпущено | Свинец превращается в сульфат свинца на отрицательном электроде, электроны перемещаются от положительной пластины к отрицательной пластине | Кислота серная слабая (водоподобная) | |
Таблица 1а: Состав л. эад. Кислоты.
| NiMH, NiCd | Катод (положительный) | Анод (отрицательный) | Электролит |
|---|---|---|---|
| Материал | Никель оксигидроксид | NiMH: водородопоглощающий сплав NiCd: кадмий | Гидроксид калия |
Таблица 1b: Состав NiMH и NiCd.
в кембриджском словаре английского языка
КАТОД | Определение в кембриджском словаре английского языка Примеры из литературы- Таким образом необходим электрический


 Анод – электрод, и на нем есть окислительная реакция, а именно он будет отдавать электроны. А вот электрод, на котором будет происходить окислительная реакция называется восстановлением.
Анод – электрод, и на нем есть окислительная реакция, а именно он будет отдавать электроны. А вот электрод, на котором будет происходить окислительная реакция называется восстановлением.