ГДЗ химия 11 класс Радецкий, дидактический материал, итоговая работа по темам 1-2-3, доп вопрос 8. Охарактеризуйте строение молекулы – Рамблер/класс
ГДЗ химия 11 класс Радецкий, дидактический материал, итоговая работа по темам 1-2-3, доп вопрос 8. Охарактеризуйте строение молекулы – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Охарактеризуйте строение молекулы воды.
ответы
2 связи ковалентные полярные, перекрывание лобовое, молекула угловая
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Юмор
Олимпиады
ЕГЭ
10 класс
похожие вопросы 5
ЕГЭ Математика 11 класс. Ященко И. В. Тренировочная работа 39 Вопрос 10 Найдите корень уравнения.
Привет пользователи! Окажите пожалуйста услугу…ответить помогите….
Найдите корень уравнения
(Подробнее…)
ЕГЭМатематикаЯщенко И.В.Семенов А.В.11 класс
Помогите решить очень нужно
Помогите
ГДЗЭкзамены
Приветики! Поможете мне с прогрессией? Раздел II. № 6.21. ГДЗ Алгебра 9 класс ОГЭ Кузнецова.
№ 6.21. ГДЗ Алгебра 9 класс ОГЭ Кузнецова.
1) Найдите сумму первых десяти членов арифмети-
ческой прогрессии, если сумма первых трех ее чле-
нов равна нулю, а сумма (Подробнее…)
Задача 4. Работа 3. Расчетные задачи. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
Помогите найти решение вот на такую задачу:
Какая масса сажи образуется при термическом разложении этана массой 90 г, если (Подробнее…)
ГДЗХимияРадецкий А.М.10 класс
Задача 16. Работа 3. Расчетные задачи. Химия. Дидактический материал. 10 класс. А.М. Радецкий ГДЗ
Горит! Спасайте! Выручите ответом на задачу.
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором (Подробнее…)
ГДЗХимияРадецкий А.М.10 класс
ГДЗ Химия 11 класc Рудзитис Г.Е. Фельдман Ф.Г. §9 Пространственное строение молекул РЕШЕБНИК ОТВЕТЫ » Крутые решение для вас от GDZ.
 cool
coolГДЗ Химия 11 класc Рудзитис Г.Е. Фельдман Ф.Г. §9 Пространственное строение молекул РЕШЕБНИК ОТВЕТЫ
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Приведите примеры образования молекул органических и неорганических веществ на основе sp-, sp2— и sp3-гибридизации.
| Вещества | Тип гибридизации | ||
| sp-гибридизация | sp2-гибридизация | sp3-гибридизация | |
| Органические | этин HC≡CH | этен CH2=CH2 формальдегид H2C=O | метан CH4 этан CH3―CH3 |
| Неорганические | фторид бериллия BeF2 оксид углерода (IV) CO2 | хлорид бора BCl3 оксид серы (IV) SO2 | вода H2O аммиак NH3 |
Задание 2
Что общего у молекул метана, аммиака и воды и чем они различаются по строению?
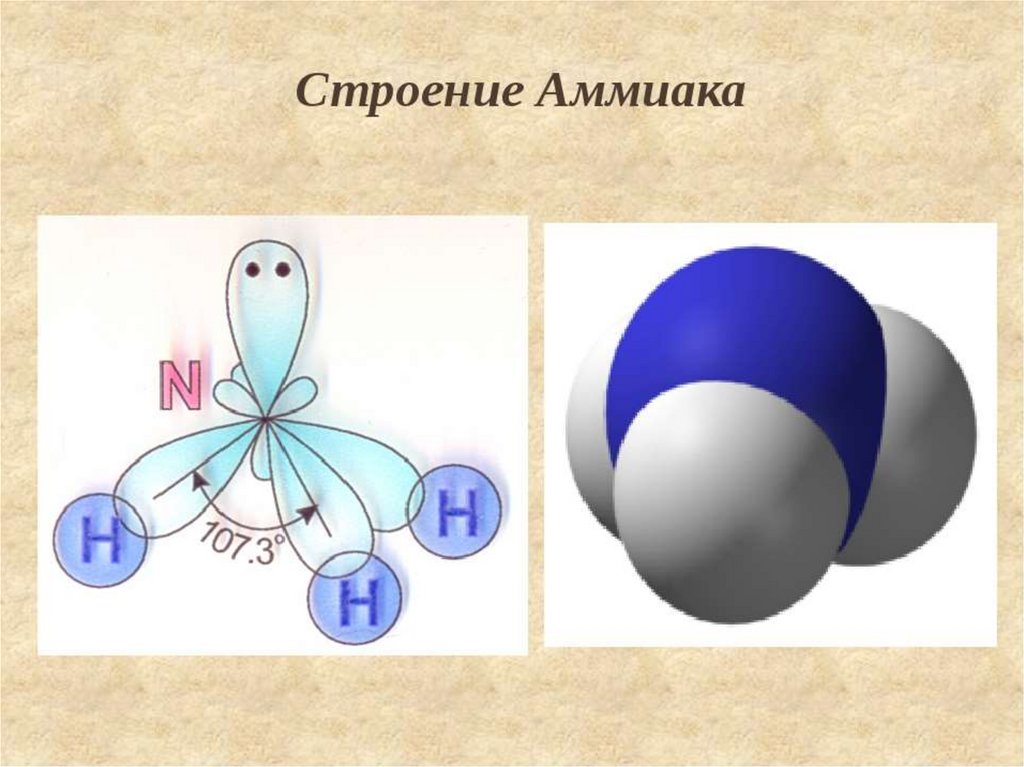
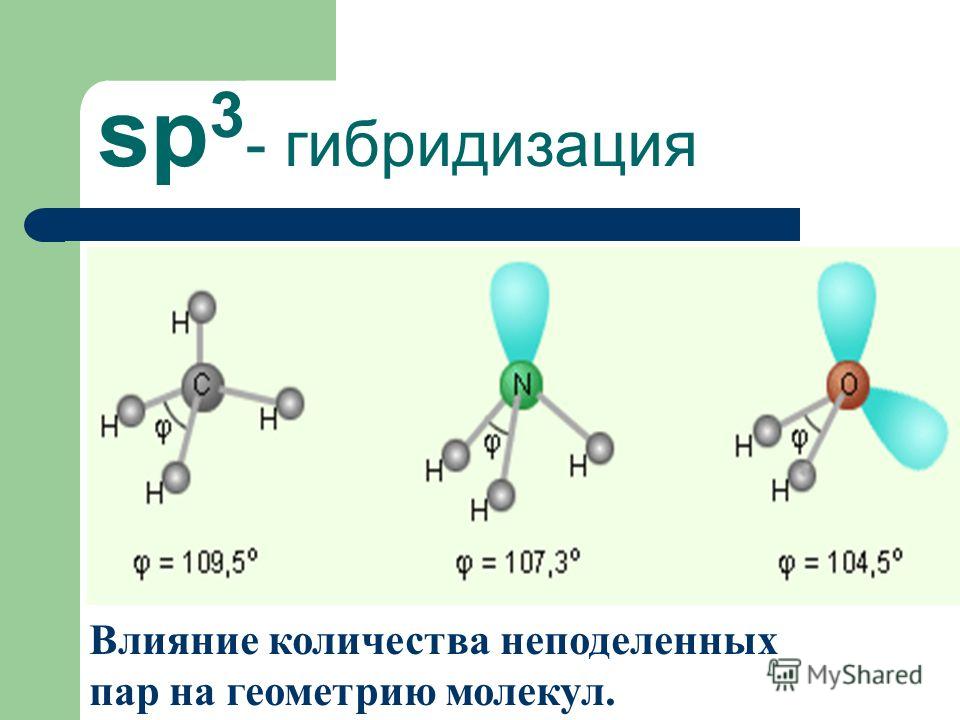
Сходство состоит в том, что в молекулах метана CH4, аммиака NH3 и воды H2O центральные атомы находятся в состоянии sp3-гибридизации.
Различие состоит в том, что в молекуле метана в образовании связей участвуют все четыре гибридные орбитали атома углерода, в молекуле аммиака ― три гибридные орбитали атома азота (четвёртая заполнена неподелённой электронной парой), в молекуле воды ― две гибридные орбитали атома кислорода (две других заполнены неподелёнными электронными парами). В молекуле метана угол между связями приблизительно равен тетраэдрическому углу (109°28). Между орбиталями, участвующими в образовании связей, и орбиталями, занятыми свободными электронными парами, действуют силы отталкивания. Так как у атома азота одна такая пара, то угол отклонения от тетраэдрического небольшой и составляет 107,3°, а в атома кислорода их уже две, поэтому угол отклонения больше и составляет 104,5°.
Задание 3
Охарактеризуйте строение молекулы воды. Укажите вид связей, их количество, полярность. Как осуществляется перекрывание электронных орбиталей при образовании связей? Какую геометрическую форму имеет молекула?
Ковалентная связь образуется за счет двух неспаренных р-электронов атома кислорода и s-электрона каждого атома водорода, связи O―H являются полярными за счет более высокой электроотрицательности кислорода.
При образовании молекулы воды происходит гибридизация орбиталей атома кислорода по типу sp3, в результате перекрывания s-орбиталей атомов водорода с sр3-гибридными орбиталями атома кислорода, угол между связями H–O–H равен 104,5°. Отклонение от тетраэдрического угла (109°28′) обусловлено действием неподелённых электронных пар: у атома кислорода связывающими электронными парами заняты только две sp3-гибридные орбитали, а две другие заполнены неподелёнными электронными парами.
Так как молекула воды имеет угловое строение и образована элементами с разной степенью электроотрицательности, то она является полярной.
Задание 4
Составьте структурную формулу четырёххлористого углерода. Определите вид химической связи в этом соединении, тип гибридизации орбиталей атома углерода и форму молекулы.
| Cтруктурная формула четырёххлористого углерода | Вид химической связи в соединении | Тип гибридизации орбиталей | Форма молекулы |
| ковалентная полярная (электронные пары смещены в сторону хлора) | sp3-гибридизация (угол между связями 109028′) | тетраэдрическая |
Задание 5
К 200 г раствора, содержащего 24% нитрата калия, добавили 800 мл воды. Определите массовую долю (в процентах) нитрата калия в полученном растворе.
Определите массовую долю (в процентах) нитрата калия в полученном растворе.
Дано: m(раствора)=200 г, V(H2O)=800 мл, ω(KNO3)=24%
Найти: ω1(KNO3)-?
Решение
1. Вычислим массу воды:
m(H2O)=ρ(H2O)•V(H2O)=1 г/мл•800 мл=800 г
2. Вычислим массу нитрата калия в начальном растворе:
m(KNO3)=(ω(KNO3)•m(раствора)):100%=(24%•200 г):100%=48 г
3. Рассчитаем массу полученного раствора:
m1(раствора)=m(раствора)+m(Н2О)=200 г + 800 г=1000 г
4. Вычислим массовую долю нитрата калия в полученном растворе:
ω1(KNO3)=(m(KNO3)/m2(раствора))•100%=(48 г : 1000 г)•100%=4,8%
Ответ: 4,8%
Тест 1
sp3-гибридизацией можно объяснить геометрическую форму молекулы
1) NH3
2) Br2 молекула линейная Br–Br
3) C2H6
4) HBr молекула линейная H–Br
Тест 2
sp2-гибридизацией можно объяснить геометрическую форму молекулы
1) C2H4
2) BBr2
3) CH4 sp3-гибридизация
4) H2O sp3-гибридизация
Тест 3
sp-гибридизацией можно объяснить геометрическую форму молекулы
1) BCl3 sp2-гибридизация
2) BeF2
3) C2H2
4) C2H6 sp3-гибридизация
Другие задания смотри здесь.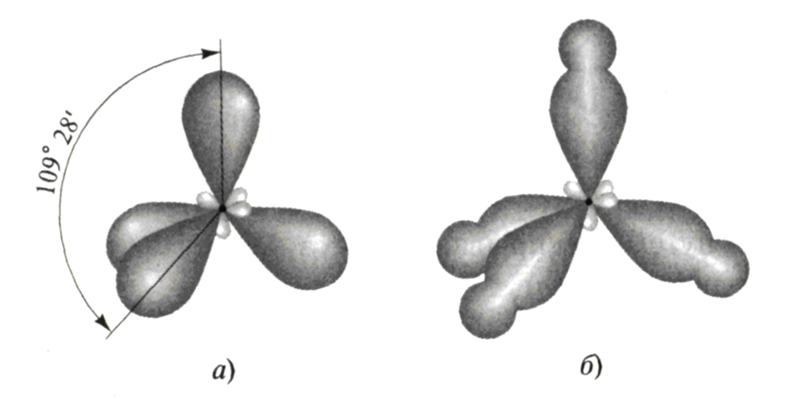 ..
..
молекулярных форм | Химия для неспециалистов |
Цели обучения
- Описать молекулы, на форму которых влияет теория VSEPR.
- Определить одиночную пару.
- Опишите, как неподеленные пары электронов влияют на геометрию молекул.
Электроскоп — это прибор, используемый для изучения заряда. Когда положительно заряженный объект (стержень) приближается к верхней стойке, электроны устремляются к верхней части банки, оставляя два золотых листа положительно заряженными. Листья отталкиваются друг от друга, так как оба держат положительные заряды. Теория VSEPR говорит, что электронные пары, а также набор одинаковых зарядов, будут отталкивать друг друга, так что форма молекулы будет регулироваться так, чтобы пары валентных электронов оставались как можно дальше друг от друга.
Центральный атом без одиноких пар
Чтобы легко понять возможные типы молекул, мы будем использовать простую систему для идентификации частей любой молекулы.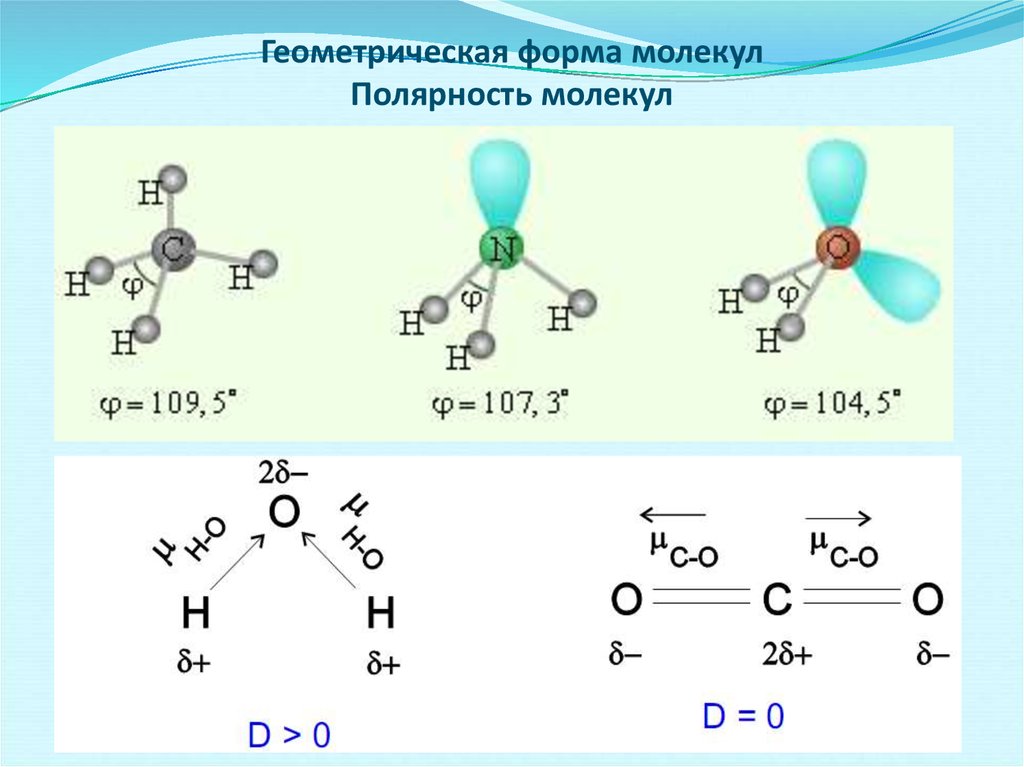
A = центральный атом в молекуле
B = атомы, окружающие центральный атом
Нижние индексы после B будут обозначать количество атомов B, которые связаны с центральным атомом A. Например, AB
AB
2 : Гидрид бериллия (BeH 2 )Гидрид бериллия состоит из центрального атома бериллия с двумя одинарными связями с атомами водорода. Напомним, что это нарушает правило октетов.
H-Be-H
В соответствии с требованием, чтобы пары электронов были максимально удалены друг от друга, две связывающие пары в молекулах BeH 2 будут располагаться прямо на противоположных сторонах центрального атома Be. Полученная геометрия представляет собой линейную молекулу, показанную на рисунке 9.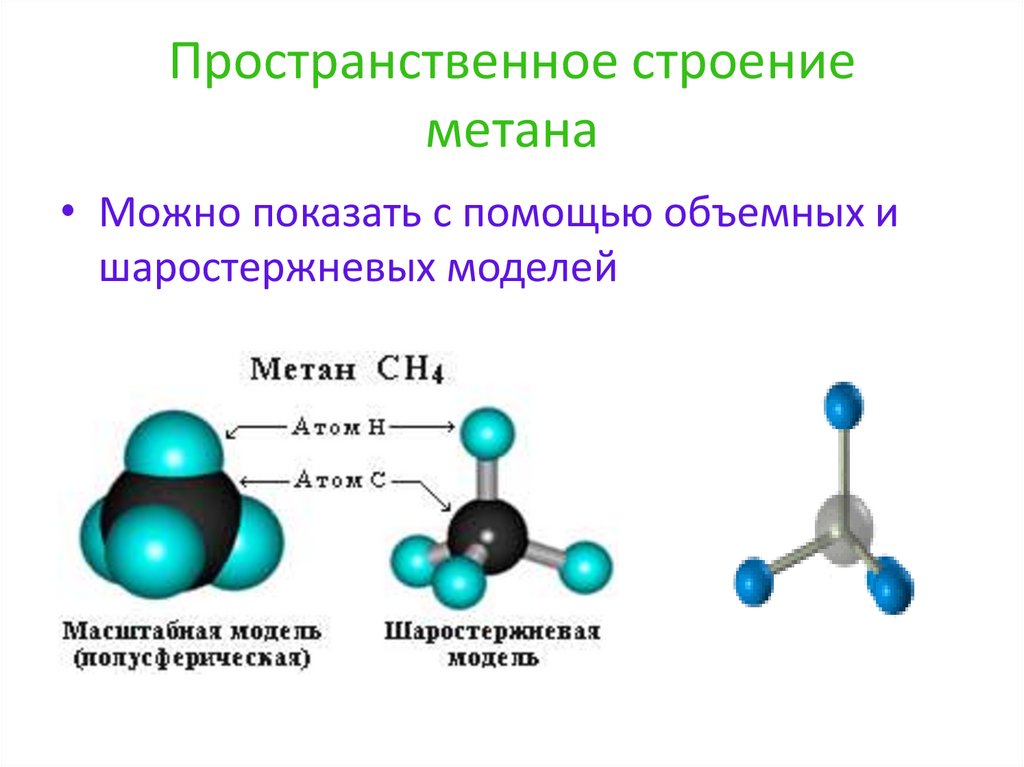
Рис. 1. Модель гидрида бериллия.
Валентный угол для H-Be-H составляет 180° из-за его линейной геометрии.
Углекислый газ является еще одним примером молекулы, подпадающей под категорию AB 2 . Его структура Льюиса состоит из двойных связей между центральным углеродом и атомами кислорода (см. Рисунок 2 ).
Рис. 2. Связывание с углекислым газом.
Отталкивание между двумя группами по четыре электрона (две пары) ничем не отличается от отталкивания двух групп по два электрона (одна пара) в BeH
Рисунок 3. Углекислый газ.
AB
3 : Трифторид бора (BF 3 ) Трифторид бора состоит из центрального атома бора с тремя одинарными связями с атомами фтора (см. Рисунок 4 ). Атом бора также имеет неполный октет.
Рисунок 4 ). Атом бора также имеет неполный октет.
Рисунок 4. Склеивание трехфтористым бором.
Геометрия молекулы BF 3 называется тригонально-плоской (см. Рисунок 5 ). Атомы фтора расположены в вершинах равностороннего треугольника. Угол F-B-F равен 120°, и все четыре атома лежат в одной плоскости.
Рисунок 5. Модель трехфтористого бора.
AB
4 : Метан (CH 4 ) Метан представляет собой органическое соединение, которое является основным компонентом природного газа. Его структура состоит из центрального атома углерода с четырьмя одинарными связями с атомами водорода (см. Рисунок 6 ). Чтобы максимально увеличить расстояние друг от друга, четыре группы связывающих электронов не лежат в одной плоскости. Вместо этого каждый из атомов водорода лежит в углах геометрической формы, называемой тетраэдром.
Рисунок 6. Тетраэдрическая структура метана.
Молекулярная геометрия молекулы метана тетраэдрическая (см. Рисунок 7 ). Валентные углы HCH составляют 109,5 °, что больше, чем 90 °, которые они имели бы, если бы молекула была плоской. При составлении структурной формулы такой молекулы, как метан, полезно иметь возможность указать трехмерный характер ее формы. Приведенная ниже структурная формула называется перспективным рисунком. Связь, обозначенная пунктирной линией, должна визуализироваться как углубляющаяся в страницу, а связь сплошным треугольником должна визуализироваться как выходящая из страницы.
Рисунок 7. Перспективная модель метана.
Как вся эта одежда может поместиться в таком маленьком пространстве? Когда мы путешествуем, мы часто берем с собой намного больше вещей, чем нам нужно.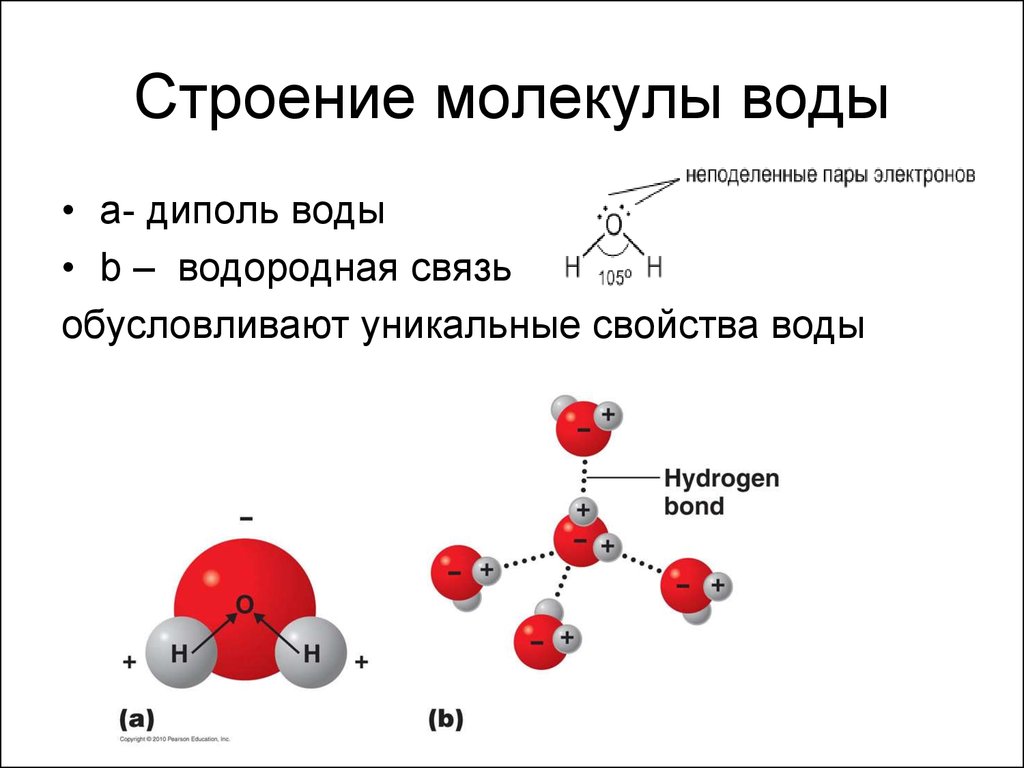
Центральный атом с одной или несколькими неподеленными парами
Молекулярная геометрия молекул изменяется, когда центральный атом имеет одну или несколько неподеленных пар электронов. Общее количество электронных пар, как связывающих, так и неподеленных пар, приводит к тому, что называется электронный домен геометрия. Когда одна или несколько связывающих пар электронов заменяются неподеленной парой, молекулярная геометрия (фактическая форма) молекулы изменяется. В соответствии с символами A и B, установленными в предыдущем разделе, мы будем использовать E для обозначения неподеленной пары на центральном атоме (A). Нижний индекс будет использоваться, когда имеется более одной одинокой пары.
АБ
3 E: Аммиак, NH 3Молекула аммиака содержит три одинарные связи и одну неподеленную пару у центрального атома азота (см. Рисунок 8 ).
Рис. 8. Электроны неподеленной пары в аммиаке.
Геометрия домена для молекулы с четырьмя электронными парами является тетраэдрической, как это было видно для CH 4 . В молекуле аммиака одна из электронных пар является неподеленной, а не связывающей парой. Молекулярная геометрия NH 3 называется тригонально-пирамидальной (см. 9).0013 Рисунок 9 ).
Рисунок 9. Молекула аммиака.
Напомним, что валентный угол в тетраэдрической молекуле CH 4 равен 109,5°. Опять же, замена одной из связанных электронных пар неподеленной парой немного сжимает угол. Угол H-N-H составляет приблизительно 107°.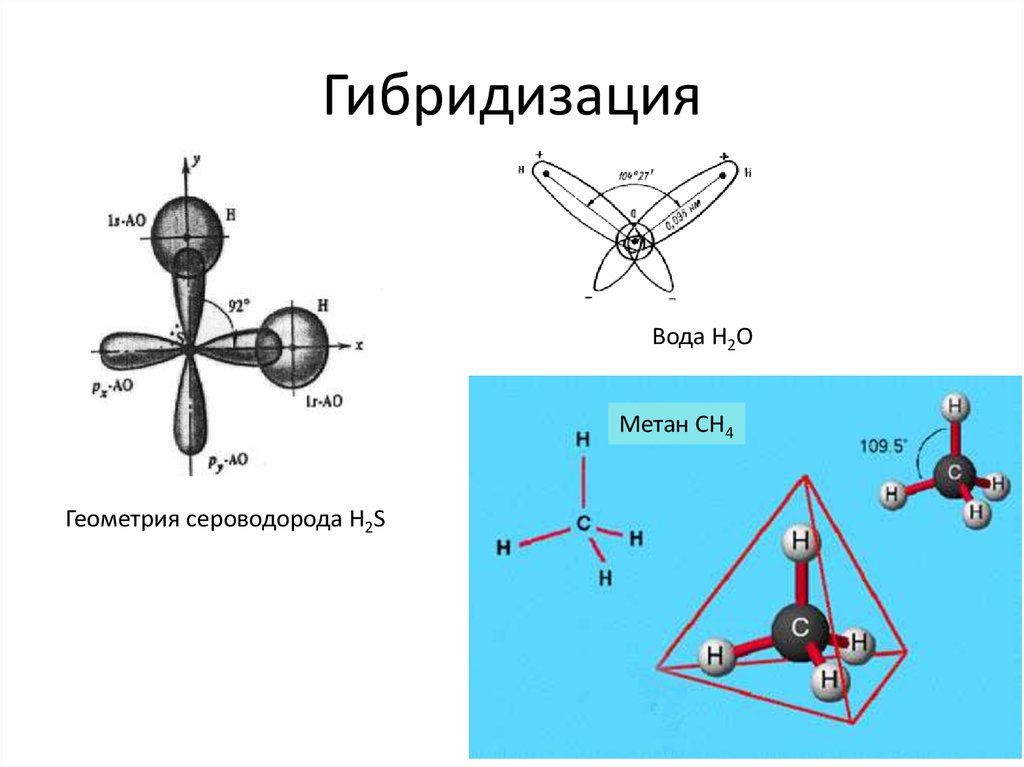
AB
2 E 2 : Вода, H 2 OМолекула воды состоит из двух связывающих пар и двух неподеленных пар (см. Рисунок 10 ).
Рисунок 10. Неподеленная пара электронов на воде.
Как и для метана и аммиака, геометрия домена для молекулы с четырьмя электронными парами является тетраэдрической. В молекуле воды две пары электронов являются неподеленными, а не связывающими парами. Молекулярная геометрия молекулы воды изогнута. Валентный угол HOH составляет 104,5°, что меньше валентного угла в NH 3 (см. , рисунок 11 ).
Рисунок 11. Молекула воды.
АВ
4 E: Тетрафторид серы, SF 4Структура Льюиса для SF 4 содержит четыре одинарные связи и неподеленную пару на атоме серы (см. Рисунок 12 ).
Рис. 12. Электроны неподеленной пары в SF 4 .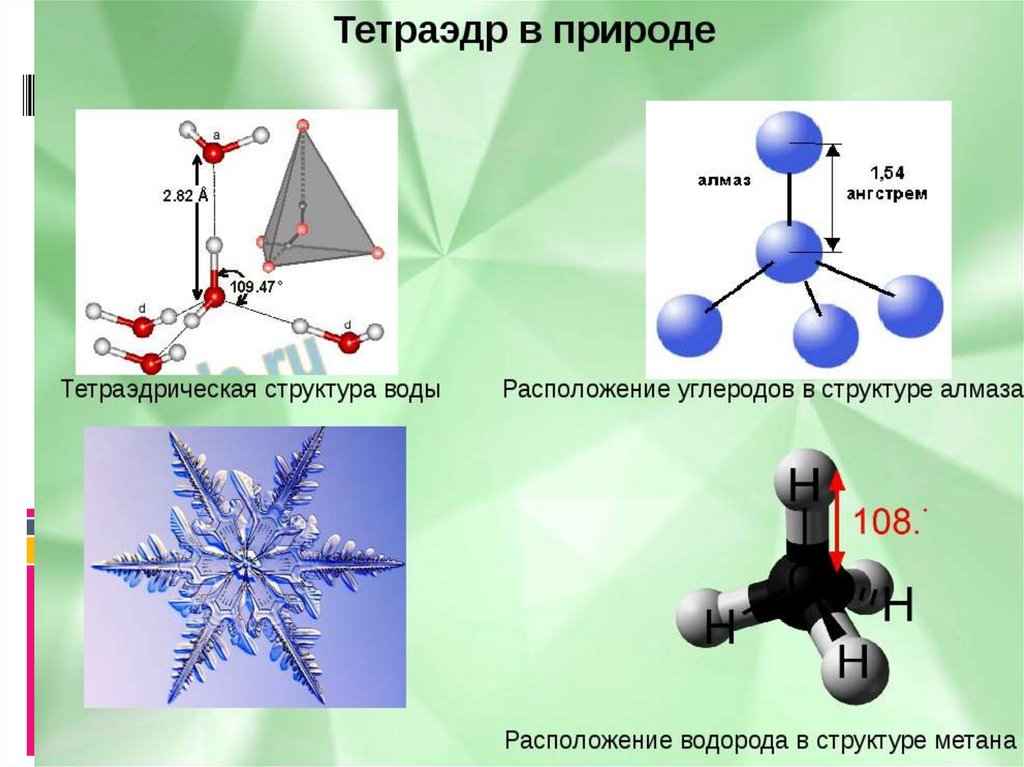
Атом серы имеет вокруг себя пять электронных групп, что соответствует геометрии тригонально-бипирамидального домена, как в PCl 5 (см. Рисунок 13 ). Напомним, что тригонально-бипирамидальная геометрия имеет три экваториальных атома и два аксиальных атома, присоединенных к центральному атому. Из-за большего отталкивания неподеленной пары один из экваториальных атомов замещается неподеленной парой. Геометрия молекулы называется искаженным тетраэдром или качелями.
Рис. 13. Модель с мячом и клюшкой для SF 4 .
| Общее количество электронных пар | Количество пар соединений | Количество одиночных пар | Геометрия электронного домена | Молекулярная геометрия | Примеры |
| 3 | 2 | 1 | треугольная планарная | изогнутый | О 3 |
| 4 | 3 | 1 | четырехгранный | треугольная пирамидальная | НХ 3 |
| 4 | 2 | 2 | четырехгранный | изогнутый | Н 2 О |
| 5 | 4 | 1 | тригонально-бипирамидальная | искаженный тетраэдр (качели) | СФ 4 |
| 5 | 3 | 2 | тригонально-бипирамидальный | Т-образный | СИФ 3 |
| 5 | 2 | 3 | тригонально-бипирамидальный | линейный | I 3 — |
| 6 | 5 | 1 | восьмигранный | квадратная пирамидальная | БрФ 5 |
| 6 | 4 | 2 | восьмигранный | квадратный плоский | ХеФ 4 |
Резюме
- Пары электронов отталкиваются друг от друга и влияют на валентные углы и форму молекул.

- Наличие неподеленной пары электронов влияет на трехмерную форму молекулы.
Практика
Центральный атом без неподеленных пар
Используйте ссылку ниже, чтобы ответить на следующие вопросы:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Какой формы PF 5 ?
- Какие углы тела C-H мы предсказали бы для метана, если бы молекула была плоской?
- Какая молекула имеет форму октаэдра?
Центральный атом с одной или несколькими неподеленными парами
Используйте ссылку ниже, чтобы ответить на следующие вопросы:
http://www.mpilkington.com/23.pdf
- Каков общий принцип работы с молекулами, содержащими более четырех электронных пар?
- Почему на рисунке с пятью электронными парами вокруг центрального атома предпочтительнее расположение справа?
- На рисунке с шестью электронными парами, почему конфигурация с неподеленными парами на 180 o относительно друг друга более стабильна?
Обзор
Центральный атом без неподеленных пар
- Каковы валентные углы в углекислом газе?
- Какая молекула имеет валентный угол 109,5°?
- Какова геометрия молекулы BF 3 ?
Центральный атом с одной или несколькими неподеленными парами
- Почему вода имеет искривленную геометрию?
- Почему аммиак не является плоской молекулой?
- Как бы мы записали конфигурацию для тетрафторида ксенона, используя систему ABE?
Глоссарий
- центральный атом: Атом, вокруг которого расположены другие атомы.

- Геометрия электронного домена: Геометрия, основанная только на количестве электронных пар вокруг центрального атома, как связывающих, так и неподеленных пар.
Показать ссылки
ссылки
- Сильванус П. Томпсон. http://commons.wikimedia.org/wiki/File:Electroscope_showing_induction.png .
- Бен Миллс (Викимедиа: Benjah-bmm27).http://commons.wikimedia.org/wiki/File:Beryllium-hydride-molecule-IR-3D-balls.png .
- Фонд CK-12 — Джой Шэн.
- Пользователь: Benji9072/Wikimedia Commons.http://commons.wikimedia.org/wiki/File:Carbon_dioxide_structure.png.
- Фонд CK-12 — Джой Шэн.
- Бен Миллс (Викимедиа: Benjah-bmm27).http://commons.wikimedia.org/wiki/File:Boron-trifluoride-3D-balls.png .
- (слева) Пирсон Скотт Форесман. http://commons.wikimedia.org/wiki/File:Tetrahedron_(PSF).png; (справа) Бен Миллс (Викимедиа: Benjah-bmm27). http://commons.wikimedia.org/wiki/Файл:Метан-CRC-MW-3D-balls.
 png.
png. - Бен Миллс (Викимедиа: Benjah-bmm27). http://commons.wikimedia.org/wiki/Файл:Метан-2D-stereo.svg.
- Highways England (Flickr: HA0478-038). https://flic.kr/p/a9VYZn.
- Фонд CK-12 — Джой Шэн.
- (слева) Пользователь: Booyabazooka/Wikimedia Commons. http://commons.wikimedia.org/wiki/File:Ammonia_lone_electron_pair.svg; (справа) Бен Миллс (Викимедиа: Benjah-bmm27). http://commons.wikimedia.org/wiki/File:Ammonia-3D-balls-A.png.
- Фонд CK-12 — Джой Шэн.
- Бен Миллс (Викимедиа: Benjah-bmm27). (Слева) http://commons.wikimedia.org/wiki/File:Water-dimensions-from-Greenwood%26Earnshaw-2D.png; (справа) http://commons.wikimedia.org/wiki/File:Water-3D-balls-A.png.
- Фонд CK-12 — Джой Шэн.
- Бен Миллс (Викимедиа: Benjah-bmm27). http://commons.wikimedia.org/wiki/File:Sulphur-tetrafluoride-3D-balls.png .
Лицензии и атрибуты
Содержимое по лицензии CC, совместно используемое ранее
- Понятия химии средний уровень.
 Автор : Calbreath, Baxter, et al. Предоставлено : CK12.org. Расположен по адресу : https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/. Лицензия : CC BY-NC: Attribution-NonCommercial
Автор : Calbreath, Baxter, et al. Предоставлено : CK12.org. Расположен по адресу : https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/. Лицензия : CC BY-NC: Attribution-NonCommercial
Какова геометрия молекул воды?[A] Искаженный тетраэдр[B] Тетраэдрический[C] Треугольный плоский[D] Диагональный
Ответ
Проверенный
231,3 тыс.+ просмотров
Подсказка: Чтобы узнать геометрию молекулы воды, попробуйте выяснить гибридизацию с помощью теории ВСЕПР. Он не имеет линейной структуры. Структура слегка изогнута из-за отталкивания неподеленных пар, а валентный угол немного меньше, чем должен быть.
Полный ответ:
Мы знаем, что молекулярная геометрия молекулы представляет собой трехмерное расположение атомов, образующих молекулу. Геометрия молекулы помогает нам понять общую форму молекулы. Это также помогает нам исследовать угол связи, длину связи, торсионные углы и другие геометрические факторы.
Это также помогает нам исследовать угол связи, длину связи, торсионные углы и другие геометрические факторы.
Согласно теории VSEPR, т.е. теории отталкивания пар электронов валентной оболочки, геометрия, гибридизация и координационное число взаимосвязаны.
Согласно этой теории, мы можем узнать геометрию молекул по количеству электронных пар, окружающих их центральный атом.
В молекулах воды, как известно, 2 атома водорода и один атом кислорода. Здесь центральным атомом является кислород. Атомный номер кислорода равен 8. Следовательно, его электронная конфигурация равна 2, 6.
Из электронной конфигурации мы можем понять, что в его валентной оболочке 6 электронов. 9{‘}}$. Следовательно, вода имеет изогнутую структуру и поэтому рассматривается как искаженный тетраэдр.
Следовательно, правильный ответ — вариант [А] Искаженный тетраэдр.
Примечание:
Хотя VSEPR довольно успешно определяет геометрию молекул, у этой теории есть определенные недостатки.



 png.
png.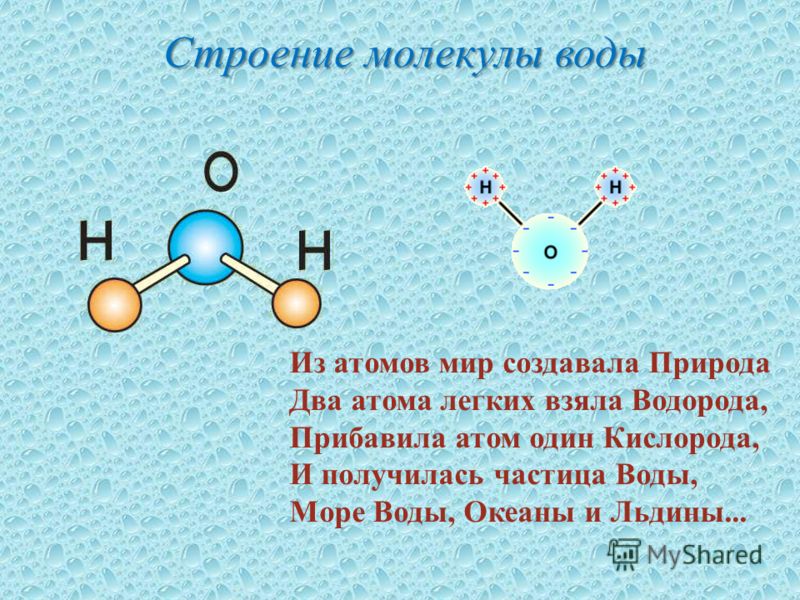 Автор : Calbreath, Baxter, et al. Предоставлено : CK12.org. Расположен по адресу : https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/. Лицензия : CC BY-NC: Attribution-NonCommercial
Автор : Calbreath, Baxter, et al. Предоставлено : CK12.org. Расположен по адресу : https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/. Лицензия : CC BY-NC: Attribution-NonCommercial