1.1. Основные виды химической связи — ЗФТШ, МФТИ
Взаимодействие валентных (наименее прочно связанных с ядром) электронов атомов приводит к образованию химических связей, т. е. к объединению атомов в молекулу. Образование молекулы из атомов возможно лишь тогда, когда оно приводит к выигрышу энергии; молекулярное состояние должно обладать меньшей энергией, чем атомное состояние, и, следовательно, быть устойчивее. Таким наиболее устойчивым является состояние атома, когда число электронов на внешнем электронном уровне максимальное, которое он может вместить; такой уровень называется завершённым и характеризуется наибольшей прочностью. Таковы электронные конфигурации атомов благородных газов. Значит, образование химической связи должно приводить к завершению внешнего электронного уровня атомов.
Это взаимодействие валентных электронов, приводящее к образованию химической связи, может осуществляться по-разному. Различают три основных вида химических связей: ковалентную, ионную и металлическую.
Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода:
`»H»+»H»=»H»_2`; `Delta»H»=-436` кДж/моль
Реакция сопровождается высвобождением большого количества тепла, значит, она энергетически выгодна.
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным `1s`-электроном. При сближении атомов до определённого расстояния происходит частичное перекрывание их электронных облаков (орбиталей).
Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов.
Химическую связь можно изобразить:
1) в виде точек, обозначающих электроны и поставленных у химического знака элемента:
`»H»* + *»H»=»H»:»H»` где `:` означает `sigma`-связь
2) с помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:
3) часто, особенно в органической химии, ковалентную связь изображают чёрточкой, которая символизирует пару электронов: `»H» — «H»`.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов или электронной пары:
:Cl·····+·Cl····: → :Cl····:Cl····::\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}\cdot+\cdot\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\;\rightarrow\;:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:
В каждом атоме хлора `7` валентных электронов, из них `6` в виде неподелённых пар, а `1` — неспаренный электрон. Образование химической связи происходит именно за счёт неспаренных электронов каждого атома хлора. Они связываются в общую пару (или неподелённую пару) электронов. Если считать, что общая пара принадлежит обоим атомам, то каждый из них становится обладателем `8` электронов, т. е. приобретает устойчивую конфигурацию благородного газа. Поэтому ясно, что молекула хлора энергетически выгоднее, чем отдельные атомы.
Это также `sigma`-связь, но она образована перекрыванием `p`-электронных орбиталей по оси `x`.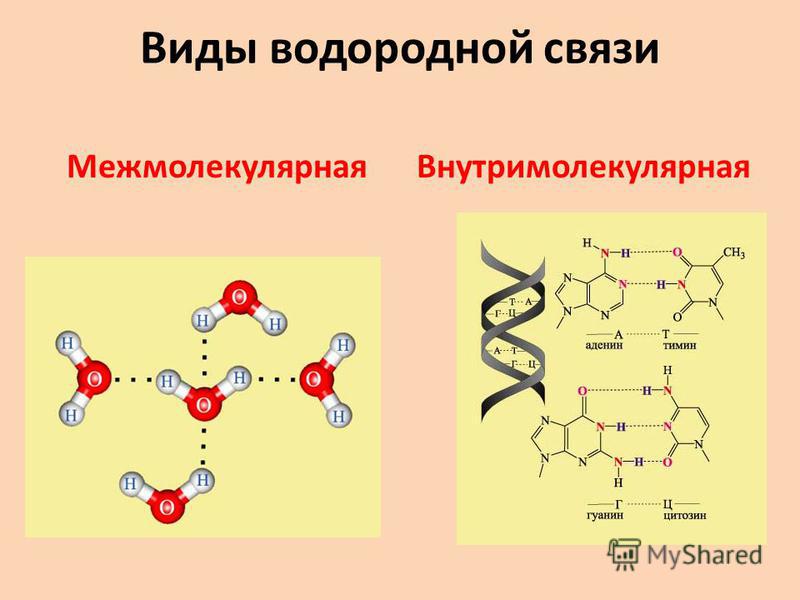
Если в реагирующих атомах имеется `2` или `3` неспаренных электрона, то могут образоваться не `1`, а `2` или `3` связи, т. е. общих электронных пары. Если между атомами возникла одна ковалентная связь, то она называется одинарной, если две — двойной, если три — тройной. Они обозначаются соответственно = или `-=` штрихами.
Но хотя обозначение их одинаково, они отличаются по своим свойствам от одинарной `sigma`-связи. Чтобы пояснить разницу, рассмотрим образование тройной связи в молекуле азота `»N»_2`. В ней атомы имеют три общие пары электронов:
:N···+·N··: → :N⋮⋮N::\overset\cdot{\underset\cdot{\mathrm N}}\cdot+\cdot\overset\cdot{\underset\cdot{\mathrm N}}:\;\rightarrow\;:\mathrm N\vdots\vdots\mathrm N:
Они образованы неспаренными `p`-электронами двух атомов азота:
Орбитали `2p`-электронов расположены взаимно перпендикулярно, т. е. по осям `x`, `y` и `z`. Если перекрывание по оси `x` ведёт к образованию `sigma`-связи (перекрывание вдоль линии, связывающей центры атомов), то перекрывание по осям `y` и `z` происходит по обе стороны линии, связывающей центры соединяющихся атомов. Такая
Такая
Очевидно, что взаимное перекрывание орбиталей в случае `pi`-связи меньше, чем в случае `sigma`-связи, поэтому `pi`-связь всегда менее прочная, чем `sigma`-связь. Но в сумме три связи `(sigma_x+pi_y+pi_z)` придают молекуле `»N»_2` большую прочность, поэтому молекула азота при нормальных условиях нереакционноспособна.
Таким образом, если имеется одинарная связь, то это обязательно `sigma`-связь; если имеется двойная или тройная связь, то одна из составляющих её связей обязательно `sigma`-связь (как более прочная она формируется первая и разрушается последняя), а остальные — `pi`-связи. И `sigma`-, и `pi`-связи — это разновидности ковалентной связи.
В общем случае
Например, полярная ковалентная связь образуется при взаимодействии атомов водорода и хлора.
H·+·Cl····: → H:Cl····:\mathrm H\cdot+\cdot\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:\;\rightarrow\;\mathrm H:\overset{\cdot\cdot}{\underset{\cdot\cdot}{\mathrm{Cl}}}:
Электронная пара смещена к атому хлора, так как относительная электроотрицательность хлора `(x=3)` больше, чем у водорода `(x=2,1)`.
У молекул, содержащих неполярную связь, связующее облако распределяется симметрично между ядрами обоих атомов, и ядра в равной степени тянут его к себе. Электрический момент диполя таких молекул (`»H»_2`, `»F»_2`, `»Cl»_2` и др.) равен нулю. Молекулы, содержащие полярную связь, образованы связующим электронным облаком, смещённым в сторону атома с большей относительной электроотрицательностью.
Описанные выше примеры образования ковалентной связи относятся к обменному механизму, когда каждый из соединяющихся в молекулу атомов предоставляет по электрону. Однако образование ковалентной связи может происходить и по донорно-акцепторному механизму. В этом случае химическая связь возникает за счёт двухэлектронного облака одного атома (спаренных электронов) и свободной орбитали другого атома. Атом, предоставляющий неподелённую пару, называется донором, а атом, принимающий её (т. е. предоставляющий свободную орбиталь) —акцептором.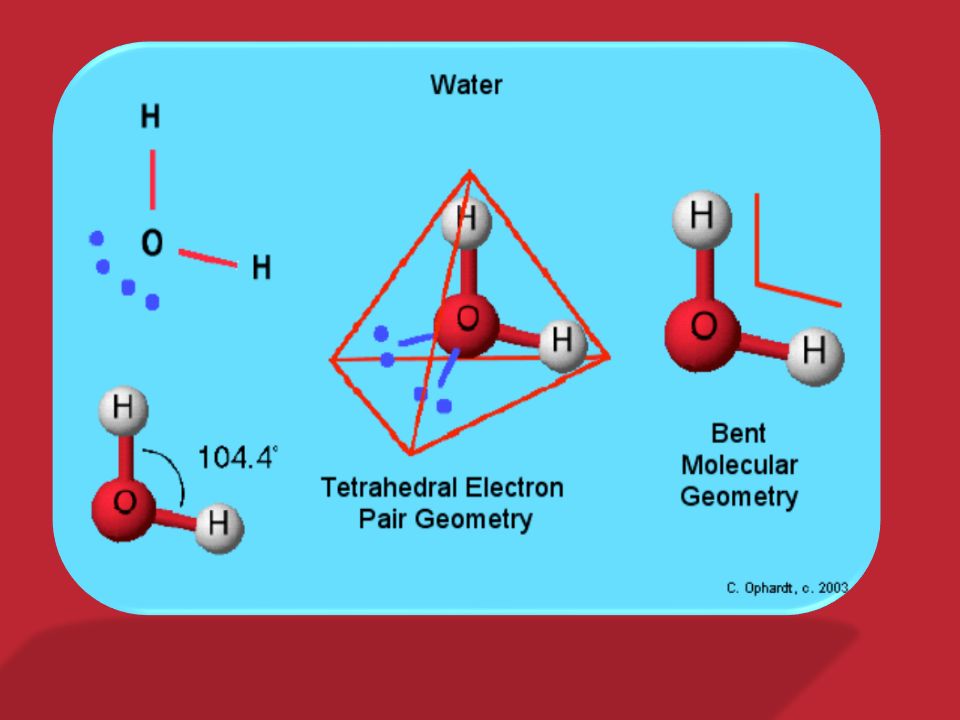 -`, несущими разноимённые заряды, возникают силы электростатического притяжения, в результате чего образуется соединение `»NaCl»`.
-`, несущими разноимённые заряды, возникают силы электростатического притяжения, в результате чего образуется соединение `»NaCl»`.
Ионные соединения образуют атомы элементов, резко отличающихся по электроотрицательности, например, атомы элементов главных подгрупп I и II групп с элементами главных подгрупп VI и VII групп.
Таким образом, между механизмами возникновения ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Поэтому можно рассматривать ионную связь как предельный случай полярной ковалентной связи.
Вместе с тем надо помнить о важных отличиях ионной связи от ковалентной. Ионная связь характеризуется ненаправленностью в пространстве (каждый ион может притягивать ион противоположного знака по любому направлению) и ненасыщаемостью (взаимодействие ионов не устраняет способность притягивать или отталкивать другие ионы). Вследствие ненаправленности и ненасыщаемости ионные соединения в твёрдом состоянии представляют собой ионную кристаллическую решётку, в которой каждый ион взаимодействует не с одним, а со многими ионами противоположного знака; например, в решётке хлорида натрия катион натрия окружён шестью хлорид-анионами и наоборот.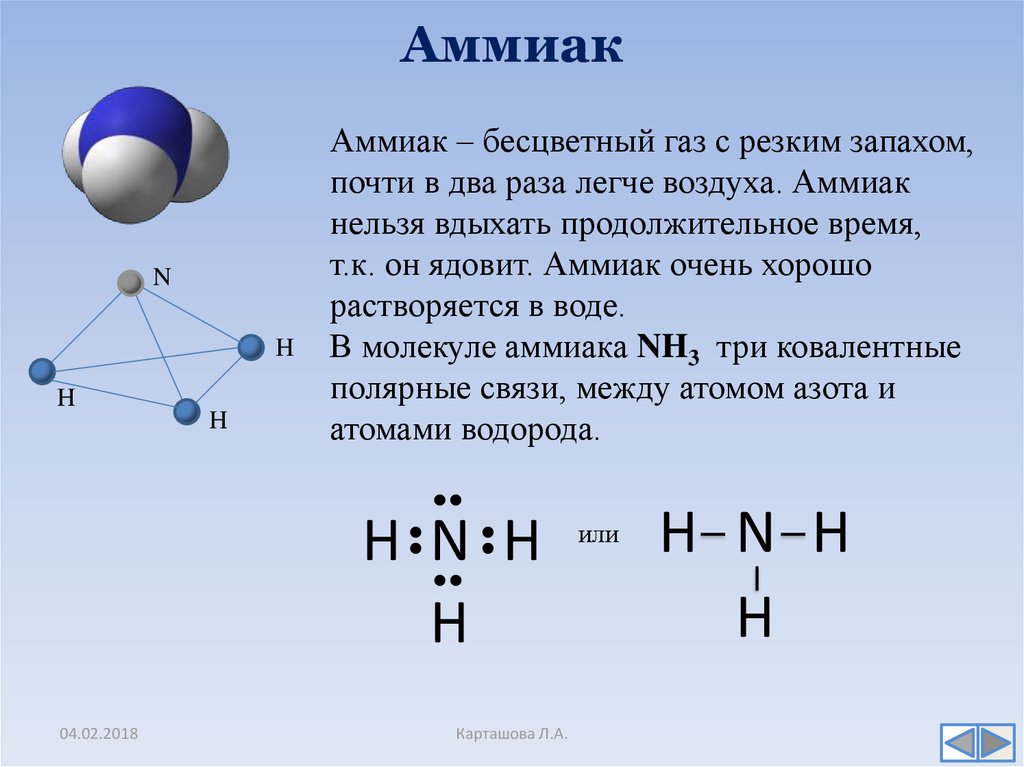 Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
Связи между ионами многочисленны и прочны, поэтому вещества с ионной решёткой тугоплавки, малолетучи и обладают сравнительно высокой твёрдостью. При плавлении ионных кристаллов прочность связи между ионами уменьшается, и расплавы их проводят электрический ток. Ионные соединения, как правило, хорошо растворяются в воде и других полярных растворителях.
В то же время ковалентная связь отличается насыщаемостью (т. е. способностью атомов образовывать ограниченное количество ковалентных связей, определяемое числом неспаренных электронов) и направленностью (определённой пространственной структурой молекул, которой мы коснёмся ниже).
Твёрдые вещества, состоящие из молекул (полярных и неполярных), образуют молекулярные кристаллические решётки. Молекулы в таких решётках соединены сравнительно слабыми межмолекулярными силами, поэтому вещества с молекулярной решёткой имеют малую твёрдость, низкие температуры плавления, они плохо растворимы в воде, а их растворы почти не проводят электрический ток.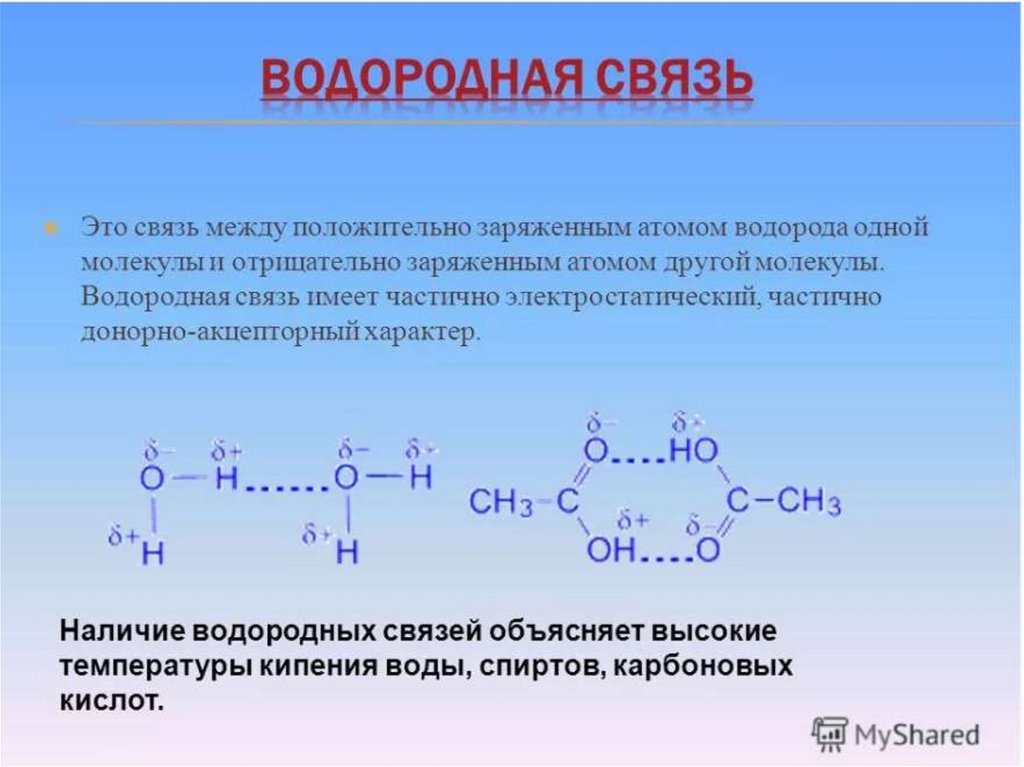 Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода (IV) («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Число неорганических веществ с молекулярной кристаллической решёткой невелико: лёд, твёрдый оксид углерода (IV) («сухой лёд»), твёрдые галогеноводороды и простые вещества, но зато большинство кристаллических органических соединений имеют молекулярную решётку.
Если же в узлах решётки располагаются атомы, соединённые прочными ковалентными связями, то такие вещества имеют высокие температуры плавления, прочность и твёрдость, они практически нерастворимы в жидкостях.
Характерный пример вещества с атомной кристаллической решёткой — алмаз; она характерна также для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Особый тип решётки в твёрдом состоянии образуют металлы. В узлах такой металлической кристаллической решётки находятся катионы металлов, а между ними — отрицательно заряженный «электронный газ». Атомы металлов в решётке упакованы так тесно, что валентные орбитали соседних атомов перекрываются, и электроны получают возможность свободно перемещаться из орбиталей одного атома в орбитали других атомов, осуществляя связь между всеми атомами данного кристалла металла. Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Лишённые валентных электронов, атомы превращаются в катионы, а электроны, осуществляющие связь, перемещаются по всему кристаллу металла и становятся общими.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в её основе лежит обобществление валентных электронов. Однако при ковалентной связи эти электроны находятся вблизи соединённых атомов и прочно с ними связаны, тогда как при металлической связи электроны свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны, т. е. без разрушения изменяют форму, прокатываются в листы, вытягиваются в проволоку. Наличие свободных электронов придаёт кристаллам металлов непрозрачность, высокую электрическую проводимость, теплопроводность.
Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.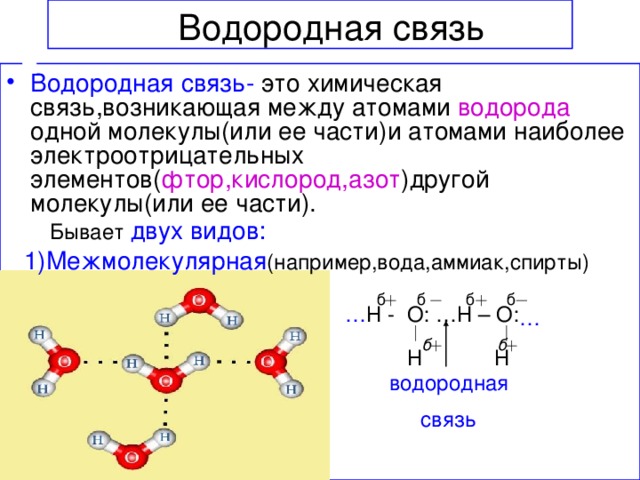
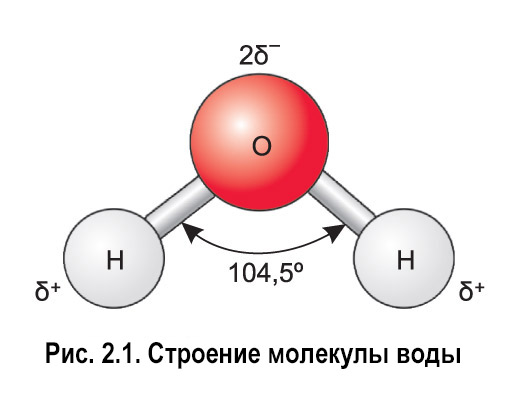
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
Эта способность обусловливает строение и свойства воды и льда.
Вода является жидкостью, хотя более тяжелый сероводород – полный электронный аналог воды – газ. Молекулы воды образуют между собой водородные связи, что увеличивает плотность вещества в жидком состоянии и его температуру кипения. Между молекулами сероводорода подобных связей не возникает из-за большого радиуса и сравнительно малой электроотрицательности атома серы.
При замерзании количество водородных связей между молекулами воды становится максимальным. Строго ориентируясь относительно друг друга, они образуют правильные шестиугольники. Образованные ими канальцы заполнены воздухом, поэтому плотность льда меньше плотности воды.
Водородная связь приводит к образованию димеров муравьиной и уксусной кислот, устойчивых в газообразном и жидком состоянии:
Благодаря водородной связи фтороводород `»HF»` в обычных условиях существует в жидком состоянии (`»t»_»кип»=19,5^@»C»`), а плавиковая кислота диссоциирует с образованием как фторид-аниона `»F»^-`, так и гидродифторид-аниона `»HF»_2^-`.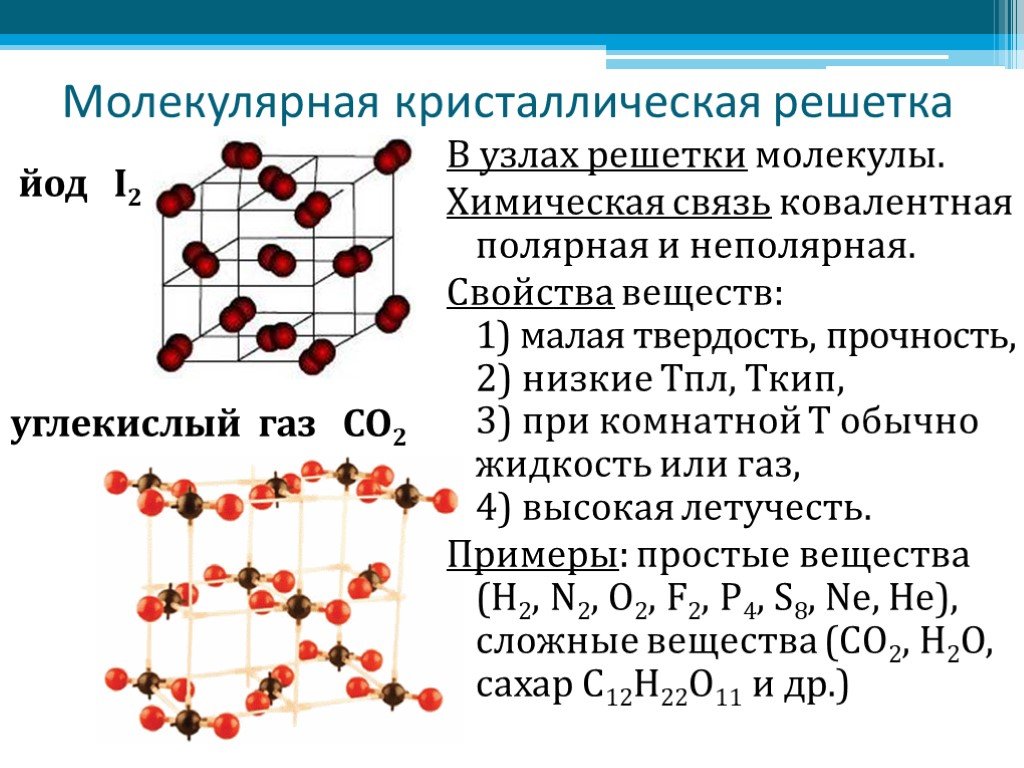
Важную роль играют водородные связи в химии процессов жизнедеятельности, поскольку они распространены в молекулах белков, нуклеиновых кислот и других биологически важных соединений.
Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).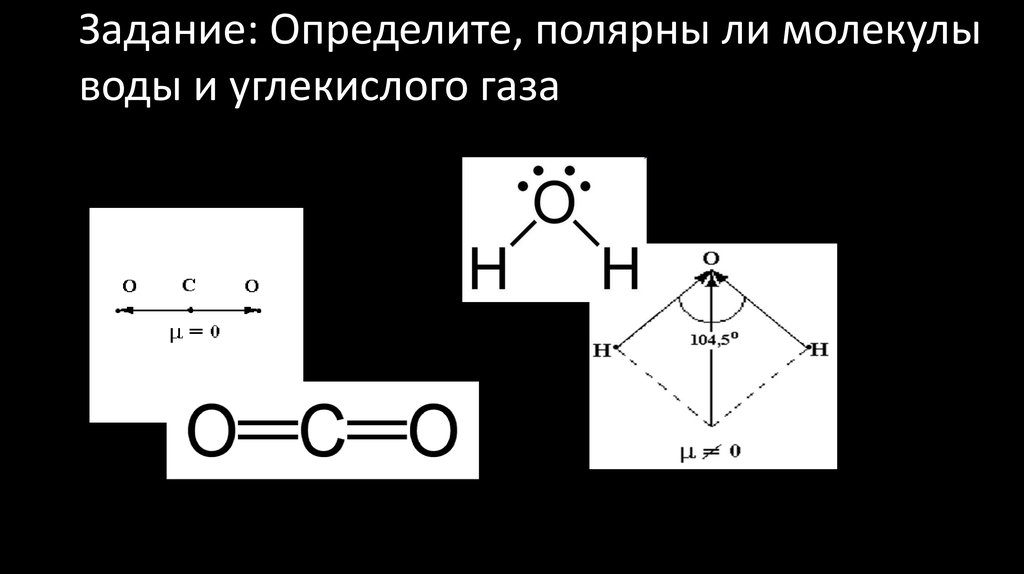
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».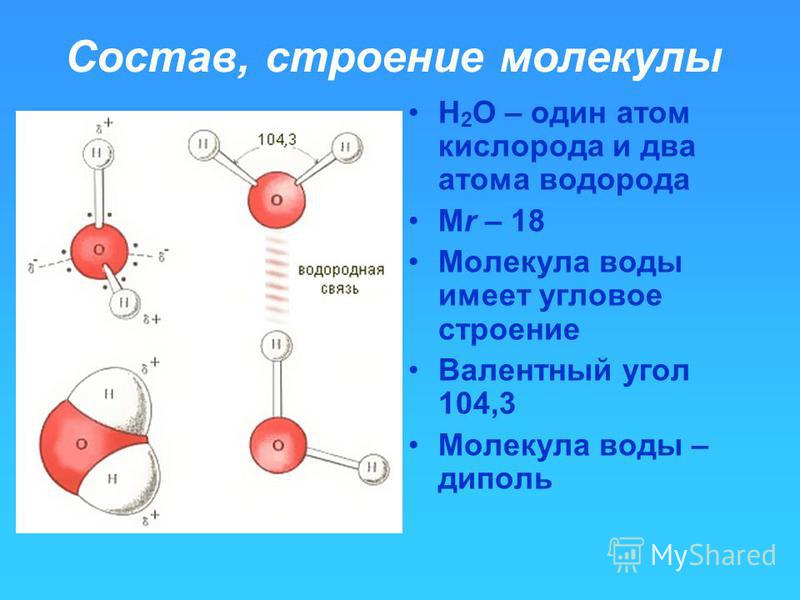
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ «О введение в действие новой редакции Устава и изменении наименования Университета» с 13.07.2016 г. в связи с переименованием Университета считать:
— полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
— полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
— сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
Какой тип связи присутствует в молекуле воды Нарисуйте электронно-точечную структуру воды Hsub2subO…
Перейти к
- Упражнение
- Глава 1 Химические реакции и уравнения
- Глава 2 Кислоты, основания и соли
- Глава 3 Металлы и неметаллы
- Глава 5 Периодическая классификация элементов
Главная > Лахмир Сингх Солюшнс Класс 10 Химия > Глава 3 — Глава 3 Металлы и неметаллы > Упражнение > Вопрос 97
Вопрос 97 Упражнение
Какие типы связей присутствуют в молекуле воды? Нарисуйте электронно-точечную структуру воды (H 2 O).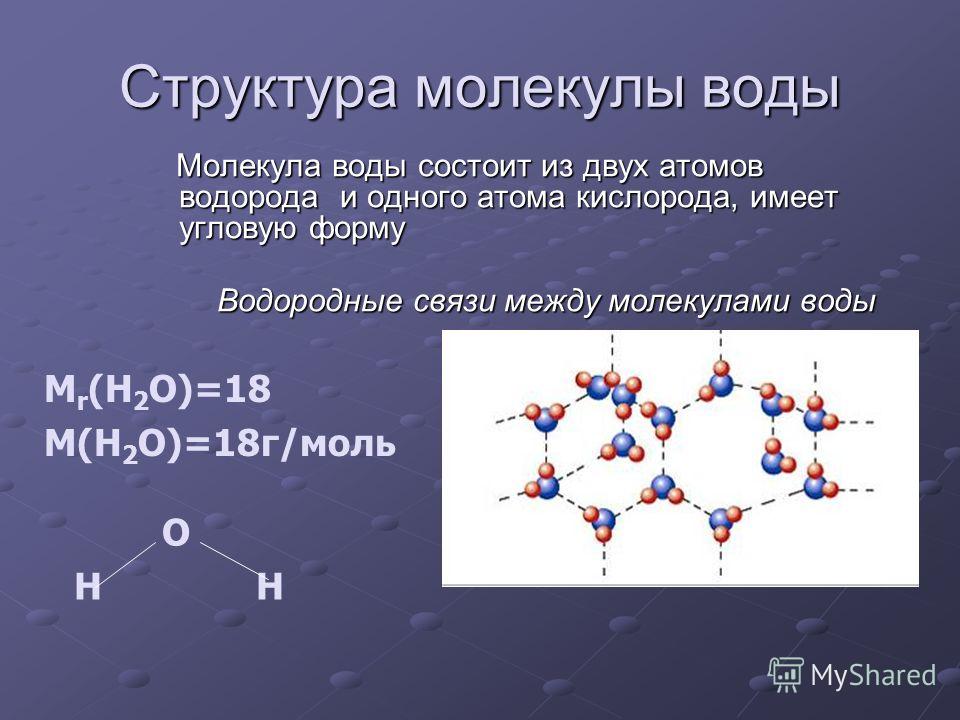
Ответ:
В молекуле воды присутствуют ковалентные связи. Это прочная связь, скрепляющая атомы водорода и кислорода отдельных H 2 Молекулы О. Ковалентные связи возникают, когда два атома делят друг с другом электроны (в данном случае кислород и водород).
Связанные вопросы
**Назовите один металл и один неметалл, которые существуют в жидком состоянии при комнатной температуре.**
**Назовите металл, который является самым плохим проводником тепла.**
**(а) Что имеется в виду, когда говорят, что металлы ковкие и пластичные? Объясните примерами.****(b…
**Назовите два металла, которые бурно реагируют с холодной водой. Напишите любые три наблюдения, которые вы бы сделали…
В данной реакции оксид натрия взаимодействует с водой.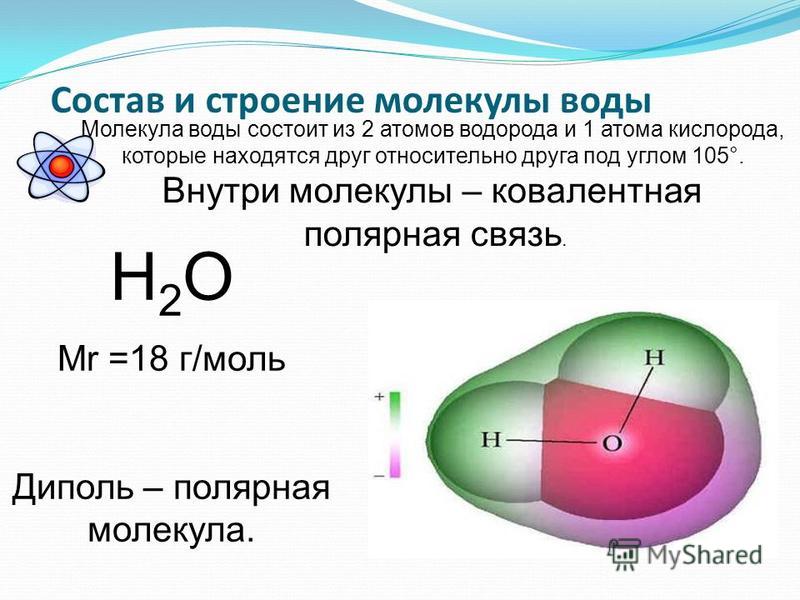 Какой продукт образуется в данной реакции?…
Какой продукт образуется в данной реакции?…
_*_*Заполните следующие пропуски подходящими словами:_*_***(a) Магний высвобождает ________________…
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнение
Главы
Глава 1 Химические реакции и уравнения
Глава 2 Кислоты, основания и соли
Глава 3 Металлы и неметаллы
Глава 4 Углерод и его соединения
Глава 5 Периодическая классификация элементов
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
Какие две связи удерживают молекулу воды вместе? Подсказка молекула воды вместе с другими молекулами воды.
 Следовательно, нам нужно рассмотреть оба случая и найти связи, удерживающие молекулу вместе в обоих случаях.
Следовательно, нам нужно рассмотреть оба случая и найти связи, удерживающие молекулу вместе в обоих случаях. Завершите шаг за шагом Ответ:
Давайте рассмотрим молекулу воды, как показано на рисунке
Из таблицы Менделеева мы можем понять, что кислороду нужны два электрона для достижения стабильного состояния, а водороду нужен один электрон для достижения стабильного состояния. государство.
Следовательно, атомы водорода и атом кислорода образуют две ковалентные связи кислород-водород.
Это связи, которые удерживают одну молекулу воды связанной и вместе.
Теперь, несмотря на то, что разница электроотрицательности между кислородом и водородом меньше, кислород из-за более высокой электроотрицательности притягивает электронную пару к себе.
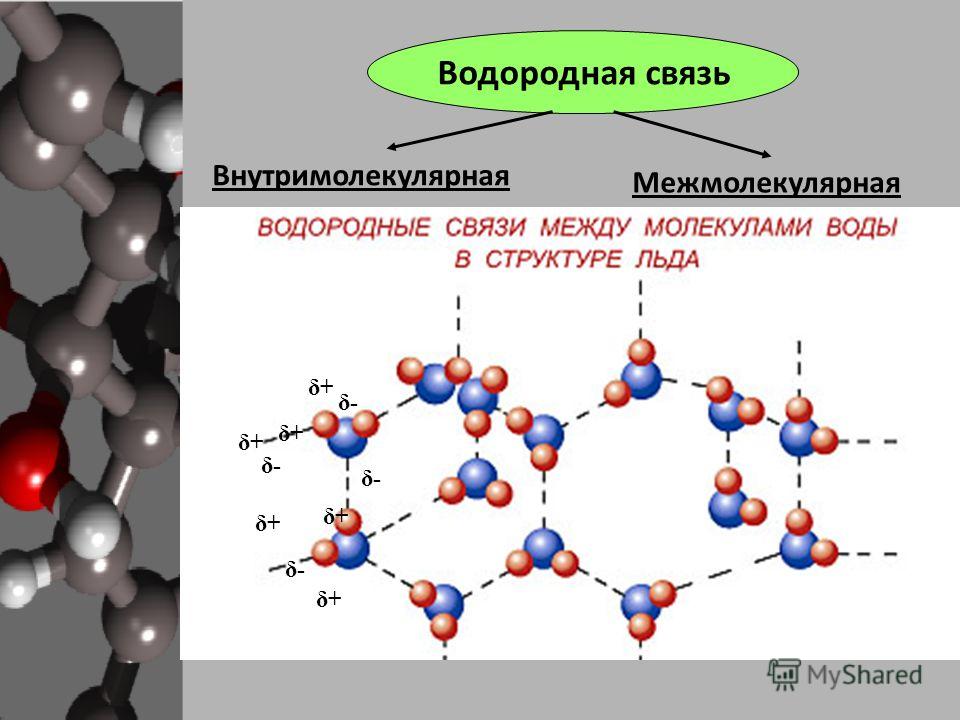
Благодаря этому на водороде образуется частичный положительный заряд, а на кислороде — частичный отрицательный заряд.
Из-за этого явления частично положительно заряженный водород притягивается кислородом соседней молекулы, которая частично отрицательно заряжена и имеет неподеленную пару электронов.
Следовательно, водород одной молекулы образует связь с кислородом другой молекулы из-за противоположных зарядов, что известно как водородная связь, как показано на рисунке.
Эта связь классифицируется не совсем как связь, а как притяжение, которое слабее, чем ионная или ковалентная связь, но сильнее, чем дисперсионные силы Вандер-Ваальса.
Следовательно, в воде присутствуют два типа связи, которые удерживают молекулу вместе, а именно ковалентная связь и водородная связь.
Примечание:
Водородная связь, которая образуется между водородом одной молекулы и кислородом соседней молекулы, отвечает за некоторые из основных свойств воды, такие как относительно высокая температура кипения, адгезия, когезия и ее плотность.