§ 5. Углеводы. Биология 9 класс Пасечник
1. Какие вещества, относящиеся к углеводам, вам известны?
Глюкоза, фруктоза, крахмал, целлюлоза, хитин.
2. Какую роль играют углеводы в живом организме?
Углеводы представляют собой важнейшие источники энергии, необходимой для жизнедеятельности организмов.
3. В результате какого процесса углеводы образуются в клетках зелёных растений?
Углеводы образуются в клетках зелёных растений в результате фотосинтеза.
Вопросы
1. Какой состав и строение имеют молекулы углеводов?
Углеводы состоят из углерода, водорода и кислорода. У большинства из них соотношение водорода и кислорода в молекуле такое же, как и в молекуле воды.
Все углеводы делятся на простые, или моносахариды, и сложные, или полисахариды.
2. Какие углеводы называются моно-, ди- и полисахаридами? 3. Какие функции выполняют углеводы в живых организмах?
Все углеводы делятся на простые, или моносахариды, и сложные, или полисахариды. Из моносахаридов наибольшее значение для живых организмов имеют рибоза, дезоксирибоза, глюкоза, фруктоза, галактоза.
Ди- и полисахариды образуются путём соединения двух и более молекул моносахаридов. Так, сахароза (тростниковый сахар), мальтоза (солодовый сахар), лактоза (молочный сахар) — дисахариды, образовавшиеся в результате слияния двух молекул моносахаридов. Дисахариды по своим свойствам близки к моносахаридам. Например, и те и другие хороню растворимы в воде и имеют сладкий вкус.
Полисахариды состоят из большого числа моносахаридов.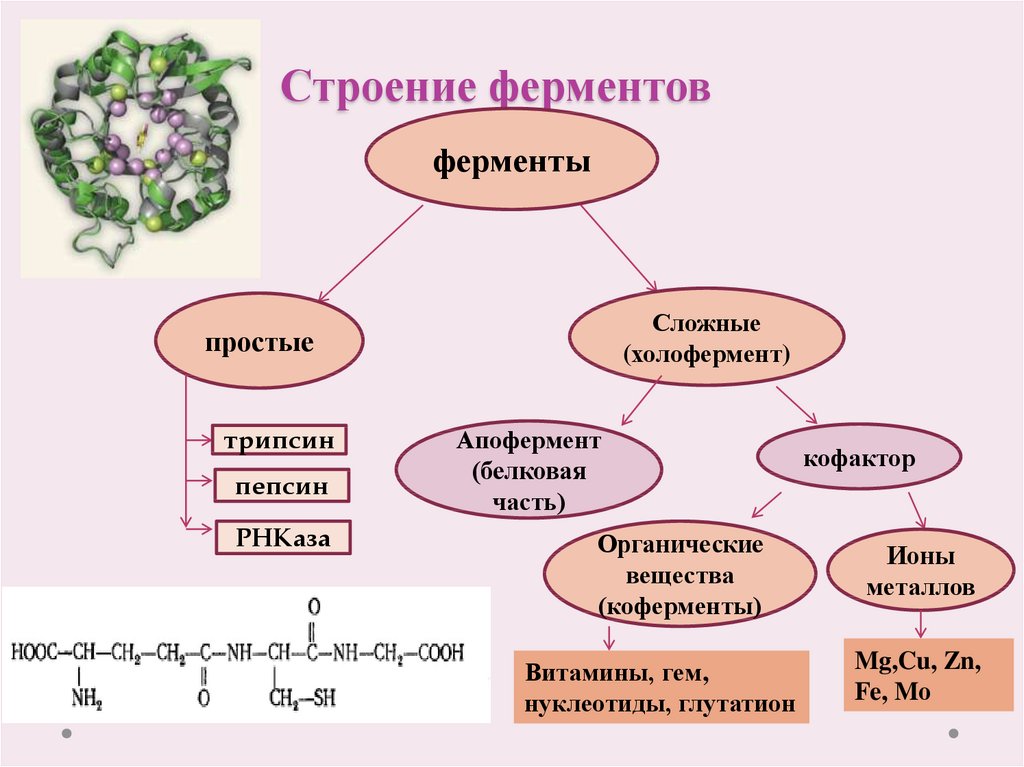 К ним относятся крахмал, гликоген, целлюлоза, хитин и др. С увеличением количества мономеров растворимость полисахаридов уменьшается и сладкий вкус исчезает.
К ним относятся крахмал, гликоген, целлюлоза, хитин и др. С увеличением количества мономеров растворимость полисахаридов уменьшается и сладкий вкус исчезает.
Основная функция углеводов — энергетическая. При расщеплении и окислении молекул углеводов выделяется энергия (при распаде 1 г углеводов — 17,6 кДж), которая обеспечивает жизнедеятельность организма.
При избытке углеводов они накапливаются в клетке в качестве запасных веществ (крахмал, гликоген) и при необходимости используются организмом в качестве источника энергии.
Углеводы используются и в качестве строительного материала.
Некоторые полисахариды входят в состав клеточных мембран и служат рецепторами, обеспечивая узнавание клетками друг друга и их взаимодействие.
Задания
Проанализируйте рисунок 6 «Схема строения полисахаридов» и текст параграфа. Какие предположения вы можете выдвинуть на основе сравнения особенностей строения молекул и функций, выполняемых крахмалом, гликогеном и целлюлозой в живом организме? Обсудите этот вопрос с одноклассниками.
Строение представленных на рисунке молекул углеводов позволяет им выполнять определенные функции.
Полимерные цепочки крахмала и гликогена позволяют им накапливаться в клетке в качестве запасных веществ (т.к. они компактные за счет способности изгибаться и свертываться) и при необходимости использоваться организмом в качестве источника энергии.
Строение молекул целлюлозы (длинные прямолинейные цепи) делает их как нельзя лучше приспособленными для использования в качестве строительного материала (целлюлоза является важным структурным компонентом клеточных стенок многих одноклеточных, грибов и растений).
Биологические молекулы • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Биологические молекулы имеют модульное строение. К числу важных классов биологических молекул относятся белки, углеводы, липиды и нуклеиновые кислоты. Множество других молекул в клетке играют роль «энергетической валюты».
Жизнь — таинственная, сложная, загадочная — не что иное как совокупность достаточно крупных молекул и довольно простых химических реакций.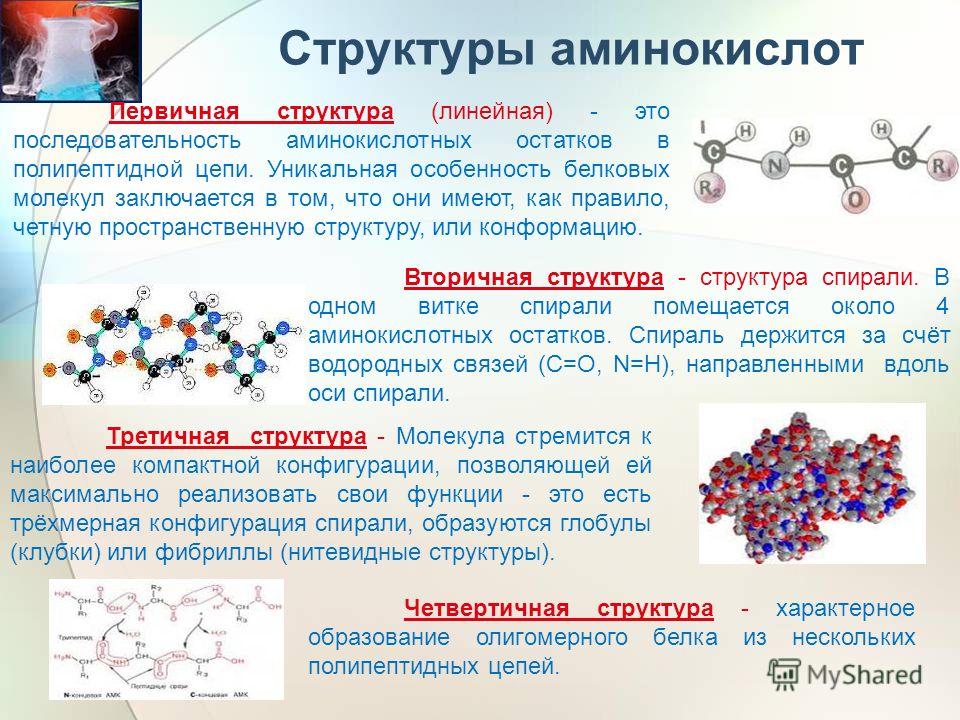 Если бы вам понадобилось конструировать крупные молекулы, вы пошли бы по одному из двух путей. Либо, как в кустарном ювелирном деле, вы стали строить каждую молекулу «с нуля», проделывая каждый раз уникальную работу. Либо — этот путь используется в современных строительных технологиях — вы бы изготовили набор простых молекул, из которых можно собирать самые разнообразные молекулы большего размера, сочетая модули тем или иным образом. Оказывается, именно такое модульное строение имеют биологические молекулы. Согласно теории эволюции, таким и должен был быть самой простой путь к крупным молекулам, поскольку в начале эволюционного процесса необходимость в конструировании очень сложных молекул отсутствовала. Со временем же могли добавляться новые модули, расширяя коллекцию крупных разнородных элементов, что вполне соответствует духу эволюции.
Если бы вам понадобилось конструировать крупные молекулы, вы пошли бы по одному из двух путей. Либо, как в кустарном ювелирном деле, вы стали строить каждую молекулу «с нуля», проделывая каждый раз уникальную работу. Либо — этот путь используется в современных строительных технологиях — вы бы изготовили набор простых молекул, из которых можно собирать самые разнообразные молекулы большего размера, сочетая модули тем или иным образом. Оказывается, именно такое модульное строение имеют биологические молекулы. Согласно теории эволюции, таким и должен был быть самой простой путь к крупным молекулам, поскольку в начале эволюционного процесса необходимость в конструировании очень сложных молекул отсутствовала. Со временем же могли добавляться новые модули, расширяя коллекцию крупных разнородных элементов, что вполне соответствует духу эволюции.
Белки
Основной структурной единицей белков являются молекулы аминокислот. Чтобы понять, что такое аминокислота, представьте себе совокупность атомов, у которых с одной стороны наружу выступает водород, с другой — соединенные между собой кислород и водород, а посередине расположены разнообразные другие компоненты. Подобно тому как бусины нанизываются на нить, из этих аминокислот собираются белки — ион водорода (Н+) одной аминокислоты объединяется с ионом гидроксила (ОН–) другой аминокислоты с образованием молекулы воды. (Представьте, как каждый раз при соединении двух аминокислотных молекул между ними пробегает капелька воды.) Среди белков самую важную роль играют белки-ферменты (
Подобно тому как бусины нанизываются на нить, из этих аминокислот собираются белки — ион водорода (Н+) одной аминокислоты объединяется с ионом гидроксила (ОН–) другой аминокислоты с образованием молекулы воды. (Представьте, как каждый раз при соединении двух аминокислотных молекул между ними пробегает капелька воды.) Среди белков самую важную роль играют белки-ферменты (
Углеводы
Углеводы содержат кислород, водород и углерод в соотношении 1:2:1. Во многих живых системах молекулы углеводов выполняют роль источников энергии. Одним из важнейших углеводов можно считать сахар глюкозу, содержащую шесть атомов углерода (С6
 Соединяя молекулы глюкозы, как основные строительные модули, можно получить сложные углеводы. Как и белки, углеводы играют вспомогательную роль в клетках, поскольку входят в клеточные структуры. Например, растительные волокна состоят из целлюлозы, которая представляет собой вереницу сцепленных особым образом молекул глюкозы.
Соединяя молекулы глюкозы, как основные строительные модули, можно получить сложные углеводы. Как и белки, углеводы играют вспомогательную роль в клетках, поскольку входят в клеточные структуры. Например, растительные волокна состоят из целлюлозы, которая представляет собой вереницу сцепленных особым образом молекул глюкозы. Липиды
Липиды — это нерастворимые в воде органические молекулы. Вы получите правильное представление о липидах, если вообразите капельки жира, плавающие на поверхности бульона. В живых организмах липиды выполняют две важные функции. Один класс молекул — фосфолипиды — состоят из маленькой головки, содержащей фосфатную группу (атом фосфора, соединенный с четырьмя атомами кислорода), и длинного углеводородного хвоста. Углеводородный хвост этой молекулы
 Если поместить молекулы фосфолипидов в воду, они будут стремиться достичь минимального энергетического состояния и выстроятся таким образом, что их хвосты окажутся вместе, а головки — врозь. Такая
Если поместить молекулы фосфолипидов в воду, они будут стремиться достичь минимального энергетического состояния и выстроятся таким образом, что их хвосты окажутся вместе, а головки — врозь. Такая Кроме того, в липидах запасается энергия. Липиды могут накапливать примерно вдвое больше энергии на единицу массы, чем углеводы. Вот почему, когда вы переедаете и ваш организм хочет запасти энергию на случай непредвиденных обстоятельств в будущем, когда пищи не будет, он станет запасать ее в форме жира. На этом простом факте строится многомиллиардная индустрия диетических продуктов.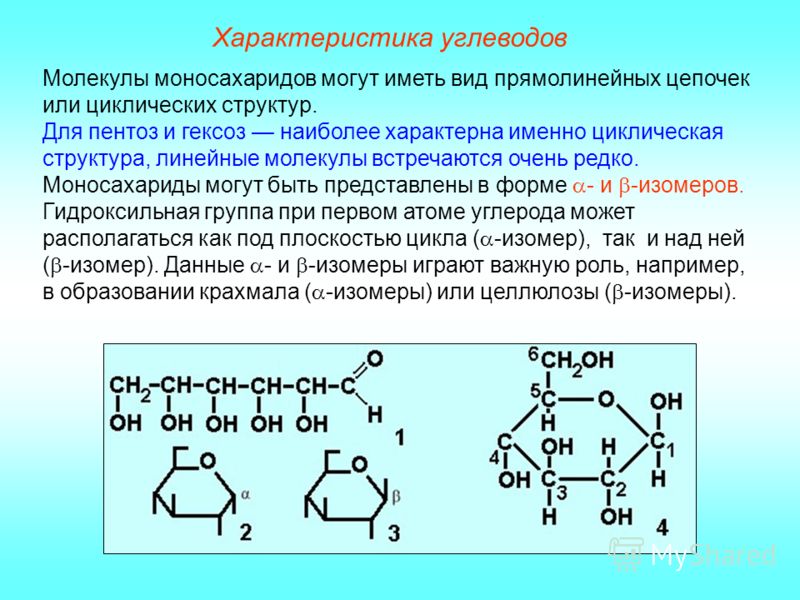
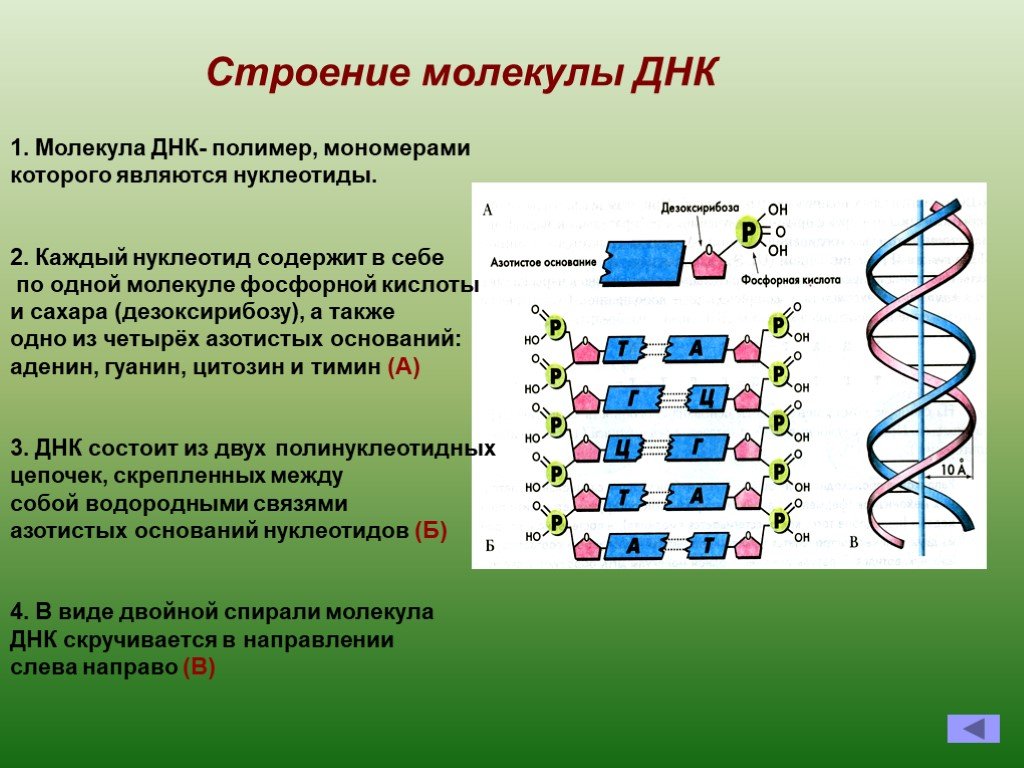
Нуклеиновые кислоты
Молекулы ДНК и РНК (см. Центральная догма молекулярной биологии) переносят информацию о химических процессах, идущих в клетке, и участвуют в передаче содержащейся в ДНК информации в цитоплазму клетки. В ДНК живого организма закодированы белки-ферменты, которые катализируют все химические реакции, происходящие в этом организме.
Молекулы-переносчики энергии
Жизнедеятельность требует затрат энергии. В частности, нужно, чтобы энергия, произведенная в одном месте, могла быть использована в другом. Эту функцию в клетке осуществляет целая армия специализированных молекул. Пожалуй, самые важные из них — аденозин трифосфат (АТФ) и аденозин дифосфат (АДФ). Обе молекулы устроены так: группа из атомов углерода, водорода и азота (она называется аденин) присоединена к молекуле рибозы (это сахар), и все это вместе крепится к хвосту из фосфатов. Из названий молекул понятно, что в хвосте АДФ содержится два фосфата, а в хвосте АТФ — три. Когда в клетке происходит химический процесс, например фотосинтез, образующаяся энергия идет на присоединение третьего фосфата к хвосту АДФ. Полученная молекула АТФ затем переносится в другие части клетки. Там запасенная энергия может быть использована в других химических процессах: она выделяется при отщеплении последнего фосфата от АТФ, в результате чего АТФ вновь превращается в АДФ.
Когда в клетке происходит химический процесс, например фотосинтез, образующаяся энергия идет на присоединение третьего фосфата к хвосту АДФ. Полученная молекула АТФ затем переносится в другие части клетки. Там запасенная энергия может быть использована в других химических процессах: она выделяется при отщеплении последнего фосфата от АТФ, в результате чего АТФ вновь превращается в АДФ.
Как мы уже упоминали, существуют и другие молекулы, которые переносят энергию в клетке. Набор таких молекул чем-то напоминает разные варианты оплаты счетов. Вы можете выбрать наличные, банковский перевод, кредитную карту и т. д. — в зависимости от того, какой способ вам удобнее. Так же и клетка для поддержания своей жизнедеятельности может использовать АТФ (эквивалент наличных денег) или любую другую из большого набора более сложных молекул.
Молекула | Определение, примеры, структуры и факты
представления молекулярной структуры
Просмотреть все средства массовой информации
- Ключевые люди:
- Дж.
 Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А. Хауптман
Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А. Хауптман
- Похожие темы:
- радикальный биомолекула конфигурация конформация гомоядерная молекула
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
молекула , группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую можно разделить чистое вещество, сохраняя при этом состав и химические свойства этого вещества.
Характеристики молекул
Деление образца вещества на все более мелкие части не приводит ни к изменению его состава, ни к химическим свойствам до тех пор, пока не будут получены части, состоящие из отдельных молекул. Дальнейшее подразделение вещества приводит к еще более мелким частям, которые обычно отличаются от исходного вещества по составу и всегда отличаются от него химическими свойствами. На этой последней стадии фрагментации химические связи, удерживающие атомы в молекуле, разрываются.
На этой последней стадии фрагментации химические связи, удерживающие атомы в молекуле, разрываются.
Атомы состоят из одного ядра с положительным зарядом, окруженного облаком отрицательно заряженных электронов. Когда атомы близко подходят друг к другу, электронные облака взаимодействуют друг с другом и с ядрами. Если это взаимодействие таково, что общая энергия системы снижается, то атомы связываются вместе, образуя молекулу. Таким образом, со структурной точки зрения молекула состоит из скопления атомов, удерживаемых вместе валентными силами. Двухатомные молекулы содержат два атома, которые химически связаны. Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Молекулярная связь
Отношение числа атомов, которые могут быть связаны друг с другом для образования молекул, является фиксированным; например, каждая молекула воды содержит два атома водорода и один атом кислорода. Именно эта особенность отличает химические соединения от растворов и других механических смесей. Таким образом, водород и кислород могут присутствовать в любых пропорциях в механических смесях, но при искровом разряде они будут соединяться только в определенных пропорциях, образуя химическое соединение вода (H 2 О). Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H 2 O 2 ).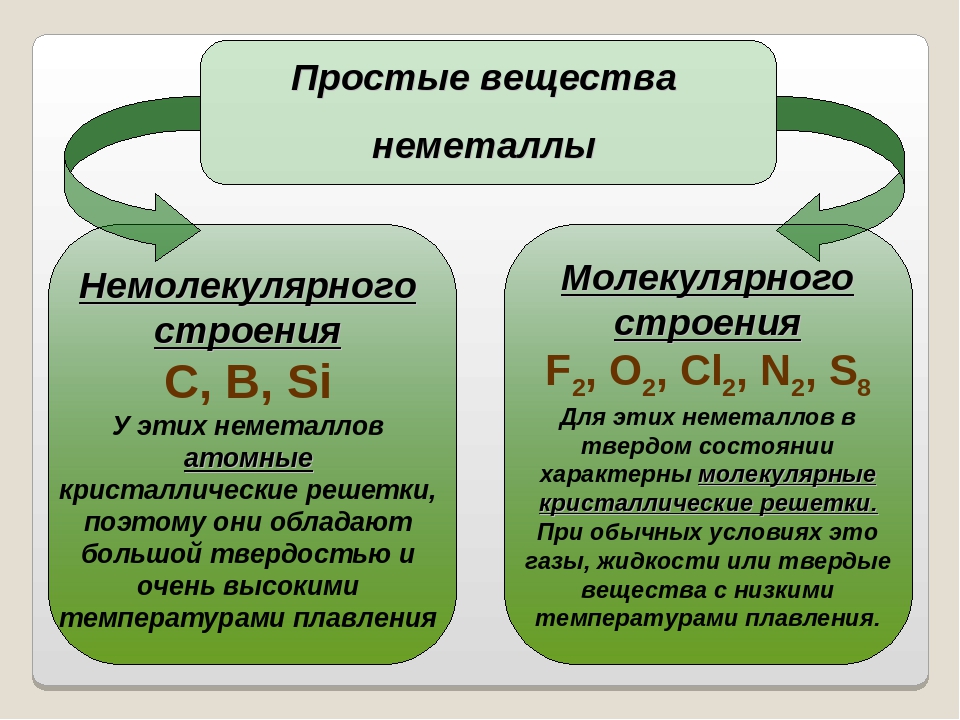 Кроме того, атомы могут связываться друг с другом в одинаковых пропорциях, образуя разные молекулы. Такие молекулы называются изомерами и отличаются только расположением атомов внутри молекул. Например, этиловый спирт (СН 3 CH 2 OH) и метиловый эфир (CH 3 OCH 3 ) содержат один, два и шесть атомов кислорода, углерода и водорода соответственно, но эти атомы связаны по-разному.
Кроме того, атомы могут связываться друг с другом в одинаковых пропорциях, образуя разные молекулы. Такие молекулы называются изомерами и отличаются только расположением атомов внутри молекул. Например, этиловый спирт (СН 3 CH 2 OH) и метиловый эфир (CH 3 OCH 3 ) содержат один, два и шесть атомов кислорода, углерода и водорода соответственно, но эти атомы связаны по-разному.
Britannica Quiz
Все тонкости химии
Не все вещества состоят из отдельных молекулярных единиц. Хлорид натрия (поваренная соль), например, состоит из ионов натрия и ионов хлора, расположенных в решетке так, что каждый ион натрия окружен шестью равноудаленными ионами хлора, а каждый ион хлора окружен шестью равноудаленными ионами натрия. Силы, действующие между любым натрием и любым соседним ионом хлора, равны. Следовательно, не существует отдельного агрегата, идентифицируемого как молекула хлорида натрия. Следовательно, в хлориде натрия и во всех твердых телах подобного рода понятие химической молекулы не имеет значения. Поэтому формула такого соединения дается как простейшее соотношение атомов, называемое формульной единицей, в случае хлорида натрия — NaCl.
Поэтому формула такого соединения дается как простейшее соотношение атомов, называемое формульной единицей, в случае хлорида натрия — NaCl.
Молекулы удерживаются вместе общими электронными парами или ковалентными связями. Такие связи являются направленными, что означает, что атомы занимают определенное положение относительно друг друга, чтобы максимизировать силу связи. В результате каждая молекула имеет определенную, достаточно жесткую структуру или пространственное распределение ее атомов. Структурная химия занимается валентностью, которая определяет, как атомы соединяются в определенных соотношениях и как это связано с направлениями и длинами связей. Свойства молекул коррелируют с их строением; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула углекислого газа является линейной и не имеет дипольного момента. Выяснение того, каким образом атомы реорганизуются в ходе химических реакций, имеет важное значение. В некоторых молекулах структура может быть нежесткой; например, в этане (H 3 CCH 3 ) существует практически свободное вращение вокруг простой связи углерод-углерод.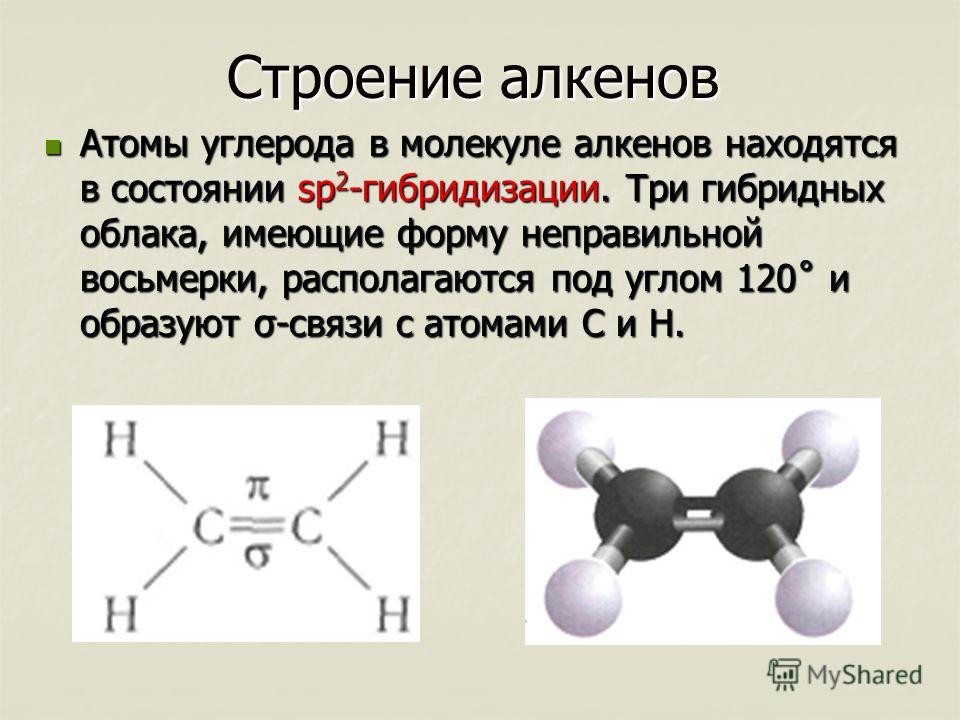
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться
2.1: Атомы: их состав и строение
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 13536
Цели обучения
- знать значение изотопов и атомных масс.
Атомный и молекулярный вес
Нижние индексы в химических формулах и коэффициенты в химических уравнениях представляют точных величин. \(\ce{H_2O}\), например, указывает, что молекула воды состоит ровно из двух атомов водорода и один атом кислорода. Следующее уравнение:
\[ \ce{C3H8(g) + 5O2(g) \rightarrow 3CO2(g) + 4h3O(l)} \label{Eq1} \]
не только говорит нам, что пропан реагирует с кислородом 1 молекул пропана реагирует с 5 молекулами кислорода с образованием 3 молекул углекислого газа и 4 молекул воды. Атомы разных элементов имеют разную массу. Ранние работы по разделению воды на составные элементы (водород и кислород) показали, что в 100 граммах воды содержится 11,1 грамма водорода и 88,9 грамма кислорода: \[\text{100 граммов воды} \rightarrow \text{11.1 граммов водорода} + \text{88,9 граммов кислорода} \label{Eq2} \] Позднее ученые обнаружили, что вода состоит из двух атомов водорода на каждый атом кислорода. Следовательно, в приведенном выше анализе 90 104 в 11,1 граммах водорода было в два раза больше атомов, чем в 88,9 граммах кислорода.  Поскольку сосчитать отдельные атомы или молекулы немного сложно, количественные аспекты химии полагаются на знание масс вовлеченных соединений.
Поскольку сосчитать отдельные атомы или молекулы немного сложно, количественные аспекты химии полагаются на знание масс вовлеченных соединений.
\[ \dfrac{\dfrac{88,9\;g\;Кислород}{1\; atom}}{\dfrac{111\;g\;водород}{2\;атомы}} = 16 \label{Eq3} \]
Водороду, самому легкому элементу, была присвоена относительная масса «1», и другим элементам были присвоены «атомные массы» относительно этого значения для водорода. Таким образом, атомная масса кислорода была равна 16. Теперь мы знаем, что 9Атом водорода 0025 имеет массу 1,6735 x 10 -24 граммов, а атом кислорода имеет массу 2,6561 X 10 -23 граммов. Как мы видели ранее, при работе с такими малыми числами удобно использовать единицу отсчета: единиц атомной массы . Атомная единица массы ( а.е.м. ) была стандартизирована не по водороду, а по 12 изотопа углерода ( а.е.м. = 12 ).
Таким образом, атомная масса кислорода была равна 16. Теперь мы знаем, что 9Атом водорода 0025 имеет массу 1,6735 x 10 -24 граммов, а атом кислорода имеет массу 2,6561 X 10 -23 граммов. Как мы видели ранее, при работе с такими малыми числами удобно использовать единицу отсчета: единиц атомной массы . Атомная единица массы ( а.е.м. ) была стандартизирована не по водороду, а по 12 изотопа углерода ( а.е.м. = 12 ).
Таким образом, масса атома водорода ( 1 H) равна 1,0080 а.е.м. , а масса атома кислорода ( 16 O) равна 15,995 0 а.е.м. Как только массы атомов были определены, AMU может быть назначено фактическим значением:
1 AMU = 1,66054 x 10 -24 Грам.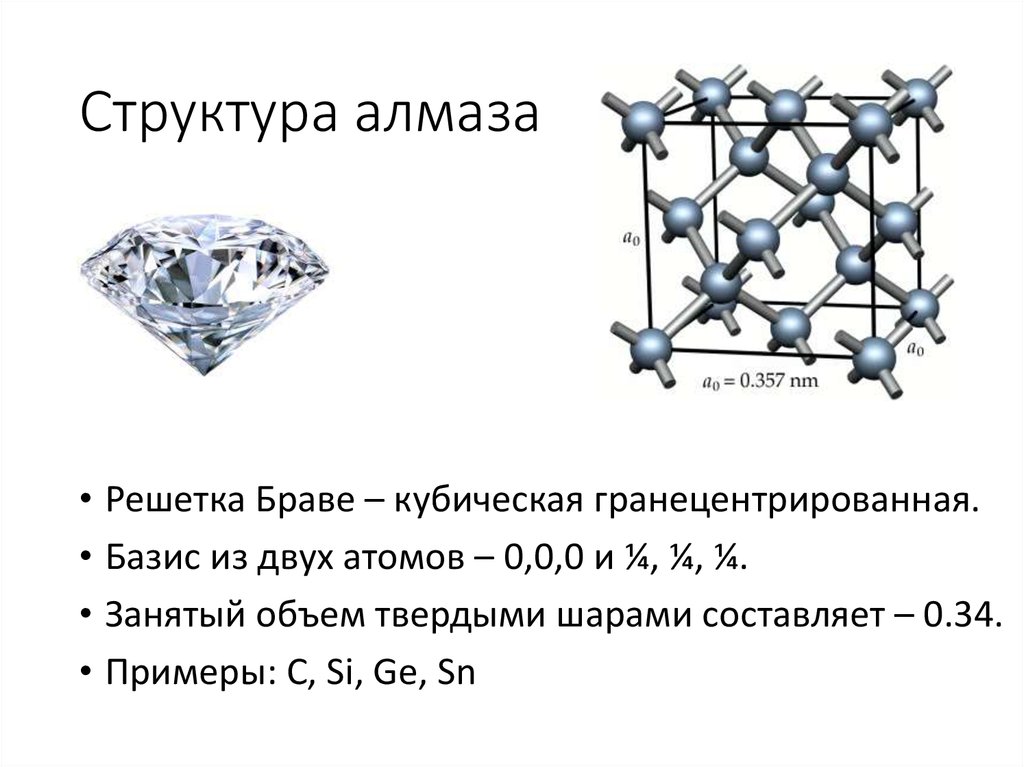 23 а.е.м.
23 а.е.м.
Массовые числа и атомная масса элементов: Массовые числа и атомная масса элементов, YouTube(opens in new window) [youtu.be]
Средняя атомная масса
Хотя массы электрон, протон и нейтрон известны с высокой степенью точности (табл. 2.3.1), масса любого данного атома — это не просто сумма масс его электронов, протонов и нейтронов. Например, отношение масс 1 H (водород) и 2 H (дейтерий) на самом деле составляют 0,500384, а не 0,49979, как предсказывалось по количеству присутствующих нейтронов и протонов. Хотя разница в массе невелика, она чрезвычайно важна, поскольку является источником огромного количества энергии, выделяемой в ядерных реакциях.
Поскольку атомы слишком малы для измерения по отдельности и не имеют заряда, не существует удобного способа точного измерения абсолютных атомных масс.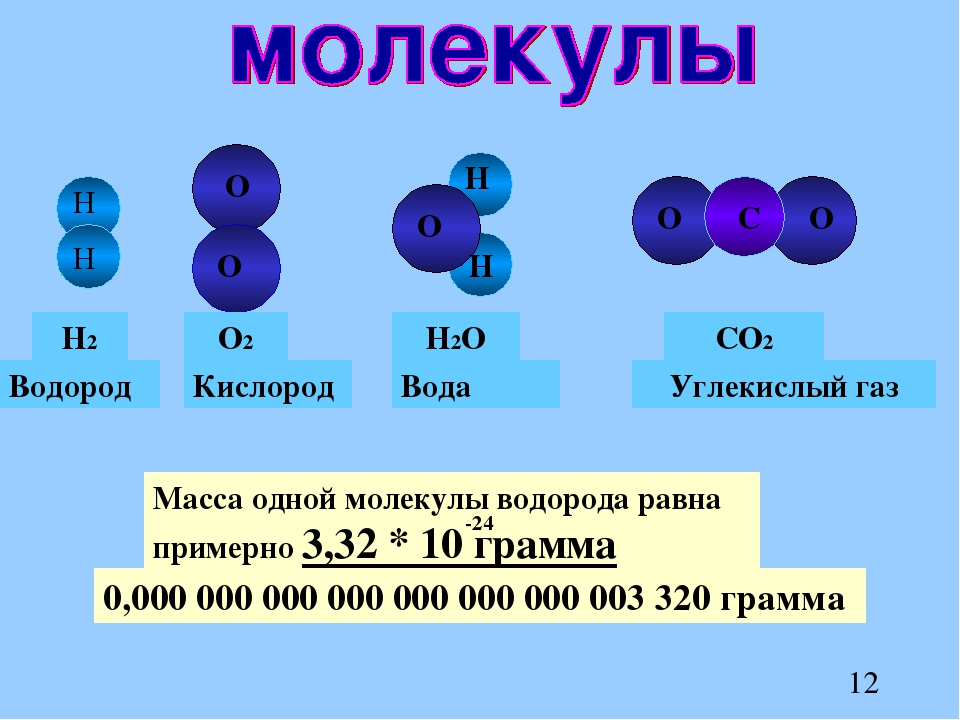 Однако ученые могут очень точно измерять относительные атомные массы, используя прибор, называемый масс-спектрометром. Этот метод концептуально похож на тот, который Томсон использовал для определения отношения массы электрона к заряду. Во-первых, электроны удаляются или присоединяются к атомам или молекулам, создавая таким образом заряженные частицы, называемые ионами. При приложении электрического поля ионы ускоряются в отдельной камере, где они отклоняются от своей первоначальной траектории магнитным полем, как электроны в эксперименте Томсона. Степень отклонения зависит от отношения массы иона к заряду. Измеряя относительное отклонение ионов с одинаковым зарядом, ученые могут определить их относительную массу (рис. \(\PageIndex{1}\)). Таким образом, невозможно точно вычислить абсолютные массы атомов, просто сложив вместе массы электронов, протонов и нейтронов, и нельзя измерить абсолютные массы атомов, но можно очень точно измерить относительные массы. На самом деле в химии довольно часто встречаются величины, величина которых может быть измерена только относительно какой-либо другой величины, а не абсолютно.
Однако ученые могут очень точно измерять относительные атомные массы, используя прибор, называемый масс-спектрометром. Этот метод концептуально похож на тот, который Томсон использовал для определения отношения массы электрона к заряду. Во-первых, электроны удаляются или присоединяются к атомам или молекулам, создавая таким образом заряженные частицы, называемые ионами. При приложении электрического поля ионы ускоряются в отдельной камере, где они отклоняются от своей первоначальной траектории магнитным полем, как электроны в эксперименте Томсона. Степень отклонения зависит от отношения массы иона к заряду. Измеряя относительное отклонение ионов с одинаковым зарядом, ученые могут определить их относительную массу (рис. \(\PageIndex{1}\)). Таким образом, невозможно точно вычислить абсолютные массы атомов, просто сложив вместе массы электронов, протонов и нейтронов, и нельзя измерить абсолютные массы атомов, но можно очень точно измерить относительные массы. На самом деле в химии довольно часто встречаются величины, величина которых может быть измерена только относительно какой-либо другой величины, а не абсолютно. Мы встретим много других примеров позже в этом тексте. В таких случаях химики обычно определяют стандарт, произвольно присваивая числовое значение одной из величин, что позволяет им рассчитать числовые значения для остальных. 9{37}Cl\) примерно в соотношении 3:1. (а) Когда образец элементарного хлора вводится в масс-спектрометр, электрическая энергия используется для диссоциации молекул Cl 2 на атомы хлора и превращения атомов хлора в ионы Cl + . Затем ионы ускоряются в магнитном поле. Степень, в которой ионы отклоняются магнитным полем, зависит от их относительного отношения массы к заряду. Обратите внимание, что более легкие ионы 35 Cl + отклоняются сильнее, чем более тяжелые 37 Cl + ионы. Измеряя относительные отклонения ионов, химики могут определить их отношение массы к заряду и, следовательно, их массы. (b) Каждый пик в масс-спектре соответствует иону с определенным отношением массы к заряду.
Мы встретим много других примеров позже в этом тексте. В таких случаях химики обычно определяют стандарт, произвольно присваивая числовое значение одной из величин, что позволяет им рассчитать числовые значения для остальных. 9{37}Cl\) примерно в соотношении 3:1. (а) Когда образец элементарного хлора вводится в масс-спектрометр, электрическая энергия используется для диссоциации молекул Cl 2 на атомы хлора и превращения атомов хлора в ионы Cl + . Затем ионы ускоряются в магнитном поле. Степень, в которой ионы отклоняются магнитным полем, зависит от их относительного отношения массы к заряду. Обратите внимание, что более легкие ионы 35 Cl + отклоняются сильнее, чем более тяжелые 37 Cl + ионы. Измеряя относительные отклонения ионов, химики могут определить их отношение массы к заряду и, следовательно, их массы. (b) Каждый пик в масс-спектре соответствует иону с определенным отношением массы к заряду.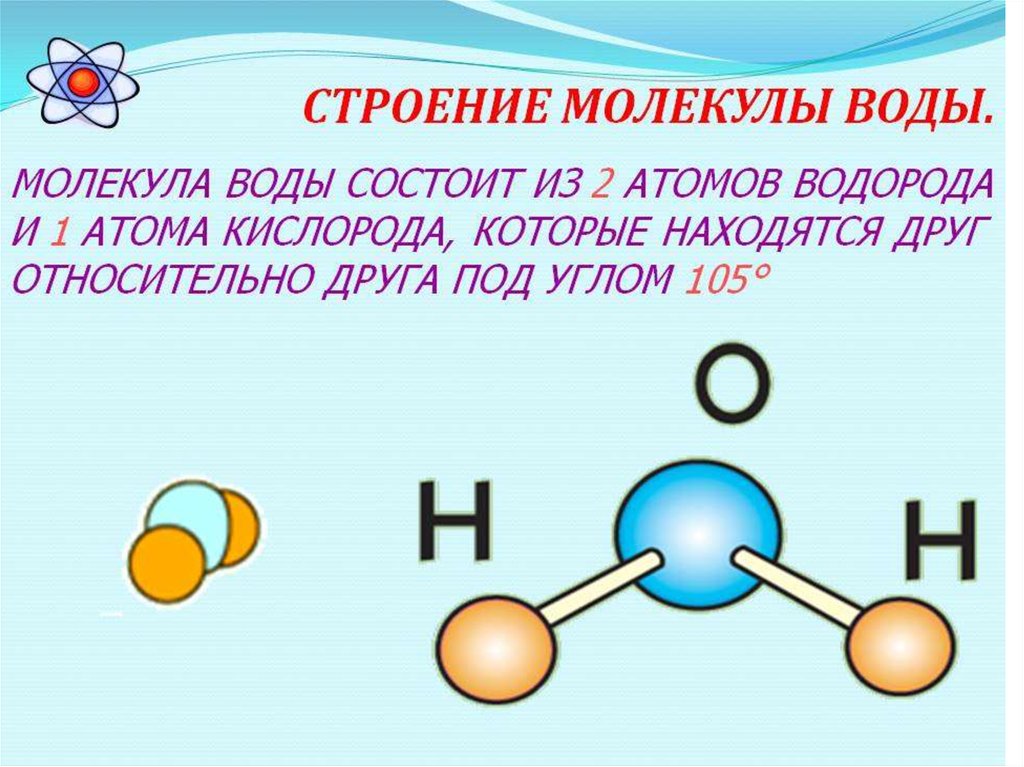 Содержание двух изотопов можно определить по высоте пиков. A: Схема масс-спектрометра, показывающая анализ газообразного хлора. B: Масс-спектр хлора.
Содержание двух изотопов можно определить по высоте пиков. A: Схема масс-спектрометра, показывающая анализ газообразного хлора. B: Масс-спектр хлора.
Произвольным стандартом, который был установлен для описания атомной массы, является атомная единица массы (аму или u), определяемая как одна двенадцатая массы одного атома 12 C. Поскольку массы всех остальных атомов рассчитываются относительно стандарта 12 C, 12 C является единственным атомом, перечисленным в таблице 2.3.2, точная атомная масса которого равна массовому числу. Опыты показали, что 1 а.е.м. = 1,66×10 -24 г.
Масс-спектрометрические эксперименты дают значение 0,167842 для отношения массы 2 H к массе 12 C, поэтому абсолютная масса 2 H равна
9{12} C = 0,167842 \× 12 \; а.е.м. = 2,104104 \; amu \label{Eq4} \]Аналогично определяются массы остальных элементов.
Периодическая таблица содержит атомные массы всех элементов. Сравнение этих значений с данными, указанными для некоторых изотопов в таблице 2.3.2, показывает, что атомные массы, указанные в периодической таблице, никогда точно не соответствуют массам любого из изотопов. Поскольку большинство элементов существуют в виде смесей нескольких стабильных изотопов, атомная масса элемента определяется как средневзвешенное значение масс изотопов. Например, встречающийся в природе углерод в значительной степени представляет собой смесь двух изотопов: 98,89% 12 C (масса = 12 а.е.м. по определению) и 1,11% 13 C (масса = 13,003355 а.е.м.). Процентное содержание 14 C настолько мало, что его можно не учитывать в данном расчете. Средняя атомная масса углерода рассчитывается следующим образом:
Сравнение этих значений с данными, указанными для некоторых изотопов в таблице 2.3.2, показывает, что атомные массы, указанные в периодической таблице, никогда точно не соответствуют массам любого из изотопов. Поскольку большинство элементов существуют в виде смесей нескольких стабильных изотопов, атомная масса элемента определяется как средневзвешенное значение масс изотопов. Например, встречающийся в природе углерод в значительной степени представляет собой смесь двух изотопов: 98,89% 12 C (масса = 12 а.е.м. по определению) и 1,11% 13 C (масса = 13,003355 а.е.м.). Процентное содержание 14 C настолько мало, что его можно не учитывать в данном расчете. Средняя атомная масса углерода рассчитывается следующим образом:
\[ \rm(0,9889 х 12 а.е.м.) + (0,0111 х 13,003355 а.е.м.) = 12,01 а.е.м. \label{Eq5} \]
Углерод состоит преимущественно из 12 С, поэтому его средняя атомная масса должна быть близка к 12 а.е.м., что согласуется с этим расчетом.
Значение 12,01 показано под символом C в периодической таблице, хотя и без сокращения аму, которое обычно опускается. Таким образом, приведенная в таблице атомная масса углерода или любого другого элемента представляет собой средневзвешенное значение масс встречающихся в природе изотопов.
Пример \(\PageIndex{1}\): Бром
Встречающийся в природе бром состоит из двух изотопов, перечисленных в следующей таблице:
| Изотоп | Точная масса (а.е.м.) | Обилие в процентах (%) |
|---|---|---|
| 79 Бр | 78.9183 | 50,69 |
| 81 Бр | 80.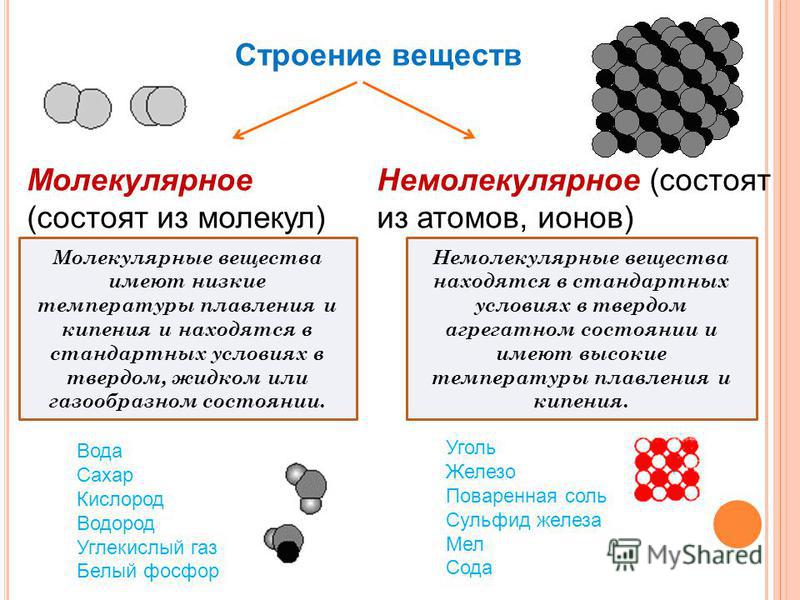 9163 9163 | 49,31 |
Рассчитайте атомную массу брома.
Дано : точная масса и процентное содержание
Запрошено : атомная масса
Стратегия :
- Преобразуйте процентное содержание в десятичную форму, чтобы получить массовую долю каждого изотопа.
- Умножьте точную массу каждого изотопа на его соответствующую массовую долю (процент распространенности ÷ 100), чтобы получить его взвешенную массу.
- Сложите взвешенные массы, чтобы получить атомную массу элемента. 9{81}Br}: 80,9163 а.е.м. х 0,4931 = 39,90 а.е.м.\)
- Ответить
24.31 а.е.м.
C Сумма взвешенных масс атомной массы брома составляет
40,00 а.е.м. + 39,90 а.е.м. D Это значение находится примерно посередине между массами двух изотопов, что ожидается, поскольку процентное содержание каждого из них составляет примерно 50%.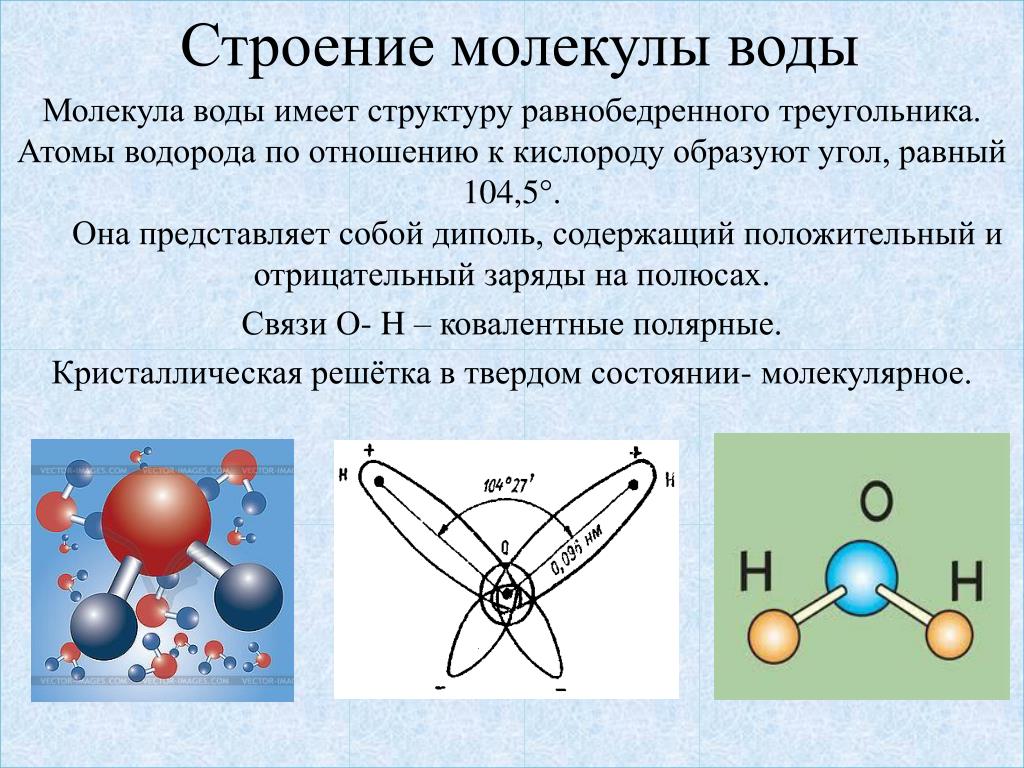
Упражнение \(\PageIndex{1}\)
Три изотопа магния перечислены в следующей таблице:
| Изотоп | Точная масса (а.е.м.) | Обилие в процентах (%) |
|---|---|---|
| 24 мг | 23.98504 | 78,70 |
| 25 мг | 24.98584 | 10.13 |
| 26 мг | 25.98259 | 11.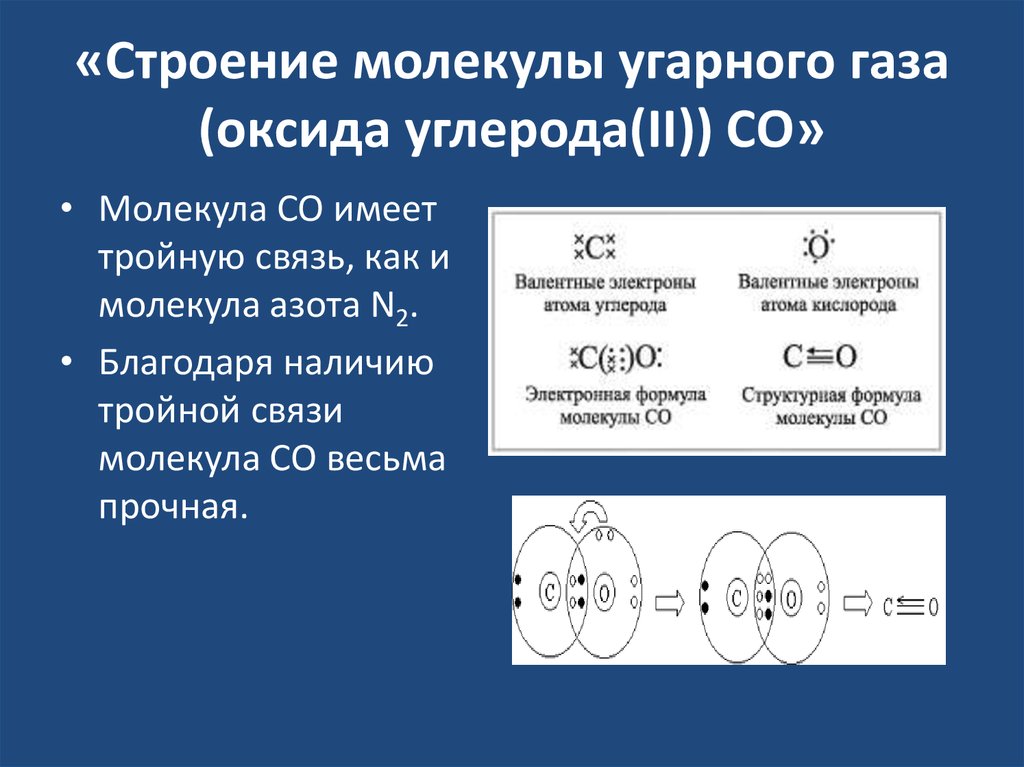 17 17 |
Используйте эти данные для расчета атомной массы магния.
Определение среднего атомного веса элемента: Определение среднего атомного веса элемента(opens in new window) [youtu.be]
Резюме
Масса атома – это средневзвешенное значение, которое в значительной степени определяется количеством протонов и нейтронов, тогда как количество протонов и электронов определяет его заряд. Каждый атом элемента содержит одинаковое количество протонов, известное как атомный номер (Z). Нейтральные атомы имеют одинаковое количество электронов и протонов. Атомы элемента, содержащие разное количество нейтронов, называются изотопами. Каждый изотоп данного элемента имеет одинаковый атомный номер, но разное массовое число (А), которое представляет собой сумму количества протонов и нейтронов.


 Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А. Хауптман
Фрейзер Стоддарт
Джозеф Лошмидт
Курт Вютрих
Бернард Феринга
Герберт А. Хауптман