Водородные связи назвали «кремом от загара» для биомолекул
Химики из Германии и Великобритании обнаружили, что наличие водородных связей в молекулярной системе затрудняет разрыв химических связей под действием ультрафиолета. Это явление может играть важную роль и в биологических системах — белках и нуклеиновых кислотах, защищая их от действия излучения. Исследование опубликовано в журнале Physical Review Letters, кратко о нем сообщает Physics.
Молекулы вещества при поглощении ультрафиолетового излучения переходят в возбужденное состояние. Избыточная энергия, которую при этом получает молекула, может расходоваться на разрыв химической связи — такой процесс называется фотодиссоциацией. В некоторых ситуациях может происходить реорганизация химических связей в молекуле — фотоизомеризация — или даже химическая реакция с другой, невозбужденной молекулой.
В случае химического синтеза эти реакции могут быть целью эксперимента. Но точно такие же процессы могут происходить и в живой клетке с ее компонентами. Это может приводить к неблагоприятным последствиям. Например, под действием ультрафиолета в ДНК происходит димеризация тимина (когда два фрагмента тимина «склеиваются» между собой), искажающая структуру молекулы. Для обращения этих изменений у клеток есть специальные механизмы исправления ошибок, подробнее о которых можно прочитать здесь.
Это может приводить к неблагоприятным последствиям. Например, под действием ультрафиолета в ДНК происходит димеризация тимина (когда два фрагмента тимина «склеиваются» между собой), искажающая структуру молекулы. Для обращения этих изменений у клеток есть специальные механизмы исправления ошибок, подробнее о которых можно прочитать здесь.
Ранее было известно, что наличие водородных связей между молекулой, поглощающей ультрафиолет, и растворителем или белками изменяет характер фотохимических реакций. Считается, что первая стадия таких процессов — перенос атома водорода от возбужденной молекулы к невозбужденным соседям. Исследовать это явление напрямую сложно, признают авторы новой работы. Однако им удалось сравнить фотодиссоциацию в системе с водородными связями и без них.
Авторы изучали поведение молекул аммиака при облучении ультрафиолетом с длиной волны 200 нанометров. Химики сравнивали изменения в электронной структуре изолированных молекул с изменениями в парах молекул, связанных между собой водородной связью.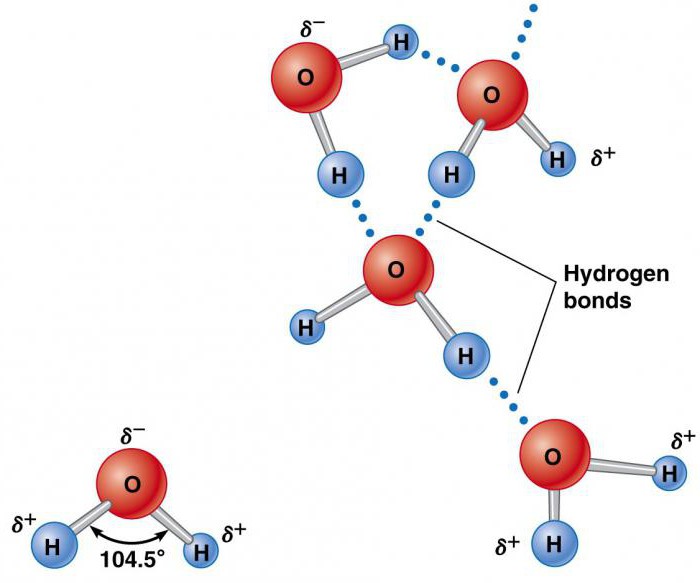 С помощью первого импульса ультрафиолетового лазера ученые возбуждали молекулы. Через небольшие интервалы времени после этого (порядка десятков фемтосекунд) следовал второй импульс, уже в оптическом диапазоне. С его помощью химики получали информацию об электронных свойствах молекулы.
С помощью первого импульса ультрафиолетового лазера ученые возбуждали молекулы. Через небольшие интервалы времени после этого (порядка десятков фемтосекунд) следовал второй импульс, уже в оптическом диапазоне. С его помощью химики получали информацию об электронных свойствах молекулы.
Изолированная молекула аммиака теряла один из атомов водорода после возбуждения лазером. В отличие от нее, димеры, связанные водородной связью, не изменяли химического строения. По данным ученых, после возбуждения одной из молекул ее протон перемещался по водородной связи, как по каналу, к соседней молекуле — происходила стабилизация. Этот процесс обратим, и в некоторый момент в системе происходит перенос заряда, после чего она возвращается в исходное невозбужденное состояние.
Авторы предполагают, что этот механизм защиты от фотодиссоциации может существовать и в биомолекулах. Так, аналогичные водородные связи между аминогруппой (R–NH2) и другими атомами азота возникают в парах оснований РНК и ДНК.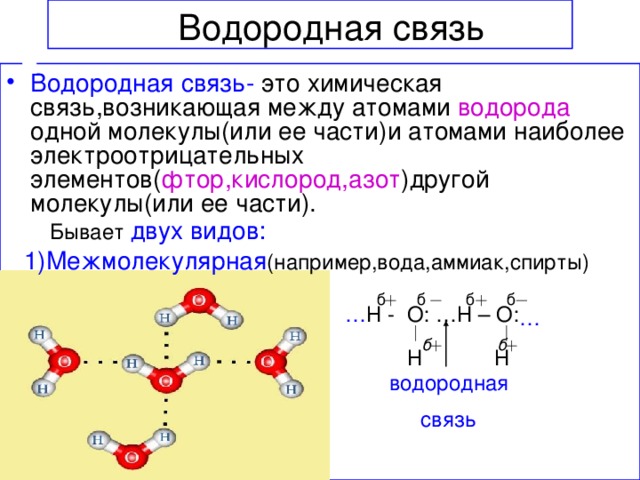
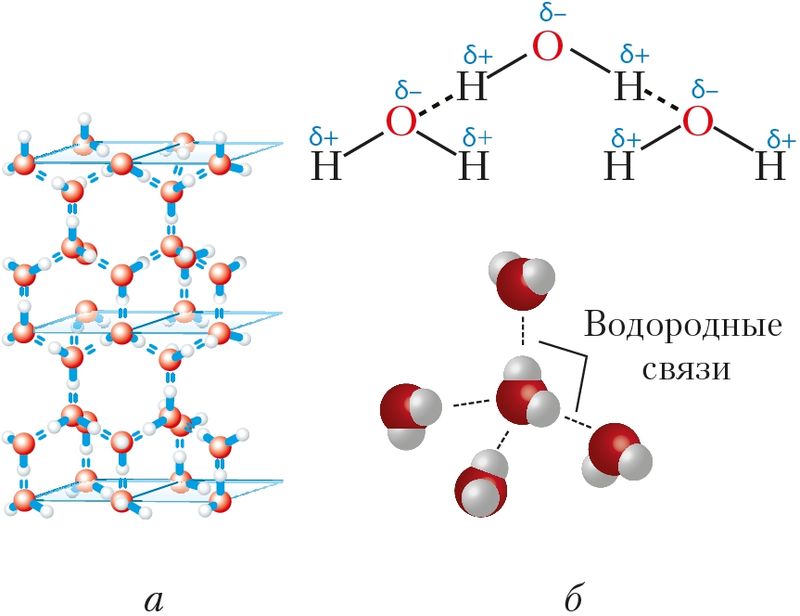
Водородная связь — один из видов взаимодействий, возникающих между двумя молекулами или между разными частями одной молекулы. Его можно описать как электростатическое взаимодействие между электроотрицательными атомами, несущими на себе частичный отрицательный заряд, и атомами водорода, как правило, несущими частичный положительный заряд. К примеру, водородные связи возникают между молекулами воды — отрицательно заряженный кислород «притягивает» к себе положительно заряженный водород. Если бы водородных связей в воде не существовало, то она скорее всего была бы газообразной при комнатной температуре, подобно сероводороду.
Благодаря водородным связям в воде существуют ассоциаты молекул, напоминающие собой кристаллы льда. Это короткоживущие объекты, молекулы которых постоянно сменяют друг друга. Недавно исследователям из Университета Стоуни-Брук удалось найти следы этих «твердых» объектов в жидкой воде — фононы (кванты колебаний кристаллической решетки).
Владимир Королёв
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.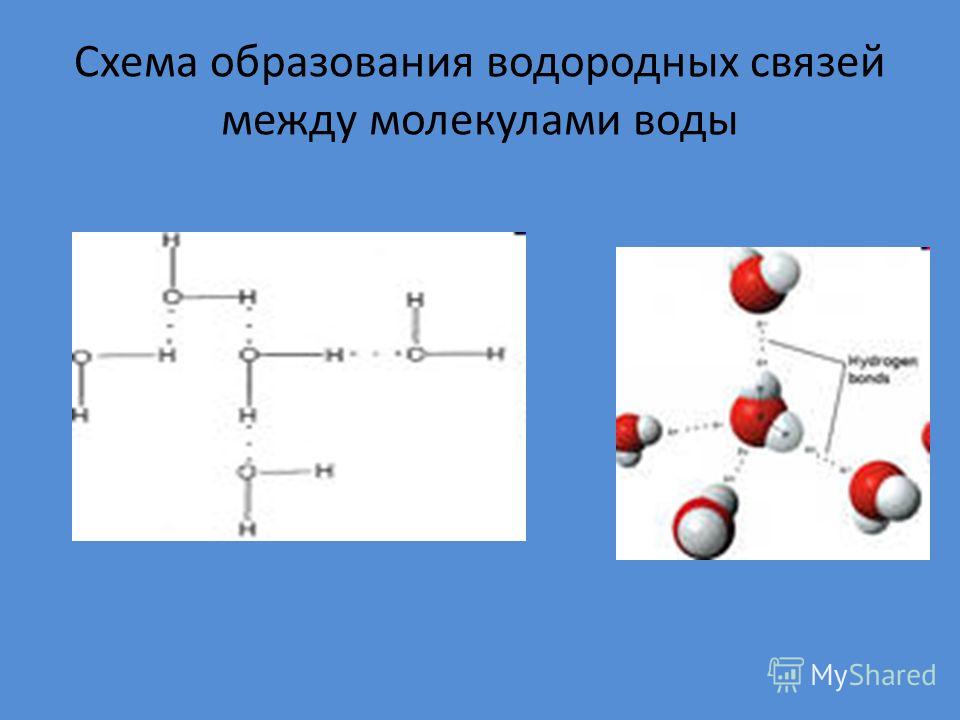
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
зависимость температуры кипения и температуры плавления от молекулярной массы соединенийТак, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
- Межмолекулярная водородная связь образуется между различными молекулами веществ. Обязательным условием образования такого вида водородной связи — это наличие водорода в одной молекуле и одного из элементов с высокой электроотрицательностью в другой молекуле (например, F, O, N, Cl, S). Связь может возникать как между одинаковыми молекулами, так и между разными. Например, это могут быть молекулы аммиака, воды, фтороводорода, спиртов (например, метанол, этанол), карбоновых кислот (например, муравьиная, уксусная кислоты), аминокислот в молекуле белка:
- Внутримолекулярная водородная связь образуется внутри одной молекулы. Условие образования внутримолекулярной водородной связи — это наличие в одной молекуле и атомов водорода и атомы с высокой электроотрицательностью.

Характеристика водородной связи
Водородная связь характеризуется
- Направленностью в пространстве и насыщаемостью.
- Водородная связь оказывает большое влияние на
- Водородная связь — слабая связь. Величина энергии водородной связи обычно лежит в пределах от 4 до 25 кДж/моль, это всего несколько процентов от величины энергии обычной химической связи.

N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Тонуть или плавать — Что происходит, когда вы ослабляете водородные связи в воде?
Вода — чудодейственная жидкость. Все живые существа нуждаются в нем, чтобы выжить, и он сам по себе обладает некоторыми уникальными свойствами. Водородные связи ответственны за необычные свойства воды. Эти сильные межмолекулярные силы образуются между молекулами воды и ответственны за высокую температуру кипения и широкий диапазон температур в жидкой воде.
Эти сильные межмолекулярные силы образуются между молекулами воды и ответственны за высокую температуру кипения и широкий диапазон температур в жидкой воде.
Вода известна как молекула Микки Мауса, потому что два атома водорода соединяются с одним атомом кислорода, образуя молекулу – h3O. Когда два атома водорода связываются с кислородом, электроны распределяются неравномерно. (Вытащите школьную химию для этого урока.) Из-за этого кислород имеет частичный отрицательный заряд, а водород — частичный положительный заряд.
Противоположные заряды притягиваются друг к другу, как магниты, и образуют водородную связь.
Водородные связи не являются прочными, но они заставляют молекулы воды слипаться. Связи заставляют молекулы воды прочно связываться друг с другом. Но эти связи можно разорвать, просто добавив в воду другое вещество.
Как кусок льда плавает на поверхности воды? Или по нему пробегает ящерица или водяной жук? Водородные связи сближают молекулы, образуя плотную структуру.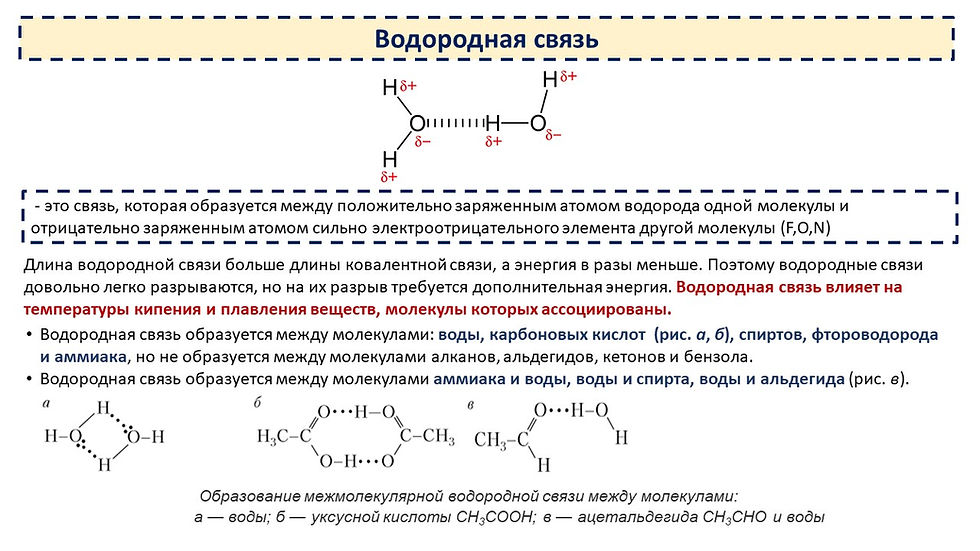 Молекулы хотят оставаться вместе и удерживать лед или жука. Поверхностное натяжение придает воде достаточную структуру, чтобы удерживать что-то сверху. Если нарушить поверхностное натяжение, предмет утонет.
Молекулы хотят оставаться вместе и удерживать лед или жука. Поверхностное натяжение придает воде достаточную структуру, чтобы удерживать что-то сверху. Если нарушить поверхностное натяжение, предмет утонет.
Что произойдет, если вы ослабите или измените величину поверхностного натяжения воды? Добавление в воду только одного дополнительного вещества может сильно повлиять на водородные связи, определяя, будет ли что-то плавать или тонет.
Проведите простой эксперимент, чтобы проверить прочность водородных связей в воде –
Эксперимент
- Наполните водой два стакана поровну.
- В одну из чашек добавьте около 1 унции (30 мл) средства для мытья посуды и осторожно перемешайте раствор.
- Создайте два одинаковых бумажных шарика, которые поместятся в ваши стаканы с водой.
- Аккуратно бросьте один бумажный шарик в обычную воду, а другой – в стакан с мыльным раствором.

- Вы быстро заметите, что бумажные шарики по-разному реагируют на две жидкости. На самом деле, один бумажный шар начинает тонуть, а другой остается на поверхности воды!
Как это работает?
Может показаться, что один бумажный шарик плывет по воде, а другой тонет, но дело не только в плотности. Вместо этого вы наблюдаете разницу в поверхностном натяжении воды. Мыло — это поверхностно-активное вещество или соединение, которое снижает поверхностное натяжение жидкости. Мыло, в частности, снижает поверхностное натяжение воды, ослабляя водородные связи, которые делают воду таким особенным веществом.
Это более низкое поверхностное натяжение имеет два прямых эффекта, когда речь идет о бумажном шаре. Во-первых, более низкое поверхностное натяжение означает, что бумага не может находиться на поверхности воды, что позволяет большему количеству воды соприкасаться с большей частью бумаги. Во-вторых, ослабление водородных связей означает, что вода с большей вероятностью впитается в пористую бумагу, что сделает бумагу более плотной и заставит ее тонуть.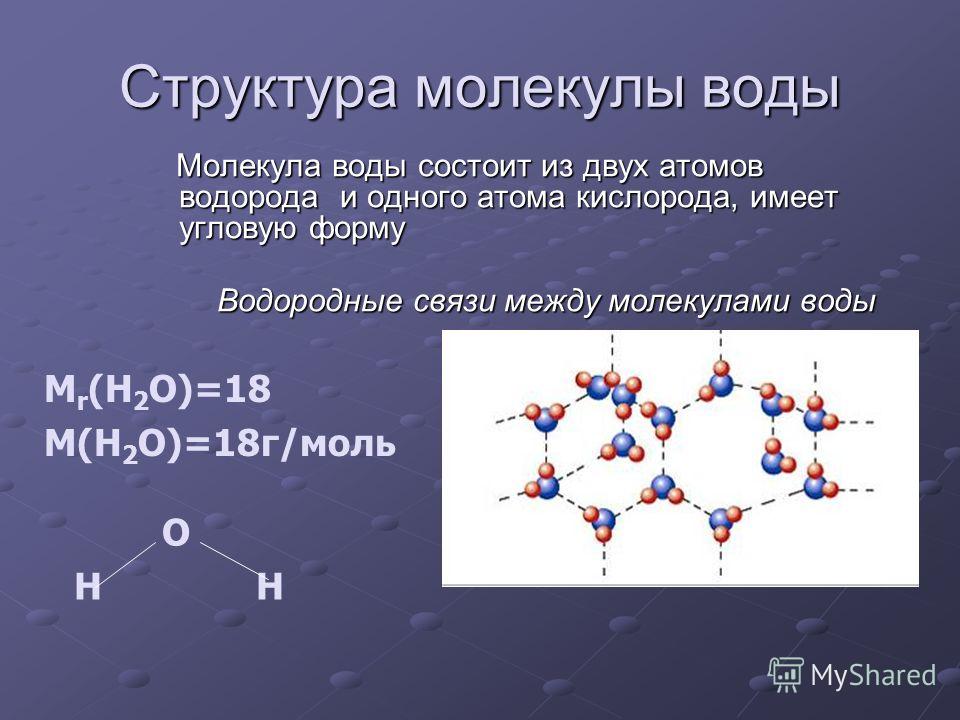
Узнайте, как провести этот эксперимент, превратить его в научную ярмарку и вывести его на новый уровень, посетив страницу «Эксперимент с раковиной или плаванием» на сайте SteveSpanglerScience.com.
Почему молекулы воды вокруг небольших гидрофобных растворенных веществ образуют более прочные водородные связи, чем в массе?
. 2020 апрель; 1864(4):129537.
doi: 10.1016/j.bbagen.2020.129537. Epub 2020 21 января.
Франси Мерзель 1 , Франк Авбель 2
Принадлежности
- 1 Теоретический факультет Национального химического института, Хайдрихова 19, 1000 Любляна, Словения. Электронный адрес: franci.
 [email protected].
[email protected]. - 2 Теоретический факультет, Национальный химический институт, Хайдрихова 19, 1000 Любляна, Словения.
- PMID: 31972294
- DOI: 10.1016/j.bbagen.2020.129537
Франси Мерзель и др. Биохим Биофиз Acta Gen Subj. 2020 апрель
. 2020 апрель; 1864(4):129537.
doi: 10.1016/j.bbagen.2020.129537. Epub 2020 21 января.
Авторы
Франси Мерзель 1 , Франк Авбель 2
Принадлежности
- 1 Теоретический факультет Национального химического института, Хайдрихова 19, 1000 Любляна, Словения.
 Электронный адрес: [email protected].
Электронный адрес: [email protected]. - 2 Теоретический факультет, Национальный химический институт, Хайдрихова 19, 1000 Любляна, Словения.
- PMID: 31972294
- DOI: 10.1016/j.bbagen.2020.129537
Абстрактный
Известно, что молекулярные растворенные вещества сильно влияют на структурные и динамические свойства окружающей воды. В нашем недавнем исследовании (PNAS, 114, 322 (2017)) мы определили наличие усиленных водородных связей воды вблизи гидрофобных растворенных веществ, используя как ИК-спектроскопию, так и моделирование молекулярной динамики ab-initio. Было показано, что молекулы воды, участвующие в усилении водородных связей, демонстрируют обширную структурную упорядоченность и ограниченную подвижность.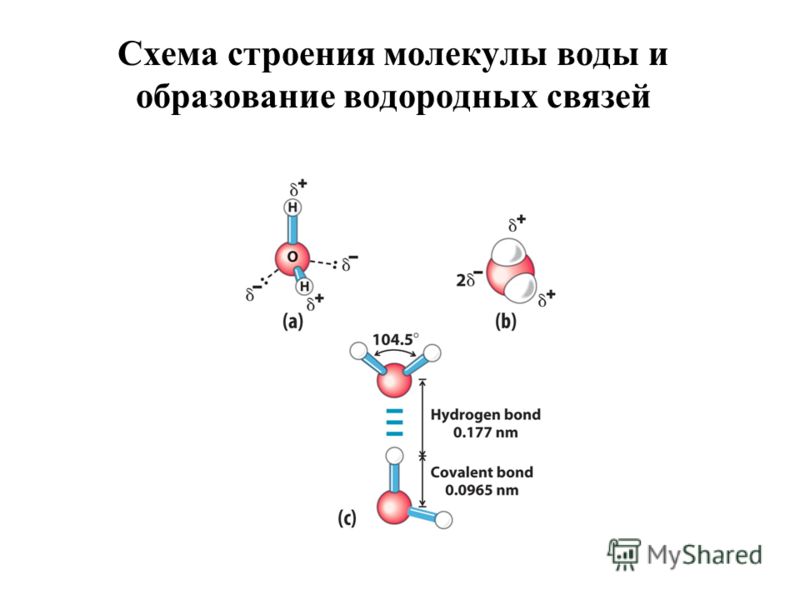
Ключевые слова: Ab-initio MD моделирование; Прочность водородной связи; Гидрофобное увлажнение; Локальное электрическое поле; Структурирование воды.
Copyright © 2020 Elsevier B.V. Все права защищены.
Заявление о конфликте интересов
w3.org/1999/xlink» xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:p1=»http://pubmed.gov/pub-one»> Декларация о конкурирующих интересах Нет.Похожие статьи
Происхождение гидрофобности и повышенной прочности водородных связей воды вблизи чисто гидрофобных растворенных веществ.
Грдадольник Ю., Мерзель Ф., Авбель Ф. Грдадольник Дж. и соавт. Proc Natl Acad Sci U S A. 10 января 2017 г .; 114 (2): 322–327. doi: 10.1073/pnas.1612480114. Epub 2016 27 декабря. Proc Natl Acad Sci U S A. 2017. PMID: 28028244 Бесплатная статья ЧВК.
Структурные и спектроскопические свойства воды вокруг малых гидрофобных растворенных веществ.
Монтанья М., Стерпоне Ф., Гвидони Л. Монтанья М. и др. J Phys Chem B. 27 сентября 2012 г .
 ; 116 (38): 11695-700. дои: 10.1021/jp303213m. Epub 2012 18 сентября.
J Phys Chem B. 2012.
PMID: 22946539
Бесплатная статья ЧВК.
; 116 (38): 11695-700. дои: 10.1021/jp303213m. Epub 2012 18 сентября.
J Phys Chem B. 2012.
PMID: 22946539
Бесплатная статья ЧВК.Водные тетраэдры, динамика водородных связей и ориентационная подвижность воды вокруг гидрофобных растворенных веществ.
Галамба Н. Галамба Н. J Phys Chem B. 17 апреля 2014 г.; 118 (15): 4169-76. doi: 10.1021/jp500067a. Epub 2014 4 апр. J Phys Chem B. 2014. PMID: 24660958
Последние достижения в теоретических, симуляционных и экспериментальных исследованиях роли водородных связей воды в гидрофобных явлениях.
Джикаев Ю.С., Ракенштейн Э. Джикаев Ю.С., и соавт. Adv Коллоидный интерфейс Sci. 2016 Сентябрь; 235: 23-45. doi: 10.1016/j.cis.2016.05.006. Эпаб 2016 18 мая.
 Adv Коллоидный интерфейс Sci. 2016.
PMID: 27312562
Обзор.
Adv Коллоидный интерфейс Sci. 2016.
PMID: 27312562
Обзор.Динамика гидратации воды в белках.
Тейшейра Х. Тейшейра Дж. Gen Physiol Biophys. 2009 июнь; 28 (2): 168-73. doi: 10.4149/gpb_2009_02_168. Gen Physiol Biophys. 2009. PMID: 19592713 Обзор.
Посмотреть все похожие статьи
Цитируется
Анализ сайт-специфических модификаций миоглобина в новом конечном продукте улучшенного гликозилирования, полученном из мелибиозы.
Гостомска-Пампух К., Вишневский Ю.Р., Совинский К., Грущецкий В.И., Гамиан А., Станишевская М. Гостомска-Пампуч К. и соавт. Int J Mol Sci. 2022 27 октября; 23 (21): 13036. дои: 10.3390/ijms232113036. Int J Mol Sci.






 Электронный адрес:
Электронный адрес: 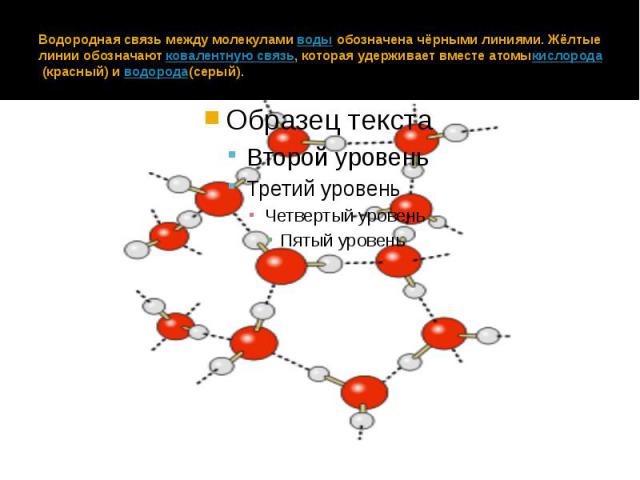 ; 116 (38): 11695-700. дои: 10.1021/jp303213m. Epub 2012 18 сентября.
J Phys Chem B. 2012.
PMID: 22946539
Бесплатная статья ЧВК.
; 116 (38): 11695-700. дои: 10.1021/jp303213m. Epub 2012 18 сентября.
J Phys Chem B. 2012.
PMID: 22946539
Бесплатная статья ЧВК.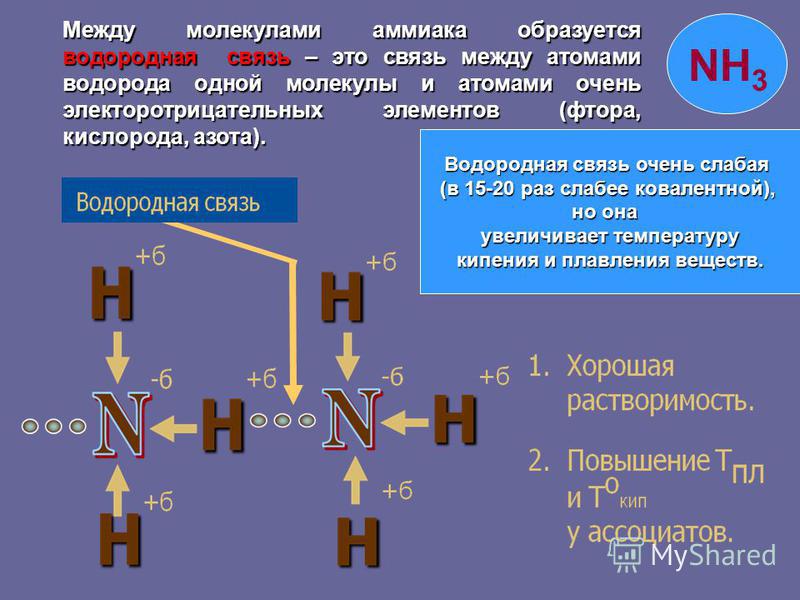 Adv Коллоидный интерфейс Sci. 2016.
PMID: 27312562
Обзор.
Adv Коллоидный интерфейс Sci. 2016.
PMID: 27312562
Обзор.