Строение молекулы воды
К.х.н. О.В. Мосин
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ В АНАЛИЗЕ СТРОЕНИЯ МОЛЕКУЛЫ ВОДЫ
Если нам захочется посмотреть, как устроена молекула воды, то придется в первую очередь вспомнить ее состав. Молекула воды состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода H2O (формула воды). В молекуле воды главное действующее лицо — атом кислорода. Вспомним его энергетическую диаграмму (рисунок слева):
Два неспаренных р-электрона атома кислорода О очень реакционноспособны. Они всегда готовы образовать химические связи с двумя s-электронами атомов водорода.
Рис. Так выглядит перекрывание р-орбиталей кислорода с s-орбиталями двух атомов водорода (рисунок справа):
Таким образом, из двух атомов водорода и одного атома кислорода получается угловая молекула воды которую можно условно изобразить еще так:
Рис. Молекула воды имеет угловую форму (ниже слева)
Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород — кислород не прямой (90°), а немного больше — 104,5°. Химические связи эти полярные: кислород гораздо электроотрицательнее водорода и подтягивает к себе электронные облака, образующие химические связи. Вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода — положительный. Поэтому и вся молекула воды тоже попадает в отряд «химических полярников» — веществ, молекулы которых представляют собой электрические диполи.
Строение молекулы воды Н2О можно проанализировать с помощью метода молекулярных орбиталей (МО). Схема молекулярных орбиталей молекулы воды приведена ниже.
Рис. Схема расположения координатных осей (а) и энергетическая диаграмма орбиталей молекулы Н2О (б).
Для построения схемы молекулярной орбитали молекулы воды Н2О совместим начало координат с атомом кислорода, а атомы водорода расположим в плоскости xz (Подробнее см. Г.Грей «Электроны и химическая связь»,М., изд-во «Мир», 1967, с.155-62 и G.L.Miessier, D.A.Tarr, «Inorganic Chemistry», Prantice Hall Int.Inc., 1991, p.153-57).
В формировании суммарной молекулярной орбитали воды принимают участие отдельные атомные орбитали водорода и кислорода, обладающие одинаковой симметрией и близкими энергиями. Однако вклад атомных орбиталей атомов водорода и кислорода в образование общей молекулярной орбитали молекулы воды разный, что отражается в разных величинах коэффициентов в соответствующих линейных комбинациях атомных орбиталей. Взаимодействие (перекрывание) 1sатомной орбитали водорода, 2sи 2рzатомной орбитали кислорода приводит к образованию 2a1-связывающей и 4a1-разрыхляющей молекулярной орбиталей.
Рис. Перекрывание 2s(а), 2px- (б) и 2pя(в) орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
Из этих данных и умозаключений можно сделать следующие выводы.
1. Молекула Н2О диамагнитна.
2. Электроны на связывающих 2а1 и 1b1 орбиталях обеспечивают связи ОН, а на несвязывающих (3а1 и 1b2) орбиталях соответствуют свободным электронным парам в молекуле Н2О, как это описывается в рамках метода валентных связей.
3. Принципиальным отличием метода молекулярных орбиталей от метода валентных связей является разная энергия ионизации занятых молекулярных орбиталей, составляющая (в эВ) 27.3 (2а1), 16.2 (1b1), 14.5 (3а1) и 12.6 (1b2), соответственно.
4. Метод молекулярных связей (в отличие от метода валентных связей) позволяет оценить разницу в энергиях молекулярных орбиталей. В частности, существенным является различие в энергии двух несвязывающих орбиталей 3а1 и 1b2. Это связано с различной природой орбиталей — 1b2 локализована на атоме кислорода, тогда как 3а1 образована с участием атомной орбитали водорода и кислорода и не является локализованной. Локализация электронов на 1b2 молекулярной орбитали приводит к тому, что отрицательный заряд в молекуле Н2О сосредоточен вблизи атома кислорода, а положительный — вблизи атомов водорода. Таким образом, молекула Н2О оказывается полярной (дипольный момент μ = l. q = 1.84D). Это соответствует и простым соображениям электроотрицательности: связывающие электроны смещаются к более электроотрицательному атому.
Так как у молекулы Н2О в образовании связей принимают в основном участие 2р-орбитали кислорода и 1s-орбитали водорода, то можно ожидать, что угол НО- Н должен быть близким к 90о. Однако из эксперимента следует, что этот угол равен 104.5о. Причина такого различия заключается в том, что этот угол соответствует минимуму энергии. Согласно квантово-механическим расчетам, энергия молекулы зависит не только от энергии молекулярных орбиталей и числа электронов на них, но и от валентного угла НО- Н. В приближении метода валентных связей увеличение угла НО- Н от 90о (характерного для взаимодействия р-орбиталей) до 104.5о связано с взаимным отталкиванием положительно заряженных атомов водорода.
При переходе от Н2О к другим двухатомным молекулам Н2S, H2Se и H2Te диаграммы молекулярных орбиталей изменяются, что обусловлено увеличением энергий исходных АО халькогенов: Е3s = -20.7 эВ; Е3р = -12.0 эВ; Е4s = 20.8 эВ; Е4р = 11.9 эВ. Поэтому растет участие ns-атомных орбиталей халькогена в образовании молекулярных орбиталей. При этом несвязывающий характер орбиталей nb2 сохраняется, а связывающий характер орбиталей 2а1 усиливается. В целом, по мере увеличения энергии атомных орбиталей nsи nруменьшается разность сумм энергий молекулярных и атомных орбиталей, которые характеризуют прочность молекул Н2Э. Вклады nратомных орбиталей атомов халькогенов в энергию молекулярной орбитали уменьшаются, и соответственно понижается локализация электронов на атомах и полярность молекул. Вероятно, благодаря этому уменьшаются валентные углы НЭ- Н в молекулах халькогенов. Именно так, с точки зрения теории молекулярных орбиталей, объясняется понижение устойчивости молекул H2S, H2Sе, H2Te по сравнению с молекулой Н2О.
К.х.н. О.В. Мосин
20 завораживающих фактов о невообразимо маленьких объектах
1. Но начнем мы совсем с другой стороны. Прежде чем отправиться в путешествие к глубинам материи, давайте обратим свой взор вверх.
Например, известно, что до Луны в среднем почти 400 тысяч километров, до Солнца — 150 миллионов, до Плутона (который уже не виден без телескопа) — 6 миллиардов, до ближайшей звезды Проксимы Центавра — 40 триллионов, до ближайшей крупной галактики туманности Андромеды — 25 квинтиллионов, и наконец до окраин обозримой Вселенной — 130 секстиллионов.
Впечатляюще, конечно, но разница между всеми этими «квадри-», «квинти-» и «сексти-» не кажется столь уж огромной, хотя они и различаются между собой в тысячу раз. Совсем другое дело микромир. Разве в нем может быть скрыто так уж много интересного, ведь ему просто негде там поместиться. Так говорит нам здравый смысл и ошибается.
2. Если на одном конце логарифмической шкалы отложить самое маленькое известное расстояние во Вселенной, а на другом — самое большое, то посередине окажется… песчинка. Её диаметр — 0.1 мм.
3. Если положить в ряд 400 млрд песчинок, их ряд обогнёт весь земной шар по экватору. А если собрать эти же 400 млрд в мешок, весить он будет около тонны.
4. Толщина человеческого волоса — 50–70 микронам, то есть их 15–20 штук на миллиметр. Для того чтобы выложить ими расстояние до Луны, потребуется 8 триллионов волос (если складывать их не по длине, а по ширине, конечно). Поскольку на голове у одного человека их около 100 тысяч, то если собрать волосы у всего населения России, до Луны хватит с лихвой и даже еще останется.
5. Размер бактерий — от 0.5 до 5 микрон. Если увеличить среднюю бактерию до такого размера, что она удобно ляжет нам в ладонь (в 100 тысяч раз), толщина волоса станет равной 5 метрам.
6. Кстати, внутри человеческого тела обитает целый квадриллион бактерий, а их общий вес составляет 2 килограмма. Их, собственно, даже больше, чем клеток самого тела. Так что вполне можно сказать, что человек — это просто такой организм, состоящий из бактерий и вирусов с небольшими вкраплениями чего-то еще.
7. Размеры вирусов различаются еще больше, чем бактерий, — чуть ли не в 100 тысяч раз. Если бы дело обстояло так с людьми, то они были бы ростом от 1 сантиметра до 1 километра, и их социальное взаимодействие стало бы любопытным зрелищем.
8. Средняя длина наиболее распространенных разновидностей вирусов — 100 нанометров или 10^(-7) степени метра. Если мы снова выполним операцию приближения таким образом, чтобы вирус стал размером с ладонь, то длина бактерии будет 1 метр, а толщина волоса — 50 метров.
9. Длина волны видимого света — 400–750 нанометров, и увидеть объекты меньше этой величины попросту невозможно. Попытавшись осветить такоей объект, волна просто обогнет его и не отразится.
10. Иногда задают вопрос, как выглядит атом или какого он цвета. На самом деле, атом не выглядит никак. Просто вообще никак. И не потому, что у нас недостаточно хорошие микроскопы, а потому что размеры атома меньше расстояния, для которого существует само понятие «видимости»…
11. Вдоль окружности земного шара можно плотно разместить 400 триллионов вирусов. Много. Такое расстояние в километрах свет проходит за 40 лет. Но если собрать их всех вместе, то они легко поместятся на кончике пальца.
12. Примерный размер молекулы воды — 3 на 10^(-10) метра. В стакане воды таких молекул 10 септиллионов — примерно столько миллиметров от нас до Галактики Андромеды. А в кубическом сантиметре воздуха молекул 30 квинтиллионов (в основном, азота и кислорода).
13. Диаметр атома углерода (основы всей жизни на Земле) — 3.5 на 10^(-10) метра, то есть даже чуть больше, чем молекулы воды. Атом водорода в 10 раз меньше — 3 на 10^(-11) метра. Это, конечно, мало. Но насколько мало? Поражающий всякое воображение факт состоит в том, что мельчайшая, едва различимая крупинка соли состоит из 1 квинтиллиона атомов.
Давайте обратимся к нашему стандартному масштабу и приблизим атом водорода так, чтобы он удобно лег в руку. Вирусы тогда будут 300-метрового размера, бактерии 3-километрового, а толщина волоса станет равна 150 километрам, и даже в лежащем состоянии он выйдет за границы атмосферы (а в длину может достать и до Луны).
14. Так называемый «классический» диаметр электрона — 5.5 фемтометров или 5.5 на 10^(-15) метра. Размеры протона и нейтрона еще меньше и составляют около 1.5 фемтометров. Протонов в метре примерно столько же, сколько муравьев на планете Земля. Используем уже привычное нам увеличение. Протон удобно лежит у нас в ладони, — и тогда размер среднего вируса окажется равным 7 000 километрам (почти как вся Россия с запада на восток, между прочим), а толщина волоса в 2 раза превысит размеры Солнца.
15. О размерах сложно сказать что-то определенное. Предполагается, что они находятся где-то в пределах 10^(-19) — 10^(-18) метра. Самый маленький — истинный кварк — «диаметром» (давайте для напоминания о вышесказанном будем писать это слово в кавычках) 10^(-22) метра.
16. Есть еще такая штука как нейтрино. Посмотрите на свою ладонь. Через нее ежесекундно пролетает триллион нейтрино, испущенных Солнцем. И можете не прятать руку за спину. Нейтрино с легкостью пройдут и сквозь ваше тело, и сквозь стену, и сквозь всю нашу планету, и даже сквозь слой свинца толщиной в 1 световой год. «Диаметр» нейтрино равен 10^(-24) метра — эта частица в 100 раз меньше истинного кварка, или в миллиард раз меньше протона, или в 10 септиллионов раз меньше тираннозавра. Почти во столько же раз сам тираннозавр меньше всей обозримой Вселенной. Если увеличить нейтрино так, чтобы он был размером с апельсин, то даже протон будет в 10 раз больше Земли.
17. А сейчас я искренне надеюсь, что вас должна поразить одна из двух нижеследующих вещей. Первая — мы можем продвинуться еще дальше (и даже сделать какие-то осмысленные предположения о том, что там будет). Вторая — но при этом двигаться вглубь материи бесконечно все-таки нельзя, и вскоре мы уткнемся в тупик. Вот только для достижения этих самых «тупиковых» размеров нам придется опуститься еще на 11 порядков, если считать от нейтрино. То есть эти размеры меньше нейтрино в 100 миллиардов раз. Во столько же раз песчинка меньше всей нашей планеты, кстати.
18. Итак, на размерах 10^(-35) метра нас ждет такое замечательное понятие, как планковская длина, — минимальное расстояние из возможных в реальном мире (насколько это принято считать в современной науке).
19. Еще здесь обитают квантовые струны — объекты весьма примечательные с любой точки зрения (например, они одномерны, — у них нет толщины), но для нашей темы важно, что их длина тоже находится в пределах 10^(-35) метра. Давайте проделаем наш стандартный «увеличительный» эксперимент в последний раз. Квантовая струна становится удобного размера, и мы держим ее в руке как карандаш. При этом нейтрино будет в 7 раз больше Солнца, а атом водорода в 300 раз превысит размеры Млечного Пути.
20. Наконец мы подошли к самой структуре мироздания — масштабу, на котором пространство становится похожим на время, время на пространство, и происходят разные другие причудливые штуки. Дальше уже ничего нет (наверное)…
Тяжёлая вода — Википедия
| Тяжёлая вода | |||
|---|---|---|---|
| |||
| Систематическое наименование | оксид дейтерия | ||
| Традиционные названия | тяжёлая вода | ||
| Хим. формула | D2O | ||
| Состояние | жидкость | ||
| Молярная масса | 20,04 г/моль | ||
| Плотность | 1,1042 г/см³ | ||
| Динамическая вязкость | 0,00125 Па·с | ||
| Температура | |||
| • плавления | 3,81 °C | ||
| • кипения | 101,43 °C | ||
| Критическая точка | |||
| • давление | 21,86 МПа | ||
| Мол. теплоёмк. | 84,3 Дж/(моль·К) | ||
| Уд. теплоёмк. | 4,105 Дж/(кг·К) | ||
| Энтальпия | |||
| • образования | −294,6 кДж/моль | ||
| • плавления | 5,301 кДж/моль | ||
| • кипения | 45,4 кДж/моль | ||
| Давление пара | 10 мм рт. ст. при 13,1 °C 100 мм рт. ст. при 54 °C | ||
| Растворимость | |||
| • в воде | неограниченная | ||
| • в эфире | малорастворима | ||
| • в этаноле | неограниченная | ||
| Показатель преломления | 1,32844 (при 20 °C) | ||
| Рег. номер CAS | 7789-20-0 | ||
| PubChem | 24602 | ||
| Рег. номер EINECS | 232-148-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | ZC0230000 | ||
| ChEBI | 41981 | ||
| ChemSpider | 23004 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Тяжёлая вода́ — обычно этот термин применяется для обозначения тяжеловодородной воды, известной также как оксид дейтерия. Тяжеловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо двух атомов обычного лёгкого изотопа водорода (протия) содержит два атома тяжёлого изотопа водорода — дейтерия, а её кислород по изотопному составу соответствует кислороду воздуха[1]. Формула тяжеловодородной воды обычно записывается как D
Молекулы тяжеловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году, за что учёный был удостоен Нобелевской премии по химии в 1934 году. Уже в 1933 году Гилберт Льюис впервые выделил чистую тяжеловодородную воду. При электролизе обычной воды, содержащей наряду с обычными молекулами воды незначительное количество молекул полутяжёлой воды (НDО) и ещё меньшее количество молекул тяжёлой воды (D2O), включающих в себя тяжёлый изотоп водорода, остаток постепенно обогащается молекулами этих соединений. Из такого остатка после многократного повторения электролиза Льюису удалось выделить небольшое количество воды, состоящей почти на 100 % из молекул соединения кислорода с дейтерием и получившей название тяжёлой. Этот способ производства тяжёлой воды остаётся основным и сейчас, хотя используется в основном на окончательной стадии обогащения от 5—10 % до >99 % (см. ниже).
После открытия в конце 1938 года деления ядер и осознания возможности использования цепных ядерных реакций деления, индуцированных нейтронами, возникла необходимость в замедлителе нейтронов — веществе, позволяющем эффективно замедлять нейтроны, не теряя их в реакциях захвата. Наиболее эффективно нейтроны замедляются лёгкими ядрами, и самым эффективным замедлителем должны были бы быть ядра обычного водорода (протия), однако они обладают высоким сечением захвата нейтронов. Напротив, тяжёлый водород захватывает очень мало нейтронов (сечение захвата тепловых нейтронов у протия в более чем 100 тысяч раз выше, чем у дейтерия). Технически наиболее удобным соединением дейтерия является тяжёлая вода, причём она способна также служить теплоносителем, отводя выделяющееся тепло от области, где происходит цепная реакция деления. С самых ранних времён ядерной энергетики тяжёлая вода стала важным компонентом в некоторых реакторах, как энергетических, так и предназначенных для наработки изотопов плутония для ядерного оружия. Эти так называемые тяжеловодные реакторы имеют то преимущество, что могут работать на природном (необогащённом) уране без использования графитовых замедлителей, которые на этапе вывода из эксплуатации могут представлять опасность взрыва пыли и содержат наведённую радиоактивность (углерод-14 и ряд других радионуклидов)
Производство тяжёлой воды в СССР[править | править код]
 | Эта статья или раздел описывает ситуацию применительно лишь к одному региону (СССР) Вы можете помочь Википедии, добавив информацию для других стран и регионов. |
Промышленное производство и применение тяжёлой воды началось с развитием атомной энергетики. В СССР при организации Лаборатории № 3 АН СССР (современный ИТЭФ) перед руководителем проекта А. И. Алихановым была поставлена задача создания реактора на тяжёлой воде. Это обусловило потребность в тяжёлой воде, и техническим советом Специального комитета при СНК СССР был разработан проект Постановления СНК СССР «О строительстве полупромышленных установок по производству продукта 180», работы по созданию производительных установок тяжёлой воды в кратчайшие сроки были поручены руководителю атомного проекта Б. Л. Ванникову, народному комиссару химической промышленности М. Г. Первухину, представителю Госплана Н. А. Борисову, народному комиссару по делам строительства СССР С. З. Гинзбургу, народному комиссару машиностроения и приборостроения СССР П. И. Паршину и народному комиссару нефтяной промышленности СССР Н. К. Байбакову
| Параметр | D2O | HDO | H2O |
|---|---|---|---|
| Температура плавления, °C | 3,82 | 2,04 | 0,00 |
| Температура кипения, °C | 101,4 | 100,7 | 100,0 |
| Плотность при 20 °C, г/см³ | 1,1056 | 1,054 | 0,9982 |
| Температура максимальной плотности, °C | 11,6 | 4,0 | |
| Вязкость при 20 °C, сантипуаз | 1,2467 | 1,1248 | 1,0016 |
| Поверхностное натяжение при 25 °C, дин·см | 71,87 | 71,93 | 71,98 |
| Молярное уменьшение объёма при плавлении, см³/моль | 1,567 | 1,634 | |
| Молярная теплота плавления, ккал/моль | 1,515 | 1,436 | |
| Молярная теплота парообразования, ккал/моль | 10,864 | 10,757 | 10,515 |
| pH при 25 °C | 7,41 | 7,266 | 7,00 |
В природных водах один атом дейтерия приходится на 6400—7600[5] атомов протия. Почти весь он находится в составе молекул полутяжёлой воды DHO, одна такая молекула приходится на 3200—3800 молекул лёгкой воды. Лишь очень незначительная часть атомов дейтерия формирует молекулы тяжёлой воды D2O, поскольку вероятность двум атомам дейтерия встретиться в составе одной молекулы в природе мала (примерно 0,5⋅10−7). При искусственном повышении концентрации дейтерия в воде эта вероятность растёт.
Биологическая роль и физиологическое воздействие[править | править код]
Тяжёлая вода токсична лишь в слабой степени, химические реакции в её среде проходят несколько медленнее по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Эксперименты над млекопитающими (мыши, крысы, собаки)[6] показали, что замещение 25 % водорода в тканях дейтерием приводит к стерильности, иногда необратимой[7][8]. Более высокие концентрации приводят к быстрой гибели животного; так, млекопитающие, которые пили тяжёлую воду в течение недели, погибли, когда половина воды в их теле была дейтерирована; рыбы и беспозвоночные погибают лишь при 90 % дейтерировании воды в теле
Таким образом, тяжёлая вода гораздо менее токсична, чем, например, поваренная соль. Тяжёлая вода использовалась для лечения артериальной гипертензии у людей в суточных дозах от 10 до 675 г D2O в день[15].
В человеческом организме содержится в качестве естественной примеси столько же дейтерия, сколько в 5 граммах тяжёлой воды; этот дейтерий в основном входит в молекулы полутяжёлой воды HDO, а также во все прочие биологические соединения, в которых есть водород.[источник не указан 597 дней]
Тяжёлая вода накапливается в остатке электролита при многократном электролизе воды. На открытом воздухе тяжёлая вода быстро поглощает пары обычной воды, поэтому можно сказать, что она гигроскопична. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока. В 1935 году, сразу после открытия тяжёлой воды, её цена составляла ориентировочно 19 долларов за грамм[16]. В настоящее время тяжёлая вода с содержанием дейтерия 99 % ат., продаваемая поставщиками химических реактивов, при покупке 1 кг сто́ит около 1 евро за грамм[17], однако эта цена относится к продукту с контролируемым и гарантированным качеством химического реактива; при снижении требований к качеству цена может быть на порядок ниже.
Среди населения бытует миф о том, что при длительном кипячении природной воды концентрация тяжёлой воды в ней повышается, что якобы может вредно сказаться на здоровье, из-за публикации предположения В. В. Похлёбкина в книге «Чай. Его типы, свойства, употребление», вышедшей в 1968 году[18]. В действительности повышение концентрации тяжёлой воды при кипячении ничтожно. Академик Игорь Васильевич Петрянов-Соколов как-то подсчитал, сколько воды должно испариться из чайника, чтобы в остатке заметно повысилось содержание дейтерия. Оказалось, что для получения 1 литра воды, в которой концентрация дейтерия равна 0,15 %, то есть всего в 10 раз превышает природную, в чайник надо долить в общей сложности 2,1⋅1030 тонн воды, что в 300 млн раз превышает массу Земли[19]. Гораздо сильнее сказывается на вкусе и свойствах воды при кипячении повышение концентрации растворённых солей, переход в раствор веществ из стенок посуды и термическое разложение органических примесей.
Стоимость производства тяжёлой воды определяется затратами энергии. Поэтому при обогащении тяжёлой воды применяют последовательно разные технологии — вначале пользуются более дешёвыми технологиями, с бо́льшими потерями тяжёлой воды, а в конце — более энергозатратными, но с меньшими потерями тяжёлой воды.
С 1933 по 1946 годы единственным применявшимся методом обогащения был электролиз. В последующем появились технологии ректификации жидкого водорода и изотопного обмена в системах: водород — жидкий аммиак, водород — вода, сероводород — вода. Современное массовое производство во входном потоке использует воду, дистиллированную из электролита цехов получения электролитического водорода, с содержанием 0,1—0,2 % тяжёлой воды.
На первой стадии концентрирования применяется двухтемпературная противоточная сероводородная технология изотопного обмена, выходная концентрация тяжёлой воды 5—10 %. На второй — каскадный электролиз раствора щёлочи при температуре около 0 °C, выходная концентрация тяжёлой воды 99,75—99,995 %.
Крупнейшим в мире производителем тяжёлой воды является Канада, что связано с применением в её энергетике тяжеловодных ядерных реакторов CANDU.
Важнейшим свойством тяжёловодородной воды является то, что она практически не поглощает нейтроны, поэтому используется в ядерных реакторах для замедления нейтронов и в качестве теплоносителя. Она используется также в качестве изотопного индикатора в химии, биологии и гидрологии, агрохимии и др. (в том числе в опытах с живыми организмами и при диагностических исследованиях человека). В физике элементарных частиц тяжёлая вода используется для детектирования нейтрино; так, крупнейший детектор солнечных нейтрино SNO (Канада) содержит 1000 тонн тяжёлой воды.
Дейтерий — ядерное топливо для энергетики будущего, основанной на управляемом термоядерном синтезе. В первых энергетических реакторах такого типа предполагается осуществить реакцию D + T → 4He + n + 17,6 МэВ[20].
В некоторых странах (например, в Австралии) коммерческий оборот тяжёлой воды поставлен под государственные ограничения, что связано с теоретической возможностью её использования для создания «несанкционированных» реакторов на природном уране, пригодных для наработки оружейного плутония.
Полутяжёлая вода[править | править код]
Выделяют также полутяжёлую воду (известную также под названиями дейтериевая вода, монодейтериевая вода, гидроксид дейтерия), у которой только один атом водорода замещён дейтерием. Формулу такой воды записывают так: DHO или ²HHO. Следует отметить, что вода, имеющая формальный состав DHO, вследствие реакций изотопного обмена реально будет состоять из смеси молекул DHO, D2O и H2O (в пропорции примерно 2:1:1). Это замечание справедливо и для THO и TDO.
Сверхтяжёлая вода[править | править код]
Сверхтяжёлая вода содержит тритий, период полураспада которого более 12 лет. По своим свойствам сверхтяжёлая вода (T2O) ещё заметнее отличается от обычной: кипит при 104 °C, замерзает при +9 °C и имеет плотность 1,21 г/см³[21]. Известны (то есть получены в виде более или менее чистых макроскопических образцов) все девять вариантов сверхтяжёлой воды: THO, TDO и T2O с каждым из трёх стабильных изотопов кислорода (16O, 17O и 18O). Иногда сверхтяжёлую воду называют просто тяжёлой водой, если это не может вызвать путаницы. Сверхтяжёлая вода имеет высокую радиотоксичность.
Тяжелокислородные изотопные модификации воды[править | править код]
Термин тяжёлая вода применяют также по отношению к тяжелокислородной воде, у которой обычный лёгкий кислород 16O заменён одним из тяжёлых стабильных изотопов 17O или 18O. Тяжёлые изотопы кислорода существуют в природной смеси, поэтому в природной воде всегда есть примесь обеих тяжелокислородных модификаций. Их физические свойства также несколько отличаются от свойств обычной воды; так, температура замерзания 1H218O составляет +0,28 °C[4].
Тяжелокислородная вода, в частности, 1H218O, используется в диагностике онкологических заболеваний (из неё на циклотроне получают изотоп фтор-18, который используют для синтеза препаратов для диагностики онкозаболеваний, в частности 18-фдг).
Общее число изотопных модификаций воды[править | править код]
Если подсчитать все возможные нерадиоактивные соединения с общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
- Н216O − лёгкая вода, или просто вода
- Н217O
- Н218O − тяжелокислородная вода
- HD16O − полутяжёлая вода
- HD17O
- HD18O
- D216O − тяжёлая вода
- D217O
- D218O
С учётом трития их число возрастает до 18:
- T216O — сверхтяжёлая вода
- T217O
- T218O
- DT16O
- DT17O
- DT18O
- HT16O
- HT17O
- HT18O
Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1H216O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 радиоактивных «тяжёлых вод».
Всего же общее число возможных «вод» с учётом всех известных изотопов водорода (7) и кислорода (17) формально равняется 476. Однако распад почти всех радиоактивных изотопов водорода и кислорода происходит за секунды или доли секунды (важным исключением является тритий, период полураспада которого более 12 лет). Например, все более тяжёлые, чем тритий, изотопы водорода живут порядка 10−20 с; за это время никакие химические связи просто не успевают образоваться, и, следовательно, молекул воды с такими изотопами не бывает. Радиоизотопы кислорода имеют периоды полураспада от нескольких десятков секунд до наносекунд. Поэтому макроскопические образцы воды с такими изотопами получить невозможно, хотя молекулы и микрообразцы могут быть получены. Интересно, что некоторые из этих короткоживущих радиоизотопных модификаций воды легче, чем обычная «лёгкая» вода (например, 1H215O).
- ↑ Петрянов И. В. Самое необыкновенное вещество // Химия и жизнь. — 1965. — № 3. — С. 2—14.
- ↑ http://www-pub.iaea.org/MTCD/publications/PDF/ngwm-cd/PDF-Files/paper%2017%20%28Holt%29.pdf
- ↑
 документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке - ↑ 1 2 Water properties
- ↑ Зельвенский Я. Д. Дейтерий // Химическая энциклопедия: в 5 т. / И. Л. Кнунянц (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 16—17. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
- ↑ 1 2 D. J. Kushner, Alison Baker, and T. G. Dunstall. Pharmacological uses and perspectives of heavy water and deuterated compounds (англ.) // Can. J. Physiol. Pharmacol. (англ.)русск. : journal. — 1999. — Vol. 77, no. 2. — P. 79—88. — DOI:10.1139/cjpp-77-2-79. — PMID 10535697.
- ↑ Лобышев В. Н., Калиниченко Л. П. Изотопные эффекты D2O в биологических системах. — М.: Наука, 1978. — 215 с.
- ↑ Vertes A. Physiological effects of heavy water. Elements and isotopes: formation, transformation, distribution (англ.). — Dordrecht: Kluwer Acad. Publ., 2004. — 112 p.
- ↑ Trotsenko, Y. A., Khmelenina, V. N., Beschastny, A. P. (1995) The Ribulose Monophosphate (Quayle) Cycle: News and Views. Microbial Growth on C1 Compounds, in: Proceedings of the 8th International Symposium on Microbial Growth on C1 Compounds (Lindstrom M. E., Tabita F. R., eds.). San Diego (USA), Boston: Kluwer Academic Publishers, pp. 23-26
- ↑ Мосин О. В., Швец В. И., Складнев Д. А., Игнатов И. Микробный синтез дейтерий-меченного L-фенилаланина факультативной метилотрофной бактерией Brevibacterium Methylicum на средах с различными концентрациями тяжелой воды // Биофармацевтический журнал. — 2012. — Т. 4, вып. 1. — С. 11—22.
- ↑ Мосин О. В., Игнатов И. Изотопные эффекты дейтерия в клетках бактерий и микроводорослей при росте на тяжелой воде (D2O) // Вода: химия и экология. — 2012. — Вып. 3. — С. 83—94.
- ↑ Crespi H. L. Fully deuterated microorganisms: tools in magnetic resonance and neutron scattering. Synthesis and Applications of Isotopically Labeled Compounds / in: Proceedings of an International Symposium. Baillie T, Jones J.R eds. Amsterdam: Elsevier. 1989. pp. 329—332.
- ↑ Mosin O. V., Ignatov I. Microbiological Synthesis of 2H-Labeled Phenylalanine, Alanine, Valine, and Leucine/Isoleucine with Different Degrees of Deuterium Enrichment by the Gram-Positive Facultative Methylotrophic Bacterium Вrevibacterium Methylicum (англ.) // International Journal of BioMedicine. — 2013. — Vol. 3, iss. 2. — P. 132—138.
- ↑ Money K. E., Myles W. S. Heavy water nystagmus and effects of alcohol (англ.) // Nature. — 1974. — Vol. 247, no. 5440. — P. 404—405. — DOI:10.1038/247404a0. — Bibcode: 1974Natur.247..404M. — PMID 4544739.
- ↑ Патент США № 5 223 269 от 29 июня 1993. Method and composition for the treatment of hypertension. Описание патента на сайте Ведомства по патентам и товарным знакам США.
- ↑ Pharmacologist drinks heavy water in experiment (англ.). Science News Staff (9 February 1935). Дата обращения 7 сентября 2013.
- ↑ Deuterium oxide, 99 atom % D | D2O | Sigma-Aldrich
- ↑ Дейтерий — в чайнике? // Химия и жизнь. — 1969. — № 2. — С. 24—25.
- ↑ Илья Леенсон. Тяжелая вода (неопр.). Энциклопедия Кругосвет. Дата обращения 7 сентября 2013.
- ↑ Андреев Б. М., Зельвенский Я. Д., Катальников С. Г. Тяжелые изотопы водорода в ядерной технике. — М.: Энергоатомиздат, 1987.
- ↑ Зельвенский Я. Д. Тритий // Химическая энциклопедия: в 5 т. / Н. С. Зефиров (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 5—7. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
диаметр, формула, строение. Чему равна масса молекулы водорода?
В периодической таблице Менделеева под номером 1 расположен самый часто встречающийся элемент во Вселенной — водород. Его распространение, в процентном соотношении, приближается к 75%. Самое низкое его содержание отмечено в слоях атмосферы – 0,0001%. В коре Земли содержится 1% газа по массе. Наибольшее его количество отмечается в воде: 12%. На нашей планете это третий по распространению химический элемент.
Описание элемента
Молекула водорода, формула которого Н-Н или Н2, наделена физическими и химическими свойствами.
Водород является газом, который не наделен ни цветом, ни запахом. Расположение водорода в таблице на 1 месте обусловлено тем, что в различных условиях этот элемент может проявлять себя как металл или как газ. На его внешней орбитали расположен 1 электрон, который водород может отдавать (металлические свойства) или же принимать еще один (качества газа).
Диаметр водородной молекулы равняется 27 нм.
Диаметр атома водорода равен 1А, радиус – 0, 41 А.
Свойства
К физическим относятся следующие:
- Температура кипения – 256оС.
- Температура плавления -259,2оС.
- Масса по воздуху (D) — 0,069.
- Водород плохо растворим в воде.
Химические свойства таковы:
- Неполярная связь между частицами молекулы обладает энергией в 436 кДж/моль.
- Температура тепловой диссоциации равна 2000оС.
- Реагирует с:
- галогенами;
- кислородом;
- серой;
- азотом;
- оксидом азота;
- активными металлами.
В условиях природы, водород встречается как в естественном виде, так и в форме изотопов: протий, дейтерий и тритий.
Строение молекулы
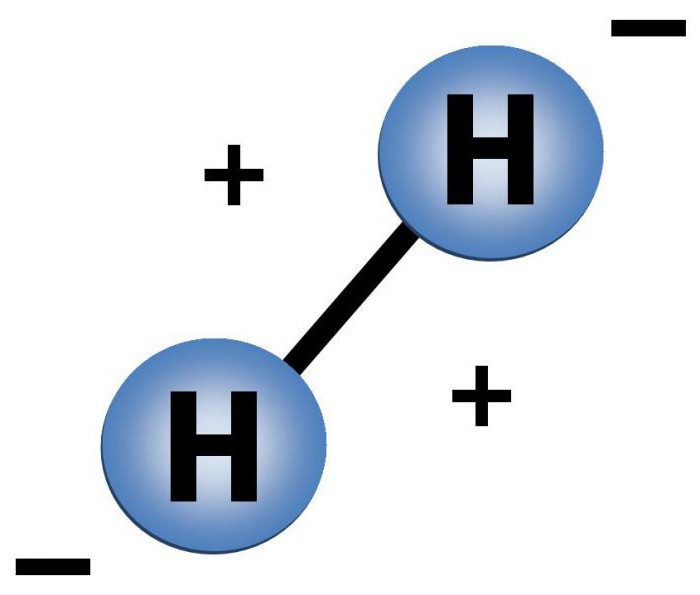
Молекула элемента имеет простое строение. Состав молекулы водорода представлен двумя атомами, которые, сближаясь, образуют ковалентную неполярную связь, а также одну электронную пару. Строение одного атома представляет: 1 положительно заряженное ядро, вокруг которого передвигается 1 отрицательно заряженный электрон. Этот электрон располагается на 1s орбитали.
Н — 1е = Н+ этот ион водорода является положительным.
Это выражение указывает на то, что водород обладает схожими параметрами с элементами 1 группы в периодической системе, которые являются щелочными металлами (литий, натрий, калий), отдающими свой единственный электрон на внешней орбитали.
Н + 1е = Н– ион водорода отрицательный.
Это уравнение показывает, что водород является родственным с аналогичными элементами из 7-й группы, которые являются газом и способны принимать недостающие электроны на свой внешний электронный уровень. К таким газам относятся: фтор, хлор, бром и т. д.
Состав молекулы водорода графически представлена далее.
Расстояние между водородными атомами r=0,74 А, в то время, как сумма орбитальных радиусов составляет 1,06 А. Это влияет на глубину перекрывания электронных облаков и на прочную, устойчивую водородную связь.
Атом водорода является самым элементарным атомом в природе. Размер атомного протона равен 10,5 А, а диаметр одного атома равен 0,1 нм.
Молекулы изотопов имеют особое строение. Атомное ядро протия состоит из одного лишь протона. Обозначается изотоп: 1Н.
Ядерное строение выглядит как комплекс из протона и нейтрона (2Н).
3Н — тритий — в своем атомном строении наделен ядром с 1 протоном и двумя нейтронами.
Масса
В науке существуют формулы, вычисляющие, чему равна масса молекулы водорода. По отношению к элементу, определяют молекулярную и атомную массы.
Молярная масса молекулы водорода вычисляется по общей формуле:
M = m / n, где m — это масса вещества, n — его количество.
Масса атома равна 1,008 а.е.м. Следовательно, относительная масса молекулы будет также равна 1,008. Поскольку молекула водорода состоит из двух атомов, то относительный атомный вес равен 2,016 а. е. м. Масса молекулы водорода выражается в граммах на моль (г/моль).
Значение в природе
Наиболее значимым в природе веществом, которое образует водород в комплексе с кислородом, является вода. Вода – источник жизни, поэтому водород – это жизненно необходимый элемент.
Из 100% всех химических элементов, которые составляют организменную среду, 1/10 часть, или 10%, приходится на водород. Помимо воды, он способен поддерживать четвертичную белковую структуру, что является возможным, благодаря водородной связи.
Принцип комплементарности нуклеиновых кислот также происходит с действием водородной молекулы. В растительной клетке Н принимает участие в процессе фотосинтеза, биосинтеза, в переносе энергии по мембранным каналам.
Применение
В химической промышленности водород достаточно широко применим. Его добавляют при изготовлении пластмассовых изделий, в мыловарении, а также при аммиачном и ментоловом производстве.
Пищевая промышленность: при выработке продуктов питания, водород добавляют в качестве пищевой добавки Е949. Такой компонент можно увидеть на упаковке маргарина, растительных масел. Добавка Е949 разрешена пищевой промышленностью РФ.
Водород некогда был задействован и в промышленности воздухоплавания, поскольку вещество легче воздуха. Так, в 30-е годы прошлого века этим вида газа наполняли воздушные шары и дирижабли. Несмотря на его дешевизну и удобство использования, водород вскоре прекратили использовать в качестве наполнителя, поскольку участились случаи взрывов летательных аппаратов.
В наши дни газ применяют, как топливо, используемое в космической промышленности. Однако рассматриваются методы применения его для работы двигателей легковых и грузовых автомобилей, поскольку элемент при сгорании не выделяет в атмосферу вредных примесей, а, значит, является экологически чистым.
Неотъемлемым компонентом изотопы водорода выступают в составе многих медикаментозных средств. Дейтерий применяют в фармакологических исследованиях, для определения поведения и воздействия лекарственного препарата в организме. Тритий используется в радиодиагностике, как элемент, определяющий биохимические реакции метаболизма ферментов. Водород входит в состав перекиси, которая является дезинфицирующим средством.
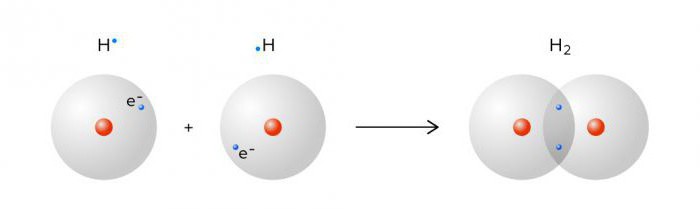
Молекула водорода — Википедия
Моле́кула водоро́да — простейшая молекула, состоящая из двух атомов водорода. В её состав входят два ядра атомов водорода и два электрона. Вследствие взаимодействия между электронами и ядрами образуется ковалентная химическая связь. Кроме основной изотопной модификации H2, существуют разновидности, в которых один или оба атома протия заменены другими изотопами водорода — дейтерием или тритием: HD, HT, D2, DT, T2. Симметричность или несимметричность молекулы имеет значение при её вращении.
 Рис.1.Модель водорода по Бору и осевая проекция электронного кольца
Рис.1.Модель водорода по Бору и осевая проекция электронного кольцаН.Бор ещё в 1913 году дал описание модели молекулы водорода[1]. Согласно Бору, два внешних электрона, образующих молекулу, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга (рис.1). Боровская модель химической связи давала чёткую картину образования молекулярного водорода — динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга (d), притяжением кольца из двух электронов. При этом модель Нильса Бора учитывала кулоновское отталкивание — оба электрона за счёт электростатического отталкивания находятся в диаметрально противоположных точках электронного кольца вокруг линии, проходящей через ядра обоих атомов молекулы водорода.
Также как и боровская модель атома, боровская модель молекулы водорода не отражала и не могла отражать волновую природу электрона и статистическую интерпретацию волновой функции. Здесь уместно дополнить боровскую модель молекулы водорода достижениями квантовой механики, аналогично боровской модели атома. В этом случае гипотетическое кольцо электронов в модели молекулы водорода трансформируется в геометрическое место расположения плотности вероятности нахождения связывающих электронов. Электронную пару следует представлять электронным облаком в форме кольца, баранки, тора. При этом предполагается, что электроны в торе удалены друг от друга на максимально возможное расстояние, а электронная плотность в молекуле водорода имеет минимум — «кулоновскую дырку» на линии, соединяющей ядра молекулы водорода. Наиболее вероятный радиус электронного тора (re) определяется боровским радиусом a0 и межъядерным расстоянием (d)
- re2 = a02 — (d/2)2; re = 0,377 Å.
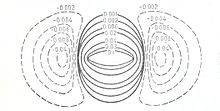 Рис.2.Контурная карта электронной плотности для молекулы водорода[2]
Рис.2.Контурная карта электронной плотности для молекулы водорода[2]В теории молекулярных орбиталей, разработанной в 1927—1932 г.г. Ф.Хундом, Р.Малликеном и др., модель молекулы водорода описывали контурными картами электронной плотности (рис.2).
Карта строится как разность между электронной плотностью молекулы и несвязанных атомов. Сплошные линии контурной карты отражают области увеличения электронной плотности (в единицах заряда электрона). Пунктирные — области её уменьшения в молекуле по сравнению с электронной плотностью несвязанных атомов водорода, сближенных на равновесное расстояние.[2]
Поскольку в теории молекулярных орбиталей учитывается лишь фермиевская корреляция электронов, поэтому электронная плотность в молекуле водорода сконцентрирована на линии, соединяющей ядра молекулы (см. рис.2).
 Рис.3.Модель молекулы водорода в теории валентных связей
Рис.3.Модель молекулы водорода в теории валентных связейКвантово-механическую теорию ковалентной связи в молекуле водорода разработали в 1927 году Вальтер Гайтлер и Фриц Лондон. Выполненный ими расчёт волновых функций явился основой теории валентных связей. В этой теории модель молекулы водорода описывали перекрыванием атомных орбиталей атомов водорода (1S типа). Схема перекрывания электронных облаков, образующих сигма-связь молекулы водорода, совпадает с линией соединения атомных центров молекулы (рис.3).
Расчёт молекулы водорода в основном сводится к определению интеграла перекрытия атомных орбиталей.
Гамильтониан молекулы водорода H2 записывается в виде
- H^=−ℏ22MΔR1−ℏ22MΔR2−ℏ22mΔr1−ℏ22mΔr2+e2|R1−R2|+e2|r1−r2|{\displaystyle {\hat {H}}=-{\frac {\hbar ^{2}}{2M}}\Delta _{R_{1}}-{\frac {\hbar ^{2}}{2M}}\Delta _{R_{2}}-{\frac {\hbar ^{2}}{2m}}\Delta _{r_{1}}-{\frac {\hbar ^{2}}{2m}}\Delta _{r_{2}}+{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {R} _{2}|}}+{\frac {e^{2}}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}}
- −e2|R1−r1|−e2|R1−r2|−e2|R2−r1|−e2|R2−r2|{\displaystyle -{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {r} _{1}|}}-{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {r} _{2}|}}-{\frac {e^{2}}{|\mathbf {R} _{2}-\mathbf {r} _{1}|}}-{\frac {e^{2}}{|\mathbf {R} _{2}-\mathbf {r} _{2}|}}},
где M — масса протона, m — масса электрона, Ri{\displaystyle \mathbf {R} _{i}} — координаты ядер, ri{\displaystyle \mathbf {r} _{i}} — координаты электронов.
В адиабатическом приближении задача нахождения энергетических состояний молекулы водорода разбивается на два этапа. На первом этапе рассматривается только электронная подсистема, а ядра считаются зафиксированными в точках R1{\displaystyle \mathbf {R} _{1}} и R2{\displaystyle \mathbf {R} _{2}}.
Гамильтониан электронной подсистемы имеет вид
- H^el=−ℏ22mΔr1−ℏ22mΔr2+e2|r1−r2|−e2|R1−r1|−e2|R1−r2|−e2|R2−r1|−e2|R2−r2|{\displaystyle {\hat {H}}_{el}=-{\frac {\hbar ^{2}}{2m}}\Delta _{r_{1}}-{\frac {\hbar ^{2}}{2m}}\Delta _{r_{2}}+{\frac {e^{2}}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}-{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {r} _{1}|}}-{\frac {e^{2}}{|\mathbf {R} _{1}-\mathbf {r} _{2}|}}-{\frac {e^{2}}{|\mathbf {R} _{2}-\mathbf {r} _{1}|}}-{\frac {e^{2}}{|\mathbf {R} _{2}-\mathbf {r} _{2}|}}},
Гамильтониан молекулы водорода симметричен относительно переменных r1{\displaystyle \mathbf {r} _{1}} и r2{\displaystyle \mathbf {r} _{2}}, то есть не изменяется при смене нумерации электронов. Кроме того, он не зависит от спиновых переменных.
 Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи
Схематическое изображение симметричной волновой функции молекулы водорода и образования ковалентной связи 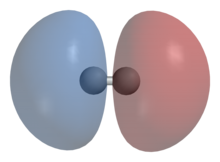 Схематическое изображение антисимметричной волновой функции молекулы водорода
Схематическое изображение антисимметричной волновой функции молекулы водородаИсходя из принципа тождественности частиц и учитывая то, что электроны являются фермионами, волновая функция молекулы водорода должна быть антисимметричной относительно перестановки электронов. Независимость гамильтониана от спиновых переменных позволяет выбрать её в виде произведения двух функций, одна из которых зависит только от координат и называется координатной волновой функцией, а вторая зависит только от спинов и называется спиновой функцией.
Существуют два возможных типа спиновых функций для двух электронов: с параллельными спинами и с антипараллельными спинами. Функции с параллельными спинами симметричны относительно перестановки электронов и образуют триплетные состояния, в которых суммарный спин равен единице. Функции с антипараллельными спинами образуют синглетные состояния с нулевым суммарным спином (см. Мультиплетность, Состояние (квантовая механика)). Они антисимметричны относительно перестановки электронов.
Поскольку волновая функция электрона должна быть антисимметричной относительно перестановки, она может быть произведением либо
- симметричной координатной функции на антисимметричную спиновую функцию, либо
- антисимметричной координатной функции на симметричную спиновую функцию.
Симметричную и антисимметричную координатные функции основного состояния в нулевом приближении теории возмущений можно построить исходя из волновых функций основного состояния атома водорода ψ1s{\displaystyle \psi _{1s}} .
- ψsym=12(ψ1s1(r1)ψ1s2(r2)+ψ1s1(r2)ψ1s2(r1)){\displaystyle \psi _{sym}={\frac {1}{\sqrt {2}}}\left(\psi _{1s1}(\mathbf {r} _{1})\psi _{1s2}(\mathbf {r} _{2})+\psi _{1s1}(\mathbf {r} _{2})\psi _{1s2}(\mathbf {r} _{1})\right)}
- ψasym=12(ψ1s1(r1)ψ1s2(r2)−ψ1s1(r2)ψ1s2(r1)){\displaystyle \psi _{asym}={\frac {1}{\sqrt {2}}}\left(\psi _{1s1}(\mathbf {r} _{1})\psi _{1s2}(\mathbf {r} _{2})-\psi _{1s1}(\mathbf {r} _{2})\psi _{1s2}(\mathbf {r} _{1})\right)}
Первый член каждой из приведенных волновых функций отвечает локализации электрона, пронумерованного индексом 1 на атоме с индексом 1 и электрона, пронумерованного индексом 2 на атоме с индексом 2. Второй член отвечает ситуации, когда первый электрон принадлежит второму атому, а второй — первому. При смене нумерации электронов первая (симметричная) функция не меняется, вторая (антисимметричная) — меняет знак.
Энергия электронных состояний находится усреднением гамильтониана на волновых функциях
- E=∫ψ∗H^ψdV1dV2{\displaystyle {\mathcal {E}}=\int \psi ^{*}{\hat {H}}\psi dV_{1}dV_{2}}.
Для двух возможных волновых функций основного состояния она приобретает вид
- Esym/asym=2E1s+e2R+Q±A1±S2{\displaystyle {\mathcal {E}}_{sym/asym}=2E_{1s}+{\frac {e^{2}}{R}}+{\frac {Q\pm A}{1\pm S^{2}}}},
где R=|R1−R2|{\displaystyle R=|\mathbf {R} _{1}-\mathbf {R} _{2}|} — расстояние между ядрами, E1s{\displaystyle E_{1s}} — значение энергии основного состояния атома водорода, S{\displaystyle S} — интеграл перекрытия, который определяется выражением
- S(R)=∫ψ1s(|r−R1|)ψ1s(|r−R2|)dV{\displaystyle S(R)=\int \psi _{1s}(|\mathbf {r} -\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} -\mathbf {R} _{2}|)dV},
Q{\displaystyle Q} — кулоновский интеграл, определяемый как
- Q(R)=e2∫ψ1s2(|r1−R1|)ψ1s2(|r2−R2|)[1|r1−r2|−1|r1−R2|−1|r2−R1|]dV1dV2{\displaystyle Q(R)=e^{2}\int \psi _{1s}^{2}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}^{2}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}-{\frac {1}{|\mathbf {r} _{1}-\mathbf {R} _{2}|}}-{\frac {1}{|\mathbf {r} _{2}-\mathbf {R} _{1}|}}\right]dV_{1}dV_{2}},
A{\displaystyle A} — обменный интеграл, равный
- A(R)=e2∫ψ1s(|r1−R1|)ψ1s(|r2−R2|)ψ1s(|r2−R1|)ψ1s(|r1−R2|)[1|r1−r2|{\displaystyle A(R)=e^{2}\int \psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{2}|)\psi _{1s}(|\mathbf {r} _{2}-\mathbf {R} _{1}|)\psi _{1s}(|\mathbf {r} _{1}-\mathbf {R} _{2}|)\left[{\frac {1}{|\mathbf {r} _{1}-\mathbf {r} _{2}|}}\right.}
- −1|r1−R2|−1|r2−R1|]dV1dV2{\displaystyle \left.-{\frac {1}{|\mathbf {r} _{1}-\mathbf {R} _{2}|}}-{\frac {1}{|\mathbf {r} _{2}-\mathbf {R} _{1}|}}\right]dV_{1}dV_{2}}.
Энергия молекулы водорода состоит из удвоенной энергии атома водорода, энергии кулоновского отталкивания между ядрами и членов, определяющих взаимодействие электронов между собой и с другим ядром. В зависимости от спинового состояния в формуле для E{\displaystyle {\mathcal {E}}} следует выбирать знак «+» или знак «-». Знак «+» отвечает синглетному состоянию, знак «-» — триплетному.
Величина Q(R){\displaystyle Q(R)} — это средняя энергия кулоновского взаимодействия между двумя электронами и электронов с «чужим ядром». Величина A(R){\displaystyle A(R)} определяет вклад в энергию обменного взаимодействия, которая не имеет аналога в классической механике. Именно этот член определяет существенное различие между синглетными и триплетными состояниями.
Зависимость энергии основного состояния от расстояния между ядрами[править | править код]
Ковалентная связь[править | править код]
 Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состояний
Энергия взаимодействия атомов в молекуле водорода для синглетного(сплошная линия) и триплетного (пунктирная линия) состоянийОбменный интеграл для молекулы водорода в определённом диапазоне расстояний между атомами отрицательный. Вследствие этого, для синглетных состояний он обеспечивает дополнительное притягивание между ядрами атомов, а для триплетных — дополнительное отталкивание. Дополнительное притягивание обусловливает появление минимума электронной энергии на расстоянии приблизительно в 1,5 радиуса Бора (что соответствует приблизительно 75 пм). Этот минимум возникает только для синглетного состояния, то есть для антипараллельных спинов. Таким образом устанавливается ковалентная связь между атомами. Электроны двух атомов водорода «спариваются».
Насыщение ковалентной связи[править | править код]
Для параллельных спинов, то есть для триплетного состояния, дополнительный положительный вклад в энергию приводит к тому, что атомы отталкиваются на любом расстоянии. Этим объясняется насыщение ковалентной связи. Молекула водорода может состоять только из двух атомов. Третий атом водорода не может образовать связь с молекулой потому, что его спин непременно будет параллельным одному из спинов электронов в составе молекулы. Параллельность спинов приводит к отталкиванию между ядрами на любом расстоянии.
Необходимо отметить, что на больших расстояниях между атомами они притягиваются в любых состояниях благодаря Ван-дер-Ваальсовому взаимодействию, которое, однако, намного слабее ковалентной связи. Ван-дер-Ваальсово взаимодействие не учитывается в приведенной теории, поскольку требует рассмотрения возбуждённых состояний высших, чем 1s-орбиталь.
Гамильтониан, описывающий относительное движение двух ядер в молекуле водорода имеет вид
- H^nucl=−ℏ22μR2∂∂R(R2∂∂R)+L^22μR2+Esym(R){\displaystyle {\hat {H}}_{nucl}=-{\frac {\hbar ^{2}}{2\mu R^{2}}}{\frac {\partial }{\partial R}}\left(R^{2}{\frac {\partial }{\partial R}}\right)+{\frac {{\hat {L}}^{2}}{2\mu R^{2}}}+{\mathcal {E}}_{sym}(R)},
где μ=M/2{\displaystyle \mu =M/2} — приведённая масса двух ядер, Esym(R){\displaystyle {\mathcal {E}}_{sym}(R)} — энергия синглетного электронного состояния, зависящая от расстояния между ядрами (определена в предыдущем разделе), L^{\displaystyle {\hat {L}}} — оператор углового момента, описывающий вращение молекулы.
Вращение[править | править код]
Оператор углового момента коммутирует с гамильтонианом, поэтому собственные функции гамильтониана можно выбрать общими с собственными функциями оператора углового момента, то есть сферические гармоники:
- L^2Ylm=ℏ2l(l+1)Ylm{\displaystyle {\hat {L}}^{2}Y_{lm}=\hbar ^{2}l(l+1)Y_{lm}}.
Вклад вращения в энергию молекулы равен
- Erot=ℏ2l(l+1)2μR2{\displaystyle E_{rot}={\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}}.
Этот вклад мал, потому, что массы ядер намного больше, чем массы электронов. Он зависит от расстояния между ядрами R. При колебаниях ядер это расстояние меняется, поэтому вращательное движение, строго говоря, невозможно отделить от колебательного. Однако при малых l и при малых энергиях колебательного движения можно считать, что R равняется определённому среднему значению.
Вращательные уровни вырождены относительно магнитного квантового числа ml. Кратность вырождения 2l+1.
Колебания атомов[править | править код]
Вблизи минимума функцию Esym(R)+ℏ2l(l+1)2μR2{\displaystyle {\mathcal {E}}_{sym}(R)+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}} можно разложить в ряд Тейлора, ограничившись только квадратичным членом.
- U(R)≈Esym(R)+ℏ2l(l+1)2μR2=E(R0)+ℏ2l(l+1)2μR02+μω22(R−R02){\displaystyle U(R)\approx {\mathcal {E}}_{sym}(R)+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}={\mathcal {E}}(R_{0})+{\frac {\hbar ^{2}l(l+1)}{2\mu R_{0}^{2}}}+{\frac {\mu \omega ^{2}}{2}}(R-R_{0}^{2})},
где
- μω2=d2UdR2|R=R0{\displaystyle \mu \omega ^{2}=\left.{\frac {d^{2}U}{dR^{2}}}\right|_{R=R_{0}}}
Таким образом, задача об энергетических состояниях колебания ядер сводится к задаче квантового гармонического осциллятора. Следовательно, для низших колебательных и вращательных уровней энергия молекулы водорода равна
- Es,n,l=Esym(R0)+ℏ2l(l+1)2μR2+ℏω(v+12){\displaystyle E_{s,n,l}={\mathcal {E}}_{sym}(R_{0})+{\frac {\hbar ^{2}l(l+1)}{2\mu R^{2}}}+\hbar \omega \left(v+{\frac {1}{2}}\right)},
где v=0,1…{\displaystyle v=0,1\ldots } — колебательное квантовое число.
Низшая энергия колебания ℏω2{\displaystyle {\frac {\hbar \omega }{2}}} отвечает нулевым колебаниям.
При больших значениях квантовых чисел n и l колебательное и вращательное движение разделить невозможно.
Таким образом, энергию молекулы при малых квантовых числах можно записать в виде трёх слагаемых — электронного, колебательного и вращательного:
- Es,n,l=Eel+Ev+Er{\displaystyle E_{s,n,l}=E_{el}+E_{v}+E_{r}}
Малым параметром задачи является отношение массы электрона к массе протона. Электронное слагаемое не зависит от этого отношения, колебательное пропорционально m/M{\displaystyle {\sqrt {m/M}}}, вращательное пропорционально m/M{\displaystyle m/M}. Поэтому
- Eel≫Ev≫Er{\displaystyle E_{el}\gg E_{v}\gg E_{r}}.
Следовательно, электронный уровень расщепляется на несколько колебательных, каждый из которых, в свою очередь, расщепляется на вращательные. Поскольку энергии вращательных уровней близки, то в оптических спектрах они сливаются в полосы — образуется полосатый спектр, который наблюдается для молекулы HD. Для симметричной молекулы H2 переходы между орбитальными и колебательными уровнями запрещены правилами отбора, поэтому молекулярный протий не поглощает в инфракрасной области.
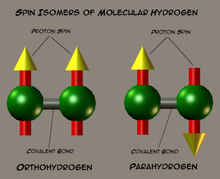 Схематическое изображение спиновых изомеров водорода
Схематическое изображение спиновых изомеров водородаЯдра атомов водорода, входящие в состав молекулы, являются протонами — фермионами со спином 1/2. По правилам сложения спинов ядерный спин молекулы может быть 0 или 1. Молекулы водорода с суммарным ядерным спином 0 называют параводородом, а молекулы с суммарным ядерным спином 1 и тремя возможными проекциями (−1, 0, 1) называют ортоводородом. В состоянии термодинамического равновесия при комнатной температуре отношение между ортоводородом и параводородом составляет 3:1. Однако при низких температурах в состоянии термодинамического равновесия молекулы параводорода доминируют благодаря разным вращательным свойствам: параводород является симметричным ротатором, ортоводород — несимметричным ротатором. Переход ортоводорода в параводород — медленный процесс, и состояние термодинамического равновесия при низких температурах устанавливается долго.
Межъядерные расстояния и энергии диссоциации молекул водорода, его изотопов и молекулярного иона водорода[3]
| Молекула | Межъядерное расстояние,Å | Энергия диссоциации, Эв |
|---|---|---|
| H2 | 0,7416 | 4,477 |
| HD | 0,7414 | 4,512 |
| D2 | 0,7416 | 4,555 |
| DT | 0,7416 | 4,570 |
| T2 | 0,7416 | 4,588 |
| HT | 0,7416 | 4,524 |
| H2+ | 1,06 | 2,648 |
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения (α) в зависимости от абсолютной температуры[4]:
| T, к | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10-6 | 2,47 · 10-2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10-4 | 7,83 · 10-2 | 0,621 | 0,954 | 0,992 | 0,999 |
- ↑ Бор Н. Избранные научные труды (статьи 1909-1925 г.г). — М.: Наука, 1973. — Т. 1. — С. 133. — 584 с.
- ↑ 1 2 Химический энциклопедический словарь / гл. редактор И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 646. — 792 с.



 (
( документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке
документа Протокол № 9 заседания Специального комитета при Совнаркоме СССР. Москва, Кремль 30 ноября 1945 года в Викитеке