Теория кристаллического поля — Википедия
Теория кристаллического поля — квантовохимическая модель, в которой электронная конфигурация соединений переходных металлов описывается как состояние иона либо атома, находящегося в электростатическом поле, создаваемым окружающими его ионами, атомами или молекулами. Концепция кристаллического поля была предложена Беккерелем для описания состояния атомов в кристаллах и затем развита Хансом Бете и Джоном Ван Флеком для описания низших состояний катионов переходных металлов, окруженных лигандами — как анионами, так и нейтральными молекулами. Теория кристаллического поля была в дальнейшем объединена [и усовершенствована] с теорией (делокализованных) молекулярных орбиталей в более общую теорию поля лигандов, учитывающую частичную ковалентность связи металл-лиганд в координационных соединениях[1].
Теория кристаллического поля позволяет предсказать или интерпретировать оптические спектры поглощения и спектры электронного парамагнитного резонанса кристаллов и комплексных соединений, а также энтальпий гидратации и устойчивости в растворах комплексов переходных металлов.
Согласно ТКП, взаимодействие между переходным металлом и лигандами возникает вследствие притяжения между положительно заряженным катионом металла и отрицательным зарядом электронов на несвязывающих орбиталях лиганда. Теория рассматривает изменение энергии пяти вырожденных d-орбиталей в окружении точечных зарядов лигандов. По мере приближения лиганда к иону металла, электроны лиганда становятся ближе к некоторым d-орбиталям, чем к другим, вызывая потерю вырожденности. Электроны d-орбиталей и лигандов отталкиваются друг от друга как заряды с одинаковым знаком. Таким образом, энергия тех
На расщепление влияют следующие факторы:
- Природа иона металла.
- Степень окисления металла. Чем выше степень окисления, тем выше энергия расщепления.
- Расположение лигандов вокруг иона металла.
- Природа лигандов, окружающих ион металла. Чем сильнее эффект от лигандов, тем больше разность между высоким и низким уровнем энергии.
Самый распространённый вид координации лигандов — октаэдрическая, при которой шесть лигандов создают кристаллическое поле октаэдрической симметрии вокруг иона металла. При октаэдрическом окружении иона металла с одним электроном на внешней оболочке d-орбитали разделяются на две группы с разностью энергетических уровней Δ
Следующими по распространённости являются тетраэдрические
Разность энергетических уровней Δ между двумя или более группами орбиталей зависит также от природы лигандов. Некоторые лиганды вызывают меньшее расщепление, чем другие, причины чего объясняет теория поля лигандов. Спектрохимический ряд — полученный опытным путём список лигандов, упорядоченных в порядке возрастания Δ:[2]
I− < Br− < S2− < SCN− < Cl− < NO3− < N3− < F− < OH− < C2O42− < H2O < NCS− < CH3CN < py < NH3 < en < bipy < phen < NO
Степень окисления металла также влияет на Δ. Металл с более высокой степенью окисления ближе притягивает лиганды за счёт большей разности зарядов. Лиганды, находящиеся ближе к иону металла, вызывают большее расщепление.
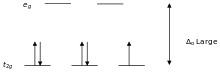 Распределение d-электронов низкоспинового комплекса [Fe(NO2)6]3−
Распределение d-электронов низкоспинового комплекса [Fe(NO2)6]3−Лиганды, вызывающие большое расщепление d-уровней, например CN− и CO, называются лигандами сильного поля
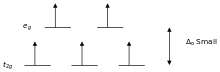 Распределение
Распределение Напротив, лиганды, вызывающие малое расщепление, например I− и Br−, называются лигандами слабого поля. В этом случае легче поместить электроны в орбитали с высокой энергией, чем расположить два электрона в одной орбитали с низкой энергией, потому что два электрона в одной орбитали отталкивают друг друга, и затраты энергии на размещение второго электрона в орбитали выше, чем Δ. Таким образом, прежде чем появятся парные электроны, в каждую из пяти d-орбиталей должно быть помещёно по одному электрону в соответствии с правилом Хунда. Такие комплексы называются
Энергия расщепления для тетраэдрических комплексов Δтетр примерно равна 4/9Δокт (для одинаковых металла и лигандов). В результате этого разность энергетических уровней d-орбиталей обычно ниже энергии спаривания электронов, и тетраэдрические комплексы обычно высокоспиновые.
Диаграммы распределения d-электронов позволяют предсказать магнитные свойства координационных соединений. Комплексы с непарными электронами являются парамагнитными и притягиваются магнитным полем, а без — диамагнитными и слабо отталкиваются.
Энергия стабилизации кристаллическим полем[править | править код]
Энергия стабилизации кристаллическим полем (ЭСКП) — энергия электронной конфигурации иона переходного металла относительно средней энергии орбиталей. Стабилизация возникает вследствие того, что в поле лигандов энергетический уровень некоторых орбиталей ниже, чем в гипотетическом сферическом поле, в котором на все пять d-орбиталей действует одинаковая сила отталкивания, и все d-орбитали вырождены. Например, в октаэдрическом случае уровень t2g ниже, чем средний уровень в сферическом поле. Следовательно, если в данных орбиталях находятся электроны, то ион металла более стабилен в поле лигандов относительно сферического поля. Наоборот, энергетический уровень орбиталей
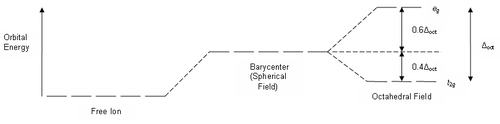 Энергия стабилизации октаэдрическим полем
Энергия стабилизации октаэдрическим полемВ октаэдрическом поле три орбитали t2g стабилизированы относительно среднего энергетического уровня на 2/5 Δокт, а две орбитали eg дестабилизированы на 3/5 Δокт. Выше были приведены примеры двух электронных конфигураций d5. В первом примере — низкоспиновый комплекс [Fe(NO
Диаграммы расщепления d-уровня кристаллическим полем[править | править код]
- ↑ crystal field // IUPAC Gold Book
- ↑ Д. Шрайвер, П. Эткинс. Теория кристаллического поля // Неорганическая химия = Inorganic Chemistry. —
3. Теория кристаллического поля.
Теория кристаллического поля пришла на смену теории валентных связей в 40-х годах XX столетия. В чистом виде она сейчас не применяется, так как не может объяснить образование ковалентных связей в комплексных соединениях и совершенно не учитывает истинного состояния лигандов (например, их действительных размеров) даже в случае взаимодействий, близких к чисто электростатическим.
Уже с середины 50-х годов упрощенная теория кристаллического поля была заменена усовершенствованной теорией поля лигандов, учитывающей ковалентный характер химических связей между комплексообразователем и лигандом.
Однако наиболее общий подход к объяснению образования комплексных соединений дает теория молекулярных орбиталей (МО), которая в настоящее время превалирует над всеми остальными. Метод молекулярных орбиталей предусматривает и чисто электростатическое взаимодействие при отсутствии перекрывания атомных орбиталей, и всю совокупность промежуточных степеней перекрывания.
Рассмотрим основные понятия теории кристаллического поля, которая, как и теория валентных связей, все еще сохраняет свое значение для качественного описания химических связей в комплексных соединениях из-за большой простоты и наглядности.
В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается.
Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и прежде всего d-подуровни расщепляются, и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов ( октаэдрическое, тетраэдрическое или иное кристаллическое поле ). Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
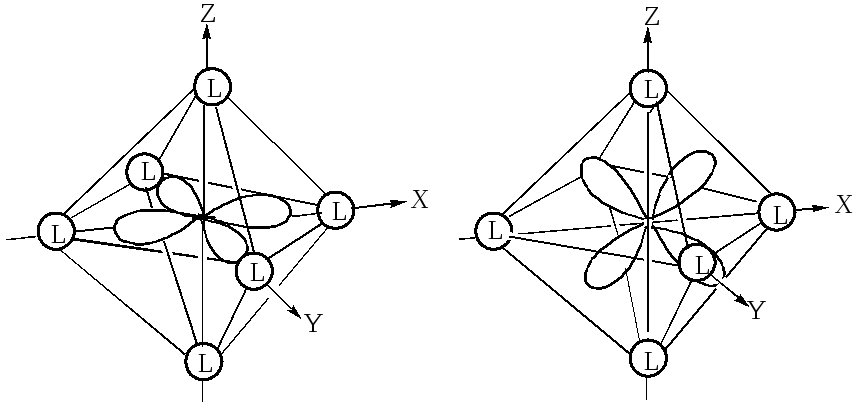
Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6]3 или [Co(NH3)6]3+). В центре октаэдра находится атом-комплексообразователь М(+x) с электронами на d-атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F или полярные молекулы типа NH3). В условном ионе М(+x), не связанном с лигандами, энергии всех пяти d-АО одинаковы (т.е. атомные орбитали вырожденные).
Однако в октаэдрическом поле лигандов d-АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d(z2) и d(x2 y2), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов. Физической моделью такого взаимодействия может служить сильно сжатая пружина.
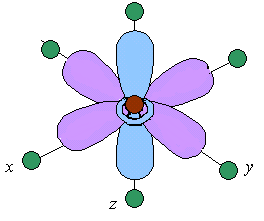

Другие три d-АО – d(xy), d(xz) и d(yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от них. Взаимодействие таких d-АО с лигандами минимально, а следовательно – энергия d(xy), d(xz) и d(yz)-АО понижается по сравнению с исходной.
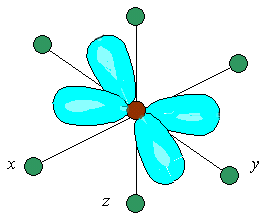

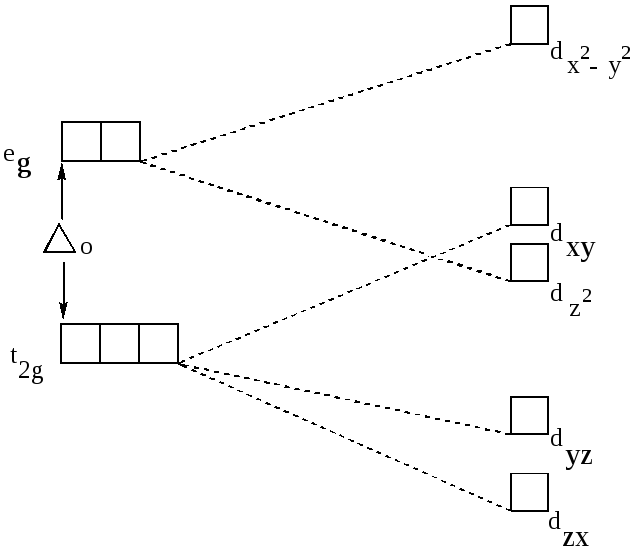
Таким образом, пятикратно вырожденные d-АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы новых орбиталей – трехкратно вырожденные орбитали с более низкой энергией, d(xy), d(xz) и d(yz), и двукратно вырожденные орбитали с более высокой энергией, d(z2) и d(x2y2). Эти новые группы d-орбиталей с более низкой и более высокой энергией обозначают d и d:
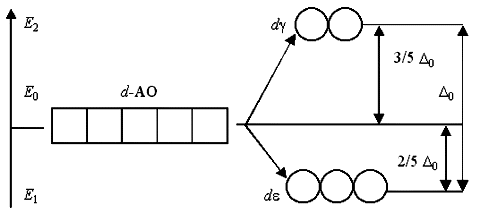
Разность энергий двух новых подуровней d и d получила название параметра расщепления 0:
E2 – E1 = 0
Расположение двух новых энергетических подуровней d и d по отношению к исходному (d-АО) на энергетической диаграмме несимметричное:
(Е2 – Е0) (Е0 – Е1).
Квантово-механическая теория требует, чтобы при полном заселении новых энергетических уровней электронами общая энергия осталась без изменения, т.е. она должна остаться равной Е0. Иначе говоря, должно выполняться равенство
4(Е2 – Е0) = 6(Е0 – Е1),
где 4 и 6 – максимальное число электронов на d- и d-АО. Из этого равенства следует, что
(Е2 – Е0) / (Е0 – Е1) = 3/2 и (Е2 – Е1) / (Е0 – Е1>) = 5/2, или
0 / (Е0 – Е1) = 5/2, откуда (Е0 – Е1) = 2/5 0>.
Размещение каждого электрона из шести максимально возможных на d-орбитали вызывает уменьшение (выигрыш) энергии на 2/5 0.
Наоборот, размещение каждого электрона из четырех возможных на d-орбитали вызывает увеличение (затрату) энергии на 3/5 0.
Если заселить электронами d- и d-орбитали полностью, то никакого выигрыша энергии не будет (как не будет и дополнительной затраты энергии):
4 3/5 0 6 2/5 0 = 0.
Но если исходная d-АО заселена только частично и содержит от 1 до 6 электронов, и эти электроны размещаются только на d-АО, то мы получим значительный выигрыш энергии. Выигрыш энергии за счет преимущественного заселения электронами d-атомных орбиталей называют энергией стабилизации комплекса полем лигандов.
Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое. Чем сильнее поле лигандов, чем больше значение параметра расщепления 0.
Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях. Длины волн полос поглощения комплексов в кристаллическом состоянии или в растворе, обусловленные переходом электронов с d- на d-АО, связаны с параметром расщепления 0 следующим образом:
= 1 / ; 0 = Е2 – Е1 = h = h (c / ) = h c ,
где постоянная Планка h равна 6,626 1034 Дж . с; скорость света с = 3 1010 см/с. Единица измерения 0 – та же, что у волнового числа : см1, что приближенно отвечает 12 Дж/моль.
Параметр расщепления, помимо типа лиганда, зависит от степени окисления и природы комплексообразователя. В комплексных соединениях, включающих комплексообразователи одного и того же периода и в одинаковой степени окисления, с одними и теми же лигандами, параметр расщепления примерно одинаков. С ростом степени окисления комплексообразователя значение 0увеличивается. Так, для аквакомплексов [Mn(H2O)6]2+ и [Fe(H2O)6]2+ значение параметра расщепления составляет 7800 и 10400 см1, а для [Mn(H2O)6]3+ и [Fe(H2O)6]3+ 13700 и 21000 см1 соответственно.
При увеличении заряда ядра атома-комплексообразователя 0 тоже растет. Катионы гексаамминкобальта(III) [Co(NH3)6]3+, гексаамминродия(III) [Rh(NH3)6]3+, гексаамминиридия(III) [Ir(NH3)6]3+ (Z = 27, 45 и 77) характеризуются параметрами расщепления, равными 22900, 34100 и 41000 см-1.
Зависимость 0 от природы лигандов более разнообразна. В результате исследования многочисленных комплексных соединений было установлено, что по способности увеличивать параметр расщепления металлов-комплексообразователей, находящихся в своих обычных степенях окисления, наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд, вдоль которого значение 0 монотонно растет: I Br Cl NCS NO3 F OH H2O H NH3 NO2 CN NO CO.
Таким образом, наиболее сильное электростатическое поле вокруг комплексообразователя и самое сильное расщепление d-АО вызывают лиганды NO2CN и CO.
Рассмотрим распределение электронов по d- и d-орбиталям в октаэдрическом поле лигандов. Заселение d- и d-орбиталей происходит в полном соответствии с правилом Гунда и принципом Паули. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки d-подуровня:
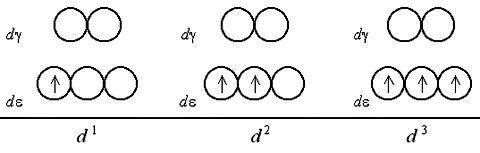
Если число электронов на d-подуровне комплексообразователя больше трех, для размещения их по расщепленным подуровням появляется две возможности. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий d- и d-орбитали; четвертый, а затем и пятый электроны заселяют квантовые ячейки d-подуровня. При сильном поле лигандов и высоком значении 0 заселение четвертым и пятым электроном d-подуровня исключено; происходит заполнение d-орбиталей.
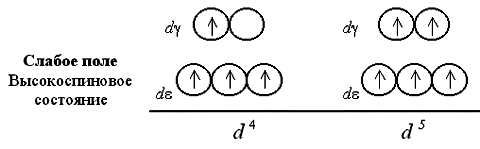
При слабом поле лигандов заселяющие квантовые ячейки 4 или 5 электронов имеют параллельные спины, поэтому получаемый комплекс оказывается сильно парамагнитен. В сильном поле лигандов образуются одна, а затем две электронные пары на d-подуровне, так что парамагнетизм комплекса оказывается гораздо слабее.
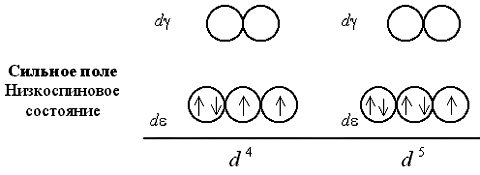
Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d-подуровне, дополняя конфигурации до электронных пар (одной в случае d6, двух – d7 и трех – d8):
В случае сильного поля лигандов шестой электрон заселяет d-АО, приводя к диамагнетизму комплекса, после чего седьмой и восьмой электроны поступают на d-подуровень:
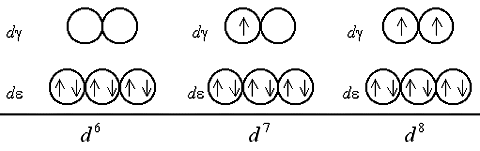
Очевидно, при восьмиэлектронной конфигурации различия в строении между комплексами с лигандами слабого и сильного поля исчезают. Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
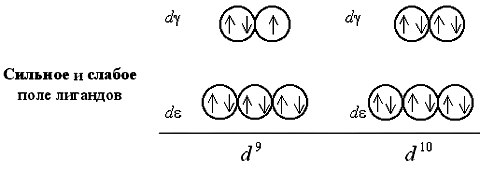
Вернемся к рассмотрению электронного строения октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3. В соответствии с расположением в спектрохимическом ряду, аммиак NH3 относится к числу лигандов сильного поля, а фторид-ион F – слабого поля. Следовательно, заселение электронами атомных орбиталей в данных комплексах будет происходит по схеме:
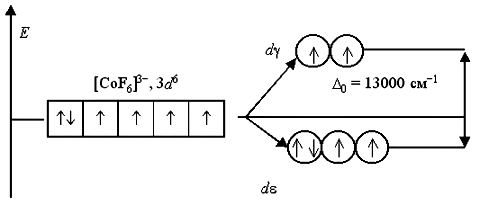
В анионе [CoF6]3 лиганды F создают слабое кристаллическое поле ( 0 = 13000 см1), и все электроны исходной 3d6-АО размещаются на d- и d-орбиталях без какого-либо спаривания. Комплексный ион является высокоспиновым и содержит четыре неспаренных электрона, поэтому он парамагнитен.
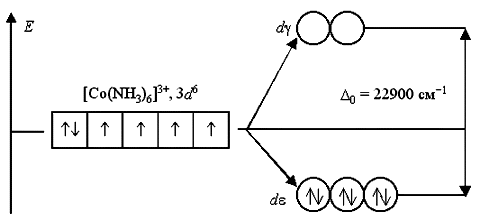
В ионе [Co(NH3)6]3+ лиганды NH3 создают сильное кристаллическое поле (0 = 22900 см1), все 3d6-электроны размещаются на более энергетически выгодной d-орбитали. Переход электронов с d- на d-орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен.
Аналогичным образом могут быть представлены схемы распределения электронов по орбиталям в октаэдрическом поле для ионов [Fe(H2O)6]2+ и [Fe(CN)6]4:

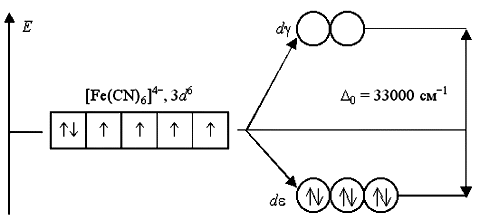
Лиганды H2O создают слабое поле; обмен электронами между d- и d-орбиталями не вызывает затруднений и поэтому число неспаренных электронов в комплексном ионе такое же, как и в условном ионе Fe+II. Получаемый аквакомплекс – высокоспиновый, парамагнитный. Наоборот, лиганды CN вызывают значительное расщепление d-АО, составляющее 33000 см1. Это значит, что существует сильная тенденция к размещению всех электронов на d-орбиталях. Выигрыш энергии, получаемый при таком заселении орбиталей, много больше энергетических затрат, обусловленных спариванием электронов.
Теория кристаллического поля
В 1929г. Г.Бете в статье «Расщепление атомных термов в кристаллах» заложил основы теоретического подхода к описанию распределения электронов в d- и f-оболочках центрального атома, координирующего относительно себя группы лигандов в окружениях различной симметрии. Этот подход, получивший название теории кристаллического поля, включает следующие основные положения:
а) Природа сил, вызывающих наличие координационных связей и определяющих устойчивость координационного соединения, сводится к чисто электростатическому взаимодействию между центральным ионом-комплексообразователем и лигандами.
б) Лиганды независимо от их реальной структуры рассматриваются в теории кристаллического поля как точечные заряды, характер расположения которых относительно центрального иона определяет симметрию действующего на него внешнего электростатического поля.
в) Электронная конфигурация центрального иона учитывается в рамках квантово-механических представлений.
В свободном атоме или ионе энергии всех d –электронов, принадлежащих к одной и той же электронной оболочке, одинаковы, т.е. имеет место вырождение энергетических уровней. Между электронными облаками d–электронов и лигандами действуют силы отталкивания, приводящие к увеличению энергии d–электронов. Однако воздействие лигандов на различные d–орбитали неодинаково. Энергия электронов на d–орбиталях, расположенных близко к лигандам, возрастает больше, чем на d–орбиталях, удалённых от лигандов; в результате под действием лигандов происходит расщепление энергетических уровней d–орбиталей.
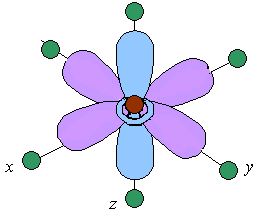
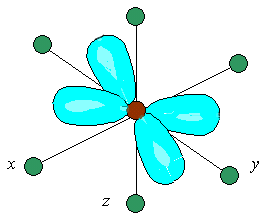
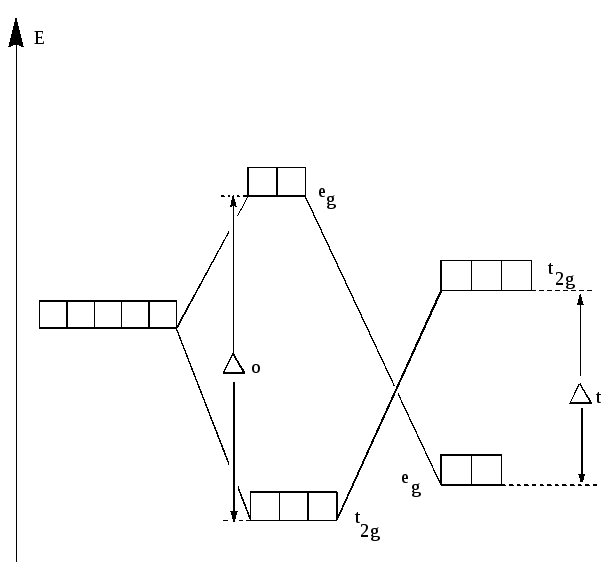
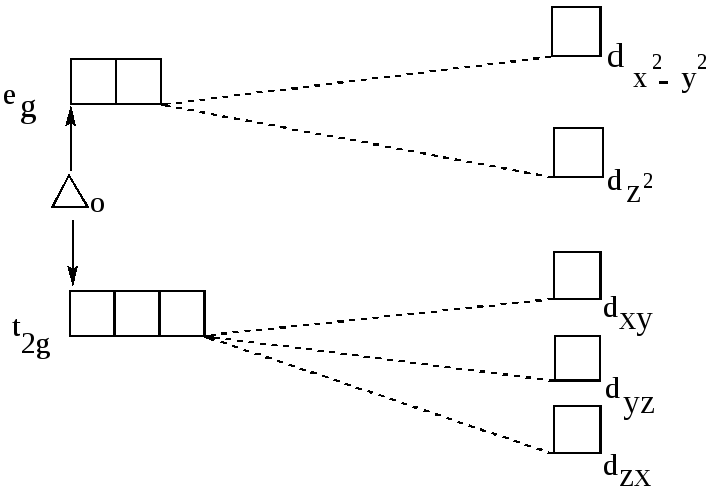
При октаэдрическом расположении лигандов вокруг центрального атома наибольшее отталкивание испытывают электроны, находящиеся на орбиталях dz2 и dx2-y2 , направленных к лигандам (рис.18), поэтому их энергия будет более высокой, чем у электронов, находящихся на орбиталях dxy,dxz,dyz, расположенных между лигандами. В октаэдрическом поле лигандов происходит расщепление d –уровня на два энергетических уровня: более высокий eg (соответствует орбиталям dz2,
dx2-y2 ) и более низкий уровень t2g ( соответствует орбиталям dxy,dxz,dyz).Таким образом, вырождение пяти d –орбиталей иона снимается частично, что приводит к образованию двукратно вырожденного уровня eg и трёхкратно вырожденного уровня t2g.
Разница в энергиях уровней eg и t2g называется энергией расщепления . Расчёты показывают, что если за точку отсчёта принять энергию d–уровня, то энергия уровня eg равна о + 3/5, а уровня t2g соответственно, о — 2/5,где о-изменение энергии уровня под действием сферически симметричной части поля лигандов, -энергия расщепления.


а) б)
Рис. 18. Орбитали dx2—y2 (а) и dxy(б) в октаэдрическом поле
лигандов
d-орбитали иона Ион в окта- Ион в тетра-
в сферическом эдрическом эдрическом
поле поле поле
Рис.20. Расщепление d-орбиталей кристаллическим полем
разной симметрии
eg – орбитали( dz2, dx2—y2) t2g— орбитали(dxy,dxz,dyz).
Поглощение света комплексными соединениями d-элементов теория кристаллического поля объясняет переходом электронов с t2g – подуровня на eg – подуровень в октаэдрических комплексах и с eg – подуровень на t2g– подуровень в тетраэдрических комплексах. При этом поглощается квант света, энергия которого равна энергии расщепления: h=, где h- постоянная Планка,— частота колебаний. Энергия расщепления, таким образом, оказывается математически связана с частотой колебания света в максимуме поглощения и, следовательно, с длиной волны максимума поглощения: =/h и =с/, где с- скорость света.
Основные факторы, влияющие на величину расщепления
а) Энергия расщепления тем больше, чем больше заряд катиона-комплексообразователя при прочих равных условиях (одинаковая электронная конфигурация, размеры ионов, одинаковое лигандное окружение, симметрия, число и природа лигандов). С увеличением заряда иона значение увеличивается, так как лиганды ближе подходят к иону и, следовательно, вызывают большее расщепление d-уровня. Экспериментально показано, что двухзарядные катионы 3-d переходного ряда имеют о в среднем 7500-12500см-1, а трёхзарядные 14000-25000 см-1 .
Например, аквакомплексы [Cr(H2O)6]2+ и [Mn(H2O)6]3+имеют соответственно синюю и вишнево-красную окраску. Ионы Cr2+ и Mn3+ изоэлектронны, их электронная конфигурация 3d4.Красное окрашивание [Mn(H2O)6]3+ свидетельствует о поглощении комплексом более коротких волн, т.е. о большей энергии расщепления, чем у комплекса [Cr(H2O)6]2+,который поглощает более длинные волны (красно-зелёная часть спектра видимого света),
и, следовательно, имеет более низкую энергию расщепления.
б) Для данного заряда (и электронной конфигурации) катиона-комплексообразователя, принадлежащего к ряду d–элементов, при заданном лигандном окружении расщепление тем больше, чем больше атомный номер элемента, образующего центральный ион. Так, в ряду гексааммиакатов Co3+,Rh3+,Ir3+ с d6-электронной конфигурацией{[Co(NH3)6]3+, [Rh(NH3)6]3+, [Ir(NH3)6]3+} расщепление увеличивается от Co к Ir . Это объясняется тем, что протяжённость d -орбиталей растёт в ряду 3d-4d-5d. Это приводит к усилению электростатического отталкивания между лигандами и электронами d-орбиталей центрального иона, что увеличивает неравноценность энергетического состояния электронов на t2g и eg — орбиталях, т.е. величина расщепления увеличивается.
в) Расщепление в октаэдрическом поле больше при прочих равных условиях, чем в тетраэдрическом. Объясняется это тем, что при одинаковом расстоянии металл-лиганд суммарный заряд лигандов и их суммарное отталкивание от d-орбиталей больше в октаэдре, чем в тетраэдре ( t 4/9о).
г) Величина расщепления зависит от природы лиганда, что определяется положением лиганда в спектрохимическом ряду:
I < Br < SCN— < Cl <NO3— < F < OH < ONO— < C2O42 < H2O < NCS < CH3CN < NH3 < глицин < пиридин < этилендиамин<
дипиридил < о-фенантролин < NC— < NO2 < CN < CO.
Принято считать, что левее аммиака в спектрохимическом ряду располагаются лиганды “слабого поля”, а правее – лиганды “сильного поля”, дающие при прочих равных условиях большую величину расщепления.
Удовлетворительного обоснования расположению лигандов в этом ряду теория кристаллического поля не даёт. Например, теория не объясняет, почему более полярные лиганды, в частности, Н2О,( =1,85D) дают более слабое поле, чем менее полярные,например,NH3( =1,47 D).
Если общее число электронов, находящихся на d–орбиталях центрального атома, не превышает трёх, то они размещаются на орбиталях более низкого энергетического уровня по правилу Хунда. Например, три d-электрона иона Cr3+ в октаэдрическом поле занимают три d–орбитали с низкой энергией ( t2g): t2g3eg0 .
Благодаря такой электронной конфигурации комплексы Cr3+ очень прочны, так как электронные облака t2g-орбиталей располагаются между лигандами и слабо экранируют заряд ядра хрома. Поэтому комплексов Cr3+ известно очень много.
При наличии в ионе-комплексообразователе числа электронов, превышающего число орбиталей с низкой энергией, возможны
два варианта заполнения орбиталей электронами. В случае слабого поля энергетически более выгодным оказывается равномерное распределение d-электронов по всем d–орбиталям в соответствии с правилом Хунда. В этом случае центральный ион сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс (например: [FeF6]3(рис.21).
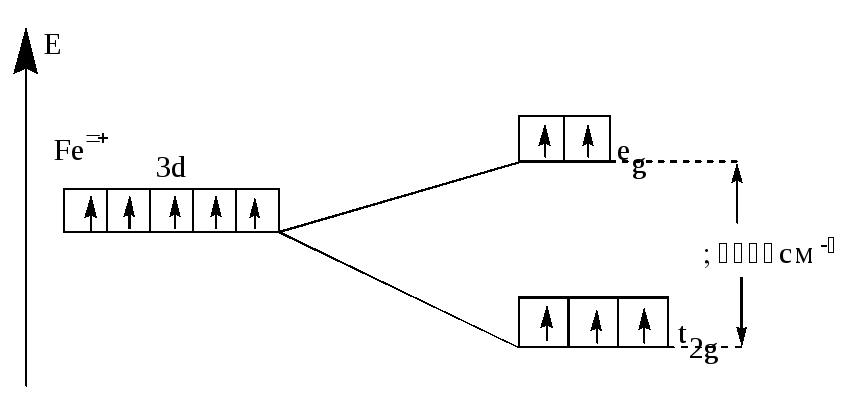
Рис.21. Распределение d-электронов по орбиталям иона Fe3+
в октаэдрическом комплексе [FeF6]3-.
В случае же сильного поля энергетически более выгодным будет размещение максимального числа электронов на t2g -орбиталях, при этом образуется низкоспиновый диамагнитный комплекс(например: [Fe(CN))6]3-(рис.22).
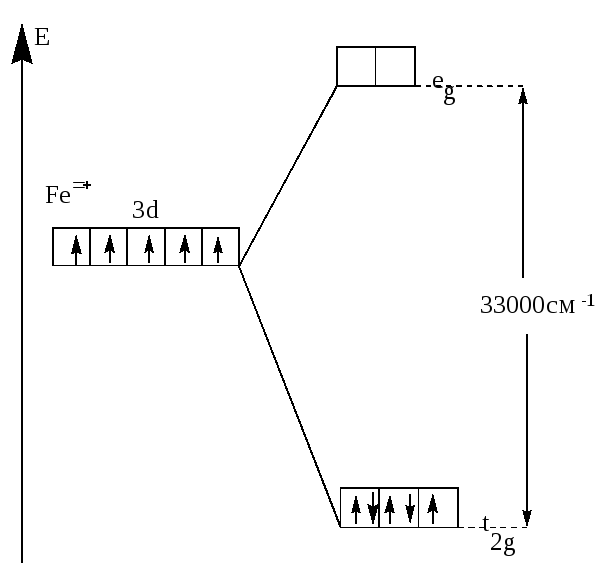
Рис.22. Распределение d-электронов по орбиталям иона Fe3+
в октаэдрическом комплексе [Fe(CN)6]3-.
Табл.1 показывает, что подразделение комплексов на высокоспиновые и низкоспиновые имеет смысл только в случае электронных конфигураций d4,d5,d6 и d7 ..
Таблица 1. Электронные конфигурации комплексообразователя в октаэдрических комплексных соединениях в слабом и сильном полях
Электрон- ная кон- фигурация | Распределение электронов по подуровням в слабом поле | Максим. спин | Распределение электронов по подуровням в сильном поле | Максим. спин |
d1 | t2g1eg0 | 0,5 | t2g1eg0 | 0,5 |
d2 | t2g2eg0 | 1,0 | t2g2eg0 | 1,0 |
d3 | t2g3eg0 | 1,5 | t2g3eg0 | 1,5 |
d4 | t2g3eg1 | 2,0 | t2g4eg0 | 1,0 |
d5 | t2g3eg2 | 2,5 | t2g5eg0 | 0,5 |
d6 | t2g4eg2 | 2,0 | t2g6eg0 | 0,0 |
d7 | t2g5eg2 | 1,5 | t2g6eg1 | 0,5 |
d8 | t2g6eg2 | 1,0 | t2g6eg2 | 1,0 |
d9 | t2g6eg3 | 0,5 | t2g6eg3 | 0,5 |
d10 | t2g6eg4 | 0,0 | t2g6eg4 | 0,0 |
Стереохимия соединений d-элементов определяется теми же принципами что и для остальных элементов, т.е. тенденцией электронных пар занимать положения с минимальным взаимодействием между собой. Но для d –элементов приходится учитывать дополнительное влияние несвязывающих электронов на (n -1)d- орбиталях. Если несвязывающая
(n -1)d- конфигурация симметрична по отношению к октаэдрическому полю лигандов, то все шесть лигандов будут отталкиваться в одинаковой степени, и следует ожидать правильного октаэдрического строения. Такими конфигурациями являются:
do , например Ti+4 в [TiF6]4-
t2g3 , например Cr+3 в [Cr(C2O4)3]3-
t2g3 eg2(высокоспиновая),
например Mn+2 в [MnF6]4-
Fe+3 в [FeF6]3-
t2g6 (низкоспиновая),
например Fe+2 в [Fe(CN)6]4-
Co+3 в [Co(NH3)6]3+
t2g6eg2 , например Ni+2 в [NiF4]2- и [Ni(NO2)4]4-
t2g6eg4, например Zn+2 в [Zn(NH3)6]2+
Низкоспиновые комплексы (d6) ионов Co3+ и Fe2+ ,имеющие
d–электроны только на слабо экранирующих ядро t2g -орбиталях, весьма прочны и их известно очень много.
Неполное укомплектование электронами орбиталей t2g или eg нарушает симметрию комплексов. Так как t2g–орбитали направлены в пространство между лигандами, несимметричная конфигурация их мало влияет на стереохимию. С другой стороны, несимметричные eg– конфигурации оказывают большее влияние, так как их орбитали направлены прямо на лиганды, и, следовательно, некоторые из них будут отталкиваться сильнее, чем другие. В результате высокосимметричное координационное окружение центрального атома подвергается искажению, причём понижение симметрии сопровождается дополнительным расщеплением орбиталей, что приводит к появлению более устойчивых систем (рис.23).Это называется эффектом Яна-Теллера. Наиболее ярко эффект Яна-Теллера проявляется у комплексов, образованных лигандами сильного поля. В этом случае энергетическая выгода от дополнительного расщепления орбиталей особенно велика. Согласно теореме Яна-Теллера данный эффект может проявляться только в тех случаях, когда электронная структура центрального иона допускает двоякое распределение электронов по подуровням и тогда электроны могут разместиться на более выгодных подуровнях, появившихся вследствие дополнительного расщепления, а менее выгодные уровни оставить вакантными или менее заселёнными. Этот эффект проявляется в следующих электронных конфигурациях центрального атома:
t2g6eg1(d7— конфигурация, сильное поле),
t2g6eg2(d8-конфигурация, сильное поле),
t2g6eg3(d9 –конфигурация).
Более слабый эффект наблюдается в высокоспиновых системах:
t2g1eg0(d1-конфигурация),
t2g2eg0 (d2— конфигурация),
t2g4eg2( d6— конфигурация,слабое поле).
Октаэдр Искажённый октаэдр ( по оси z)
Рис.23. Слабое тетрагональное искажение октаэдрического поля.
Например, гексакоординационные комплексы меди(II) склонны к тетрагональному искажению, так как электронная конфигурация центрального иона Cu2+ как в слабом, так и в сильном октаэдрическом поле имеет вид t2g6eg3, а такое состояние допускает двоякое распределение электронов на eg -подуровне:
либо (dz2)2(dx2—y2)1, либо (dz2)1(dx2—y2)2.
У меди(II) электронами в той или иной мере заняты все d–орбитали. Так как орбиталь dx2—y2 лежит выше в искаженном октаэдре, чем орбиталь dz2, неспаренный eg1 у меди размещается на высоколежащей dx2—y2 орбитали. На dz2 – орбитали оказывается элетронная пара eg2. Это приводит к очень сильному отталкиванию лигандов от центрального иона именно в направлении оси dz2, т.е. происходит вытягивание октаэдра.
Например, в комплексе [Cu(NH3)4(H2O)2]SO4 четыре связи
(Cu—N) имеют длину 2,05 Ао, длина связей
(Cu—O) больше – 2,59 и 3,37(Ао). Таким образом, 4 лиганда (NH3), находящиеся в плоскости xy, прочно связаны с ионом меди, а два лиганда (H2O) связаны слабо и удалены. Это приводит к тетрагональному искажению октаэдру – он становится вытянутым.
В некоторых комплексах вследствие очень большого удаления от центрального иона лигандов, расположенных по оси z, координационное число уменьшается от 6 до 4. Октаэдр превращается в плоский квадрат (рис.24):
Октаэдр Сильно искажённый октаэдр
или квадрат
Рис.24. Сильное тетрагональное искажение октаэдрического комплекса с превращением его в квадратный комплекс.
Квадратные комплексы являются типичными для центральных ионов с d8-электронной конфигурацией, особенно для 4d- и 5d -переходного ряда. Многие комплексы Ni2+ имеют плоское квадратное строение. Однако превращение октаэдра в квадрат у Ni2+ достигается только в случае лигандов сильного поля. К числу таких комплексов относится, например,[Ni(CN)4]2-.Лиганды слабого поля дают парамагнитные высокоспиновые комплексы с различной степенью тетрагонального искажения в зависимости от силы поля, например, [Ni(H2O)6]2+.
Особенно характерны квадратные комплексы для d-элементов 5и 6 периодов таблицы Д.И.Менделеева с d8-электронной конфигурацией. Для этих элементов вследствие большой величины параметра расщепления образование квадратных комплексов происходит даже в случае лигандов слабого поля. Так, все комплексы Pd2+ и Pt2+ имеют плоское квадратное строение. Комплексы [PdCl4]2-, [PtCl4]2-, [Pt(NH3)4]2+ (слабое поле) и [PtCN)4]2-(сильное поле) являются низкоспиновыми, диамагнитными.
Не может проявляться эффект Яна-Теллера в высокоспиновых комплексах, образованных центральными ионами с электронной конфигурацией d5(t2g3eg2)- ионы Mn2+,Fe3+; d3(t2g3eg0)- ион Cr3+; d8(t2g6eg2)- ион Ni2+. В этих случаях перераспределение электронов невозможно, так как на t2g и eg нет свободных или неэквивалентных позиций, а изменение электронной конфигурации возможно только в случае сильного кристаллического поля. Экспериментально подтверждено для таких электронных конфигураций отсутствие искажений в октаэдрических комплексах.
|
|
ПОЛЯ ЛИГАНДОВ ТЕОРИЯ,
квантовохим. теория электронного строения координац. соединений. Описывает
взаимодействие центр. атома (или группы атомов) и лигандов на основе представлений
о мол. орбиталях в рамках молекулярных орбиталей методов. Как и в кристаллического
поля теории, в поля лигандов теории принимается, что состояние электронов центр. атома
определяется электростатич. полем, созданным лигандами, однако учитывается также
изменение электронного распределения лигандов под воздействием центр. атома.
Соотв. расширяются и задачи, решаемые методами поля лигандов теории: помимо описания строения,
реакц. способности, расчета спектральных и термодинамич. характеристик координац.
соединений и изменений их св-в при замене центр, атома или, лигандов, становится
возможным теоретич. анализ таких ситуаций, когда взаимодействие центр. атома
и лигандов настолько существенно, что может привести, напр., к образованию прочных
хим. связей. Так, поля лигандов теория позволяет, в частности, описать смещения электронной
плотности s- и p-электронных подсистем в группах СО карбонильных комплексов
металлов. Согласно поля лигандов теории, изменение
электронного распределений в комплексном соед. по сравнению со свободными (изолированными)
центр. атомом и лигандами наиб. существенно для валентной оболочки центр. атома,
высших заполненных и низших незаполненных (виртуальных) орбиталей лигандов;
именно из этих орбиталей конструируются мол. орби-тали комплекса в целом. Остальные
орбитали центр. атома и лигандов считаются неизменными. Эксперим. результаты,
получаемые методами фотоэлектронной и рентгеновской спектроскопии, а также расчеты
с помощью неэмпирических методов квантовой химии свидетельствуют о том,
что потенциалы ионизации с внутр. орбиталей комплексов и электронные распределения
зависят от природы лигандов. Однако при описании электронного строения валентной
оболочки комплекса этой зависимостью можно пренебречь. Поля лигандов теория наиб. плодотворна
для анализа комплексных соед., образованных d- и f-элементами,
в частности переходными металлами, для к-рых характерна близость расположения
атомных уровней типа 3d, 4s и 4р. Расположение энергетич.
уровней комплекса и его орбитали можно определить непосредственно одним из методов
мол. орбиталей (наиб. надежные результаты получают при применении метода самосогласованного
поля ССП-Хa) либо рассчитать приближенно, напр. в предположении,
что изменение взаимодействия орбиталей центр. атома и лигандов в зависимости
от геом. расположения лигандов м. б. описано с использованием лишь угловой части
интегралов перекрывания (см. Молекулярные интегралы). Радиальная часть
интегралов перекрывания более чувствительна к расстояниям между центр. атомом
и лигандами, поэтому изменение радиальной части обычно связывают с нек-рыми
эффективными параметрами, характеризующими степень ковалентности связи. На рис.
показана рассчитанная схема расположения энергетич. уровней октаэдрич. комплекса
XY6, образованного d-элементом; возле каждого уровня указан
тип симметрии орбиталей. Для обозначенных уровней t2u,
t1g, t1u (жирные линии)
корреляция p-орбита-лей лигандов и орбиталей центр. атома мала. Приведенная
картина типична и напоминает в осн. чертах систему уровней, получаемую на основе
теории кристаллич. поля. Схема энергетич. уровней
октаэдрич. комплекса XY6. Пунктирные линии обозначают корреляцию
орбиталей центр. атома X с s- и p-орбиталями лигандов Y. При уровнях
энергии указан тип симметрии орбиталей; звездочкой отмечены разрыхляющие орбитали. С помощью указанной схемы
энергетич. уровней можно, напр., описать низшие электронные состояния комплекса
TiCl63- , если учитывать лишь валентные орбитали атома
Ti (4 валентных электрона), а для каждого из атомов С1-по одной s-орбитали
и по две p-орбитали (5 валентных 2p-электронов для каждого атома).
Все 37 электронов располагают в соответствии с принципом Паули на одноэлект-ронных
уровнях так, чтобы энергия системы была минимальной. Как и в теории кристаллич.
поля, различают случаи сильного, слабого и среднего поля, сравнивая интенсивность
поля лигандов с энергией межэлектронного отталкивания. Для анализируемого комплексаимеет
место случай сильного поля. Если учесть вырождение энергетич. уровней (для уровней
типа a1g кратность вырождения равна 1, типа
еg-2, типов t1g, t1u,
t2g и t2u-3), основное
состояние этого комплекса можно описать электронной конфигурацией .
Для комплекса в целом эта электронная конфигурация определяет состояние типа
2Т2g, т.к. полностью заполненные оболочки
не дают вклада в мультиплетность и симметрию состояния. В рассмотренном примере
ион С1 можно представить условно точечным зарядом, определяющим поле, в к-ром
движется единств. электрон иона Ti3+ , поэтому результаты, полученные
на основе поля лигандов теории и теории кристаллич. поля, качественно совпадают. Однако
количеств. оценки, напр. для потенциалов ионизации, рассчитанных на основе Куп-манса
теоремы, или для энергии электронных переходов
в низшее возбужденное состояние комплекса, существенно различаются. В хелатных,
«сэндвичевых» соед., координационных соед. с p-связями лиганды
— металл и во мн. др. комплексах с легко поляризуемыми лигандами электронное
состояние лигандов и центр. атома нельзя определять как обусловленное воздействием
поля системы точечных зарядов. В таких случаях применима лишь поля лигандов теория, но не
теория кристаллич. поля. То же относится к проблемам исследования перераспределения
спиновой плотности методами ЭПР и анализа взаимодействия электронных и колебат.
движений в молекуле (см. Яна-Теллера эффект). Поля лигандов теория позволяет
объяснить транс-эффект при замещении лигандов, взаимное влияние лигандов
на реакц. способность комплекса и т.п. Ограничения поля лигандов теории относятся
прежде всего к анализу возбужденных состояний комплексов (особенно в случае
средних и слабых полей лигандов). В этих случаях для получения надежных данных
о распределении электронов в комплексах следует учитывать не только расположение
и порядок одноэлектронных уровней энергии, но и корреляц. эффекты, обусловленные
межэлектронным отталкиванием. При анализе комплексов, образованных тяжелыми
металлами, необходим учет спин-орбитального взаимодействия и нек-рых
др. эффектов. Лит.: Бальхаузен
К., Введение в теорию поля лигандов, пер. с нем., М., 1964; Берсукер И. Б.,
Электронное строение и свойства координационных соединений,
2 изд., Л., 1976; Современные проблемы квантовой химии. Строение и свойства
молекул, Л., 1986; Левин А. А., ДьячковП. Н., Электронное строение, структура
и превращения гетеролигандных молекул, М., 1990; Степанов Н. Ф., Пупышев В.
И., Квантовая механика молекул и квантовая химия, М., 1991. В. И. Пупышев. |
Теория поля лигандов
Хотя теория кристаллического поля основана на наглядных представлениях и даёт разумное объяснение спектральных и магнитных свойств некоторых комплексов, у неё есть и существенный недостаток. Рассматривая только электростатические взаимодействия, теория кристаллического поля полностью игнорирует ковалентный характер связи между металлом и лигандами.
Несмотря на успешное в ряде случаев использование этой теории для решения задач координационной химии, эта теория не позволяет объяснить многих важных явлений, связанных с комплексообразованием. В частности, нельзя объяснить закономерность изменения силы лигандов, фиксируемую спектрохимическим рядом. Нельзя также с точки зрения этой теории объяснить ряд явлений, связанных с ковалентным воздействием центрального иона и лигандов. Это подтверждается методами ЭПР, ЯМР, ИК-спектроскопии, электронной спектроскопии, магнетохимии, данными рентгеноструктурного анализа. Теория кристаллического поля не учитывает поляризационные эффекты, приводящие к возникновению ковалентных связей, вносящих очень значительный вклад в энергию взаимодействия центрального иона и лигандов.
Теория поля лигандов объединяет метод молекулярных орбиталей и теорию кристаллического поля: электростатическое воздействие поля лигандов на несвязывающие орбитали центрального атома-комплексообразователя, которое связано со стереохимией, магнитными свойствами и оптическим поглощением комплексов, а связи металл-лиганд можно рассматривать с точки зрения локализованных молекулярных орбиталей, образующихся из соответствующих атомных орбиталей. Особое значение в теории поля лигандов имеет возможность p-донорного и p- дативного взаимодействия.
Теория молекулярных орбиталей даёт подход, учитывающий ковалентный характер связей. Основные принципы теории молекулярных орбиталей, развитых в своё время для двухатомных молекул, применимы и к координационным соединениям. Для комплекса волновая функция молекулярной орбитали yмо представляет собой линейную комбинацию, состоящую из волновых функций орбитали центрального атома металла jм и групповой орбитали лигандов åсjL(линейная комбинация определённых орбиталей лигандов):
yмо =аjм ± båсjL
Знак + в уравнении отвечает связывающей орбитали, знак — разрыхляющей.
Рассмотрим октаэдрические комплексы d-элементов. Система координат взаимного расположения комплексообразователя и лигандов октаэдрического комплекса ML6 показана на рис.25 .
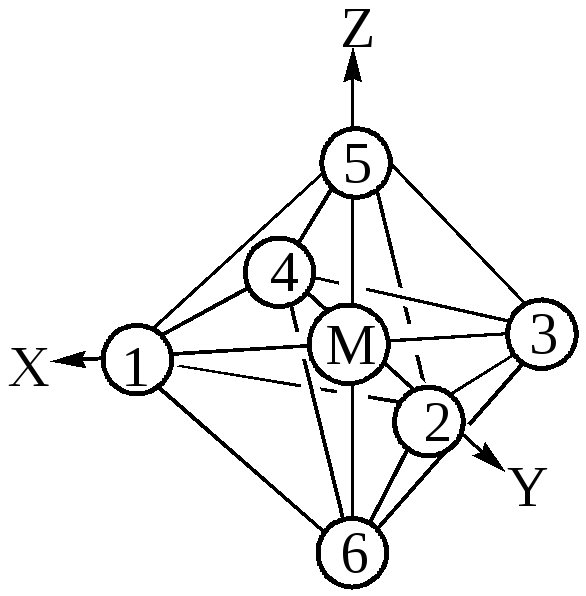
Рис.25. Схема октаэдрического комплекса ML6.
С учётом симметрии и энергетических соображений молекулярные орбитали(МО) строятся как линейная комбинация атомных орбиталей(АО). Могут образовываться как s -, так и p — молекулярные орбитали. Рассматривая связывание в октаэдрических комплексах, мы будем принимать во внимание в начале только s- взаимодействие. Металл (4 период) способен предоставить лигандам девять орбиталей: пять 3d, одну 4s и три 4р. Так,
s-орбиталь комплексообразователя благодаря сферической симметрии одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра. Это приводит к образованию семицентровых связывающей и разрыхляющей молекулярных ss – орбиталей(ss и s*s). Каждая из трёх р-орбиталей может перекрываться с орбиталями лигандов, расположенных по осям x,y,z: px— орбиталь перекрывается только с орбиталями лигандов 1и 3, py— орбиталь – только с орбиталями лигандов 2и 4, pz— орбиталь – только с орбиталями лигандов5 и 6. Это приводит к образованию трёхцентровых, трёх связывающих и трёх разрыхляющих sp -орбиталей(sx,sy,szиsx*,sy*,sz*).Орбитали eg(sz2 и sx2-y2) перекрываются с орбиталями лигандов, соответствующим образом расположеннных в пространстве. При этом образуются две связывающие и две разрыхляющие молекулярные s-орбитали (sz2, sx2-y2 и sz2*и sx-2y2*).Орбитали t2g
(dxy,dyz,dxz ) не подходят для s-связывания, так как они не направлены к орбиталям лиганда. Орбитали t2g могут перекрываться по p — типу с теми орбиталями лигандов, которые обладают подходящей для этого симметрией. Многие лиганды (например, NH3, H2O, Cl—, Br—) не имеют таких орбиталей с энергией, близкой к энергии t2g— орбиталей центрального атома. Между такими лигандами и центральным атомом не образуется p- связей. Электроны, находящиеся на орбиталях t2g в комплексах, где отсутствуют p- связи, мало отличающиеся от их энергии в несвязанном атоме металла. Считается, что электроны, занимающие в свободном атоме металла орбитали dxy,dyz,dxz , при образовании комплекса переходят на несвязывающие молекулярные орбитали t2g, которые по энергии и форме электронных облаков мало отличаются от атомных орбиталей (их обозначение pxyo, pyzo, pxzo).
Октаэдрические комплексы в основном состоянии имеют семь энергетических уровней, три из которых связывающие, три- разрыхляющие и один – несвязывающий.
Рассмотрим с помощью этого метода электронную конфигурацию высокоспинового комплексного иона [CoF6]3- и низкоспинового иона [Co(NH3)6]3+. В образовании химической связи в этом комплексе участвуют 18 электронов: 6 электронов иона-комплексообразователя Co3+ и 12 электронов шести лигандов F—
(в высокоспиновом комплексном ионе) и шести лигандов NH3
(в низкоспиновом комплексном ионе). Молекулярные орбитали образуются в том случае, если атомные орбитали исходных взаимодействующих частиц близки по энергии и соответствующим образом ориентированы в пространстве. Орбиталь 4s иона Co3+ одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра, в результате чего образуются связывающая и разрыхляющие молекулярные ss-орбитали:ss и ss*. Каждая из трёх 4р- орбиталей иона Co3+ перекрываются с орбиталями лигандов, так как последние расположены по осям р-орбиталей комплексообразователя. Это приводит к образованию шести sр— орбиталей: трёх связывающих sx , sy , sz и трёх разрыхляющих sx* ,sy*,sz*. Орбитали s(z2) и s(x2-y2)иона Co3+ перекрываются с орбиталями лигандов, соответствующим образом расположенных в пространстве. При этом образуются четыре молекулярные орбитали: две связывающие sz2,
s(x2-y2) и две разрыхляющие s(z2 )*, s(x2—y2)*. Орбитали dxy,dxz,dyz иона-комплексообразователя не направлены к орбиталям лигандов и не комбинируются с ними, поэтому не участвуют в образовании s-связи. Энергия этих орбиталей не изменяется, и они являются несвязывающими орбиталями. Их обозначение:
pxzо,pxyо,pyzо .
Таким образом, в каждом из комплексных ионов [CoF6]3- и [Co(NH3)6]3+ пятнадцать молекулярных орбиталей: шесть связывающих, шесть разрыхляющих и три несвязывающих.18 валентных электронов в высокоспиновом комплексном ионе [CoF6]3- на молекулярных орбиталях располагаются следующим образом:
(ss )2,(sx)2,(sy)2,(sz)2,(sx2-y2)2,(sz2)2/ (pxzо)2,(pxyо)1,(pyzо)1 /
(s*x2—y2)1,(s*z2)1.
Схема образования молекулярных орбиталей в высокоспиновом комплексном ионе [CoF6]3- представлена диаграммой на рис.26.
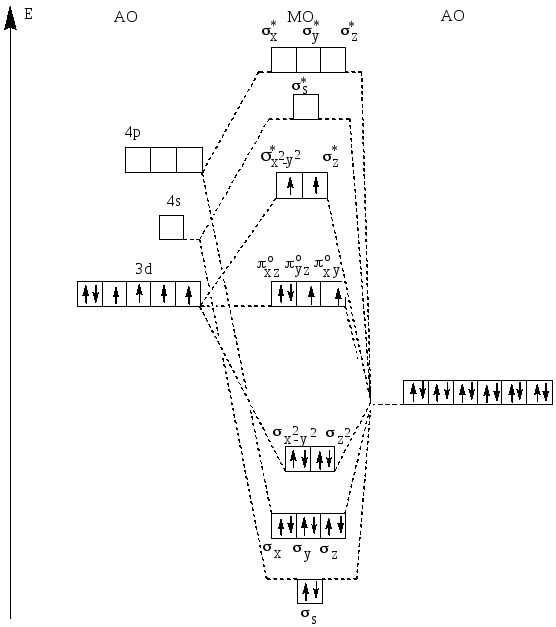
Рис.26. Схема распределения валентных электронов по молекулярным орбиталям октаэдрического высокоспинового комплекса [CoF6]3-.
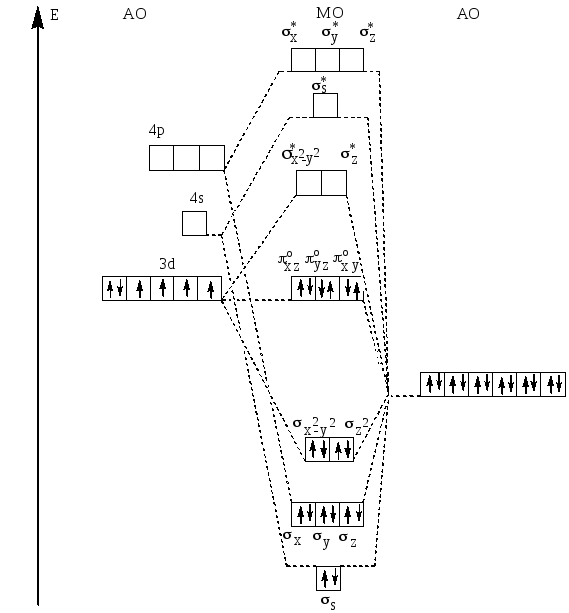
Рис.27. Схема распределения валентных электронов по молекулярным орбиталям октаэдрического низкоспинового комплексного иона [Co(NH3)6]3+.
Молекулярные орбитали oxy ,oxz, oyz и *x2—y2, *z2 в теории поля лигандов соответствуют dx2—y2 , dz2и dxy, dxz, dyz – орбиталям, возникающих при расщеплении d — уровня в октаэдрическом поле лигандов. Таким образом, и в теории поля лигандов величина соответствует энергии электронного перехода между уровнями t2g и eg . В соответствии с рассматриваемой теорией растёт с увеличением степени перекрывания исходных орбиталей, которое приводит к увеличению энергетического различия между связывающими и разрыхляющими орбиталями, т.е. значение растёт с усилением - связывания металл-лиганд.
Однако, большинство лигандов способно к образованию не только -, но и - связей. Орбитали лигандов, способные к - перекрыванию, это р- и d- атомные орбитали или молекулярные и * — орбитали двухатомных молекул. По условиям симметрии t2g(dxy, dxz,dyz) – орбитали центрального атома могут комбинироваться с орбиталями лигандов с образованием молекулярных - орбиталей. В зависимости от того, заполнены или вакантны валентные орбитали лигандов, влияние образования - связей на величину оказывается прямо противоположным. Если заполненные уровни лигандов лежат значительно глубже валентных уровней металла, связывающие молекулярные орбитали комплекса будут формироваться на основе атомных орбиталей лигандов (например, галогенов или воды), а антисвязывающие – из орбиталей металла. В этом случае становится меньше значения, характерного для комплексов с одними лишь - связями. При образовании *- орбиталей комплекса некоторая часть электронной плотности от лигандов переносится к центральному атому. Такое - взаимодействие называется -донорно-акцепторным. Если вакантны уровни лигандов, лежащих выше заполненных валентных уровней металла, связывающие молекулярные орбитали комплекса, напротив, будут формироваться на основе орбиталей металла, а разрыхляющие молекулярные орбитали — на основе орбиталей лигандов. В результате, энергия несвязывающей t2g— орбитали центрального атома понижается, так как она превращается в связывающую молекулярную орбиталь. В этом случае становится больше значения, характерного для комплексов с одними лишь - связями. Тогда при образовании - орбиталей комплекса часть электронной плотности центрального атома переносится к лигандам. Такое взаимодействие называется
-дативным.
Лиганды, являющиеся- акцепторами, вызывают большее расщепление d- уровня; лиганды, являющиеся -донорами, наоборот, вызывают малое расщепление d- уровня. Именно поэтому лиганды начала спектрохимического ряда (галогены, Н2О), которые способны быть только -донорами, но не -акцепторами, создают слабое поле, а лиганды правой части ряда (СО,NO2—,CN—) проявляют свойства -акцепторов и, участвуя в -дативном взаимодействии, создают сильное поле. Такие комплексные соединения имеют большую устойчивость.
Физико-химические методы исследования карбонилов металлов, таких как [Fe(CO)5], [Ni(CO)4]и других, подтверждают наличие прочной -дативной связи металл-лиганд. Рентгеноэлектронная спектроскопия фиксирует на атоме металла положительный заряд, причиной которого является перенос электронов с центрального атома на разрыхляющие орбитали лиганда. В результате координации атомом металла прочность связи С-О уменьшается.
Следует также отметить, что хорошие -акцепторы, которые проявляют тенденцию к образованию комплексов с металлами в низкой степени окисления, так как при этом лиганду возвращается основная часть заряда, отданного металлу при образовании
- связей, повышают устойчивость комплексов металлов с низкими степенями окисления.
d-Элементы образуют также комплексы с молекулами органических соединений с - связями. В качестве примера можно привести соль Цейзе K[C2H4PtCl3], дибензолхром [Cr(C6H6)2] ферроцен [Fe(C5H5)2].
В анионе [Pt(- C2H4)Cl3]— соли Цейзе ион Pt2+ в сильном поле лигандов имеет dsp2— гибридизацию и образует, как правило, квадратные комплексы. Вакантная d- орбиталь Pt2+ перекрывается с заполненной электронами связывающей - орбиталью С2Н4 (донорно-акцепторная связь). (рис. 28).
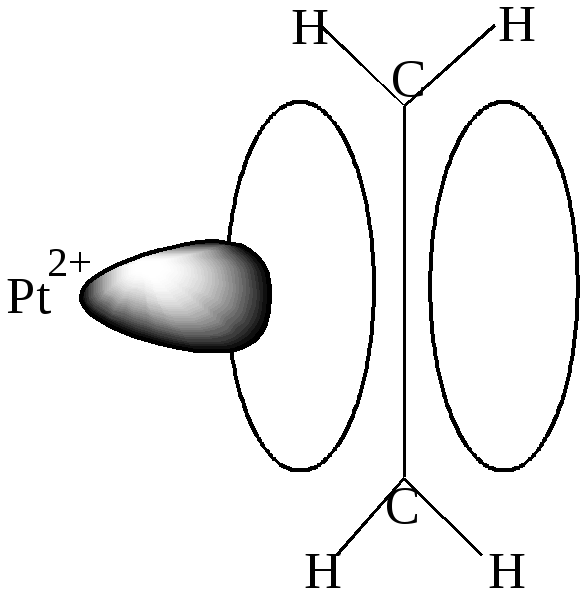
Рис. 28. Схема образования донорно-акцепторной связи
в этиленовом комплексе платины(II).
Перекрывание *- разрыхляющей вакантной орбитали С2Н4 – с заполненной двумя электронами d- орбиталью Pt2+ образует - дативную связь (рис.29). Таким образом, в подобных комплексах осуществляется кратная связь, что определяет их стабильность.
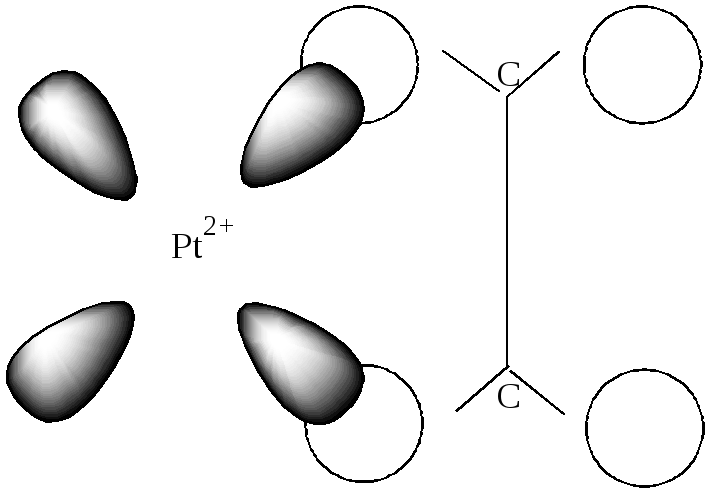
Рис. 29. Схема образования π-дативной связи в этиленовом
комплексе платины(II).
Лиганды сила поля — Справочник химика 21
Покажем это на примере рассмотрения электронного строения комплексов железа. На рис. 3.23, а изображено распределение электронов в невозбужденном атоме железа. Подуровни 35 и Ър полностью заполнены парами электронов, в образовании связи они не принимают участия, на рис, 3.23,6 даны подуровни с электронами, принимающими участие в химических процессах, а на рис. 3.23, в это электронное строение представлено одной строкой 3 45 4р°4 . При образовании иона Ре + два электрона с 45-подуровня отрываются и образуется конфигурация (рис. 3.23, г). Ион Ре2+ взаимодействует с лигандами, причем от силы поля лигандов зависят электронное строение комплексообразователя и его магнитные свойства. [c.134]В отличие от ионов -эле.ментов для ионов лантаноидов можно рассматривать только высокоспиновые состояния, так как сила поля даже самого сильного лиганда оказывается недостаточной для спаривания электронов на нижнем расщепленном уровне. Поэтому /-подуровень лантаноидов заполняется сначала семью одиночными электронами, и только потом начинается их спаривание. В результате осуществляется распределение электронов, подчиняющееся правилу Хунда. Поэтому магнитные свойства комплексных нонов лантаноидов не зависят от силы поля лигандов. [c.208]
Для комплексного иона [Си (NHa)4] + максимум поглощения видимого света соответствует длине волны 304 нм, а для иона [Си(Н20)4Р+ — длине волны 365 нм. Вычислить энергию расщепления -подуровня в этих комплексных ионах. Как изменяется сила поля лиганда при переходе от Nh4 к Н2О [c.211]
Если бы электроны могли свободно распределяться по всем -уровням, тогда, говоря символически, каждый электрон на /5 задерживался бы в /ае Состоянии и на /5 — в е2-состоянии и имел бы среднюю энергию 40 . Если принять эту энергию за нулевой уровень, то электрону в 4й-состоянии соответствует энергия —4D , а электрону в е2-состоянии — энергия +60д. Выраженную в таких единицах разность энергии между основными состояниями в возмущенном и невозмущенном случае называют энергией стабилизации в поле лигандов (ЭСПЛ) (или энергией стабилизации кристаллическим полем). В табл. 26 приведены ее значения, понятные без объяснений, полученные для различного распределения электронов (варианты распределения в зависимости от того, занимают электроны все пять уровней или только -состояния, возможны, если число электронов колеблется от четырех до семи). Изменение ЭСПЛ в зависимости от числа электронов очень хорошо совпадает с изменением теплоты гидратации двухзарядных ионов элементов первого периода (рис. 55). Значения могут быть найдены эмпирически из спектров комплексов. Так, например, полоса поглощения в видимой области для комплексных ионов [Т1(Н20)в1 , существующих в водном растворе, относится к переходу -электрона из 2 -состояния в е -состояние, частота которого и соответствует расщеплению QDq- Оказывается, что очень сильно зависит от природы лигандов. Сила поля лигандов и, следовательно, увеличивается в следующем ряду [c.163]
Как связано изменение окраски комплексов меди(П) при замещении молекул Н2О на молекулы Nh4 и этилендиамина с различиями в силе поля этих лигандов [c.651]
С изменением силы поля лигандов состояния одной и той же симметрии и одной и той же спиновой вырожденности не могут пересекаться. [c.82]
Как следует из электростатики, сила поля (вызываемое им расщепление 10 О ) тем больше, чем больше заряд (или дипольный момент) лигандов, протяженность -орбиталей и чем короче расстояние центральный нон — лиганд. Практически 10 находят кз спектров растворов по частоте Vп,ax максимума полосы поглощения [c.122]
Влияет ли сила поля лигандов на электронное строение октаэдрических комплексов хрома (1П) [c.624]
Объясните, почему окраска разбавленного водного раствора СиЗО по мере приливания концентрированной хлороводородной кислоты переходит от голубой в зеленую. Можно ли судить о силе поля лигандов на основании этого эксперимента [c.73]
Заполнение электронами расщепленных уровней tqg и eg происходит в последовательности, которая обеспечивает минимальную энергию системы комплексообразователь — лиганд и определяется соотношением двух конкурирующих факторов энергией спаривания электронов и разностью энергий упрочнения и ослабления связи Д св- Поэтому заполнение электронами уровней /гг и вд может проходить двумя способами в зависимости от силы поля лигандов, [c.201]
Заметим, что некоторые электронные конфигурации, отвечающие началу и окончанию заполнения -подуровня, не зависят от силы поля лигандов. Таковы, например, конфигурации (1 и для октаэдрического окружения. [c.204]
Величина расщепления зависит как от природы лиганда, так и от природы металла и его степени окисления. Следовательно, каждый лиганд можно характеризовать силой поля, которая вызывает расщепление -уровней. В результате экспериментального исследования спектров многочисленных комплексов различных металлов было установлено, что влияние лигандов может быть представлено в виде спектрохимического ряда, где они расположены в порядке возрастания энергии расщепления 1 ряда состоит в том, чтобы ориентировочно предсказать величину расщепления -уровней, а следовательно, и относительное положение полос поглощения в спектрах комплексов данного металла с разными лигандами. В некоторых случаях наблюдается аномальная последовательность для соседних или близко расположенных членов ряда, что необходимо иметь в виду. [c.212]
Согласно правилу Хунда в октаэдрическом окружении лигандов первыми заполняются три нижележащие ёху, уг- и -орбитали. Следующий, четвертый, -электрон имеет две различные возможности заполнения или на более низкую орбиталь с образованием пары электронов, или на более высокую орбиталь с сохранением неспаренного состояния. При осуществлении первого варианта из четырех электронов два остаются неспаренными и реализуется низкоспиновое состояние. Во втором варианте все четыре электрона не спарены, и возникает высокоспиновое состояние. Пятый, шестой и седьмой -электроны имеют две возможности заполнения с переходом в высокоспиновое илн низкоспиновое состояние. Остальные три электрона заполняют оставшиеся орбитали независимо от силы поля окружающих лигандов. [c.204]
Кобальт в двухвалентном состоянии o +( ) также образует два типа комплексов, различающихся по магнитным свойствам. В низкоспиновом комплексе Со(Ы02)б один неспаренный электрон, а в высокоспиновом Со (НаО) » три неспаренных электрона. Магнитные свойства ионов комплексообразователей, имеющих на -подуровне по 8 и 9 электронов, не зависят от силы поля лигандов. Таковы ионы [c.245]
Электронное состояние атома-комплексообразователя и сила поля лигандов влияют на кинетическую стабильность комплексных ионов и скорости реакций с их участием. Кинетическую стабильность комплексов принято характеризовать скоростью замещения в них одних лигандов на другие. Если при 25 °С и стандартной концентрации реагирующих веществ замещение лигандов
3.5.1.Теория кристаллического поля и теория поля лигандов
Простейший способ описания химической связи в координационных соединениях дает теория кристаллического поля (ТКП). В ее рамках электронное строение комплекса объясняется в терминах возмущения АО центрального атома электростатическим полем лигандов. Это возмущение полагается малым и приводит лишь к расщеплению энергетических уровней d- или f-элемента. Распределение валентных электронов по расщепленным энергетическим уровням центрального атома определяется его сортом, величиной отталкивания этих электронов от лигандов, считающихся отрицательными точечными зарядами, взаимодействием электронов между собой. Таким образом, электронная конфигурация центрального атома a рассматривается явно, тогда как лиганды – феноменологически. Возмущение описывается оператором возмущения
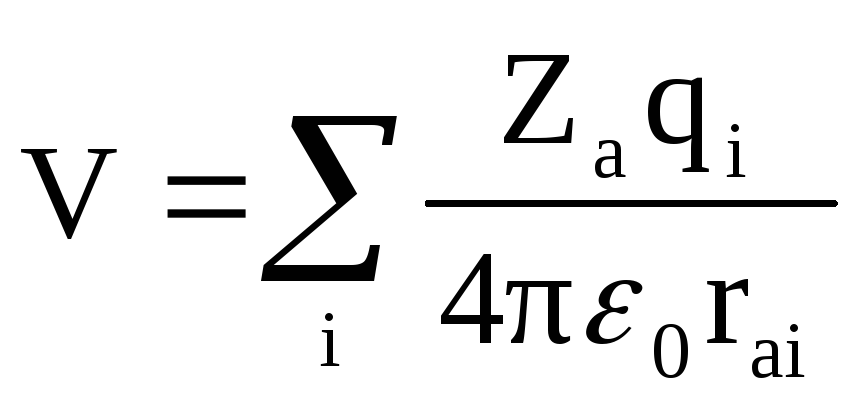 (3.41)
(3.41)
где rai – расстояние от ядра центрального атома а до лиганда i.
Для координационных соединений ионов, имеющих в d-оболочке один электрон (Ti3+, V4+) характер расщепления уровней можно установить, не проводя точных расчетов. Все АО свободного иона энергетически равноценны, они сохраняют свою эквивалентность и в гипотетическом сферически-симметричном поле лигандов (в этом поле их общий уровень лишь поднят в силу взаимодействия с отрицательно заряженными лигандами над уровнем в свободном ионе на некоторую величину ). В октаэдрическом поле лигандов радиальные части полной волновой функции всех d-AO одинаковы, однако по угловым характеристикам они делятся на две неравноценные группы. К одной из них, трижды вы-
рожденной и обозначаемой t2g, принадлежат dxy-, dxz— и dyz-AO. Если единственный d-электрон рассматриваемого центрального иона остается в комплексе на одной из этих орбиталей, он оказывается более удаленным от расположенных по координатным осям одноименно заряженных лигандов, чем в том случае, если бы d1-электрон занимал дважды вырожденные еg-орбитали (dx2-y2 и dz2).
Расщепление t2g и еg -уровней рассматривается как некоторый эмпирический параметр и обозначается или 10Dq:
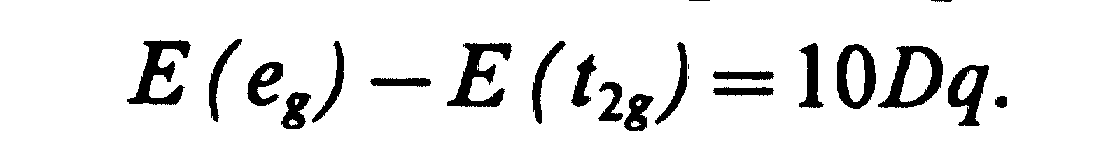 (3.42)
(3.42)
Принимая за нуль отсчета энергию пятикратно вырожденного энергетического уровня d-электронов в сферически-симметричном поле лигандов , можно оценить относительную стабилизацию электронов на t2g и дестабилизацию на еg -уровнях в единицах Dq.
Если все три t2g и два еg-уровня d-электронов центрального иона заселены электронами, сохраняется сферическое распределение электронной плотности центрального иона и выполняется соотношение, известное как теорема центра тяжести:
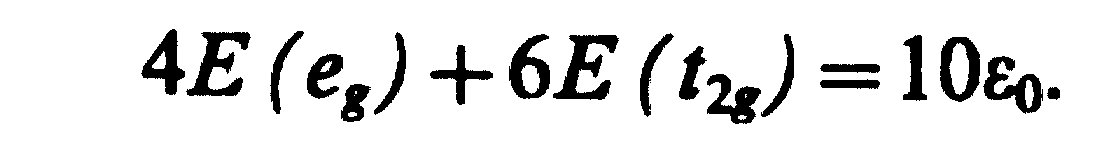 (3.43)
(3.43)
Коэффициенты в левой части этого уравнения соответствуют количеству электронов, которые можно разместить на t2g — и еg -уровнях.
Вводя для энергии стабилизации и дестабилизации обозначения
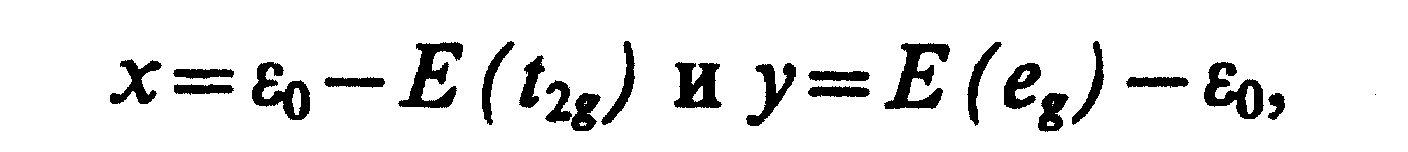 (3.44)
(3.44)
получаем:
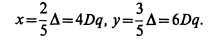 (3.45)
(3.45)
При тетраэдрической координации центрального иона также происходит расщепление уровней d-орбиталей, однако при этом положение электрона на e-орбиталях оказывается более выгодным, чем на t-орбиталях. Это можно наглядно объяснить тем, что в тетраэдре лиганды находятся на диагоналях вписанного в сферу куба, а в октаэдре — на его гранях:
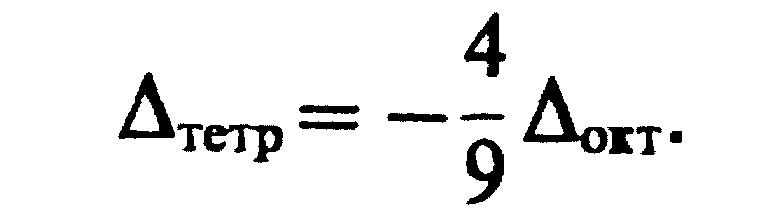 (3.46)
(3.46)
Представленный качественный подход, основанный на рассмотрении взаимодействий электрона на отдельных d-орбиталях с зарядами лигандов, позволяет получить картину расщепления уровней в полях другой симметрии (рис. 11.4). Относительные значения расщеплений отдельных уровней можно получить лишь при количественном расчете.
В табл. 3.10 даны представления симметрии d-орбиталей для точечных групп симметрии, отвечающих наиболее важным конфигурациям координационного узла комплексов.
Таблица 3.10 Представления симметрии для d-орбиталей при различных случаях симметрии
Координационное число | Конфигурация | Точечная Симметрия | АО и их симметрийные обозначения | ||||
dz2 | dx2-y2 | dxy | dxz | dyz | |||
4 | Тетраэдр | Td | е | е | t2 | t2 | t2 |
4 | Квадрат | D4h | a1g | b1g | b2g | e | e |
5 | Квадратная пирамида | С4V | a1 | b1 | b2 | е | е |
5 | Тригональная бипирамида | D3h | a1 | е’ | е’ | е» | е» |
6 | Октаэдр | Oh | eg | eg | t2g | t2g | t2g |

