Сибирские ученые изучают молекулы воды методом широкополосной спектроскопии | Infopro54
Перед учеными стоит задача создать обогащенные изомеры, которые могут найти применение в задачах магнитной томографии.
Структура воды, несмотря на многочисленные исследования, продолжает вызывать интерес учёных. Сотрудники Института автоматики и электрометрии СО РАН (г. Новосибирск) и Института сильноточной электроники СО РАН (г. Томск) решили изучить молекулы воды методами широкополосной терагерцовой спектроскопии. Статья об этом вышла в журнале IEEE Transactions on Terahertz Science and Technology, сообщает издание «Наука в Сибири».
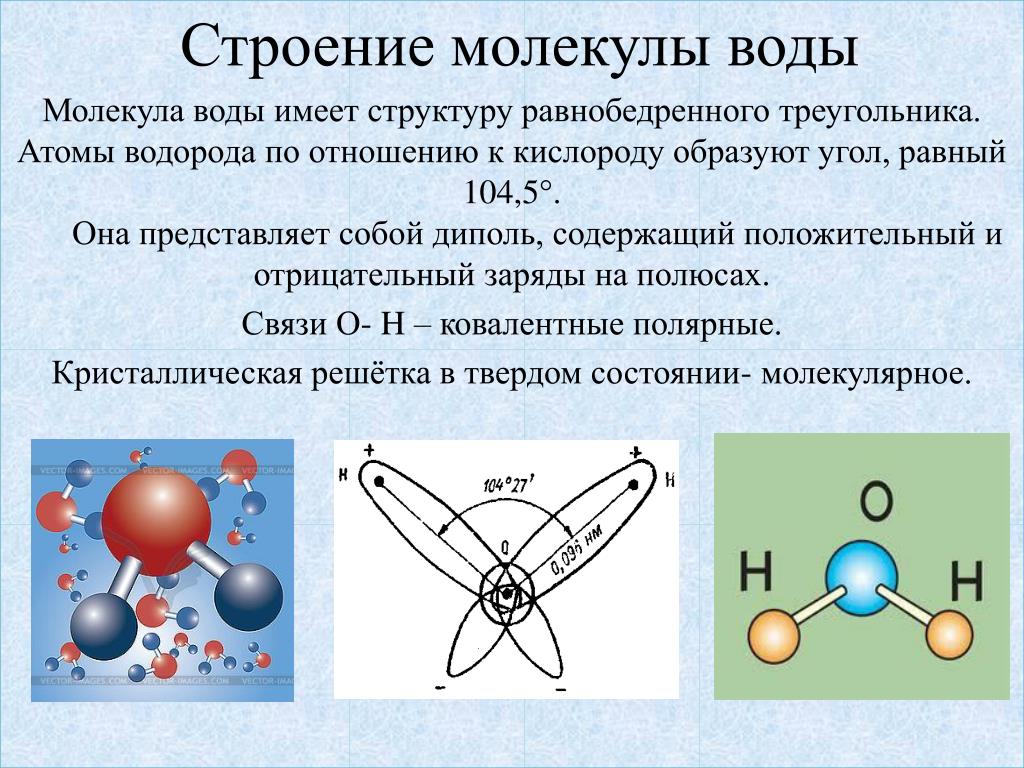
Вода — один из самых важных элементов на Земле. В молекулу воды входит два атома водорода. Ядро каждого из атомов — протон — имеет специфическое физическое свойство, которое называется спин. Молекула воды, в которой спины двух протонов сонаправлены, называется ортоизомером. Если же они направлены навстречу друг другу, то мы имеем дело с параизомером.
— Наше знание о свойствах спиновых изомеров воды ещё не полно, — поясняет один из авторов статьи кандидат технических наук Александр Мамрашев. — Эти два вида молекул имеют почти идентичные физические и химические свойства, поэтому их трудно отделить друг от друга. Также трудно осуществить превращение одного изомера в другой. В нормальных условиях концентрации изомеров молекул воды относятся как 3:1. Основная задача в рамках гранта Российского научного фонда № 17-12-01418, который мы сейчас выполняем, — изменить это отношение в ту или другую сторону, создав тем самым обогащение одного из изомеров. Далее можно будет исследовать свойства и применения спиновых изомеров воды.
По словам ученого, чтобы следить за концентрацией каждого из изомеров, необходим эффективный метод их детектирования. Учёные ИАиЭ СО РАН и ИСЭ СО РАН разработали эффективный метод измерения содержания орто- и параизомеров паров воды, присутствующих в воздухе. Дело в том, что спектры поглощения этих видов молекул отличаются друг от друга: следуя законам квантовой статистики, два изомера воды находятся в различных вращательных состояниях, и это проявляется в инфракрасных и терагерцовых спектрах поглощения.
Для измерения спектров поглощения на вещество направляется поток излучения, часть которого проходит практически без взаимодействия с субстанцией, а часть поглощается ею. В данном исследовании специалисты использовали импульсное терагерцовое излучение и спектрометр, который позволяет измерять поглощение в широком диапазоне частот от 0,1 до 2,7 ТГц. Измеряя величину поглощения отдельных линий, принадлежащих орто- и пара-h3O, в терагерцовом диапазоне, можно определить концентрацию молекул каждого из изомеров.
Преимуществом разработанного метода по сравнению с методами классической узкополосной спектроскопии является возможность одновременного измерения нескольких линий поглощения молекул воды в одинаковых физических условиях без перестройки частоты излучения.
Результат доказывает работоспособность предложенного метода и открывает перспективы его использования для исследования обогащения ядерных спиновых изомеров молекул воды в газовой фазе. Обогащенные изомеры могут найти применение в задачах магнитной томографии и для исследования процессов с участием молекул воды в космосе.
Фото: pixabay.com, автор- PublicDomainPictures
ЖК «Новые Матрешки»
Пл.Маркса25 минут
Реклама. Рекламодатель: ООО СЗ «ВИРА Инвест».
Речной вокзал30 минут
Реклама. Рекламодатель: ООО СФ Проспект
ЖК «Матрешкин двор»
Студенческая30 минут
Реклама. Рекламодатель: ООО СЗ «ВИРА Инвест».
Grando — дом-небоскреб
Березовая роща5 минут
Реклама. Рекламодатель: ООО СЗ «ВИРА Инвест».
ЖК «GORIZONT»
Золотая Нива12 минут
Реклама. Рекламодатель: ООО СЗ «ВИРА Инвест»
ЖК «Luna»
Заельцовская9 минут
Реклама. Рекламодатель: ООО СЗ «ВИРА Инвест»
Повлияет ли нововведение на рынок недвижимости в Новосибирске?
Читать статью >>
Разработана программа по обустройству выделенных полос в Новосибирске до 2030 года.
Читать статью >>
На этом настаивали кредиторы эмитента. Они опасаются, что бизнес компании может быть переведен на третьих лиц.
Они опасаются, что бизнес компании может быть переведен на третьих лиц.
Читать статью >>
Лидером традиционно остается Узбекистан.
Читать статью >>
Физики впервые смогли разделить воду на две разные жидкости – Москва 24, 29.05.2018
29 мая 2018, 18:00
НаукаФото: ТАСС/YAY
Швейцарские физики впервые в истории смогли разделить воду на две разных жидкости, состоящие из двух типов молекул воды с разными свойствами. Метод их производства опубликован в журнале Nature Communications.
«Мы показали, что реакции с участием пара-воды идут на 25 процентов быстрее, чем с орто-водой, что связано с тем, как спин ядра атомов водорода влияет на вращение всей молекулы», – заявил Штефан Виллич из университета Базеля. По его словам, это позволит раскрыть механизмы, управляющие ходом реакций.
Пространственная структура и некоторые физические свойства молекул воды зависят от спина атомов водорода. Если этот показатель одинаков у обоих атомов, то молекула называется пара-водой, если они противоположны – орто-водой. Полный перечень различий между ними не известен, в 2002 году российские физики показали, что орто-вода хуже конденсируется, чем пара-вода.
Если этот показатель одинаков у обоих атомов, то молекула называется пара-водой, если они противоположны – орто-водой. Полный перечень различий между ними не известен, в 2002 году российские физики показали, что орто-вода хуже конденсируется, чем пара-вода.
Прямое превращение одной формы воды в другую запрещено законами квантовой механики. В любом стакане этой жидкости присутствуют оба типа молекул. Первые опыты показали, что разделить их было невозможно, поскольку иногда взаимодействие между группами заставляют их менять спин атомов водорода.
Решить проблему удалось после охлаждения воды до температуры, близкой к абсолютному нулю. Молекулы пара- и орто-воды сами разделились на два лагеря, не соприкасающихся друг с другом.
Для этого воду превратили в разреженный пар, который не застывает даже при сверхнизких температурах, а затем пропустили через мощный генератор электростатических полей. Так были получены два узких потока молекул, один из которых содержал в себе только пара-воду, а второй – только орто-воду.
Затем потоки столкнулись с облаком другого газа из ионов кальция и диазенилия. Последний взаимодействует с водой даже при сверхнизких температурах, отдавая ей «лишний» водород. Он стал одним из первых «межзвездных» химических соединений, открытых астрономами в космосе в последние 50 лет.
Облако и потоки воды подвергли воздействию ультрафиолета, наблюдая за взаимодействием влаги с диазенилием. Так ученые раскрыли несколько интересных свойств пара- и орто-воды. Первая вступала в реакции быстрее и активнее, что говорит о существенных различиях в их поведении и в других химических взаимодействиях.
Исследователи намерены продолжать эксперименты с чистыми формами воды, чтобы выяснить их свойства. Ученых также интересует ответ на вопрос, почему пропорции пара- и орто-воды на Земле отличаются от тех значений, которые были вычислены для других звездных систем. Эти сведения могут уточнить существующую картину формирования планеты и зарождения жизни.
Ранее японские ученые выяснили, что вязкость воды зависит от ее микроскопических структур. Наибольшую плотность они отметили у жидкости при температуре в четыре градуса Цельсия. Это в свою очередь сказывается на отклонении от норм физических свойств. Исследователи полагают открытие поможет разработчикам очистительных фильтров.
Наибольшую плотность они отметили у жидкости при температуре в четыре градуса Цельсия. Это в свою очередь сказывается на отклонении от норм физических свойств. Исследователи полагают открытие поможет разработчикам очистительных фильтров.
наука
Ещё больше новостей — в телеграм-канале Москва 24 Подписывайтесь!
Новости СМИ2
Вода (молекула) — Простая англоязычная Википедия, свободная энциклопедия
Переключить оглавлениеИз простой английской Википедии, бесплатной энциклопедии
| Вода (H 2 O) | |
|---|---|
| Общие | |
| Систематическое название | Вода |
| Другие наименования | Аква Оксид водорода Гидроксид водорода Гидрат Оксидан Соляная кислота Монооксид дигидрогена Кислота гидроксоводородная μ -Оксидодигидроген |
| Молекулярная формула | HOH или H 2 O |
| Молярная масса | 18,01524 г·моль −1 |
| Внешний вид | прозрачная, почти бесцветная жидкость с легким оттенком синего [1] |
| Номер CAS | [7732-18-5] |
см. также также | Вода (страница данных) |
| Недвижимость | |
| Плотность и фаза | 1000 кг·м −3 , жидкость (4 °C) 917 кг·м −3 , твердое |
| Температура плавления | 0 °C, 32 °F (273,15 K) [2] |
| Температура кипения | 100 °C, 212 °F (373,15 K) [2] |
| Тройная точка | 273,16 К, 611,73 Па |
| Критическая точка | 647 К, 22,1 МПа |
| Удельная теплоемкость Производительность (газ) | c p =1970 Дж·кг −1 ·K −1 @ 300 K c v =1510 Дж·кг 90 054 −1 ·К −1 при 300 К [3] |
| Удельная теплоемкость емкость (жидкость) | 4186 Дж·кг −1 ·К −1 |
| Удельная теплоемкость | 2060 Дж·кг −1 ·K −1 |
| Кислотность (p K a ) | 15,74 |
| Основность (p K b ) | 15,74 |
| Вязкость | 0,001 Па·с при 20 °C |
| Поверхностное натяжение при 20 °C | 7,28 Н·м −1 |
| Структура | |
| Молекулярная форма | нелинейный изгиб |
| Кристаллическая структура | Шестигранник См.  |
| Дипольный момент | 1,85 Д |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности |
| Основные опасности | Утопление |
| NFPA 704 |
|
| Номер РТЭКС | ЗК0110000 |
| Страница дополнительных данных | |
| Структура и свойства | n , ε r и т.д. |
| Термодинамические данные | Фазовое поведение |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Родственные растворители | ацетон метанол |
| Родственные соединения | водяной пар лед тяжелая вода |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) Отказ от ответственности и ссылки на Infobox | |
Вода (H 2 O, HOH) покрывает 70-75% поверхности Земли в жидком и твердом (лед) состояниях и присутствует в атмосфере в виде пара.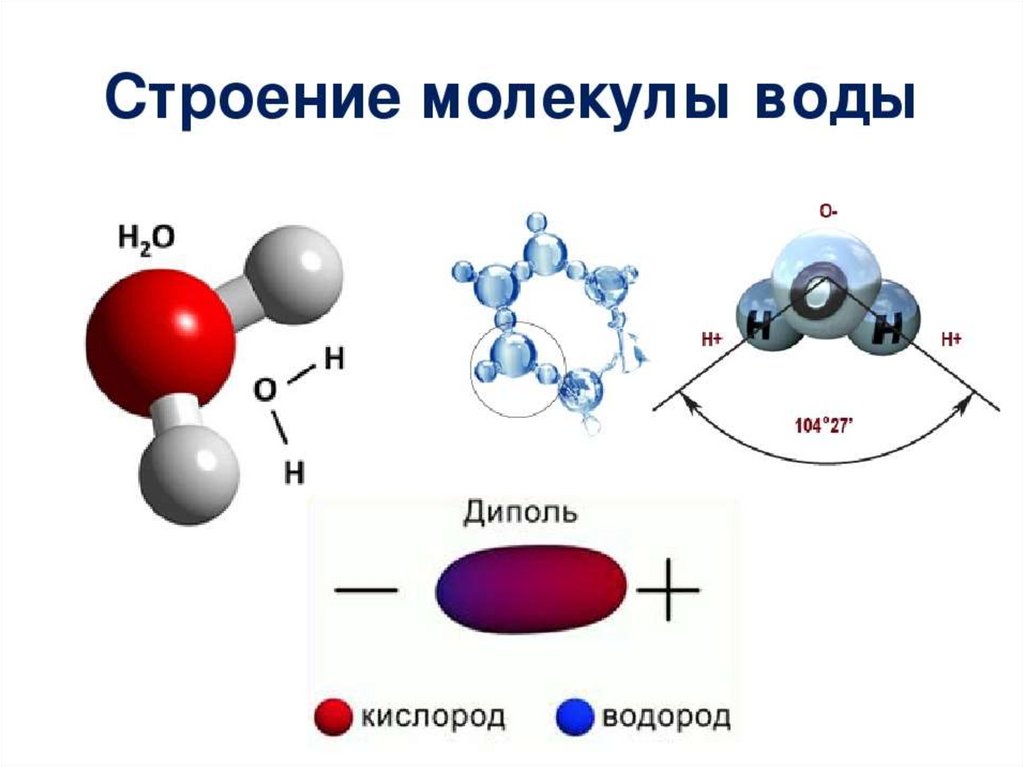
При комнатной температуре это почти бесцветная жидкость без вкуса и запаха. Многие вещества растворяются в воде, и ее обычно считают универсальным растворителем ; из-за этого вода в природе и в употреблении редко бывает чистой и может иметь некоторые свойства, отличные от лабораторных. Но есть много соединений, которые практически, если не полностью, нерастворимы в воде. Вода — единственное обычное чистое вещество, встречающееся в природе во всех трех агрегатных состояниях. О других веществах см. Химические свойства.
Чистая вода не имеет вкуса. Это другие химические вещества в воде, которые могут придать воде вкус.
Как правило, объем жидкости увеличивается при нагревании, однако объем воды уменьшается при нагревании в диапазоне температур от 0°C до 4°C. Его объем увеличивается только при нагревании выше 4°С. Такое поведение является одним из ряда аномальных свойств воды.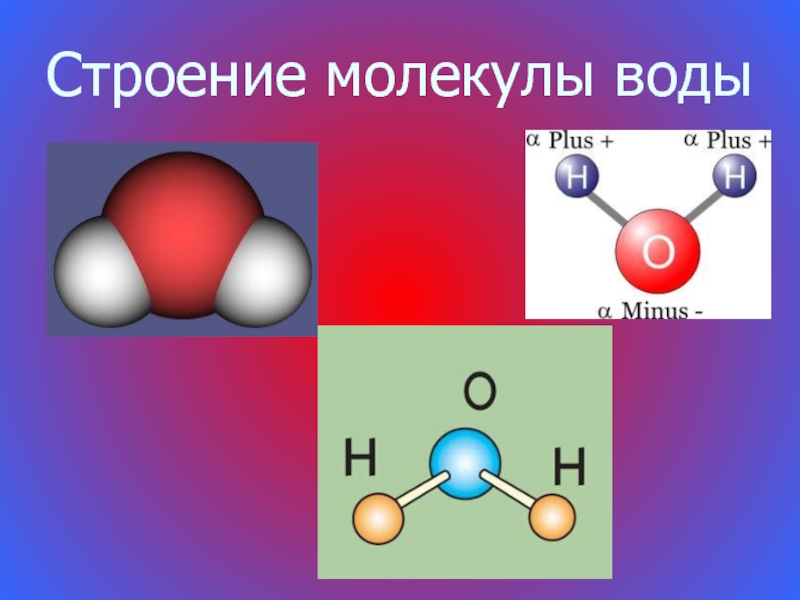
Это свойство уменьшения объема позволяет рыбам и другим водным животным выживать в водоеме, когда на его поверхности намерзает лед. В холодном климате, когда температура водоема достигает 4°С, верхние слои воды, соприкасающиеся с холодным воздухом, продолжают терять тепловую энергию, и их температура падает ниже 4°С. При охлаждении ниже 4°С эти слои поднимаются, а не опускаются, так как вода имеет максимальную плотность при 4°С. Таким образом, на дне остается слой воды с температурой 4°С, а выше образуются слои воды 3°С, 2°С, 1°С и 0°С. Поскольку лед является плохим проводником тепла, он не позволяет передавать тепловую энергию от жидкой воды под слои льда, что предотвращает замерзание жидкой воды. Следовательно, водные существа выживают в таких местах.
- ↑ Браун К.Л. и Смитнов С.Н. 1993. Почему вода голубая? J. Chem Ed . 70 , 612. [1] Архивировано 25 мая 2019 г. в Wayback Machine.
- ↑ 2,0 2,1 Вен Стандартная средняя вода в океане (VSMOW), используется для калибровки, расплавляет при 273,1500089 (10) K (0,000089 (10) ° C и кипят при 373,1339 K (99,9839 ° C).

- ↑ Serway, Raymond A. Физика для ученых и инженеров , 3-е издание
- ↑ Химия воды [2] Архивировано 21 октября 2011 г. в Wayback Machine.
- Структура и поведение воды Комплексный и актуальный ресурс NPOV, поддерживаемый профессором Мартином Чаплином из Университета Саут-Бэнк, Великобритания
- Поддельный сайт о «опасности» монооксида дигидрогена
- Стокгольмский международный институт водных ресурсов (SIWI)
- Объяснение аномальных свойств воды
- Computational Chemistry Wiki Архивировано 27 сентября 2007 г. в Wayback Machine
Обман окиси дигидрогена включает в себя перечисление негативных эффектов воды с использованием незнакомого научного названия, а затем просьбу людей помочь контролировать это, казалось бы, опасное вещество. Обман был, по-видимому, создан Эриком Лехнером, Ларсом Норпхеном и Мэтью Кауфманом, соседями по дому во время учебы в Калифорнийском университете в Санта-Круз в 1989 году, переработан Крейгом Джексоном в 1994 году и привлек внимание широкой общественности в 1997 году, когда Натан Зонер, 14-летний… старый студент собрал петиции о запрете «DHMO» в качестве основы своего научного проекта под названием «Насколько мы доверчивы?» [1] Дополнительные рекомендуемые знания
Исходный внешний вид в ИнтернетеПервая веб-публикация Крейга Джексона включала следующее: Монооксид дигидрогена: Первоначальная веб-страница больше недоступна, но она была скопирована Интернет-архивом: Запрет монооксида дигидрогена! Терминология «Монооксид дигидрогена» может показаться опасным для тех, кто плохо разбирается в химии или придерживается идеала «безхимической» жизни. Молекула воды имеет химическую формулу H 2 O, что означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Буквально термин «моноксид дигидрогена» означает «два водорода, один кислород» в соответствии с его молекулярной формулой: префикс ди в диводород означает «два», приставка моно в монооксид означает «один», а оксид представляет собой соединение, содержащее один или несколько атомов кислорода. Использование цифровых префиксов является типичной номенклатурой для соединений, образованных ковалентными связями, которые присутствуют в воде. Префикс для первого названного элемента часто опускается, если участвующие элементы обычно образуют только одно соединение или даже если число атомов первого названного элемента одинаково во всех соединениях двух (или более) элементов. Префикс моно- часто опускается для второго элемента, если он является единственным общим соединением, которое образуют элементы. Таким образом, обращение к H 2 S как к моносульфиду водорода встречается гораздо реже, чем название сероводород. Однако, поскольку углерод и кислород могут образовывать несколько соединений (окись углерода, двуокись углерода, двуокись углерода и двуокись углерода), префикс моно- сохраняется, как и в случае с окисью кремния и двуокисью кремния. Действительно, водород и кислород образуют другое общее соединение, H 2 О 2 . Используя префиксную номенклатуру, это соединение можно было бы назвать диоксидом водорода, также известным как перекись водорода. Вода имеет обычное научное или систематическое название оксид водорода , а также щелочное название гидроксид водорода и несколько названий кислот, таких как гидроксидная кислота , гидроксильная кислота и гидроксильная кислота . Между прочим, термин «гидроксикислота», использованный в оригинальном розыгрыше, немного неверен, так как не соответствует общепринятому. Для этого соединения были разработаны дополнительные названия μ-оксидодигидрогена и оксидана. Вода не является систематическим химическим названием в рамках какой-либо признанной номенклатуры и не является международным. Это также не термин, обычно используемый для твердых или газообразных форм. Согласно редакции номенклатуры неорганической химии ИЮПАК 2005 г., для каждого соединения не существует единого правильного названия. [2] Основная функция химической номенклатуры состоит в том, чтобы у человека, который слышит или читает химическое название, не было двусмысленности относительно того, к какому химическому соединению оно относится: каждое название должно относиться к одному веществу. Общественные усилия с участием DHMO
|



 Обман призван проиллюстрировать, как отсутствие научных знаний и преувеличенный анализ могут привести к неуместным страхам. Монооксид дигидрогена, сокращенно до DHMO, — это научное название воды, которое, хотя технически правильно, почти никогда не используется.
Обман призван проиллюстрировать, как отсутствие научных знаний и преувеличенный анализ могут привести к неуместным страхам. Монооксид дигидрогена, сокращенно до DHMO, — это научное название воды, которое, хотя технически правильно, почти никогда не используется.
 Термин монооксид имеет отрицательный оттенок из-за того, что он является частью названия высокотоксичного монооксида углерода.
Термин монооксид имеет отрицательный оттенок из-за того, что он является частью названия высокотоксичного монооксида углерода. Таким образом, Н 2 S часто называют просто сероводородом, а оксид лития является общим названием для Li 2 O. Однако названия дигидрогенсульфид, оксид дилития и монооксид дилития также широко используются как в промышленности, так и в университетах.
Таким образом, Н 2 S часто называют просто сероводородом, а оксид лития является общим названием для Li 2 O. Однако названия дигидрогенсульфид, оксид дилития и монооксид дилития также широко используются как в промышленности, так и в университетах. Таким образом, сохранение монооксида дигидрогена позволяет отличить его от другого соединения.
Таким образом, сохранение монооксида дигидрогена позволяет отличить его от другого соединения. Считается менее важным обеспечить, чтобы каждое вещество имело одно название, хотя количество допустимых названий ограничено. [2] Вода — одно из допустимых названий этого соединения.
Считается менее важным обеспечить, чтобы каждое вещество имело одно название, хотя количество допустимых названий ограничено. [2] Вода — одно из допустимых названий этого соединения.

 Помощник юриста попросил городской совет включить это в повестку дня; позже он объяснил это плохим исследованием. [6] Закон был снят с повестки дня еще до того, как он был поставлен на голосование, но не раньше, чем город получил массу негативных отзывов. [1]
Помощник юриста попросил городской совет включить это в повестку дня; позже он объяснил это плохим исследованием. [6] Закон был снят с повестки дня еще до того, как он был поставлен на голосование, но не раньше, чем город получил массу негативных отзывов. [1]