1.7. Как нарисовать молекулу . Удивительный мир органической химии
Можно ли нарисовать молекулу на бумаге? Такой вопрос задавали химики еще в середине XIX в. Они пытались это сделать, но такие попытки, конечно, были безуспешными.
Теперь нам понятны причины этих неудач. Для того чтобы изобразить молекулу на листке бумаги, необходимо было знать строение органических веществ.
Для решения этой проблемы много сделали химики, развивая учение о валентности химических элементов. Напомним, что валентность химического элемента — это свойство его атомов присоединять определенное число атомов других элементов. Поскольку углерод является основой всех органических соединений, то установление его четырехвалентности было важным моментом для объяснения строения этих веществ. Как известно, идеи о четырехвалентности атома углерода высказал А. Купер еще в 1858 г. При этом он считал, что углеродные атомы могут соединяться друг с другом (правда, эта мысль была уже не новой; ее высказал Фридрих Рохледер еще в 1852 г.
Однако эмпирические формулы, показывающие, какие элементы и в каком количестве входят в состав органического вещества, мало говорят о его строении. Для этого нужны другие формулы — формулы строения. Такие формулы называют структурными формулами.
Для этого нужны другие формулы — формулы строения. Такие формулы называют структурными формулами.
Согласно представлениям А. Кекуле, А. Купера и А. М. Бутлерова, углеродные атомы могут соединяться друг с другом с помощью одной или нескольких из четырех своих валентных связей, образуя длинные углеродные цепи — прямые или разветвленные. Поскольку у каждого атома углерода имеются четыре валентные связи, а у каждого атома водорода — только одна такая связь, можно изобразить три формулы простейших предельных углеводородов — метана СН
В молекуле метана атомы водорода связаны с атомом углерода, а не друг с другом. Это и понятно. Если допустить, что водородные атомы соединены не с углеродным атомом, а между собой, то тогда они, исчерпав на это по единственной валентности, не смогли бы соединиться с атомом углерода. В результате образовались бы две молекулы водорода, а не молекула метана.
Такие структуры соответствуют молекуле метана и частице, у которой атом углерода имеет две свободные валентности, но такая частица будет очень неустойчивой. Значит, существует другая возможность соединения атомов в молекуле этана: два углеродных атома соединены между собой, а с ними атомы водорода. Такой же порядок соединения атомов мы видим в молекуле пропана и в других углеводородах.
Увеличивая число атомов углерода, можно продолжить вывод формул следующих за пропаном углеводородов — бутана (С4Н10), пентана (С5Н12), гексана (С6Н14) и т. д.
Если добавить к углеводородной цепи атом кислорода (имеющего две валентные связи) или атом азота (с тремя валентными связями), то можно написать структурные формулы молекул этилового спирта (С2Н5ОН) и метиламина (CH3NH2):
Структурные формулы, как вы видите, наглядно показывают последовательность соединения между собой атомов в молекуле.
Если же в молекулах органических соединений содержатся двойные или тройные связи, то их изображают так:
Как видите, простая (одинарная) связь изображается одной черточкой, двойная — двумя, а тройная — тремя. Число черточек у элемента соответствует его валентности. Обычно структурные формулы записывают в более сокращенном виде, например:
Если же изображают циклические соединения, то в их формулах символы атомов углерода и водорода можно не обозначать, но их присутствие обязательно подразумевается:
Полезность структурных формул была настолько очевидной, что многие химики приняли их сразу. Они стали отказываться от изображения органических молекул в виде нагромождений из радикалов. Сам А. М. Бутлеров широко использовал структурные формулы в своей работе. Более того, начиная с 60-х гг. XIX в. он убедительно показывал, как с помощью структурных формул можно наглядно объяснить причины существования изомеров.
В то же время нельзя забывать и о том, что любая, даже очень удачная структурная формула — всего лишь абстрактный образ молекулы. Она не является точным отображением реальной структуры и конечно же не может выразить полностью свойства органической молекулы. Формула лишь показывает расположение атомов в молекуле. Это означает, что нельзя отождествлять символ молекулы — формулу — с ее реальной «фотографией».
Как нарисовать молекулу
Меню программы:
Основные кнопки управления:
Слева направо: построить молекулу, выделить, вращение молекулы, вращение по кругу, перемещение, выбор, увеличение и уменьшение, еще вариант перемещения.
Как нарисовать молекулу?
В левом верхнем
углу выбираем первый курсор
,
в меню выбираем углерод и рисуем «основу»(без
водородов) нашего соединения. Щелчком
мыши «ставим» атом, нажатием на него
«протягиваем» связь.
Если необходимо добавить еще какой-либо атом, которого нет верхнем меню, заходим в BUILT—DEFAULT ELEMENT и выбираем необходимый элемент в таблице.
Когда нарисовали все, КРОМЕ водородов, заходим в меню BUILT –ADD HYDROGEN. Также можно нажать кнопку (для более новых версий). Не забудьте проверить, правильно ли добавились водороды! При необходимости – скорректируйте результат.
Теперь необходимо получить изображение молекулы для того, чтобы представить ее в отчете. Ниже описаны опции, которые помогут настроить его под ваши запросы.
Чтобы отобразить символы атомом, заходим в меню DISPLAY—LABELS
Также в меню DISPLAY —RENDERINGS Можно выбрать модель атома(линии, шарики), поварьировать параметры отображения и т.д. Фон экрана меняется в меню FILE—PREFERENCES
Теперь
можно переходить к самому расчету.
Первое, что необходиом сделать – провести
«двойную» оптимизацию геометрии.
!!!В меню file –startlog начинаем запись файла *.log, в котором будет записана вся информация о расчете!!!
В меню setup выбираете molecular mechanics и MM+, нажимаете ОК.
Затем compute-geometry optimization-OK. При сравнительно небольших молекулах число циклов можно не менять, оставив значение по умолчанию, которое предлагает программа.
При окончании расчета внизу должна появиться подобная запись
Если написано NO, это значит, что сходимость в энергии не достигнута, т.е. необходимо запустить оптимизацию еше раз, пока не будет достигнута сходимость(converged=YES).
В
меню display-labels можно длину связи (bond
length),
после выбора закрываете окно и у вас на
соединении отображаются эти величины. Их нужно переписать или сделать скрин
картинки, чтобы потом вставить в отчет!
Их нужно переписать или сделать скрин
картинки, чтобы потом вставить в отчет!
Повторяем оптимизацию, только выбираем semi emperical в меню setup(метод AM1, MNDO и др.) и также compute – geometry optimization, при необходимости увеличивая число циклов для расчета.
Вот что получается по окончанию(успешному) оптимизации:
В меню DISPLAY-LABELS по очереди выбираете заряд(charge) и длину связи (bond length), после выбора закрываете окно и у вас на соединении отображаются эти величины. Их нужно переписать или сделать скрин картинки.
Теперь переходим к построению МО. В меню compute—orbitals появляется следующее окошко. Вводя номер ВЗМО и НСМО(по очереди) можно посмотреть их энергию, а нажав кнопку plot —ОК можно построить изображение МО на вашей молекуле. Если видно плохо, поменяйте RENDERINGS или нажмите F4 и выбирете парметры для 3d-графика(wire mesh и contour value).
Последовательно
сохраняем диаграмму МО, а также изображения
МО(ВЗМО И НСМО) на флешку/диск для
последующего отчета.
*При расчете номера ВЗМО и НСМО нужно помнить, что полуэмперические методы учитывают ТОЛЬКО валентные электроны!
Теперь можно остановить запись log-файла(file-stop log)
Например, получается вот так:
В вашем log-файле, как и в работе 1 есть информация об энергиях всех орбиталей!
Последнее, что необходимо сделать – это построить электростатический потенциал соединения для оценки его реакционной способности. Идем в compute-plot molecular graphs и выбираем следующие параметры:
Помните, что нажав F4 можно отрегулировать изображение: выбрать тип поверхности, шаг и т.д. Если у вас есть сильный ЭО заместитель, а потенциал весь положительный, это значит, что значение контура поверхности слишком большое. Можно попробовать его уменьшить и посмотреть, что получается. Например:
Что должно быть в отчете:
Сама молекула
Заряды и длины связей ПОСЛЕ оптимизации по методу ММ
Заряды и длины связей после оптимизации по методу AM1
Полные энергии после оптимизации по методу MM и AM1
Орбитали(ВЗМО и НСМО), их энергии и изображение
Графическое распределение электростатического потенциала
Не забудьте сохранить себе log-файл
1.
 4. Представляющие структуры | Органическая химия 1: Открытый учебник Химические структуры являются важными строительными блоками в органической химии. Они составляют «слова» каждого предложения по органической химии, поэтому очень важно понимать, как читать и писать структуры. Химические структуры обычно представляются скелетной формулой, которая обеспечивает графическое представление молекулы, в которой для ясности опущено большинство атомов водорода. Полные структуры Льюиса используются редко, когда требуется более полный рисунок, потому что их часто труднее читать, чем скелетные структуры. Иногда структуры должны быть представлены другими способами, такими как имя или другой идентификатор. Рис. 1 иллюстрирует некоторые из наиболее распространенных представлений соединения под названием 1-бромбутан. Рис. 1: Представления 1-бромбутана: скелетная структура, структура типа Льюиса, строка InChI, InChIKey, SMILES [1] и регистрационный номер CAS. [2] Здесь вы научитесь понимать, писать и рисовать органические молекулы.
4. Представляющие структуры | Органическая химия 1: Открытый учебник Химические структуры являются важными строительными блоками в органической химии. Они составляют «слова» каждого предложения по органической химии, поэтому очень важно понимать, как читать и писать структуры. Химические структуры обычно представляются скелетной формулой, которая обеспечивает графическое представление молекулы, в которой для ясности опущено большинство атомов водорода. Полные структуры Льюиса используются редко, когда требуется более полный рисунок, потому что их часто труднее читать, чем скелетные структуры. Иногда структуры должны быть представлены другими способами, такими как имя или другой идентификатор. Рис. 1 иллюстрирует некоторые из наиболее распространенных представлений соединения под названием 1-бромбутан. Рис. 1: Представления 1-бромбутана: скелетная структура, структура типа Льюиса, строка InChI, InChIKey, SMILES [1] и регистрационный номер CAS. [2] Здесь вы научитесь понимать, писать и рисовать органические молекулы. Почему были разработаны различные техники рисования? Органические молекулы могут стать сложными и большими. Постоянно вытягивать каждую деталь, особенно когда в этом нет необходимости, утомительно, поэтому химики-органики разработали способы сделать это более удобным и простым. Кроме того, некоторые из этих сокращенных способов рисования молекул дают нам представление об углах связи, относительном положении атомов в молекуле, а некоторые устраняют многочисленные атомы водорода, которые могут мешать смотреть на основу структуры.
Почему были разработаны различные техники рисования? Органические молекулы могут стать сложными и большими. Постоянно вытягивать каждую деталь, особенно когда в этом нет необходимости, утомительно, поэтому химики-органики разработали способы сделать это более удобным и простым. Кроме того, некоторые из этих сокращенных способов рисования молекул дают нам представление об углах связи, относительном положении атомов в молекуле, а некоторые устраняют многочисленные атомы водорода, которые могут мешать смотреть на основу структуры.Знакомство со структурным чертежом
Обратите внимание на следующие рисунки структуры ретинола, наиболее распространенной формы витамина А. Первый рисунок соответствует структуре на основе Льюиса, что полезно, когда вы хотите рассмотреть каждый отдельный атом; однако отображение всех атомов водорода затрудняет сравнение общей структуры с другими подобными молекулами и затрудняет сосредоточение внимания на двойных связях и группе ОН.
Ретинол: прямолинейный рисунок Льюиса
Ниже приведена скелетная формула (также известная как линия-угол) для ретинола.![]() В этом упрощенном представлении можно легко увидеть углерод-углеродные связи, двойные связи, группу ОН и группы CH 3 , торчащие из основного кольца и цепи. Кроме того, это намного быстрее нарисовать, чем тот, что выше.
В этом упрощенном представлении можно легко увидеть углерод-углеродные связи, двойные связи, группу ОН и группы CH 3 , торчащие из основного кольца и цепи. Кроме того, это намного быстрее нарисовать, чем тот, что выше.
Ретинол: формула скелета
Важность структуры
Изучение и применение на практике основ органической химии очень поможет вам в долгосрочной перспективе, когда вы будете изучать новые концепции и реакции. Некоторые люди говорят, что органическая химия похожа на другой язык, и в некоторых аспектах это так. Сначала это может показаться трудным или непосильным, но чем больше вы будете практиковаться в рассмотрении и рисовании органических молекул, тем лучше вы будете знакомиться со структурами и формулами. Еще одна хорошая идея — приобрести комплект моделей и физически создать молекулы, которые вам сложно представить в голове.
Изучая общую химию, вы, возможно, уже изучали молекулярную структуру. Различные способы рисования органических молекул включают типа Льюиса , сокращенных формул и скелетных формул . Будет полезнее, если вам будет удобно переходить от одного стиля рисования к другому, смотреть на рисунки и понимать, что они означают, чем знать, какой вид рисунка как называется.
Будет полезнее, если вам будет удобно переходить от одного стиля рисования к другому, смотреть на рисунки и понимать, что они означают, чем знать, какой вид рисунка как называется.
Примером рисунка, который включает в себя все три способа рисования органических молекул, может быть следующий дополнительный рисунок ретинола. В большинстве рисунков используется скелетная формула, но -CH 3 записываются в виде сокращенных формул, а группа -ОН записывается в форме типа Льюиса.
Рисование структуры органических молекул
Хотя более крупные молекулы могут показаться сложными, их можно легко понять, разбив их на части и рассмотрев более мелкие компоненты.
Все атомы хотят, чтобы их валентная оболочка была полной, «закрытой оболочкой». Водород имеет полную оболочку только с 2 e – , тогда как углерод, кислород и азот хотят иметь 8 e – («октет»). Рассматривая различные представления молекул, помните о правиле октетов. Также помните, что водород может связать один раз, кислород может связать до двух раз, азот может связать до трех раз, а углерод может связать до четырех раз.
Тип Льюиса
Структуры типа Льюиса аналогичны традиционным структурам Льюиса, но вместо ковалентных связей, представленных электронными точками, два общих электрона показаны линией.
(А)
(B)
(C)
Неподеленные пары остаются в виде двух электронных точек, но обычно их не учитывают, даже если они все еще существуют . Обратите внимание, что три неподеленные пары электронов не были втянуты вокруг хлора в примере B.
Сокращенные формулы
Сокращенная формула состоит из элементарных символов. Порядок атомов предполагает связность. Сокращенные формулы можно читать в любом направлении, а H 3 C совпадает с CH 3 9.0016 , хотя последнее более распространено, потому что посмотрите на примеры ниже и сопоставьте их с их идентичной молекулой по структурам Кекуле и формулам линий связи.
(A) CH 3 CH 2 OH (B) ClCH 2 CH 2 CH(OCH 3 )CH 3 (C) H 3 CNHCH 2 COOH
Давайте внимательно посмотрим на пример B.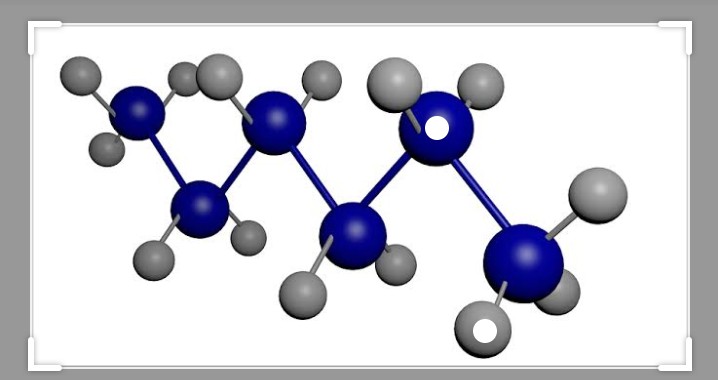 Когда вы работаете с сокращенной формулой, вы хотите сосредоточиться на углероде и других элементах, которые не являются водородом. Водороды важны, но обычно они используются для завершения октетов. Также обратите внимание на -OCH 3 написано в скобках, что говорит вам, что это не часть основной цепи атомов углерода. Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи. В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что в последней структуре углерод не имеет полного октета и кислорода.
Когда вы работаете с сокращенной формулой, вы хотите сосредоточиться на углероде и других элементах, которые не являются водородом. Водороды важны, но обычно они используются для завершения октетов. Также обратите внимание на -OCH 3 написано в скобках, что говорит вам, что это не часть основной цепи атомов углерода. Когда вы читаете сокращенную формулу, если вы достигаете атома, который не имеет полного октета к тому времени, когда вы достигаете следующего водорода, то, возможно, существуют двойные или тройные связи. В примере C углерод имеет двойную связь с кислородом и одинарную связь с другим кислородом. Обратите внимание, что COOH означает C(=O)-OH вместо CH 3 -C-O-O-H, потому что в последней структуре углерод не имеет полного октета и кислорода.
Скелетные формулы
Из-за типичных (более стабильных) связей, которые атомы склонны образовывать в молекулах, скелетные цепи часто выглядят как зигзагообразные линии. Если вы работаете с набором молекулярных моделей, вам будет трудно собрать прямые молекулы (если только они не содержат sp-тройные связи), тогда как зигзагообразные молекулы и связи гораздо более осуществимы.![]()
(A)
(B)
(C)
Эти молекулы соответствуют точно таким же молекулам, которые изображены для структур типа Льюиса и сокращенных формул. Обратите внимание, что углероды больше не нарисованы и заменены концами и изгибами линий. Кроме того, водороды были опущены, но их можно было легко втянуть (см. Практические задачи). Хотя мы обычно не рисуем Н, которые связаны с углеродом, мы рисуем их, если они связаны с другими атомами, кроме углерода (примером является группа ОН выше в примере А). Это делается потому, что не всегда ясно, окружен ли неуглеродный атом неподеленными парами или атомами водорода. Также в примере A обратите внимание, как ОН нарисован со связью со вторым углеродом, но это не означает, что на конце этой связи/линии есть третий углерод.
Задачи
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Сколько атомов углерода на следующем рисунке? Сколько водородов?
- Посмотрите на следующую молекулу витамина А и нарисуйте скрытые атомы водорода и пары электронов.

(Подсказка: все ли атомы углерода имеют 4 связи? Все атомы кислорода имеют полный октет?) - Сколько связей может образовывать водород?
- Сколько связей может образовывать хлор?
- Пунктирные линии означают, что атомная связь идет ___________(от/к) вас.
- Draw ClCH 2 CH 2 CH(OCH 3 )CH 3 в форме Льюиса и скелета.
Показать ответ
Дополнительная литература
Сообщение химической структуры с помощью формул и названий
Ссылки
[1] http://www.chemspider.com/Chemical-Structure.7711.html?rid=b8719dd4-7de2-4140-aebf-afb809c26dab
[2] http://www.commonchemistry.org/ChemicalDetail.aspx?ref=109-65-9
3. Фоллхардт, К. Питер С. и Нил Э. Шор. Органическая химия: структура и функции . 5-е изд. Нью-Йорк: Компания WH Freeman, 2007. 38–40.
4. Кляйн, Дэвид Р. Органическая химия I как второй язык .![]() 2-е изд. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2007. 1–14.
2-е изд. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2007. 1–14.
Внешние ссылки
- Стереохимия: http://en.wikipedia.org/wiki/Stereochemistry
- Ретинол: http://en.wikipedia.org/wiki/Ретинол Правило октета
- : http://en.wikipedia.org/wiki/Octet_rule
- Структуры Льюиса: http://chemwiki.ucdavis.edu/index.php?title=Wikitexts/UCD_Chem_118A/ChemWiki_Module_Topics_for_Chem_118B/Lewis_Structures&highlight=lewis+structures Гибридные орбитали
- sp: http://chemwiki.ucdavis.edu/index.php?title=Wikitexts/UCD_Chem_118A/ChemWiki_Module_Topics_for_Chem_118B/Hybrid_Orbitals&highlight=sp
- Для рисования органических молекул на компьютере: https://www.chemdoodle.com/
Название IUPAC
Традиционно химическое название было необходимо, когда требовалось неграфическое представление, например, в химическом каталоге или справочнике. В законе химическое вещество часто по-прежнему представлено названием, а не структурой. В результате был разработан набор правил, позволяющих снабдить любую структуру систематическим именем. Эти правила были одобрены руководящим органом химии, Международным союзом теоретической и прикладной химии (IUPAC), и в настоящее время хорошо известны в публикациях по химии. Это гарантирует, что когда химики передают информацию через текст, они могут быть уверены, что имеют в виду одну и ту же химическую структуру. Основные правила номенклатуры можно найти в Интернете в Синей книге ИЮПАК [2] и в любом современном учебнике по органической химии.
В результате был разработан набор правил, позволяющих снабдить любую структуру систематическим именем. Эти правила были одобрены руководящим органом химии, Международным союзом теоретической и прикладной химии (IUPAC), и в настоящее время хорошо известны в публикациях по химии. Это гарантирует, что когда химики передают информацию через текст, они могут быть уверены, что имеют в виду одну и ту же химическую структуру. Основные правила номенклатуры можно найти в Интернете в Синей книге ИЮПАК [2] и в любом современном учебнике по органической химии.
Компьютерные идентификаторы
Когда компьютеры стали использоваться для хранения химической информации, возникла необходимость в разработке идентификаторов для химических веществ. Хотя структуры можно рисовать на компьютере, большинство структур, опубликованных в 2019 году, представляют собой просто файлы изображений, в которых химическая информация не может быть легко прочитана компьютером. Большинство программ для рисования структур позволяет пользователю сохранять структуру в виде файла Molfile, который содержит структуру в машиночитаемом табличном формате, подходящем для химических баз данных и т. д. Тем не менее, многие увидели необходимость в более лаконичном способе представления химических структур для компьютеров. в одной строке (строке символов). Их можно разделить на идентификаторы «поиска в реестре», которые фактически являются номером списка в базе данных (без внутренней химической информации), и «линейные обозначения», которые инкапсулируют структурную информацию в одну строку.
д. Тем не менее, многие увидели необходимость в более лаконичном способе представления химических структур для компьютеров. в одной строке (строке символов). Их можно разделить на идентификаторы «поиска в реестре», которые фактически являются номером списка в базе данных (без внутренней химической информации), и «линейные обозначения», которые инкапсулируют структурную информацию в одну строку.
С 1965 года Chemical Abstracts Service (CAS) выделяет идентификаторы «поиска в реестре», называемые регистрационными номерами CAS, для каждого вещества в своей базе данных.[3] Каждый номер уникален для данного вещества. Номер присваивается CAS и не содержит структурной информации в номере; как таковой, он представляет собой фактическое вещество (обычно такое, о котором сообщалось в литературе), а не структуру (которая может быть только теоретической). Регистрационные номера CAS теперь широко используются за пределами CAS в качестве идентификаторов веществ, например, в списке «Химических веществ, представляющих интерес» правительства США для национальной безопасности. [4]
[4]
Затем были разработаны другие идентификаторы на основе строковых обозначений, которые кодировали структурную информацию в идентификаторе.[5] Одним из важных таких идентификаторов является SMILES, разработанный в 1980-х годах как машиночитаемый формат, который «удобен для человека»; простые структуры могут быть легко прочитаны из строки SMILES как компьютером, так и опытным химиком.[6]
Международный химический идентификатор (InChI )
Наиболее важным структурным представлением для компьютеров является InChI, которое IUPAC также считает «официальным» представлением машин. Хотя он был впервые опубликован только в 2005 году, он быстро зарекомендовал себя как ценный способ передачи структурной информации через Интернет7. В отличие от многих идентификаторов, алгоритм InChI доступен для использования в соответствии с открытыми авторскими правами, так что его можно свободно генерировать и использовать. использоваться без риска нарушения авторских прав.![]()
Ученому не важно уметь читать или писать ИнХИ с нуля; любая программа химического рисования может легко выполнить эту задачу. Однако полезно понять, как устроена ИнХИ и как ее использовать. Рассмотрим простую структуру, такую как 2-бромбутан, которая имеет структуру и InChI, показанные ниже:
InChI представляет собой строку символов, которая использует ряд «слоев» для обозначения различных уровней структурной детализации. Таким образом, химики могут передавать информацию на соответствующем уровне детализации. Каждая InChI начинается с «InChI=», за которым следует номер версии, в данном случае это версия 1. Буква «S» указывает на то, что InChI является «стандартной» и не содержит никакой дополнительной информации. Остальная часть InChI организована слоями, где каждый уровень начинается с косой черты «/». Эти подслои показывают: химическую формулу, соединения атомов (начиная с /c) и атомы водорода (начиная с /h). Например, для 2-бромбутана имеем:
В некоторых случаях может потребоваться указать более высокий уровень детализации, например, трехмерную ориентацию атомов или стереохимию . Для этого мы используем дополнительный слой в конце, в данном случае слой стереохимии (начинающийся с /t, /m и /s), чтобы получить InChI, уникальный для данного конкретного стереоизомера:
Для этого мы используем дополнительный слой в конце, в данном случае слой стереохимии (начинающийся с /t, /m и /s), чтобы получить InChI, уникальный для данного конкретного стереоизомера:
Один из полезных аспектов этого многоуровневого структура заключается в том, что аналогичные структуры имеют аналогичные ИнКИ. Например, все изомеры с формулой C4H9Br будут начинаться с C4H9.Br в подслое химической формулы; в базе данных эти изомеры могут быть легко идентифицированы. Точно так же два стереоизомера будут иметь один и тот же основной слой и различаться только стереохимическим слоем. Многие простые органические соединения будут иметь в своих ИнХИ только основной слой.
InChI такого рода можно найти в Википедии и большинстве онлайн-баз данных по химическим веществам, таких как PubChem и ChemSpider, где он считается одним из основных типов химического идентификатора.[7] InChI можно сгенерировать из химической структуры в большинстве современных программ для рисования структур, таких как BioviaDraw, ChemDraw, ChemSketch или ChemDoodle. Эти программы позволяют и обратное — ввести ИнХИ и использовать его для создания химической структуры.
Эти программы позволяют и обратное — ввести ИнХИ и использовать его для создания химической структуры.
InChIKey
Для более крупных молекул InChIKey может стать большим и громоздким, что затрудняет его использование для определенных приложений, особенно для поиска в Интернете. Многие поисковые системы обрезают длинные строки поиска, поэтому более поздние символы теряются при поиске. По этой причине был создан InChIKey , в котором InChI (или структура) преобразуется в строку из 27 символов (включая два дефиса) на основе последовательности только заглавных букв. InChIKey чаще всего используется для поиска в Интернете. Например, полный ИнХИ для морфина: ИнХИ=1S/C17h29.NO3/c1-18-7-6-17-10-3-5-13(20)16(17)21-15-12(19)4-2-9(14(15)17)8-11( 10)18/h3-5,10-11,13,16,19-20H,6-8h3,1h4/t10-,11+,13-,16-,17-/m0/s1, тогда как InChIKey просто BQJCRHHNABKAKU-KBQPJGBKSA-N .
Это преобразование в InChIKey использует «хеш-функцию», которая шифрует код InChIKey, чтобы сгенерировать InChIKey, максимально приближенный к уникальному. Одним неприятным побочным эффектом этого является то, что однажды зашифрованная как InChIKey, структура не может быть преобразована обратно в InChI или структуру. Это, в свою очередь, означает, что структуру, закодированную в InChIKey, можно найти только путем сравнения ее со списком известных InChIKeys, известным как «таблица поиска». Если InChIKey предназначен для нового или неизвестного вещества, InChIKey не может позволить пользователю идентифицировать молекулу.
Одним неприятным побочным эффектом этого является то, что однажды зашифрованная как InChIKey, структура не может быть преобразована обратно в InChI или структуру. Это, в свою очередь, означает, что структуру, закодированную в InChIKey, можно найти только путем сравнения ее со списком известных InChIKeys, известным как «таблица поиска». Если InChIKey предназначен для нового или неизвестного вещества, InChIKey не может позволить пользователю идентифицировать молекулу.
Как и сам InChI, InChIKeys можно генерировать по желанию с помощью любой стандартной программы для построения чертежей. Копирование InChIKey в поисковую систему позволяет пользователю быстро находить в Интернете документы, относящиеся к этой конкретной структуре.
Резюме
Химические структуры могут быть представлены различными способами, такими как имена IUPAC или удобные для компьютера линейные обозначения, такие как InChI. InChI встраивает структурную информацию в серию «слоев», и ее можно преобразовать обратно в исходную структуру. Это полезно для хранения информации о химической структуре в базах данных. Между тем, InChIKey — это хешированная версия InChI, которая в основном используется для поиска химических структур в Интернете.
Это полезно для хранения информации о химической структуре в базах данных. Между тем, InChIKey — это хешированная версия InChI, которая в основном используется для поиска химических структур в Интернете.
[1] https://iupac.org/projects/project-details/?project_nr=2001-043-1-800, доступ
[2] https://www.acdlabs.com/iupac/nomenclature/
[3] https://www.cas.org/about/cas-history
[4] https://www.dhs.gov/cisa/appendix-chemicals-interest
[5] Хеллер, Стивен Р.; Макнот, Алан; Плетнев. Игорь; Штейн, Стивен; Чеховской, Дмитрий. «InChI, международный химический идентификатор IUPAC». Журнал химинформатики , 2015 , 7 :23.
[6]. Помощь Мол. Дес. , 2015 , 29 : 681
Рисование органических молекул
Рисование органических молекул необходимо для получения отличной оценки по органической химии. Часто преподаватели вычитают много баллов из студентов, которые понимают материал только потому, что их рисунки ужасны! К сожалению, этот урок может быть посвящен как искусству, так и науке, но помните, что важно не только понимать, но и свяжись чтобы ты понял! Только много практики и эти советы от StudyOrgo гарантируют, что вы получите всю необходимую подготовку для успешной сдачи следующего экзамена.
Зарегистрируйтесь в StudyOrgo сегодня, чтобы получить помощь по всем вопросам органической химии!
Двумерные линейные структуры
Простейшими чертежами в органической химии являются линейные чертежи. Общая химия часто указывала связь каждого элемента в молекуле. Химики-органики используют сложные молекулы, и время дорого. Поэтому был необходим быстрый способ извлечения углеводородов. Есть несколько правил, которые помогут вам нарисовать соответствующие структуры в органической химии.
- Нарисуйте атомы углерода в виде зигзага, где точки обозначают атомы углерода, а линии обозначают связи. Все остальные атомы, связанные с углеродом, если не указано иное, являются водородами.
- Оттяните все связи как можно дальше.
- Нанесение атомов углерода с одинарными связями в любом направлении эквивалентно.
- Никогда, никогда, никогда не присоединяйте к углероду более 4 связей!!!
Трехмерные конструкции
Штрих и клин: Часть информации, которая теряется при рисовании молекул, — это трехмерное расположение заместителей вокруг атомов углерода. Это становится очень важным при работе со стереоцентрами, которые могут иметь два возможных энантиомера. Чтобы описать это расположение, химики используют модель черточки и клина. Представьте себе, что бумага (или монитор компьютера в данном случае) является зеркальной плоскостью, тире указывает на связь ниже плоскости, а клин указывает на связь выше самолет. Глядя на приведенный ниже пример, мы видим, что стереохимия 1-хлорэтанола неоднозначна, если ее изобразить в виде линейной структуры. В виде штриха и клина становится ясно, что показанная стереоконформация представляет собой R-1-хлорэтанол.
Это становится очень важным при работе со стереоцентрами, которые могут иметь два возможных энантиомера. Чтобы описать это расположение, химики используют модель черточки и клина. Представьте себе, что бумага (или монитор компьютера в данном случае) является зеркальной плоскостью, тире указывает на связь ниже плоскости, а клин указывает на связь выше самолет. Глядя на приведенный ниже пример, мы видим, что стереохимия 1-хлорэтанола неоднозначна, если ее изобразить в виде линейной структуры. В виде штриха и клина становится ясно, что показанная стереоконформация представляет собой R-1-хлорэтанол.
Проекция Фишера: Для ациклических молекул, особенно со многими заместителями, химики будут использовать проекцию Фишера, чтобы ускорить рисование молекул. Условное обозначение изображает связи, проведенные сверху вниз, в конформации штриха, а связи, проведенные слева направо, — в конформации клина. Это легко и быстро указывает на стереохимию без громоздких жирных и пунктирных связей, как показано справа.
Это легко и быстро указывает на стереохимию без громоздких жирных и пунктирных связей, как показано справа.
Проекция Хаворта: Для циклических молекул химики используют проекцию Хаворта. Проекция изображает кольцо под углом, наполовину выше плоскости бумаги и наполовину позади плоскости бумаги. Это позволяет рисовать заместители в плоскости бумаги. Возьмем, к примеру, глюкозу, показанную ниже. Проекция Хаворта слева обычно рисуется, чтобы показать, находятся ли спиртовые группы выше или ниже (альфа- и бета-соответственно) плоскости кольца. Более подробный рисунок помещает кольцо в конформацию стула, которая указывает, находятся ли заместители в экваториальной или аксиальной форме. Это позволяет определить стереохимию каждого стереоизомера.
Проекция Ньюмена : Напомним, что даже при трехмерной конфигурации атомов существует свободное вращение вокруг sp 3 гибридизированной связи.


