Научный центр мирового уровня «Центр междисциплинарных исследований человеческого потенциала» – Национальный исследовательский университет «Высшая школа экономики»
НЦМУ «Центр междисциплинарных исследований человеческого потенциала» — это…
*по сведению на 1 января 2022 года
Ближайшие мероприятия
09 фев 16:00
Научный семинар «Ментальное здоровье населения России в период пандемии COVID-19 и социально-экономических изменений 2022 г.: уязвимые группы и способы поддержки»
26 мая 27 мая
Шестая Международная конференция пользователей данными «Российского мониторинга экономического положения и здоровья населения НИУ ВШЭ» (RLMS-HSE)
Славянская площадь, 4с2, Россия, Москва
Заявки — до 25 марта
Все мероприятия
Подписаться на анонсы
Публикации
The report «Platform Employment in Russia: Scale, Motives and Barriers to Participation»
The report «Breakthrough Innovations: Human Being 2.
 0»
0»The report «New Requirements for Human Potential: Development of Independence»
The report «Long-Term Care System: Lessons from International Experience for Russia»
The report «Social Protection in Russia Before and After the Pandemic: Future Forks»
The report «Impacts of Climate Change on Human Potential, Economy and Ecosystems»
The report «Structural Changes in Healthcare: Trends and Outlook»
The report «Higher Education Graduates in the Russian Labor Market: Trends and Challenges»
The report «Inequality in Health Care»
The report «Wage Inequality: Dynamics, Major Factors, Regional Differences, Impact of Labor Market Institutions»
The report «Inequality in Russia in comparison with other countries: income, wealth, opportunities»
The report «Subjective Stratification of Russian Society: State, Dynamics, Key Problems»
Доклад «Как и зачем измерять профессиональные навыки?»
The report “Russia’s Pension System in the Context of Long-term Challenges and National Development Goals”
The book by Sergey Malinovsky and Ekaterina Shibanova “Regional Differentiation of Higher Education Accessibility in Russia”
The book by Pavel Sorokin, Alexander Povalko and Svetlana Chernenko “Teaching entrepreneurship in Russian and World Universities: Why, How and With What Results?”
Как измерить человеческий потенциал сотрудника организации: диалог науки и практики
12.
 04.2022
04.2022
Поделитесь с друзьями
8 апреля 2022 года, в последний день академической программы XXIII Ясинской международной научной конференции по проблемам развития экономики и общества, состоялась специальная сессия НЦМУ «Центр междисциплинарных исследований человеческого потенциала» под названием «Как измерить человеческий потенциал сотрудника организации: диалог науки и практики». Мероприятие было организовано в рамках гранта, предоставленного Министерством науки и высшего образования Российской Федерации (№ соглашения о предоставлении гранта: 075-15-2020-928).
Руководитель практики «Digital Assessment» в ЭКОПСИ Юрий Шатров представил доклад «Модель оценки потенциала сотрудника организации „Potential in Focus“: разработка и валидация». Согласно статистике, 55% организаций заявляют о том, что основная проблема в оценке потенциала — недостаточная обоснованность этой практики с точки зрения науки и влияния на бизнес. Однако исследователь отмечает, что компании часто используют невалидизированные методики с плохо операционализированными конструктами или методы и методики, которые не предназначены для оценки потенциала.
Третье выступление было посвящено опыту Университета Правительства Москвы по созданию в 2020-2021 годах модели командно-управленческих ролей, которая, после успешного пилотирования, начинает активно применяться для реализации кадровых проектов. Доклад представил ректор Университета Правительства Москвы Василий Фивейский. Он отметил, что компетенции являются одним из самых популярных HR-конструктов, используемых для задач подбора персонала, оценки всех видов, развития, формирования кадрового резерва и так далее. Вместе с тем, при кажущейся простоте и логичности использования моделей корпоративных компетенций, они имеют и серьезные минусы, среди которых — слабый учет специфики работы сотрудников на различных уровнях управленческой иерархии, статичность моделей компетенций, слабое понимание языка моделей компетенций руководителями. Василий Фивейский предлагает несколько моделей и способов снижения этих негативных коннотаций и отмечает, что возможной перспективной альтернативой компетенциям могут стать ролевые модели, которые лишены многих недостатков компетенций и при этом позволяют более глубок учесть специфику конкретных профессиональных и управленческих задач, стоящих перед сотрудниками. Кроме того, ролевые модели открывают широкие возможности командной диагностики, делают значительно более понятной обратную связь и тому подобное.
Вместе с тем, при кажущейся простоте и логичности использования моделей корпоративных компетенций, они имеют и серьезные минусы, среди которых — слабый учет специфики работы сотрудников на различных уровнях управленческой иерархии, статичность моделей компетенций, слабое понимание языка моделей компетенций руководителями. Василий Фивейский предлагает несколько моделей и способов снижения этих негативных коннотаций и отмечает, что возможной перспективной альтернативой компетенциям могут стать ролевые модели, которые лишены многих недостатков компетенций и при этом позволяют более глубок учесть специфику конкретных профессиональных и управленческих задач, стоящих перед сотрудниками. Кроме того, ролевые модели открывают широкие возможности командной диагностики, делают значительно более понятной обратную связь и тому подобное.
Профессор Высшей школы бизнеса НИУ ВШЭ Вероника Кабалина и эксперт «Яндекс.Практикума» Осипова Александра представили способ оценки талантливых сотрудников для отбора их в кадровый резерв. Они провели эмпирическое исследование, которое включало в себя 45 глубинных полуструктурированных интервью с HR-специалистами из 21 отрасли (по одному респонденту из одной компании). Эмпирической базой количественного этапа исследования стали результаты оценки потенциала 1807 талантливых сотрудников, которая проводились консалтинговой компанией TalentQ Pro в 2019-2021 годах в девяти российских и пяти зарубежных компаниях. В результате исследования была сформирована новая модель потенциала талантливого сотрудника, которая содержит ряд индикаторов потенциала.
Они провели эмпирическое исследование, которое включало в себя 45 глубинных полуструктурированных интервью с HR-специалистами из 21 отрасли (по одному респонденту из одной компании). Эмпирической базой количественного этапа исследования стали результаты оценки потенциала 1807 талантливых сотрудников, которая проводились консалтинговой компанией TalentQ Pro в 2019-2021 годах в девяти российских и пяти зарубежных компаниях. В результате исследования была сформирована новая модель потенциала талантливого сотрудника, которая содержит ряд индикаторов потенциала.
Заключительный доклад сессии представили научные сотрудники Института образования НИУ ВШЭ Алена Куликова и Денис Федерякин. Их исследование было посвящено возможностям и ограничениям ипсативных данных для измерения характеристик потенциала сотрудника организации. Выступающие представили теоретическую модель инструмента — 16 рабочих ценностей, разделенных на четыре группы, каждая из которых может выступать как мотиватором (в том случае, если эта конкретная ценность значима для человека), так и демотиватором (если человек данную ценность активно отвергает). В работе Куликова и Федерякин рассматривают мотиваторы и демотиваторы как биполярные конструкты: в зависимости от структуры ценностей одни и те же факторы могут как воодушевлять и мотивировать человека, так и отвращать его от выполнения той или иной деятельности. Так, например, для людей с высокими коммуникативными способностями, навыками командной работы и выраженными экстраверсивными чертами групповые проекты будут являться предпочтительной формой деятельности, а тех, кто не обладает этим набором навыков и черт, необходимость работать в группе будет демотивировать.
В работе Куликова и Федерякин рассматривают мотиваторы и демотиваторы как биполярные конструкты: в зависимости от структуры ценностей одни и те же факторы могут как воодушевлять и мотивировать человека, так и отвращать его от выполнения той или иной деятельности. Так, например, для людей с высокими коммуникативными способностями, навыками командной работы и выраженными экстраверсивными чертами групповые проекты будут являться предпочтительной формой деятельности, а тех, кто не обладает этим набором навыков и черт, необходимость работать в группе будет демотивировать.
Анализ полученных результатов позволяет сделать вывод о том, что при изменении формата сбора данных — в частности, перехода от шкалы ликерта к ипсативному формату — происходит существенное изменение структуры опросника и процесса ответа. Утверждения, выверенные на этапе шкалы ликерта, могут начать демонстрировать неудовлетворительные психометрические характеристики в ипсативном формате. При этом, в случае обработки ипсативных опросников в классической шкале тестирования, исследователь даже не сможет получить информацию о поведении утверждений в своем опроснике. Это исследование может помочь разработчикам профессиональных и личностных тестов преодолеть определенные ограничения и барьеры, стоящие перед стандартными ныне тестами.
Это исследование может помочь разработчикам профессиональных и личностных тестов преодолеть определенные ограничения и барьеры, стоящие перед стандартными ныне тестами.
Отчет о проведении встречи с выпускницей ИОН Ярославой Николайчук
Принципы измерения электрохимического потенциала
Как возникают электрохимические потенциалы?
Напряжения и потенциалы возникают между электронным проводником (электродом) и ионным проводником (электролитом), как только они соприкасаются друг с другом. Обмен зарядами происходит до тех пор, пока система не уравновесится. Пример: если лист железа погрузить в солевой раствор меди, на железе образуется осадок меди. Если вы проведете обратный эксперимент (погрузите медный лист в солевой раствор), ничего не произойдет.
Чем эти два металла отличаются друг от друга?
Равновесие между металлом и жидкостью возникает при их контакте. Ионы металлов растворяются из решетки металла, погруженного в жидкость собственных ионов или ионов других металлов.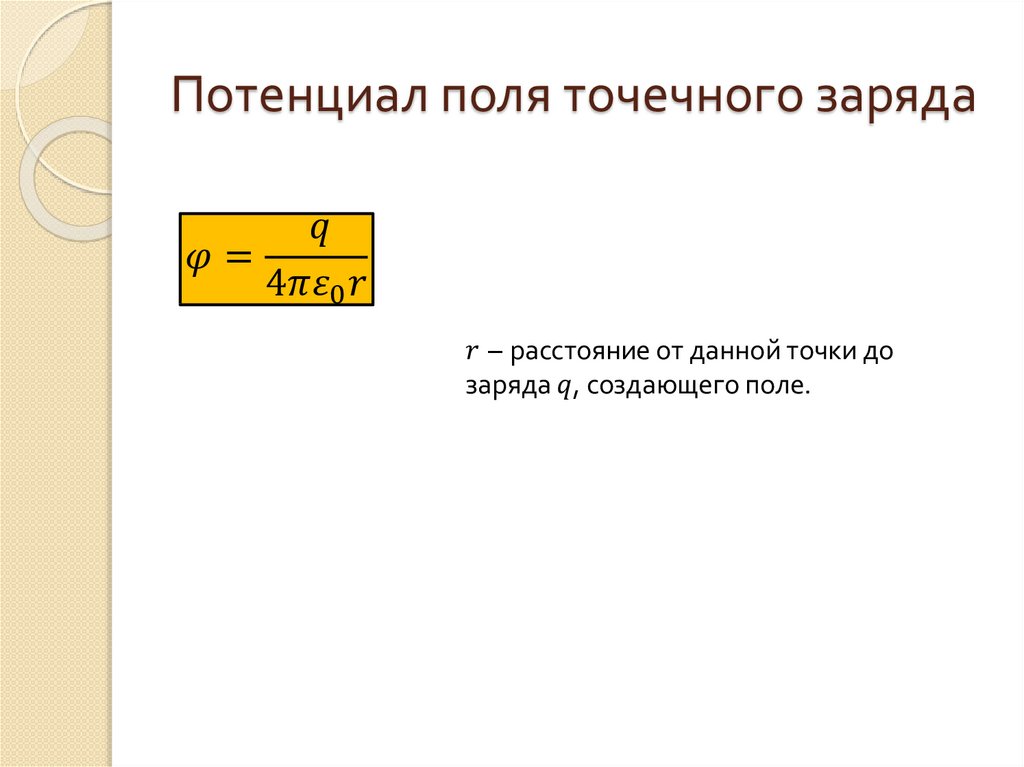 Это известно как давление раствора, которое определяется разностью энергии решетки и энергии гидратации. В свою очередь, ионы металлов вдавливаются обратно в металлическую решетку за счет давления разделения.
Это известно как давление раствора, которое определяется разностью энергии решетки и энергии гидратации. В свою очередь, ионы металлов вдавливаются обратно в металлическую решетку за счет давления разделения.
В приведенном выше примере это означает, что ионы железа переходят в раствор, в то время как ионы меди, присутствующие в растворе, поглощают оставшиеся электроны в листовом железе и отделяются в виде меди от листового железа. Если перевернуть опыт, то ни медь не перейдет в раствор, ни ионы железа не отделятся. Таким образом, давление раствора железа выше, чем давление раствора меди.
Если преобладает давление раствора, на металлическом стержне возникает избыток электронов. Если преобладает давление разделения, на металлическом стержне возникает нехватка электронов. Формируется динамическое равновесие. Таким образом, разделение ионов металла поддерживается за счет электрического притяжения отрицательно заряженного металла. Давление раствора, давление разделения и электрическое давление приводят к состоянию минимальной энергии, при котором совершается электрическая работа. Электрическую работу можно увидеть в виде напряжения на металлическом стержне.
Электрическую работу можно увидеть в виде напряжения на металлическом стержне.
Схематическое изображение полуэлемента железо-медь
Это абсолютное равновесное напряжение как таковое не может быть определено экспериментально, поскольку экспериментально доступна только разность напряжений. Следовательно, необходим второй электрод, который называется электродом сравнения, электродом сравнения, индифферентным электродом или индикаторным электродом. Его равновесное напряжение также не может быть измерено отдельно. Чтобы сравнить напряжения различных металлов в их растворах, их необходимо измерить относительно одного и того же электрода сравнения. Поэтому следует использовать электрод сравнения, равновесное напряжение которого устанавливается быстро и воспроизводимо.
В прошлом платиновый электрод с платиновым покрытием, промытый газообразным водородом в соляной кислоте, зарекомендовал себя. Равновесное напряжение при стандартных условиях (активность ионов гидроксония в соляной кислоте 1 моль/л; газообразный водород 1,013 бар) определено как 0,000 В при всех температурах. Только тогда водородный электрод обозначается как стандартный водородный электрод. Если измерять разность потенциалов различных металлов в растворах их солей относительно стандартного водородного электрода, возникают разные напряжения, которые могут быть выше или ниже 0,000 В.
Только тогда водородный электрод обозначается как стандартный водородный электрод. Если измерять разность потенциалов различных металлов в растворах их солей относительно стандартного водородного электрода, возникают разные напряжения, которые могут быть выше или ниже 0,000 В.
Измерения стандартных потенциалов с помощью HydroFlex в качестве стандартного водородного электрода
Ожидаемые равновесные потенциалы различных систем при стандартных условиях (25°C, активность ионов металлов 1 моль/л) сопоставлены в электрохимическом ряду. Металлы с равновесным потенциалом ниже 0 В обозначаются как неблагородные. Если равновесные потенциалы выше 0 В, металлы обозначаются как благородные.
В соответствии с электрохимическим рядом можно также указать равновесные потенциалы неметаллов и их ионов, а также ионных соединений и их зарядов. Если реагент окисляется, образуется продукт восстановления. В обратном случае продукт окисления образуется при восстановлении реагента. Таким образом, всегда есть окислительно-восстановительные пары. Равновесные потенциалы являются мерой окислительной или восстановительной способности. Чем отрицательнее потенциал, тем легче металлы испускают электроны. Они окисляются и действуют как восстановитель. Чем выше потенциал, тем сложнее окислять электроны. Вместо этого их легче восстанавливать, и поэтому они действуют как окислитель. Ожидаемые напряжения для различных комбинаций полуячеек можно рассчитать с помощью стандартных потенциалов. Можно делать прогнозы о возможных или невозможных химических реакциях в водных растворах. Соглашение E = E (справа) – E (слева) является авторитетным для расчета ожидаемого напряжения.
Таким образом, всегда есть окислительно-восстановительные пары. Равновесные потенциалы являются мерой окислительной или восстановительной способности. Чем отрицательнее потенциал, тем легче металлы испускают электроны. Они окисляются и действуют как восстановитель. Чем выше потенциал, тем сложнее окислять электроны. Вместо этого их легче восстанавливать, и поэтому они действуют как окислитель. Ожидаемые напряжения для различных комбинаций полуячеек можно рассчитать с помощью стандартных потенциалов. Можно делать прогнозы о возможных или невозможных химических реакциях в водных растворах. Соглашение E = E (справа) – E (слева) является авторитетным для расчета ожидаемого напряжения.
Выдержка из электрохимической серии
Активность и концентрация – оба термина используются в электрохимии. Но в чем разница?
Концентрация вещества c указывает количество вещества n растворенного вещества в определенном объеме, поэтому единицей измерения является моль/л. Кроме того, в химии обозначение молярности М принято для концентрации вещества в моль/л. Концентрация вещества зависит от температуры, потому что объем зависит от температуры. Вы также можете связать концентрацию вещества растворенного вещества с массой растворителя в кг. Затем вы получаете моляльность b в моль/кг. Моляльность не зависит от температуры. Моляльность особенно часто встречается в старых таблицах. Более того, можно найти срок активности вида. Активность вещества есть термодинамическая величина, своего рода корректирующая концентрация.
Концентрация вещества зависит от температуры, потому что объем зависит от температуры. Вы также можете связать концентрацию вещества растворенного вещества с массой растворителя в кг. Затем вы получаете моляльность b в моль/кг. Моляльность не зависит от температуры. Моляльность особенно часто встречается в старых таблицах. Более того, можно найти срок активности вида. Активность вещества есть термодинамическая величина, своего рода корректирующая концентрация.
В растворе заряженные ионы окружены сольватными оболочками (гидратные оболочки в воде как растворителе) и, таким образом, изолированы друг от друга. Ионы менее эффективны. Активность соответствует оставшейся эффективной концентрации, которая, как правило, ниже концентрации из-за взаимодействия между ионами в растворе. Только в очень разбавленных растворах активность и концентрация почти равны. В высококонцентрированных растворах активность может достигать более высоких значений, чем концентрация, потому что молекул сольвата недостаточно для полной сольватации всех ионов. Отклонение между активностью и концентрацией выражается в поправочном коэффициенте, так называемом коэффициенте активности y, γ или f (в зависимости от вида, в котором указана концентрация вещества).
Отклонение между активностью и концентрацией выражается в поправочном коэффициенте, так называемом коэффициенте активности y, γ или f (в зависимости от вида, в котором указана концентрация вещества).
Универсальное определение активности (не соответствует физико-химическому определению) по Jander, Jahr; массовый анализ; 15. Auflage, 1989, de Gruyter:
a = y c c = концентрация вещества в моль/л (молярность)
a = γ c c = концентрация вещества в моль/кг (моляльность)
a = f c c = содержание растворенное вещество в молярной доле
Потенциал – напряжение – электродвижущая сила
Все три термина обозначают разность потенциалов между двумя системами. Если точка отсчета для измерения известна, вы говорите о потенциале, в противном случае вы говорите о напряжении.
Электродвижущая сила означает разность потенциалов элемента, которая измеряется, если элемент работает обратимо и ток не течет.
В соответствии с соглашением IUPAC1 стандартный потенциал (или стандартное напряжение) E рассчитывается по уравнению
E = E(правый) – E(левый) левая ячейка).
1: Коэн и др.: Величины, единицы и символы в физической химии, Зеленая книга ИЮПАК, 3-е изд., 2-е издание, Издательство ИЮПАК и RSC, Кембридж, 2008, с. 71
IUPAC² также определяет: «Стандартный потенциал электрохимической реакции, сокращенно стандартный потенциал, определяется как стандартный потенциал гипотетической ячейки, в которой электрод (полуячейка) слева на диаграмме ячейки стандартный водородный электрод (SHE) и электрод справа — это электрод, о котором идет речь». & RSC Publishing, Кембридж, 2008, с. 74
Если всегда рассматривать стандартный водородный электрод как «левую» ячейку, то автоматически возникают стандартные потенциалы электрохимического ряда, обозначенные как стандартный восстановительный потенциал. В старых таблицах часто встречаются стандартные потенциалы окисления, тогда приходится менять местами алгебраические знаки. Определить, указаны ли в таблице потенциалы окисления или восстановления, можно, наблюдая за алгебраическими знаками реакции Cu/Cu2+, поскольку тогда стандартный потенциал равен +0,34 В.
При этом возникает вопрос, какой электрод к какому входу измерительного прибора должен быть подключен, поскольку в соответствии с подключением электродов изменяется алгебраический знак измеряемого потенциала. Значения электрохимического ряда являются результатом измерений при подключении стандартного водородного электрода к минусовому входу (СОМ). Если вы измеряете относительно другого электрода сравнения, вы подключаете его к отрицательному входу (COM). Таким образом, измерительный электрод всегда подключен к положительному полюсу: E = E (электрод измерения) – E (электрод сравнения) .
Преобразование потенциалов общих электродов сравнения
Алгебраический знак измеренных потенциалов показывает, какой электрод более положительный, в каком направлении течет ток и какая реакция протекает самопроизвольно, поскольку потенциал напрямую связан с константой равновесия реагентов. E > 0 для E (справа) > E (слева) означает, что правый электрод положительно заряжен по отношению к левому электроду.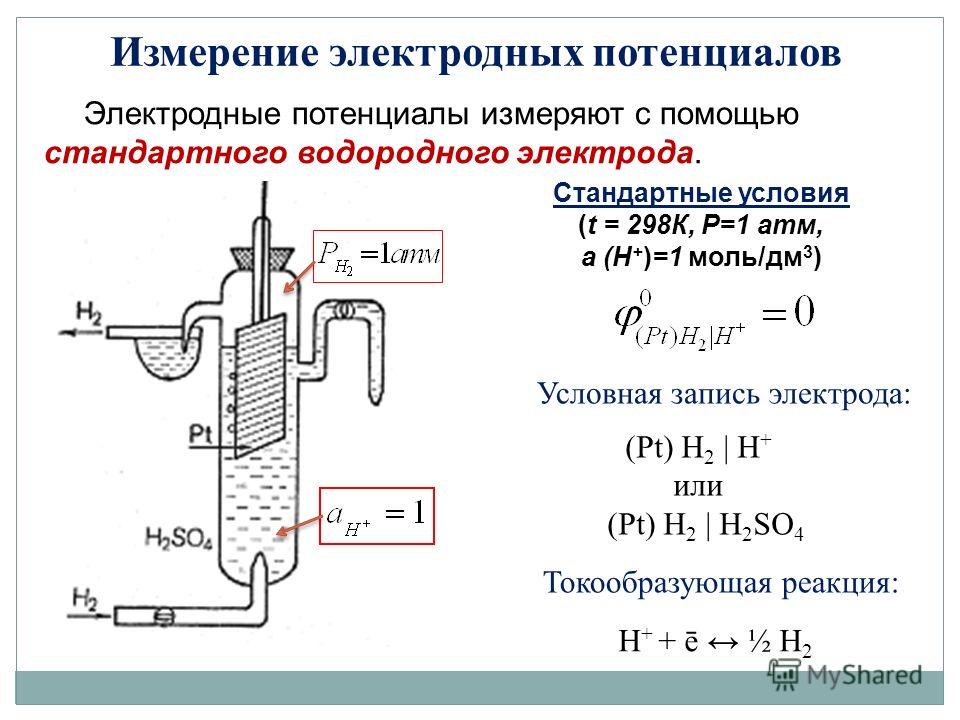
Недостаток электронов на правом электроде, вызванный восстановлением частиц. Этот электрод также называют катодом, где происходит восстановление. Следовательно, электрод течет слева направо. Таким образом, электрический ток, к сожалению, определяемый как поток положительных частиц, течет в противоположном направлении. На левом электроде избыток электронов, т.к. там частицы окислены. Этот электрод называется анодом, где происходит окисление. По тренду реакция протекает самопроизвольно слева (окисление) направо (восстановление). E < 0 для E (справа) < E (слева) косвенно означает, что реакция протекает самопроизвольно справа налево.
Измерение потенциалов – также в школе
Измерение потенциалов происходит почти без тока. Электрод, потенциал которого вы хотите определить, соединяется в соответствующем растворе с электродом сравнения через измерительный прибор. В зависимости от условий измерения к испытательной ячейке предъявляются особые требования. Используемый измерительный прибор также может влиять на результаты измерений. Входное сопротивление используемых измерительных приборов может, в зависимости от внутреннего сопротивления электрода сравнения, влиять на измерение потенциала или даже искажать его. С имеющимся в продаже электродом сравнения измерение потенциала является бестоковым только в том случае, если измерительные приборы имеют высокое сопротивление. В противном случае могут произойти электрохимические превращения. Водородный электрод сравнения HydroFlex имеет низкое внутреннее сопротивление, поэтому для измерения потенциала можно использовать портативные мультиметры, если исследуемая система имеет низкое сопротивление.
Входное сопротивление используемых измерительных приборов может, в зависимости от внутреннего сопротивления электрода сравнения, влиять на измерение потенциала или даже искажать его. С имеющимся в продаже электродом сравнения измерение потенциала является бестоковым только в том случае, если измерительные приборы имеют высокое сопротивление. В противном случае могут произойти электрохимические превращения. Водородный электрод сравнения HydroFlex имеет низкое внутреннее сопротивление, поэтому для измерения потенциала можно использовать портативные мультиметры, если исследуемая система имеет низкое сопротивление.
По нашему мнению, HydroFlex должен быть частью оборудования каждой школы, поскольку стандартные потенциалы могут быть измерены в соответствии со стандартами в простых системах. Вы можете использовать HydroFlex в стакане с серной или соляной кислотой (концентрация 1 моль/л) и мгновенно получить стандартный водородный электрод. Соедините этот сосуд с измерительной системой через солевой мостик (самый простой случай: фильтровальная бумага, пропитанная KNO3). Ваши ученики могут напрямую считывать стандартные потенциалы на мультиметре и сравнивать их с таблицами.
Ваши ученики могут напрямую считывать стандартные потенциалы на мультиметре и сравнивать их с таблицами.
Экспериментальные и теоретические стандартные потенциалы в простых системах, которые можно измерить с помощью HydroFlex в школе
Компания LEYBOLD предлагает наш водородный электрод для экспериментов «Standardpotenziale von Metallen» (C4.4.3.2B).
Д. Бем, Т. Курценкнабе, М. Шваб, Э. Гейдель: Experimente zur Bestimmung von Standardpotenzialen im Chemieunterricht, Praxis der Naturwissenschaften, Chemie in der Schule, Aktuelle Entwicklungen in der Elektrochemie, Heft 8, 64. Jahrgang, декабрь 2015 г. , Фридрих Ферлаг.
Оценка рисков: Messung von Standardpotenzialen, Redoxpotenzial und Konzentration Дополнительную информацию или предложения по использованию HydroFlex в школе можно найти здесь: www.fachreferent-chemie.de.
HydroFlex в качестве практичного водородного электрода для школы был представлен на Бундеконгрессе 2014 МНУ в Касселе. Вы можете найти сценарий, включая сценарий лекции, включая лекцию здесь.
Вы можете найти сценарий, включая сценарий лекции, включая лекцию здесь.
Электроды сравнения с солевым мостиком (электроды сравнения второго рода)
В прежние годы другие системы, кроме обратимого водородного электрода, использовались в качестве электродов сравнения, но их можно использовать только с внутренним электролитом и соответствующим электролитным мостом. Это электроды сравнения второго рода. Эти электроды сравнения следует выбирать в соответствии с измеряемым раствором, чтобы избежать загрязнения и ненужных диффузионных напряжений. Кроме того, диафрагма не должна быть настолько мелкопористой, что снижает переходное сопротивление между измеряемым раствором и электродом сравнения. Для водных и кислых растворов установлены следующие ссылки:
Хлорсеребряный электрод
Стандартный опорный потенциал и опорные потенциалы хлорсеребряного электрода относительно NHE, 25°C (Hamann, Vielstich: Elektrochemie; Wiley-VCH, 1998)
Хлорсеребряный электрод – зависимость потенциала от температуры и концентрации внутреннего электролита
Ртутно-хлористый ртутный электрод (каломельный электрод)
Стандартный опорный потенциал и опорные потенциалы каломельного электрода относительно NHE, 25°C (Hamann, Vielstich: Elektrochemie; Wiley-VCH, 1998)
Электрод ртутный хлоридно-ртутный – зависимость потенциала от температуры и концентрации внутреннего электролита
Электрод ртутный сульфатно-ртутный
Стандартный опорный потенциал и опорные потенциалы ртутно-сульфатного электрода по отношению к NHE, 25°C (Hamann, Vielstich: Elektrochemie; Wiley-VCH, 1998)
Ртутный сульфатно-ртутный электрод – зависимость потенциала от температуры и концентрации внутреннего электролита
Ртутно-оксидно-ртутный электрод
Стандартный опорный потенциал и опорные потенциалы ртутно-оксидного электрода относительно NHE, 25°C (Hamann, Vielstich: Elektrochemie; Wiley-VCH, 1998)
Ртутный оксидно-ртутный электрод – зависимость потенциала от температуры и концентрации внутреннего электролита
Электролитный мостик – солевой мостик
Электролитный или солевой мостик используется для контакта различных электролитов. Диафрагма здесь является точкой контакта, проводящей ионы. В солевых мостиках коммерческих электродов сравнения можно найти диафрагмы, сделанные из керамики, платиновой бечевки, шлифовки, малейших отверстий, капилляров, таких как капилляр Габера-Луггина, волокон, тканей, таких как пеллон или прочный тефлон.
Диафрагма здесь является точкой контакта, проводящей ионы. В солевых мостиках коммерческих электродов сравнения можно найти диафрагмы, сделанные из керамики, платиновой бечевки, шлифовки, малейших отверстий, капилляров, таких как капилляр Габера-Луггина, волокон, тканей, таких как пеллон или прочный тефлон.
Коммерческие электроды сравнения основаны на солевых мостиках. Соединение с измерительным раствором осуществляется с помощью диафрагмы, которая обычно изготавливается из керамики, платинового шпагата или шлифовки.
Мембрана: характеристики наиболее часто используемых материалов, состоящих из Galster, pH-Messung, Wiley-VCH, 1990
Различные материалы имеют разную скорость потока, которая зависит от пористости материала и размера мембраны. диафрагма. Также на скорость потока могут влиять качество изготовления электрода сравнения, повреждения, загрязнения диафрагмы.
Расход различных типов диафрагм, взятых из Galster, pH-Messung, Wiley-VCH, 1990
При использовании электролитных мостов необходимо учитывать, что в зависимости от типа диафрагмы в измеряемый раствор вытекает различное количество внутреннего электролита. Выбор электрода сравнения зависит от измерительного раствора, в котором должен использоваться электрод. Во избежание загрязнения внутреннего электролита в электроде сравнения, вызванного диффузией измерительного раствора, необходимо вытекание внутреннего электролита в измерительный раствор. Поэтому заливное отверстие должно быть открыто или, по крайней мере, не закрываться наглухо во время измерений. Уровень заполнения внутреннего электролита должен быть значительно выше уровня измеряемого раствора.
Выбор электрода сравнения зависит от измерительного раствора, в котором должен использоваться электрод. Во избежание загрязнения внутреннего электролита в электроде сравнения, вызванного диффузией измерительного раствора, необходимо вытекание внутреннего электролита в измерительный раствор. Поэтому заливное отверстие должно быть открыто или, по крайней мере, не закрываться наглухо во время измерений. Уровень заполнения внутреннего электролита должен быть значительно выше уровня измеряемого раствора.
В трудноизмеряемых средах, таких как сильно загрязненные или высоковязкие образцы, предпочтительно использовать шлифованные диафрагмы из-за их высокой скорости потока.
Электроды сравнения с твердым внутренним электролитом не имеют оттока электролита. Однако через диафрагму измерительный раствор может попасть в твердый электролит и загрязнить, растворить или разбавить его. Внутренний электролит вне электрода сравнения загрязняет измерительный раствор. Электроды сравнения необходимо повторно заправлять. Уровень жидкости в электроде сравнения всегда должен быть выше уровня измеряемого раствора. Электроды сравнения с твердым электролитом со временем теряют точность из-за изменения твердого электролита из-за поступления ионов измеряемого раствора.
Уровень жидкости в электроде сравнения всегда должен быть выше уровня измеряемого раствора. Электроды сравнения с твердым электролитом со временем теряют точность из-за изменения твердого электролита из-за поступления ионов измеряемого раствора.
На каждой диафрагме возникает диффузионное напряжение, приводящее к отклонениям измеряемого потенциала.
Диффузионное напряжение – диффузионные потенциалы
Мембрана является точкой контакта между шунтирующим электролитом и измерительным электролитом. В этот момент возникают диффузионные напряжения, поскольку анионы и катионы разных электролитов имеют разную скорость миграции. Диффузионные напряжения можно уменьшить за счет выбора шунтирующего электролита и типа солевого мостика.
Диффузионное напряжение по R. Holze, Leitfaden der Elektrochemie, 1998; Teubner Taschenbücher Chemie
Измеренная и расчетная СКФ у здоровых потенциальных доноров почки
. 2004 г., январь; 43 (1): 112-9.
2004 г., январь; 43 (1): 112-9.
doi: 10.1053/j.ajkd.2003.09.026.
Эндрю Д. Правило 1 , Хайе М. Гуссак, Грегори Р. Понд, Эрик Дж. Бергстрал, Марк Д. Стегал, Фернандо Г. Косио, Тимоти С. Ларсон
Принадлежности
принадлежность
- 1 Отделение нефрологии и внутренних болезней, клиника Майо, Рочестер, Миннесота 55905, США.
- PMID: 14712434
- DOI: 10.1053/ж.айкд.2003.09.026
Эндрю Д. Рул и др. Am J почек Dis. 2004 Январь
. 2004 г., январь; 43 (1): 112-9.
2004 г., январь; 43 (1): 112-9.
doi: 10.1053/j.ajkd.2003.09.026.
Авторы
Эндрю Д Правило 1 , Хайе М. Гуссак, Грегори Р. Понд, Эрик Дж. Бергстрал, Марк Д. Стегал, Фернандо Г. Косио, Тимоти С. Ларсон
принадлежность
- 1 Отделение нефрологии и внутренних болезней, клиника Майо, Рочестер, Миннесота 55905, США.
- PMID: 14712434
- DOI: 10.1053/ж.айкд.2003.09.026
Абстрактный
Фон: Немеченый радиоактивным изотопом клиренс йоталамата является точным способом определения скорости клубочковой фильтрации (СКФ). Целью данного исследования является определение нормального диапазона клиренса немеченого радиоактивным изотопом йоталамата у потенциальных доноров почек и оценка точности оценок СКФ на основе креатинина в этой популяции.
Целью данного исследования является определение нормального диапазона клиренса немеченого радиоактивным изотопом йоталамата у потенциальных доноров почек и оценка точности оценок СКФ на основе креатинина в этой популяции.
Методы: Были изучены медицинские записи 365 потенциальных доноров почек. СКФ измеряли по клиренсу немеченого радиоактивным изотопом йоталамата. Линейный регрессионный анализ был использован для определения возрастных и половых нормальных значений СКФ и креатинина сыворотки. Для оценки СКФ по уровням креатинина в сыворотке использовались сокращенная модификация диеты при заболеваниях почек (MDRD) и уравнения прогноза Кокрофта-Голта.
Полученные результаты: СКФ значительно снижалась с возрастом (P <0,001) и была ниже у женщин, чем у мужчин (P <0,001). Мужчины в возрасте 20 лет имели расчетную среднюю СКФ 129.мл/мин, который снизился на 4,6 мл/мин/декаду. Женщины в возрасте 20 лет имели среднюю СКФ 123 мл/мин, которая снижалась на 7,1 мл/мин/десять лет. Регрессионный анализ СКФ, нормализованный к площади поверхности тела (нСКФ), был значим для возраста (P <0,001), но не для пола (P = 0,826). У 20-летнего мужчины средняя СКФ составила 111 мл/мин/1,73 м2, которая снизилась на 4,9 мл/мин/1,73 м2/десятилетие. Корреляция между измеренной нСКФ и рассчитанной СКФ была слабой (r = 0,26 для сокращенного уравнения MDRD; r = 0,35 для уравнения Кокрофта-Голта).
Женщины в возрасте 20 лет имели среднюю СКФ 123 мл/мин, которая снижалась на 7,1 мл/мин/десять лет. Регрессионный анализ СКФ, нормализованный к площади поверхности тела (нСКФ), был значим для возраста (P <0,001), но не для пола (P = 0,826). У 20-летнего мужчины средняя СКФ составила 111 мл/мин/1,73 м2, которая снизилась на 4,9 мл/мин/1,73 м2/десятилетие. Корреляция между измеренной нСКФ и рассчитанной СКФ была слабой (r = 0,26 для сокращенного уравнения MDRD; r = 0,35 для уравнения Кокрофта-Голта).
Заключение: Это исследование клиренса немеченого радиоактивным изотопом йоталамата для измерения СКФ у потенциальных доноров почек установило нормальные значения с поправкой на возраст. У здоровых людей СКФ не может быть точно оценена с использованием сокращенных формул прогнозирования MDRD или Кокрофта-Голта.
Похожие статьи
Оценка скорости клубочковой фильтрации у здоровых взрослых индийцев: сравнение различных уравнений прогнозирования.

Махаджан С., Мухия Г.К., Сингх Р., Тивари С.К., Калра В., Бховмик Д.М., Гупта С., Агарвал С.К., Даш С.К. Махаджан С. и др. J Нефрол. 2005 г., май-июнь; 18(3):257-61. J Нефрол. 2005. PMID: 16013012
Модификация уравнения диеты при заболеваниях почек занижает скорость клубочковой фильтрации у египетских доноров почек.
Ибрагим С., Рашид Л., Дараи М. Ибрагим С. и др. Exp Clin Transplant. 2008 г., июнь; 6 (2): 144-8. Exp Clin Transplant. 2008. PMID: 18816242
Сравнение прогностических уравнений для оценки скорости клубочковой фильтрации у взрослых без заболеваний почек.
Лин Дж., Найт Э.Л., Хоган М.Л., Сингх А.К. Лин Дж. и др. J Am Soc Нефрол. 2003 г., 14 октября (10): 2573-80.
 doi: 10.1097/01.asn.0000088721.98173.4b.
J Am Soc Нефрол. 2003.
PMID: 14514734
Клиническое испытание.
doi: 10.1097/01.asn.0000088721.98173.4b.
J Am Soc Нефрол. 2003.
PMID: 14514734
Клиническое испытание.[Обоснование, плюсы и минусы оценки СКФ: уравнения Кокрофта-Голта и MDRD].
Чирилло М. Чирилло М. Г Итал Нефрол. 2009 г., май-июнь; 26(3):310-7. Г Итал Нефрол. 2009. PMID: 19554528 Обзор. итальянский.
Оценка СКФ на основе креатинина у реципиентов почечного трансплантата: систематический обзор.
Уайт К.А., Хуанг Д., Акбари А., Гарланд Дж., Нолл Г.А. Уайт К.А. и соавт. Am J почек Dis. 2008 июнь; 51 (6): 1005-15. doi: 10.1053/j.ajkd.2008.02.308. Epub 2008 2 мая. Am J почек Dis. 2008. PMID: 18455847 Обзор.
Посмотреть все похожие статьи
Цитируется
Оценка СКФ у потенциальных живых доноров почек: расовые и нерасовые уравнения и измеренная СКФ.

Гудсон Д.А., Чалупски М.Р., Вигли Н., Хуан Ю., Чиу М., Банг Х., Рошанраван Б., Янг Б.Я., Чен Л.Х. Гудсон Д.А. и соавт. Почки Мед. 2022 14 октября; 4(12):100558. doi: 10.1016/j.xkme.2022.100558. электронная коллекция 2022 дек. Почки Мед. 2022. PMID: 36471819 Бесплатная статья ЧВК.
Влияет ли секс на соотношение 2D:4D или циркулирующие гормоны взрослых на расчетную скорость клубочковой фильтрации? Поперечное исследование в Гане.
Банье М., Зогли К.Е., Осуману Х.А., Обенг Л., Ачемпонг Т.К., Дагунгонг С.Б., Байор Э., Амиду Н. Банье М. и соавт. Physiol Rep. 2022 Nov;10(22):e15516. дои: 10.14814/phy2.15516. Физиол Респ. 2022. PMID: 36385503 Бесплатная статья ЧВК.
Клубочковая фильтрация у пожилых людей.

Норонья И.Л., Санта-Катарина Г.П., Андраде Л., Коэльо В.А., Джейкоб-Фильо В., Элиас Р.М. Норонья, И.Л., и соавт. Front Med (Лозанна). 2022 15 сентября; 9:769329. doi: 10.3389/fmed.2022.769329. Электронная коллекция 2022. Front Med (Лозанна). 2022. PMID: 36186775 Бесплатная статья ЧВК. Обзор.
Растворимый рецептор активатора урокиназы плазминогена и снижение функции почек у пациентов без заболевания почек.
Иверсен Э., Каллемос Т., Хорнум М., Бенгаард А.К., Нелин Дж.О., Расмуссен Л.Дж.Х., Сандхолдт Х., Тавеньер Дж., Фельдт-Расмуссен Б., Андерсен О., Ойген-Олсен Дж., Хоулинд М.Б. Иверсен Э. и соавт. Клин Кидни Дж. 21 февраля 2022 г.; 15 (8): 1534-1541. дои: 10.1093/ckj/sfac048. Электронная коллекция 2022 авг. Клин Кидни Дж. 2022. PMID: 35892012 Бесплатная статья ЧВК.
Влияние скрининга на основе измеренной и расчетной скорости клубочковой фильтрации на характеристики живого донора почки: исследование нескольких когорт.



 04.2022
04.2022
 doi: 10.1097/01.asn.0000088721.98173.4b.
J Am Soc Нефрол. 2003.
PMID: 14514734
Клиническое испытание.
doi: 10.1097/01.asn.0000088721.98173.4b.
J Am Soc Нефрол. 2003.
PMID: 14514734
Клиническое испытание.