Обсуждение:Молекула водорода — Википедия
Материал из Википедии — свободной энциклопедии
Приведённое на Вики-страничке «Молекула водорода» утверждение, содержащее фразу «Вследствие взаимодействия между электронами образуется ковалентная химическая связь» является ошибочным. Если бы электроны действительно взаимодействовали между собой и в результате этого взаимодействия образовывались бы ковалентные химические связи, то потребителям элекатроэнергии поступал бы не электрический ток, а ковалентные химические связи.
Приведённые красивые математические выражения являются мишурой. Нужна физически наглядная модель, правильно отражающая сущность реальной системы молекулы водорода. Важна интерпретация факта объединения электрически нейтральных атомов водорода в устойчивую молекулу. Нужно четкое описание природы ковалентной химической связи, образующей молекулу водорода. —Golart 15:14, 30 ноября 2011 (UTC)
- Если Вы «правильно отразите сущность реальных систем», то станете вторым Бором и Шрёдингером заодно. А Википедия — не место для распространения новых идей, и оригинальные исследования в ней запрещены. Мы тут только собираем всё, что сделано до нас, например, физиками 20-х годов. —аимаина хикари 15:26, 30 ноября 2011 (UTC)
- Не нужно быть ни Бором, ни Шрёдингером, чтобы заметить ошибочность фразы «Вследствие взаимодействия между электронами образуется ковалентная химическая связь». Электроны не взаимодействуют друг с другом с образованием химической связи. Получение химической связи из электронов абсурдно. —Golart 11:26, 1 декабря 2011 (UTC)
- Что касается физиков 20-х годов прошлого века, то упомянутый выше вами Нильс Бор разработал не только модель атома, но и модель молекулы. В этой модели внешние электроны двух атомов, образующих химическую связь, вращаются по одной и той же орбите вокруг линии, проходящей через ядра обоих атомов, и удерживают последние на определённом расстоянии друг от друга [Нильс Бор. Избранные научные труды. Том I. Статьи 1909-1925 г.г. Изд. Наука 1970, с.133].
Модель химической связи Н.Бора давала четкую электростатическую картину образования молекулярного водорода – динамическое равновесие системы, содержащей два протона, удерживающихся на определённом расстоянии друг от друга электростатическим воздействием кольца из двух электронов. При этом, модель Н.Бора точно отражала корреляционное взаимодействие электронов (кулоновское отталкивание) – оба электрона за счёт электростатического отталкивания находились в диаметрально противоположных точках орбиты вокруг линии, проходящей через ядра обоих атомов молекулы водорода и, образуя соответствующий электрический квадруполь.
Так же как и боровская модель атома, модель химической связи Н.Бора не отражала и не могла отражать волновую природу электрона и статическую интерпретацию волновой функции Макса Борна. Здесь уместно дополнить модель химической связи Н.Бора достижениями квантовой химии, аналогично модели атома водорода. В этом случае гипотетическое боровское кольцо электронов в химической связи трансформируется в геометрическое место расположения центров вероятного нахождения электронов (центров областей локализации электронов в молекуле).
Межъядерное расстояние в молекуле водорода определяется как длина диагонали квадруполя
D = a
Аналогичное описание модели химической связи дано в книге Ганкиных В.Ю и Ю.В «Как образуется химическая связь и протекают химические реакции» — М: Издательская группа «Граница», 2007 г. – 320с., ил.
Модель двухатомной связи представляют в виде двух ядер, между которыми в плоскости, перпендикулярной оси, соединяющей ядра, вращаются связывающие электроны. При этом предполагается, что между заряженными частицами (электроны, ядра) действуют только электростатические силы. Если соединяющиеся в молекулу атомы имеют одинаковые потенциалы ионизации, то плоскость вращения электронов располагается на равном расстоянии от каждого из ядер. Если же потенциалы ионизации различны, то плоскость вращения электронной пары смещается в сторону атома с большим первым потенциалом ионизации.
В связи с обнаружением в трудах классиков забытой модели молекулы, учитывающей кулоновскую электронную корреляцию, предлагаю дополнить содержание статьи «Молекула водорода» разделом 1 «Модели молекулы водорода». В новом разделе указать:
1.1. Модель молекулы водорода в рамках метода валентных схем (связей) В. Гайтлера и Ф. Лондона ;
1.2. Модель молекулы водорода в рамках метода молекулярных орбиталей Ф. Хунда, Р. Малликена, В. Фока ;
1.3. Модель молекулы водорода в рамках кулоновской электронной корреляции Н.Бора. —Golart 15:31, 5 декабря 2011 (UTC)
Это не карта электронной плотности. 193.232.68.75 16:58, 23 октября 2012 (UTC)
На странице нет значения частоты валентных колебаний в молекуле. Если кто-нибудь найдёт — добавьте пожалуйста.
- быстрым поиском нашёл несколько разных значений от 1,26*10^14 Гц до 4396 см-1(соответствует 1,32*10^14 Гц). Известно также оценочное значение в 6000К(1,25*10^14 Гц). Хотелось бы иметь точное значение из проверенного источника.
Вопрос 25. Квантово-механическое объяснение образования молекулы водорода из атомов.
С точки зрения квантовой механики при образовании химической связи между атомами их электронные орбитали перекрываются. В результате в межъядерной области создается повышенная электронная плотность по сравнению с электронной плотностью в изолированных атомах, которая как бы стягивает ядра в единую устойчивую систему. В силу особенностей электронных состояний между ядрами может происходить не повышение электронной плотности, а, наоборот, уменьшение ее до нуля. В этом случае химическая связь не образуется. Причины устойчивости многоатомной частицы заключаются в понижении энергии ее образования. Рассмотрим, например, изменение энергии при сближении двух атомов водорода, находящихся на бесконечно большом расстоянии (r = ∞) друг от друга. Потенциальную энергию Е при r = ∞ примем равной нулю.
Система состоит из двух протонов и двух электронов. Между частицами возникает два типа сил: силы отталкивания между электронами двух атомов и протонами атомов и силы притяжения между протонами и электронами.
П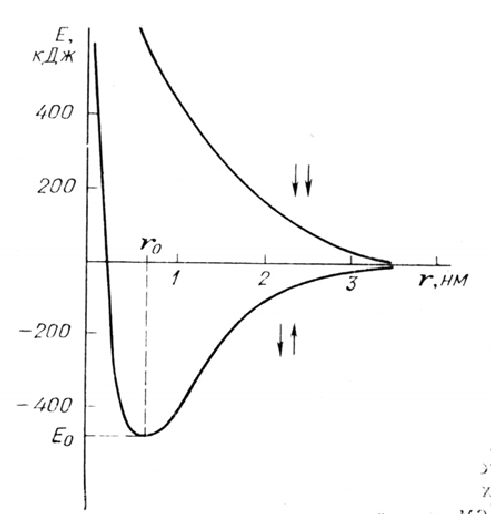 редставим
себе, что два атома водорода сближаются
друг с другом из бесконечности. На
бесконечно большом расстоянии
взаимодействия между атомами нет. Как
только атомы входят в «зону действия»
друг друга, между ними начинают действовать
электростатические силы двух типов:
редставим
себе, что два атома водорода сближаются
друг с другом из бесконечности. На
бесконечно большом расстоянии
взаимодействия между атомами нет. Как
только атомы входят в «зону действия»
друг друга, между ними начинают действовать
электростатические силы двух типов:
Кривая потенциальной энергии для молекулы водорода
силы притяжения (между ядром первого атома и электроном второго, ядром второго атома и электроном первого) и силы отталкивания (между ядром первого атома и ядром второго, между электроном первого атома и электроном второго). Соотношение между этими силами есть функция межъядерного расстояния: преобладание сил притяжения приводит к тому, что общая энергия системы начинает снижаться и достигает минимального значения при расстоянии rо, а на расстояниях <rо резко возрастают силы отталкивания, и энергия системы бесконечно возрастает. Состояние рассматриваемой системы, отвечающее межъядерному расстоянию rо, наиболее энергетически выгодно (потенциальная энергия двух взаимодействующих атомов минимальна). Именно в этом состоянии осуществляется оптимальное соотношение между силами притяжения и отталкивания и образуется химическая связь. Расстояние rо является межъядерным расстоянием в молекуле, его называют длиной связи.
Квантово-механический анализ процесса сближения двух нейтральных атомов вносит в этот вывод некоторые дополнения: химическая связь между атомами образуется только в том случае, если спины электронов антипараллельны (↑↓). В случае параллельных спинов (↑↑) энергия системы монотонно возрастает, причем ее значения превосходят сумму энергий изолированных атомов при любых расстояниях между ними, и образования химической связи не происходит.
Итак, образование химической связи – процесс энергетически выгодный: его сопровождает выделение энергии. Энергию, которая выделяется при образовании химической связи между атомами, называют энергией связи. Величину этой энергии относят к одному моль связей и выражают в кДж/моль. Чтобы получить значение энергии одной связи, необходимо разделить мольную энергию на 6.023·1023 моль-1.
Вопрос 26. Основные положения метода валентных связей (ВС). Насыщаемость и направленность ковалентной связи. Направленность ковалентных химических связей, образуемых р-электронами. Строение молекул PH3, AsH3, H2Se.
1.Причиной связи является электростатическое взаимодействие ядер и электронов.
2.Связь образуется электронной парой с антипараллельными спинами.
3.Насыщаемость связи обусловлена образованием электронных пар.
4.Прочность связи пропорциональна степени перекрывания электронных облаков.
5.Направленность связи обусловлена перекрыванием электронных облаков в области максимальной электронной плотности.
6.Химическая связь между двумя атомами возникает как результат перекрытия АО с образованием электронных пар.
7.Атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц.
8.В соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с разными спинами.
9.Характеристики химической связи (энергия, длина, полярность) определяются типом перекрывающихся АО.
Валентность – это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента. Мерой валентности может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью элемента обычно понимается его способность к образованию химических связей. В представлении метода ВС числовое значение валентности соответствует числу ковалентных связей, которые образует атом.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении.
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Для p- и d-электронных облаков перекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называется s-связью. s-Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Между двумя атомами в молекуле возможно только одна σ-связь. Для двух s-орбиталей, одной s- и одной p-орбиталей, очевидно, такой способ перекрывания является единственно возможным. Две p-орбитали перекрываются
Три p-орбитали каждого атома азота располагаются в пространстве взаимно перпендикулярно – по соответствующим осям декартовой системы координат. Те орбитали разных атомов азота, которые оказываются ориентированными по одной и той же оси, перекрываются
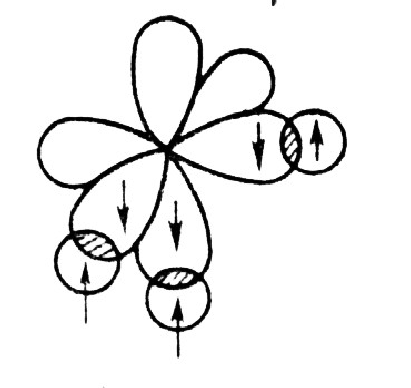
Молекула фосфина – PH3 построена из одного атома фосфора и трех атомов водорода. В процессе ее образования происходит перекрывание трех взаимно перпендикулярных p-орбиталей атома фосфора со сферическими водородными 1s-орбиталями:
– пирамиду.
Пирамидальная с атомом As в вершине; углы H-As-H 92,08°. У H2Se форма та же.
Вопрос 27. Донорно-акцепторная химсвязь. Максимальная ковалентность атомов элементов 2 и 3 периодов с учетом образования донорно-акцепторной связи. Строение ионов NH4+, [BF4]− …
По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов. По донорно-акцепторному механизму происходит, например, присоединение фторид-иона к молекуле трифторида бора. Вакантная р-орбиталь бора (акцептора электронной пары) в молекуле BF3 перекрывается с р-орбиталью иона F−, выступающего в роли донора электронной пары. В образовавшемся ионе
Атомы, внешняя электронная оболочка которых состоит только из s- и р-орбиталей, могут быть либо донорами, либо акцепторами электронной пары. Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается дативный механизм образования связи. По такому механизму возникает связь, например, при образовании комплексного иона аммония:
HN3 + H+ → NH4+.
В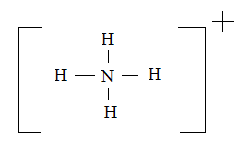 молекуле NH3 атом азота имеет неподеленную пару
электронов (двухэлектронное облако). У
иона водорода же орбиталь свободна. При
достаточном сближении молекулы NH3 и иона H+ двухэлектронное облако азота попадает
в сферу притяжения иона водорода. Иначе
говоря, двухэлектронное атомное облако
превращается в двухэлектронное
молекулярное облако, т.е. возникает
четвертая ковалентная связь. В
образовавшемся ионе NH4+ все
четыре связи N
H равноценны и неразличимы независимо
от первоначального происхождения. Это
означает, что заряд присоединившегося
иона H+ делокализован между всеми атомами.
Комплексный ион NH4+ можно рассматривать также как производное
четырехковалентного иона N+,
связанного с четырьмя атомами водорода.
молекуле NH3 атом азота имеет неподеленную пару
электронов (двухэлектронное облако). У
иона водорода же орбиталь свободна. При
достаточном сближении молекулы NH3 и иона H+ двухэлектронное облако азота попадает
в сферу притяжения иона водорода. Иначе
говоря, двухэлектронное атомное облако
превращается в двухэлектронное
молекулярное облако, т.е. возникает
четвертая ковалентная связь. В
образовавшемся ионе NH4+ все
четыре связи N
H равноценны и неразличимы независимо
от первоначального происхождения. Это
означает, что заряд присоединившегося
иона H+ делокализован между всеми атомами.
Комплексный ион NH4+ можно рассматривать также как производное
четырехковалентного иона N+,
связанного с четырьмя атомами водорода.
Элементы 2 периода имеют четыре валентных орбитали (одну s и три р) и образуют четыре ковалентные связи. Максимальное значение ковалентности у элементов 3 периода равно 6, что соответствует участию в образовании связей одной s-, трех р- и двух d-орбиталей.
Двухатомная молекула — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 октября 2013; проверки требуют 6 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 октября 2013; проверки требуют 6 правок. Компьютерное представление Молекулы Азота N2
Компьютерное представление Молекулы Азота N2Двуха́томная моле́кула — молекула, состоящая из двух атомов одного или разных элементов. Если двухатомная молекула состоит из двух атомов того же элемента, например, водород (H2) или азот (N2), тогда она называется гомоядерной. В другом случае, если двухатомная молекула состоит из двух атомов разных элементов, например, монооксид углерода (CO) или оксид азота(II) (NO), то она называется гетероядерной. Атомы двухатомной молекулы связаны при помощи ковалентной связи.
При стандартных условиях стабильные гомоядерные двухатомные молекулы образуются только газами (за исключением благородных газов, таких как гелий (He) или неон (Ne), которые при стандартных условиях являются одноатомными газами):
При несколько более высоких температурах гомоядерные двухатомные молекулы также образуют галогены, например:
То же относится и ко многим другим элементам в парах при достаточно высоких температурах.[1]
При квантово-механическом рассмотрении двухатомной молекулы используются различные приближения для потенциальной энергии межатомного взаимодействия. Наиболее распространённые из них — потенциал Морзе и потенциал Пёшль — Теллера. Большой вклад в понимание электронной структуры и строение молекул внёс Г. Херцберг, лауреат Нобелевской премии по химии за 1971 год[2][3].
- ↑ Некрасов Б. В. Курс общей химии. — Издание 14-ое (стереотипное). — М.: Государственное издательство химической литературы, 1962. — 843 с.
- ↑ Герцберг Г. Спектры и строение двухатомных молекул. — изд. иностранной литературы. — 1949.
- ↑ Хьюбер К.-Н., Герцберг Г. Константы двухатомных молекул. — в 2-х частях:1, молекулы Ag-MoO. 2, молекулы N2-ZnO. — М.: «Мир», 1984.
Молекулярный ион водорода — Википедия
Материал из Википедии — свободной энциклопедии
Молекулярный ион водорода — простейший двухатомный ион H2+, образуется при ионизации молекулы водорода. В молекулярном ионе H2+ образуется одноэлектронная химическая связь с расстоянием dHH = 1,07Å. Одноэлектронная связь менее прочна (энергия разрыва 61 ккал/моль), чем обычная двухэлектронная связь в нейтральной молекуле водорода (dHH=0,74Å, энергия разрыва 104 ккал/моль)[1]. Расчеты зависимостей полной энергии и её компонент от межъядерного расстояния для простейшей структуры с химической связью — молекулярного иона водорода H2+ с одноэлектронной связью — показывают, что минимум полной энергии, который достигается при равновесном межъядерном расстоянии, равном 1,06Å, связан с резким понижением потенциальной энергии электрона вследствие концентрации и сжатия облака электронной плотности в межъядерной области[2].
Можно представить образование иона H2+ как результат реакции атома водорода и протона:
- H+H+→h3++61 kcal{\displaystyle {\mathsf {H+H^{+}\rightarrow H_{2}^{+}+61\ kcal}}}
или ионизацию молекулы водорода
- h3+357 kcal→h3++e−{\displaystyle {\mathsf {H_{2}+357\ kcal\rightarrow H_{2}^{+}+e^{-}}}}
Также молекулярным ионом водорода можно считать молекулу H3+, которая сравнительно устойчива и образуется по схеме
- h3+H+→h4++70 kcal{\displaystyle {\mathsf {H_{2}+H^{+}\rightarrow H_{3}^{+}+70\ kcal}}}
или по бимолекулярной реакции через возбуждённый ион водорода H4+[3].
- h3++h3→[h5+]∗→h4++H+1,1 eV{\displaystyle {\mathsf {H_{2}^{+}+H_{2}\rightarrow [H_{4}^{+}]^{*}\rightarrow H_{3}^{+}+H+1,1\ eV}}}
Молекулярный ион водорода H2+ содержит два протона, заряженных положительно, и один электрон, заряженный отрицательно. Единственный электрон компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии dHH = 1,06 Å. Центр электронной плотности электронного облака (орбитали) равноудалён от обоих протонов на боровский радиус α0 = 0,53 Å и является центром симметрии молекулярного иона водорода H2+
Молекулярный ион водорода H3+ содержит три протона и два электрона. Электростатическое отталкивание трёх протонов компенсируется двумя электронами. Методом кулоновского взрыва показано, что протоны молекулярного иона водорода H3+ находятся в вершинах равностороннего треугольника с межъядерным расстоянием 1,25 ± 0,2Å[4]. Точного решения волнового уравнения Шрёдингера, описывающего поведение электронов для систем, содержащих два электрона, не существует. Широко используемая приближённая теория молекулярных орбиталей не учитывает кулоновскую электронную корреляцию — электростатическое отталкивание электронов. Можно считать, что при учёте кулоновской электронной корреляции центры электронной плотности электронов будут равноудалены друг от друга, а также равноудалены от ядер молекулярного иона водорода H3+. В центре молекулярного графа H3+ существует «кулоновская дыра». В молекулярном ионе H3+ реализуется двухэлектронная трёхцентровая химическая связь.
- ↑ Некрасов Б. В. Основы общей химии. — 3-е изд., испр. и доп. — М.: «Химия», 1973. — Т. 1. — 656 с.
- ↑ Химический энциклопедический словарь. — М.: Советская энциклопедия. — 1983, С. 645
- ↑ Никитин Е. Е. Успехи химии. — 1969. — Т. XXXVIII. — 1153-1167 с.
- ↑ Реферативный журнал химии. — 1983. — Т. 7Б131.
Из каких частиц состоит молекула воды? срочно!
Н2О из двух атомов водорода и одного кислорода на четвёрку D2О тяжёлая вода-из двух атомов тяжёлого водорода-дейтерия (там в атоме водорода) нейтрон присутствует) и одного кислорода на пять с плюсом
лол водород, кислород
2 атома водорода и 1 атом кислорода
воду обозначают Н 2 О. Н — атом водород, О атом кислорода. *
он состоит из двух атомов водорода и одного атома кислорода . То есть состоят из более мелких частиц ! Настя ))
Ольга, спасибо, что посоветовала <a rel=»nofollow» href=»https://ok.ru/dk?cmd=logExternal&st.cmd=logExternal&st.link=http://mail.yandex.ru/r?url=http://fond2019.ru/&https://mail.ru &st.name=externalLinkRedirect&st» target=»_blank»>fond2019.ru</a> Выплатили 28 тысяч за 20 минут как ты и написала. Жаль что раньше не знала про такие фонды, на работу бы ходить не пришлось:)

