Школьная физика от Шептикина А.С.
Вариант №04
I. В стеклянную трубку наливают до половины воды и затем осторожно доливают спирт (рис. 3,а). Измерив уровень спирта, перемешивают его с водой. При этом оказывается, что объем получившейся смеси меньше суммы взятых объемов жидкостей (рис. 3, б). Какое из приведенных объяснений правильное? | |
1. Вода и спирт ведут себя подобно зерну в мешке: когда мешок встряхивают, то зерно уплотняется и объем его становится меньше | |
2. Так как воду доливают спиртом, то столб спирта давит на воду и она сжимается | |
3. Между частицами воды имеются промежутки, в которых располагаются частицы спирта |
II. Из каких частиц состоит молекула кислорода. | |
1. Из двух атомов водорода и одного атома кислорода | |
2. Из одного атома кислорода и одного атома водорода | |
3. Из двух атомов кислорода | |
4. Из двух атомов водорода | |
5. Из двух атомов кислорода и одного атома водорода |
III. Из каких частиц состоит молекула водорода? | |
1. Из двух атомов водорода и одного атома кислорода | |
2. Из одного атома кислорода и одного атома водорода | |
3. Из двух атомов кислорода | |
4. Из двух атомов водорода | |
5. |
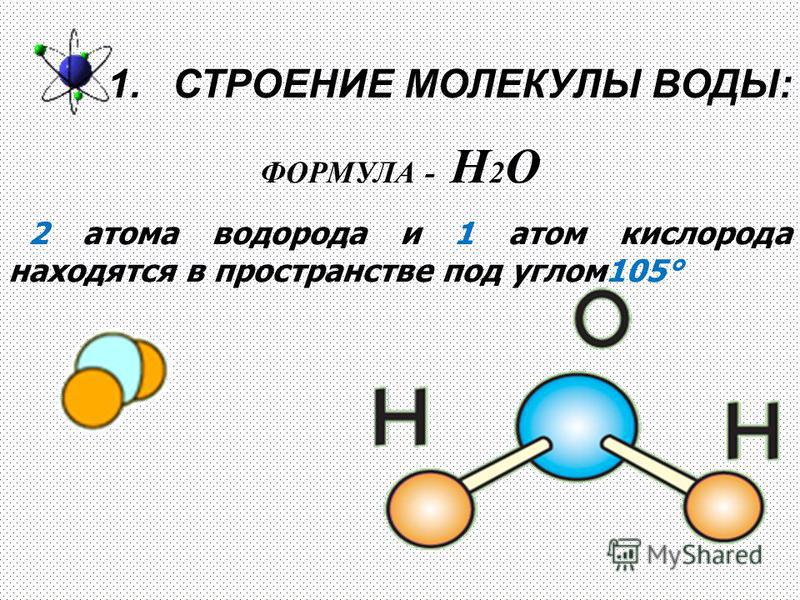
IV. Из каких частиц состоит молекула воды? | |
1. Из двух атомов водорода и одного атома кислорода | |
2. | |
3. Из двух атомов кислорода | |
4. Из двух атомов водорода | |
5. Из двух атомов кислорода и одного атома водорода |
V. В каких телах диффузия протекает быстрее: в твердых, жидких или газообразных? | |
1. Одинаково во всех телах | |
2. В твердых телах | |
3. | |
4. В газах |
VI. С одинаковой ли скоростью движутся молекулы в неподвижном воздухе в жаркий летний день и зимой в сильный мороз? | |
1. С одинаковой | |
2. Летом быстрее, чем зимой | |
3. Зимой быстрее, чем летом |
| Вы ответили верно на | |
| Ваша оценка: | |
| Количество баллов: |
Какими были первые атомы, появившиеся во Вселенной?
содержание
Какими были первые атомы во Вселенной?
Первым образовавшимся химическим элементом был водород (H). Это простейший химический элемент в нашей Вселенной, у него 1 протон, 1 электрон и нет нейтронов. Электроны гораздо меньшие частицы, чем протоны и нейтроны, их масса практически ничтожна.
Электроны гораздо меньшие частицы, чем протоны и нейтроны, их масса практически ничтожна.
Как появился первый атом Вселенной?
Когда появился первый атом во Вселенной? Таким образом, через 380 XNUMX лет после Большого взрыва вокруг атомных ядер начали скапливаться электроны. Из этого союза родились первые атомы, эти компоненты всей материи, которую мы знаем.
Какой самый старый атом во Вселенной?
Отвечать. Теория Биг-Бена очень расплывчата, но предполагается, что самым старым атомом является водород.
Какие два элемента появились во Вселенной первыми?
Водород, гелий и литий, самые легкие элементы периодической таблицы, образовались первыми во Вселенной. Теоретические и наблюдательные данные указывают на образование этих элементов в первые три минуты после Большого взрыва, физического события, ответственного за создание Вселенной 13.8 миллиарда лет назад.
Какие атомы присутствуют во Вселенной?
Наиболее распространены водород и гелий, образовавшиеся в первые 3 минуты Большого взрыва, который является отправной точкой всего сущего. 82 атомов в наблюдаемой Вселенной. Чтобы поместить это в контексте, это 10.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000 XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX
82 атомов в наблюдаемой Вселенной. Чтобы поместить это в контексте, это 10.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000.000 XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX
Из скольких атомов состоит тело человека?
Человеческое тело состоит из 7 октиллионов атомов и имеет примерно 10 триллионов клеток. Наиболее распространенными атомами, составляющими большинство биологических молекул (белков, углеводов, липидов и нуклеиновых кислот), являются углерод, кислород, азот, водород и фосфор.
Как создаются атомы?
Все атомы произошли от водорода (H), который был первым образованным химическим элементом и является самым простым элементом во Вселенной. Он образован протоном, играющим роль ядра, и вокруг этого ядра вращается только один электрон. Более сложные элементы имеют, помимо протона, нейтрон для формирования ядра.
Какой самый большой атом?
Самый большой атом, когда-либо созданный в экспериментальной ситуации, принадлежит Оганессону (Og) и имеет 118 протонов в ядре. На бумаге это благородный газ, то есть: несмотря на то, что он является причудливым человеческим творением, есть некоторый шанс, что он обладает свойствами, подобными свойствам гелия.
Какой самый маленький атом в мире?
Среди частиц, имеющих некоторую массу, самой маленькой является нейтрино. «Это может быть 4 x 10–33 грамма», — говорит физик Клаудио Фурукава из USP. Это соответствует одной миллиардной триллионной триллионной части грамма и дает массу в 100 миллионов раз меньше массы протона, которая составляет 1,67 x 10-24 грамма.
Что самое древнее во Вселенной?
HD 140283, также известная как «звезда Мафусаила», — это звезда, которую мы наблюдаем уже почти 100 лет. Однако при измерении ее возраста ученые достигли значения в 14,27 миллиарда лет.
Какой был первый элемент Земли?
Первым родился водород из частиц, образовавшихся в результате «большого взрыва», с которого началась Вселенная.
Какие 21 химические элементы присутствуют в организме человека?
нашей жизни, это кальций, хлор, кобальт, медь, хром, сера, железо, фтор, фосфор, йод, магний, марганец, молибден, калий, селен, натрий и цинк.
Что в организме человека есть на Земле?
Вот в чем дело: у нас 65% кислорода, 18% углерода и 10,2% водорода. Если мы добавим небольшое количество азота (3,1%), щепотку кальция для костей (1,6%), 1,2% фосфора, 0,25% калия и серы и меньшие проценты натрия, магния и хлора, мы уже достигли 99,95%.
Кто открыл атом?
Первыми мыслителями-философами, рассматривавшими эту идею, были: Левкип и Демокрит, причем Левкипп был первым, кто предположил, что все состоит (вся вселенная) из неделимых частиц, называемых атомами.
Какие атомы наиболее распространены в природе?
Самым распространенным химическим элементом во Вселенной является водород (H). Подсчитано, что он составляет 75% массы всей материи и 93% атомов в космосе. Это также самый простой и легкий химический элемент, в котором всего один протон в ядре и один электрон в его электроне.
Какой самый важный элемент в организме человека?
Кислород занимает первое место среди химических элементов, входящих в состав человеческого организма. По словам Таунсенда, на его долю приходится от 65% до 67% массы тела человека.
Что такое атомы?
Субатомные частицы Сегодня мы знаем, что атомы состоят из субатомных частиц, таких как протоны, нейтроны, электроны, позитроны, кварки, нейтрино и мезоны. В данный момент нас интересуют только фундаментальные субчастицы: протоны, нейтроны и электроны. Протоны — электрически заряженные частицы.
Для чего нужен атом?
Атом является фундаментальной единицей материи и наименьшей частицей, способной идентифицировать химический элемент, поскольку он сохраняет его идентичность. Термин атом происходит от греческого и означает неделимый.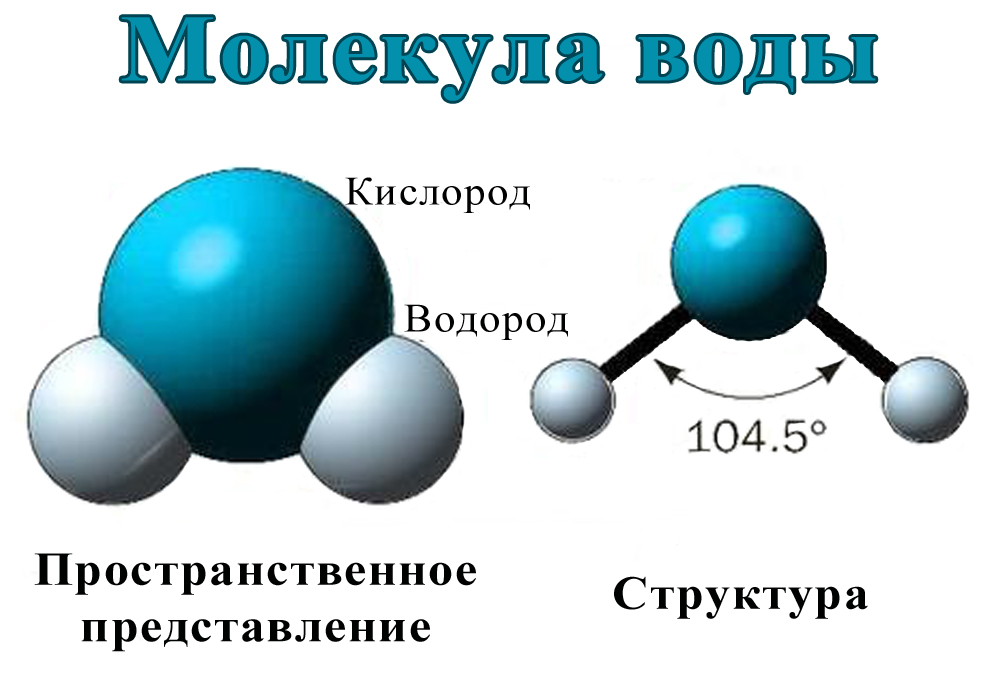 Он состоит из ядра, содержащего нейтроны и протоны, и электронов, окружающих ядро.
Он состоит из ядра, содержащего нейтроны и протоны, и электронов, окружающих ядро.
Из каких трех частиц состоит атом?
1.1. Атомная структура
Атомы состоят из элементарных частиц: протонов, нейтронов и электронов. В таблице I приведены некоторые характеристики атомных частиц.
Сколько существует различных типов атомов?
Есть 92 различных типа атомов и еще 25, которые уже были получены в лаборатории.
Сколько атомов известно?
Химические элементы состоят из набора атомов, состоящих из одинакового количества протонов в ядре. В настоящее время известно 118 элементов, из них 92 созданы природой и 26 созданы искусственно. Все они представлены в периодической таблице.
Сколько планет во всей Вселенной?
Пока что мы говорим о триллионах возможных планет только в Млечном Пути. Поскольку мы уже знаем, что во Вселенной существует по крайней мере еще 200 миллиардов галактик, мы можем оценить, что вокруг звезд вращается 10²⁵ экзопланет — или, если хотите, 10. 000.000.000.000.000.000.000.000 XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX миров в наблюдаемой Вселенной.
000.000.000.000.000.000.000.000 XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX миров в наблюдаемой Вселенной.
Сколько песчинок в мире?
При таком среднем размере песчинок мы можем насчитать примерно 100 миллиардов песчинок на кубический метр. Отсюда закончите вычисление сами: если у нас 1012 кубических метров с 1011 зерен на кубический метр, у нас 1023 песчинки на Земле.
Какова длина атома?
10 35 лет — это среднее время жизни атома, по данным американского астронома Мартина Риса.
Правда ли, что мы состоим из атомов?
Но фундаментальным аспектом являются атомы, из которых состоит наше тело. По сути, мы состоим всего из четырех типов частиц, которые существовали большую часть времени в истории Вселенной. Это может быть немного сокращено.
Сколько атомов в 1 ячейке?
Это зависит от размера ячейки, не все ячейки имеют одинаковый размер. Но это число приблизительно равно 7 квадриллионам атомов на клетку, если мы возьмем общее количество атомов в теле и разделим его на общее количество клеток в человеческом теле.
Можно ли создать что-то из ничего?
Новый эксперимент доказал, что материю можно создать из ничего. Исследователи, участвовавшие в исследовании, смогли создать в лаборатории электрические поля, достаточно сильные для спонтанной генерации пар частица-античастица из воздуха.
Можно ли разбить атом?
Ядерное деление в ядерной физике — это расщепление ядра нестабильного атома на два меньших ядра путем бомбардировки его частицами, такими как нейтроны. Изотопы, образующиеся при расщеплении, имеют одинаковую массу, но обычно имеют соотношение масс 3:2.
Нельзя что-то трогать?
Ответ прост: никогда, ни при каких обстоятельствах мы по-настоящему не прикасаемся к другим вещам или людям. Когда мы подходим очень близко к телу, у нас появляется ощущение прикосновения к нему. Но внутри происходит так называемое электрическое отталкивание.
Что меньше кварка?
Следовательно, кварки и электроны — самые маленькие из известных нам объектов.
Какая частица меньше атома?
протон (р+) — одна из мелких частиц, составляющих атом, являющийся мельчайшей частицей химического элемента. Протон, или протон (по европейскому португальскому), образован тремя кварками, являющимися другими субчастицами.
Протон, или протон (по европейскому португальскому), образован тремя кварками, являющимися другими субчастицами.
Какая частица меньше атома?
Сегодня мы знаем, что электроны — это наименее массивные частицы, из которых состоит атом. Требуется 1836 электронов, чтобы достичь массы протона или нейтрона, которые являются частицами, составляющими атомное ядро.
Что такое кварк?
Протоны и нейтроны, находящиеся вместе в ядре атома, могут быть фрагментированы на еще более мелкие частицы. Эти частицы называются кварками. Насколько нам известно, существует по крайней мере шесть различных видов кварков, обнаруженных в ходе экспериментов, проведенных на больших ускорителях частиц.
Кто открыл кварк?
В 1964 году два физика, Мюррей Гелл-Манн и Джордж Цвейг, по отдельности предположили существование субатомных частиц, известных как кварки.
Атом представляет собой структуру (состоящую из протона, нейтрона, электрона, ядра, уровней, подуровней и орбиталей), образующую материю. Атом — это название, данное образующемуся из материи (всему, что занимает пространство и имеет массу). Это название предложили греческие философы Демокрит и Левкипп.
Атом — это название, данное образующемуся из материи (всему, что занимает пространство и имеет массу). Это название предложили греческие философы Демокрит и Левкипп.
Что самое горячее во Вселенной?
Что самое горячее во Вселенной? Ответ может быть 141.678.500.000.000.000.000.000.000.000.000 32 XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX XNUMX градусов Цельсия (в этом числе XNUMX дома). Она называется планковской температурой.
Что самое большое в мире?
Откройте для себя 10 величайших вещей в мире:
- Слонов
- Джекфрут.
- Масджид аль-Харам.
- Большой Барьерный риф.
- Гренландия/Гренландия.
- Салар де Уюни.
- Гигантская секвойя. 10 самых больших мест, живых существ и вещей в мире.
- Синий кит. 10 самых больших мест, живых существ и вещей в мире.
Какой объект был первым в мире?
Старинная докерамическая маска. Эта каменная маска считается древнейшей в мире. Информации о нем до сих пор недостаточно, но археологи считают, что он датируется 7. 000 годом до нашей эры, докерамической эпохой периода неолита.
000 годом до нашей эры, докерамической эпохой периода неолита.
Какая молекула была первой во Вселенной?
Гелий был первым атомом, и вскоре атомы гелия соединились с протонами, чтобы сформировать первую молекулу Вселенной, гидрид гелия (HeH+).
Какой самый большой атом во Вселенной?
Какой самый большой атом во Вселенной? Самый большой атом, когда-либо созданный в экспериментальной ситуации, принадлежит Оганессону (Og) и имеет 118 протонов в ядре. На бумаге это благородный газ, то есть: несмотря на то, что он является причудливым человеческим творением, есть некоторый шанс, что он обладает свойствами, подобными свойствам гелия.
Сколько вселенных в мире?
Открытие планет, расположенных за пределами Солнечной системы, также называемых экзопланетами, способствует изучению возможных признаков жизни во Вселенной.
Кто был создателем атомов?
Первыми мыслителями-философами, рассматривавшими эту идею, были: Левкип и Демокрит, причем Левкипп был первым, кто предположил, что все состоит (вся вселенная) из неделимых частиц, называемых атомами.
Водород был почти невозможен
16 апреля 2021 г. | Майк Олброу
Если бы не было водорода, не было бы и воды, или H
Когда расширяющаяся Вселенная остыла после Большого Взрыва, протоны и электроны нашли друг друга и образовали атомы водорода с небольшим количеством гелия и лития. Иллюстрация: ЦЕРН
Водород — простейший атом, в котором крошечный электрон вращается вокруг большего, но все же крошечного протона. Наши самые мощные «микроскопы», ускорители частиц, вообще не показывают размеров электронов, в то время как протоны представляют собой сферы примерно 1,7 х 10 -15 метров в поперечнике, что составляет 10 триллионных долей диаметра человеческого волоса. Они связаны друг с другом электрическим притяжением между противоположными электрическими зарядами.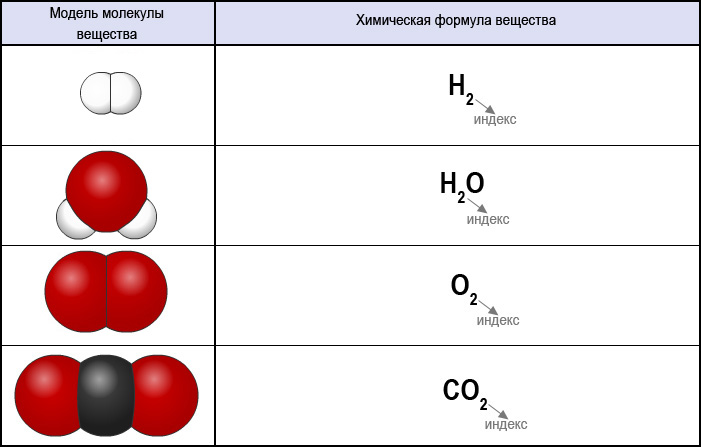
Протон состоит из двух верхних и одного нижнего, поэтому uud , и имеет немного более тяжелого нейтрального брата, называемого нейтроном, состоящего из одного верхнего и двух нижних, поэтому
Нейтроны и протоны имеют почти, но не совсем одинаковую массу. Физики используют для частиц единицу массы, называемую миллионом электрон-вольт, или МэВ. Масса нейтрона равна 939,565 МэВ, всего на 1,293 МэВ больше, чем масса протона, 938,272 МэВ. Эта небольшая разница позволяет нижнему кварку распадаться на верхний кварк, превращая нейтрон в протон, испуская при этом электрон (что составляет 0,5 МэВ) и гораздо более легкое антинейтрино, отнимающее заряд и энергию.
Никто не знает, почему нижний кварк чуть-чуть тяжелее верхнего, ровно настолько, чтобы позволить нейтронам распасться. Поскольку ап-кварк имеет больший электрический заряд, можно было бы ожидать обратного. Но тогда все свободные протоны Большого взрыва распались бы на нейтроны и позитроны с нейтрино. Ни водорода, ни воды, ни звезд, какими мы их знаем — совсем другая, возможно, стерильная Вселенная. Возможно, большинство вселенных таковы.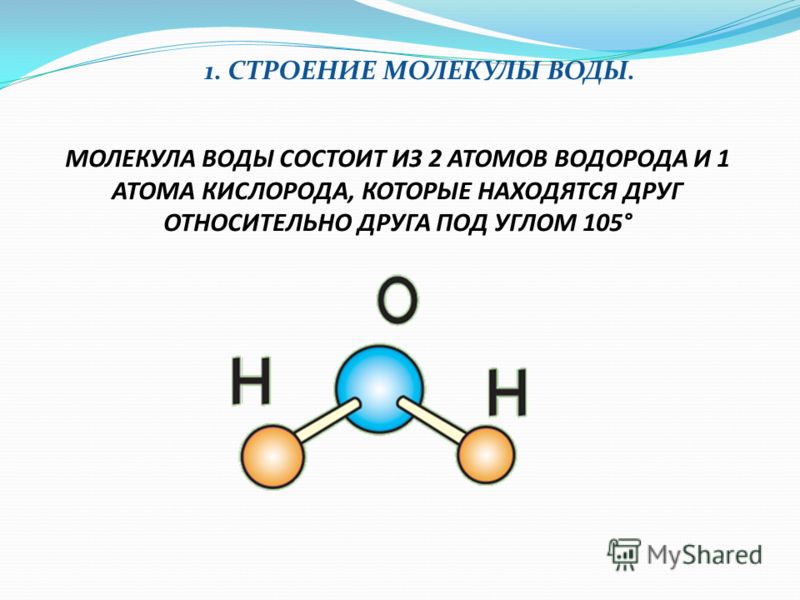
Это версия статьи, первоначально опубликованной в Положительно Нейпервилл . Майк Олброу — заслуженный ученый Фермилаб. Взгляды автора — его собственные.
Метки: астрофизика, Большой взрыв
2.1 Строительные блоки молекул – концепции биологии – 1-е канадское издание
Перейти к содержанию
Глава 2: Введение в химию жизни
К концу этого раздела вы сможете:
- Описать материю и элементы
- Описать взаимосвязь между протонами, нейтронами и электронами, а также способы, которыми электроны могут передаваться или делиться между атомами
Посмотрите видео об электронах и о том, как электроны в химических связях влияют на форму и функцию молекул.
На самом фундаментальном уровне жизнь состоит из материи . Материя занимает пространство и имеет массу. Вся материя состоит из элементов , веществ, которые не могут быть расщеплены или химически преобразованы в другие вещества.
Каждый элемент обозначается своим химическим символом (например, H, N, O, C и Na) и обладает уникальными свойствами. Эти уникальные свойства позволяют элементам комбинироваться и связываться друг с другом особым образом.
Атом — это наименьший компонент элемента, который сохраняет все химические свойства этого элемента. Например, один атом водорода обладает всеми свойствами элемента водорода, например, он существует в виде газа при комнатной температуре и связывается с кислородом, образуя молекулу воды. Атомы водорода не могут быть разбиты на что-то меньшее, сохраняя при этом свойства водорода. Если бы атом водорода был разбит на субатомные частицы, он бы больше не обладал свойствами водорода.
На самом базовом уровне все организмы состоят из комбинации элементов. Они содержат атомы, которые объединяются вместе, образуя молекулы. В многоклеточных организмах, таких как животные, молекулы могут взаимодействовать, образуя клетки, которые объединяются, образуя ткани, составляющие органы. Эти комбинации продолжаются до тех пор, пока не образуются целые многоклеточные организмы.
Все атомы содержат протонов , электронов и нейтронов . Единственным исключением является водород (H), который состоит из одного протона и одного электрона. Протон – это положительно заряженная частица, находящаяся в ядро (сердцевина атома) атома и имеет массу 1 и заряд +1. Электрон – это отрицательно заряженная частица, которая движется в пространстве вокруг ядра. Другими словами, он находится вне ядра. Он имеет пренебрежимо малую массу и имеет заряд -1.
Рисунок 2.2 Атомы состоят из протонов и нейтронов, находящихся внутри ядра, и электронов, окружающих ядро.
Нейтроны, как и протоны, находятся в ядре атома. Они имеют массу 1 и не имеют заряда. Положительные (протоны) и отрицательные (электроны) заряды уравновешивают друг друга в нейтральном атоме, который имеет нулевой суммарный заряд.
Поскольку протоны и нейтроны имеют массу 1, масса атома равна количеству протонов и нейтронов этого атома. Количество электронов не влияет на общую массу, потому что их масса очень мала.
Как было сказано ранее, каждый элемент имеет свои уникальные свойства. Каждый из них содержит разное количество протонов и нейтронов, что дает ему собственный атомный номер и массовое число. Атомный номер элемента равен количеству протонов, содержащихся в этом элементе. массовое число или атомная масса, это количество протонов плюс количество нейтронов этого элемента. Следовательно, можно определить количество нейтронов, вычитая атомный номер из массового числа.
Эти числа предоставляют информацию об элементах и о том, как они будут реагировать при объединении.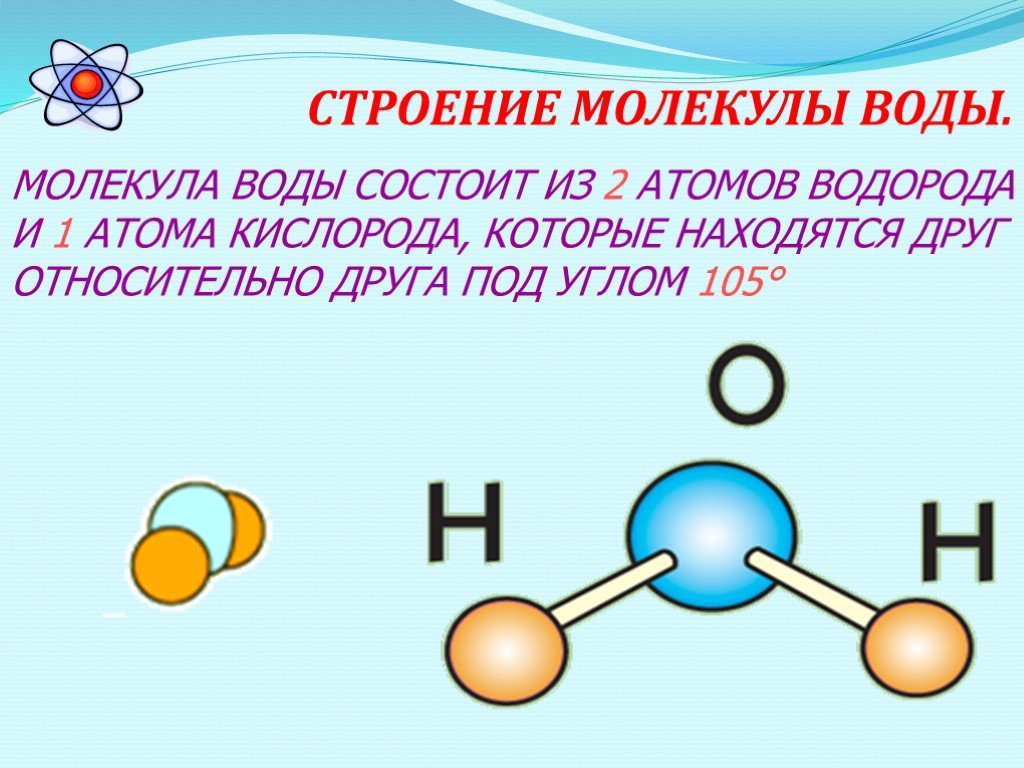 Различные элементы имеют разные температуры плавления и кипения и находятся в разных состояниях (жидком, твердом или газообразном) при комнатной температуре. Они также сочетаются по-разному. Некоторые образуют определенные типы связей, а другие нет. То, как они объединяются, зависит от количества присутствующих электронов. Из-за этих характеристик элементы расположены в периодическая таблица элементов , таблица элементов, которая включает атомный номер и относительную атомную массу каждого элемента. Периодическая таблица также предоставляет ключевую информацию о свойствах элементов, часто обозначаемых цветовой маркировкой. Расположение в таблице также показывает, как организованы электроны в каждом элементе, и дает важные сведения о том, как атомы будут реагировать друг с другом, образуя молекулы.
Различные элементы имеют разные температуры плавления и кипения и находятся в разных состояниях (жидком, твердом или газообразном) при комнатной температуре. Они также сочетаются по-разному. Некоторые образуют определенные типы связей, а другие нет. То, как они объединяются, зависит от количества присутствующих электронов. Из-за этих характеристик элементы расположены в периодическая таблица элементов , таблица элементов, которая включает атомный номер и относительную атомную массу каждого элемента. Периодическая таблица также предоставляет ключевую информацию о свойствах элементов, часто обозначаемых цветовой маркировкой. Расположение в таблице также показывает, как организованы электроны в каждом элементе, и дает важные сведения о том, как атомы будут реагировать друг с другом, образуя молекулы.
Изотопы — это разные формы одного и того же элемента, имеющие одинаковое количество протонов, но разное количество нейтронов. Некоторые элементы, такие как углерод, калий и уран, имеют природные изотопы.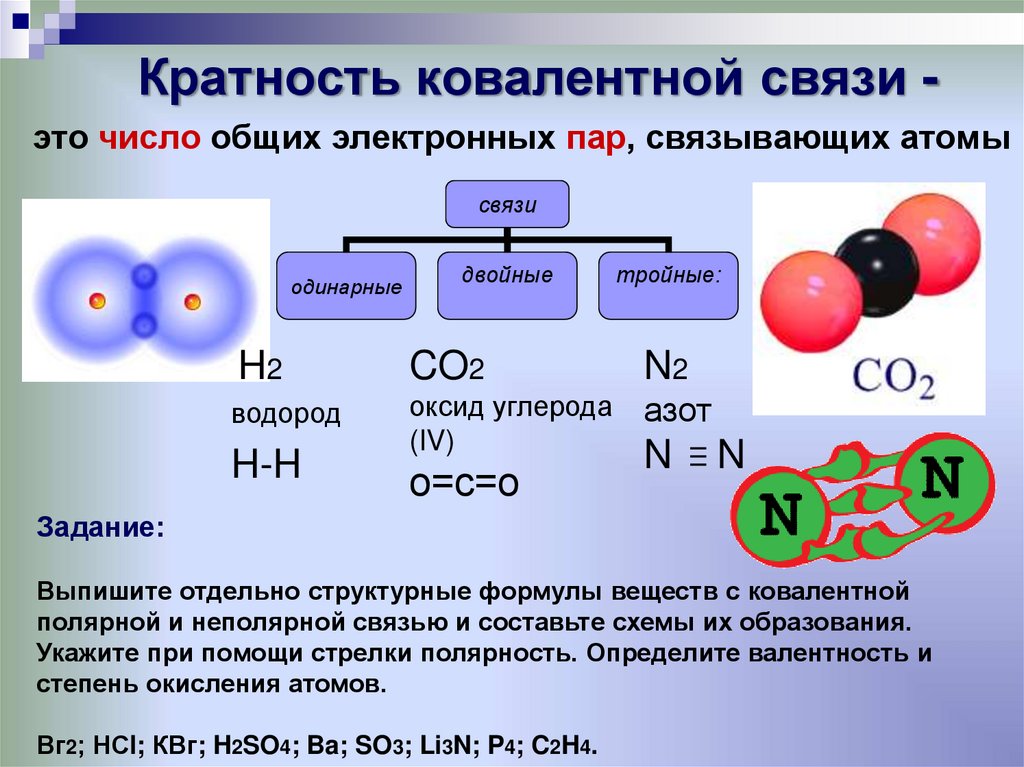 Углерод-12, наиболее распространенный изотоп углерода, содержит шесть протонов и шесть нейтронов. Следовательно, он имеет массовое число 12 (шесть протонов и шесть нейтронов) и атомный номер 6 (что делает его углеродом). Углерод-14 содержит шесть протонов и восемь нейтронов. Следовательно, он имеет массовое число 14 (шесть протонов и восемь нейтронов) и атомный номер 6, что означает, что это все еще элемент углерода. Эти две альтернативные формы углерода являются изотопами. Некоторые изотопы нестабильны и теряют протоны, другие субатомные частицы или энергию, образуя более стабильные элементы. Их называют радиоактивные изотопы или радиоизотопы.
Углерод-12, наиболее распространенный изотоп углерода, содержит шесть протонов и шесть нейтронов. Следовательно, он имеет массовое число 12 (шесть протонов и шесть нейтронов) и атомный номер 6 (что делает его углеродом). Углерод-14 содержит шесть протонов и восемь нейтронов. Следовательно, он имеет массовое число 14 (шесть протонов и восемь нейтронов) и атомный номер 6, что означает, что это все еще элемент углерода. Эти две альтернативные формы углерода являются изотопами. Некоторые изотопы нестабильны и теряют протоны, другие субатомные частицы или энергию, образуя более стабильные элементы. Их называют радиоактивные изотопы или радиоизотопы.

Сколько нейтронов имеют (K) калий-39 и калий-40 соответственно?
Эволюция в действии
Радиоуглеродный анализ
Радиоуглерод-14 ( 14 C) представляет собой встречающийся в природе радиоизотоп, который создается в атмосфере космическими лучами. Это непрерывный процесс, поэтому всегда создается больше 14 C. По мере развития живого организма относительный уровень 14 С в его организме равен концентрации 14 С в атмосфере. Когда организм умирает, он больше не поглощает 14 C, поэтому соотношение будет снижаться. 14 C распадается до 14 N в процессе, называемом бета-распадом; он выделяет энергию в этом медленном процессе.
Приблизительно через 5730 лет только половина исходной концентрации 14 C превратится в 14 N. Время, необходимое для того, чтобы половина исходной концентрации изотопа распалась до более стабильной формы называется периодом его полураспада. Поскольку период полураспада 14 C велик, его используют для определения возраста ранее живших объектов, таких как окаменелости. Используя отношение концентрации 14 С, обнаруженной в объекте, к количеству 14 С, обнаруженному в атмосфере, можно определить количество еще не распавшегося изотопа. Исходя из этого количества, возраст окаменелости можно рассчитать примерно до 50 000 лет. Изотопы с более длительным периодом полураспада, такие как калий-40, используются для расчета возраста более старых окаменелостей. С помощью углеродного датирования ученые могут реконструировать экологию и биогеографию организмов, живших в течение последних 50 000 лет.
Поскольку период полураспада 14 C велик, его используют для определения возраста ранее живших объектов, таких как окаменелости. Используя отношение концентрации 14 С, обнаруженной в объекте, к количеству 14 С, обнаруженному в атмосфере, можно определить количество еще не распавшегося изотопа. Исходя из этого количества, возраст окаменелости можно рассчитать примерно до 50 000 лет. Изотопы с более длительным периодом полураспада, такие как калий-40, используются для расчета возраста более старых окаменелостей. С помощью углеродного датирования ученые могут реконструировать экологию и биогеографию организмов, живших в течение последних 50 000 лет.
Концепция в действии
Чтобы узнать больше об атомах и изотопах и о том, как отличить один изотоп от другого, посетите этот сайт и запустите моделирование.
То, как элементы взаимодействуют друг с другом, зависит от того, как расположены их электроны и сколько отверстий для электронов существует в самой внешней области, где электроны присутствуют в атоме. Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может содержать до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем может быть заполнена любая другая оболочка. Водород имеет один электрон; поэтому у него занято только одно место в самой нижней оболочке. У гелия два электрона; поэтому он может полностью заполнить нижнюю оболочку своими двумя электронами. Если вы посмотрите на периодическую таблицу, то увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что у них есть только электроны в их первой оболочке. Водород и гелий — единственные два элемента, которые имеют самую нижнюю оболочку и не имеют других оболочек.
Второй и третий энергетические уровни могут содержать до восьми электронов. Восемь электронов расположены в четырех парах, и одна позиция в каждой паре заполняется электроном до того, как любые пары будут заполнены.
Восемь электронов расположены в четырех парах, и одна позиция в каждой паре заполняется электроном до того, как любые пары будут заполнены.
Снова взглянув на периодическую таблицу, вы заметите, что в ней семь строк. Эти строки соответствуют количеству оболочек, которые имеют элементы в этой строке. Элементы в определенной строке имеют увеличивающееся количество электронов по мере продвижения столбцов слева направо. Хотя каждый элемент имеет одинаковое количество оболочек, не все оболочки полностью заполнены электронами. Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne). Все они имеют электроны, которые занимают только первую и вторую оболочки. У лития только один электрон на внешней оболочке, у бериллия — два электрона, у бора — три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
Не у всех элементов достаточно электронов, чтобы заполнить их самые внешние оболочки, но атом наиболее стабилен, когда все электронные позиции в самой внешней оболочке заполнены.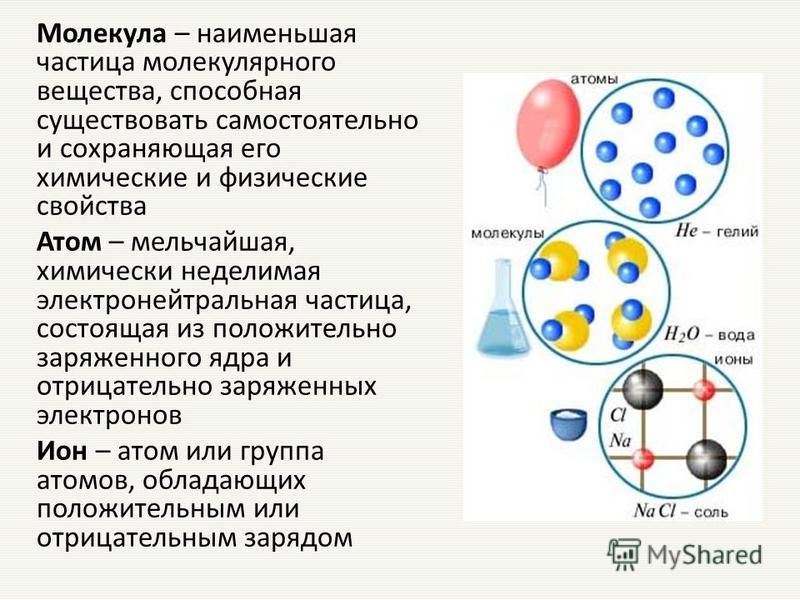 Из-за этих вакансий в самых внешних оболочках мы видим образование химических связей или взаимодействие между двумя или более одинаковыми или разными элементами, что приводит к образованию молекул. Для достижения большей стабильности атомы стремятся полностью заполнить свои внешние оболочки и для достижения этой цели будут связываться с другими элементами, делясь электронами, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку самые внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется 9.0058 правило октета . Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Из-за этих вакансий в самых внешних оболочках мы видим образование химических связей или взаимодействие между двумя или более одинаковыми или разными элементами, что приводит к образованию молекул. Для достижения большей стабильности атомы стремятся полностью заполнить свои внешние оболочки и для достижения этой цели будут связываться с другими элементами, делясь электронами, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку самые внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется 9.0058 правило октета . Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Если атом не содержит одинакового количества протонов и электронов, он называется ионом . Поскольку количество электронов не равно количеству протонов, каждый ион имеет суммарный заряд. Положительные ионы образуются в результате потери электронов и называются катионами . Отрицательные ионы образуются при присоединении электронов и называются анионы .
Положительные ионы образуются в результате потери электронов и называются катионами . Отрицательные ионы образуются при присоединении электронов и называются анионы .
Например, натрий имеет только один электрон на внешней оболочке. Натрию требуется меньше энергии, чтобы отдать один электрон, чем принять еще семь электронов, чтобы заполнить внешнюю оболочку. Если натрий потеряет электрон, у него теперь будет 11 протонов и только 10 электронов, в результате чего его общий заряд составит +1. Теперь его называют ионом натрия.
У атома хлора на внешней оболочке семь электронов. Опять же, для хлора более энергоэффективно получить один электрон, чем потерять семь. Следовательно, он стремится получить электрон, чтобы создать ион с 17 протонами и 18 электронами, что придает ему суммарный отрицательный (-1) заряд. Теперь его называют хлорид-ионом. Это движение электронов от одного элемента к другому называется электронный перенос . Как показано, атом натрия (Na) имеет только один электрон на внешней оболочке, тогда как атом хлора (Cl) имеет семь электронов на внешней оболочке. Атом натрия пожертвует свой один электрон, чтобы опустошить свою оболочку, а атом хлора примет этот электрон, чтобы заполнить свою оболочку, став хлоридом. Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки. Поскольку количество электронов больше не равно количеству протонов, каждый из них теперь является ионом и имеет заряд +1 (натрий) или -1 (хлорид).
Как показано, атом натрия (Na) имеет только один электрон на внешней оболочке, тогда как атом хлора (Cl) имеет семь электронов на внешней оболочке. Атом натрия пожертвует свой один электрон, чтобы опустошить свою оболочку, а атом хлора примет этот электрон, чтобы заполнить свою оболочку, став хлоридом. Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки. Поскольку количество электронов больше не равно количеству протонов, каждый из них теперь является ионом и имеет заряд +1 (натрий) или -1 (хлорид).
Ионные связи
Существует четыре типа связей или взаимодействий: ионные, ковалентные, водородные связи и взаимодействия Ван-дер-Ваальса. Ионные и ковалентные связи представляют собой сильные взаимодействия, которые требуют больших затрат энергии для разрыва. Когда элемент отдает электрон со своей внешней оболочки, как в приведенном выше примере с атомом натрия, образуется положительный ион.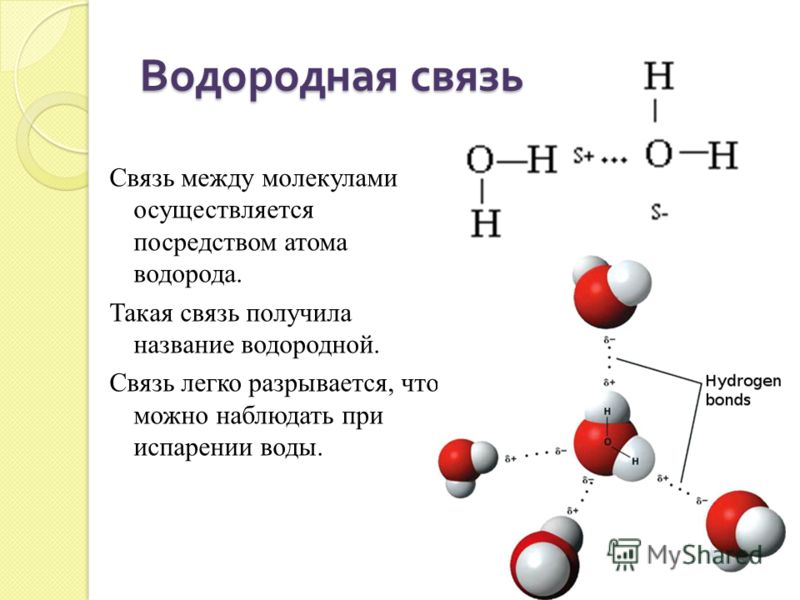 Элемент, принимающий электрон, теперь заряжен отрицательно. Поскольку положительные и отрицательные заряды притягиваются, эти ионы остаются вместе и образуют ионная связь или связь между ионами. Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда ионы Na + и Cl – объединяются с образованием NaCl, один электрон от атома натрия остается с другими семью электронами от атома хлора, а ионы натрия и хлорида притягиваются друг к другу в решетке ионов с чистым нулем. заряд.
Элемент, принимающий электрон, теперь заряжен отрицательно. Поскольку положительные и отрицательные заряды притягиваются, эти ионы остаются вместе и образуют ионная связь или связь между ионами. Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда ионы Na + и Cl – объединяются с образованием NaCl, один электрон от атома натрия остается с другими семью электронами от атома хлора, а ионы натрия и хлорида притягиваются друг к другу в решетке ионов с чистым нулем. заряд.
Ковалентные связи
Другим типом сильной химической связи между двумя или более атомами является ковалентная связь . Эти связи образуются, когда пара электронов делится между двумя элементами, и являются самой прочной и наиболее распространенной формой химической связи в живых организмах. Ковалентные связи образуются между элементами, из которых состоят биологические молекулы в наших клетках. В отличие от ионных связей, ковалентные связи не диссоциируют в воде.
В отличие от ионных связей, ковалентные связи не диссоциируют в воде.
Атомы водорода и кислорода, объединяясь в молекулы воды, связаны друг с другом ковалентными связями. Электрон из атома водорода делит свое время между внешней оболочкой атома водорода и незавершенной внешней оболочкой атома кислорода. Чтобы полностью заполнить внешнюю оболочку атома кислорода, необходимы два электрона от двух атомов водорода, отсюда индекс «2» в H 2 O. Электроны делятся между атомами, деля свое время между собой, чтобы «заполнить» внешнюю оболочку каждого. Это совместное использование представляет собой более низкое энергетическое состояние для всех вовлеченных атомов, чем если бы они существовали без заполненных внешних оболочек.
Ковалентные связи бывают двух типов: полярные и неполярные. Неполярные ковалентные связи образуются между двумя атомами одного и того же элемента или между разными элементами, которые делят электроны поровну. Например, атом кислорода может соединиться с другим атомом кислорода, чтобы заполнить их внешние оболочки.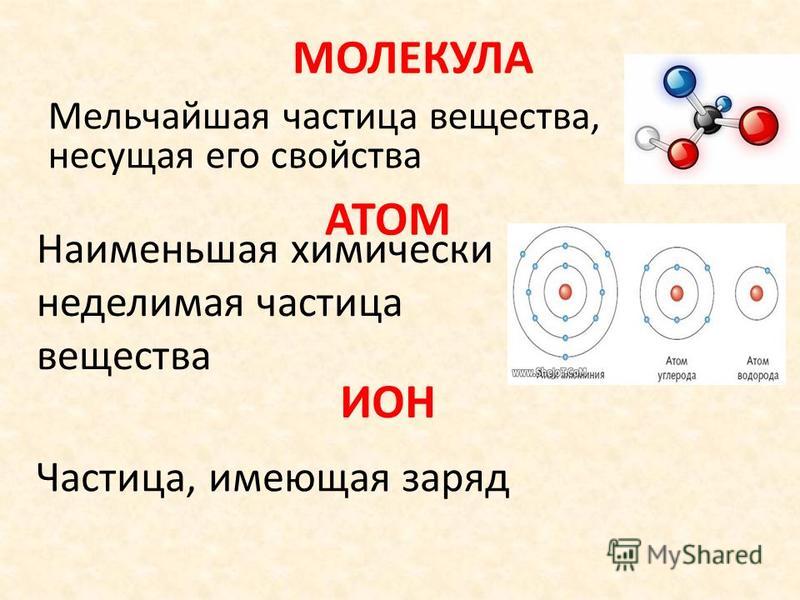 Эта ассоциация неполярна, потому что электроны будут равномерно распределены между каждым атомом кислорода. Две ковалентные связи образуются между двумя атомами кислорода, потому что кислороду требуется два общих электрона, чтобы заполнить его внешнюю оболочку. Атомы азота образуют три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи находится в метане (CH 4 ) молекула. Атом углерода имеет четыре электрона на внешней оболочке и нуждается в еще четырех электронах, чтобы заполнить ее. Он получает эти четыре из четырех атомов водорода, каждый атом дает один. Все эти элементы делят электроны поровну, создавая четыре неполярные ковалентные связи.
Эта ассоциация неполярна, потому что электроны будут равномерно распределены между каждым атомом кислорода. Две ковалентные связи образуются между двумя атомами кислорода, потому что кислороду требуется два общих электрона, чтобы заполнить его внешнюю оболочку. Атомы азота образуют три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи находится в метане (CH 4 ) молекула. Атом углерода имеет четыре электрона на внешней оболочке и нуждается в еще четырех электронах, чтобы заполнить ее. Он получает эти четыре из четырех атомов водорода, каждый атом дает один. Все эти элементы делят электроны поровну, создавая четыре неполярные ковалентные связи.
В полярной ковалентной связи электроны, общие для атомов, проводят больше времени ближе к одному ядру, чем к другому ядру. Из-за неравномерного распределения электронов между разными ядрами возникает слегка положительный (δ+) или слегка отрицательный (δ–) заряд.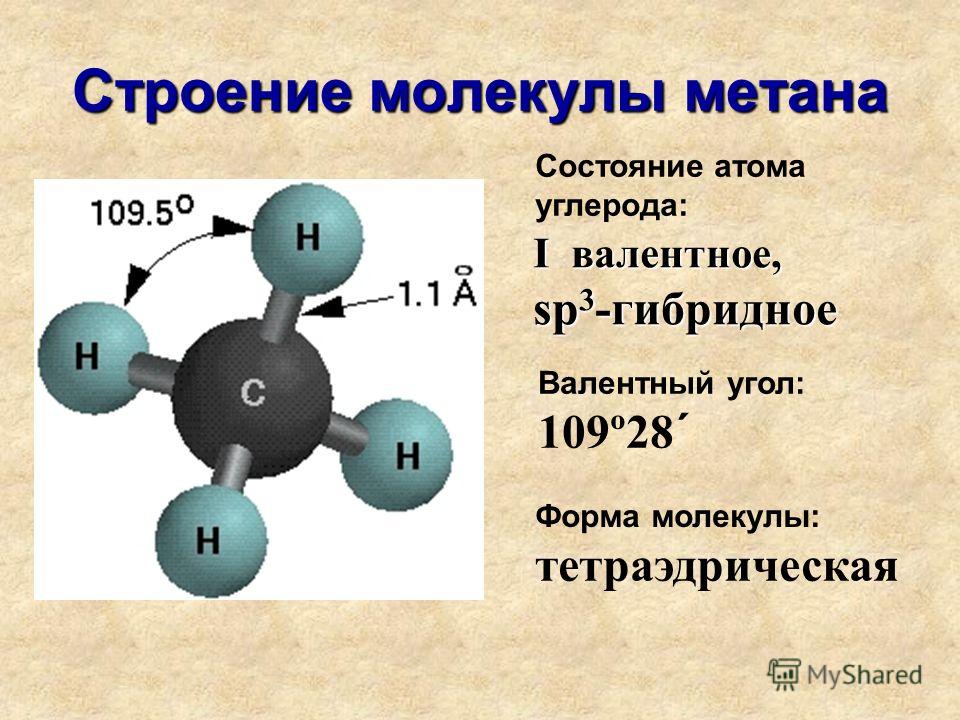 Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени возле ядра кислорода, придавая ему небольшой отрицательный заряд, чем возле ядер водорода, придавая этим молекулам небольшой положительный заряд.
Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени возле ядра кислорода, придавая ему небольшой отрицательный заряд, чем возле ядер водорода, придавая этим молекулам небольшой положительный заряд.
Водородные связи
Ионные и ковалентные связи являются сильными связями, для разрыва которых требуется значительная энергия. Однако не все связи между элементами являются ионными или ковалентными связями. Также могут образовываться более слабые связи. Это притяжения, возникающие между положительными и отрицательными зарядами, для разрыва которых не требуется много энергии. Часто встречаются две слабые связи: водородные связи и ван-дер-ваальсовы взаимодействия. Эти связи обуславливают уникальные свойства воды и уникальные структуры ДНК и белков.
Когда образуются полярные ковалентные связи, содержащие атом водорода, атом водорода в этой связи имеет слегка положительный заряд.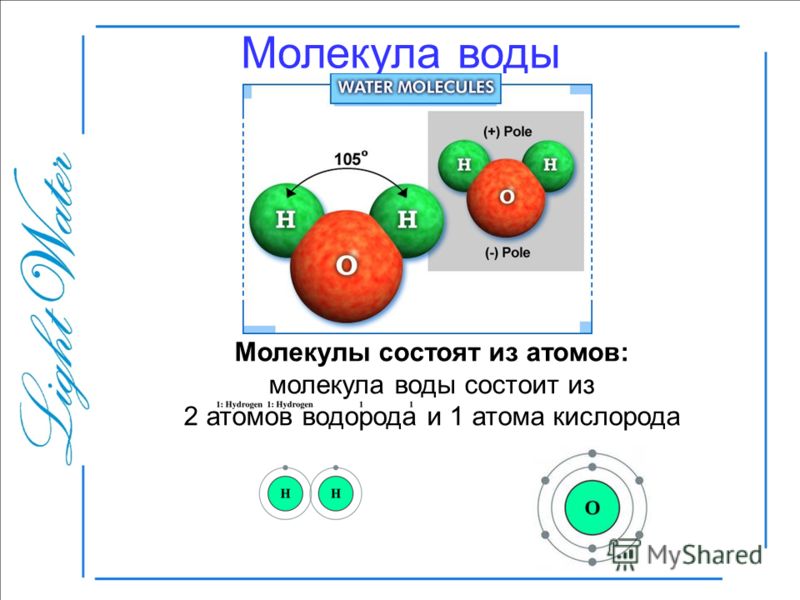 Это связано с тем, что общий электрон сильнее притягивается к другому элементу и от ядра водорода. Поскольку атом водорода слегка положителен (δ+), он будет притягиваться к соседним отрицательным частичным зарядам (δ–). При этом происходит слабое взаимодействие между δ+ зарядом атома водорода одной молекулы и δ– зарядом другой молекулы. Это взаимодействие называется водородной связью. Этот тип связи распространен; например, жидкая природа воды обусловлена водородными связями между молекулами воды. Водородные связи придают воде уникальные свойства, поддерживающие жизнь. Если бы не водородные связи, вода была бы газом, а не жидкостью при комнатной температуре.
Это связано с тем, что общий электрон сильнее притягивается к другому элементу и от ядра водорода. Поскольку атом водорода слегка положителен (δ+), он будет притягиваться к соседним отрицательным частичным зарядам (δ–). При этом происходит слабое взаимодействие между δ+ зарядом атома водорода одной молекулы и δ– зарядом другой молекулы. Это взаимодействие называется водородной связью. Этот тип связи распространен; например, жидкая природа воды обусловлена водородными связями между молекулами воды. Водородные связи придают воде уникальные свойства, поддерживающие жизнь. Если бы не водородные связи, вода была бы газом, а не жидкостью при комнатной температуре.
Водородные связи могут образовываться между различными молекулами, и они не всегда должны включать молекулу воды. Атомы водорода в полярных связях внутри любой молекулы могут образовывать связи с другими соседними молекулами. Например, водородные связи удерживают вместе две длинные нити ДНК, придавая молекуле ДНК ее характерную двухцепочечную структуру. Водородные связи также ответственны за некоторую часть трехмерной структуры белков.
Например, водородные связи удерживают вместе две длинные нити ДНК, придавая молекуле ДНК ее характерную двухцепочечную структуру. Водородные связи также ответственны за некоторую часть трехмерной структуры белков.
Взаимодействия Ван-дер-Ваальса
Подобно водородным связям, ван-дер-ваальсовые взаимодействия представляют собой слабое притяжение или взаимодействие между молекулами. Они возникают между полярными, ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, образующимися при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах.
Специалисты по рентгенографии
Проходили ли вы или кто-либо из ваших знакомых магнитно-резонансную томографию (МРТ), маммографию или рентген? Эти тесты производят изображения ваших мягких тканей и органов (как при МРТ или маммографии) или ваших костей (как это происходит в рентгеновском снимке) с использованием либо радиоволн, либо специальных изотопов (помеченных радиоактивным или флуоресцентным маркером), которые проглатываются или вводятся внутривенно. тело. Эти тесты предоставляют данные для диагностики заболеваний путем создания изображений ваших органов или скелетной системы.
тело. Эти тесты предоставляют данные для диагностики заболеваний путем создания изображений ваших органов или скелетной системы.
МРТ работает, подвергая ядра водорода, которых много в воде в мягких тканях, флуктуирующим магнитным полям, которые заставляют их излучать собственное магнитное поле. Затем этот сигнал считывается датчиками машины и интерпретируется компьютером для формирования подробного изображения.
Некоторые технологи и техники рентгенографии специализируются на компьютерной томографии, МРТ и маммографии. Они производят фильмы или изображения тела, которые помогают медицинским работникам исследовать и ставить диагноз. Рентгенологи работают непосредственно с пациентами, объясняя работу механизмов, готовя их к обследованиям и следя за тем, чтобы их тело или части тела располагались правильно для получения необходимых изображений. Затем врачи или рентгенологи анализируют результаты теста.
Специалисты по рентгенографии могут работать в больницах, кабинетах врачей или специализированных центрах визуализации. Обучение на техника-рентгенолога происходит в больницах, колледжах и университетах, которые предлагают сертификаты, степени младшего специалиста или бакалавра в области рентгенографии.
Обучение на техника-рентгенолога происходит в больницах, колледжах и университетах, которые предлагают сертификаты, степени младшего специалиста или бакалавра в области рентгенографии.
Материя — это все, что занимает пространство и имеет массу. Он состоит из атомов различных элементов. Все 92 элемента, которые встречаются в природе, обладают уникальными свойствами, которые позволяют им комбинироваться различными способами для создания соединений или молекул. Атомы, состоящие из протонов, нейтронов и электронов, являются мельчайшими единицами элемента, сохраняющими все свойства этого элемента. Электроны могут быть пожертвованы или разделены между атомами для создания связей, включая ионные, ковалентные и водородные связи, а также взаимодействия Ван-дер-Ваальса.
анион : отрицательный ион, образованный при присоединении электронов
атомный номер : число протонов в атоме
катион: положительный ион, образованный при отдаче электронов
: 5 взаимодействие между двумя химическими связями или нескольких одинаковых или разных элементов, что приводит к образованию молекул
ковалентная связь: тип сильной связи между двумя или более одинаковыми или разными элементами; образуется, когда электроны делятся между элементами
электрон: отрицательно заряженная частица, находящаяся вне ядра на электронной орбитали; не имеет функциональной массы и имеет заряд –1
перенос электронов: движение электронов от одного элемента к другому
элемент: одно из 118 уникальных веществ, которые не могут быть разбиты на более мелкие вещества и сохраняют свойство это вещество; каждый элемент имеет определенное количество протонов и уникальные свойства
водородная связь: слабая связь между частично положительно заряженными атомами водорода и частично отрицательно заряженными элементами или молекулами.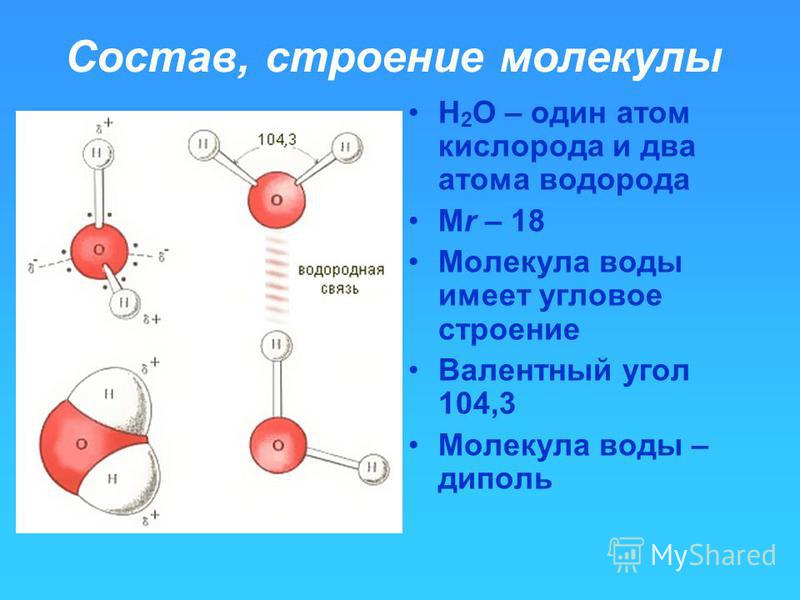
ионная связь: химическая связь, которая образуется между ионами с противоположными зарядами
изотоп: одна или несколько форм элемента с разным числом нейтронов
массовое число: количество протонов и нейтронов в атоме
материя: все, что имеет массу и занимает пространство
нейтрон: частица без заряда, которая находится в ядре атома; имеет массу 1
неполярная ковалентная связь: тип ковалентной связи, которая образуется между атомами, когда электроны распределяются поровну между атомами, что приводит к отсутствию областей с частичными зарядами, как в полярных ковалентных связях
ядро: (химия) плотный центр атома, состоящий из протонов и (за исключением атома водорода) нейтронов
правило октета: утверждает, что самая внешняя оболочка элемента с число может содержать восемь электронов
периодическая таблица элементов: организационная схема элементов с указанием атомного номера и массового числа каждого элемента; также предоставляет ключевую информацию о свойствах элементов
полярная ковалентная связь: тип ковалентной связи, при которой электроны притягиваются к одному атому и от другого, что приводит к образованию слегка положительно и слегка отрицательно заряженных областей молекулы
протон: положительно заряженная частица, которая находится в ядро атома; имеет массу 1 и заряд +1
радиоактивный изотоп: изотоп, который спонтанно испускает частицы или энергию для образования более стабильного элемента
Ван-дер-Ваальсово взаимодействие : слабое притяжение или взаимодействие между молекулами, вызванное слегка положительно заряженными или слегка отрицательно заряженными атомами
Атрибуция СМИ
- Рисунок 2.




 Из двух атомов кислорода и одного атома водорода
Из двух атомов кислорода и одного атома водорода
