§1. Теория химического строения органических соединений А.М. Бутлерова — ЗФТШ, МФТИ
Александр Михайлович Бутлеров — профессор Казанского университета, академик, создатель теории химического строения органических соединений. На основе этой теории предсказал и впервые синтезировал ряд новых соединений. Понятие «химическое строение» в теории является ключевым. А. М. Бутлеров определял «химичес-кое строение» как последовательность соединения атомов в молекуле.
Другим значимым аспектом теории А. М. Бутлерова стало утверждение, что химическое строение веществ можно установить опытным путём химическими методами и отразить в формуле.
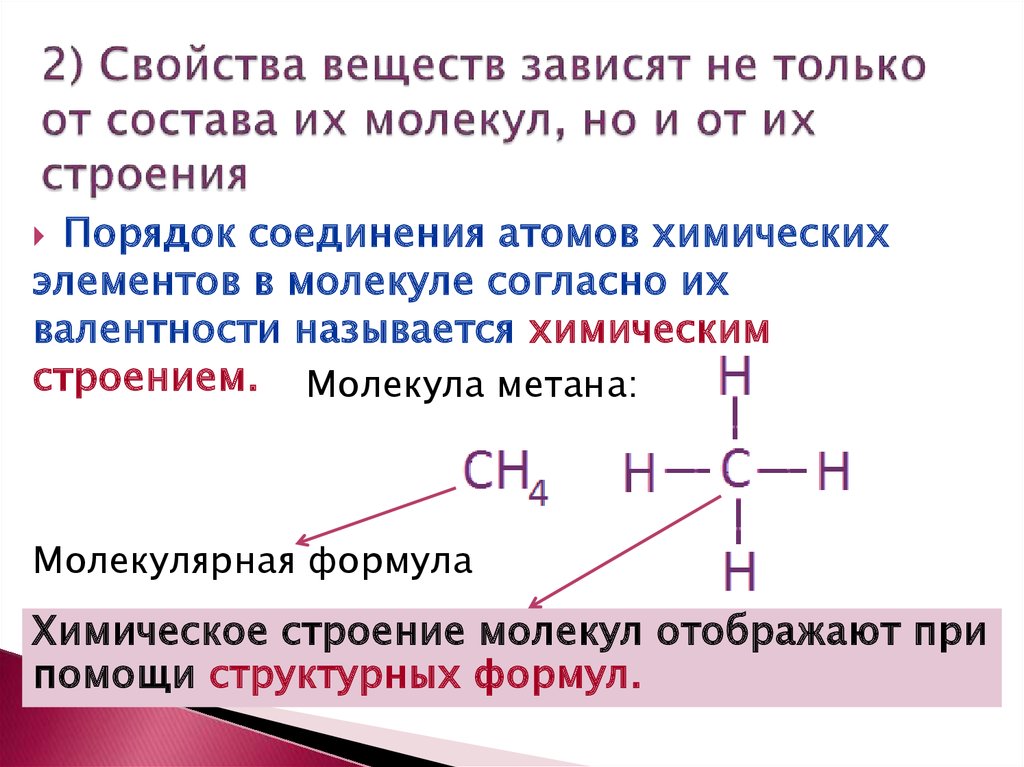
Структуры органических соединений отображаются химическими формулами, в которых показан порядок соединения атомов в молекулах. Такие формулы называют формулами химического строения или структурными формулами.
Структурные формулы отображают только последовательность соединения атомов, но не расположение их в пространстве.
Каждая структурная формула отображает строение одной и той же молекулы пропана, т.
Структурные формулы веществ обычно изображают в сокращённом виде `»CH»_3-«CH»_2-«CH»_3`. В сокращённых формулах чёрточки показывают связь атомов углерода друг с другом, но не показывают связи между атомами углерода и водорода. Начиная с бутана возможен различный порядок соединения атомов при одном и том же составе молекулы, т. е. в бутане атомы углерода могут располагаться в виде линейной и разветвлённой цепей.
`»C»-«C»-«C»-«C»`
В первом случае каждый атом углерода соединён с одним (если он концевой) или с двумя (если он находится внутри цепи) соседними атомами углерода; во втором случае – появляется атом углерода, соединённый с тремя соседними атомами углерода. Различному порядку связывания атомов при одном и том же качественном и количественном составе молекулы должны соответствовать разные вещества.
Бутан линейного строения и изобутан различаются температурами кипения.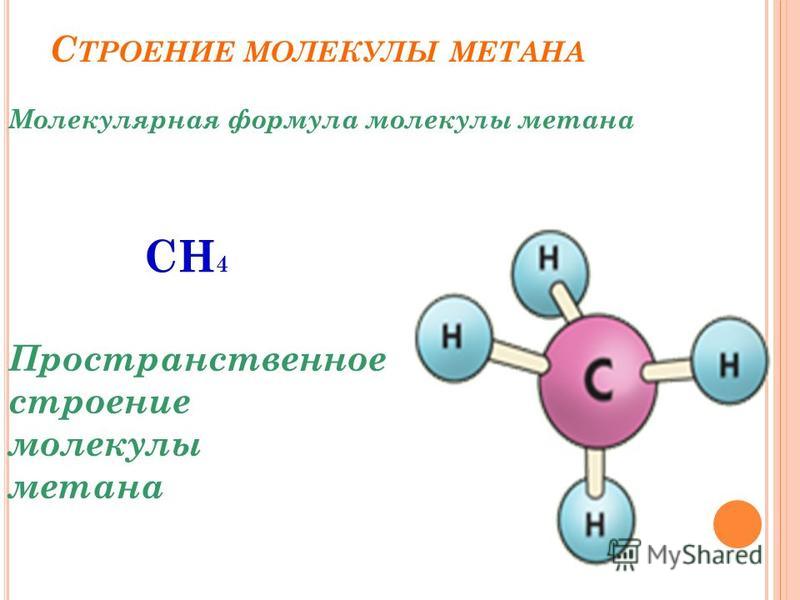 @»C»`)
@»C»`)
С увеличением числа атомов углерода в молекуле число возможных изомеров резко возрастает. Различия в химическом строении являются причиной проявления изомерами различных физико-химических свойств.
Теория А. М. Бутлерова завоевала признание. Значение теории химического строения А. М. Бутлерова можно сравнить с Периодическим законом и Периодической системой химических элементов Д. И. Менделеева.
Для изображения электронного строения молекул используются электронные формулы (структуры Льюиса, октетные формулы). При написании электронной формулы должно выполняться правило октета, согласно которому атом, участвуя в образовании химической связи (отдавая или принимая электроны), стремится приобрести электронную конфигурацию инертного газа — октет (восемь) валентных электронов. Исключение составляет атом водорода, для которого устойчивой является конфигурация гелия, т. е. два валентных электрона.
Общую пару электронов иногда обозначают чёрточкой, которая и символизирует внутримолекулярную химическую связь:
Из чего состоят молекулы? — «Как и Почему»
Содержание:
Известно, что все вещества состоят из молекул. Классическая теория химического строения вещества рассматривает молекулу как самую маленькую постоянную частицу, которой присущи все его свойства. Но из чего состоят сами молекулы? Давайте рассмотрим этот вопрос подробнее.
Классическая теория химического строения вещества рассматривает молекулу как самую маленькую постоянную частицу, которой присущи все его свойства. Но из чего состоят сами молекулы? Давайте рассмотрим этот вопрос подробнее.
Что такое молекула?
Название «молекула» происходит от латинского molecula – это уменьшительное от слова moles (в переводе масса). Впервые их существование было доказано в эксперименте в 1906 г. Ж. Перреном, французским физиком, когда он изучал броуновское движение.
Жан Батист Перрен с «мега-спектроскопом» в Институте Кюри. 1927 г.В химии так называется отдельная частица вещества, которая состоит из 2 или больше атомов, связанных между собой ковалентными связями. Квантовая механика определяет ее как систему, состоящую не из атомов, а из их ядер и электронов, с ними взаимодействующих.
Интересный факт: физика называет молекулами не только многоатомные частицы, но и одноатомные, состоящие из атомов, не соединенных между собой химическими связями (чистая ртуть или инертные газы). В этом случае понятия «молекула» и «атом» совмещаются.
В этом случае понятия «молекула» и «атом» совмещаются.
Обыкновенно молекулы электрически нейтральны, так как число протонов и электронов в них одинаково, но бывают молекулы, имеющие электрический заряд (называются они ионы).
Частицы вещества с большой молекулярной массой получили название макромолекулы. Из них состоят протеины, нуклеиновые кислоты, ферменты, полисахариды, аминокислоты, сложные липиды и отдельные созданные искусственно соединения, например, полимеры. Они включают в себя сотни и тысячи атомов. Производные углеводородов – органические вещества и биополимеры, как правило, не только имеют большую массу, но и устроены сложнее, чем неорганические соединения.
Строение молекул
У молекулы какого-либо соединения состав неизменный, в ней всегда одинаковое число атомов, химические свойства зависят от валентных связей, их скрепляющих. Классическая теория рассматривает молекулу как динамическую структуру, состоящую из ядер атомов и их групп и некоторого числа электронов, находящихся на внутренних и внешних уровнях.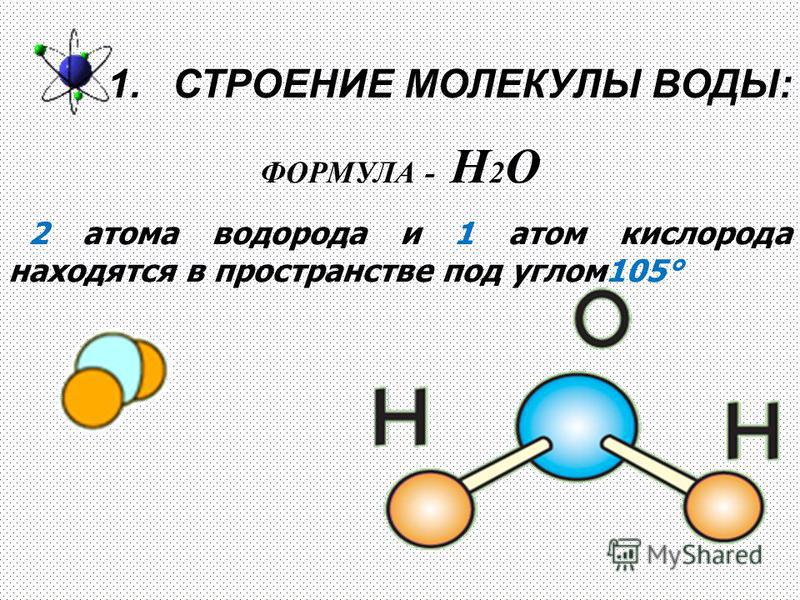
Химические связи образуют обычно только внешние электроны. Связь создается 1,2 или 3 парами электронов 2 соседних атомов (в результате чего появляется электронное облако). Энергия взаимодействия атомов зависит от дистанции, на которой они находятся, и способствует стабильности молекулы при обычных условиях: она не дает атомам чересчур сближаться.
Атомы могут быть заряжены положительно и отрицательно, их число всегда постоянно. На строение и состав молекул определенного вещества не влияет то, как оно было получено, то есть искусственно произведенное вещество будет точно таким же, как и натуральное.
Молекулярный состав записывается с помощью химических формул. Строение определяет, какими физическими свойствами будет обладать вещество.
Интересный факт: органические вещества, вода, углекислый газ плавятся и кипят при относительно низких температурах, сохраняют свою структуру и в твердом состоянии. Многие неорганические вещества состоят не из молекул, а атомов (кристаллы, чистые металлы и др.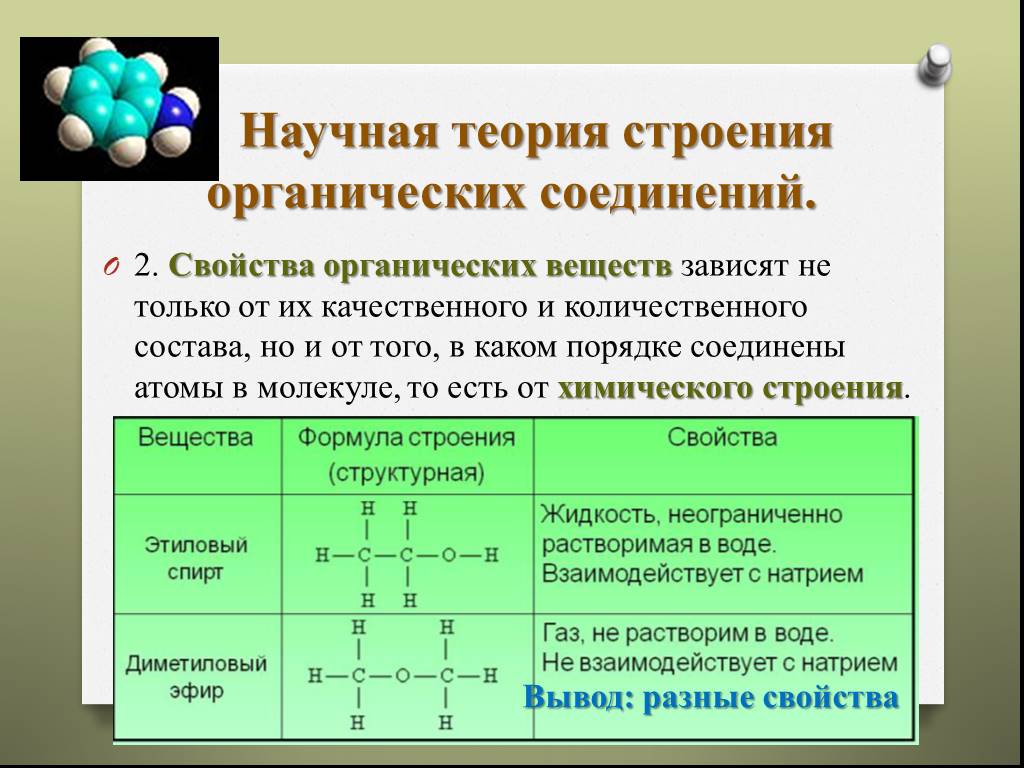 ).
).
Молекулы в науке
В химии это основное понятие, молекулярное строение определяется исходя из химических реакций с веществом. Также можно, зная строение, установить, какими будут реакции. В результате химических исследований получена основная доля знаний о молекулярной функциональности и строении.
Строением в физике объясняются физические свойства жидкостей, газов и твердых тел. Подвижность молекул определяет, как быстро вещество способно проникать в другое при соприкосновении, уровень вязкости и показатель теплопроводности.
В биологии молекулярные свойства и пространственное строение имеют первостепенное значение, так как все живое функционирует благодаря тонкому балансу взаимодействия между молекулами (химического и нехимического).
На вопрос, из чего состоят молекулы, можно ответить так – из определенного числа атомов, соединенных вместе химическими связями. Из молекул состоят все вещества на планете, физические и химические свойства которых определяются строением и составом молекул.
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Что такое молекула?
По
- Гэвин Райт
Молекула – это два или более атома, соединенных химическими связями, которые образуют наименьшую единицу вещества, сохраняющую состав и свойства этого вещества. Молекулы составляют основу химии. Молекулы отмечены символом элемента и нижним индексом с количеством атомов.
Атомы являются основной единицей элемента. Они состоят из ядра и окружающих его электронов. Когда атом имеет неполную электронную оболочку, говорят, что он имеет валентные электроны. Когда два или более атома объединяются, чтобы разделить валентные электроны внешней оболочки, образуется химическая (ковалентная) связь, и они переходят в более низкое энергетическое состояние.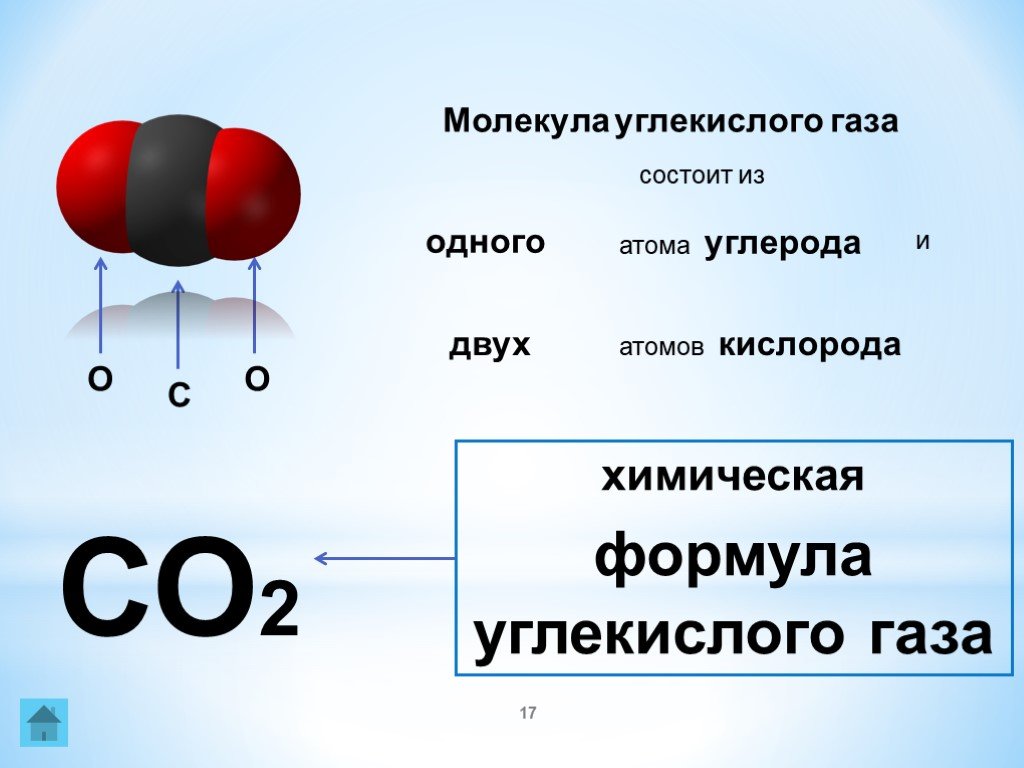
Двухатомные молекулы — это когда объединяются только два атома. Примером двухатомной молекулы является монооксид углерода (СО), состоящий из одного атома углерода и одного атома кислорода. Если два атома представляют собой один и тот же элемент, он называется
Атомы могут объединяться в молекулы разными способами. Одни и те же атомы могут соединяться в разных пропорциях, образуя разные молекулы. Например, два атома водорода и один атом кислорода образуют воду (H 2 O), а два атома водорода и два атома кислорода образуют перекись водорода (H 2 O 2 ).
Молекулярная масса молекулы представляет собой сумму атомных масс всех составляющих ее атомов. Число Авогадро (6,02214076 × 10 23 ) — это число молекул, которое составляет атомный вес молекулы в граммах (г). Например, вода — это два атома водорода массой 1 г каждый и один атом кислорода массой 16 г, а это означает, что один моль молекул воды весит 18 г.
Слово «молекула» происходит от латинского molecula , означающего единицу массы. Это название должно было охватывать его первоначальное значение «наименьшая единица вещества, которая все еще сохраняет свойства этого вещества». В 1873 году Джеймс Максвелл определил атом и молекулу: «Атом — это тело, которое нельзя разрезать пополам; молекула — это наименьшая возможная часть определенного вещества». Поскольку молекулы были названы до того, как была открыта их истинная природа, это привело к тому, что сейчас определение является неточным и обсуждаемым.
Поскольку молекулы были названы до того, как была открыта их истинная природа, это привело к тому, что сейчас определение является неточным и обсуждаемым.
Молекулы составляют основу химии
Немолекулярные соединенияМногие соединения не подходят под строгое определение молекулы, но широко распространены в химии и повседневной жизни. Некоторыми примерами структур, не являющихся молекулярными по своей природе, являются кристаллы, минералы и металлы.
Благородные газы — это элементы, не имеющие валентных электронов и, следовательно, не нуждающиеся в образовании ковалентных связей, чтобы стать стабильными. Некоторые могут считать их молекулой, состоящей всего из одного атома.
В солях и ионных связях нет обычных ковалентных связей, поэтому они не считаются молекулами. Например, поваренная соль (хлорид натрия) образует решетчатую структуру, удерживаемую ионными связями. В ионной связи электроны могут быть общими для многих атомов, а не только для двух, как в ковалентной связи. Эти химические связи не приводят к четкому разделению отдельных молекул. Эти химические структуры выражаются в виде соотношений составляющих их элементов.
Эти химические связи не приводят к четкому разделению отдельных молекул. Эти химические структуры выражаются в виде соотношений составляющих их элементов.
Металлы не используют ковалентные связи и не считаются молекулами. Вместо этого они образуют металлические связи, в которых свободные валентные электроны распределяются между всеми различными атомами в делокализованных электронных облаках. Электроны могут свободно перемещаться по всей структуре, а не быть локализованными.
См. Также: Matter , GAS , Сплошной , Плазма и Liquid .
Последнее обновление: июнь 2022 г.
Продолжить чтение о молекуле- Молекулярная память может повысить плотность жесткого диска
- Что нужно знать о хранении данных ДНК сегодня
- Стохастические точечные процессы и их практическое значение
- Технология искусственного интеллекта COVID-19 поддерживает социальное дистанцирование и цепочки поставок
- Исследователи NUS разработали устройство памяти на основе мозга
встроенное устройство
Встроенное устройство является частью более крупной вычислительной системы и имеет определенное назначение.
ПоискСеть
- беспроводная ячеистая сеть (WMN)
Беспроводная ячеистая сеть (WMN) — это ячеистая сеть, созданная путем соединения узлов беспроводной точки доступа (WAP), установленных в …
- Wi-Fi 7
Wi-Fi 7 — это ожидаемый стандарт 802.11be, разрабатываемый IEEE.
- сетевая безопасность
Сетевая безопасность охватывает все шаги, предпринятые для защиты целостности компьютерной сети и данных в ней.
ПоискБезопасность
- Что такое модель безопасности с нулевым доверием?
Модель безопасности с нулевым доверием — это подход к кибербезопасности, который по умолчанию запрещает доступ к цифровым ресурсам предприятия и …
- RAT (троянец удаленного доступа)
RAT (троян удаленного доступа) — это вредоносное ПО, которое злоумышленник использует для получения полных административных привилегий и удаленного управления целью .
 ..
.. - атака на цепочку поставок
Атака на цепочку поставок — это тип кибератаки, нацеленной на организации путем сосредоточения внимания на более слабых звеньях в организации …
ПоискCIO
- пространственные вычисления
Пространственные вычисления широко характеризуют процессы и инструменты, используемые для захвата, обработки и взаимодействия с трехмерными данными.
- Пользовательский опыт
Дизайн взаимодействия с пользователем (UX) — это процесс и практика, используемые для разработки и внедрения продукта, который будет обеспечивать положительные и …
- соблюдение конфиденциальности
Соблюдение конфиденциальности — это соблюдение компанией установленных правил защиты личной информации, спецификаций или …
SearchHRSoftware
- Поиск талантов
Привлечение талантов — это стратегический процесс, который работодатели используют для анализа своих долгосрочных потребностей в талантах в контексте бизнеса .
 ..
.. - удержание сотрудников
Удержание сотрудников — организационная цель сохранения продуктивных и талантливых работников и снижения текучести кадров за счет стимулирования …
- гибридная рабочая модель
Гибридная модель работы — это структура рабочей силы, включающая сотрудников, работающих удаленно, и тех, кто работает на месте, в офисе компании…
SearchCustomerExperience
- CRM (управление взаимоотношениями с клиентами) аналитика
Аналитика CRM (управление взаимоотношениями с клиентами) включает в себя все программы, которые анализируют данные о клиентах и представляют…
- разговорный маркетинг
Диалоговый маркетинг — это маркетинг, который привлекает клиентов посредством диалога.
- цифровой маркетинг
Цифровой маркетинг — это общий термин для любых усилий компании по установлению связи с клиентами с помощью электронных технологий.

Сравнить-Контраст-Соединить: Химические структуры — Визуализация невидимого
Сравнить-Контрастировать-Соединить: Химические структуры — Визуализация невидимого | manoa.hawaii.edu/ExploringOurFluidEarthПерейти к основному содержанию
Версия для печати
NGSS Научная и инженерная практика:
Химия может быть трудной для понимания темой, отчасти потому, что трудно представить себе структуру и форму атомов и молекул. Со временем способ моделирования молекул изменился. Каждое молекулярное представление имеет свои преимущества и недостатки, но каждое из них способствует способности ученых понимать химию. В таблице SF 2.2 показаны четыре различные модели, используемые для демонстрации молекулы бутана (C 4 Н 10 ).
Точечные структуры Льюиса представляют собой двумерные представления молекул, которые иллюстрируют каждый атом как его химический символ. Линии обозначают связи с другими атомами, а несвязывающие электроны представлены маленькими точками рядом с химическими символами.
Линии обозначают связи с другими атомами, а несвязывающие электроны представлены маленькими точками рядом с химическими символами.
Обозначение линий связи показывает выбранные атомы в виде их химических символов, при этом некоторые атомы углерода изображаются в виде углов между линиями и опускаются атомы водорода, которые, как предполагается, входят в структуру. Обозначение линии связи преимущественно используется в органической химии (химия, связанная с живыми существами).
Модели шаров и палочек — это трехмерные модели, в которых атомы представлены сферами разного цвета, а связи представлены палочками между сферами. Определенные атомы связаны с разными цветами, например, черный цвет обычно используется для обозначения углерода, а белый — для обозначения водорода.
Модели заполнения пространства аналогичны моделям мяча и палки в том смысле, что они представляют собой трехмерные модели, представляющие атомы в виде цветных сфер. Разница между ними заключается в том, что вместо палочек, представляющих связи, как в модели шара и палочки, сферы, представляющие атомы, сплавлены вместе, а размер сферы представляет собой размер фактического атома.
Разница между ними заключается в том, что вместо палочек, представляющих связи, как в модели шара и палочки, сферы, представляющие атомы, сплавлены вместе, а размер сферы представляет собой размер фактического атома.
| Модель | Представительство | Преимущества | Недостатки |
|---|---|---|---|
| Льюис Дот | Показывает связывающие и несвязывающие электроны. | Более крупные молекулы могут стать скучными и запутанными. | |
| Обозначение линии облигаций | Упрощает большие структуры, выделяя важные атомы, связи и группы. | Атомы иногда могут быть забыты в структурах, когда предполагается, что они там есть. | |
| Мяч и клюшка | Показывает трехмерное расположение атомов и связей. | Для идентификации атомов требуется ключ цветового представления. | |
| Заполнение пространства | Показывает трехмерное расположение, а также соотношение размеров атомов. | Связи между атомами иногда трудно различить. |
Эти четыре модели представляют собой некоторые из наиболее распространенных моделей, используемых для представления молекул, но они не единственные модели, используемые учеными. Некоторые модели являются узкоспециализированными и используются учеными определенного типа. Например, биохимики и биологи используют систему моделирования, называемую моделированием ленточных белков, для представления больших и сложных молекул, называемых белками.
Набор вопросов:
- Исследуйте и нарисуйте точечную структуру Льюиса, обозначение шариковой линии, модель шара и стержня и модель заполнения пространства для каждой из следующих молекул.



 ..
.. ..
..