Курс общей химии
Курс общей химии
ОглавлениеПРЕДИСЛОВИЕВВЕДЕНИЕ § 1. ПРЕДМЕТ ХИМИИ § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ 1. СТРОЕНИЕ ВЕЩЕСТВА Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Глава II. ХИМИЧЕСКАЯ СВЯЗЬ § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ § III.  2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ 2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ§ III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ § V. 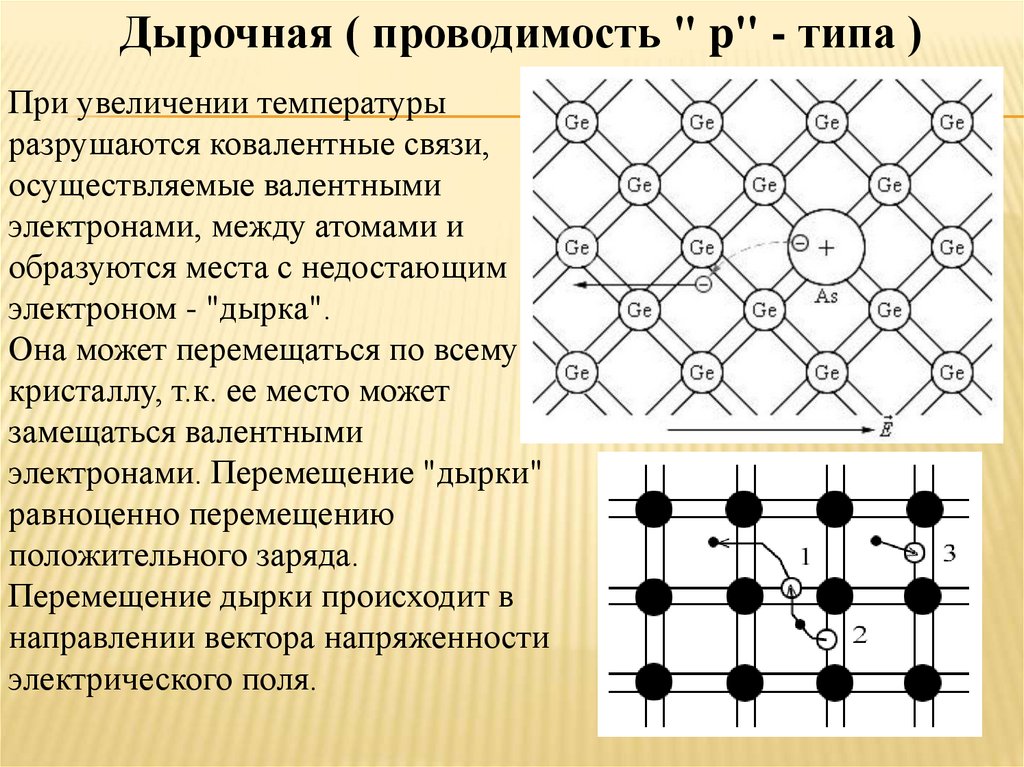 8. КАТАЛИЗ 8. КАТАЛИЗ3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ § VII.6. ЭЛЕКТРОЛИЗ Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ § VIII. 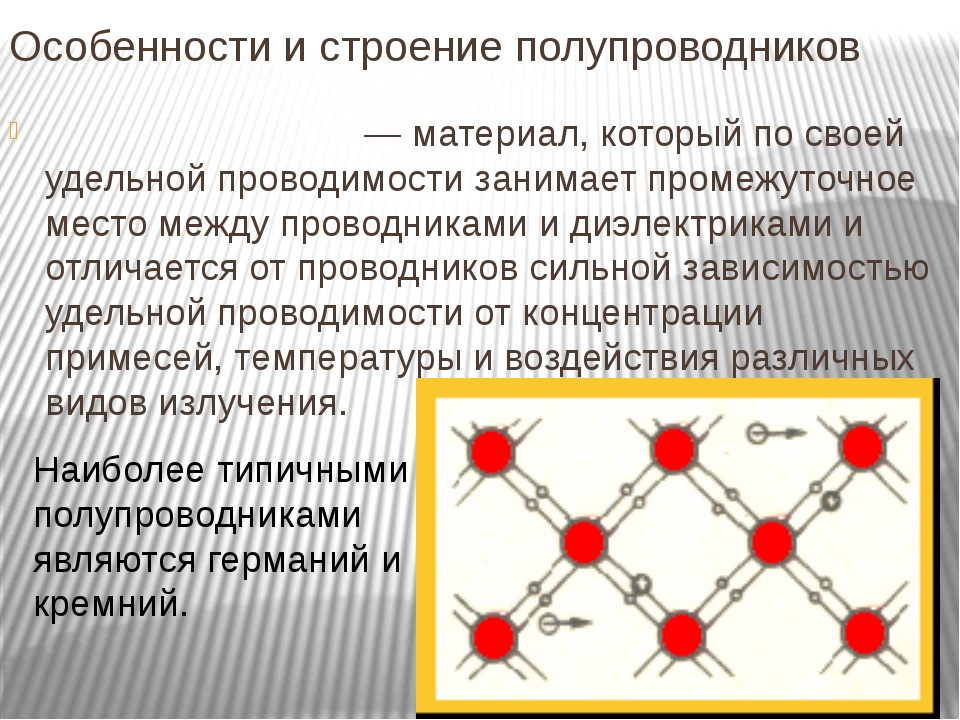 3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ 3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ§ VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ § XI.  2. УГЛЕВОДОРОДЫ 2. УГЛЕВОДОРОДЫ§ ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ § XIII.3. СВОЙСТВА ПОЛИМЕРОВ § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ § XIV.2. ПРИРОДНЫЕ ВОДЫ § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ § XV.  2. ЯДЕРНЫЕ РЕАКЦИИ 2. ЯДЕРНЫЕ РЕАКЦИИ§ XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ) § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ ЗАКЛЮЧЕНИЕ |
Проектируем электрику вместе: О проводимости полупроводников
Проводимость полупроводников. Полупроводниковые соединения. Электронная и дырочная проводимость. Доноры и акцепторы. Полупроводники N-типа и P-типа.
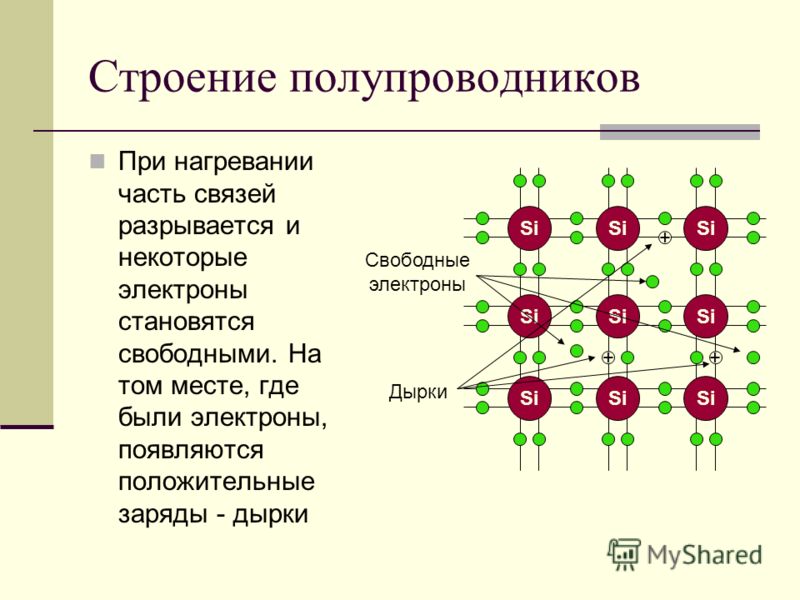
Полупроводник – это вещество (обычно твердый химический элемент или соединение), которое может проводить электричество при определенных условиях. Его проводимость варьируется в зависимости от полярности приложенного напряжения, от температуры, от примеси (легирование) или от интенсивности облучения инфракрасным, ультрафиолетовым или видимым светом. Это такие элементарные полупроводники, как германий, кремний, сурьма, мышьяк, селен, теллур и многие другие. Кремний является наиболее известным из них и является основой для большинства интегральных схем. Полупроводниковые соединения включают арсенид галлия, антимонид индия и оксиды большинства металлов. Арсенид галлия, например, широко используется в устройствах с низким уровнем шумов для усиления слабых сигналов. Полупроводники оказали огромное влияние на наше общество. Вы обнаружите полупроводники везде – в радиоприемниках, телевизорах, компьютерах, смартфонах и в другой микропроцессорной технике.
Это такие элементарные полупроводники, как германий, кремний, сурьма, мышьяк, селен, теллур и многие другие. Кремний является наиболее известным из них и является основой для большинства интегральных схем. Полупроводниковые соединения включают арсенид галлия, антимонид индия и оксиды большинства металлов. Арсенид галлия, например, широко используется в устройствах с низким уровнем шумов для усиления слабых сигналов. Полупроводники оказали огромное влияние на наше общество. Вы обнаружите полупроводники везде – в радиоприемниках, телевизорах, компьютерах, смартфонах и в другой микропроцессорной технике.
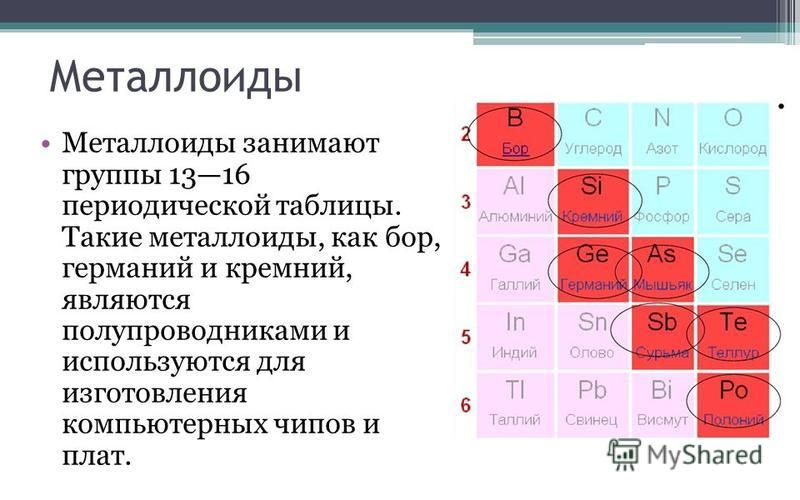
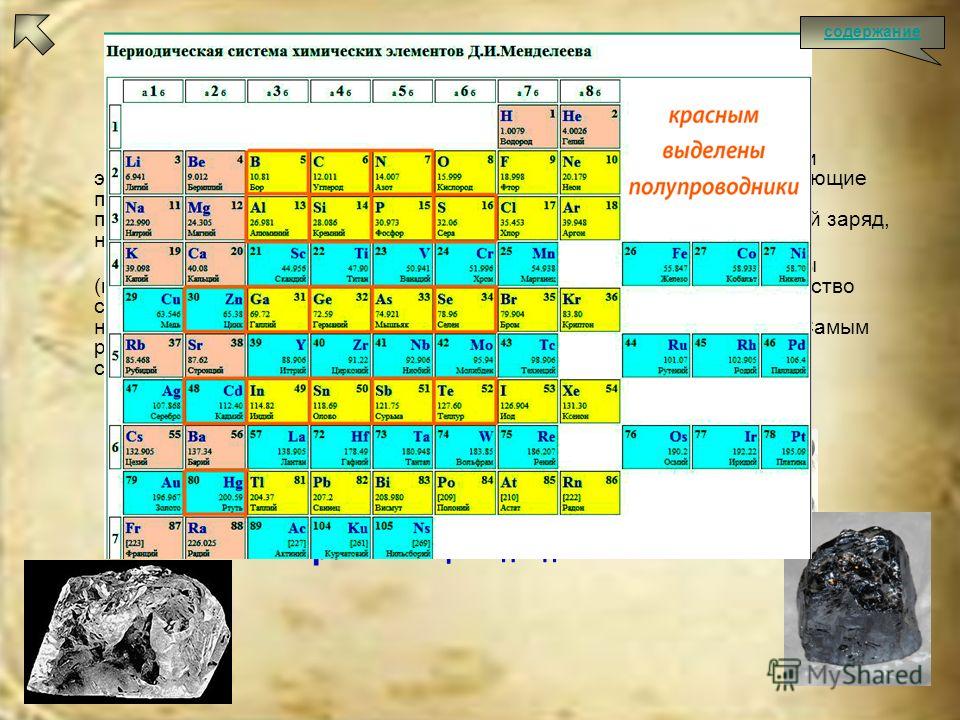
Кремний – очень распространенный элемент. Например, он является основным компонентом песка и кварца. Если вы поищете кремний в периодической таблице, вы обнаружите его под 14-м номером, – он сидит между алюминием и фосфором.
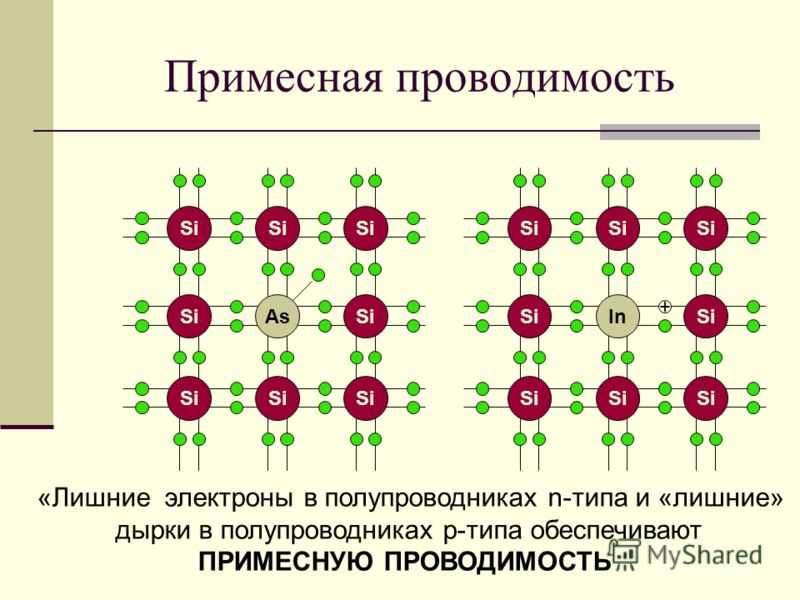
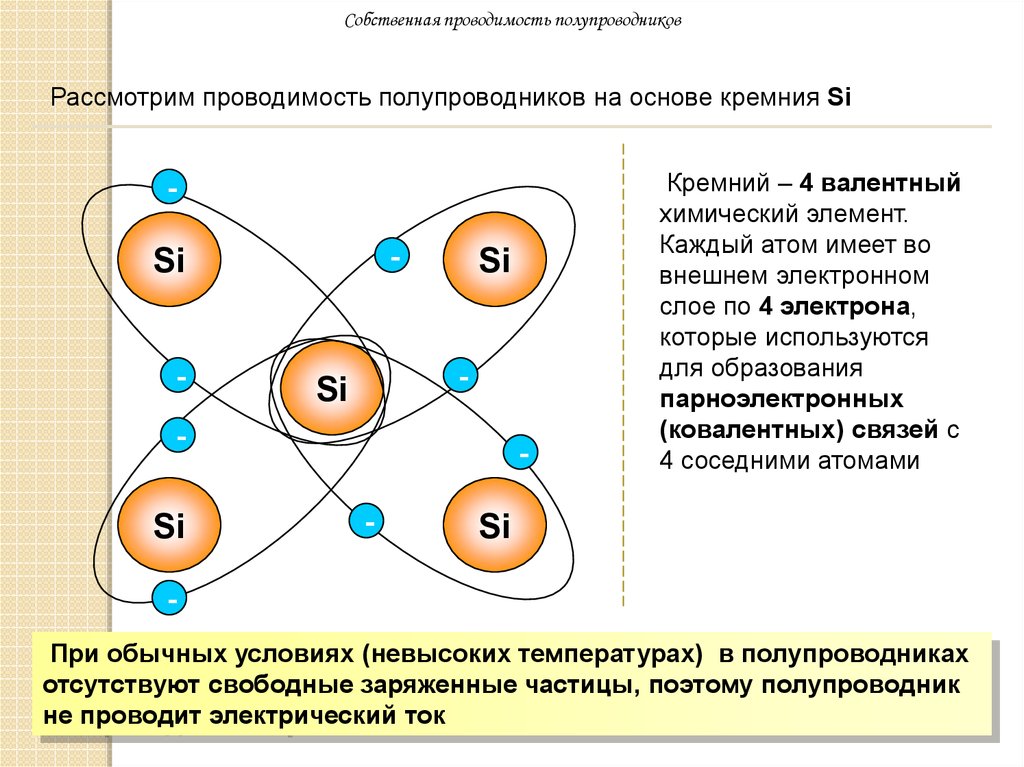
Кремний (также как и германий) обладает уникальным свойством своей электронной структуры – он имеет четыре электрона на своей внешней орбите.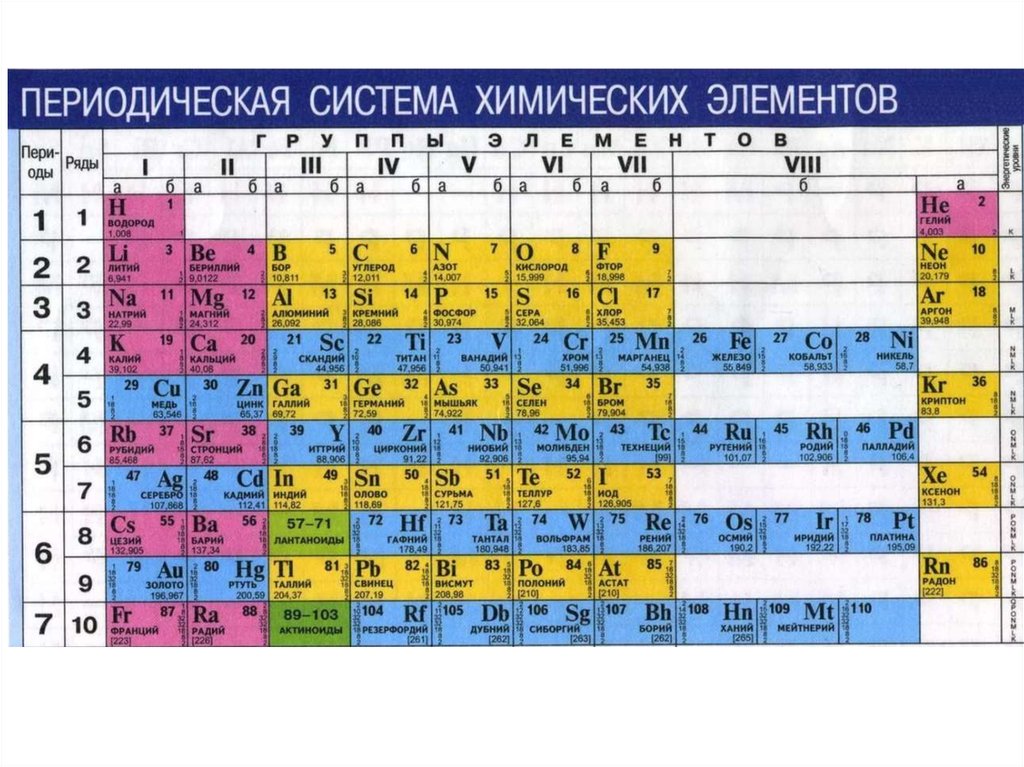 Четыре электрона образуют совершенные ковалентные связи с четырьмя соседними атомами, создавая решетку – поэтому они не могут свободно двигаться. Чистый кристалл кремния почти идеальный изолятор. Но все это можно изменить через процесс, называемый легированием.
Четыре электрона образуют совершенные ковалентные связи с четырьмя соседними атомами, создавая решетку – поэтому они не могут свободно двигаться. Чистый кристалл кремния почти идеальный изолятор. Но все это можно изменить через процесс, называемый легированием.
При легировании в кристалл кремния добавляется небольшое количество примеси.
Существует два типа примесей:
N-тип. В легировании N-типа в кремний добавляют в небольших количествах фосфор или мышьяк. Фосфор и мышьяк имеют пять внешних электронов, поэтому всем не находится места, когда они попадают в решетку кремния. Пятый электрон остается лишним и может свободно передвигаться. Для создания достаточного количества свободных электронов требуется очень небольшое количество примеси, чтобы через кремний мог протекать электрический ток. Легированный кремний N-типа является хорошим проводником. Электроны имеют отрицательный заряд, отсюда и название – полупроводник N-типа.
P-тип. В легировании P-типа легирующей примесью является бор или галлий. Бор и галлий имеют только три внешних электрона. При попадании в решетку кремния они образуют пустые места или «дырки» в решетке. Отсутствие одного электрона создает эффект положительно заряженного атома, поэтому и полупроводник P-типа.
«Дырки» могут создавать ток. Каким образом? «Дырка» замещается электроном от соседнего атома, в котором вместо электрона возникает пустое место, которое вновь может быть замещено электроном. Таким образом «дырка» перемещается между атомами полупроводника P-типа. Легированный кремний типа P также является хорошим проводником.
Минимальное количество примеси N-типа или P-типа превращает кристалл кремния из хорошего изолятора в жизнеспособный проводник – отсюда и название «полупроводник».
Полупроводники N-типа и P-типа не настолько интересны сами по себе, но когда вы их объединяете, вы получаете очень интересное явление на их стыке. Это то, что происходит в полупроводниковом диоде.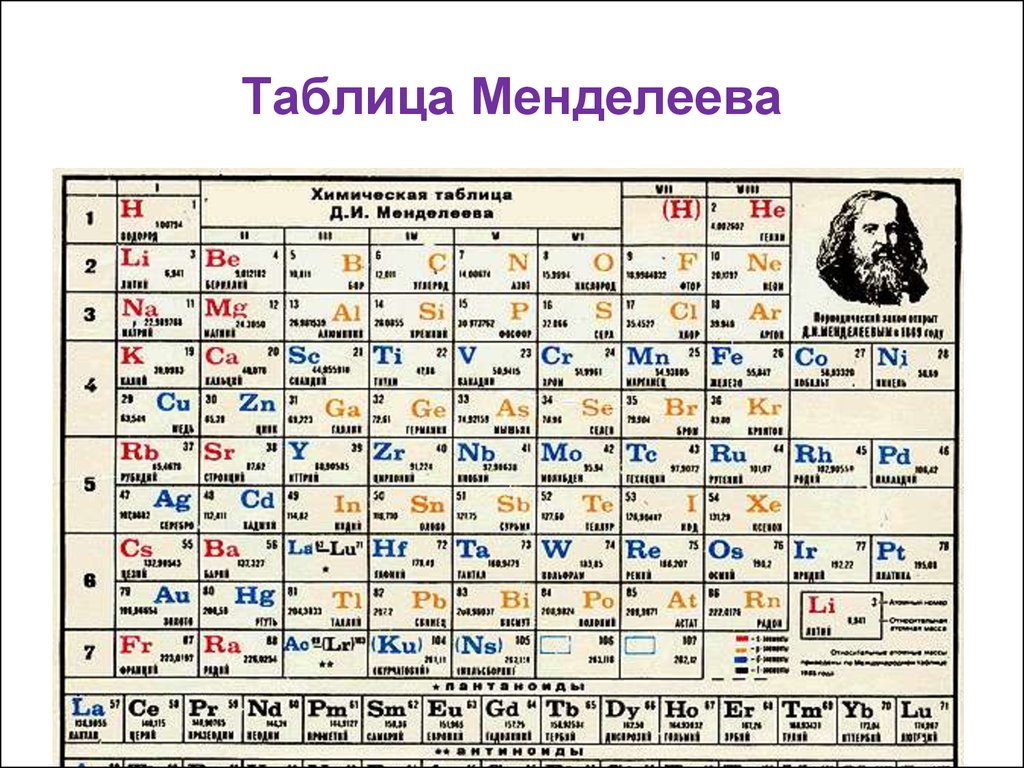 Но об этом – в следующих статьях.
Но об этом – в следующих статьях.
7.2: Структуры элементных и составных полупроводников
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 55905
- Паван М. В. Раджа и Эндрю Р. Бэррон
- Университет Райса через OpenStax CNX
Монокристалл либо элементарного (например, кремний), либо составного (например, арсенид галлия) полупроводника составляет основу почти всех полупроводниковых устройств. Возможность управлять электронными и оптоэлектронными свойствами этих материалов основана на понимании их структуры. Кроме того, металлы и многие изоляторы, используемые в микроэлектронных устройствах, также являются кристаллическими.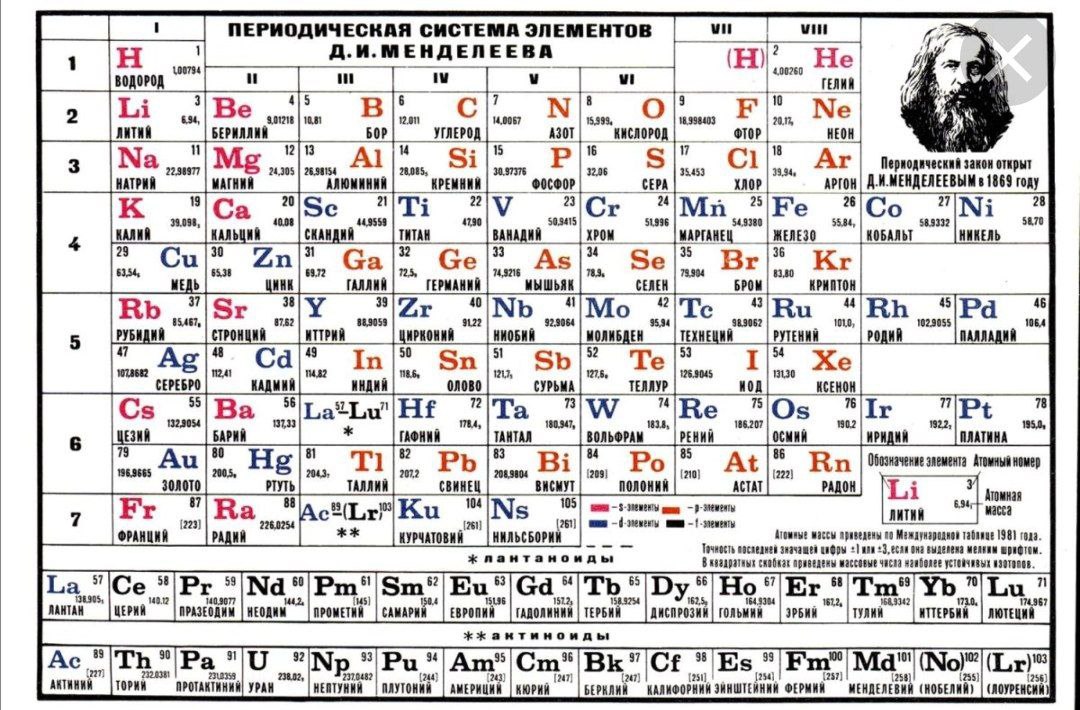
Группа IV (14) Элементы
Каждая из полупроводниковых фаз элементов группы IV (14), C (алмаз), Si, Ge и α-Sn, имеет кубическую структуру алмаза (рис. \(\PageIndex{1}\)). Их постоянные решетки (a, Å) и плотности (ρ, г/см3) приведены в таблице \(\PageIndex{1}\).
Рисунок \(\PageIndex{1}\) Структура элементарной ячейки кубической решетки алмаза, показывающая две взаимопроникающие гранецентрированные кубические решетки.| | Параметр решетки, a ( Å) | Плотность (г/см 3 ) |
|---|---|---|
| углерод (алмаз) | 3,56683(1) | 3,51525 |
| кремний | 5. | 2.319002 |
| германий | 5.657906(1) | 5.3234 |
| олово (α-Sn) | 6.4892(1) |
Как и следовало ожидать, параметр решетки увеличивается в ряду C < Si < Ge < α-Sn. Кремний и германий образуют непрерывный ряд твердых растворов с постепенно изменяющимися параметрами. Стоит отметить высокую степень точности, с которой известны параметры решетки для особо чистых кристаллов этих элементов. Кроме того, важно учитывать температуру, при которой проводятся структурные измерения, поскольку параметры решетки зависят от температуры (рис. \(\PageIndex{1}\)). Постоянная решетки (a) в Å для кремния высокой чистоты может быть рассчитана для любой температуры (T) в диапазоне температур 29{-9}\ (T-298.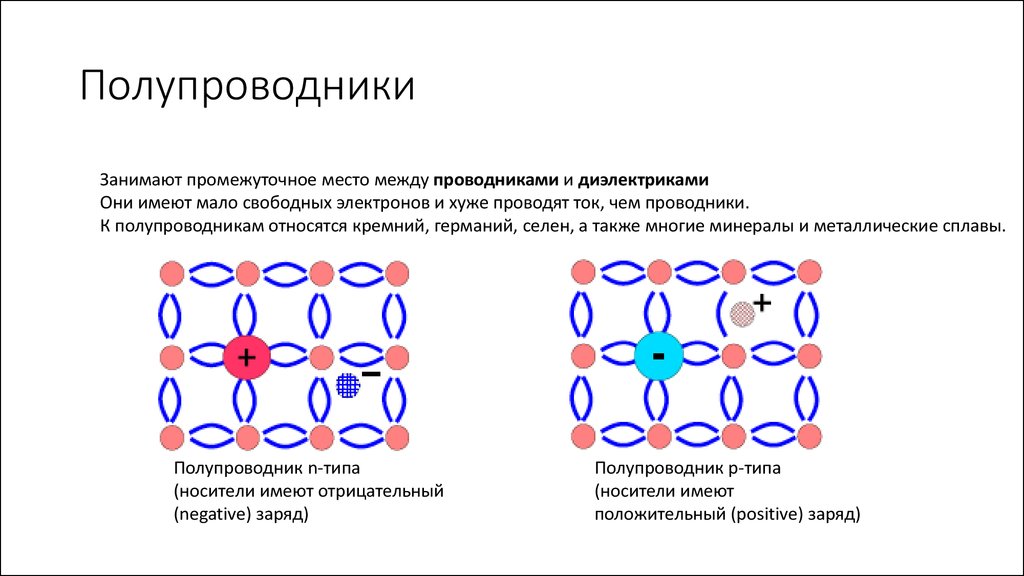 15\ K) \label{1} \]
15\ K) \label{1} \]
Несмотря на то, что алмазные кубические формы Si и Ge являются единственными формами, представляющими непосредственный интерес для полупроводниковых устройств, каждая из них существует в многочисленных кристаллических формах высокого давления и метастабильных формах. Они описаны вместе с их взаимными преобразованиями в таблице \(\PageIndex{2}\).
| Фаза | Структура | Замечания |
|---|---|---|
| Си I | кубический алмаз | стабилен при нормальном давлении |
| Си II | серая оловянная структура | из Si I или Si V выше 14 ГПа |
| Си III | куб.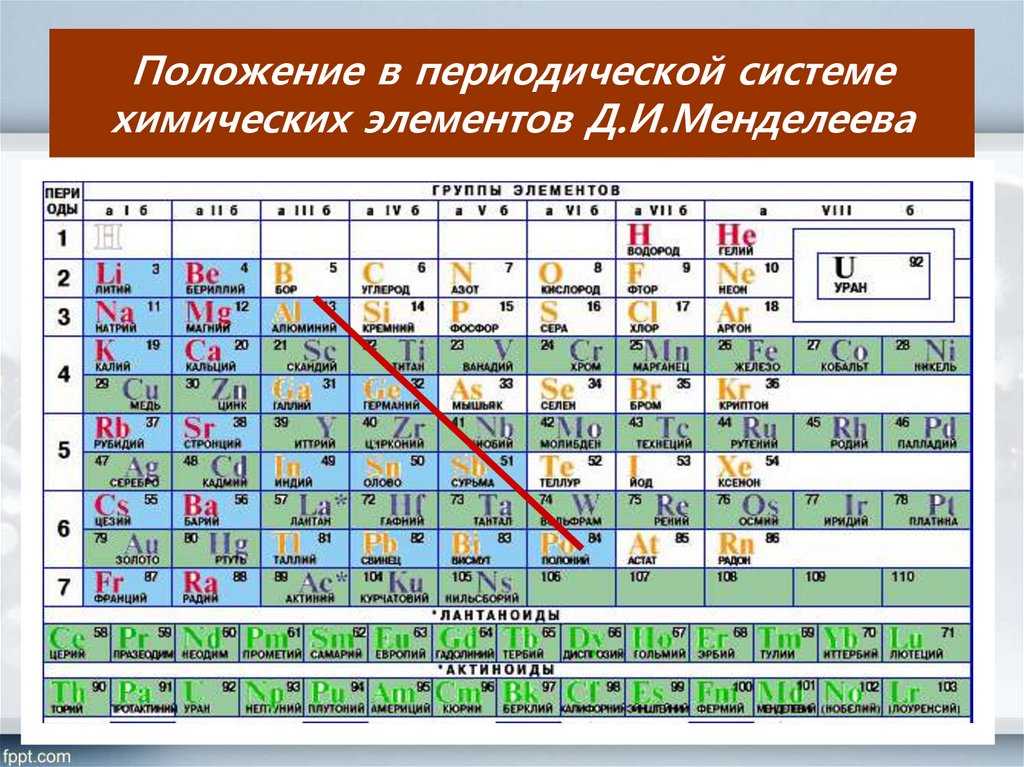 | метастабильный, образованный из Si II выше 10 ГПа |
| Си IV | шестигранник | |
| Си В | неопознанный | стабильный выше 34 ГПа, сформированный из Si II выше 16 ГПа |
| Си VI | шестигранник, плотно упакованный | стабильно выше 45 ГПа |
| Ге I | алмаз кубический | фаза низкого давления |
| Ге II | Структура β-олова | образован из Ge I выше 10 ГПа |
| Ге III | четырехугольный | образован закалкой Ge II при низком давлении |
| Ге IV | по центру корпуса | , образованный закалкой Ge II до 1 атм при 200 К |
Соединения группы III-V (13-15)
Стабильные фазы арсенидов, фосфидов и антимонидов алюминия, галлия и индия имеют структуру цинковой обманки (рис.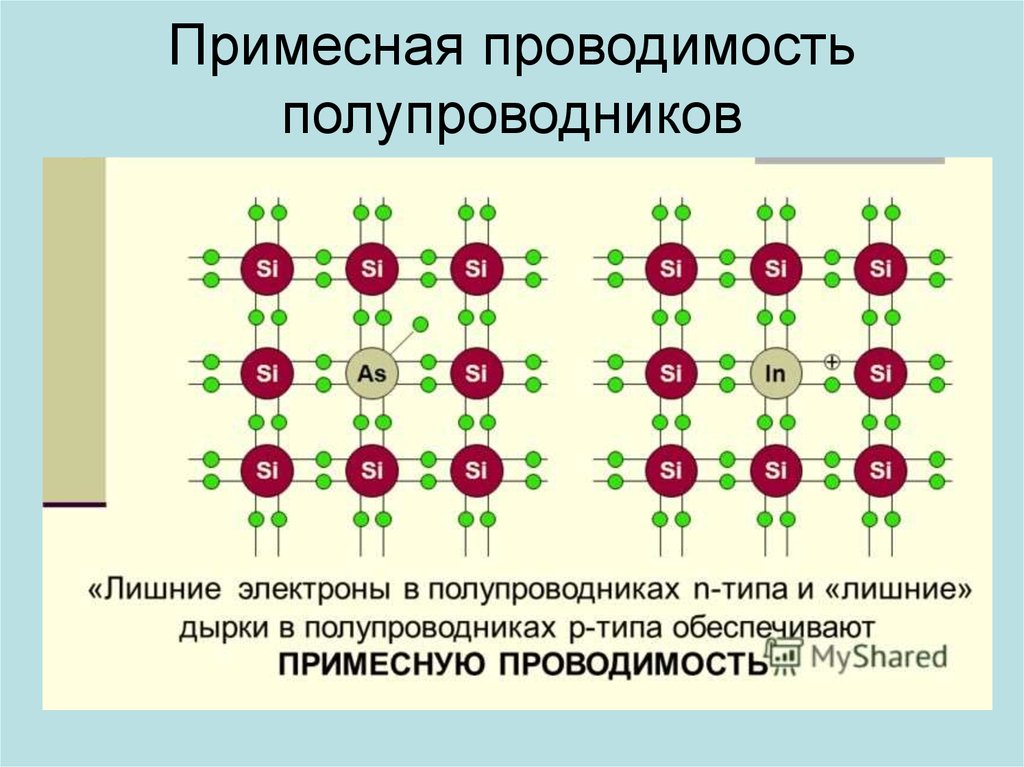 \(\PageIndex{3}\)). Напротив, нитриды обнаруживаются в виде структур вюрцита (например, рисунок \(\PageIndex{4}\)). Строение, параметры решетки и плотности соединений AIIIBV приведены в таблице \(\PageIndex{3}\). Стоит отметить, что, вопреки ожиданиям, параметр решетки соединений галлия меньше, чем у их алюминиевого гомолога; для GaAs а = 5,653 Å; AlAs а = 5,660 Å. Как и в случае с элементами группы IV, параметры решетки сильно зависят от температуры; однако дополнительные вариации возникают из-за любого отклонения от абсолютной стехиометрии. Эти эффекты показаны на рисунке \(\PageIndex{4}\).
\(\PageIndex{3}\)). Напротив, нитриды обнаруживаются в виде структур вюрцита (например, рисунок \(\PageIndex{4}\)). Строение, параметры решетки и плотности соединений AIIIBV приведены в таблице \(\PageIndex{3}\). Стоит отметить, что, вопреки ожиданиям, параметр решетки соединений галлия меньше, чем у их алюминиевого гомолога; для GaAs а = 5,653 Å; AlAs а = 5,660 Å. Как и в случае с элементами группы IV, параметры решетки сильно зависят от температуры; однако дополнительные вариации возникают из-за любого отклонения от абсолютной стехиометрии. Эти эффекты показаны на рисунке \(\PageIndex{4}\).
| Соединение | Структура | Параметр решетки ( Å ) | Плотность (г/см 3 ) |
|---|---|---|---|
| АИН | вюрцит | а = 3,11(1), с = 4,98(1) | 3,255 |
| АИП | цинковая обманка | а = 5,4635(4) | 2,40(1) |
| ЗИС | цинковая обманка | а = 5,660 | 3,760 |
| АИСб | цинковая обманка | а = 6,1355(1) | 4,26 |
| GaN | вюрцит | а = 3,190, с = 5,187 | |
| ГаП | цинковая обманка | а= 5,4505(2) | 4,138 |
| GaAs | цинковая обманка | а = 5,56325(2) | 5. 3176(3) 3176(3) |
| ИнН | вюрцит | а = 3,5446, с = 5,7034 | 6,81 |
| ИнП | цинковая обманка | а = 5,868(1) | 4,81 |
| ИнАс | цинковая обманка | а = 6,0583 | 5,667 |
| ИнСб | цинковая обманка | а = 6,47937 | 5.7747(4) |
Однородность структур сплавов для широкого круга твердых растворов, образующихся между соединениями III-V практически в любых сочетаниях. Образуются два класса тройных сплавов: III х -III 1-х -V (например, Al х -Ga 1-х -As) и III-V 1-х -V x (например, Ga-As 1-x -P x ). В то время как четверные сплавы типа III x -III 1-x -V y -V 1-y позволяют выращивать материалы с аналогичными параметрами решетки, но широким диапазоном ширины запрещенной зоны. Очень важным тройным сплавом, особенно в оптоэлектронике, является Al 9.0344 x -Ga 1-x -As и его параметр решетки ( a ) напрямую связан с составом (x).
\[ a\ =\ 5,6533\ +\ 0,0078\ x \номер \]
Не все соединения III-V имеют хорошо охарактеризованные фазы высокого давления. однако в каждом случае, когда наблюдается фаза высокого давления, координационное число как элемента группы III, так и элемента группы V увеличивается с четырех до шести.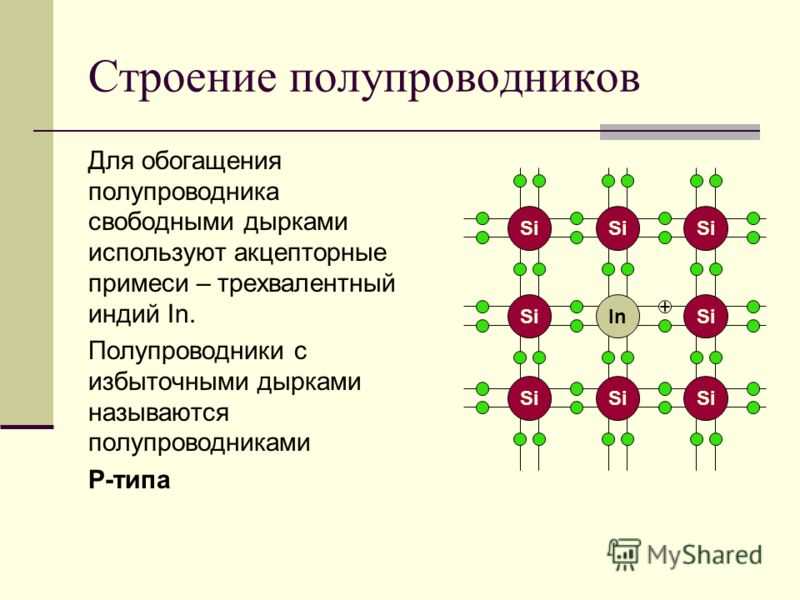 Так, AlP претерпевает превращение цинковой обманки в каменную соль при высоком давлении выше 170 кбар, а AlSb и GaAs образуют орторомбически искаженные структуры каменной соли выше 77 и 172 кбар соответственно. Предложена орторомбическая структура высокобарической формы InP (>133 кбар). Арсенид индия (InAs) претерпевает двухфазные превращения. Структура цинковой обманки преобразуется в структуру каменной соли выше 77 кбар, которая, в свою очередь, образует структуру β-олова выше 170 кбар.
Так, AlP претерпевает превращение цинковой обманки в каменную соль при высоком давлении выше 170 кбар, а AlSb и GaAs образуют орторомбически искаженные структуры каменной соли выше 77 и 172 кбар соответственно. Предложена орторомбическая структура высокобарической формы InP (>133 кбар). Арсенид индия (InAs) претерпевает двухфазные превращения. Структура цинковой обманки преобразуется в структуру каменной соли выше 77 кбар, которая, в свою очередь, образует структуру β-олова выше 170 кбар.
Соединения группы II-VI (12-16)
Структуры полупроводников соединений II-VI менее предсказуемы, чем структуры соединений III-V (выше), и хотя структура цинковой обманки существует почти для всех соединений наблюдается более сильная тенденция к гексагональной форме вюрцита. В некоторых случаях структура цинковой обманки наблюдается в условиях окружающей среды, но может быть преобразована в форму вюрцита при нагревании. В целом форма вюрцита преобладает с более мелкими анионами (например, оксидами), в то время как цинковая обманка становится более стабильной фазой для более крупных анионов (например, теллуридов).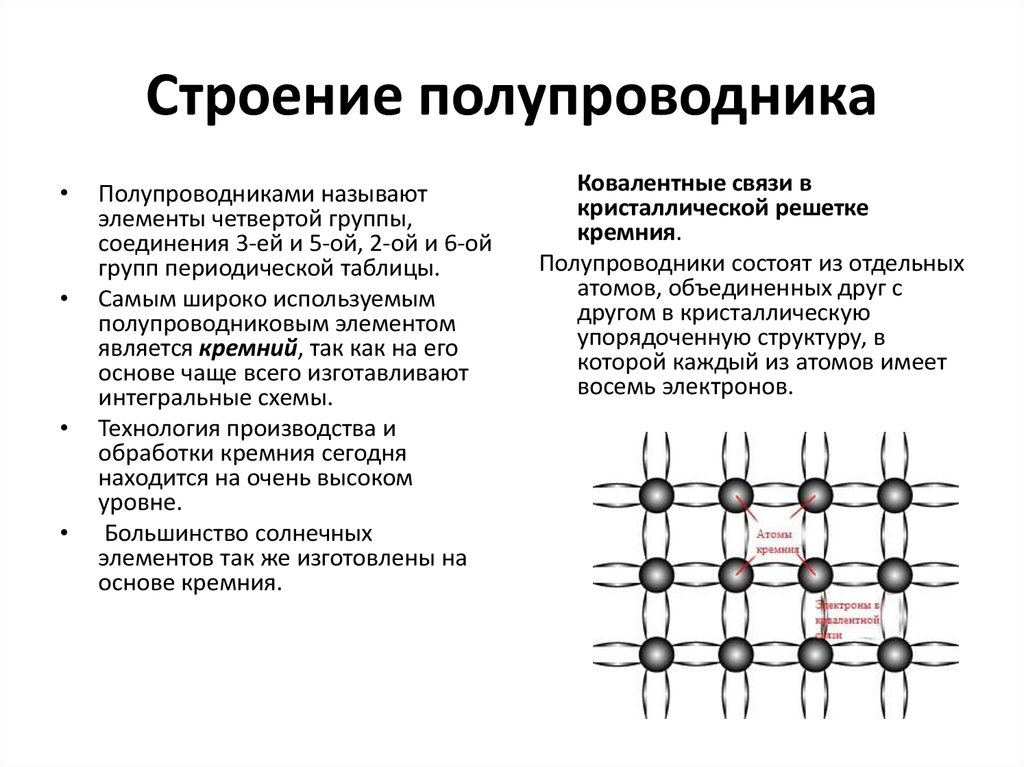 Единственным исключением является сульфид ртути (HgS), который является архетипом тригональной фазы киновари. В таблице \(\PageIndex{5}\) перечислены стабильные фазы халькогенидов цинка, кадмия и ртути, а также их высокотемпературные фазы, где это применимо. . Твердые растворы соединений II—VI образуются не так легко, как соединения III—V; однако двумя важными примерами являются ZnS x Se 1-x и Cd x Hg 1-x Te.
Единственным исключением является сульфид ртути (HgS), который является архетипом тригональной фазы киновари. В таблице \(\PageIndex{5}\) перечислены стабильные фазы халькогенидов цинка, кадмия и ртути, а также их высокотемпературные фазы, где это применимо. . Твердые растворы соединений II—VI образуются не так легко, как соединения III—V; однако двумя важными примерами являются ZnS x Se 1-x и Cd x Hg 1-x Te.
| Соединение | Структура | Параметр решетки ( Å) | Плотность (г/см 3 ) |
| ЗНС | цинковая обманка | а = 5,410 | 4,075 |
| вюрцит | а = 3,822, с = 6,260 | 4,087 | |
| ZnSe | цинковая обманка | а = 5,668 | 5,27 |
| ZnTe | цинковая обманка | а = 6,10 | 5,636 |
| ДС | вюрцит | а = 4,136, с = 6,714 | 4,82 |
| CdSe | вюрцит | а = 4,300, с = 7,011 | 5,81 |
| CdTe | цинковая обманка | а = 6,482 | 5,87 |
| HgS | киноварь | а = 4,149, с = 9,495 | |
| цинковая обманка | а = 5,851 | 7,73 | |
| HgSe | цинковая обманка | а = 6,085 | 8,25 |
| HgTe | цинковая обманка | а = 6,46 | 8. 07 07 |
Все халькогениды цинка трансформируются в структуру хлорида цезия под высоким давлением, в то время как все соединения кадмия образуют фазы каменной соли под высоким давлением (рис. \(\PageIndex{6}\)). Селенид ртути (HgSe) и теллурид ртути (HgTe) преобразуются в архетипическую структуру сульфида ртути, киноварь, под высоким давлением.
Рисунок \(\PageIndex{6}\) Структура элементарной ячейки решетки каменной соли. Ионы натрия показаны фиолетовым цветом, а ионы хлора — красным.I-III-VI
2 (11-13-16) Соединения Почти все соединения I-III-VI2 при комнатной температуре принимают структуру халькопирита (рис. \(\PageIndex{7}\)). Константы ячеек и плотности приведены в таблице \(\PageIndex{6}\). Хотя имеется несколько сообщений о высокотемпературных или высоконапорных фазах, было показано, что AgInS2 существует в виде высокотемпературного орторомбического полиморфа (a = 6,954, b = 8,264 и c = 6,683 Å), а AgInTe2 образует кубическую фазу при высоких температурах. давления.
давления.
| Соединение | Параметр решетки a (Å) | Параметр решетки c (Å) | Плотность (г см 3 ) |
| CuAlS 2 | 5,32 | 10.430 | 3,45 |
| CuAlSe 2 | 5,61 | 10,92 | 4,69 |
| CuAlTe 2 | 5,96 | 11,77 | 5,47 |
| CuGaS 2 | 5,35 | 10,46 | 4,38 |
| CuGaSe 2 | 5,61 | 11. 00 00 | 5,57 |
| CuGaTe 2 | 6,00 | 11,93 | 5,95 |
| CuInS 2 | 5,52 | 11.08 | 4,74 |
| CuInSe 2 | 5,78 | 11,55 | 5,77 |
| CuInTe 2 | 6,17 | 12.34 | 6.10 |
| AgAlS 2 | 6,30 | 11,84 | 6,15 |
| AgGaS 2 | 5,75 | 10,29 | 4,70 |
| AgGaSe 2 | 5,98 | 10,88 | 5,70 |
| AgGaTe 2 | 6,29 | 11,95 | 6,08 |
| АгИнС 2 | 5,82 | 11. 17 17 | 4,97 |
| AgInSe 2 | 6.095 | 11,69 | 5,82 |
| АгИнТе 2 | 6,43 | 12,59 | 6,96 |
Из соединений I-III-VI2 халькогениды меди-индия (CuInE2), безусловно, наиболее изучены для их применения в солнечных элементах. Одним из преимуществ медно-индийхалькогенидных соединений является образование твердых растворов (сплавов) формулы CuInE2-xE’x, где переменная состава (x) изменяется от 0 до 2. Системы CuInS2-xSex и CuInSe2-xTex также были исследованы, как и четвертичная система CuGayIn1-yS2-xSex. Как и следовало ожидать из рассмотрения относительных ионных радиусов халькогенидов, параметры решетки сплава CuInS2-xSex должны увеличиваться с увеличением содержания селена. Закон Вергарда требует, чтобы постоянная решетки для линейного раствора двух полупроводников линейно изменялась в зависимости от состава (например, как это наблюдается для AlxGa1-xAs), однако изменение постоянных тетрагональной решетки (a и c) в зависимости от состава для CuInS2-xSx лучше всего описываются параболическими соотношениями. 9{2} \nonumber \]
Закон Вергарда требует, чтобы постоянная решетки для линейного раствора двух полупроводников линейно изменялась в зависимости от состава (например, как это наблюдается для AlxGa1-xAs), однако изменение постоянных тетрагональной решетки (a и c) в зависимости от состава для CuInS2-xSx лучше всего описываются параболическими соотношениями. 9{2} \nonumber \]
Большая разница в ионных радиусах между S и Te (0,37 Å) препятствует образованию твердых растворов в системе CuInS2-xTex, однако сообщается об одном сплаве CuInS1,5Te0,5.
Эффекты ориентации
После получения монокристаллов высокочистого кремния или арсенида галлия их разрезают на пластины таким образом, что открытая поверхность этих пластин представляет собой кристаллографическую плоскость {100} или {111}. Относительная структура этих поверхностей важна с точки зрения окисления, травления и роста тонких пленок. Эти процессы чувствительны к ориентации; то есть они зависят от направления, в котором разрезается срез кристалла.
Плотность атомов и оборванные связи
Основные плоскости в кристалле можно различать различными способами, однако плотность атомов и/или связей полезна для прогнозирования большей части химического состава поверхностей полупроводников. Поскольку и кремний, и арсенид галлия представляют собой ГЦК-структуры, а поверхности {100} и {111} являются единственными технологически значимыми поверхностями, обсуждение будет ограничено ГЦК-структурами {100} и {111}.
Атомная плотность поверхности может быть определена как количество атомов на единицу площади. На рисунке показано схематическое изображение плоскостей {111} и {100} в ГЦК-решетке. Плоскость {111} состоит из гексагональной плотноупакованной матрицы, в которой направления кристаллов внутри плоскости ориентированы под углом 60° друг к другу. Гексагональная упаковка и ориентация направлений кристаллов показаны на рисунке \(\PageIndex{8}\) b в виде наложенного шестиугольника. Учитывая, что внутриплоскостное межатомное расстояние может быть определено как функция параметра решетки, площадь этого шестиугольника может быть легко вычислена.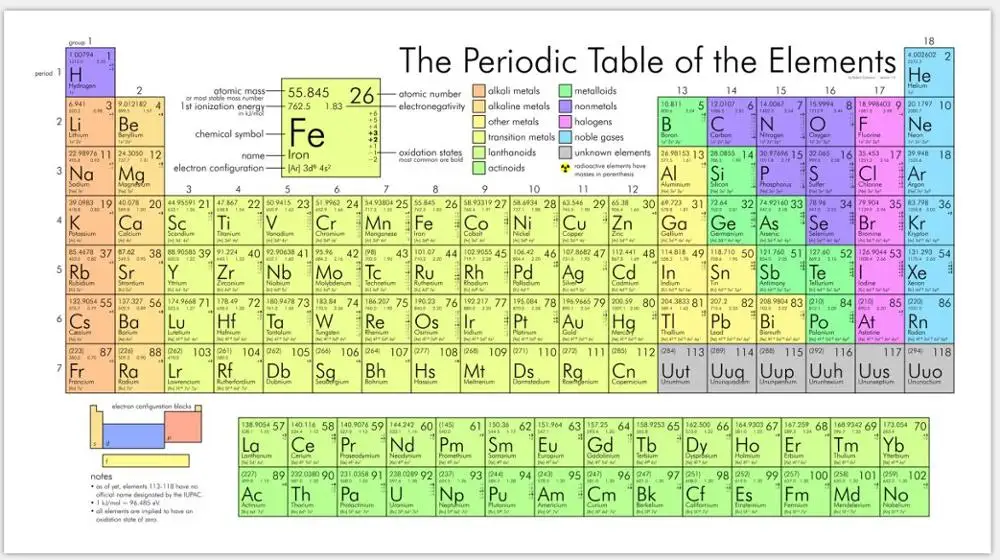 Например, в случае кремния шестиугольник имеет площадь 38,30 Å2. Число атомов внутри шестиугольника равно трем: атом в центре плюс 1/3 каждого из шести атомов в вершинах шестиугольника (каждый из атомов в вершинах шестиугольников является общим для трех других соседних шестиугольников). Таким образом, расчетная атомная плотность плоскости {111} составляет 0,0783 Å-2. Точно так же можно рассчитать атомную плотность плоскости {100}. Плоскость {100} состоит из квадратного массива, в котором направления кристаллов внутри плоскости ориентированы под углом 90° друг к другу. Поскольку квадрат совпадает с одной из граней элементарной ячейки, площадь квадрата может быть легко вычислена. Например, в случае кремния квадрат имеет площадь 29,49 Å2. Количество атомов внутри квадрата равно 2: атом в центре плюс 1/4 каждого из четырех атомов в вершинах квадрата (каждый из атомов в углах квадрата принадлежит четырем другим соседним квадратам) . Таким образом, расчетная атомная плотность плоскости {100} составляет 0,0678 Å-2.
Например, в случае кремния шестиугольник имеет площадь 38,30 Å2. Число атомов внутри шестиугольника равно трем: атом в центре плюс 1/3 каждого из шести атомов в вершинах шестиугольника (каждый из атомов в вершинах шестиугольников является общим для трех других соседних шестиугольников). Таким образом, расчетная атомная плотность плоскости {111} составляет 0,0783 Å-2. Точно так же можно рассчитать атомную плотность плоскости {100}. Плоскость {100} состоит из квадратного массива, в котором направления кристаллов внутри плоскости ориентированы под углом 90° друг к другу. Поскольку квадрат совпадает с одной из граней элементарной ячейки, площадь квадрата может быть легко вычислена. Например, в случае кремния квадрат имеет площадь 29,49 Å2. Количество атомов внутри квадрата равно 2: атом в центре плюс 1/4 каждого из четырех атомов в вершинах квадрата (каждый из атомов в углах квадрата принадлежит четырем другим соседним квадратам) . Таким образом, расчетная атомная плотность плоскости {100} составляет 0,0678 Å-2. Хотя эти значения плотности атомов специфичны для кремния, их соотношение постоянно для всех кубических структур алмаза и цинковой обманки: {100}:{111} = 1:1,155. Как правило, чем меньше оборванных связей, тем стабильнее структура поверхности.
Хотя эти значения плотности атомов специфичны для кремния, их соотношение постоянно для всех кубических структур алмаза и цинковой обманки: {100}:{111} = 1:1,155. Как правило, чем меньше оборванных связей, тем стабильнее структура поверхности.
Атом внутри кристалла любого материала будет иметь координационное число (n), определяемое структурой материала. Например, все атомы в объеме кристалла кремния будут находиться в тетраэдрическом четырехкоординатном окружении (n = 4). Однако на поверхности кристалла атомы не образуют полного комплекта связей. Таким образом, у каждого атома будет меньше ближайших соседей, чем у атома в объеме материала. Отсутствующие связи обычно называют оборванными связями. Хотя это описание не является особенно точным, оно, тем не менее, широко используется и поэтому будет использоваться здесь. Количество оборванных связей можно определить как разницу между идеальным координационным числом (определяемым объемной структурой кристалла) и фактическим координационным числом, наблюдаемым на поверхности.
Количество оборванных связей можно определить как разницу между идеальным координационным числом (определяемым объемной структурой кристалла) и фактическим координационным числом, наблюдаемым на поверхности.
На рисунке \(\PageIndex{9}\) показано сечение поверхностей {111} кубической решетки алмаза, если смотреть перпендикулярно плоскости {111}. Атомы в объеме имеют координационное число четыре. Напротив, атомы на поверхности (например, атом, показанный синим цветом на рисунке \(\PageIndex{10}\) связаны только с тремя другими атомами (атомы, показанные красным цветом на рисунке), таким образом, каждый поверхностный атом имеет одна оборванная связь. Как видно из рисунка \(\PageIndex{10}\), на котором атомы на поверхности {100} показаны перпендикулярно плоскости {100}, каждый атом на поверхности (например, показанный атом синим цветом на рисунке \(\PageIndex{9}\) координируется только с двумя другими атомами (атомы, показанные красным на рисунке \(\PageIndex{10}\), оставляя две оборванные связи на атом.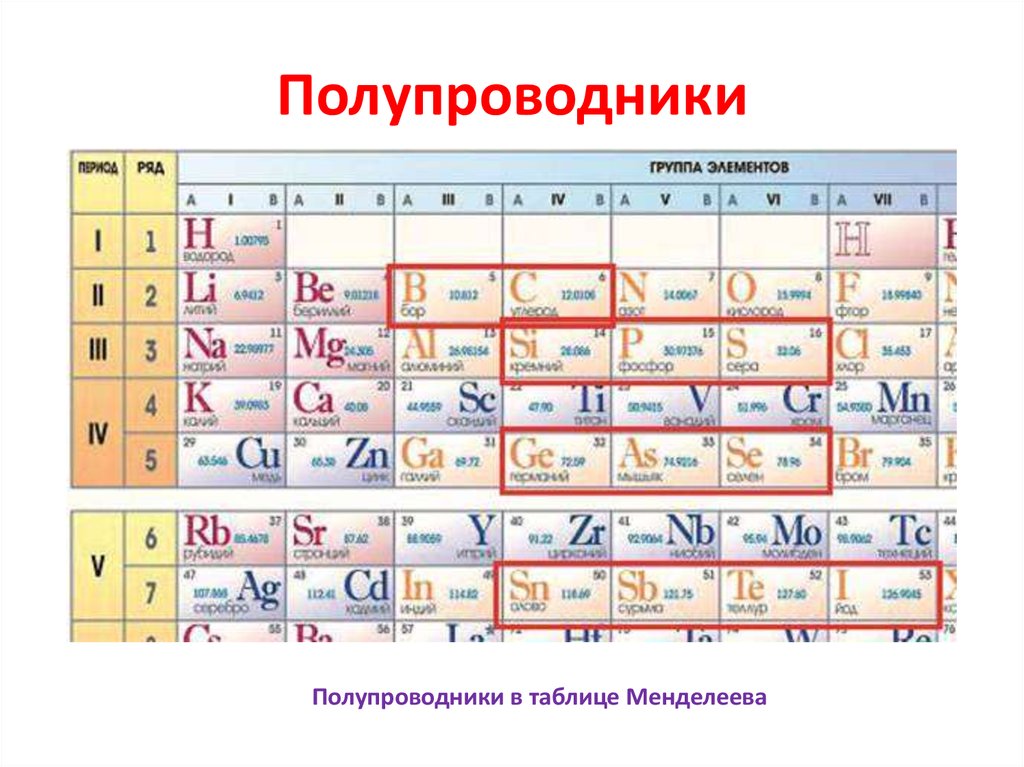 Следует отметить, что такое же количество оборванных связей обнаружено для Плоскости {111} и {100} решетки цинковой обманки Соотношение оборванных связей для плоскостей {100} и {111} всех структур алмазной кубической и цинковой обманки составляет {100}:{111} = 2:1. Кроме того, поскольку плотности атомов каждой плоскости известны, соотношение плотностей оборванных связей определяется как: {100}:{111} = 1:0,577.
Следует отметить, что такое же количество оборванных связей обнаружено для Плоскости {111} и {100} решетки цинковой обманки Соотношение оборванных связей для плоскостей {100} и {111} всех структур алмазной кубической и цинковой обманки составляет {100}:{111} = 2:1. Кроме того, поскольку плотности атомов каждой плоскости известны, соотношение плотностей оборванных связей определяется как: {100}:{111} = 1:0,577.
Кремний
Для кремния плоскости {111} упакованы плотнее, чем плоскости {100}. В результате рост кристалла кремния, таким образом, является самым медленным в направлении <111>, поскольку он требует наложения плотно упакованного атомного слоя на другой слой в его наиболее плотно упакованной форме. Как следствие <111> Si легче всего выращивать и, следовательно, дешевле всего.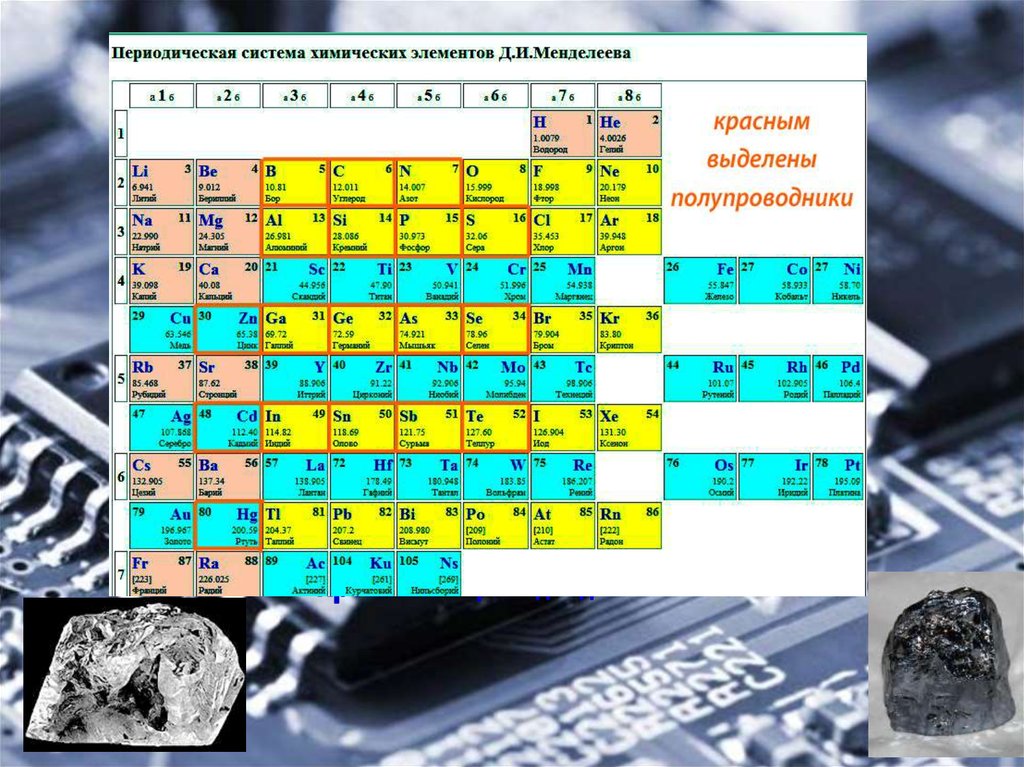
Растворение или травление кристалла связано с количеством разорванных связей, уже присутствующих на поверхности: чем меньше связей нужно разорвать, чтобы удалить отдельный атом из кристалла, тем легче будет растворить кристалл. Вследствие наличия только одной оборванной связи (для разрыва требуется три связи) травление кремния происходит медленнее всего в направлении <111>. Электронные свойства кремниевой пластины также связаны с количеством оборванных связей.
Кремниевые микросхемы, как правило, формируются на монокристаллической пластине, которая после изготовления разрезается на кубики либо путем частичного распила по толщине пластины, либо надрезанием (скребком) поверхности, а затем физическим разрушением. Физический разрыв пластины происходит по естественным плоскостям спайности, которыми в случае кремния являются плоскости {111}.
Арсенид галлия
Решетка цинковой обманки, наблюдаемая для арсенида галлия, требует дополнительных соображений по сравнению с кремнием. Хотя плоскость {100} GaAs структурно аналогична плоскости кремния, существуют две возможности: грань, состоящая либо из всех атомов галлия, либо из всех атомов мышьяка. В любом случае поверхностные атомы имеют две оборванные связи, и свойства грани не зависят от того, является ли грань галлиевой или мышьяковой.
Хотя плоскость {100} GaAs структурно аналогична плоскости кремния, существуют две возможности: грань, состоящая либо из всех атомов галлия, либо из всех атомов мышьяка. В любом случае поверхностные атомы имеют две оборванные связи, и свойства грани не зависят от того, является ли грань галлиевой или мышьяковой.
Самолет {111} также может состоять полностью из галлия или только из мышьяка. Однако, в отличие от плоскостей {100}, между этими двумя возможностями есть существенная разница. На рисунке \(\PageIndex{11}\) показана структура арсенида галлия, представленная двумя взаимопроникающими ГЦК-решетками. Ось [111] расположена вертикально в плоскости страницы. Хотя структура состоит из чередующихся слоев галлия и мышьяка, уложенных друг на друга вдоль оси [111], расстояние между последовательными слоями то большое, то малое. При назначении мышьяка в качестве исходной решетки порядок слоев в направлении [111] следующий: As-Ga-As-Ga-As-Ga, а в направлении [111] слои упорядочены Ga-As-Ga-As- Ga-As (рис.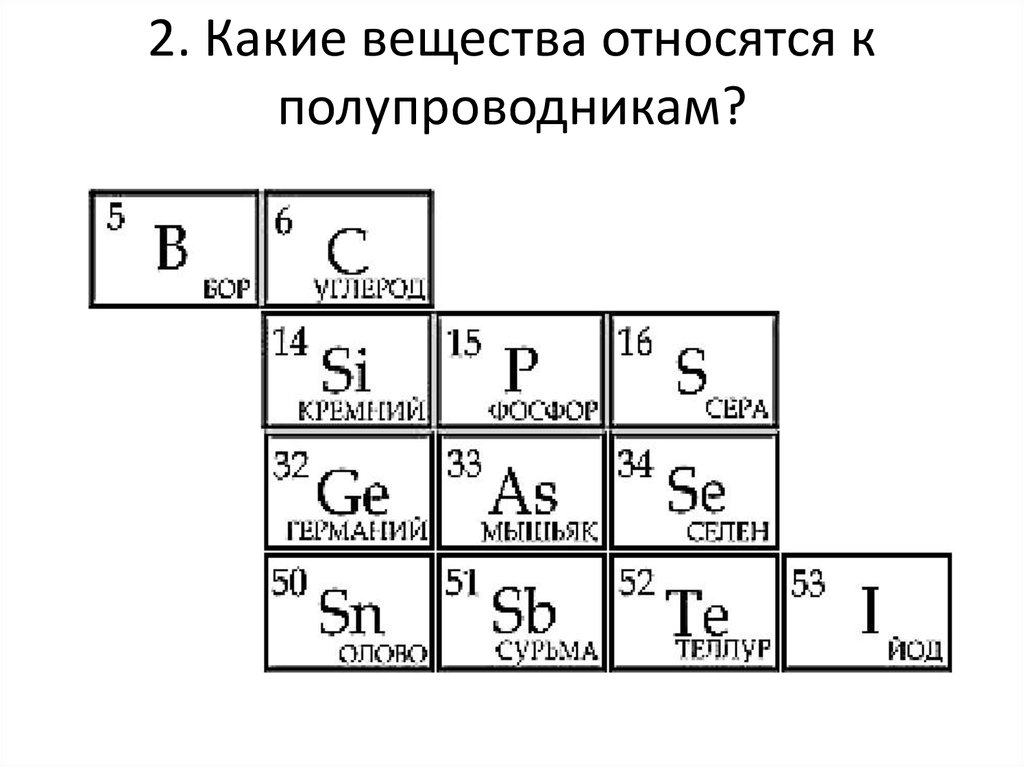 \(\PageIndex{11}\)). В кремнии эти два направления, конечно, идентичны. Поверхность кристалла будет либо мышьяковой с тремя оборванными связями, либо галлиевой с одной оборванной связью. Очевидно, что последний энергетически более выгоден. Таким образом, плоскость (111), показанная на рисунке \(\PageIndex{11}\), называется гранью (111) Ga. И наоборот, плоскость [111] будет либо галлиевой с тремя оборванными связями, либо мышьяковой с одной оборванной связью. Опять же, последний энергетически более выгоден, и поэтому плоскость [111] называется гранью (111) As.
\(\PageIndex{11}\)). В кремнии эти два направления, конечно, идентичны. Поверхность кристалла будет либо мышьяковой с тремя оборванными связями, либо галлиевой с одной оборванной связью. Очевидно, что последний энергетически более выгоден. Таким образом, плоскость (111), показанная на рисунке \(\PageIndex{11}\), называется гранью (111) Ga. И наоборот, плоскость [111] будет либо галлиевой с тремя оборванными связями, либо мышьяковой с одной оборванной связью. Опять же, последний энергетически более выгоден, и поэтому плоскость [111] называется гранью (111) As.
(111) As отличается от (111) Ga из-за разницы в количестве электронов на поверхности. Как следствие, грань (111) As травится быстрее, чем грань (111) Ga. Кроме того, поверхностное испарение ниже 770 °C происходит быстрее на грани (111) As.
Эта страница под названием 7.2: Structures of Element and Compound Semiconductors распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована Паваном М. В. Раджа и Эндрю Р. Бэрроном (OpenStax CNX) через исходный контент, который был отредактирован. к стилю и стандартам платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Паван М. В. Раджа и Эндрю Р. Бэррон
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Полупроводники
- источник@http://cnx.org/contents/[email protected]
404: Страница не найдена
Страница, которую вы пытались открыть по этому адресу, похоже, не существует. Обычно это результат плохой или устаревшей ссылки. Мы извиняемся за любые неудобства.
Что я могу сделать сейчас?
Если вы впервые посещаете TechTarget, добро пожаловать! Извините за обстоятельства, при которых мы встречаемся. Вот куда вы можете пойти отсюда:
Поиск- Пожалуйста, свяжитесь с нами, чтобы сообщить, что эта страница отсутствует, или используйте поле выше, чтобы продолжить поиск
- Наша страница «О нас» содержит дополнительную информацию о сайте, на котором вы находитесь, WhatIs.com.

- Посетите нашу домашнюю страницу и просмотрите наши технические темы
Просмотр по категории
Сеть
- система управления сетью
Система управления сетью, или NMS, представляет собой приложение или набор приложений, которые позволяют сетевым инженерам управлять сетевыми …
- хост (в вычислениях)
Хост — это компьютер или другое устройство, которое обменивается данными с другими хостами в сети.
- Сеть как услуга (NaaS)
Сеть как услуга, или NaaS, представляет собой бизнес-модель для предоставления корпоративных услуг глобальной сети практически на основе подписки.
Безопасность
- E-Sign Act (Закон об электронных подписях в глобальной и национальной торговле)
Закон об электронных подписях (Закон об электронных подписях в глобальной и национальной торговле) — это федеральный закон США, в котором указывается, что в .
 ..
.. - личная информация (PII)
Личная информация (PII) — это любые данные, которые потенциально могут идентифицировать конкретное лицо.
- политика социальных сетей
Политика в отношении социальных сетей — это корпоративный кодекс поведения, в котором содержатся рекомендации для сотрудников, публикующих контент в Интернете …
ИТ-директор
- управление корпоративными проектами (EPM)
Управление корпоративными проектами (EPM) представляет собой профессиональные практики, процессы и инструменты, используемые для управления несколькими …
- Управление портфелем проектов: руководство для начинающих
Управление портфелем проектов — это формальный подход, используемый организациями для выявления, определения приоритетов, координации и мониторинга проектов …
- SWOT-анализ (анализ сильных и слабых сторон, возможностей и угроз)
SWOT-анализ представляет собой основу для выявления и анализа сильных и слабых сторон организации, возможностей и угроз.

HRSoftware
- Эффект хоторна
Эффект Хоторна — это изменение поведения участников исследования в ответ на их знание о том, что они …
- командное сотрудничество
Совместная работа в команде — это подход к общению и управлению проектами, который делает упор на командную работу, новаторское мышление и равенство …
- самообслуживание сотрудников (ESS)
Самообслуживание сотрудников (ESS) — это широко используемая технология управления персоналом, которая позволяет сотрудникам выполнять множество связанных с работой …
Отдел обслуживания клиентов
- отток клиентов (отток клиентов)
Отток клиентов, также называемый оттоком клиентов, — это количество платящих клиентов, которые не стали постоянными клиентами.
- разрешение личности
Разрешение идентификационных данных — это процесс управления данными, который связывает поведение клиента в Интернете с его уникальной идентификацией путем сбора .





 ..
..