Дидактический материал
Тренировочные тесты ЕГЭ по химии
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная 2. Вещества только с ионной связью приведены в ряду: 1) F2, ССl4, КС1 2) NaBr,Na2O,KI 3) SO2.P4.CaF2 4) H2S,Br2,K2S 3. Соединение с ионной связью образуется при взаимодействии 1) СН4 и О2 2) SO3 и Н2О 3) С2Н6 и HNO3 4. 1) HCl,NaCl.Cl2 2) O2.H2O.CO2 3) H2O.NH3.CH4 4) NaBr.HBr.CO 5. В каком ряду записаны формулы веществ только с ковалентной полярной 1) С12, NO2, НС1 2) HBr,NO,Br2 3) H2S.H2O.Se 4) HI,H2O,PH3
6. Ковалентная неполярная связь характерна для 1) С12 2) SO3 3) СО 4) SiO 7. Веществом с ковалентной полярной связью является 1) С12 2) NaBr 3) H2S 4) MgCl2 8. Веществом с ковалентной связью является 1) СаС12 2) MgS 3) H2S 4) NaBr 9. 1) NH3 2) Сu 3) H2S 4) I2 10. Веществами с неполярной ковалентной связью являются 1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан 11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
12. Ковалентная полярная связь характерна для 1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь 1)ковалентную полярную 2) ковалентную неполярную 3) ионную 4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая? 1} ацетилена 2) этана 3) этена 4) бензола
15. 1) азота 2) сероводорода 3) метана 4) хлора
16. Водородные связи образуются между молекулами 1) диметилового эфира 2) метанола 3) этилена 4) этилацетата
17. Полярность связи наиболее выражена в молекуле 1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются 1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан
19. Водородная связь не характерна для вещества 1) Н2О 2) СН4 3) NH3 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых 1) KI и Н2О 2) СО2 и К2О 3) H2S и Na2S 4) CS2
21. 1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая? 1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду: 1) C4H10, NO2, NaCl 2) СО, CuO, CH3Cl 3) BaS,C6H6,H2 4) C6H5NO2
24. Ковалентную связь имеет каждое из веществ, указанных в ряду: 1) СаО,С3Н6, S8 2) Fe.NaNO3, CO 3) N2, CuCO3, K2S 4) C6H5NO2, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду: 1) С3Н4, NO, Na2O 2) СО, СН3С1, PBr3 3) Р2Оз, NaHSO4, Сu 4) C6H5NO2, NaF, СС14
26. 1) C3Ha,NO2, NaF 2) КС1, CH3Cl, C6H12О6 3) P2O5, NaHSO4, Ba 4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода 2) хлора 3) фосфина 4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4 3)CBr4 4)CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
30.
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
|
Химическая связь. Ионная, металлическая, водородная связь : Farmf
Химическая связь и строение молекул
Общая химия.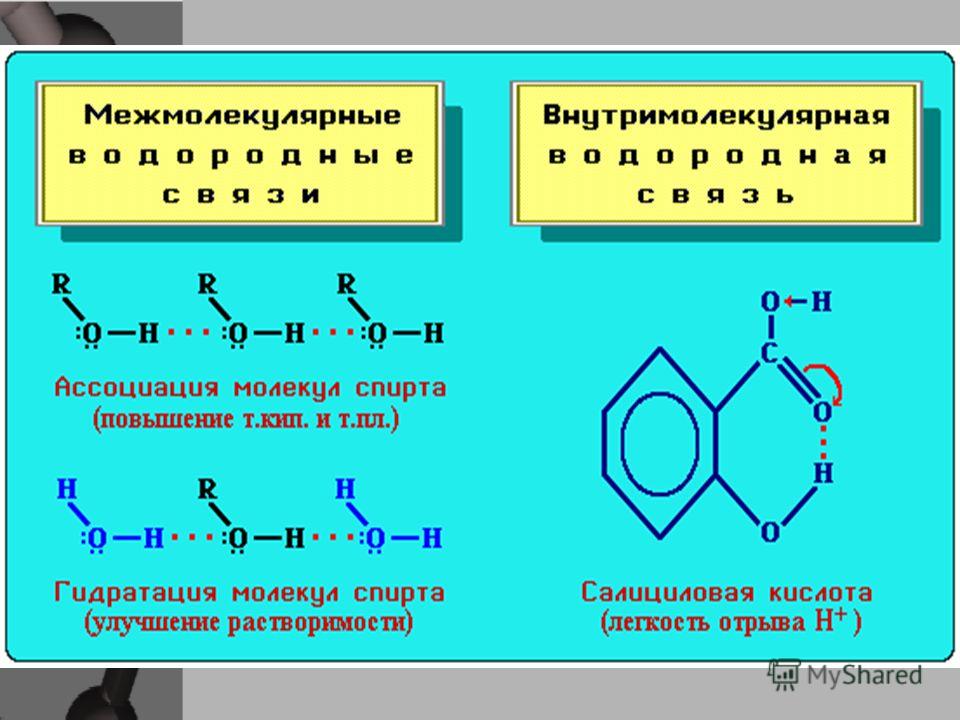 Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 4.1. Определение химической связи
- 4.2. Ионная связь (см.ниже)
- 4.3. Ковалентная связь
- 4.4. Метод валентных связей (МВС, ВС)
- 4.5. Метод молекулярных орбиталей (ММО, МО)
- 4.7. Водородная связь (см.ниже)
- 4.8. Взаимодействия между молекулами. Комплексные соединения
4.1. Определение химической связи.
Свойства веществ зависят от их состава, строения, от типа химической связи между атомами в веществе. Химическая связь имеет электрическую природу. Под химической связью понимают вид взаимодействия между частицами в веществе (или характер распределения электронной плотности).
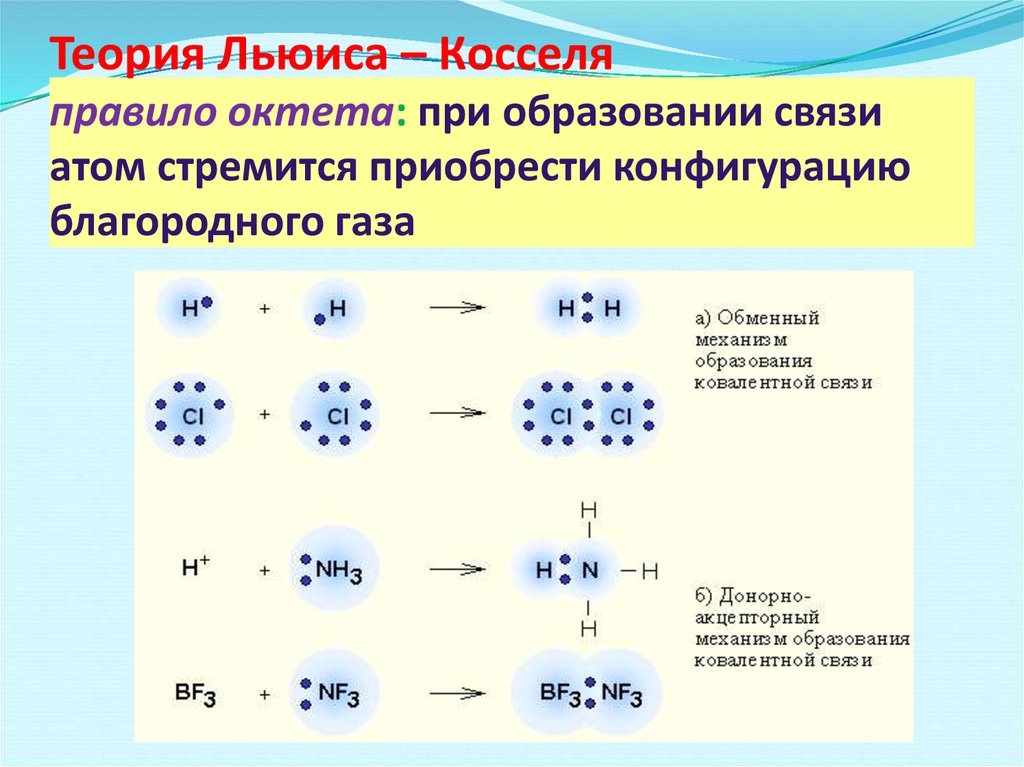
Современная теория химической связи была предложена в 1916 г. американским ученым Льюисом и одновременно с ‘ним немецким ученым Косселем. В дальнейшем эти теории были дополнены, углублены, но являются основополагающими.
В образовании химических связей участвуют не все электроны атома, а только электроны внешнего уровня (у s- и p-элементов, т.е. у элементов главных подгрупп периодической системы) или электроны внешнего и недостроенного предвнешнего уровня (у d-элементов, т.е. у элементов побочных подгрупп). Электроны, способные к образованию химических связей, называются валентными. В зависимости от того, сколько электронов приняло участие в образовании химических связей, элемент может находиться в том или ином валентном состоянии (т.е. проявить определенную валентность).
Прежде валентностью элемента называли его способность присоединять или замещать определенное число атомов других элементов. В настоящее время понятие валентности связывают с определенным типом химической связи в веществе.
Соединение атомов в молекулы – энергетически выгодный процесс и всегда сопровождается выделением энергии, величина которой соответствует прочности (энергии) возникшей химической связи:
H+H=H2+103 ккал/моль
Cl+Cl=Cl2+58 ккал/моль
Теория строения атома объяснила причину объединения атомов в молекулы как стремление к устойчивой двух- или восьмиэлектронной внешней оболочке.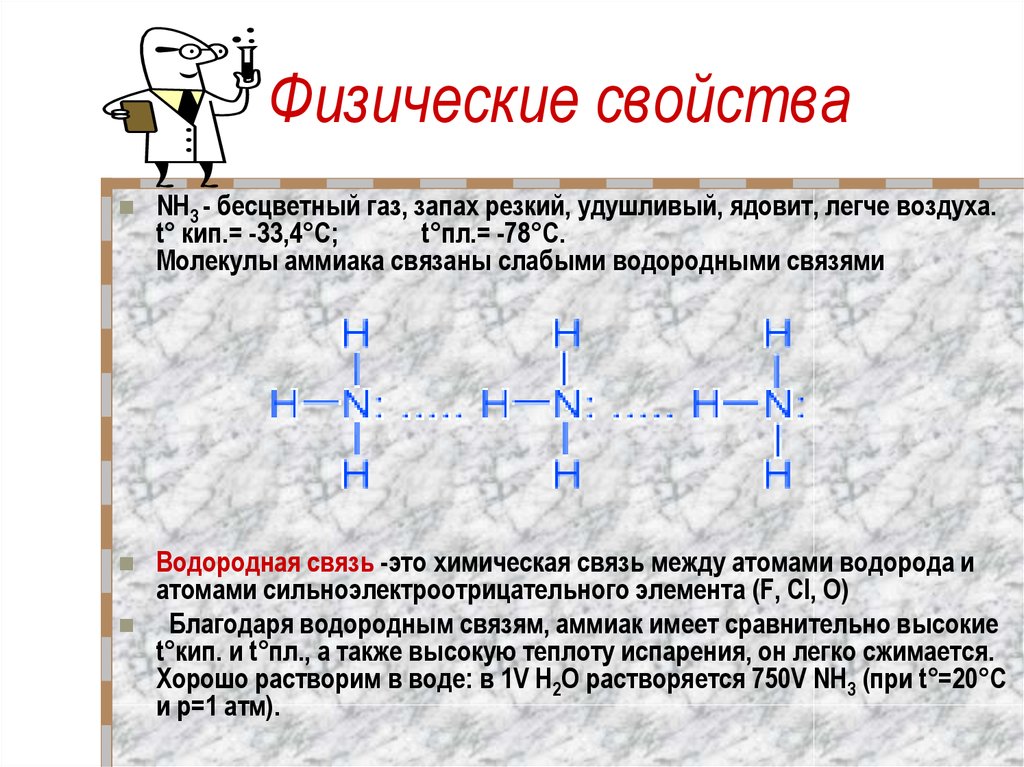 Образование устойчивой электронной конфигурации может достигаться различными способами: отдачей, присоединением, обобществлением электронов. Таким образом, под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ. К основным чертам химической связи можно отнести:
Образование устойчивой электронной конфигурации может достигаться различными способами: отдачей, присоединением, обобществлением электронов. Таким образом, под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ. К основным чертам химической связи можно отнести:
а) снижение общей энергии двух- или многоатомной системы по
сравнению с суммарной энергией изолированных частиц, из которых
эта система образована;
б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом.
Существует несколько типов химической связи, из которых важнейшими являются ионная, ковалентная, металлическая связь.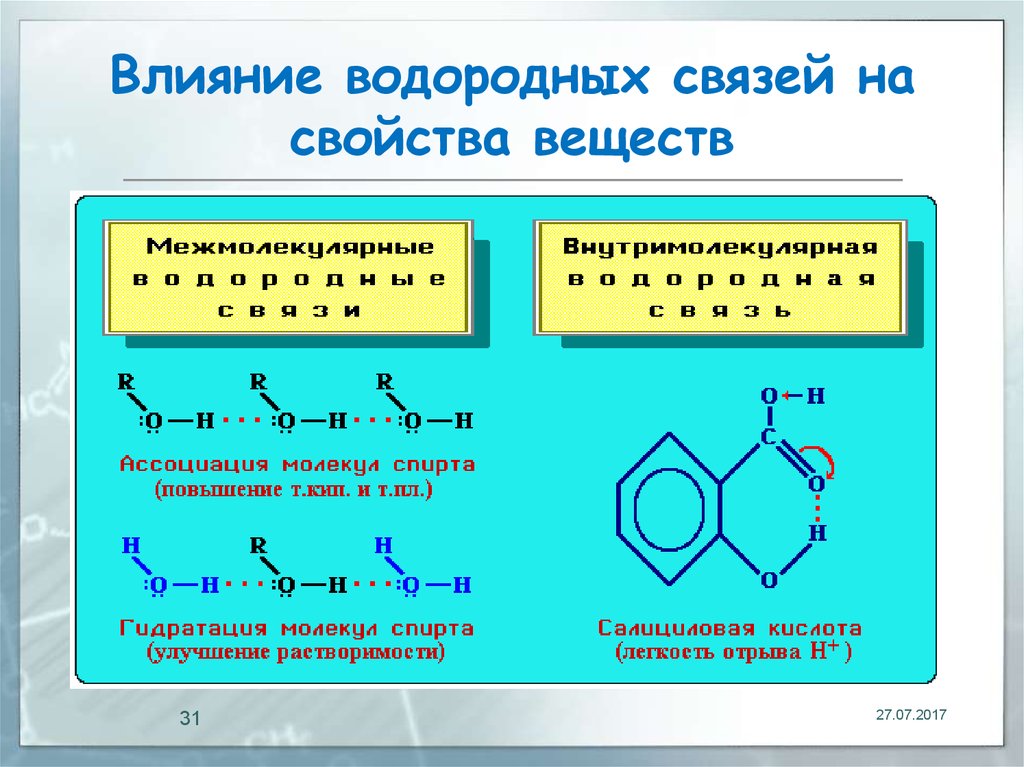
4.2. Ионная связь.
При образовании любой молекулы, атомы этой молекулы «связываются» друг с другом. Причина образования молекул состоит в том, что между атомами в молекуле действуют электростатические силы. Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное.
Если на внешнем уровне содержится максимальное число электронов, которое атом может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Такие уровни имеют атомы инертных газов. Это и служит причиной того, что инертные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы других элементов имеют незавершенные энергетические уровни. В процессе химического взаимодействия они их завершают, т. е. приобретают структуру инертных газов.
Ионный тип связи возможен только у элементов, атомы которых резко отличаются по относительной электроотрицательности (см. раздел 3.3.), т.е. способности атомов смещать электронную плотность в молекуле к себе.
раздел 3.3.), т.е. способности атомов смещать электронную плотность в молекуле к себе.
Рассмотрим электронное строение атомов некоторых металлов. неметаллов и инертного газа неона.
Электронная формула атома
натрия Is22s22p63s1 или [Ne] 3s1
кальция Is22s22p63s23p64s2 или [Ar] 4s2
хлора Is22s22p63s23p5 или [Ne] Зs23p5
кислорода Is22s2p4 или [He ]2s22p4
неона Is2s2p6
Как видно из электронного строения, атом неона имеет завершенный внешний энергетический уровень, состоящий из восьми электронов, а атомы металлов (натрия и кальция) и неметаллов (хлора и кислорода) — незавершенные энергетические уровни. В процессе химических реакций они стремятся завершить их, т.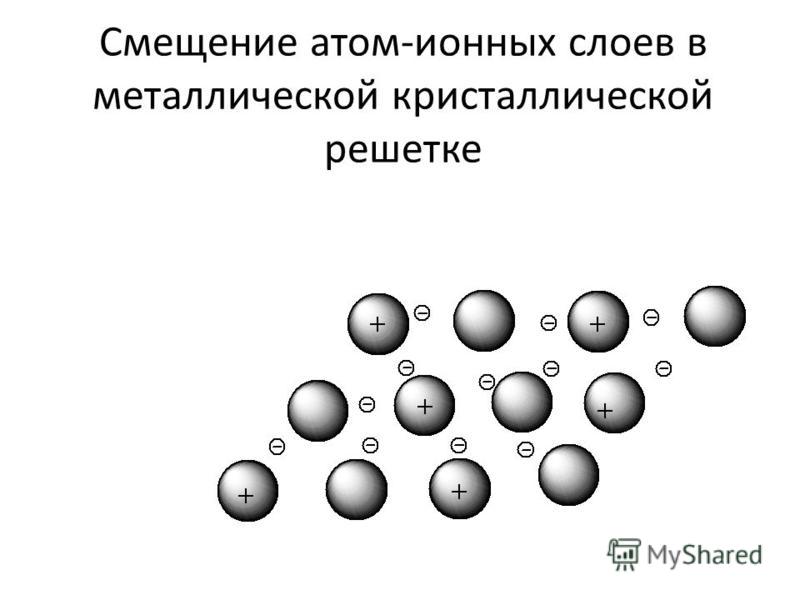 е. принять конфигурацию инертных газов.
е. принять конфигурацию инертных газов.
Для завершения энергетических уровней атомам натрия и кальция легче отдать один и два электрона, а атомам хлора и кислорода легче принять один или два электрона. Это и происходит при образовании молекул.
Образование молекул хлорида натрия (NaCI) и оксида кальция (СаО) происходит по схеме:
Na – ē → Na+[Ne]
Cl + ē →Cl–[Ar]
Атом натрия теряет электрон и превращается в ион натрия, который приобретает конфигурацию инертного газа (Ne), а атом хлора присоединяет электрон, превращается в ион хлора, приобретая конфигурацию инертного газа аргона (Аг).
Аналогично происходит и образование молекулы оксида кальция
Ca – 2ē → Ca2+[Ar]
O + 2ē → O2– [Ne]
Ионы, вследствие сил электростатического притяжения, образуют молекулы. Соединения, которые образовались путем притяжения ионов, называются ионными.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью. Ионных соединений сравнительно немного. Современная теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владения одного из соединяющихся атомов, т. е. ионная связь — крайний случай ковалентной связи.
Ионных соединений сравнительно немного. Современная теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владения одного из соединяющихся атомов, т. е. ионная связь — крайний случай ковалентной связи.
Таким образом, нет принципиального различия в механизме возникновения неполярной ковалентной, полярной ковалентной и ионной связей. Они различаются лишь степенью поляризации молекулярного электронного облака. Природа химической связи едина.
Для соединений с ионной связью характерны высокая температура кипения и плавления, электропроводностью обладают только в расплавленном состоянии, в воде легко диссоциируют на ионы.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью.
Ненаправленность ионной связи. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределены во всех направлениях в пространстве.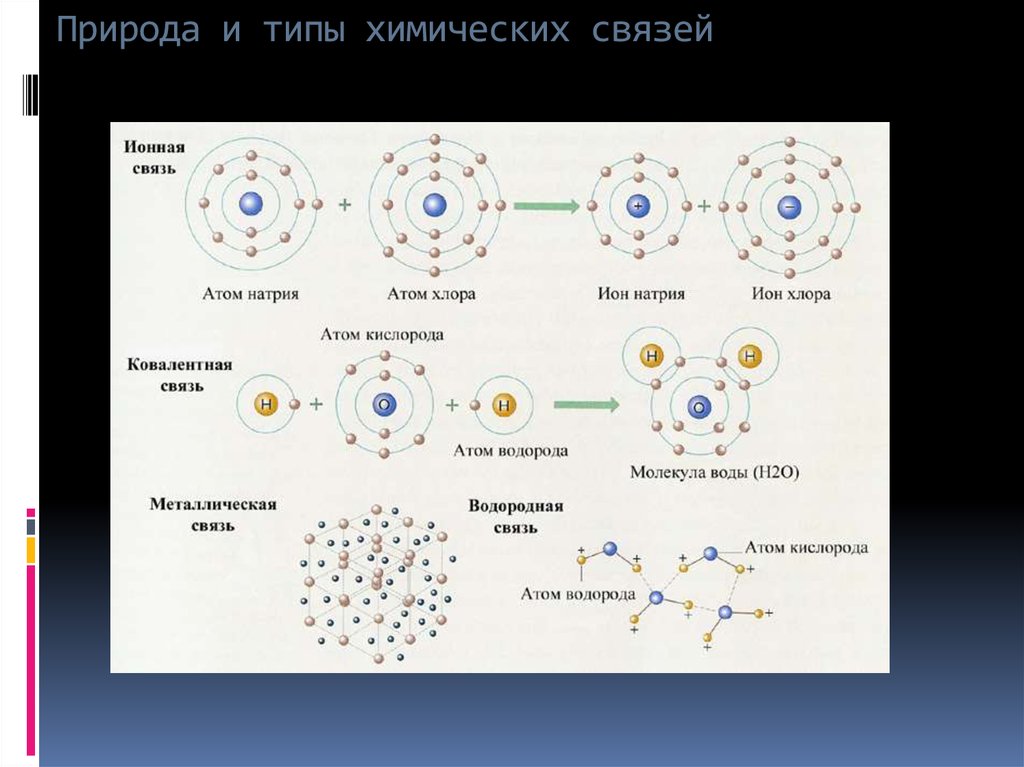 Поэтому каждый ион может притянуть к себе ионы противоположного знака в любом направлении (рис. 5).
Поэтому каждый ион может притянуть к себе ионы противоположного знака в любом направлении (рис. 5).
Ненасыщаемость ионной связи. Взаимодействие двух ионов противоположного знака друг с другом не может привести к полной взаимной компенсации их силовых полей. В силу этого, у них сохраняется способность притягивать ноны противоположного знака и по другим направлениям (рис. 6).
4.6. Металлическая связь.
Само название говорит, что речь пойдет о внутренней структуре металлов. Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов. Так, по одному электрону содержат 16 элементов, по два — 56, по три — 4 элемента и ноль — только один Pd. В то же время на внешних уровнях атомов металлов много свободных орбиталей, что позволяет электронам близко подходить к положительным ядрам в любой части кристалла.
Из-за низкой энергии ионизации электроны в металле утрачивают связь с отдельными атомами, легко обобществляются, образуя электронный газ — совокупность свободных электронов.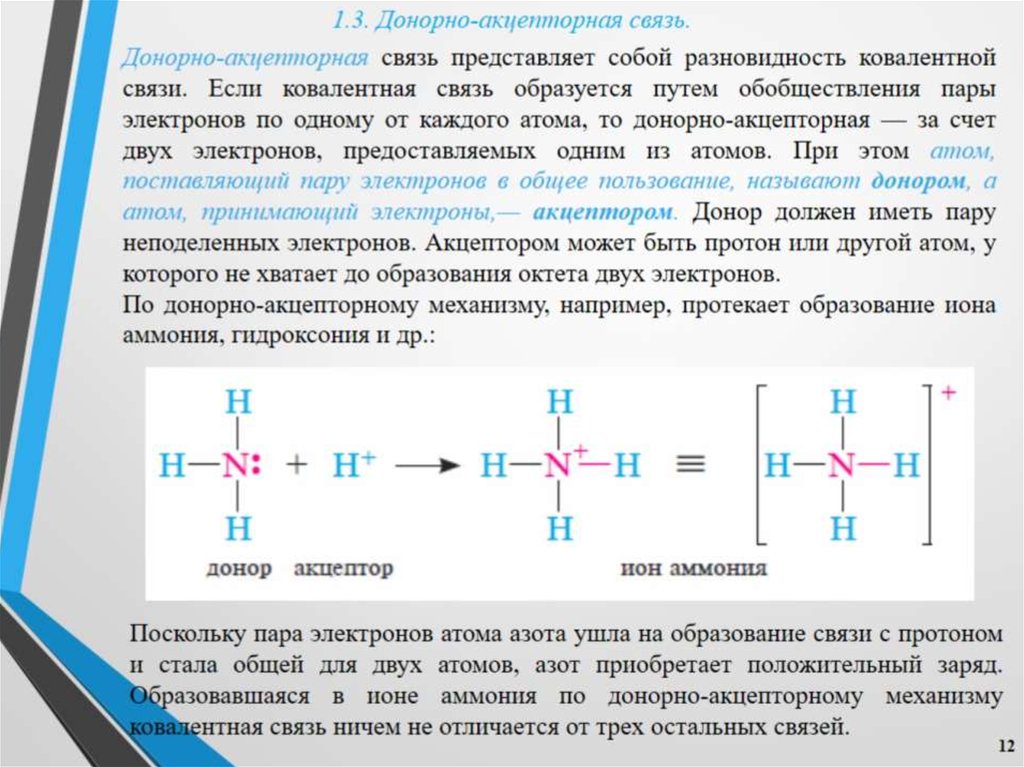 И самое главное состоит в том, что электроны в металле подвижны, легко перемещаются. Это подвижные, или нелокализованные, электроны.
И самое главное состоит в том, что электроны в металле подвижны, легко перемещаются. Это подвижные, или нелокализованные, электроны.
Теперь можно представить металл как плотно упакованную структуру положительных ионов, связанных друг с другом электронным газом. При этом сравнительно небольшое число обобществленных электронов связывает большое число ионов.
Химическая связь, образующаяся в результате электрического притяжения между ионами металла и обобществленными электронами (электронным газом), называется металлической связью. Она характерна для металлов, сплавов и интерметаллических соединений. Природа связи — электрическая.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобщении валентных электронов. Однако при ковалентной связи обобщены валентные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны; в последнем случае возможно взаимное смещение ионов без нарушения связи.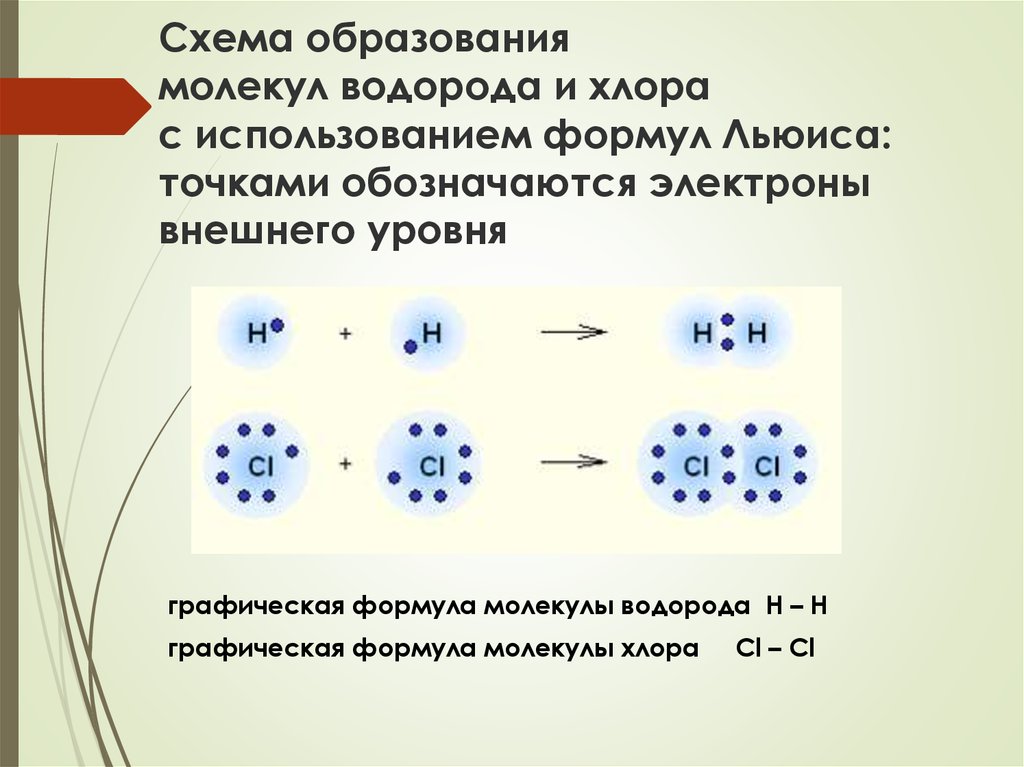 Это говорит о нелокализованности (отсутствии направленности) металлической связи. Для повышения твердости металлов в них вводят такие элементы, которые благоприятствуют образованию направленных — ковалентных — связей.
Это говорит о нелокализованности (отсутствии направленности) металлической связи. Для повышения твердости металлов в них вводят такие элементы, которые благоприятствуют образованию направленных — ковалентных — связей.
Таким образом, металлическая связь—это сильно нелокализованная химическая связь, возникающая в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, а валентные электроны из-за малой энергии ионизации слабо удерживаются ядром. Ею объясняются физические свойства металлов.
4.7. Водородная связь.
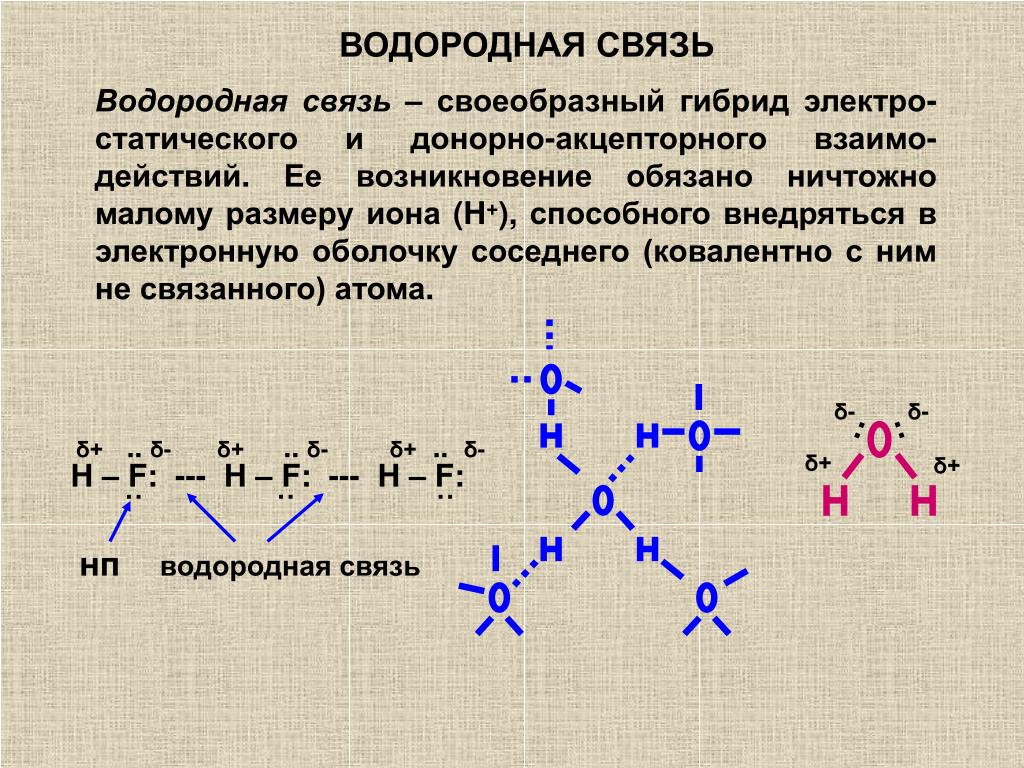
Водородная связь — это своеобразная химическая связь. Она возникает между молекулами, в состав которых входит водород и сильно электроотрицательный элемент. Такими элементами являются фтор, кислород, азот, хлор и др.
Природу водородной связи объясняли по-разному. Наибольшее распространение получило электростатическое взаимодействие.
Механизм водородной связи рассмотрим на примере молекулы воды.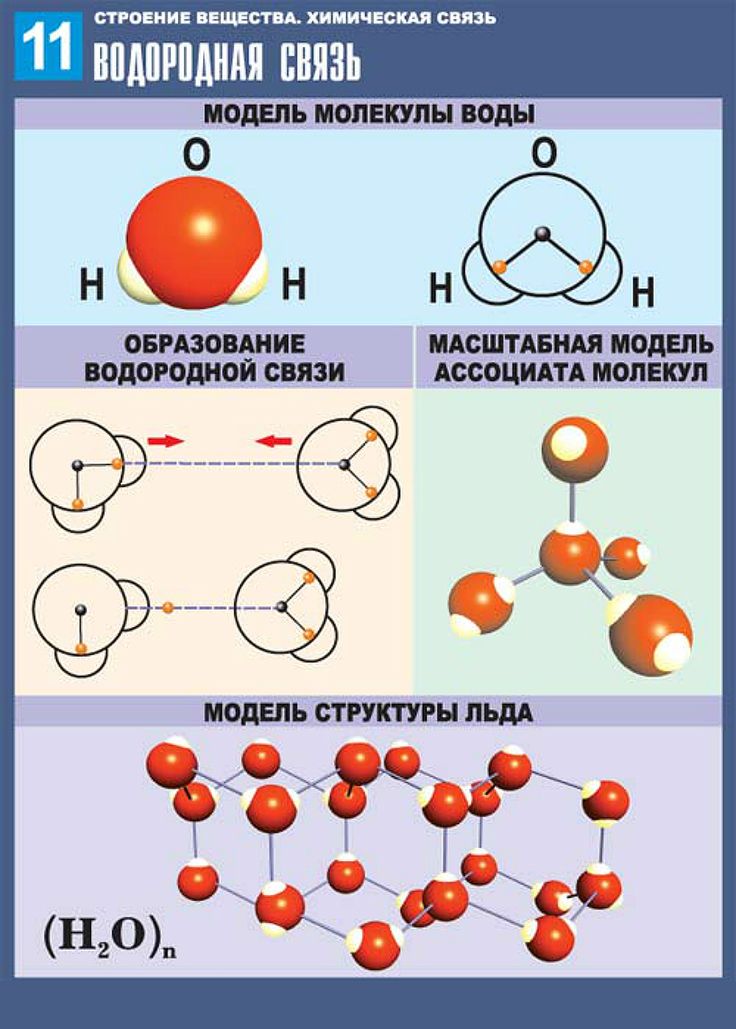 При образовании полярной ковалентной связи между атомами водорода и атомом кислорода электроны, первоначально принадлежащие атому водорода, сильно смещаются в сторону кислорода. В результате атом кислорода приобретает значительный эффективный отрицательный заряд, а ядро атома водорода с внешней по отношению к атому кислорода стороны почти лишается электронного облака. Между протоном атома водорода и отрицательно заряженным атомом кислорода соседней молекулы воды возникает электростатическое притяжение, что и приводит к образованию водородной связи.
При образовании полярной ковалентной связи между атомами водорода и атомом кислорода электроны, первоначально принадлежащие атому водорода, сильно смещаются в сторону кислорода. В результате атом кислорода приобретает значительный эффективный отрицательный заряд, а ядро атома водорода с внешней по отношению к атому кислорода стороны почти лишается электронного облака. Между протоном атома водорода и отрицательно заряженным атомом кислорода соседней молекулы воды возникает электростатическое притяжение, что и приводит к образованию водородной связи.
Процесс образования водородной связи на примере двух молекул воды может быть представлен следующей схемой (точками обозначается водородная связь, а знаками σ+, σ – — эффективные заряды атомов):
Более правильным следует считать, что в образовании водородной связи принимает участие и донорно-акцепторное взаимодействие. Ведь для этой связи характерны направленность в пространстве и насыщаемость. На это впервые указал Н. Д. Соколов, разработавший квантово-механическую теорию водородной связи.
На это впервые указал Н. Д. Соколов, разработавший квантово-механическую теорию водородной связи.
Согласно донорно-акцепторной теории, водородная связь начинается с электростатического взаимодействия, в результате которого электронная пара атомов водорода еще больше смещается в сторону кислорода, благодаря чему атом водорода как бы «оголяется», другими словами s-орбнталь атома водорода «высвобождается» и становится способной принять неподеленную электронную пару атома кислорода другой молекулы. Поле протона велико и притяжение им электронной пары атома кислорода весьма эффективно, в то время других своих электронов около протона нет, поэтому отталкивание другой молекулы воды в области атома водорода сильно понижается.
Этот механизм объясняет, почему только водород способен образовывать водородную связь. У всякого другого атома при освобождении орбитали ядро не «оголяется» и внутренние оболочки обеспечивают отталкивание от электронных оболочек второй молекулы.
Рассмотренный механизм образования водородной связи требует, чтобы атом элемента, соединяясь с водородом, обладал высокой относительной электроотрицательностью и имел в наличии неподеленную электронную пару. Только при этом условии электронное облако атома водорода достаточно сильно сместится в сторону атома партнера. Таким образом, химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы—А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью.
Только при этом условии электронное облако атома водорода достаточно сильно сместится в сторону атома партнера. Таким образом, химическая связь, образованная положительно поляризованным водородом молекулы А—Н (или полярной группы—А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью.
Образование водородной связи обусловлено тем, что в полярных молекулах А-Н или полярных группах -А-Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Электростатическая модель образования водородных связей верна только в первом приближении, поскольку энергетически дополнительное связывание атома водорода должно иметь химическую природу. Метод валентных связей не может объяснить образование дополнительной связи атома Н, так как атом водорода одновалентен. Метод молекулярных орбиталей в его многоцентровом варианте дает следующее объяснение образования водородной связи. При сближении атома Н, ковалентно связанного с атомом электроотрицательного элемента Аδ- — Нδ+, с другим атомом также электроотрицательного элемента Вδ- возникает трехцентровая связывающая молекулярная орбиталь, пребывание в которой электронной пары атома В более выгодно, чем на атомной орбитали этого же атома.
Метод молекулярных орбиталей в его многоцентровом варианте дает следующее объяснение образования водородной связи. При сближении атома Н, ковалентно связанного с атомом электроотрицательного элемента Аδ- — Нδ+, с другим атомом также электроотрицательного элемента Вδ- возникает трехцентровая связывающая молекулярная орбиталь, пребывание в которой электронной пары атома В более выгодно, чем на атомной орбитали этого же атома.
Обычно водородную связь обозначают точками и этим указывают, что она слабее ковалентной связи (примерно в 15—20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димеров уксусной кислоты можно представить схемой агрегаций молекул за счет водородных связей:
1.Образование зигзагообразных цепей в жидком фтороводороде HF:
2. Образование гидрата аммиака NН3 ∙ Н2О при растворении аммиака в воде:
10 класс. Биология. Вода и её роль в жизнедеятельности клетки — Вода и её роль в жизнедеятельности клетки
Комментарии преподавателяЦель урока – ознакомление со структурой молекулы воды, и её ролью в жизнедеятельности клетки.
Вода является одним из самых распространенных веществ на нашей планете. Для многих живых организмов вода важна вдвойне, т.к. она не только входит в состав их клеток, но и является средой обитания (рис. 1).
Рис. 1. Вода, как среда обитания. Часть кораллового рифа
В клетке в количественном отношении, вода занимает первое место среди всех химических соединений.
Вода в организме бывает свободной и связанной.
Свободная вода входит в состав цитоплазмы клетки, вакуоли; заполняет межклеточное пространство, сосуды, пространство между органами, — она нужна для транспорта и переноса веществ.
Связанная вода входит в состав клеточных структур (белков, мембран) и поддерживает их структуру.
Вода имеет ряд свойств, исключительно важных для живых организмов. Уникальные свойства воды определяются структурой её молекулы.
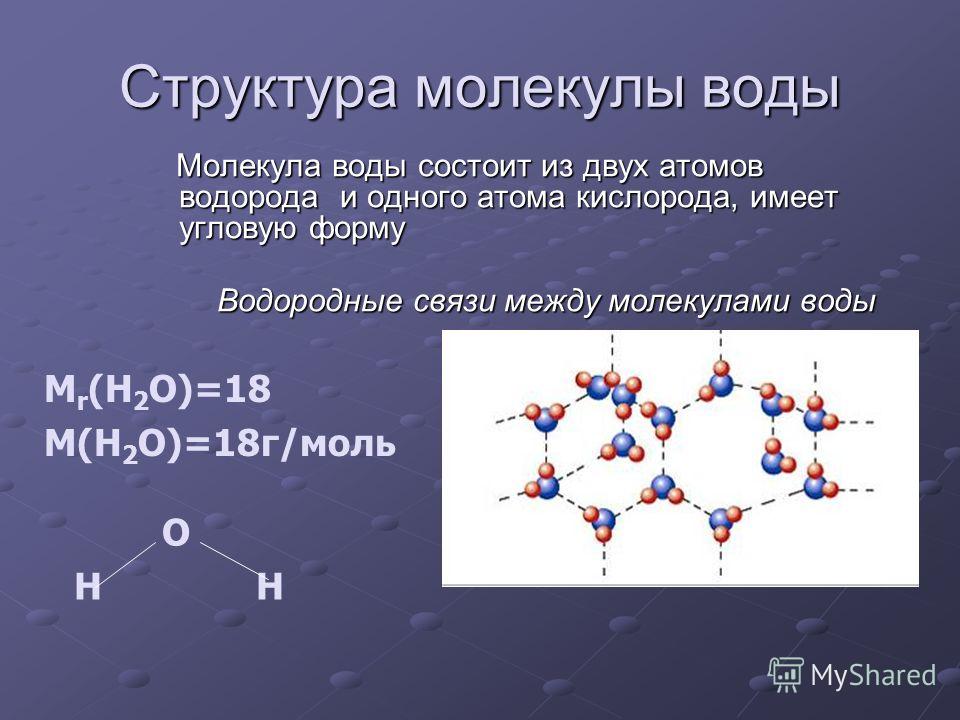
Молекула воды состоит из атома кислорода и двух атомов водорода.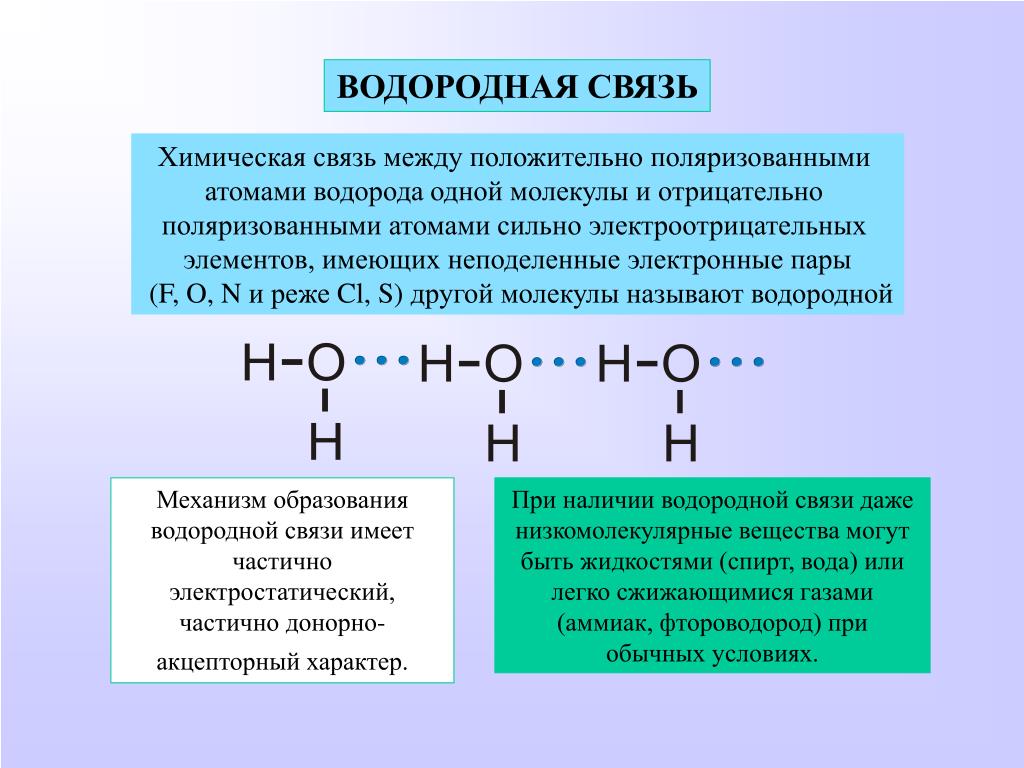
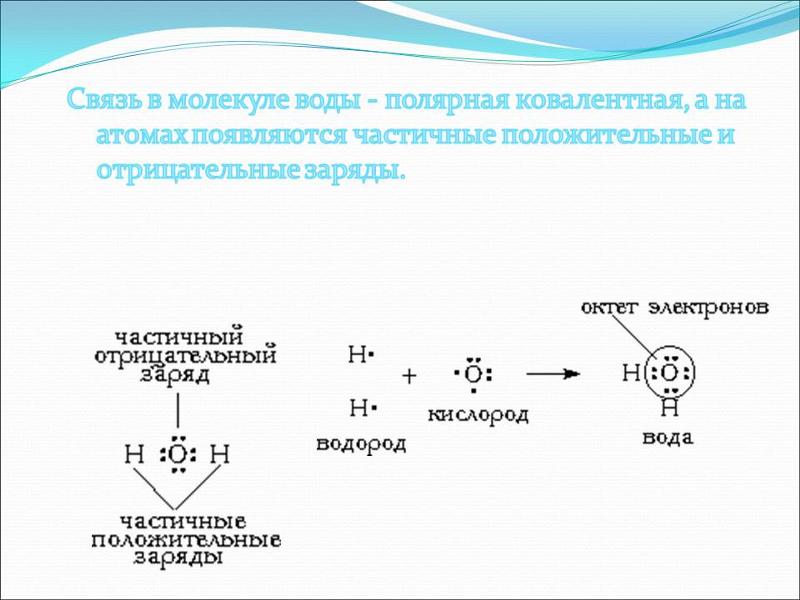
Атом кислорода как более электроотрицательный, чем атомы водорода, оттягивает электронную плотность на себя. В результате она смещается в его сторону, и на атомах водорода возникает частично положительный заряд, а на атоме кислорода частично отрицательный заряд.
Так как атомы в молекуле воды образуют угол (рис. 2), один конец молекулы воды несет положительный заряд, а другой – отрицательный. Такую молекулу называют диполем (рис. 2), или полярной молекулой.
Рис. 2. Распределение заряда в молекуле воды
Частичный положительный заряд атома водорода одной молекулы взаимодействует с частичным отрицательным зарядом атома кислорода другой молекулы. Между ними возникает электростатическое взаимодействие, и образуются водородные связи. Водородные связи слабые, но в воде их достаточно много, поэтому уникальные свойства воды как раз и определяется наличием водородных связей в воде.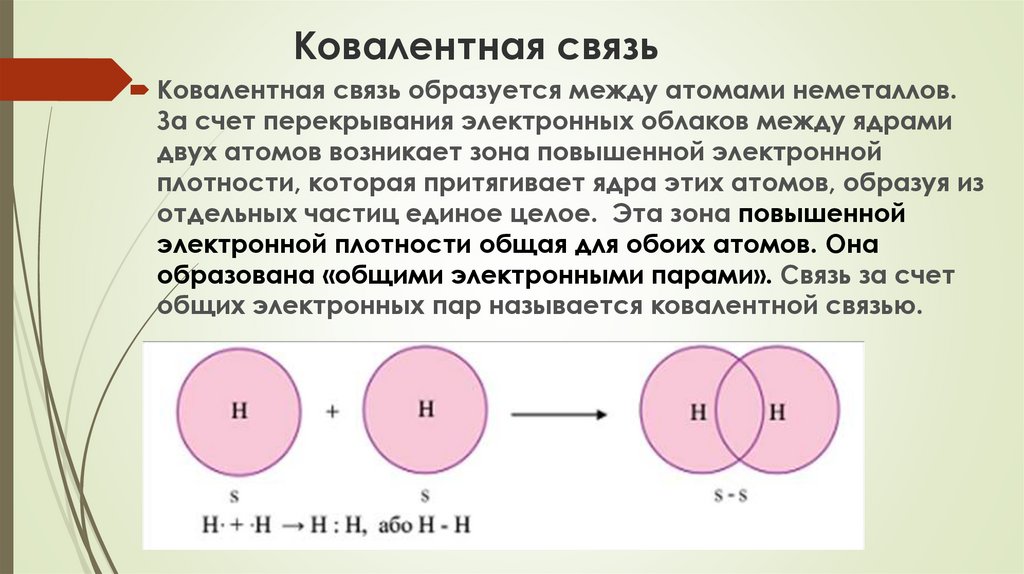
Рис. 3. Схема образования водородной связи между разноименно заряженными атомами в двух молекулах воды
Учитывая данную способность воды, рассмотрим те свойств воды, которые важны с биологической точки зрения.
Вода — универсальный растворитель. Она превосходный растворитель для полярных соединений. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы, ионы, диссоциируют, то есть отделяются друг от друга в воде, когда вещество растворяется.
Рис. 4. Растворение полярного вещества в овде. Образование ионов с гидратной оболочкой
А также соединения, например, сахара и простые спирты, в молекулах которых присутствуют заряженные группы, то есть эти вещества имеют функциональные группы для взаимодействия с водой (рис. 4).
Рис. 5. Гидролиз сахарозы в воде
В растворе молекулы или ионы вещества начинают быстрее двигаться, и реакционная способность этого вещества возрастает.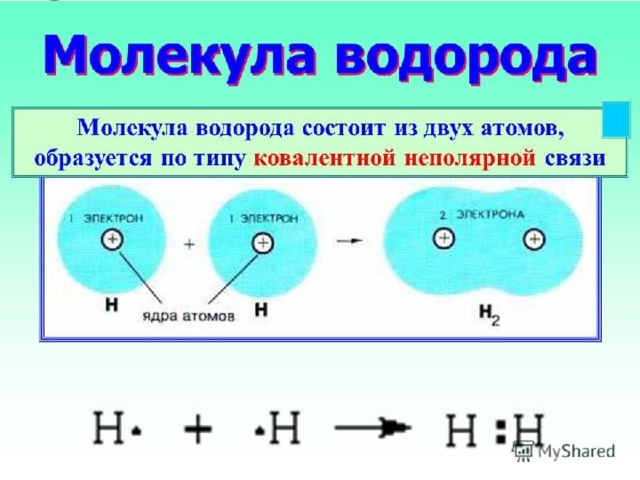 Все биохимические процессы проходят в водных растворах.
Все биохимические процессы проходят в водных растворах.
Полярные вещества «липиды» не смешиваются с водой, и поэтому могут разделять водные растворы на отдельные компартменты. Неполярные части молекул отталкиваются водой, и в ее присутствии притягиваются друг к другу.
Неполярные молекулы взаимодействуют с водой по-другому – они собираются в капли, образуют пленки. Такие вещества называют гидрофобными.
Рис. 6. Масло — вещество, которое не растворяется в воде – на поверхности воды оно образует пленки (слева) или собирается в капли (справа)
Подобные гидрофобные взаимодействия играют важную роль в обеспечении стабильности молекул субклеточных структур, а также белков и нуклеиновых кислот.
Вода обладает большой теплоёмкостью. То есть поглощает большое количество тепловой энергии при минимальном повышении собственной температуры.
Это достигается за счёт того, что большое количество энергии тратится на разрыв водородных связей. Большая теплоёмкость воды защищает организмы от перегрева. И кроме этого создает постоянные условия для протекания биохимических процессов в организме.
Вода обладает большой теплопроводностью, что обеспечит равномерное распределение тепла по всему организму. За счёт этого, биохимические процессы и все процессы жизнедеятельности проходят в относительно постоянных условиях.
У воды относительно большая теплота испарения. Испарение воды сопровождается охлаждение организма, потому что большое количество энергии тратится на разрыв водородных связей, и эта энергия черпается из окружающей среды.
Вода практически не сжимается, создавая тем самым тургорное давление, определяя объем и упругость клеток и тканей. Например, благодаря этому наша кожа упруга, а у круглых червей и медуз имеется гидростатический скелет.
Например, благодаря этому наша кожа упруга, а у круглых червей и медуз имеется гидростатический скелет.
Вода характеризуется большим поверхностным натяжением, что связано с образованием водородных связей между молекулами воды и другими соединениями.
Рис. 7. Использование поверхностного натяжения живыми организмами. Водомерка бежит по воде (слева). Кровь движется по капилляру (справа)
Благодаря силе поверхностного натяжения воды происходит капиллярный кровоток в нашем организме, восходящий и нисходящий токи воды в теле растений. Многие мелкие организмы извлекают для себя пользу из этого поверхностного натяжения, оно позволяет им удерживаться на воде или скользить по её поверхности.
Рис. 8. Основные биологически важные свойства воды
Таким образом, мы рассмотрели структуру и свойства воды.
Значение потоотделения
Потоотделение – это выделение жидкого секрета на поверхность кожи. Вместе с потом выделяются такие вещества, как аминокислоты, мыла, жирные кислоты, аммиак, холестерин – вещества, которые являются продуктами жизнедеятельности живых организмов. Также с потом могут выделяться ионы тяжелых металлов, которые случайно попали в организм
Состав пота на разных участках человеческого тела не одинаков, и зависит от разных факторов: от состояния организма, от типа питания, от действия других факторов (например, влажности среды, температуры среды), а также от физических нагрузок.
Различают термическое и психогенное потоотделение.
Рис. 9. Виды потоотделения
Термическое потоотделение, зависит от температуры окружающей среды, является одним из механизмов терморегуляции, то есть спасает наш организм от перегрева.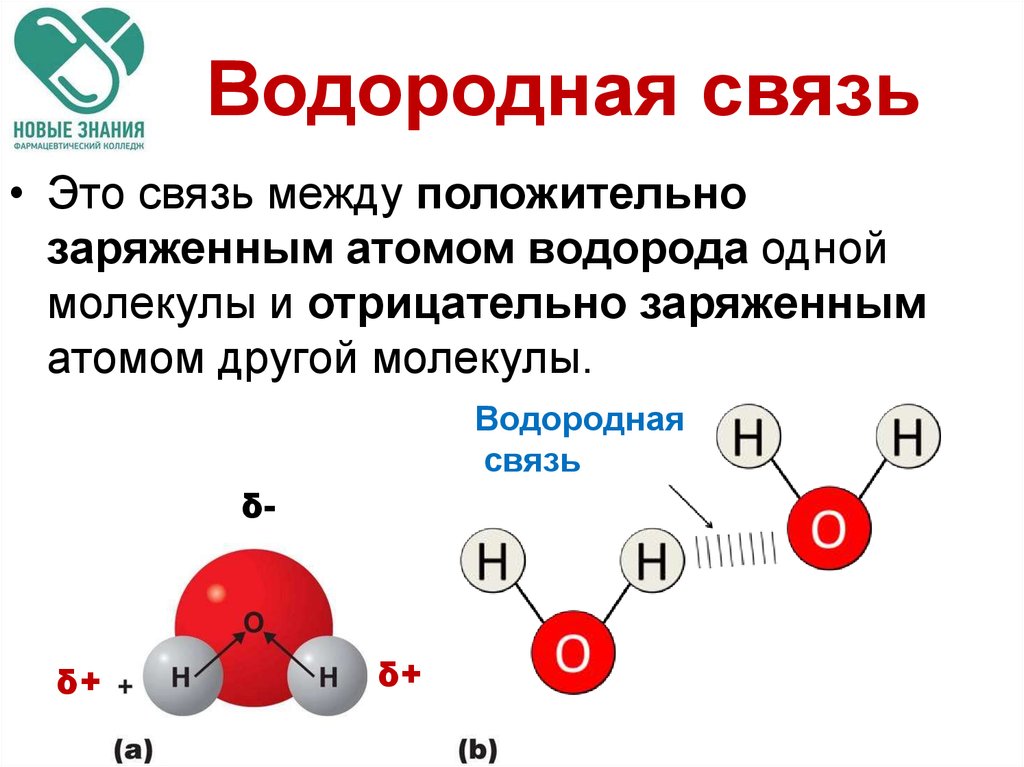 Термическое потоотделение развивается в течении нескольких минут.
Термическое потоотделение развивается в течении нескольких минут.
Психогенное потоотделение зависит от эмоционального состояния.
Психогенное потоотделение может развиваться на разных участках тела человека, это могут быть даже подошвы ног, подушки пальцев; и развивается в течении нескольких секунд.
Плотность воды и поведение её вблизи точки замерзания
Плотность воды максимально при +4оС. Она уменьшается от +4 до 0, то есть лёд менее плотный (а значит более легкий), чем вода.
Рис. 10. Лед, плавающий по поверхности воды (слева), и организмы, живущие подо льдом (справа)
Это имеет большое значение для живых организмов, обитающих в воде, потому что водоемы замерзают сверху, и многие организмы сохраняют в них жизнеспособность подо льдом.
Если бы водоемы замерзали бы снизу, от дна, тогда бы все эти живые организмы погибли бы зимой.
источник конспекта — http://interneturok.ru/ru/school/biology/10-klass/bosnovy-citologii-b/voda-i-eyo-rol-v-zhiznedeyatelnosti-kletki
источник видео — http://www.youtube.com/watch?v=UV_KBari7IY
источник видео — http://www.youtube.com/watch?v=iWV301UCPFU
источник видео — http://www.youtube.com/watch?v=Ho621rq82Qg
источник видео — http://www.youtube.com/watch?v=MllI3wMezXU
источник видео — http://www.youtube.com/watch?v=yrueRLAa84Q
источник презентации — http://www.myshared.ru/slide/download/
Глава 2 — Химические связи — БИО 140 — Биология человека I — Учебник
Глава 2Химические связи
OpenStax, Химические связи. OpenStax CNX. 28 февраля 2018 г. http://cnx.org/contents/2c60e072-7665-49b9-a2c9-2736b72b533c@5. © 28 февраля 2018 г. OpenStax. Контент учебников, созданный OpenStax, находится под лицензией Creative Commons Attribution License 4.0.
Цели обучения
- Объяснить связь между молекулами и соединениями
- Различать ионы, катионы и анионы
- Определите основное различие между ионными и ковалентными связями
- Различают неполярные и полярные ковалентные связи
- Объясните, как молекулы воды соединяются водородными связями
Атомы, разделенные большим расстоянием, не могут соединиться; скорее, они должны подойти достаточно близко, чтобы электроны в их валентных оболочках могли взаимодействовать. Но соприкасаются ли когда-нибудь атомы друг с другом? Большинство физиков сказали бы «нет», потому что отрицательно заряженные электроны в своих валентных оболочках отталкиваются друг от друга. Никакая сила в человеческом теле или где-либо еще в мире природы не может преодолеть это электрическое отталкивание. Поэтому, когда вы читаете об атомах, соединяющихся друг с другом или сталкивающихся друг с другом, имейте в виду, что атомы не сливаются в физическом смысле.
Но соприкасаются ли когда-нибудь атомы друг с другом? Большинство физиков сказали бы «нет», потому что отрицательно заряженные электроны в своих валентных оболочках отталкиваются друг от друга. Никакая сила в человеческом теле или где-либо еще в мире природы не может преодолеть это электрическое отталкивание. Поэтому, когда вы читаете об атомах, соединяющихся друг с другом или сталкивающихся друг с другом, имейте в виду, что атомы не сливаются в физическом смысле.
Вместо этого атомы соединяются, образуя химическую связь. Связь – это слабое или сильное электрическое притяжение, которое удерживает атомы в одном и том же месте. Новая группа, как правило, более стабильна (с меньшей вероятностью снова прореагирует), чем атомы, входящие в ее состав, когда они были разделены. Более или менее стабильная группа из двух или более атомов, удерживаемых вместе химическими связями, называется молекулой. Связанные атомы могут принадлежать одному и тому же элементу, как в случае H 2 , который называется молекулярным водородом или газообразным водородом.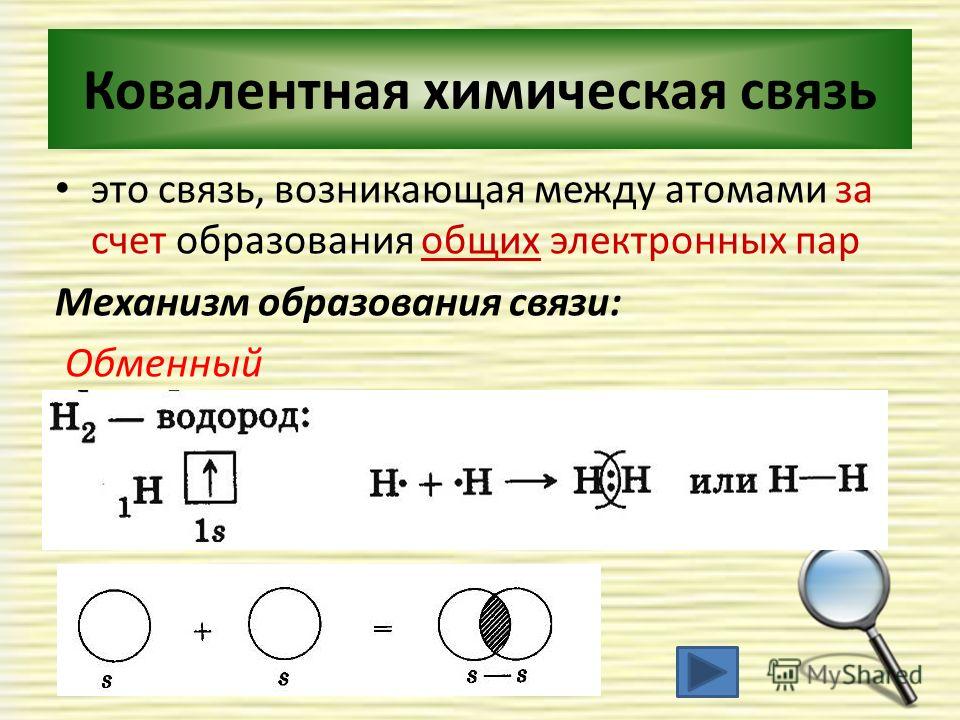 Когда молекула состоит из двух или более атомов разных элементов, она называется химическим соединением. Таким образом, единица воды, или H 2 O представляет собой соединение, как и отдельная молекула газообразного метана, или CH 4 .
Когда молекула состоит из двух или более атомов разных элементов, она называется химическим соединением. Таким образом, единица воды, или H 2 O представляет собой соединение, как и отдельная молекула газообразного метана, или CH 4 .
Три типа химических связей важны в физиологии человека, потому что они удерживают вместе вещества, которые используются организмом для важнейших аспектов гомеостаза, передачи сигналов и производства энергии, и это лишь некоторые из важных процессов. Это ионные связи, ковалентные связи и водородные связи.
Ионы и ионные связи Напомним, что атом обычно имеет одинаковое количество положительно заряженных протонов и отрицательно заряженных электронов. Пока сохраняется эта ситуация, атом электрически нейтрален. Но когда атом участвует в химической реакции, которая приводит к отдаче или принятию одного или нескольких электронов, атом становится положительно или отрицательно заряженным. Это часто происходит для большинства атомов, чтобы иметь полную валентную оболочку, как описано ранее. Это может произойти либо путем получения электронов, чтобы заполнить оболочку, которая заполнена более чем наполовину, либо путем отдачи электронов, чтобы опустошить оболочку, которая заполнена менее чем наполовину, тем самым оставляя следующую меньшую электронную оболочку в качестве новой, полной валентности. оболочка. Атом, имеющий электрический заряд, положительный или отрицательный, – это ион.
Это может произойти либо путем получения электронов, чтобы заполнить оболочку, которая заполнена более чем наполовину, либо путем отдачи электронов, чтобы опустошить оболочку, которая заполнена менее чем наполовину, тем самым оставляя следующую меньшую электронную оболочку в качестве новой, полной валентности. оболочка. Атом, имеющий электрический заряд, положительный или отрицательный, – это ион.
Калий (K), например, является важным элементом во всех клетках организма. Его атомный номер — 19. В его валентной оболочке всего один электрон. Эта характеристика делает калий весьма вероятным для участия в химических реакциях, в которых он отдает один электрон. (Калию легче отдать один электрон, чем получить семь электронов.) Потеря приведет к тому, что положительный заряд протонов калия будет более влиятельным, чем отрицательный заряд электронов калия. Другими словами, полученный ион калия будет слегка положительным. Ион калия записывается K + , что указывает на то, что он потерял один электрон.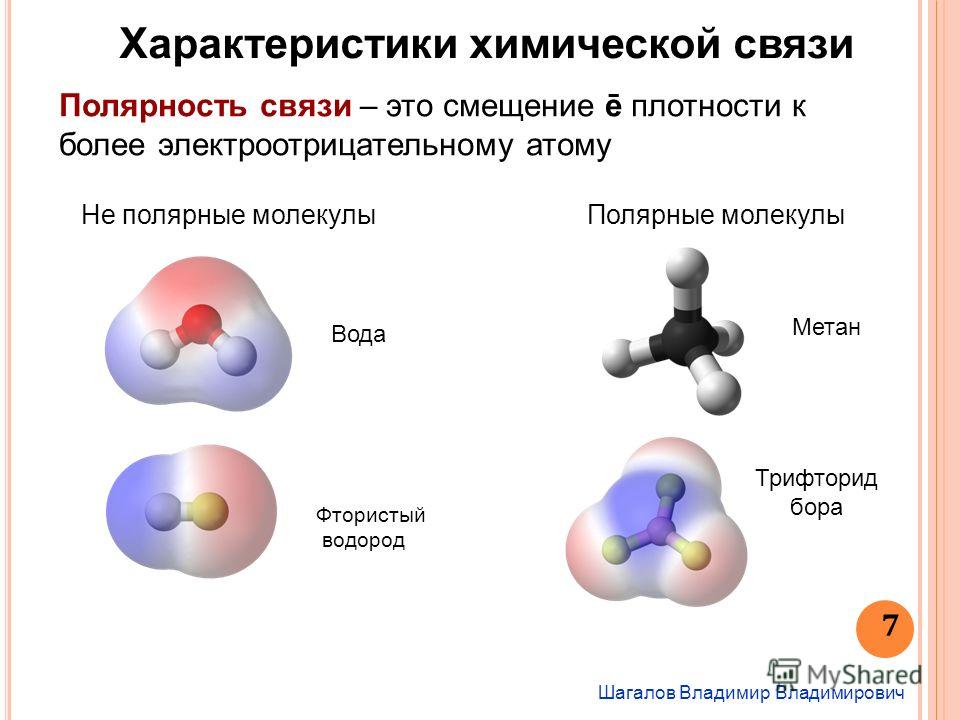 Положительно заряженный ион известен как катион.
Положительно заряженный ион известен как катион.
Теперь рассмотрим фтор (F), компонент костей и зубов. Его атомный номер девять, и у него семь электронов в его валентной оболочке. Таким образом, весьма вероятно, что фтор свяжется с другими атомами таким образом, что фтор примет один электрон (фтору легче получить один электрон, чем отдать семь электронов). Когда это произойдет, его электронов будет на один больше, чем его протонов, и он будет иметь общий отрицательный заряд. Ионизированная форма фтора называется фторидом и записывается как F – . Отрицательно заряженный ион известен как анион.
Атомы, которые могут отдать или принять более одного электрона, получат более сильный положительный или отрицательный заряд. Катион, отдавший два электрона, имеет суммарный заряд +2. Используя магний (Mg) в качестве примера, это можно записать как Mg ++ или Mg 2+ . Анион, принявший два электрона, имеет суммарный заряд -2. Ионная форма селена (Se), например, обычно записывается Se 2–.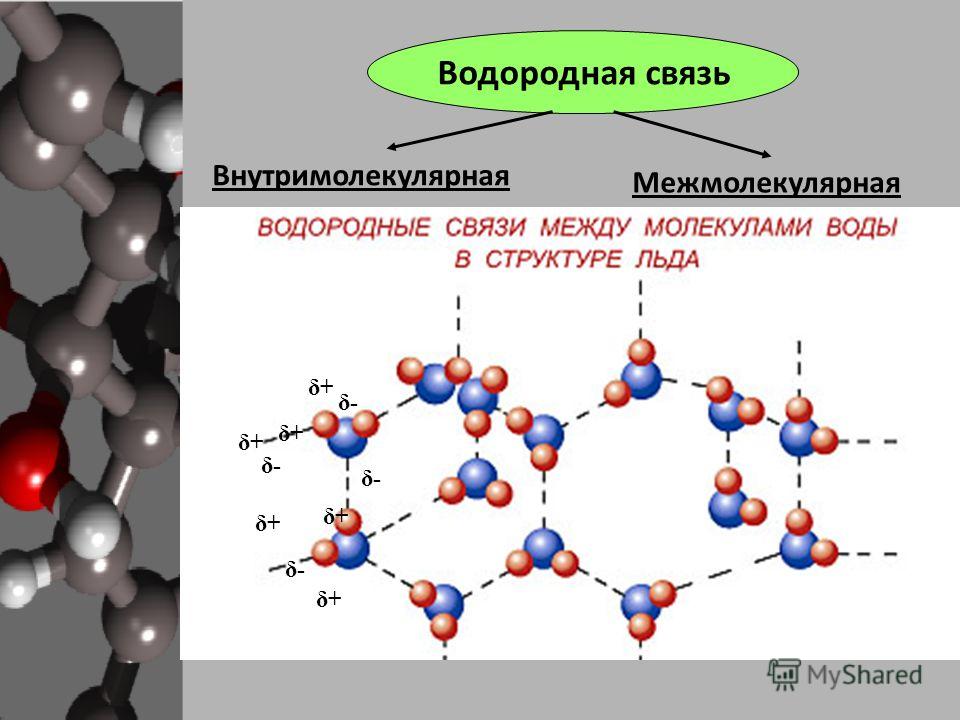
Противоположные заряды катионов и анионов вызывают умеренно сильное взаимное притяжение, которое удерживает атомы в непосредственной близости, образуя ионную связь. Ионная связь – это постоянная тесная связь между ионами с противоположным зарядом. Поваренная соль, которой вы посыпаете еду, обязана своим существованием ионной связи. Как показано на рисунке 1, натрий обычно отдает электрон хлору, превращаясь в катион Na + . Когда хлор принимает электрон, он становится анионом хлора, Cl – . Эти два иона с их противоположными зарядами сильно притягиваются друг к другу.
Ионная связь
Рис. 1: (а) Натрий легко отдает единственный электрон в своей валентной оболочке хлору, которому требуется только один электрон, чтобы иметь полную валентную оболочку. (b) Противоположные электрические заряды образующихся катиона натрия и аниона хлорида приводят к образованию связи притяжения, называемой ионной связью. в) притяжение многих ионов натрия и хлора приводит к образованию больших групп, называемых кристаллами.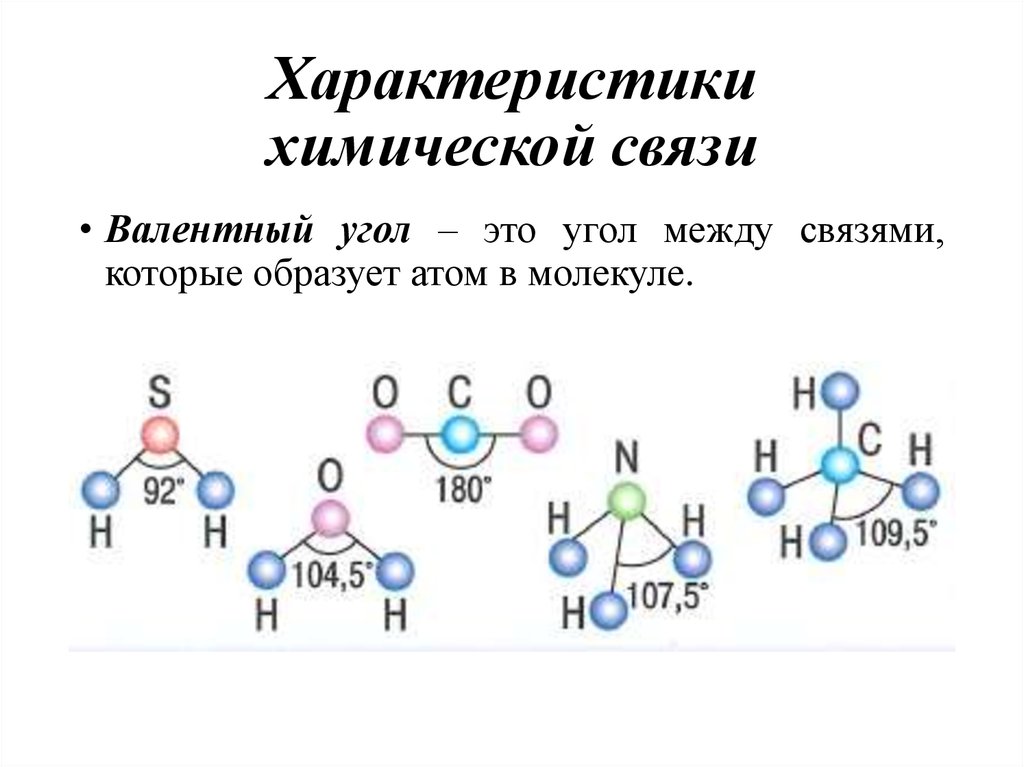
Вода является важным компонентом жизни, поскольку она способна разрушать ионные связи в солях, освобождая ионы. На самом деле в биологических жидкостях большинство отдельных атомов существует в виде ионов. Эти растворенные ионы производят электрические заряды внутри тела. Поведение этих ионов создает следы работы сердца и мозга, наблюдаемые в виде волн на электрокардиограмме (ЭКГ или ЭКГ) или электроэнцефалограмме (ЭЭГ). Электрическая активность, возникающая в результате взаимодействия заряженных ионов, является причиной того, что их также называют электролитами.
Посмотрите видео по ссылке ниже, чтобы узнать об электрической энергии и притяжении/отталкивании зарядов. Что происходит с заряженным электроскопом, когда между его пластиковыми листами перемещается проводник, и почему?
Ковалентные связи
В отличие от ионных связей, образованных притяжением между положительным зарядом катиона и отрицательным зарядом аниона, молекулы, образованные ковалентной связью, имеют общие электроны во взаимно стабилизирующих отношениях.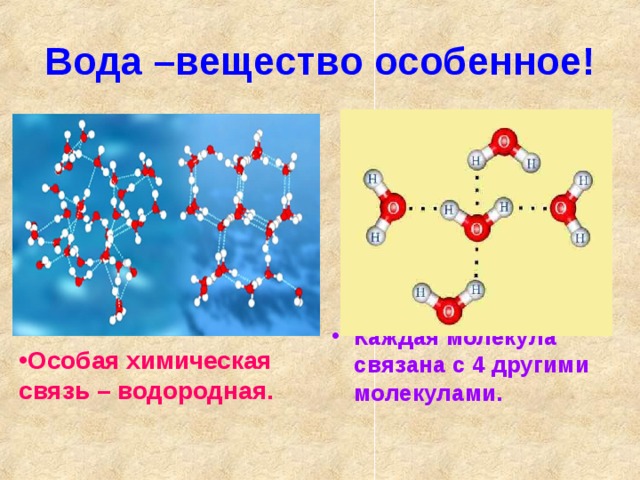 Подобно ближайшим соседям, чьи дети тусуются сначала в одном доме, а затем в другом, атомы не теряют и не приобретают электроны навсегда. Вместо этого электроны перемещаются взад и вперед между элементами. Из-за близкого расположения пар электронов (по одному электрону от каждого из двух атомов) ковалентные связи прочнее ионных.
Подобно ближайшим соседям, чьи дети тусуются сначала в одном доме, а затем в другом, атомы не теряют и не приобретают электроны навсегда. Вместо этого электроны перемещаются взад и вперед между элементами. Из-за близкого расположения пар электронов (по одному электрону от каждого из двух атомов) ковалентные связи прочнее ионных.
На рис. 2 показаны несколько распространенных типов ковалентных связей. Обратите внимание, что два ковалентно связанных атома обычно имеют только одну или две общие электронные пары, хотя возможны и более крупные общие пары. Важная концепция, которую следует извлечь из этого, заключается в том, что в ковалентных связях электроны в самой внешней валентной оболочке используются совместно, чтобы заполнить валентные оболочки обоих атомов, в конечном итоге стабилизируя оба вовлеченных атома. При одинарной ковалентной связи два атома делят один электрон, а при двойной ковалентной связи два атома делят между собой две пары электронов.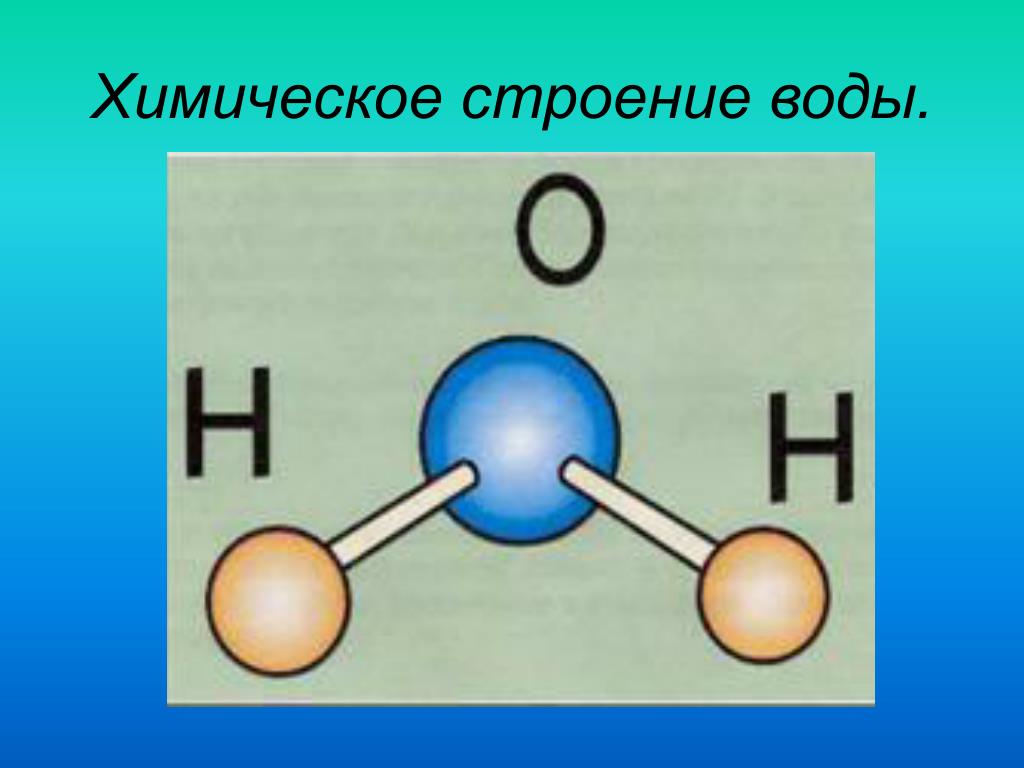 Существуют даже тройные ковалентные связи, когда три атома являются общими.
Существуют даже тройные ковалентные связи, когда три атома являются общими.
Ковалентная связь
Рисунок 2
Вы можете видеть, что ковалентные связи, показанные на рисунке, уравновешены. Разделение отрицательных электронов относительно равно, как и электрическое притяжение положительных протонов в ядрах вовлеченных атомов. Вот почему ковалентно связанные молекулы, которые электрически сбалансированы таким образом, описываются как неполярные; то есть ни одна область молекулы не является ни более положительной, ни более отрицательной, чем любая другая.
Полярные ковалентные связи Группы законодателей с совершенно противоположными взглядами на тот или иной вопрос часто описываются авторами новостей как «поляризованные». В химии полярная молекула — это молекула, которая содержит области с противоположными электрическими зарядами. Полярные молекулы возникают, когда атомы неравномерно делят электроны в полярных ковалентных связях.
Наиболее известным примером полярной молекулы является вода (рис. 3). Молекула состоит из трех частей: одного атома кислорода, ядро которого содержит восемь протонов, и двух атомов водорода, ядра которых содержат только по одному протону. Поскольку каждый протон обладает одинаковым положительным зарядом, ядро, содержащее восемь протонов, создает заряд, в восемь раз больший, чем ядро, содержащее один протон. Это означает, что отрицательно заряженные электроны, присутствующие в молекуле воды, сильнее притягиваются к ядру кислорода, чем к ядрам водорода. Таким образом, единственный отрицательный электрон каждого атома водорода мигрирует к атому кислорода, делая кислородный конец их связи немного более отрицательным, чем водородный конец их связи.
Полярные ковалентные связи в молекуле воды
Рисунок 3
То, что верно для связей, верно и для молекулы воды в целом; то есть область кислорода имеет слегка отрицательный заряд, а области атомов водорода имеют слегка положительный заряд.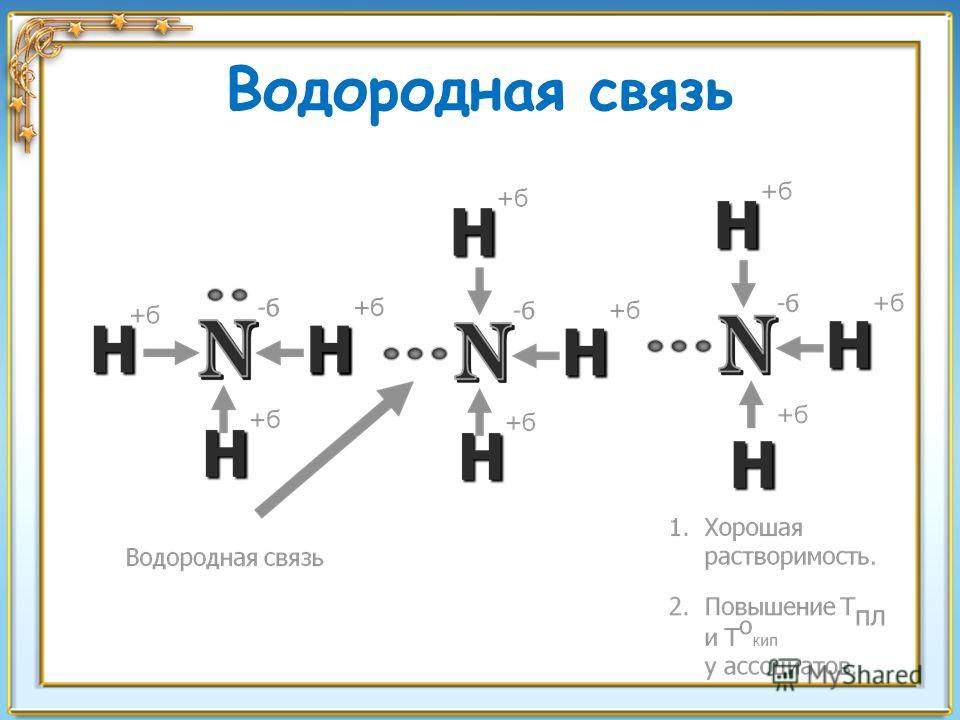 Эти заряды часто называют «частичными зарядами», потому что сила заряда меньше, чем один полный электрон, как это происходит в ионной связи. Как показано на рисунке, области слабой полярности обозначены греческой буквой дельта (δ) и знаком плюс (+) или минус (–).
Эти заряды часто называют «частичными зарядами», потому что сила заряда меньше, чем один полный электрон, как это происходит в ионной связи. Как показано на рисунке, области слабой полярности обозначены греческой буквой дельта (δ) и знаком плюс (+) или минус (–).
Несмотря на то, что одна молекула воды невообразимо мала, она имеет массу, и противоположные электрические заряды на молекуле притягивают эту массу таким образом, что она создает форму, напоминающую треугольную палатку (см. рис. b ). Этот диполь с положительным зарядом на одном конце, образованным атомами водорода на «дне» палатки, и отрицательным зарядом на противоположном конце (атомом кислорода на «верху» палатки) делает заряженные области весьма вероятными. взаимодействовать с заряженными областями других полярных молекул. Для физиологии человека образующаяся связь является одной из важнейших, образованных водой, — водородной связью.
Водородные связи Водородная связь образуется, когда слабоположительный атом водорода, уже связанный с одним электроотрицательным атомом (например, кислородом в молекуле воды), притягивается к другому электроотрицательному атому другой молекулы.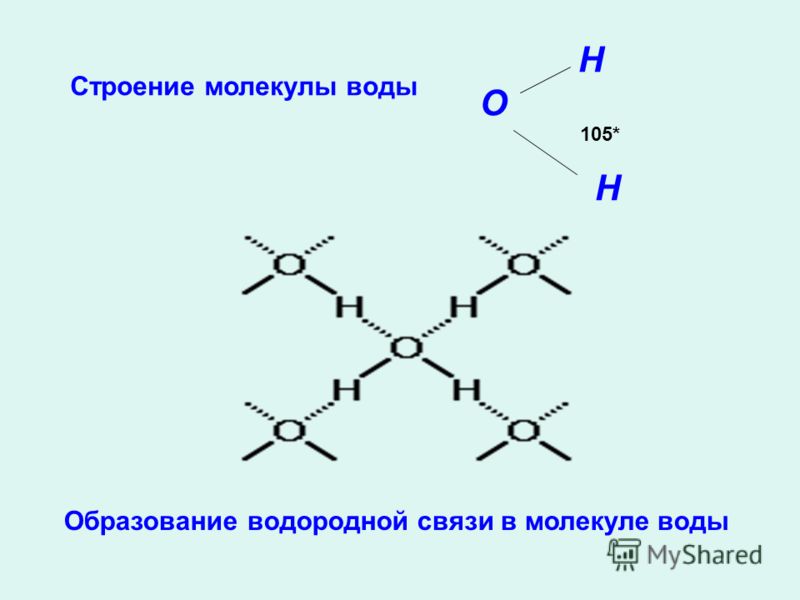 Другими словами, водородные связи всегда включают водород, который уже является частью полярной молекулы.
Другими словами, водородные связи всегда включают водород, который уже является частью полярной молекулы.
Самый распространенный пример водородной связи в природе возникает между молекулами воды. Это происходит на ваших глазах всякий раз, когда две капли дождя сливаются в большую бусинку или ручей переливается в реку. Водородная связь возникает из-за того, что слабоотрицательный атом кислорода в одной молекуле воды притягивается к слабоположительным атомам водорода двух других молекул воды (рис. 4).
Водородные связи между молекулами воды
Рисунок 4: Обратите внимание, что связи возникают между слабо положительным зарядом атомов водорода и слабо отрицательным зарядом атомов кислорода. Водородные связи относительно слабы и поэтому обозначены пунктирной (а не сплошной) линией.
Молекулы воды также сильно притягивают другие типы заряженных молекул, а также ионы. Это объясняет, почему «поваренная соль», например, на самом деле представляет собой молекулу, называемую в химии «солью», состоящую из равных количеств положительно заряженного натрия (Na + ) и отрицательно заряженный хлорид (Cl – ), так легко растворяются в воде, в этом случае образуя диполь-ионные связи между водой и электрически заряженными ионами (электролитами).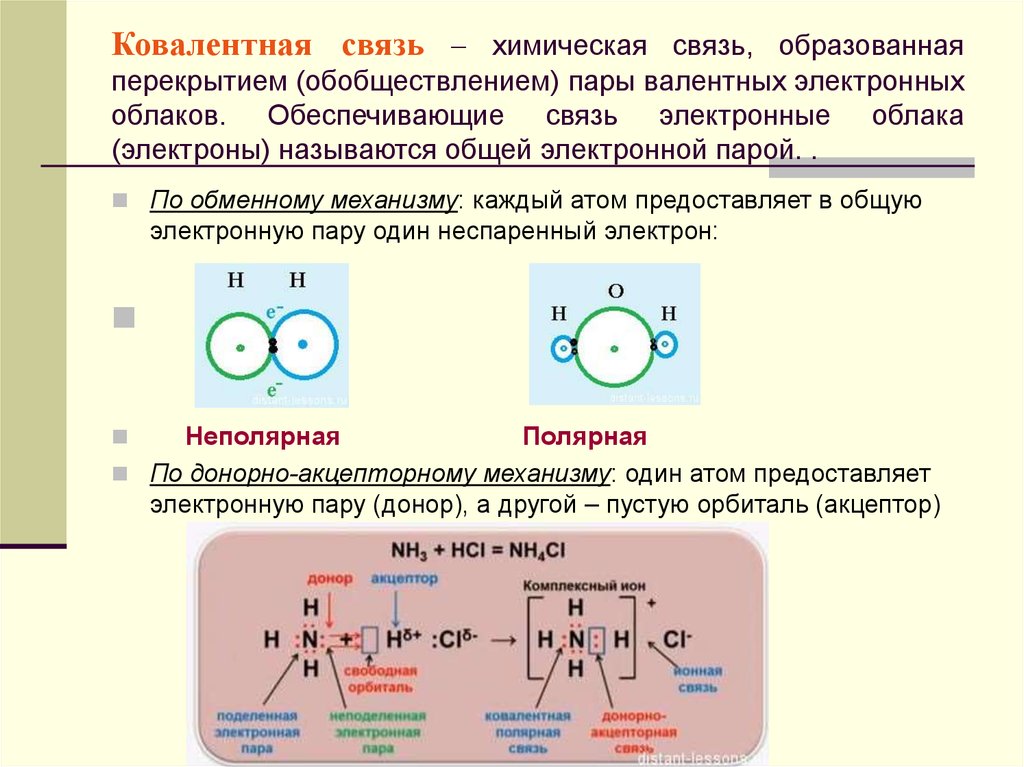 Молекулы воды также отталкивают молекулы с неполярными ковалентными связями, такие как жиры, липиды и масла. Вы можете продемонстрировать это с помощью простого кухонного эксперимента: налейте чайную ложку растительного масла, соединения, образованного неполярными ковалентными связями, в стакан с водой. Вместо того, чтобы мгновенно растворяться в воде, масло образует отчетливую каплю, потому что полярные молекулы воды отталкивают неполярное масло.
Молекулы воды также отталкивают молекулы с неполярными ковалентными связями, такие как жиры, липиды и масла. Вы можете продемонстрировать это с помощью простого кухонного эксперимента: налейте чайную ложку растительного масла, соединения, образованного неполярными ковалентными связями, в стакан с водой. Вместо того, чтобы мгновенно растворяться в воде, масло образует отчетливую каплю, потому что полярные молекулы воды отталкивают неполярное масло.
Каждый момент жизни атомы кислорода, углерода, водорода и других элементов человеческого тела создают и разрывают химические связи. Ионы — это заряженные атомы, которые образуются, когда атом отдает или принимает один или несколько отрицательно заряженных электронов. Катионы (ионы с положительным зарядом) притягиваются к анионам (ионам с отрицательным зарядом). Это притяжение называется ионной связью. В ковалентных связях участвующие атомы не теряют и не приобретают электроны, а делят их между собой. Молекулы с неполярными ковалентными связями электрически сбалансированы и имеют линейную трехмерную форму. Молекулы с полярными ковалентными связями имеют «полюса» — области слабо положительного и отрицательного заряда — и имеют треугольную трехмерную форму. Атом кислорода и два атома водорода образуют молекулы воды посредством полярных ковалентных связей. Водородные связи связывают атомы водорода, уже участвующие в полярных ковалентных связях, с анионами или электроотрицательными областями других полярных молекул. Водородные связи связывают молекулы воды, что приводит к свойствам воды, важным для живых существ.
Молекулы с неполярными ковалентными связями электрически сбалансированы и имеют линейную трехмерную форму. Молекулы с полярными ковалентными связями имеют «полюса» — области слабо положительного и отрицательного заряда — и имеют треугольную трехмерную форму. Атом кислорода и два атома водорода образуют молекулы воды посредством полярных ковалентных связей. Водородные связи связывают атомы водорода, уже участвующие в полярных ковалентных связях, с анионами или электроотрицательными областями других полярных молекул. Водородные связи связывают молекулы воды, что приводит к свойствам воды, важным для живых существ.
Его химическая формула проста, но вода (H3O) является одним из самых поразительных веществ в известной Вселенной. , нюансированный, изменяющий форму состав.
Это что-то вроде загадки: соединение, состоящее всего из двух химических элементов, один из которых является самым простым в известной вселенной. Пара атомов водорода, крепко держащаяся за один атом кислорода, создает обманчиво минималистское устройство, которое противоречит его огромной универсальности и важности.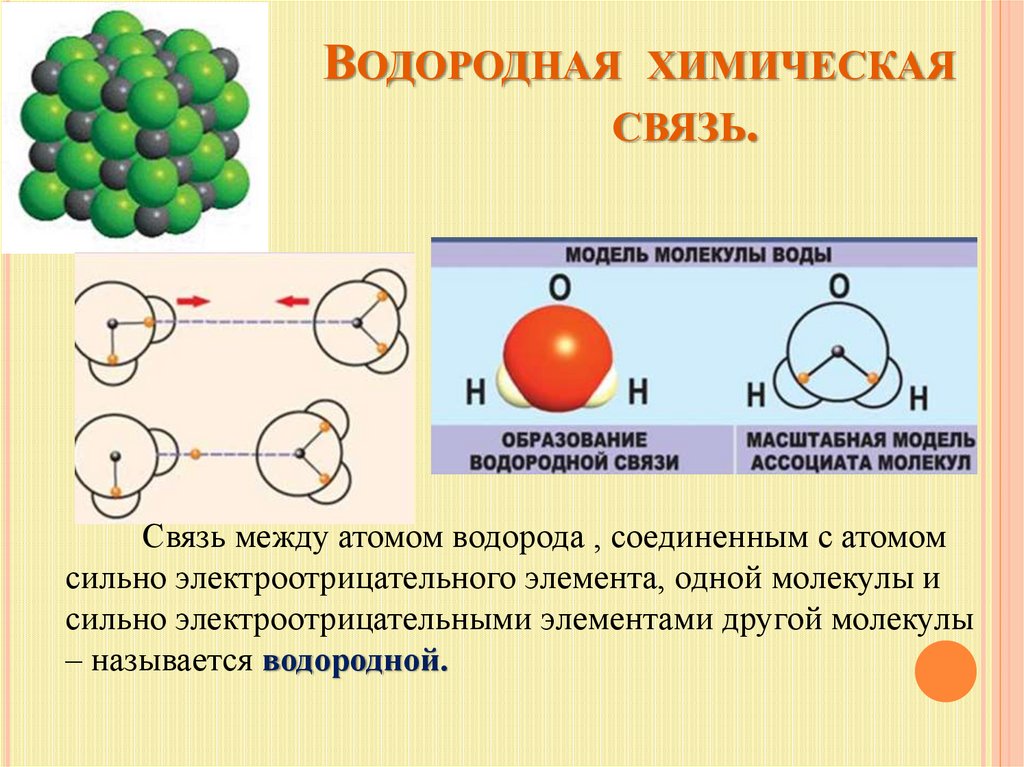
Ценность воды как ресурса общеизвестна. Без постоянного снабжения цивилизация, какой мы ее знаем, не существовала бы.
Но как вещество — как молекула — вода, как правило, ускользает от чувства удивления большинства людей. Что очень плохо, на самом деле, потому что это весьма примечательно.
Формованные и связанные
Основная молекулярная формула воды, H₂O, предполагает простую структуру из трех атомов на прямой линии. Но физические свойства трех атомов требуют другого расположения — V-образной формы с кислородом в конце. Эта нелинейная форма превращает воду в замечательную субстанцию с поразительными способностями.
Форма «V» возникает из-за расположения электронов в молекуле, которое вызывает дисбаланс электрического заряда, при этом кислородная точка «V» немного более отрицательна, чем противоположный конец возле атомов водорода. Это небольшое разделение означает, что молекулы воды поляризованы — один полюс положительный, а другой отрицательный.
Полярность электрического заряда лежит в основе удивительных свойств воды. Слегка отрицательный конец одной молекулы воды притягивает слегка положительный конец другой и наоборот, что ученые называют водородной связью.
Водородные связи между молекулами воды исключительно прочны, что придает им склонность цепляться друг за друга, что чаще всего проявляется в виде поверхностного натяжения. Например, вода в наполненном до краев сосуде выглядит выпуклой, если смотреть сбоку из-за поверхностного натяжения. А некоторые существа, такие как водомерки, могут использовать поверхностное натяжение, чтобы скользить по поверхности прудов.
Водородные связи также позволяют воде прилипать к посторонним веществам. Это клейкое свойство позволяет растениям вытягивать воду из земли через корни и до кончиков листьев, игнорируя притяжение.
Полярная природа воды и ее форма делают ее легче в твердом состоянии, чем в жидком. Это потому, что молекулярные V образуют воздушные кристаллические структуры при замерзании, делая лед менее плотным, чем его жидкая форма. Таким образом, лед плавает по рекам и озерам, образуя щит против холодного воздуха сверху и удерживая воду внизу от замерзания, что позволяет рыбам и другим водным видам выживать в более холодных краях.
Таким образом, лед плавает по рекам и озерам, образуя щит против холодного воздуха сверху и удерживая воду внизу от замерзания, что позволяет рыбам и другим водным видам выживать в более холодных краях.
Водородные связи воды также приводят к еще одной важной характеристике — более высокой, чем ожидалось, температуре кипения, объясняет Джессика Парр, профессор (преподаватель) химии. Парр получила докторскую степень по химии в USC Dornsife в 2007 году и с тех пор преподает общую химию студентам. Ее диссертационное исследование было сосредоточено на понимании того, как водородные связи реагируют на воздействие интенсивного света.
«Если бы вода не была способна образовывать такие прочные водородные связи, она бы кипела при минус 200 градусах Цельсия, — объясняет Парр, — намного ниже фактической точки замерзания 0 градусов Цельсия. Это означает, что он будет существовать на Земле в основном в виде газа, что сделает жизнь в том виде, в каком мы ее знаем, невозможной. Вместо этого наша планета залита водой, всего около 366 миллионов миллиардов галлонов.
Вместо этого наша планета залита водой, всего около 366 миллионов миллиардов галлонов.
Универсальный растворитель
Полярная природа воды также делает ее исключительным растворителем, способным растворять самые разные вещества.
«Мы называем его «универсальным растворителем», потому что он может растворять не все, а очень многое», — говорит Парр. «Многие другие молекулы разборчивы в том, с чем они взаимодействуют и как они работают вместе, но вода будет взаимодействовать практически со всем».
Например, его положительные и отрицательные центры притягивают и легко разводят заряженные атомы, называемые ионами, из которых состоят такие соли, как хлорид натрия, обычно используемый в кулинарии. Положительно заряженные атомы натрия и отрицательно заряженные хлориды находят удобный дом среди поляризованных молекул воды.
Но вода также может растворять вещества, не состоящие из ионов, например сахара. Однако вместо того, чтобы разделять отдельные атомы молекулы сахара, молекулы воды прокладывают себе путь между каждой молекулой сахара, находя слабо заряженные части для водородной связи.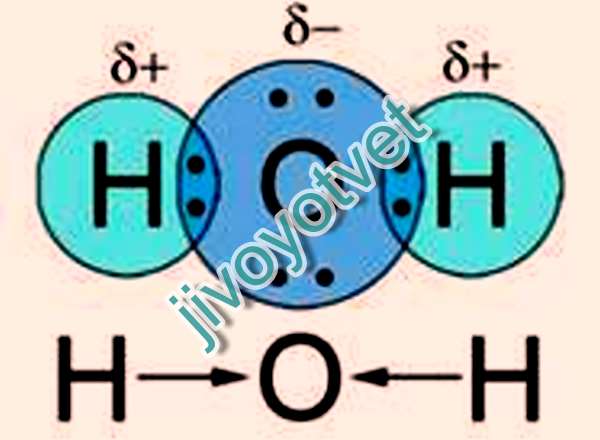 Это ослабляет связи между молекулами сахара, отталкивая их друг от друга и в конечном итоге превращая в раствор.
Это ослабляет связи между молекулами сахара, отталкивая их друг от друга и в конечном итоге превращая в раствор.
«Пока присутствует один атом, который заставляет другую молекулу взаимодействовать с водой, вода будет это делать», — говорит Парр.
Становится странно
Вода не всегда ведет себя так, как ожидалось. Хотя он чаще всего переходит из твердого состояния (льда) в жидкое, а затем в газообразное (пар или пар) и наоборот, когда его температура поднимается и падает, он может совершить прыжок прямо из льда в пар при правильных условиях.
«Если вы когда-нибудь замечали, что кубики льда со временем становятся меньше, то это потому, что они сублимируются в морозильной камере — лед сразу превращается в газ», — объясняет Парр. Эта сублимация происходит из-за низкой влажности внутри морозильной камеры, что позволяет нескольким молекулам воды выходить из льда в воздух без предварительного таяния.
В обратном процессе, называемом отложением, газообразная вода внезапно замерзает, так и не превратившись в жидкость.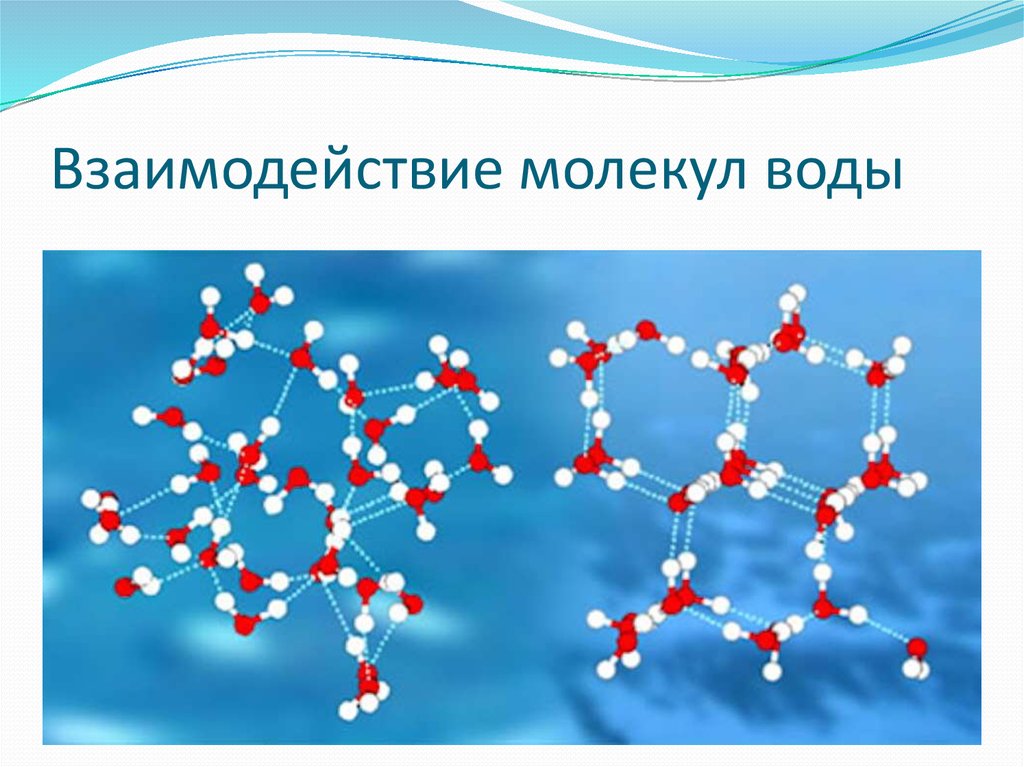 Так образуется снег. А при подходящих условиях снег может пропустить стадию таяния и сублимировать обратно в атмосферу, что является особой проблемой для подверженных засухе районов, таких как Калифорния, где таяние снежного покрова является источником воды.
Так образуется снег. А при подходящих условиях снег может пропустить стадию таяния и сублимировать обратно в атмосферу, что является особой проблемой для подверженных засухе районов, таких как Калифорния, где таяние снежного покрова является источником воды.
Но вода может быть еще более странной.
«Лед имеет множество различных кристаллических форм, но он также может существовать в форме, напоминающей стекло — аморфное твердое вещество, которое находится где-то между жидкостью и твердым телом и все еще может течь», — говорит Парр. По словам Парра, когда молекулы воды сливаются при очень низких температурах и давлениях — представьте себе космическое пространство — образующийся лед также может вести себя как стекло. Ученые подозревают, что это может быть одна из самых распространенных форм воды во Вселенной.
Тайны и чудеса продолжаются
Несмотря на широкое распространение во Вселенной и на Земле, а также на давнее знакомство людей с водой, вода продолжает удивлять.
Ученые недавно обнаружили форму под названием «суперионный лед». Существуя при чрезвычайно высоком давлении, например, в ядре планет, он, по-видимому, играет роль в поддержании магнитных полей Земли.
И хотя вода в чистом виде не является электрическим проводником, она ведет себя неожиданно при воздействии электрического поля. Александр Бендерский из USC Dornsife, адъюнкт-профессор химии, и Стивен Кронин из инженерной школы USC Viterbi недавно обнаружили, что молекулы воды вблизи электрода выстраиваются иначе, чем те, что дальше.
«Мы смогли увидеть, как молекулы взаимодействуют с электрическим полем так, как никто раньше не понимал», — сказал Бендерский. Открытие может изменить то, как химики контролируют реакции, в том числе процессы изготовления лекарств и очистки воды для питья.
По мере того, как исследователи продолжают исследовать это универсальное, неожиданное вещество, потенциально раскрывая более странные свойства, вода может оказаться самой сложной простой молекулой во Вселенной.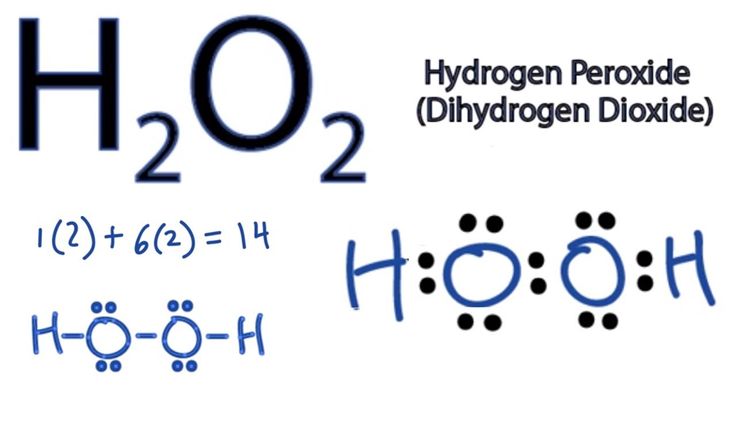
Химическая связь – Образовательное партнерство по фармакологии алкоголя
Внутримолекулярные связи
Химические связи образуются, когда взаимодействие между двумя или более атомами требует меньше энергии, чем поддержание атомов по отдельности. Химические связи определяются силами притяжения между их ядрами и электронами и могут варьироваться в диапазоне от мимолетного притяжения до необратимого связывания. Существует несколько типов химических связей, которые можно классифицировать на основе вовлеченных атомов и распределения электронов между атомами. Внутримолекулярные связи — это связи, которые соединяют атомы в соединения. Существует 3 типа внутримолекулярных связей: ковалентная, ионная и металлическая.
Ковалентная связь: связь, в которой пара или пары электронов являются общими для двух атомов.
- Молекулярные соединения относятся к соединениям с ковалентной связью, как правило, с низкой молекулярной массой.
- Высокомолекулярные соединения представляют собой соединения с высокой молекулярной массой, которые ковалентно связаны и имеют линейную, разветвленную или поперечную связь.

- Сеть: соединения, в которых каждый атом ковалентно связан со всеми своими ближайшими соседями, так что весь кристалл представляет собой одну молекулу.
Ионная связь: связь, которая удерживает атомы вместе в соединении; электростатическое притяжение между заряженными ионами. Ионные соединения образуются между атомами, существенно различающимися по электроотрицательности. Электрон (электроны), участвующие в связывании, передаются от менее электроотрицательного к более электроотрицательному атому (атомам), образуя ионы. Донор электронов (катион) теперь несет суммарный положительный заряд, а акцептор электронов (анион) теперь несет суммарный отрицательный заряд.
Металлическая связь: связь, возникающая в результате притяжения между положительными ионами и окружающими подвижными электронами.
Межмолекулярные силы
Межмолекулярные силы — это силы, которые притягивают молекулы или частицы к подобным или непохожим молекулам или частицам.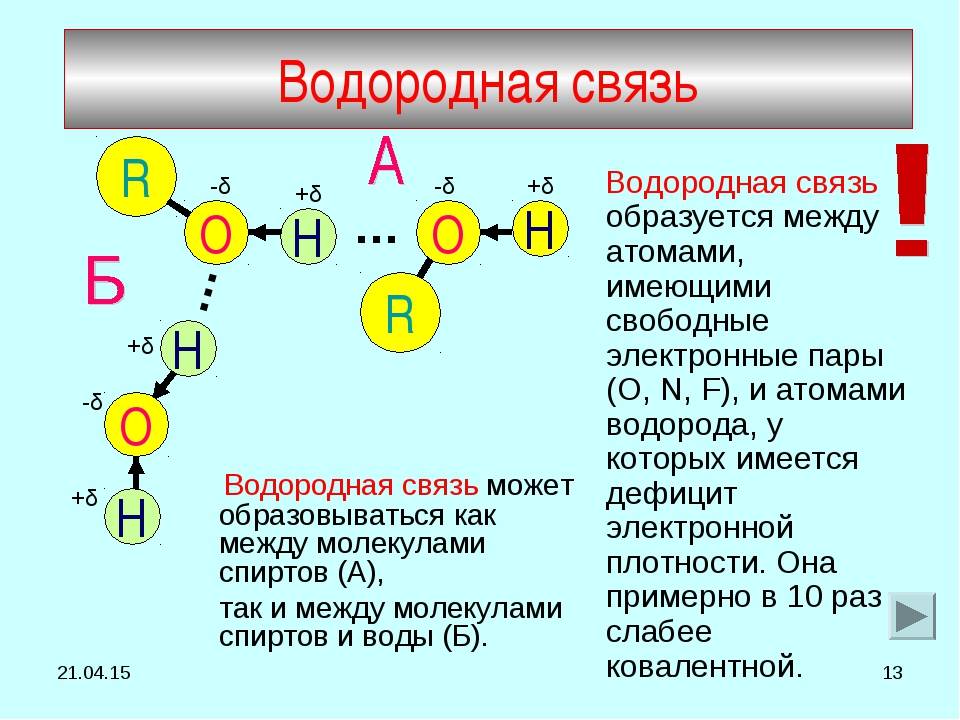 Как правило, эти силы между молекулами образуют гораздо более слабые связи, чем те связи, которые образуют соединения. Межмолекулярные силы описаны ниже. Они сгруппированы в 3 подкатегории в зависимости от типа внутримолекулярных связей, образующих соединение:
Как правило, эти силы между молекулами образуют гораздо более слабые связи, чем те связи, которые образуют соединения. Межмолекулярные силы описаны ниже. Они сгруппированы в 3 подкатегории в зависимости от типа внутримолекулярных связей, образующих соединение:
- Ионные соединения проявляют электростатические межмолекулярные силы, которые образуют прочные связи с другими ионными соединениями.
- Ковалентные соединения проявляют ван-дер-ваальсовы межмолекулярные силы, которые образуют связи различной прочности с другими ковалентными соединениями. К трем типам сил Ван-дер-Ваальса относятся: 1) дисперсионные (слабые), 2) диполь-дипольные (средние) и 3) водородные (сильные).
- Ион-дипольные связи (ионные соединения с ковалентными молекулами) образуются между ионами и полярными молекулами. Эти соединения обычно образуют связи от средней до сильной.
Ниже описаны пять видов межмолекулярных сил; описанная сила связи варьируется от самой сильной до самой слабой (последние 3 являются примерами сил Ван-дер-Ваальса). Пожалуйста, помните, что это сравнение относится к другим межмолекулярным притяжениям, а не к силе ковалентной или ионной связи; существует множество исключений, которые здесь не предусмотрены.
Пожалуйста, помните, что это сравнение относится к другим межмолекулярным притяжениям, а не к силе ковалентной или ионной связи; существует множество исключений, которые здесь не предусмотрены.
- Электростатический: силы притяжения между ионами противоположного заряда; например, NaCl соединяется с другим NaCl с образованием кристалла соли.
- Ион-диполь: силы притяжения между катионом/анионом и молекулами растворителя при растворении в воде или других полярных молекулах; например, NaCl растворяется в воде с образованием Na+ и Cl-, окруженных молекулами воды.
Поскольку атомы и молекулы представляют собой трехмерные структуры, вращающиеся вокруг ядра электроны редко распределяются равномерно. Как следствие, в противном случае нейтральные атомы или молекулы испытывают мгновенные моменты полярности (называемые мгновенными диполями). В жидкостях близлежащие молекулы могут ощущать влияние таких короткоживущих диполей и генерировать собственные мгновенные диполи.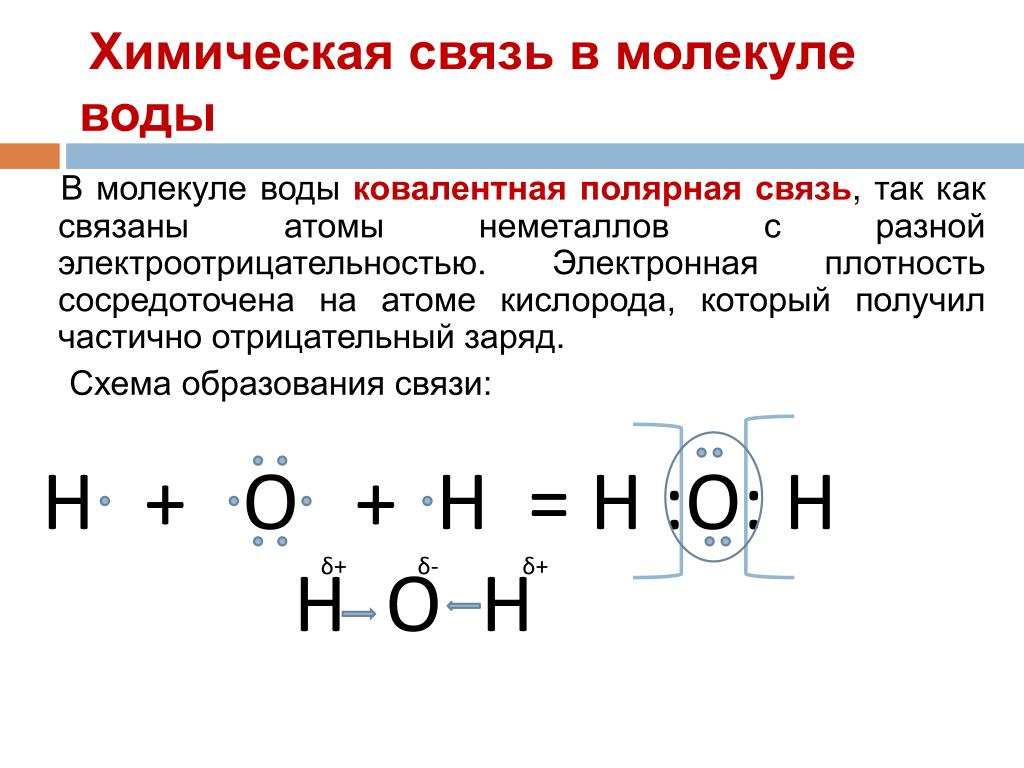 Сумма этих изменяющихся взаимодействий между зарядами представляет собой слабое притяжение или связь, называемую силами Ван-дер-Ваальса.
Сумма этих изменяющихся взаимодействий между зарядами представляет собой слабое притяжение или связь, называемую силами Ван-дер-Ваальса.
- Водородная связь: особый тип диполь-дипольного взаимодействия между атомом водорода в полярной связи, такой как O-H или N-H, и электроотрицательными атомами N, O или F. Эти силы притяжения намного сильнее, чем другие дипольные связи. -дипольные силы. В результате неравного распределения электронов атомы водорода приобретают положительный заряд. Когда H, очень маленький атом, связан с другими очень маленькими атомами с высокой электроотрицательностью, они образуют сильное притяжение к другим подобным атомам. Только N, O и F образуют водородные связи. Молекулы воды также образуют водородные связи с другими молекулами воды.
- Диполь-Диполь: силы притяжения между полярными молекулами. Например, одна молекула h3O притягивается к другой молекуле h3O, потому что h3O является полярной молекулой. Воду называют универсальным растворителем, потому что в ней растворяются многие ионные и ковалентные соединения.

- Дисперсия (лондонские силы): силы притяжения, возникающие между временными диполями и индуцированными диполями в атомах или молекулах; например, I2 связан с I2 с образованием жидкого или твердого йода. Чем больше молекула, тем сильнее дисперсионная сила.
Химические связи и лекарства
Комбинации ковалентных, ионных и водородных связей необходимы для удержания больших макромолекул, таких как белки и нуклеиновые кислоты, в их функциональных формах. Например, отдельные базовые молекулы каждой нити ДНК связаны ковалентными связями (фосфодиэфирными связями), а две нити удерживаются вместе водородными связями. С другой стороны, большинство взаимодействий между лекарствами и их рецепторами-мишенями представляет собой комбинацию ионных сил и сил Ван-дер-Ваальса, которые обеспечивают обратимость реакции на лекарство. Ковалентные взаимодействия между лекарством и его мишенью обычно нежелательны для терапевтических целей из-за необратимого характера ковалентной связи.


 В каком ряду все вещества имеют ковалентную полярную связь?
В каком ряду все вещества имеют ковалентную полярную связь? Вещество с ковалентной неполярной связью имеет формулу
Вещество с ковалентной неполярной связью имеет формулу Тремя общими электронными парами образована ковалентная связь в молекуле
Тремя общими электронными парами образована ковалентная связь в молекуле Наименее прочная химическая связь в молекуле
Наименее прочная химическая связь в молекуле